Анемии, связанные с нарушением синтеза ДНК и РНК, представляют большую группу как наследственных, так и приобретенных заболеваний.
• Синтез ДНК нарушается при дефиците витамина В12, фолиевой кислоты, при некоторых наследственных заболеваниях, возникающих при нарушении активности ферментов, участвующих в образовании коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия).
• Эти анемии объединяет наличие в КМ мегалобластов, характеризующихся асинхронной дифференцировкой ядра и цитоплазмы и своеобразием их морфологии.
• Задержка синтеза ДНК приводит к дисбалансу клеточного роста. Синтез РНК остается неповрежденным. В результате этого происходит нарушение дифференцировки ядра, а цитоплазматические компоненты, особенно Hb, синтезируются в повышенном количестве, что способствует расширению площади эритроидных предшественников и появлению гиперхромных эритроцитов крупных размеров (макроцитов).
• Мегалобластические изменения характерны также для гранулоцитарных предшественников и мегакариоцитов.
• Основной причиной развития дефицита витамина В12 являются тяжелые атрофические гастриты, приводящие к нарушению его всасывания.
• Различают три гистологических стадии гастрита:
• атрофия слизистой желудка.
• Последние две стадии характеризуются прогрессивным уменьшением секреции, среди факторов которой происходит потеря соляной кислоты, пепсина и внутреннего фактора (ВФ), который является гастрогликопротеидом и секретируется париетальными клетками фундальной части желудка.
• В норме ВФ образует комплекс с витамином В12 и в таком виде всасывается в тонком кишечнике.
• Причины развития гастритов многочисленны и до настоящего времени не совсем понятны. Они могут являться следствием:
• химического, термического и механического повреждения слизистой желудка;
• пищевого дефицита железа, фолатов, аскорбиновой кислоты;
• эндокринной патологии — заболеваний щитовидной железы, надпочечников и поджелудочной железы;
• Существуют наследственные формы мегалобластных анемий, которые наследуются, вероятно, по аутосомно-рецессивному типу.
• Природа генетических повреждений до конца не выяснена, но предполагается существование двух главных факторов возникновения анемии:
• дефект иммунологической толерантности к группе антигенов, обнаруженных в желудке, щитовидной железе, поджелудочной железе и коже.
• дефект метаболических или ферментных систем этих органов и тканей.
• В сыворотке крови больных В12-дефицитной анемией обнаружено несколько типов ауто-АТ, AT к париетальным клеткам и клеткам щитовидной железы.
• Наиболее значимыми в этиологии анемии являются AT к ВФ. Различают три типа ауто-АТ (рис. 10.1):
• Наиболее распространенными являются так называемые блокирующие AT , которые предотвращают соединение витамина В12 и ВФ.
• Другой тип получил название присоединяющих AT . Присоединяющие AT состоят из 2-х вариантов: (рис. 10.1).
• Причины возникновения мегалобластных анемий представлены в таблице 10.1.
• Заболевание встречается у лиц старше 40 лет, обычно вследствие нарушения секреции ВФ клетками слизистой желудка.
• У некоторых больных наблюдается наследственная предрасположенность.
• Патогенез: наличие аутоиммунных заболеваний, при которых наблюдается иммунная деструкция клеток желудка, секретирующих соляную кислоту и пепсин. У всех больных наблюдается атрофия слизистой желудка и ахлоргидрия.
• Отмечена повышенная частота возникновения рака желудка.
АНЕМИЯ ПОСЛЕ РЕЗЕКЦИИ ЖЕЛУДКА
• Дефицит витамина В12 обычно развивается через 5-6 лет после тотальной гастрэктомии, вследствие уменьшения секреции ВФ и связанного с этим нарушения всасывания кобаламина.
• Задержка появления симптомов анемии отражает время, необходимое для истощения запасов кобаламина после прекращения его всасывания.
• Всасывание кобаламина может быть также нарушенным вследствие субтотальной гастрэктомии.
• Сочетание гиперпаратиреоза, множественных язв в желудке и двенадцатиперстной кишке, диареи, множественных аденом островков поджелудочной железы, вследствие чего происходит инактивация панкреатических протеаз, необходимых для всасывания кобаламина.
Рис. 10.1 СХЕМАТИЧЕСКОЕ ИЗОБРАЖЕНИЕ ВЗАИМОДЕЙСТВИЯ ВНУТРЕННЕГО ФАКТОРА (ВФ), ВИТАМИНА В12 (В12) И АНТИТЕЛ К ВФ ( AT ) (по G . R . Lee , 1993)
А: взаимодействие ВФ и В12;
Б: блокирующие AT (Б- AT ) предотвращают соединение ВФ и В12;
В: два типа соединяющих антител:
БАТ 1 имеют одинаковую аффинность для ВФ и ВФ-В12 и присоединяются на расстоянии от места присоединения В12 ВФ. БАТ 2 имеют большую аффинность для комплекса ВФ-В12 и, возможно, присоединяются как к ВФ, так и к В12.
• Причины дефицита витамина В12 указаны в таблице 10.1.
• Наиболее часто дефицит витамина В12 возникает вследствие нарушения всасывания.
Таблица 10.1 Причины возникновения мегалобластных анемий
А. Дефицит витамина в пище (редко)
б) субтотальная резекция желудка
3. Ожог слизистой желудка каустическими веществами
В. Функциональная патология ВФ
Г. Биологическая конкуренция
1. Развитие обильной бактериальной флоры в кишечнике при:
г) соустьях с выключением петель тонкой кишки
2. Инвазия широким лентецом
Д. Семейное селективное нарушение всасывания витамина B12 (синдром Иммерслунда)
Е. Лекарственно-индуцированное нарушение всасывания витамина B12
Ж. Хронические заболевания поджелудочной железы
3. Синдром Золлингера-Эллисона
К. Заболевания или резекция кишечника
1. Алкоголизм и цирроз печени
4. Заболевания, протекающие с быстрой клеточной пролиферацией
В. Врожденное нарушение всасывания
Г. Лекарственно-индуцированный дефицит
Д. Значительная резекция тонкого кишечника
III . Комбинированный дефицит фолатов и B 12
Б. Энтеропатия,чувствительная к глютену
IV. Врожденные расстройства с интеза ДНК
В. Тиамин-зависимая мегалобластная анемия
Г. Дефицит ферментов, необходимых для метаболизма фолатов
Д. Дефицит транскобаламина II
Е. Патология транскобаламина
Ж. Гомоцистинурия и метилмалоновая ацидурия
V. Лекарственно-и токсин-индуцированные расстройства синтеза ДНК
• Кишечный стаз из-за анатомических повреждений или нарушения подвижности приводит к колонизации кишечных бактерий, которые связывают кобаламин еще до его всасывания.
• Эти паразиты связывают кобаламин, однако только у 3 % лиц, зараженных паразитами, развивается анемия.
БОЛЕЗНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
• Поражение поджелудочной железы приводит к возникновению дефицита панкреатических протеаз, необходимых для всасывания кобаламина. Тесты Шиллинга часто положительны у больных с поражением поджелудочной железы, но клинически значимый дефицит кобаламина развивается редко.
ДЕФИЦИТ КОБАЛАМИНА ПРИ НАРУШЕНИИ ДИЕТЫ
• Появляется редко, обычно у вегетарианцев, которые полностью избегают употребления продуктов животного происхождения (даже яиц и творога).
• Начало В12-дефицитной анемии постепенное. Обычно степень анемии не соответствует тяжести симптомов.
• Анемия чаще развивается у светловолосых и голубоглазых людей с гиперстеническим типом телосложения.
• Классическим комплексом симптомов анемии являются поражение пищеварительной системы и неврологические нарушения, которые обычно появляются раньше и быстро прогрессируют, маскируя симптомы анемии.
• Кожные покровы обычно лимонно-желтого цвета, что обусловлено комбинацией бледности и желтухи. Может наблюдаться диффузная или ограниченная гиперпигментация кожи. Кожа чаще бархатистая и гладкая на ощупь, но может быть сухой. У больных В12-дефицитной анемией наблюдается иктеричность склер.
• При тяжелой анемии наблюдается повышение температуры тела даже при отсутствии инфекции.
• У 50 % больных мегалобластной анемией наблюдаются патологические изменения со стороны пищеварительной системы.
• Характерна потеря вкусовых ощущений, снижение аппетита; у 7-50 % больных появляется отвращение к пище, особенно мясной, чувство жжения языка, слизистой оболочки рта и прямой кишки.
• Для В12-дефицитной анемии характерен «лакированный» с участками воспаления язык, с изъязвлениями ярко-розового цвета (глоссит Хантера). Изменения со стороны слизистой языка могут появляться и в отсутствии анемии, что свидетельствует об обострении заболевания у лечившихся больных.
• Интенсивность глоссита обычно убывает после начала терапии, но чувство жжения языка может возобновляется через различные промежутки времени.
• Неврологическая симптоматика может появляться и в отсутствии анемии, и в этом случае является обратимой.
• Клинические проявления поражения нервной системы включают: парестезии, слабость, шаткую походку, нарушение тактильной и температурной чувствительности.
• При тяжелой анемии могут наблюдаться нарушения психики: появляются галлюцинации, развивается маниакально-депрессивный синдром, параноидный и шизофренический статус («мегалобластное слабоумие»).
• Если лечение не проводится, то заболевание прогрессирует, развивается спастическая атаксия и клиническая картина псевдотабеса вследствие демиелинизации волокон задних и латеральных столбов спинного мозга.
• Анемия является макроцитарной с MCV от 100 до 150 фл, но сопутствующий дефицит железа, талассемия или воспаление могут маскировать макроцитоз. Цветовой показатель выше нормы.
• Эритроциты: выраженный анизо- и пойкилоцитоз с большим количеством овальных гиперхромных макроцитов; в тяжелых случаях наблюдается базофильная пунктация эритроцитов, наличие в них телец Жолли и колец Кебота.
• Количество ретикулоцитов обычно низкое.
• Часто наблюдаются лейкопения и тромбоцитопения.
• Гиперсегментация нейтрофилов является первой гематологической патологией при мегалобластном статусе. Обычно в норме нейтрофилы имеют от 3-х до 5-ти долей; у здорового человека в периферической крови может циркулировать до 2 % гиперсегментированных нейтрофилов (имеющих более 5-ти ядерных долей). У больных мегалобластной анемией количество гиперсегментированных нейтрофилов превышает 5 %.
• Тромбоциты обычно небольших размеров.
• Костный мозг: эритроидная гиперплазия с характерными мегалобластическими изменениями. Наличие промегалобластов с митотической картиной характерно для тяжелой анемии. Количество сидеробластов и содержание железа в макрофагах повышено.
• Одновременное наличие дефицита железа может уменьшать мегалобластный эритроидный ответ, но присутствие в КМ гигантских метамиелоцитов и палочкоядерных нейтрофилов, а в периферической крови — гиперсегментированных нейтрофилов, свидетельствует в пользу мегалобластной анемии.
• Сыворотка крови: повышение концентрации билирубина, железа, ферритина.
• Активность сывороточной ЛДГ значительно повышена и увеличивается по мере прогрессирования заболевания.
• Уровень сывороточного кобаламина обычно низкий у большинства больных, но может быть нормальным в случаях врожденной патологии метаболизма кобаламина.
• Уровень сывороточного кобаламина может быть низким с нормальным тканевым уровнем витамина В12:
• у лиц, получающих большие дозы витамина С;
• при дефиците транскобаламина 1;
• Уровень сывороточных фолатов обычно высокий при дефиците кобаламина, но может быть и нормальным при комбинированном дефиците витамина В12 и фолатов.
• Метилмалоновая ацидурия и повышенный уровень метилмалоновой кислоты являются надежными индикаторами дефицита кобаламина.
• Нарушение всасывания кобаламина может быть установлено путем исследования радиоактивности выделенной мочи после приема внутрь радиоактивного кобаламина (тест Шиллинга). Если радиоактивность выделяемой мочи низкая, тест повторяется с добавлением внутрь ВФ. Нормальная экскреция радиоактивности указывает на дефицит ВФ.
• У некоторых лиц сохранена способность всасывать свободный кобаламин, но нарушен процесс выделения его из пищи, поэтому у них развивается дефицит витамина В^. У таких больных наблюдается положительный тест Шиллинга, а патология может быть установлена модификацией теста при использовании радиоактивного кобаламина в пище.
• Наибольшим источником ошибок при использовании теста Шиллинга является неполный сбор мочи. Почечная патология также приводит к задержке экскреции радиоактивного кобаламина.
• Деструкция эритроидных предшественников в КМ (неэффективный эритропоэз) является характерной чертой мегалобластной анемии. Кроме того, наблюдается неэффективный гранулоцито-и тромбоцитопоэз.
• Продолжительность жизни эритроцитов значительно укорочена; это является причиной гемолиза эритроцитов.
• При тяжелой анемии наблюдается нарушение функции сегментоядерных нейтрофилов и тромбоцитов.
• При обнаружении макроцитарной анемии врачу необходимо разграничить мегалобластную и немегалобластную анемии (рис. 10.2).
• Решающее значение в диагностике мегалобластной анемии имеет морфологическое исследование КМ и крови.
• Дифференциальная диагностика В12-дефицитной анемии проводится с:
• дефицитом фолиевой кислоты, который наблюдается обычно в более молодом возрасте, не сопровождается атрофическими изменениями слизистой оболочки желудка и неврологической симптоматикой;
• аутоиммунной гемолитической анемией (АИГА), протекающей с панцитопенией; при АИГА отсутствует мегалобластный тип кроветворения, характерны ретикулоцитоз и позитивный ПАТ;
• болезнью Маркиафавы-Миккели, для которой характерен внутрисосудистый гемолиз, гемосидеринурия, положительные сахарозный и кислотный тесты. Кроме того, при данной патологии анемия носит характер нормохромной или гипохромной.
• При проведении дифференциальной диагностики В12-дефицитной анемии необходимо установление ее причины.
• Лечение заключается в парентеральном введении витамина В12 или гидрооксикобаламина в дозах, обеспечивающих удвоение запасов депо и удовлетворение дневной потребности.
Рис. 10.2 АЛГОРИТМ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С МАКРОЦИТАРНОЙ АНЕМИЕЙ
• Токсическое действие витамина В12 не наблюдается, но высокие дозы (более 1000 мкг) подавляют транспорт белков и способствуют потере их с мочой.
Схемы введения витамина В12
• 1000 мкг витамина В12 внутримышечно ежедневно в течение 2-х недель, затем 1 раз в неделю до нормализации Hb , после чего переходят на введение 1 раз в месяц в течение всей жизни.
• Оксикобаламин (в дозе 500-1000 мкг через день или ежедневно) более активно усваивается организмом.
• При наличии неврологической симптоматики необходимо введение препарата в дозе 1000 мкг каждые 2 недели в течение 6 месяцев.
• При дефиците витамина В12 часто наблюдаются инфекционные осложнения, которые исчезают при хорошем ответе больных на терапию.
• Трансфузии эритроцитарной массы показаны для срочной ликвидации симптомов гипоксии.
• Начало терапии кобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз превращается из мегалобластного в нормобластный через 12 часов после введения витамина В12.
• Ретикулоцитоз появляется на 3-5 день, пик появления ретикулоцитов наиболее выражен на 4-10 дни. Концентрация Hb нормализуется через 1-2 месяца.
• Количество тромбоцитов и лейкоцитов нормализуется быстро, хотя гиперсегментация нейтрофилов сохраняется до 10-14 дня.
• Повышенные концентрации сывороточного железа и ЛДГ быстро снижаются после начала специфического лечения.
• После терапии кобаламином может развиваться тяжелая гипокалиемия (описаны летальные исходы), поэтому во время введения витамина В12, уровень калия должен тщательно контролироваться; при необходимости показана заместительная терапия.
• Терапию кобаламином следует назначать всем больным после тотальной гастрэктомии. После частичной гастрэктомии необходимо тщательное наблюдение за больными для ранней диагностики анемии.
• Анемия при синдроме «слепой кишки» уменьшается после терапии кобаламином, но применение антибиотиков или коррекция анатомической патологии способствует нормализации содержания Hb без назначения витамина В12.
• Около 1 % дозы витамина В12, принятой внутрь, всасывается даже при отсутствии ВФ. Поэтому больные с пернициозной анемией могут успешно лечиться приемом витамина В12 в дозе 1000 мкг/день.
ОСТРАЯ МЕГАЛОБЛАСТНАЯ АНЕМИЯ
• Острая мегалобластная анемия отражает синдром быстрого развития тромбоцитопении и (или) лейкопении с очень небольшими изменениями уровня Hb. Костный мозг при этом редко является мегалобластным.
• В большинстве случаев развивается при вдыхании паров закиси азота. Закись азота разрушает метилкобаламин, индуцируя дефицит кобаламина. Костный мозг переключается на мегалобластическое кроветворение через 12-24 часа. Гиперсегментированные нейтрофилы появляются в крови через 5 дней.
• Эффект воздействия закиси азота исчезает через несколько дней. Назначение фолиевой кислоты или витамина В12 значительно ускоряет выздоровление.
• Жизнеугрожающая мегалобластная анемия развивается у больных со столбняком, которые для снятия судорожного синдрома получают закись азота.
• Острая мегалобластная анемия может развиться у тяжелых больных при проведении интенсивной терапии, а также у лиц, получающих интенсивные трансфузии, диализ, полное парентеральное питание, антагонисты фолиевой кислоты в течение недели. Диагностика основана на обнаружении мегалобластического кроветворения.
Лечение: парентеральное введение кобаламина (1 мг) и прием фолиевой кислоты (5 мг).
МЕГАЛОБЛАСТНАЯ АНЕМИЯ, ВЫЗВАННАЯ ЛЕКАРСТВАМИ
Частичный список лекарственных препаратов, которые вызывают мегалобластную анемию, представлен в таблице 10.2. Метотрексат ингибирует дигидрофолатредуктазу — энзим, который превращает фолиевую кислоту в активную тетрагидроформу. Токсичность метотрексата устраняется назначением фолиевой кислоты.
Таблица 10.2 Медикаменты, вызывающие развитие мегалобластной анемии
Потенцируют влияние ингибитора дигидрофолатредуктазы.
Лечение: высокие дозы фолиевой кислоты
Воздействие слабее, чем у метотрексата и аминоптерина.
Могут вызывать острую мегалобластную анемию у больных с повышенной чувствительностью, особенно с низкими запасами фолиевой кислоты
Мегалобластоз при использовании больших доз препаратов
Блокирует продукцию уридин-монофосфата путем ингибирования оротидил декарбоксилазы
Главным побочным эффектом является тяжелая мегалобластная анемия
Выраженный мегалобластоз через 1-2 дня от начала терапии. Быстрое выздоровление при отмене препарата
Характерен ранний мегалобластоз
Редкий мегалобластоз, сочетающийся с низким уровнем фолатов. Купируется высокими дозами фолиевой кислоты (1-5 мг/день)
МЕГАЛОБЛАСТНАЯ АНЕМИЯ У ДЕТЕЙ
• Нарушение всасывания кобаламина развивается при нормальном содержании ВФ при ряде наследственных заболеваний у детей.
Селективное нарушение всасывания кобаламина или синдром Иммерслунда-Гресбека
• Этиология: системный дефект эпителия наследственного характера.
• Патогенез: нарушение всасывания кобаламина вследствие поражения эпителия кишечника и отсутствия специфического белка — акцептора кобаламина.
• Клиника: обычно заболевание проявляется на 1-2 году жизни. Характерны жалобы на отсутствие аппетита, рвоту. При объективном исследовании обнаруживают сухость и шелушение кожи, атрофический глоссит. Наблюдаются частые пневмонии с десквамацией эпителия бронхов и альвеол.
• Диагностика основана на оценке характера анемии, морфологического исследования пунктата КМ, обнаружения постоянной протеинурии.
• Лечение: симптоматическое и парентеральное введение витамина В12.
• Наследственный дефицит ВФ наследуется аутосомно-рецессивно и характеризуется дефицитом или резким снижением секреции ВФ клетками желудка.
• Заболевание возникает в возрасте 6-24 месяцев. Лечение — парентеральное введение кобаламина.
• Дефицит транскобаламина II — заболевание, наследуемое по аутосомно-рецессивному типу, характеризующееся возникновением мегалобластной анемии в раннем детстве. Уровень сывороточного кобаламина нормальный, но наблюдается тяжелый дефицит кобаламина в тканях, так как отсутствует транскобаламин II (форма для обеспечения транспорта витамина В^ в ткани). Диагностика основана на исследовании уровня транскобаламина II в сыворотке. Лечение — высокие дозы кобаламина.
• Ювенильная пернициозная анемия — очень редкое расстройство, обычно возникающее у подростков. Диагностика и лечение проводится аналогично терапии В12-дефицитной анемии у взрослых.
• Причины возникновения дефицита фолиевой кислоты представлены в таблице 10.1.
• Запасы фолиевой кислоты в организме ограничены, поэтому ее дефицит развивается очень быстро. Если полностью ограничить содержание фолатов в пище, фолиево-дефицитная анемия развивается через 2-4 месяца.
• Неадекватная диета является главной этиологической причиной дефицита фолиевой кислоты.
• Нарушение всасывания фолиевой кислоты наблюдается при поносах, энтеритах, после резекции тонкого кишечника, при синдроме «слепой кишки».
• Применение лекарственных препаратов, являющихся аналогами или антагонистами фолиевой кислоты (табл. 10.2), может вызвать развитие фолат-дефицитной анемии.
• Алкоголь угнетает метаболизм фолатов в организме. Развитие фолиево-дефицитной анемии наблюдается у 20-40 % лиц, злоупотребляющих алкоголем.
• Дефицит фолатов очень быстро развивается у беременных женщин.
• Фолиевая кислота совместно с витамином В12 участвует в синтезе уридина, глютаминовой кислоты, пуриновых и пиримидиновых оснований, необходимых для образования ДНК.
• Чаще всего болеют лица молодого возраста.
• Проявления заболевания связаны с анемическим синдромом.
• Изменения функции желудочно-кишечного тракта выражены меньше, чем при анемии вследствие дефицита витамина В12
• Могут наблюдаться атрофические изменения слизистой оболочки языка и полости рта, но атрофический гастрит и ахилия при сниженной желудочной секреции не развиваются.
• Неврологическая симптоматика отсутствует.
• Изменения крови и КМ соответствуют морфологической картине В12-дефицитной анемии.
• Диагностическое значение имеет определение концентрации фолиевой кислоты в эритроцитах крови.
• Дифференциальная диагностика проводится с заболеваниями по тем же признакам, что и при В12-дефицитной анемии.
• Фолиевая кислота назначается внутрь в дозе 1-5 мг/день. При назначении этих доз больным с нарушенным кишечным всасыванием происходит регрессия анемии.
• Беременным женщинам следует назначать фолиевую кислоту в дозе 1 мг/день. У женщин с повышенным риском развития дефицита кобаламина (вегетарианцы) необходимо назначать парентерально витамин В12 в дозе 1мг каждые три месяца в течение беременности.
ВРОЖДЕННОЕ НАРУШЕНИЕ СИНТЕЗА ДНК
• Оротовая ацидурия — врожденное расстройство метаболизма пиримидинов, характеризуется мегалобластной анемией и высокой экскрецией с мочой оротовой кислоты.
• Клиника: повышенная чувствительность к инфекциям, вследствие повреждения клеточного иммунного ответа.
• Лечение: витамин В12 и фолиевая кислота неэффективны. Положительный эффект оказывает уридин по 1-1,5 г/день.
• Расстройство (наследуется сцеплено с Х-хромосомой) пуринового метаболизма, характеризующееся гиперурикемией, уродствами, умственными и неврологическими дефектами, мегалобластной анемией.
ТИАМИН-ЗАВИСИМАЯ МЕГАЛОБЛАСТНАЯ АНЕМИЯ
• Наследуется по аутосомно-рецессивному типу, природа метаболической патологии неизвестна.
• Характеризуется тяжелой мегалобластной анемией, диабетом, глухотой.
• Лечение: высокие дозы (20-25 мг/день) тиамина.
ДЕФИЦИТ МЕТИЛТЕТРАФОЛАТ ТРАНСФЕРАЗЫ
• Врожденная мегалобластическая анемия в сочетании с умственной отсталостью и высоким уровнем фолатов в сыворотке крови.
• Характеризуется функциональным дефицитом фолатов, мегалобластной анемией, гиперсегментацией нейтрофилов. Иногда наблюдается задержка умственного и физического развития.
• Врожденная мегалобластная анемия, характеризующаяся снижением активности печеночной дегидрофолатредуктазы.
• Макроцитарные анемии развиваются не только вследствие дефицита ДНК и фолиевой кислоты, но и при многих других заболеваниях (немегалобластные макроцитарные анемии (табл. 10.4)).
Таблица 10.4 Немегалобластные макроцитарные анемии
Расстройства, связанные с усиленным эритропоэзом
Расстройства, связанные с увеличением поверхности мембраны эритроцитов
Синдром В12-рефрактерной анемии
Приобретенная пиридоксиндефицитная анемия
Наследственная дизэритропоэтическая анемия, тип
Хронические обструктивные заболевания легких
СИНДРОМ 5q-РЕФРАКТЕРНОЙ АНЕМИИ
• Синдром 5 q -отражает сочетание рефрактерной макроцитарной анемии с морфологической патологией мегакариоцитов в КМ и изолированной делецией длинного плеча ( q ) 5 хромосомы.
• Появление клиники синдрома характерно для лиц пожилого возраста (60 лет и старше), хотя описаны случаи манифестации патологического процесса у больных моложе 50 лет.
• Женщины болеют чаще мужчин (2:1-5:1).
• Характерной гематологической особенностью являются выраженный анизо-, пойкилоцитоз, анемия средней и тяжелой степени, со снижением уровня Hb до 80 г/л и ниже; наличие гигантских тромбоцитов, тромбоцитоз (700-1000•10 9 /л). Количество лейкоцитов обычно нормальное.
• Костный мозг: клеточность вариабельна, но всегда наблюдается эритроидная гиперплазия. Количество мегакариоцитов повышено, ядра мегакариоцитов обычно небольшого размера, часто наблюдается одноядерность мегакариоцитов, активность клеток повышена.
МАКРОЦИТОЗ ПРИ АЛКОГОЛИЗМЕ
• Умеренный макроцитоз наблюдается у 40-90 % лиц, злоупотребляющих алкоголем.
• Причиной развития макроцитоза у больных алкоголизмом может быть дефицит фолатов, однако наиболее часто алкогольный макроцитоз развивается в результате прямого токсического действия на КМ.
• Диагноз алкогольного макроцитоза основан на отсутствии морфологической картины мегалобластной анемии, наличии макроцитоза в периферической крови, нормальном содержании фолатов в сыворотке крови и в эритроцитах. Алкогольный макроцитоз не исчезает при назначении фолиевой кислоты.
• При прекращении приёма алкоголя размеры эритроцитов (исходя из параметров MCV ) возвращаются к нормальным только через 2-4 месяца.
источник
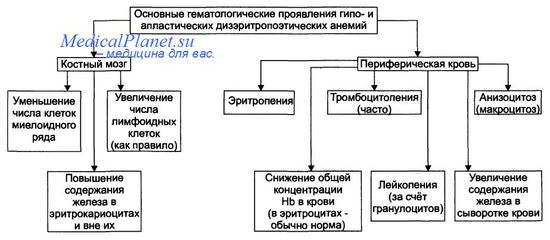
Гипо- и апластические анемии, развивающиеся в результате преимущественного повреждения стволовых клеток, являются результатом подавления функции костного мозга. По происхождению эти анемии подразделяют на первичные и вторичные.
• К первичным дизэритропоэтическим анемиям относится анемия Фанкони.
• Вторичные (приобретённые) — гипо- и апластические — дизэритропоэтические анемии обычно являются результатом действия одного или нескольких факторов: физической природы (например, ионизирующего облучения), химической природы (чаще всего ЛС, например, левомицетина, бутадиона, иммунодепрессантов, мепробамата, аминазина, цитостатиков и др.), биологической природы (главным образом вирусов, например, вызывающих гепатит, инфекционный мононуклеоз и др., а также антиэритроцитарных AT и Т-цитотоксических лимфоцитов).
— Высокие дозы ионизирующей радиации обусловливают гипоплазию костного мозга. Выраженность её зависит от дозы облучения. В основе гипоплазии кроветворной ткани лежат необратимое повреждение и гибель стволовых клеток, вплоть до их полного исчезновения, наблюдающегося при аплазии.
— Химические и биологические факторы (например, вирусы и ЛС) тормозят синтез нуклеиновых кислот и белка в стволовых клетках, нарушают клеточное и/или физико-химическое микроокружение стволовых клеток, что ведёт к расстройствам механизма их пролиферации, повреждают и вызывают гибель стволовых клеток в связи с образованием иммунных лимфоцитов и/или AT.
Любой из указанных механизмов (или их комбинация) обусловливает нарушение пролиферации и/или гибель стволовых гемопоэтических клеток, включая эритропоэтические. Это и ведёт к развитию гипо- или апласти-ческих анемий.
Проявления гипопластических анемий. Один форум родителей отмечает, что для гипо- и апластических анемий характерны следующие изменения костного мозга и периферической крови.
Клинические проявления гипопластических анемий (в связи с указанными изменениями): признаки гипоксии (недомогание, слабость, гиподинамия, головная боль, быстрая утомляемость и др.), частые кровотечения и кровоизлияния (обусловленные снижением свёртываемости крови) и высокая заболеваемость инфБ (наблюдается у пациентов с лимфопенией).
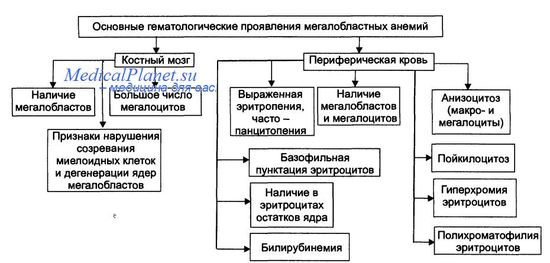
Анемии вследствие нарушения синтеза глобиновых ДНК — как правило, гиперхромные макроцитарные анемии с мегалобластным типом кроветворения. Мегалобластный эритропоэз возникает вследствие нарушения синтеза ДНК в условиях дефицита витамина В12 (цианкобаламина) или фолиевой кислоты, а также при недостаточности метионин синтетазы и дигидрофолатредуктазы. При макроцитарнои мегалобластнои анемии эритроидныи росток костного мозга представляют аномальные эритроидные клетки — мегалобласты. В эту группу анемий входят пернициозная анемия и другие В12-дефицитные анемии, а также фолиеводефицитная анемия. Эти анемии протекают тяжело и трудно поддаются лечению. Именно поэтому мегалобластные анемии ранее называли пернициозными (витамин В12-дефицитные анемии, в том числе анемия Аддисона— Бирмера).
• Патогенез мегалобластных анемий см. в статьях «Анемии витамин В12-дефицитные», «Анемия фолиеводефицитная», «Витамин В12», «Гиповитаминоз В12», «Кислота фолиевая», «Недостаточность фолиевой кислоты».
• Проявления мегалобластных анемий приведены на рисунке.
источник
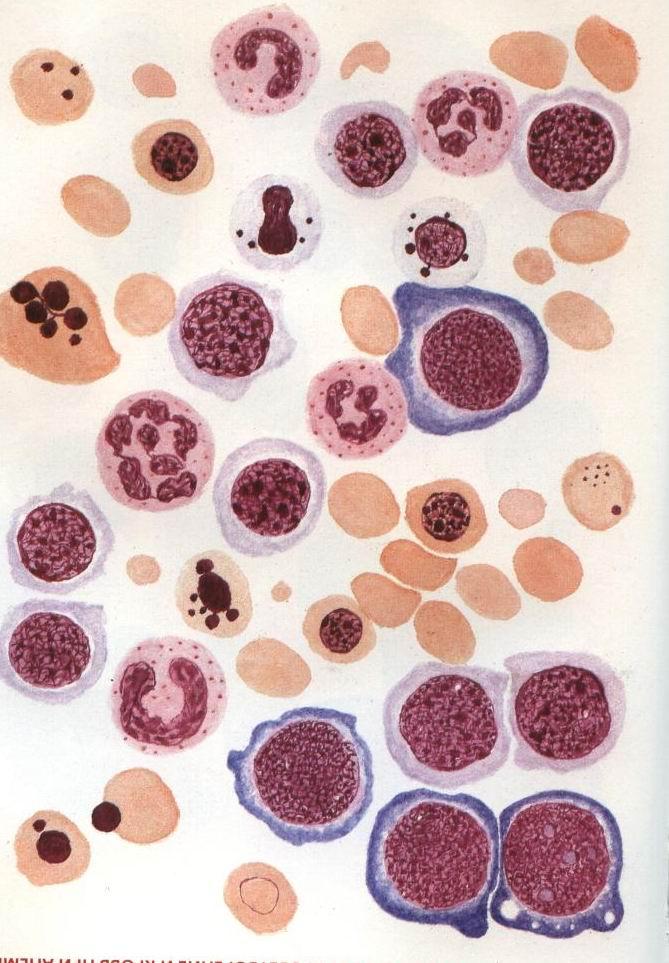
Мегалобластные анемии объединяют группу приобретенных и наследственных анемий, общим признаком которых является наличие мегалобластов в костном мозге.
Независимо от этиологии у больных выявляют гиперхромную анемию с характерными изменениями морфологии эритроцитов — эритроциты овальной формы, крупные (до 12—14 мкм и более).
Встречаются эритроциты с базофильной пунктацией цитоплазмы, во многих из них обнаруживаются остатки ядра (тельца Жолли — остатки ядерного хроматина, кольца Кебота — остатки ядерной оболочки, имеющие вид колечка; пылинки Вейденрейха — остатки ядерного вещества). Количество ретикулоцитов снижено. Наряду с анемией возможны лейконейтро- и тромбоцитопения, типично появление полисигментированных нейтрофилов.
В костномозговом пунктате число миелокариоцитов повышено, выражена гиперплазия эритроидного ростка, лейкоцитарно-эритроцитарное соотношение равно 1:1, 1:2 (в норме 3—4:1). Клетки эритроидного ростка в основном представлены мегалобластами, имеющими более крупные размеры, чем нормальные эритрокариоциты, и своеобразную морфологию ядра. Ядро располагается эксцентрично, имеет нежно-сетчатую структуру. Возможно наличие клеток с дегенеративно-измененными ядрами (в виде трефового туза, тутовой ягоды и других). Отмечается асинхронизм созревания ядра и цитоплазмы; для цитоплазмы характерна более ранняя гемоглобинизация, то есть диссоциация между степенью зрелости ядра и цитоплазмы: молодое ядро и относительно зрелая цитоплазма. Выявляют задержку созревания гранулоцитов, наличие гигантских метамиелоцитов с крупным ядром и базофильной цитоплазмой, палочкоядерных и полисегментированых нейтрофилов (с 6-10 сегментами). Число мегакариоцитов нормальное или снижено; характерно наличие гигантских форм мегакариоцитов, отшнуровывание тромбоцитов менее выражено.
Анемия у больных обусловлена неэффективным эритропоэзом и укорочением длительности жизни эритроцитов, что подтверждается повышенным содержанием эритрокариоцитов в костном мозге при сниженном количестве ретикулоцитов в периферической крови. Типичен экстрамедуллярный гемолиз эритроцитов — длительность жизни эритроцитов снижена в 2-3 раза по сравнению с нормой, билирубинемия.
Также имеются неэффективный гранулоцитопозз и тромбоцитопоэз. Таким образом, для мегалобластных анемий характерно изменение всех трех ростков кроветворения.
Клинические проявления мегалобластных анемий включают триаду признаков: анемический синдром, признаки поражения желудочно-кишечного тракта, неврологическую симптоматику.
Мегалобластные анемии могут встречаться при целом ряде состояний, но у детей в большинстве случаев они обусловлены наследственным или приобретенным дефицитом витамина В)2 или фолиевой кислоты, возможен сочетанный дефицит этих факторов. Причины мегалобластоза приведены в табл. 22.
Причины мегалобластоза [Lanzkowsky Р., 2000, с изменениями]
II. Дефицит фолиевой кислоты.
1. Врожденные нарушения синтеза ДНК:
2) тиаминзависнмая мегалобластная анемия;
3) врожденная семейная мегалобластная анемия, требующая массивных доз витамина В12 и фолиевой кислоты;
4) ассоциированная с врожденной дизэритропоэтической анемией;
2. Приобретенные дефекты синтеза ДНК:
2) сидероахрестические анемии;
3) лейкоз, особенно острый миелобластный;
4) апластические анемии (конституциональная, приобретенные);
5) эритролейкоз (синдром Ди Гульельмо);
6) рефрактерная мегалобластная анемия.
3. Мегалобластоз, индуцированный лекарственными средствами:
1) противосудорожные: фенитоин (дилантин, эпанутин), примидон (мизолин), барбитураты (фенобарбитал, туинал, фенилметилбарбитуровая кислота);
2) антиметаболиты: азатиоприн, метотрексат, 6-меркаптопурин, тиогуанин, пириметамин (дараприм), гомофолиевая кислота, 5-флюороурацил, антагонисты витамина В)2, цитозин арабинозид, гидроксимочевина, нрокарбазин;
3) противотуберкулезные: парааминосалициловая кислота (ПАСК), пиразинамид, циклосерин;
4) антибактериальные: нитрофурантоин, триметоприм;
5) противовирусные: зидовудин, ацикловир;
6) другие: триамтерен, циклофосфамид, фенилбутазон, мышьяк, закись азота.
источник
Общий признак рассматриваемых форм анемии – мегалобластный тип кроветворения (появление мегалобластов в костном мозге) с образованием на выходе мегалоцитов (крупных гиперхромных эритроцитов).
Мегалобластоз – признак двух анемий: витамин B12-дефицитной и фолиеводефицитной. В условиях недостатка указанных жизненно важных веществ изменяются нормальные процессы синтеза ДНК и РНК, что морфологически выливается в изменение вида ядерного вещества клеток, в частности клеток красного ростка костного мозга: в костном мозге появляются многочисленные мегалобласты с грубым хроматином, приобретающим тот вид, который всегда сравнивают с «мясным фаршем». Именно этим они отличаются от нормальных клеток красного ростка той же стадии развития – эритробластов. Последние содержат нежный хроматин, свойственный бластам. Нарушается также образование ядерного вещества клеток белого ростка, но здесь морфологически мы видим отражение не в изменении внешнего вида хроматина бластов – чтобы отдифференцировать бласты красного и белого ростка, еще придется попотеть, – а в полисегментарности нейтрофилов.
Для начала – несколько основных положений:
Как и в случае с другими анемиями, важно подчеркнуть, что витамин В12-дефицитная анемия – это одно из проявлений общей патологии, у которой, с одной стороны, есть определенная причина (чаще всего – атрофический гастрит и др.); с другой, поражается не только система кроветворения – дефицит универсален и его последствия универсальны.
Нам все время твердят, что пернициозной анемии – тяжелой витамин B12-дефицитной анемии – в наше время не бывает. Это глубокое заблуждение, т.к. в действительности пациенты с гемоглобином 20-40 г/л – не редкость. Отчасти сами больные, не обращающие особого внимания на свое здоровье, доводят себя до таких цифр, тем более анемия развивается очень медленно; отчасти медики пропускают случаи и спохватываются поздновато, хотя по большому счету данная патология весьма яркая. Так,…
О мегалобластах и следствии их существования – гиперхромных мегалоцитах – уже сказано, но не все – см. далее.
Второй аспект – внутрикостномозговое разрушение нормоцитов – также очень важен. Внутрикостномозговое разрушение формирующихся клеток крови, уже успевших синтезировать некоторое количество гемоглобина, ответственно за возникновение небольшой гипербилирубинемии. У больных на фоне бледности просматривается легкая желтушность. Поскольку болеют пожилые, у них сразу начинают искать онкологию с метастазами в печень. Обследование затягивается на месяцы, а ценное время уходит. Еще хуже, если больного забросят и «оставят помирать», да он и сам может махнуть на себя рукой.
Резкое снижение количества эритроцитов наряду с уменьшением числа других клеток (цитопенический синдром) – это тот признак, который должен натолкнуть на мысль о витамин B12-дефиците. Мегалоцитоз: в крови появляются крупные наполненные гемоглобином эритроциты. В мазке крови в них нет свойственного нормальным эритроцитам центрального просветления. Мегалоциты имеют скорее шаровидную, чем дисковидную форму.
Атрофия слизистой оболочки желудочно-кишечного тракта (ЖКТ), кроме прочего – следствие недостаточного синтеза ядерного вещества в интенсивно делящихся клетках ЖКТ, которые призваны обновляться каждые сутки.
Неврологическая симптоматика (в первую очередь парестезии и «ватность ног») в крайнем выражении в виде фуникулярного миелоза – это уже последствие демиелинизации в результате нарушения биохимии миелина. Важно, что неврологические проявления отличают витамин B12-дефицитную анемию от фолиеводефицитной: при фолиеводефицитной анемии, хоть периферическая кровь имеет аналогичную картину, неврологических расстройств нет (раскрытие темы заставляет повторить это несколько раз).
Участие витамина B12 в двух биохимических процессах определяет его функции в организме человека. Обе функции крайне важные, а, поскольку они важные, их выпадение делает человека инвалидом.
Первая – влияние на кровь. С точки зрения анемии интересует в первую очередь следующая химическая фигура-головоломка, на самом деле не слишком сложная и страшная:
Речь о процессе преобразования нуклеиновых кислот: уридин-5-монофосфат идет на синтез РНК; для синтеза ДНК требуется тимидин-5-монофосфат. Переход первого во второй происходит с участием 5,10-метилентерагидрофолата. Последний, пройдя через указанную реакцию, превращается в 5-метилтерагидрофолат. Для того чтобы процесс возобновился, нужно перевести 5-метилтетрагидрофолат в тетрагидрофолат – именно здесь необходим метилкобаламин (КоB12). Далее тетрагидрофолат опять превращается в необходимый 5,10-метилентетрагидрофолат, и циклы повторяются.
В этом великий смысл. Соответственно, при недостатке кобаламина синтез искомых веществ нарушается, и в результате нарушается построение ДНК и РНК, т.е. хромосом клетки. Образование клеток в костном мозге происходит с огромной интенсивностью, поэтому анемия развивается в первую очередь и проявляется особенно ярко.
Нельзя не учитывать, что витамин B12 нужен для образования ядерного вещества, т.е. он нужен не только костному мозгу, но и всем тканям организма. В связи с этим…
Второе – причастность кобаламина к синтезу миелина, необходимого для построения оболочек нервов. Однако напрямую, как мы поняли, кобаламин действовать не привык и никогда не ищет легких биохимических путей:
В первую очередь поражаются боковые и задние столбы спинного мозга, т.е. структуры, отвечающие за чувствительность. Демиелинизация может затронуть также мозжечковые пути и периферические нервы. Клиническая картина тем богаче и тяжелее, чем глубже зашел процесс, поэтому дефицит витамина необходимо распознавать как можно раньше, не теряя время на ошибочную диагностику вида анемии.
Источниками витамина B12 для человека выступают только продукты животного происхождения. Другого не дано, поэтому строгие вегетарианцы в 100% случаев заведомо обрекают себя на дефицит необходимого компонента пищи. Законы природы работают, независимо от тараканов в головах отдельных субъектов этой самой природы. Экстремизм в питании никогда ни к чему хорошему не приводил и не приводит. Все диеты с резкими ограничениями ущербны по определению.
Важный витамин всасывается посредством довольно сложной цепочки физиологических событий. Сложность, как всегда, сопряжена с возможностью поломки на разных уровнях, но в случае с витамин B12-дефицитной анемией основной патогенетический механизм реализуется через недостаток желудочного R-белка, синтез которого страдает при атрофическом гастрите. После гастрэктомии R-белок по понятным причинам полностью отсутствует.
Любой выявленный больной должен был бы стать пациентом несколько лет назад. Важно, чтобы его болезнь распознали хотя бы сейчас, при обращении к врачу.
Здесь уместно было бы поднять вопрос о целесообразности выполнения анализа крови на витамин B12. Каждый вправе ответить на него по-своему. Лично я этот анализ как диагностический тест не рассматриваю. Мало того, что лаборатория может выдать некую величину, которая ничего общего с истиной не имеет, логика заставляет взглянуть на параметр трезвым взглядом. Во-первых, поскольку запасы вещества в печени колоссальны, на весь период, пока эти запасы будут расходоваться, витамина организму будет хватать – анализ в принципе оказывается бессмысленным: априори он должен показывать норму (кстати, как и анализы на железо на стадии лечения, рассчитанной на заполнение депо). Во-вторых, когда запасы иссякнут, сразу среагирует костный мозг как ткань с крайне высокой пролиферативной активностью; анализ, скорее всего, покажет снижение, но диагноз мы будем ставить, все равно, не по нему, а на основании характерных черт анемии.
Однако главное не это. Дело в том, что, диагностируя дефицит витамина B12, мы волей-неволей должны решить вопрос о дальнейшей тактике, т.е. в данном случае – назначить инъекции витамина B12 на пожизненной основе. Спрашивается вопрос: готовы ли мы/вы относительно молодому больному никакой анемией не страдающему, у которого в ответе из лаборатории почему-то витамин B12 оказался ниже нормы, на всю оставшуюся жизнь назначить инъекции цианкобаламина? Ответ очевиден – конечно, нет. А зачем тогда делали анализ?
Напрашивается главный вывод: анализ крови на витамин в принципе никому не нужен. Его можно дополнительно сделать, когда диагностирована макроцитарная гиперхромная анемия, но смысл все также остается сомнительным, поскольку ясно, что у человека «в наличии есть» дефицит витамина B12. Более того, если вдруг лаборатория в данном случае выдаст нормальный результат, врач окажется в весьма двусмысленном положении: больному придется объяснить, что «у него в организме не хватает витамина B12, хотя анализ на витамин хороший, и теперь пожизненно ему придется делать уколы…». После такой «загогулины» больной, может быть, не выскажется в резкой форме, но в слова врача точно уж не поверит и обязательно пойдет за вторым мнением к «нормальному доктору».
Перечисленные причины понятны. Комментариев заслуживает вариант с конкурентным поглощением витамина в кишечнике. Наблюдается такое редко, но следует помнить, что поселившийся в кишечнике широкий лентец, длина которого может составлять 10 м и более, а продолжительность жизни – 25 лет, способен поглощать весь витамин B12, поступающий с пищей. При синдроме приводящей петли (иногда формирующейся после резекции желудка) витамин B12— утилизируется бактериями.
Вид больных довольно характерен, поэтому уже при первом контакте с пациентом можно высказать предположение о витамин B12-дефицитной анемии. Подтверждает это «анемическая» симптоматика…
В норме эритропоэз протекает следующим образом:
Нормальный эритробласт превращается в пронормоцит, далее – в базофильный нормоцит, полихроматофильный нормоцит. По мере насыщения гемоглобином нормоцит приобретает ацидофильность, становится оранжевым, но содержит остаточное ядро. Потом ядро исчезает. В периферическую кровь выходят только ретикулоциты и эритроциты.
При витамин B12-дефиците ядерное вещество формируется неправильно, и гемопоэз приобретает характер мегалобластического. Конечный продукт в этом случае – мегалоциты – крупные эритроциты без центрального просветления. Некоторые из мегалоцитов содержат остатки ядер (в виде телец Жоли и колец Кебота). Возможно обнаружение в периферической крови единичных нормоцитов.
Важно иметь в виду, что при витамин B12-дефиците страдает не только красный, но и все остальные ростки кроветворения, поэтому в типичном случае приходится наблюдать лейкопению и тромбоцитопению. Для популяции лейкоцитов характерно, кроме того, появление гиперсегментированных клеток. О гиперсегментарности с практической точки зрения целесообразно говорить только в отношении нейтрофилов, потому что в базофилах и эозинофилах ядра плохо различимы.
Перечисленные особенности патологии оцениваются глазом. Основываться только на результатах машинного подсчета параметров крови нельзя – обязательно изучение мазка крови под микроскопом.
Хотя при витамин B12-дефицитной анемии морфология периферической крови в общем характерна, развитие цитопении в любом случае требует цитологического исследования костного мозга для исключения лейкоза. Показано выполнение стернальной пункции. Данному требованию следуют не все. Некоторые врачи воздерживаются от пункции и сразу приступают к лечению витамином. Как правило, все заканчивается удачно, и наступает быстрое улучшение. Тем не менее данное решение остается на совести врача. Так, при остром лейкозе никакого положительного эффекта от введения витамина B12 зафиксировать не получится: анемия и цитопения будут нарастать. К сожалению, может быть упущено время.
Несмотря на малое количество эритроцитов в периферической крови, при витамин B12-дефицитной анемии костный мозг оказывается обогащенным элементами красного ростка, цитоз костного мозга возрастает, однако гемопоэз неполноценен, и большинство клеток разрушается внутри костного мозга, поэтому в биохимическом анализе крови…
Ключевой признак – мегалобластоз (и, соответственно, мегалоцитоз) проявляется при ряде других состояний. К ним относятся:
Приведенный список отнюдь не исчерпывающий, но другие состояния крайне редки и упоминаются в соответствующей литературе больше теоретически (например, мегалобластоз якобы возможен при лечении бисептолом; лечить, наверное, нужно очень долго и интенсивно).
По имеющейся информации гидроксикобаламин весьма хорош: у него лучше усвояемость и биологическая активность, но, к сожалению, он не зарегистрирован в России. В нашем распоряжении только цианкобаламин в ампулах с разной дозировкой: 200 и 500 мкг.
В последнее время начали писать о возможности перорального применения цианкобаламина.
Схем применения витамина B12 может быть много, но принципы терапии понятны в любом случае: сначала инъекции осуществляют часто с тем, чтобы быстро ликвидировать оперативный дефицит вещества. Затем менее частыми введениями добиваются стабилизации состояния больного. Далее назначают поддерживающую пожизненную терапию. Итак, две основные схемы лечения предусматривают следующее:
Лечение витамин B12-дефицитной анемии – благодарное дело. В типичном случае больной улучшается на глазах. Так, ретикулоцитарный криз следует ожидать по прошествии 8-10 дней от начала лечения. Потом содержание гемоглобина в крови быстро нарастает и нормализуется – основная проблема решена. Остается лишь убедить больного в необходимости поддерживающей терапии. Поскольку у многих в голове не укладывается, с какой стати они должны делать себе уколы пожизненно, если уже чувствуют себя хорошо, и гемоглобин нормализовался. Здесь не помешает разумное разъяснение – санитарно-просветительная работа чистой воды.
Американская схема, наверное, не хуже нашей восстанавливает кроветворение, но здесь воспроизводится лишь для расширения кругозора – гидроксикобаламина у нас не найдешь.
Особая проблема – глубокий дефицит витамина B12 с нарушением синтеза миелина, развитием фуникулярного миелоза с соответствующей неврологической симптоматикой. Лечение начинают немедленно с момента установления диагноза, так как, во-первых, без миелина нервные структуры повреждаются катастрофически; во-вторых, восстановление неврологических функций происходит очень медленно. Возможны остаточные явления. Логично, если в лечении больного с фуникулярным миелозом будет участвовать невролог.
Крайне важное предупреждение:
Оно актуально, поскольку многие уверены, что «витамины никому и никогда помешать не могут». Естественно, это глубокое заблуждение, но здесь такое заблуждение чревато серьезными последствиями. Полбеды, если больной начнет получать фолиевую кислоту на фоне массивной терапии витамином B12; хуже, когда только фолиевая кислота начинает поступать в организм, находящийся в состоянии резкого дефицита кобаламина. Такое стечение обстоятельств возможно, когда врач, не разобравшись, назвав витамин B12-дефицитную анемию «железодефицитной», назначает препараты железа с витаминными добавками (например, глобирон-Н, гино-тардиферон) или вводит в схему чистую фолиевую кислоту («…потому что помогает при малокровии…»).
Такие формы анемии возможны. Они крайне редки, но проявляются в раннем детстве. О них должны знать педиатры.
Упоминать фолиеводефицитную анемию в теме о витамин B12-дефиците приходится в связи со схожестью гематологических проявлений.
Данный вид анемии возможен, но условия для формирования истинного дефицита фолиевой кислоты весьма специфичны: например, дефицит теоретически может возникнуть в организме беременной женщины, но, только если она круглогодично не потребляет никаких свежих ни овощей, ни фруктов, да и не наблюдается акушерами, которые назначают фолиевую кислоту всем будущим матерям. Таким образом, заслуживают внимания перечисленные ниже ситуации.
Очевидно то, что с настоящей фолиеводефицитной анемией встретится вряд ли придется. Однако забывать про нее не следует.
Демиелинизации и фуникулярного миелоза не возникает по той простой причине, что фолиевая кислота никак не участвует в синтезе миелина и не влияет на него. Ориентироваться приходится на клиническую картину анемии с характерной макроцитарной морфологией в отсутствие неврологических симптомов.
Своевременной и правильной диагностике витамин B12-дефицитной анемии легко могут помешать те мероприятия, к которым часто прибегают коллеги других специальностей при лечении своей патологии. Навредить нередко норовят и сами больные, особенно в наше Интернет-зависимое время.
Здесь нельзя не вспомнить о порочной практике назначать поливитамины по любому поводу и без повода. К счастью, в прошлом осталось повальное увлечение круглогодичным употреблением поливитаминных пищевых добавок, которые можно назначать самому себе «для укрепления организма» без ограничений, и этому никто не мешал.
Существует проблема с живучестью старых отвергнутых современной наукой установок в лечении некоторых болезней. Характерный пример, когда витамин B12 не нужен, но его упорно назначают.
Об опасности бездумного применения фолиевой кислоты речь шла ранее. Напомним еще раз:
источник
Мегалобластные анемии (наследственные и приобретенные) – анемии, связанные с нарушением синтеза ДНК и РНК. Эти анемии объединяет присутствие в костном мозге мегалобластов – своеобразных больших клеток красного ряда с нежной структурой и необычным расположением хроматина в ядре, асинхронной дифференцировкой ядра и цитоплазмы.
Витамин В12 – дефицитная анемия – болезнь пожилых и старых людей. В возрасте старше 60 лет дефицит витамина В12 встречается в среднем у каждого 50-го человека, старше 70 лет — у каждого 15.
Этиология дефицита витамина В12: нарушение всасывания витамина В12. Причины нарушения всасывания: отсутствие секреции внутреннего фактора Касла, поражение тонкой кишки и конкурентное поглощение большого количества витамина В12 в кишечнике.
Наиболее частая причина нарушения всасывания витамина В12 –атрофия слизистой желудка, при которой отсутствует секреция хлористоводородной кислоты, пепсина и внутреннего фактора.
В большинстве случаев витамин В12-дефицитной анемии речь идет об аутоиммунной атрофии слизистой желудка (обнаруживаются антитела, направленные против цитоплазмы париетальных клеток желудка, более чем в половине случаев наблюдаются антитела против внутреннего фактора, у значительной части обнаружены антитела против эпителия щитовидной железы, лимфоцитов и клеток канальцев почек). Нарушение секреции внутреннего фактора изредка может стать следствием токсического воздействия на слизистую желудка, например алкоголя, особенно неразведенного спирта, при длительном его употреблении.
Витамин В12-дефицитная анемия развивается после полного удаления желудка (в связи с тем, что в печени имеется значительный запас витамина В12, мегалобластная анемия развивается не раньше, чем через 3-4 года после операции).
Вторая по частоте причина дефицита витамина В12 – нарушение его всасывания в кишечнике у больных, перенесших резекцию значительной части тонкой кишки, у больных с тяжелым хроническим энтеритом, при целиакии, при тропическом спру, реже при терминальном илеите, лимфомах кишечника, радиационном поражении, у пациентов с гипотиреозом, при синдроме Имерслунд-Гресбека.
Конкурентный расход витамина В12 наблюдается прежде всего при инвазии широким лентецом (Diphylobothnium latum), при так называемом синдроме слепой кишки (blind loop syndrome), когда в результате наложения анастомоза остаются участки тонкой кишки, через которые не проходит пища. В этих участках накапливается большое количество кишечной микробной флоры, которая поглощает витамин В12. Такая же ситуация наблюдается при множественном дивертикулезе тонкой кишки.
Описаны случаи дефицита витамина В12 при наследственном недостатке транскобаламина II, синдроме Золлингера-Эллисона, строгих вегетарианцев; у лиц, длительно принимающих ПАСК, неомицин, большие дозы хлористого калия. В связи с тем, что витамин В12 содержится в пище только животного происхождения, возникает вопрос о возможности витамин В12 дефицитной анемии у вегетарианцев. Дефицит витамина В12 у этой группы лиц развивается медленнее, чем при отсутствии внутреннего фактора, так как значительная часть витамина В12 выделяется с желчью и при наличии внутреннего фактора повторно всасывается.
Патогенез. Изменения в кроветворении и клетках эпителия желудочно-кишечного тракта связаны с нарушением образования тимидина, и, следовательно, с нарушением образования ДНК, и, таким образом, с нарушением деления клетки.
Патогенез неврологических нарушений при витамин В12-дефицитных анемиях сложен и пока изучен недостаточно (изменения в нервной системе не имеют отношения к нарушению синтеза ДНК, а связаны с нарушением обмена жирных кислот с нечетным количеством углеродных атомов).
Клиническая картина В12-дефицитной анемии складывается из поражения системы кроветворения (анемический синдром), пищеварительной и нервной системы (синдром фуникулярного миелоза).
Постепенно у больных развиваются утомляемость, слабость, сердцебиения, иногда загрудинная боль (стенокардия), одышка при физической нагрузке. Многие больные в течение ряда лет перед проявлением анемии жалуются на наличие диспепсических расстройств. Некоторые пациенты жалуются на боль в языке. Этот симптом был описан в 1901 г. W.Hunter. На языке обнаруживаются участки воспаления, иногда афты, атрофия сосочков. Больные чаще бывают полными, с одутловатым, а при выраженной анемии – бледно-желтушным лицом, у большинства выявляется легкая желтушность склер. Иногда определяется субфебрильная температура тела.
У ряда больных немного увеличена селезенка, а иногда и печень.
Желудочная секреция у большинства пациентов с дефицитом витамина В12 резко снижена. Если причиной дефицита витамина В12 служит приобретенное нарушение секреции внутреннего фактора Касла, то в желудочном соке полностью отсутствуют хлористоводородная кислота и пепсин.
ФГДС — атрофия слизистой оболочки желудка, подтверждаемая гистологическим исследованием.
Наиболее ранние симптомы поражения нервной системы – парестезии и нарушение чувствительности с постоянными легкими болевыми ощущениями, напоминающими покалывание булавками, ощущение холода, «ватных» ног, ползания мурашек, онемения в конечностях.
Редко отмечаются более глубокие нарушения: парезы и периферические параличи, нарушения глубокой чувствительности, исчезновение вибрационной и болевой чувствительности, нарушения функции тазовых органов, обоняния и вкуса, мышечная слабость и атрофия мышц.
При В12-дефицитной анемии могут наблюдаться такие явления, как судорожные припадки, галлюцинации, нарушения памяти и ориентации в пространстве. Как правило, эти симптомы вызваны гипоксией мозга на фоне тяжелой анемии, а не собственно поражением центральной нервной системы.
Периферическая кровь. Высокий цветовой показатель. Макроцитарная анемия. В эритроцитах остатки ядерных субстанций, кольца Кебота, тельца Жолли, характерна базофильная пунктация эритроцитов (элементы РНК), количество ретикулоцитов снижено, реже — нормальное.
Тромбоцитопения носит умеренный характер, редко бывает глубже 100х10 9 /л тромбоцитов. Функции тромбоцитов сохраняются нормальными, поэтому кровоточивость наблюдается редко.
В большинстве случаев снижается количество лейкоцитов за счет снижения количества нейтрофилов.
Нейтрофилы при В12-дефицитной анемии становятся более крупными, изменяется структура ядра зрелых клеток, характерна гиперсегментация ядер нейтрофилов.
Биохимический анализ крови: умеренная гипербилирубинемия (за счет непрямого билирубина до 28-47 мкмоль/л).
Определение содержания сывороточного витамина В12. Нормальное содержание витамина В12 в сыворотке крови 200-1000 пг/мл, при заболевании уровень витамина В12 снижается до 10-150 пг/мл.
Диагностический поиск: ФГДС, RRS, ирригоскопия, колоноскопия, УЗИ органов брюшной полости, щитовидной железы.
Костномозговое поражение. В результате нарушения клеточного деления уменьшается синтез клеток в трех ростках: эритроидном, гранулоцитарном и тромбоцитарном — трехростковая цитопения. Одновременно качественно изменяются форма и структура клеток – мегалобластный тип кроветворения (рис.1).
Рис. 1. Костный мозг при В12-дефицитной анемии (по М.Г.Абрамову, 1985).
Диагностические критерии витамин В12-дефицитной анемии:
трехростковая цитопения (анемия, тромбоцитопения, лейкопения);
высокий цветовой показатель, гиперхромия эритроцитов;
гиперсегментация ядер нейтрофилов, базофильная пунктация эритроцитов;
окраска кожи лимонно-желтая;
глоссит Гентера – ярко-красный лакированный язык (к специфическим жалобам относится – чувство жжения в языке);
признаки поражения нервной системы (фуникулярный миелоз);
мегалобластический тип кроветворения в костном мозге (стернальная пункция — основной метод верификации диагноза).
Дифференциальная диагностика при В12-дефицитной анемии.
Дифференциальный диагноз проводится с другими анемиями, при которых также снижается содержание лейкоцитов и тромбоцитов и есть признаки повышенного гемолиза (повышение уровня билирубина, увеличение размеров селезенки). Повышенный гемолиз сочетается с тромбоцитопенией и лейкопенией при аутоиммунной панцитопении и при ПНГ (пароксизмальной ночной гемоглобинурии).
При аутоиммунной панцитопении чаще всего бывает положительным тест Кумбса, тромбоцитопения чаще дает геморрагический синдром. При ПНГ обнаруживается внутрисосудистый гемолиз, появление черной мочи, гемосидерина в моче, повышение свободного гемоглобина в плазме, снижение содержания гаптоглобина, а также обнаружение при ПНГ комплементчувствительного клона эритроцитов при помощи теста Хема и сахарозной пробы.
При появлении в костном мозге мегалобластов необходимо проводить дифференциальную диагностику с острым лейкозом (эритромиелозом).
Мегалобласты в костном мозге обнаруживаются при лечении цитостатическими препаратами – цитозаром.
Макроцитоз эритроцитов наблюдается при гепатитах, при механической желтухе; у больных, перенесших спленэктомию.
Основной метод лечения — парентеральное введение витамина В12. Для парентерального введения применяют цианкобаламин и оксикобаламин. Для лечения витамин В12-дефицитной анемии цианкобаламин назначают по 1000 мкг в сутки. Препарат вводят внутримышечно в течение 4-6 недель. Гидроксикобаламин — через день по 1000 мкг (или 500 мкг ежедневно) в течение 4 недель.
При фуникулярном миелозе – большие дозы витамина В12 (до 200 мкг ежедневно).
Фолиевая кислота при дефиците витамина В12 не показана.
При низких запасах витамина В12 прием фолиевой кислоты может усилить неврологическую симптоматику.
На 3-4-й день от начала лечения витамином В12 начинает увеличиваться содержание ретикулоцитов. Максимальный подъем ретикулоцитов — на 5-8-й день в зависимости от выраженности анемии (ретикулоцитарный криз).
После полной нормализации показателей крови проводят закрепляющую терапию. В течение 2 мес. цианкобаламин вводят по 1000 мкг еженедельно, а затем — пожизненно по 1000 мкг 1 раз в месяц. Оксикобаламин — в течение первых двух месяцев 1 раз в 10 дней по 500 мкг, а затем пожизненно ежемесячно по 500 мкг.
Трансфузии эритроцитов следует применять лишь по жизненным показаниям — резкое нарушение гемодинамики, коматозное состояние.
Анемии, обусловленные дефицитом фолиевой кислоты, независимо от причины этого дефицита, сопровождаются появлением в костном мозге мегалобластов, внутрикостным разрушением эритрокариоцитов, панцитопенией, макроцитозом и гиперхромией эритроцитов, иногда психическими расстройствами.
Дефицит фолиевой кислоты может быть связан с недостаточным употреблением в пищу фолиевой кислоты, нарушением всасывания в кишечнике, повышенными потребностями в фолиевой кислоте. Чаще встречается у молодых женщин.
Причины дефицита фолиевой кислоты:
— недостаточное поступление фолатов в организм;
— недостаточное содержание их в рационе (мало сырых овощей и фруктов, хронический алкоголизм);
— нарушение всасывания при синдроме мальабсорбции, приеме некоторых лекарственных препаратов (противосудорожные препараты, барбитураты, оральные контрацептивы, метотрексат и др.), конкурентное потребление микрофлорой кишечника при синдроме слепой петли; у лиц перенсших резекцию тонкой кишки, целиакии, болезнь Уиппла и др.
— повышенная потребность в фолиевой кислоте: беременность, некоторые злокачественные опухоли, удаление фолиевой кислоты при гемодиализе (молекула относительно небольшого размера и свободно проходит через диализную мембрану).
Клиническая картина. Больные с дефицитом фолиевой кислоты жалуются на слабость, головокружения. Склеры глаз иктеричны. В отличие от дефицита витамина В12– не отмечается одутловатости лица, боль в языке бывает редко. Не бывает признаков фуникулярного миелоза. Редко наблюдается атрофический гастрит.
Картина крови характеризуется трехростковой цитопенией, гиперхромией эритроцитов и макроцитозом. Картина костного мозга аналогична таковой при дефиците витамина В12 — мегалобластное и «неэффективное» кроветворение, синий костный мозг, делящиеся эритрокариоциты.
Диагностика дефицита фолиевой кислоты. О дефиците фолиевой кислоты можно думать у лиц, длительно принимающих противосудорожные препараты, злоупотребляющих алкоголем, у беременных женщин, у лиц, не употребляющих в пищу сырых овощей и фруктов; у больных гетерозиготными талассемиями или одной из форм гемолитических анемий.
Содержание фолиевой кислоты в сыворотке крови у взрослого в норме 3-9 нг/мл, в эритроцитах 100-425 нг/мл. При дефиците фолиевой кислоты эти показатели снижаются.
Дифференцировать фолиеводефицитную анемию приходится, главным образом, с В12-дефицитной анемией.
При дефиците фолиевой кислоты не бывает фуникулярного миелоза, желудочная секреция может быть снижена, однако, гистаминоупорная ахилия с атрофией слизистой оболочки желудка не характерна. Диагностике помогает исследование содержания фолиевой кислоты и витамина В12 в сыворотке крови, фолиевой кислоты в эритроцитах, метилмалоновой кислоты в моче и сыворотке крови.
Лечение проводится препаратами фолиевой кислоты в дозе 5-15 мг в сутки. Профилактику следует проводить у беременных, страдающих наследственными и приобретенными формами гемолитической анемии, талассемией.
Этиология железодефицитной и В12-дефицитной анемии
Патофизиологические стадии развития ЖДА, понятие о латентном дефиците железа
Патогенез основных клинических проявлений при В12-дефицитной анемии (характеристика нарушений кроветворения, механизм развития фуникулярного миелоза, нарушений клеточной регенерации)
Клиническая характеристика общеанемического, сидеропенического синдрома; поражения желудочно — кишечного тракта и нервной системы при В12-дефицитной анемии
Классификация анемий по степени тяжести
Лабораторные и инструментальные критерии ЖДА и В12-дефицитной анемии, основные диагностические отличия.
План обследования пациента с подозрением на ЖДА и В12 дефицит.
Дифференциальный диагноз гипохромных анемий (ЖДА, анемия хронического состояния, сидероахрестические анемии, талассемии).
Дифференциальный диагноз гиперхромных анемий (В12 дефицит, дефицит фолиевой кислоты)
Принципы лечения ЖДА. Этапы терапии. Профилактика дефицита железа в группах риска.
Принципы лечения В12-дефицитной анемии. Профилактика рецидивов.
Используя клинические и диагностические критерии, заподозрить ЖДА и В-12 дефицитную анемию.
С учетом возможных причин изучаемых анемий, детально со брать анамнез.
Умение формулировать диагноз при ЖДА и В12-дефицитной анемии с использованием современной классификации
Составить план обследования пациента с подозрением на ЖДА и В-12 — дефицитную анемии для установления причины, уточнения выраженности анемических проявлений и проведения дифференциального диагноза.
Трактовать результаты лабораторных (общий анализ крови, показатели транспортного и резервного фондов железа; содержание В12, непрямого билирубина в сыворотке крови, основные показатели миелограммы) и инструментальных методов исследования (ЭКГ, ЭХО-признаки изменений сердца при тяжелой анемии, внутрижелудочная рН-метрия).
Интерпретировать заключение эндоскопического и рентгенологического исследования.
Составить план лечения при ЖДА и В-12 дефицитной анемии. Уметь выписать рецепты: сорбифер-дурулес, феррум лек, цианкобаламин, аскорбиновая кислота.
Обучение проводится на базе терапевтических отделений ГКБ №8. Главными методами обучения являются самостоятельная работа студента у постели больного под руководством преподавателя, детальный клинический разбор больных с последующей оценкой результатов параклинических методов исследований: лабораторно-биохимического, рентгенологического, ультразвукового, эндоскопического, морфологического, радиоизотопного и иммунологического (защита истории болезни проводится каждым обучающимся студентом). Студенты активно участвуют в проводимых в клинике клинических и патологоанатомических конференциях, консилиумах, курируют больных в составе «врачебных бригад» и оформляют академическую историю болезни (общепринятая схема истории болезни прилагается).
Вопросы по теме для самостоятельного изучения студентами
ВОПРОСЫ ПО ТЕМЕ, ВЫНОСИМЫЕ НА ЭКЗАМЕНЫ
ПРАКТИЧЕСКИЕ НАВЫКИ, КОТОРЫМИ ДОЛЖЕН ОВЛАДЕТЬ СТУДЕНТ ПО ТЕМЕ ЗАНЯТИЯ
источник