Общепринято выделять две формы железодефицитных состояний: латентный (скрытый) дефицит железа и железодефицитную анемию.
- Латентный дефицит железа характеризуется уменьшением количества железа в организме (сокращение его запасов в органах-депо) и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов.
- Железодефицитная анемия — это патологическое состояние, характеризующееся нарушением синтеза гемоглобина в результате недостатка железа в организме (истощение его запасов в органах-депо), которое проявляется признаками анемии и сидеропении.
Люди, страдающие от железодефицитных состояний, составляют около 20% населения Земли. Железодефицитная анемия является самой распространенной патологией системы крови и самой часто встречаемой анемией.
Причины возникновения железодефицитных состояний очень разнообразны. Распознать причину развития железодефицитной анемии в каждом конкретном случае чрезвычайно важно, так как сама по себе анемия не является первичным заболеванием, а в большинстве случаев обусловлена какой-либо патологией.
Подробнее о железодефицитной анемии читайте в этой статье.
Талассемия — анемия, обусловленная нарушением синтеза глобулиновой части молекулы гемоглобина, связанного с рецессивно наследуемыми аномалиями генов. Выделяют:
- альфа-талассемию, вызванную дефектом сектора α-цепи при отсутствии мРНК гена-α-глобулина,
- бета-талассемию, обусловленную отсутствием или нарушением функции гена β-глобулина.
Существует 4 вида α-талассемии, связанные с 4 генами α-цепей:
— Делеция или инактивация четырех генов α-цепей глобина приводит к водянке плода, ребенок рождается мертвым, концентрация гемоглобина в крови резко снижена, и он представлен в основном гемоглобином Bart. Преобладает у выходцев из азиатских стран.
— Делеция или инактивация трех генов α-цепей глобина приводит к гемоглобинопатии Н, при которой выявляется микроцитарная гипохромная анемия с мишеневидными эритроцитами и тельцами Гейнце в мазках крови. Клиническими проявлениями могут быть гемолитическая анемия и спленомегалия. Течение длительное, симптомы анемии наблюдаются в детском возрасте, но в легких случаях — лишь в зрелом возрасте. При этом варианте гемоглобинопатии показана спленэктомия.
— Делеция или инактивация двух генов α-цепей глобина не приводит к выраженному нарушению нормального эритропоэза. Развивается синдром, называемый «малой α-талассемией». Клиника проявляется легкой микроцитарной гипохромной анемией, не требующей лечений.
— При делеции или инактивации одного гена α-цепей глобина клиника анемии отсутствует.
β-талассемии связаны с наследованием ребенком гена β-глобина с нарушенной функцией. В геноме β-глобина имеются 2 мутантных аллеля.
- При наследовании только одного аллеля развивается гетерозиготная β-талассемия (малая талассемия).
- При наследовании двух мутантных аллелей развивается гомозиготная β-талассемия (большая талассемия, анемия Кули).
Гетерозиготная β-талассемия протекает с клиникой легкой гипохромной анемии, анизоцитозом и пойкилоцитозом, незначительным увеличением селезенки и повышением содержания фракции HbA2. Прогноз при данной форме анемии благоприятный.
Гомозиготная β-талассемия имеет тяжелое течение, проявляется выраженной гемолитической анемией, развивающейся к концу первого года жизни ребенка, гепатомегалией и спленомегалией, отставанием ребенка в физическом развитии, монголоидностью лица и башенным черепом.
Характерны резкое снижение образования HbA1, увеличение содержания HbF, нормальное или повышенное содержание HbA2. Уровень гемоглобина составляет 30–50 г/л, цветовой показатель ниже 0,5. В мазках крови выявляют мишеневидные эритроциты, анизоцитоз и пойкилоцитоз. Длительный гемолиз и частые переливания крови приводят к развитию гемосидероза печени и селезенки и нередко к образованию билирубиновых камней в желчных путях.
Прогноз при тяжелой гомозиготной β-талассемии неблагоприятный, больные умирают в первые годы жизни. При талассемии средней тяжести дети доживают до школьного возраста, при талассемии легкой степени тяжести больные доживают до среднего возраста.
При альфа- и бета-талассемиях проводят гемотрансфузии (повторное переливание отмытых или размороженных эритроцитов), введение фолиевой кислоты (прием по 0,005 г 1–2 раза в день). Спленэктомию проводят по показаниям (при значительной спленомегалии и распаде эритроцитов в селезенке). Замедление развития гемосидероза достигается назначением хелатов железа (десферал, дефероксамин). Трансплантация костного мозга может привести к выздоровлению.
У больных с воспалительными процессами, хроническими инфекциями, аутоиммунными заболеваниями и опухолями часто бывает нормоцитарная умеренно выраженная анемия. Анемия развивается обычно медленно в течение нескольких месяцев.
Ведущее значение в патогенезе анемии имеет нарушение использования двухвалентного железа костным мозгом. Кроме того, выявляется низкий уровень эритропоэтина. Это определяет образование в условиях дефицита железа эритроцитов, имеющих сниженную продолжительность жизни. Клиника заболевания проявляется синдромом анемии.
Типична умеренная нормоцитарная анемия с небольшой гипохромией, возможен микроцитоз на фоне хронического заболевания, гемоглобин 80–100 г/л. Сывороточное железо и общая железосвязывающая способность сыворотки обычно снижены в отличие от железодефицитной анемии. Средний эритроцитарный объем составляет 80 — 85 фл, средняя концентрация гемоглобина в эритроцитах 30–32 г/дцл. Насыщение трансферрина более 10%, уровень ферритина сыворотки нормальный, но, являясь белком острой фазы воспаления, может быть повышенным.
Лечение направлено на коррекцию основного заболевания. Симптомы анемии обычно исчезают при эффективном лечении через 1 мес. Применение только препаратов железа неэффективно. В настоящее время исследуется действие эритропоэтина при онкологических и хронических воспалительных заболеваниях.
Сидеробластные анемии — группа заболеваний, характеризующихся нарушением ферментных систем, участвующих в метаболизме железа в клетках эритроидного ряда. Железо поступает в эритробласты, где накапливается в околоядерных митохондриях, нарушается синтез гема. Образуется большое количество сидеробластов — незрелых ядросодержащих клеток костного мозга — предшественниц эритроцитов, в цитоплазме которых выявляются гранулы железа, расположенные диффузно или в виде колец вокруг ядра. Синтез гемоглобина нарушается, снижается среднее содержание гемоглобина в эритроците, появляются популяции гипохромных микроцитов.
Выделяют разные формы сидеробластных анемий:
- Наследственная форма является сцепленной с Х-хромосомной патологией, вызванной аномалией метаболизма пиридоксина (витамина В6) — недостаточностью эритроидной формы аминолевулинатсинтетазы.
- Приобретенная форма может быть вызвана лекарственными средствами (изониазидом, химиотерапевтическими средствами, алкоголем), интоксикацией свинцом, эндокринными или воспалительными заболеваниями.
- Существует также идиопатическая форма (рефрактерная сидеробластная анемия), причина которой неизвестна.
Клиника сидеробластной анемии у детей проявляется тяжелой гемолитической анемией, приводящей к вторичному гиперспленизму, увеличению запасов железа в организме и гемосидерозу. У больных старше 60 лет анемия может быть относительно тяжелой (гемоглобин 80-100 г/л).
При исследовании мазков крови находят диморфную популяцию эритроцитов (нормоцитарную и микроцитарную). При врожденных и идиопатических формах выявляют выраженный анизоцитоз и пойкилоцитоз. Средний эритроцитарный объем обычно нормальный, но может быть незначительно увеличенным. Как правило, наблюдается базофилия эритроцитов. Уровень сывороточного железа, ферритина и содержание трансферрина увеличены. В пунктате костного мозга наблюдается эритроидная гиперплазия. При окраске на железо видны аномальные кольцевидные сидеробласты.
Всем пациентам назначают пробное лечение пиридоксином. Назначают прием внутрь пиридоксина в дозе 50–200 мг/сут или его внутримышечное введение по 100 мг 2 раза в неделю на протяжении 2 мес. Наиболее эффективно использование кофермента пиридоксаль фосфата, так как иногда блокируется возможность трансформации пиридоксина в пиридоксальфосфат. При наследственных формах лечение пиридоксином необходимо периодически повторять. Но витамин В6 эффективен только при наследственной форме.
При приобретенных формах необходимо прекратить прием изониазида, употребление алкоголя и исключить другие интоксикации. Андрогены иногда стимулируют продукцию эритроцитов. Многие больные трансфузионнозависимы. У 10% пациентов с приобретенной идиопатической анемией развивается острый лейкоз.
Для уменьшения гемосидероза органов и снижения концентрации сывороточного железа, ориентируясь на его содержание и присутствие сидеробластов в костном мозге, назначают дефероксамин (внутривенно по 500–1000 мг с перерывами).
источник
Для того чтобы получить представление о патологических отклонениях в обмене веществ, обычно исходят из величины основного обмена.
На величину основного обмена, даже в физиологических условиях, могут оказывать влияние различные факторы. Доказана роль рефлекторных и условно-рефлекторных, а также гормональных влияний на основной обмен. Особенно ярко это проявляется в условиях патологии — при нарушении нейрогормональной регуляции обмена. Так, у психически больных в стадии прогрессивного паралича и старческого слабоумия находили умеренное снижение основного обмена. Более резкие нарушения его наблюдались при поражении вегетативных диэнцефальных центров (диэнцефалический синдром Пэйджа, опухоли, кровоизлияние в мозг).
Особую роль в регуляции основного обмена играет гормон щитовидной железы — тироксин, который является одним из основных регуляторов проницаемости митохондрий, оказывающий влияние на процесс окисления и фосфорилирования и, следовательно, на интенсивность энергетических процессов. Повышение основного обмена на 20% и более является важным диагностическим признаком тиреотоксикоза, а снижение его свидетельствует о гипофункции щитовидной железы.
Определенное влияние на основной обмен оказывают гормоны гипофиза. Соматотропин, например, стимулирует свободное окисление и тем самым повышает теплообразование, чем объясняется усиление энергетических процессов при опухолях гипофиза (например, при эозинофильной аденоме). В то же время гипофункция гипофиза, сопровождаясь уменьшением продукции тиротропина и кортикотропина, приводит к снижению теплопродукции и основного обмена.
Выраженным стимулирующим действием на основной обмен обладает адреналин, причем этот эффект особенно проявляется в условиях холода. Инсулин обладает противоположным влиянием, он ослабляет мышечную дрожь и теплопродукцию, увеличивая сопряжение окисления и фосфорилирования.
У людей, страдающих аддисоновой болезнью (двустороннее повреждение надпочечных желез, обычно туберкулезного происхождения), энергетические процессы угнетаются. Половые гормоны — тестостерон и прогестерон активизируют свободное окисление и способствуют освобождению энергии. При гипофункции половых желез (кастрация, недоразвитие, климакс) интенсивность энергетических процессов снижается, что сопровождается снижением основного обмена и нередко ожирением.
Повышение основного обмена может наблюдаться при усилении сердечной деятельности и дыхания. В начальной стадии развития недостаточности сердца повышение основного обмена составляет 30 — 50%. В патогенезе этого явления участвует гипоксия, которая вызывает компенсаторное усиление работы органов дыхания и кровообращения. Образующаяся при этом молочная кислота частично окисляется с дополнительными затратами кислорода. Гиперкапния тоже возбуждает дыхание и усиливает сердечную деятельность с увеличением основного обмена. Повышение основного обмена при лихорадке объясняется разобщением окисления и фосфорилирования.
При голодании основной обмен снижается в связи с переходом организма на экономное расходование энергии.
ТИПИЧЕСКИЕ НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ. НАРУШЕНИЯ РЕГУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ
Патологическая физиология [Учебник для студентов мед. вузов]Н. Н. Зайко, Ю. В. Быць, А. В. Атаман и др. К.: «Логос», 1996
НАРУШЕНИЯ УГЛЕВОДНОГО ОБМЕНА
Патология углеводного обмена может быть представлена совокупностью нарушений катаболических и анаболических превращений углеводов. Нарушения катаболизма углеводов могут возникать в результате нарушения переваривания и всасывания углеводов в кишках, гликонеогенеза и гликогенолиза в печени и дальнейшего превращения глюкозы в пировиноградную кислоту, катализируемого ферментами гликолиза. Нарушение ферментативного расщепления полисахаридов в кишках встречается сравнительно редко, поскольку амилаза вырабатывается слюнными, кишечными и поджелудочной железами. При ахилии действие амилазы слюны продолжается и в желудке.
В некоторых случаях, особенно при нарушении гормональной регуляции, воспалении слизистой оболочки, отравлениях ядами (монойодацетатом, флоридзином) могут нарушаться процессы всасывания моносахаридов в кишках.
Большинство моносахаридов в клетках кишок фосфорилируется гексокиназой. Нарушение процессов фосфорилирования неблагоприятно сказывается на всасывании углеводов.
Нарушения анаболизма углеводов проявляются нарушениями синтеза и депонирования гликогена в печени. При миастении, гипоксии отмечается нарушение гликогенеза. При охлаждении, перегревании, боли, судорогах, эмоциях может усиливаться гликогенолиз, при сахарном диабете — гликонеогенез.
Существенные нарушения в углеводном обмене возникают при авитаминозах, особенно группы В, поскольку эти витамины являются коферментами многих важных ферментов.
Нарушение нервно-гормональной регуляции является наиболее частой причиной патологии углеводного обмена. Объектами регуляции являются три основных процесса углеводного обмена: отложение углеводов в печени и мышцах в форме гликогена и переход их в жиры, т. е. депонирование в качестве источника энергии; гликогенолиз, гликонеогенез и поступление в кровь глюкозы; расщепление глюкозы с освобождением энергии. Эти процессы тесно связаны между собой. Нарушение этой координации проявляется в виде гипер- или гипогликемии и гликозурии.
Последствия нарушения нервной регуляции углеводного обмена впервые были продемонстрированы Клодом Бернаром (1855), который показал, что укол в дно IV желудочка приводит к гипергликемии. К гипергликемии может приводить раздражение серого бугра гипоталамуса, чечевичного ядра и полосатого тела базальных ядер большого мозга. Кеннон наблюдал, что психическое перенапряжение, эмоции могут повышать содержание глюкозы в крови. Гипергликемия возникает также при болевых ощущениях, во время приступов эпилепсии и т. д.
Имеется и второй путь центрального влияния нервной системы на углеводный обмен, которое распространяется к панкреатическим островкам по парасимпатическим волокнам. Нарушение гормональной регуляции углеводного обмена может возникать не только при нарушении центральных механизмов регуляции деятельности соответствующих эндокринных желез, но и при патологии самих желез или же при нарушении периферических механизмов действия гормонов.
Ведущим фактором в нарушении гормональной регуляции обмена углеводов является изменение соотношения между активностью инсулина и контринсулярных гормонов.
На рис. 14.1 показано влияние инсулина и его антагонистов на процессы, обусловливающие утилизацию глюкозы в тканях и определяющие, в известной мере, уровень гликемии.
Дефицит инсулина и преобладание контринсулярных гормонов сопровождается гипергликемией. Ее происхождение объясняется снижением аллостерического эффекта инсулина, что приводит к снижению клеточной проницаемости для глюкозы, замедлению скорости гексокиназной реакции и образования гексозо-6-фосфата, а следовательно, и дальнейшего метаболизма глюкозы, усилением процессов гликонеогенеза.
Гипергликемия наблюдается также при избыточном содержании глюкагона, адреналина, тиреоидина, гликокортикоидов, самототропина и кортикотропина в крови. Глюкагон усиливает гликогенолиз в печени. Он оказывает гликонеогенетическое, липолитическое и инсулинстимули-рующее действие, принимает участие в патогенезе сахарного диабета. У больных акромегалией с пониженной толерантностью к углеводам наблюдается повышенный уровень глюкагона в крови.
К группе контринсулярных гормонов относятся также гликокортикоиды, которые, индуцируя синтез матричной РНК, ответственной за Образование белков — ферментов гликонеогенеза, способствуют повышению уровня гликемии. В противоположность инсулину гидрокортизон понижает проницаемость клеточных мембран и замедляет скорость гексокиназной реакции. Гликокортикоиды принимают участие в механизме возникновения гипергликемии при сахарном диабете и болезни Иценко—Кушинга.
Кортикотропин действует аналогично гликокортикоидам, так как, стимулируя их выделение, усиливает гликонеогенез и тормозит активность .гексокиназы.
Повышенная продукция гормона аденогипофиза — соматотропина (гормон роста), например при акромегалии, сопровождается пониженной толерантностью к углеводам и гипергликемией. Существует представление о том, что соматотропин вызывает гиперплазию α-клеток панкреатических островков и увеличивает секрецию глюкагона. Наряду с гликокортикоидами соматотропин снижает активность гексокиназы и, следовательно, потребление глюкозы тканями, т. е. является также контринсулярным гормоном. Кроме того, соматотропин стимулирует активность инсулиназы печени. Введение его животным повышает функцию β-клеток панкреатических островков, что может привести к истощению их и возникновению метагипофизарного диабета.
Гормоны щитовидной железы также участвуют в регуляции углеводного обмена. Известно, что гиперфункция щитовидной железы характеризуется понижением устойчивости организма к углеводам. Тироксин стимулирует всасывание глюкозы в кишках, а также усиливает активность фосфорилазы печени.
Гипергликемия может быть алиментарной.
Если активность инсулина преобладает над активностью контрин-сулярных гормонов, то в углеводном обмене усиливаются анаболические процессы и устанавливается гипогликемия. Наиболее выраженная гипогликемия бывает при инсулиноме, избыточном введении инсулина извне.
Гипогликемия наблюдается при опухолях гипоталамуса, гипофункции гипофиза, аддисоновой болезни. Она возможна при углеводном голодании, тяжелой мышечной работе (марафонский бег), поражении клеток печени, гликогенозах.
При снижении уровня глюкозы в крови менее 2,5 ммоль/л возможно развитие гипогликемической комы.
Кома — это патологическое торможение центральной нервной системы, характеризующееся потерей сознания, отсутствием рефлексов и расстройством регуляции жизненно важных функций организма.
В патогенезе гипогликемической комы основное значение имеет снижение утилизации глюкозы клетками головного мозга, для деятельности которых глюкоза является основным энергетическим источником. Коме обычно предшествует появление голода, в связи с возбуждением вентролатеральных ядер гипоталамуса, тахикардия (гиперпродукция адреналина), усиление потоотделения, слабость, раздражительность, а затем могут развиться судороги.
Соотношения между действием различных гормонов на регуляцию глюкозы в крови представлены на рис. 14.2.
О состоянии регуляции углеводного обмена, о способности организма усваивать определенное количество углеводов судят по толерантности к углеводам, которую определяют с помощью глюкозной нагрузки. Скорость снижения уровня глюкозы во многом зависит от функции панкреатических островков. На рис. 14.3 показаны кривые, отражающие нагрузки глюкозой в норме и при пониженной толерантности к углеводам, которые могут быть при сахарном диабете, акромегалии, базедовой болезни, синдроме Иценко—Кушинга. В этих случаях максимум подъема кривой бывает выше 8,5 ммоль/л, а нормализация ее не завершается к концу 3 — 4 ч. Повышенная толерантность к углеводам наблюдается при гиперфункции панкреатических островков, микседеме. Гликемическая кривая в этих случаях характеризуется незначительным максимальным подъемом и резко выраженной гипогликемией ко второму часу наблюдения.
Толерантность к углеводам определяет то максимальное количество глюкозы, которое организм может усвоить без появления гликозурии. У человека это составляет 160 — 180 г глюкозы, принятой натощак. При пониженной толерантности к углеводам гликозурия развивается и от меньшего количества потребленной глюкозы. В общем гликозурия появляется тогда, когда уровень глюкозы в крови превышает почечный порог — 8,8 ммоль/л. При большой концентрации глюкозы в крови ферментативные системы, ответственные за процесс реабсорбции глюкозы в почечных канальцах (гексокиназа, фосфатаза), не обеспечивают фосфорилирование всей глюкозы и часть ее выделяется с мочой.
В некоторых случаях гликозурия появляется и без гипергликемии. Это бывает связано с нарушением процесса фосфорилирования глюкозы в почках, например, при введении флоридзина (гликозида из коры фруктовых деревьев), который ингибирует фосфорилирование. При нарушении ферментативных процессов в почках, лежащих в основе реабсорбции глюкозы, развивается почечный диабет.
источник
Анемия — это такая патология, при которой в крови уменьшается количество эритроцитарных клеток и гемоглобина. В результате этого происходит нарушение газового обмена в организме, что при тяжелом течении может приводить к тканевой гипоксии. Наиболее часто такой патологический процесс развивается не как самостоятельное заболевание, а как осложнение какой-либо основной патологии, например, при инфекциях или опухолях.
Эритроциты представляют собой красные кровяные тельца, которые синтезируются в клетках красного костного мозга. Продолжительность их жизни в среднем составляет сто двадцать дней, после чего они поступают в селезенку, где и утилизируются. Основной функцией эритроцитов является перенос к клеткам и тканям человеческого организма кислорода и обратный транспорт от них углекислого газа. Эта функция осуществляется за счет специфического белка гемоглобина, находящегося в эритроцитарной полости. Именно гемоглобин обеспечивает этим клеточным элементам красную окраску. Гемоглобин способен адсорбировать на себе молекулы кислорода и переносить их к клеткам.
Среди причин, которые вызывают развитие анемии, выделяют три большие группы. В первую очередь, это процессы, которые приводят к острым или хроническим кровопотерям. В качестве примера можно привести кишечное кровотечение, слишком обильные менструации или кровотечения в результате механических повреждений. Вторая группа причин представлена процессами, способствующими слишком быстрому распаду эритроцитов. В большинстве случаев в основе данной патологии лежат какие-либо аутоиммунные нарушения. Еще одной группой являются такие состояния, при которых замедляется синтез эритроцитарных клеток. Как правило, это связано с недостаточным поступлением в организм определенных веществ.
Если подвести итог, то анемия может формироваться в результате следующих причин:
- Генетических дефектов и наследственной предрасположенности;
- Недостаточного поступления в организм необходимых питательных веществ;
- Воздействия на организм травмирующих факторов;
- Хронических болезней желудка, кишечника и других органов;
- Опухолевых процессов в организме;
- Перенесенных инфекционных заболеваний;
- Отравлений некоторыми видами химических веществ;
- Бесконтрольного употребления определенных лекарственных препаратов, например, цитостатиков.
Помимо этого, анемия разделяется по степеням тяжести:
- Легкая степень — сопровождается снижением уровня гемоглобина в пределах девяноста грамм на литр;
- Средняя степень — уровень гемоглобина находит в диапазоне от семидесяти до девяноста грамм на литр;
- Тяжелая степень — устанавливается в том случае, если гемоглобин упал ниже семидесяти грамм на литр.
В12-дефицитная анемия возникает в результате недостаточного уровня витамина В12 в организме. Данный витамин в самом большом количестве содержится в говяжьей и свиной печени, а также в некоторых рыбных продуктах, например, в скумбрии. Кроме этого, его уровень довольно высок в других видах мяса и молочных продуктах. Этот витамин в совокупности с фолиевой кислотой принимает непосредственное участие в образовании эритроцитов.
В12-дефицитная анемия может возникать в результате недостаточно употребления вышеперечисленных продуктов питания, различных заболеваний желудка или кишечника, слишком высокого уровня потребности организма в данном витамине, заболеваний печени или недостаточной выработки специфического белка — гастромукопротеида. Этот белок синтезируется в желудке, связывается с витамином В12 и защищает его негативного влияния кишечной среды.
Клиническая картина В12-дефицитной анемии в первую очередь проявляется повышенной слабостью и быстрой утомляемостью. Появляются частые головные боли и приступы головокружения. Кожные покровы приобретают бледный оттенок и в некоторых случаях возникает желтизна. Больной человек может предъявлять жалобы на снижение аппетита и потерю массы тела, а также нарушения стула и дискомфорт в животе. Такой вид анемии сопровождается высоким уровнем артериального давления, периодической одышкой и ощущением сердцебиения. Нередко присоединяются неврологические симптомы в виде покалываний и онемения, судорог, а также мышечной слабости.
Железодефицитная анемия сопровождается низким уровнем содержания в организме железа. Железо в большом количестве содержится в гемоглобине и является его неотъемлемым компонентом. Данное вещество в наибольшем количестве находится во всех продуктах животного происхождения, например, мясе или рыбе.
Железодефицитная анемия чаще всего развивается в результате несбалансированного питания, например, при вегетарианстве. Кроме этого, она может формироваться вследствие нарушения его всасывания из-за заболеваний желудочно-кишечного тракта, повышенной потребности в железе, а также при острых и хронических кровотечениях.
Симптоматика железодефицитной анемии складывается из анемического и сидеропенического синдромов. При анемическом синдроме появляются повышенная слабость и утомляемость, головные боли и головокружения, периодические одышки и чувство сердцебиения. Сидеропенический синдром проявляется повышенной тусклостью и ломкостью ногтей и волос, сухостью и бледной окраской кожных покровов, а также извращением вкусовых и обонятельных пристрастий.
При недостаточном уровне железа для лечения анемии назначаются железосодержащие препараты, например, Ферроградумет или Сорбифер. Их дозировка подбирается каждому больному индивидуально. В том случае, если в организме существует дефицит витамина В12, больному человеку проводится курс внутримышечных инъекций цианокобаламина. Кроме этого, при обоих видах анемии необходимо скорректировать свой рацион питания.
Для профилактики таких заболеваний следует сбалансировано питаться и своевременно лечить заболевания желудочно-кишечного тракта.
источник
Нарушение обмена веществ (метаболизма) проявляются практически на всех уровнях биологических систем организма – на клеточном, молекулярном и других. Наиболее серьезным считается нарушение обмена веществ на клеточном уровне, так как оно значительно меняет механизмы саморегуляции и имеет наследственную причину.
Обмен веществ – это комплекс химических реакций, полностью соответствующих своему наименованию, ведь метаболизм по-гречески обозначает «превращение». Постоянно действующий метаболизм, по сути, поддерживает жизнь в человеческом организме, позволяя ему развиваться и размножаться, адекватно реагировать на воздействие внешней среды и сохранять все свои функции.
В метаболизме принимают участие жиры, углеводы, белки и другие элементы, каждый из которых играет собственную роль в обмене веществ.
- Незаменимый «строительный материал» — это белки, которые стали знамениты благодаря исторической фраз Энгельса о жизни как форме существования белковых тел. Высказывание одного из отцов марксизма соответствует действительности, там, где есть белковые элементы, там есть жизнь. Белки входят в структуру плазмы крови, гемоглобина, гормонов, цитоплазмы, иммунных клеток, также белки отвечают за водно-солевой баланс и процессы ферментации.
- Углеводы считаются источником энергетических ресурсов организма, среди наиболее важных – гликоген и глюкоза. Также углеводы участвуют в синтезе аминокислот, липидов.
- Жиры аккумулируют энергетические запасы, а отдают энергию только в сочетании с углеводами. Также жиры нужны для выработки гормонов, усвоения некоторых витаминов, они участвуют в строительстве клеточной оболочки, обеспечивают сохранение питательных веществ.
Нарушение обмена веществ – это изменение в одной из стадий метаболизма – в катаболизме или анаболизме. Катаболизм или диссимиляция – процесс окисления или дифференциации сложных элементов до состояния простых органических молекул, которые смогут участвовать в процессе анаболизма (ассимиляции) – синтезирования, который характерен энергозатратностью. Процесс метаболизма происходит всю жизнь согласно следующим этапам:
- Питательные элементы поступают в человеческий организм.
- Питательные вещества всасываются из пищеварительной системы, ферментируются и расщепляются, проникая в кровь и лимфатическую систему.
- Тканевый этап – транспорт, перераспределение, выделение энергии и усвоение веществ.
- Выведение продуктов распада обмена веществ, которые организм не усвоил. Выделение происходит через легкие, с потом, мочой и калом.

Причины нарушения обмена веществ, как правило, относятся к наследственному фактору, хотя они до конца еще не изучены. Основную роль регуляции внутриклеточного метаболизма выполняет генетически передаваемая информация. Если гены начинают мутировать, особенно те, которые кодируют синтезацию ферментов, развиваются дефекты обмена веществ. Также влияют на генные дефекты мутации транспортных и структурных белков, но в меньшей степени.
Также, причины нарушения обмена веществ могут быть связаны с патологическими изменениями в функции щитовидной железы, в работе гипофиза и надпочечников.
Одной из причин может быть неправильный рацион питания человека, а также несоблюдение норм здорового образа жизни. Как переедания, голодания, так и фанатичная преданность новомодным диетам, непроверенным временем и диетологами, могут спровоцировать сбой в метаболизме.

Нарушение обмена веществ у детей и нарушение обмена веществ у взрослых и отличаются порой кардинально. Детский организм развивается интенсивно, поэтому ему требуется гораздо больше энергетических ресурсов и пластических элементов, которые вырабатываются благодаря поступающей в организм пище. Особенно высок показатель метаболизма у детей до одного года, когда формируются основные системные функции ребенка. Далее ребенку требуются значительные энергетические ресурсы на процессы ассимиляции и синтеза, способствующие развитию и росту. Поскольку центральная нервная система, нейрогуморальные механизмы и железы внутренней секреции не стабилизированы, регуляция метаболических процессов у ребенка несовершенна. Поэтому нарушение обмена веществ у детей довольно частое явление, особенно в наше время, когда отсутствует культура рационального питания и соблюдение норм двигательной активности. Следствием нарушения метаболизма у ребенка могут быть такие заболевания:
- Анемия, которая развивается на фоне дефицита белковых компонентов и железа. Именно поэтому пока детский организм растет очень важно следить за питанием и режимом приема пищи ребенком. Даже если родители фанатично преданы идее вегетарианства, для ребенка такой рацион является прямым путем к анемии.
- Рахит, который развивается из-за дефицита фосфора и кальция либо патологических особенностей организма, которые препятствуют усвоению кальция. И кальций, и фосфор играют важнейшую роль в формировании костной и хрящевой системы, особенно в первые месяцы жизни малыша.
- Тетания или спазмофилия, которая развивается из-за сбоя в фосфорно-кальциевом обмене и переизбытка кальция, на фоне ранее диагностированного рахита. Спазмофилия проявляется судорожным синдромом, спазмами.
- Амилоидоз – патологическое заболевание, которое провоцируется нарушением физиологического уровня обмена веществ. Болезнь проявляется в виде поражения мышц почек или сердца, причина – отложение структурно измененных белков в мышечных тканях (амилоидов).
- Гипергликемия, которая является следствием скрытого сахарного диабета.
- Гипогликемия (инсулиновый шок) – пониженный уровень глюкозы (сахара) в крови из-за стресса или по причине заболевания диабетом матери.
Нарушение обмена веществ на каком либо этапе, как у взрослых, так и у детей, провоцирует патологические изменения в функционировании систем организма и является серьезной угрозой для состояния здоровья.

Нарушение обмена веществ симптомы демонстрирует разнообразные, среди которых наиболее характерным является лишний вес, ожирение. Далее в перечне признаков идут отечность и изменение структуры кожных покровов, волос, ногтей. Это самые «видимые» симптомы, которые должны насторожить человека и побудить его к прохождению обследования и лечению.
Также в клинической практике детально описаны заболевания, которые неизбежно сопровождаются признаками нарушения метаболизма.
- Подагра – нарушение регуляции обмена мочевой кислоты, при котором почках и хрящевых тканях скапливаются соли, провоцирующие воспалительный процесс.
- Гиперхолестеринемия — нарушения диссимиляции, катаболизма липопротеинов, когда в крови значительно повышается уровень холестерина, также холестерин накапливается в тканях. Подобный дисбаланс – одна из причин, стремительно развивающихся во всем мире сердечно-сосудистых заболеваний.
- Фенилкетонурия – нарушения обмена веществ наследственной этиологии, когда в организме не хватает специфического фермента – фенилаланингидроксилазы, что приводит к психическим нарушениям (задержка развития).
- Болезнь Гирке – переизбыток гликогена в органах и тканях, что приводит к гепатомегалии (увеличению печени), отставанию в развитии – в росте, гипогликемии.
- Алкаптонурия – нарушение обмена веществ вследствие генной мутации, когда ген, отвечающий за синтез оксидазы, не выполняет свою функцию. Это типично мужское заболевания, поражающее хрящевую ткань (позвоночник, суставы).
- Альбинизм – отсуствие необходимого пигмента – меланина. Болезнь вызывается невозможностью синтезирования тирозина и фенилаланина и имеет наследственную этиологию.
Кроме этих заболеваний, признаки нарушения обмена веществ характерны для многих других патологий, как правило, развивающихся генетической деформации.
Симптомы нарушения обмена веществ могут быть различные. Они зависят от того, какой уровень метаболизма изменяется – молекулярный, клеточный, обмен веществ в тканях и органах или целостный уровень. Любое нарушение химического обменного процесса может спровоцировать заболевание. Причины, вызывающие нарушения метаболизма кроются в дисфункции надпочечников, гипофиза, щитовидной железы, в наследственности, также нарушение обмена веществ может вызвать неправильное питание, чаще всего, голодание. Изменения в обменных процессах проявляются постепенно, поэтому первичные симптомы чаще всего не видны. Наиболее проявленные признаки касаются нарушения целостного уровня, в который включены основные виды ассимиляции и диссимиляции важных компонентов:
- Синтез протеинов (белков).
- Диссимиляция (распад) протеинов.
- Синтез жиров.
- Диссимиляция жиров.
- Синтез углеводов.
- Диссимиляция углеводов.

Нарушение обмена веществ симптомы основные:
- Заметное изменение веса тела – как в меньшую, так и в большую сторону, при сохранении привычного режима питания.
- Отсутствие аппетита либо наоборот – повышенный аппетит.
- Появление гипер или гипопигментации.
- Стоматологические проблемы, в основном, разрушение зубной эмали.
- Нарушение работы пищеварительной системы-диареи чередуются с запорами.
- Изменение структуры ногтей и волос – сухость, слоистость, ломкость (волосы – ранняя седина, ногти – белые пятна).
- Дерматологические проблемы – акне, кожные высыпания, реже – фурункулез.
- Бледность кожных покровов, одутловатость лица и отечность конечностей (пастозность).
Болезни, вызванные нарушением обмена веществ, могут быть наследственными или приобретенными.

Гиперхолестеринемия – нарушение распада липопротеинов, в следствии чего развивается атеросклероз. Признаки и заболевания:
- онемение конечностей (они часто мерзнут);
- цианоз (синюшность) кожных покровов;
- кардиологические патологии;
- нарушение концентрации внимания, памяти;
- гипертония;
- нефропатологии, диабет.
Болезнь Гирке – врожденная патология, связанная с нарушением ферментативной функции печени, при которой проявляются такие симптомы:
- гепатомегалия (увеличение печени);
- субфебрильная температура;
- одышка;
- задержка роста;
- отклонение от норм физического развития;
- гипогликемия.
Подагра – изменение обмена мочевой кислоты, отложение солей в хрящевых тканях, в почках, сопровождающееся следующими признаками:
- боли в больших пальцах ног;
- воспаление суставов стоп;
- отеки и покраснение суставов стоп;
- повышенная температура тела;
- образование тофусов (подкожных узлов) в локтевых суставах, в ушных раковинах и в области пяточных сухожилий.
Фенилкетонурия – генетическое нарушение обмена веществ, симптомы которого проявляются в возрасте до года и касаются центральной нервной системы и психического развития. В результате изменения обмена аминокислот проявляются такие признаки:
- вялость, апатия, несвойственная младенцам;
- вялость резко сменяется на раздражительность;
- отставание в физическом и психическом развитии (слабая степень олигофрении или идиотия);
- отставание в анатомическом развитии – небольшой размер черепа, позднее прорезывание зубов, недоразвитость костно-мышечной системы;
- типичные симптомы – качающаяся походка, мелкие шаги, в положении сидя – «поза портного» из-за гипертонуса;
- довольно частые случаи альбинизма (отсутсвие меланина);
- акроцианоз (синюшность) конечностей;
- гипотония;
- дерматит.
Алкаптонурия – генетическое заболевание, когда активность гомогентизиназы (фермента) снижена и расщепление аминокислот – тирозина и фенилалалина нарушается. Симптомы:
- темный цвет мочи с самого рождения;
- явно выраженная кожная гиперпигментация;
- общая слабость;
- артриты и оститы;
- остеопороз;
- охриплость голоса.
Нарушение обмена веществ, симптомы которого можно отнести к заболеваниям, вызванным внешними факторами и дисфункциями гипофиза, надпочечников, щитовидной железы. Как правило, дефицит или переизбыток аминокислот, минералов или витаминов вызывает следующие проблемы:

Калий несет ответственность за работу мышечной системы, участвует в передаче нервных сигналов (импульсов), контролирует кислотно-щелочной баланс, активизирует процессы ферментации. Нарушение нормального уровня калия провоцирует следующие симптомы:
- Со стороны нервной системы – раздражительность, снижение концентрации внимания и памяти, снижение всех рефлексов.
- Со стороны сердечно-сосудистой системы – гипотония, головокружение, аритмия (низкий уровень калия) или тахикардия (переизбыток калия).
- Со стороны пищеварительного тракта – отсутсвие аппетита, тошнота, вплоть до рвоты, расстройство стула, метеоризм, угнетение перистальтики кишечника, спазмы в животе.
- Со стороны мышечной системы – судороги (икры ног), снижение физической активности, слабость, вплоть до слабого паралича.
- Со стороны мочевыводящей системы – нарушенное мочеиспускание (частые позывы, обильное или пониженное мочеиспускание).
- Со стороны кислотно-щелочного баланса – явные проявления ацидоза ( увеличение кислотности).

Изменение нормы кальция в организме влияет на клеточные функции, на формирование костной ткани, включая зубную, кальций участвует в процессах свертываемости крови, в транспорте нервных импульсов и в работе мышц. Гиперкальциемия или гипокальциемия проявляется такими симптомами:
- Со стороны нервной системы – тики, подергивание мышц рта, спазмы в горле, невротического характера, раздражительность, тревожность, сонливость, апатия. Реже – головные боли.
- Со стороны скелетно-мышечного аппарата – онемение пальцев, судороги в икрах ног, мышечная атония, тики, хрупкость костной и зубной ткани.
- Со стороны сердечно-сосудистой системы – нарушение нормального сердечного ритма (тахикардия, аритмия), симптоматика блокады сердца, гипотония или гипертония.
- Со стороны пищеварения – тошнота до рвоты, постоянная жажда и обезвоживание, запоры.

Магний – это важный микроэлемент, внутриклеточный катион, благодаря которому работает нервная система, а также мышечный аппарат. Также магний участвует в работе всех ферментов, помогает функционированию паращитовидных желез. Дисбаланс магния проявляется такими признаками:
- Со стороны мышц – судороги, как ночные, так и дневные, мышечная атония, снижение рефлексов, вялость, вплоть до псевдопаралича, спазм дыхательных мышц, миалгии.
- Со стороны нервной системы – сонливость, вялость, апатия, снижение когнитивных функций, в случае переизбытка магния – бредовые состояния, галлюцинации.
- Со стороны сердечно-сосудистой системы – аритмия или тахикардия, сниженное артериальное давление, характеризующееся резкими скачками вверх, брадикардия, признаки блокады сердца, вплоть до остановки.

Натрий отвечает за регулирование артериального давления, контролирует кислотно-щелочной баланс, участвует в работе нервной, эндокринной, мышечной системы, транспортирует глюкозу в клетки тканей, участвует в работе почек и транспортировки аминокислот. Нарушение нормального уровня натрия проявляется следующими признаками:
- Со стороны дыхательной системы — цианоз (синюшность кожи), сильная одышка, вплоть до остановки дыхания.
- Со стороны желудочно-кишечного тракта — постоянная тошнота, рвота, спазмы, колики в абдоминальной области живота. Сильная жажда, сухой и шершавый язык.
- Со стороны сердечно-сосудистой системы — гипотония, гипотонические кризы, сосудистый коллапс (нитевидный пульс).
- Внешние проявления переизбытка натрия – отечность, пастозность кожных покровов, избыточный вес.
- Со стороны нервной системы — головные боли, тики, судороги. Тревожное и возбудимое состояние.
- Со стороны кожных покровов – потливость, снижение тургора кожи, частичная гиперемия (покраснение), сухие участки кожи.
- Со стороны мочевыводящей системы – пониженное мочеиспускание, маленькими порциями, частые позывы.
Кроме микроэлементов нарушение обмена веществ, симптомы которого разнообразны, может обозначать недостаток или переизбыток витаминов в организме. Перечислим основные витамины, которые, как правило, играют ведущие роли в функционировании органов и систем. Дисбаланс витаминов может проявляться следующими симптомами:

- Ночная «слепота».
- Сухость глаз.
- Сухость кожных покровов.
- Уплотнение слизистых оболочек глаз, оболочек мочеполовой сферы, слизистой рта.
- Отставание в росте у детей до года.
- Дефицит ниацина – утомляемость, диарея, слабоумие (деменция), дерматит. В медицине этот синдром называется синдромом трех Д.
- Недостаток тиамина (В1) – раздражительность, отечность ног, бледность кожных покровов, боли в животе, запоры, судороги, затруднения с дыханием, нервное истощение. Острый дефицит В1 может вызвать сердечную недостаточность.
- Дефицит рибофлавина (витамина В2) – трещинки в углах рта, потрескавшиеся губы, кожный зуд, воспаленные глаза («песок» в глазах), может развиться анемия.
- Недостаток витамина В6 (пиридоксина) – онемение конечностей, мышечная атония, судороги, плохое состояние ногтей и волос (выпадение), дерматиты.
- Дефицит витамина В12 (цианокоболамина) – анемия в злокачественной форме, снижение веса, запоры и поносы, мышечная атония, опухший и потрескавшийся язык, деменция, психические заболевания.
- Цинга (нарушение коллагеновых связей и в результате – повышенная кровоточивость, атония и атрофия мышц, разрушение структуры костей).
- Слабость и утомляемость.
- Раздражительность, нервозность, депрессия.
- Отечность околосуставных тканей.
- Увеличение суставов за счет отложения солей.
- Снижение иммунной защиты, частые инфекционные и воспалительные заболевания.
- Утрата аппетита, потеря веса.
- Плохое заживление ран.
- Хрупкость капилляров, синяки.
Симптомы нарушения обмена веществ множественные, часто они проявляются лишь на поздних стадиях развития заболевания. Именно поэтому так важно соблюдать правила разумного, рационального питания и регулярно проводить курсовую витаминотерапию.
Нарушение обмена веществ симптомы может иметь самые разнообразные, часто схожие с признаками более изученных заболеваний. Если неправильно диагностируемая болезнь не курируется стандартными схемами лечения, следует внимательно изучить состояние всех уровней метаболизма, обратиться к эндокринологу.

Нарушение метаболизма у взрослых и нарушение обмена веществ у детей предполагает, прежде всего, соблюдение определенного образа жизни. Взрослым людям стоит обратить внимание на давно известный медикам лечебный рацион, называемый — стол №8 по Певзнеру. Эта диета при нарушении обмена веществ была создана еще в 30-е годы прошлого века выдающимся ученым Певзнером, основоположником гастроэнтерологии и диетологии. Всего у Певзнера 15 диет, предназначенных для курирования различных групп заболеваний. Питание при ожирении и лишнем весе вполне подходит практически для всех тех, у кого нарушен метаболизм. Принцип рациона основан не на потере килограммов, а на восстановлении функций органов и систем. Главный признак того, что питание при нарушении обмена веществ начала действовать, это постоянное ощущение легкого голода. Калорийность рациона очень щадящая в сравнении с другими «скоростными» диетами – 2000 калорий ежедневно, вес действительно нормализуется медленно, постепенно, но надолго.
Питание по Певзнеру – стол №8 включает в себя следующие ограничения:
- Хлеб только из муки грубого помола, не более 150 граммов в сутки.
- Ежедневно по 250 мл овощного супа без мяса, на постном бульоне. Дважды в неделю по установленным дням, например понедельник – четверг, допускается суп на легком мясном бульоне с фрикадельками или кусочком мяса.
- Ежедневно в меню должны быть овощи, лучше свежие – не менее 200 граммов. Исключается картофель, морковь, свекла.
- Ограничение касается соленой, маринованной и острой пищи.
- Хлеб заменяется макаронными изделиями, то есть нужно выбрать два дня в неделю, когда вместо хлеба в рацион включены макароны – не более 150 граммов в сутки.
- Обязателен прием мясных продуктов (исключить колбасные изделия). Мясо нужно в качестве источника белка, не менее 150 граммов, также ежедневно нужно есть рыбу – 100-150 граммов.
- Яйца – не более 1 штуки в день – отварные или омлет
- Масло только растительное, сливочное масло, маргарин следует исключить.
- Молочные продукты выбирают с минимальной жирностью.
- Исключаются бананы, виноград.
- Чай или кофе лучше пить без сахара.
- Полностью исключается сдоба, сладкое печение, торты.
- Ежедневно нужно выпивать не менее 1, 5 литра воды (жидкости).
Питание при нарушении обмена веществ предполагает строгое ограничение либо полное исключение сала, животных жиров, риса, манной крупы, жирного мяса, колбас, картофеля, бобовых, сметаны и майонеза, алкогольных напитков.

Нарушение обмена веществ лечение предполагает комплексное и только под контролем врача. Средства, которые могут отрегулировать обмен веществ, можно разделить на следующие категории:
- Гормоны – препараты на основе биологически активных веществ, которые способствуют нормализации метаболизма, координации всех обменных процессов. Назначение гормональных препаратов должен делать только врач.
- Витаминный комплекс – низкомолекулярные, активные соединения, которые участвуют во всех жизненно-важных процессах – в ферментации, регуляции, выработке необходимых веществ, накоплении энергии, развитии тканей и костной системы. Витамины следует употреблять регулярно, грамотно подбирая их сочетание и дозировку, так как не только дефицит витаминов может спровоцировать нарушение обмена веществ, но и их переизбыток.
- Ферменты – протеолиты (трипсин) фибриногены (стрептокиназа, фибринолизин), деполимеризующие вещества (ДНК, РНК), средства, нейтрализующие вязкую консистенцию гиалуроновой кислоты (ранидаза, лидаза).
- Препараты, регулирующие гемостаз – антитромбические средства, стимуляторы эритропоэза, препараты, стабилизирующие уровень железа в крови, гемостатики.
- Аминокислоты, некоторые из которых стали самостоятельным лекарственным средством (глицин, метионин). Аминокислоты компенсируют нехватку этих веществ в организме, обеспечивая восстановление нейронной проводимости, гипотоламно-гипофизарной деятельности, улучшая состояние энергетических ресурсов и многие другие процессы.
- Биостимуляторы – улучшают состояние нервной системы, устраняют явление гипоксии, активизируют защитные свойства организма. Биогенные препараты ускоряют процесс восстановления регуляции метаболических процессов, обладают репаративными свойствами.
Кроме приема препаратов, выписанных врачом, тем, у кого нарушение обмена веществ, действительно превратилось в проблему, стоит задуматься о своем рационе.

источник
Существует аутосомно-рецессивное заболевание гемохроматоз , связанное с нарушением гепсидиновой регуляции и избыточностью всасывания железа в кишечнике. В результате железо накапливается в органах и тканях: печени, поджелудочной железе, миокарде, селезёнке, коже, эндокринных железах и др. Общее содержание железа в организме достигает 20-60 г при норме 2-4 г. Постепенно развиваются цирроз печени, кардиомиопатии, сахарный диабет 1 типа, артрит.
Приобретенный избыток железа возникает при гемолитических анемиях и избыточной задержке железа в макрофагах, нарушении мобилизации железа из депо, при избыточной парентеральной терапии железодефицитных состояний. Накапливающийся ферритин преобразуется в гемосидерин , в результате резко снижается использование железа. Такое состояние называется гемосидероз .
К образованию гемосидерина приводит перенасыщение ферритина железом, деградация его белковой части и полимеризация молекул. Провоцирующим повреждение фактором является способность железа инициировать образование активных кислородных радикалов.
Избыточное потребление препаратов железа per os не приводит к интоксикации, так как возможности транспорта металла из кишечника ограничены саморегуляцией энтероцитов и свойствами транспортных систем. Избыток железа задерживается в эпителии кишечника и выводится со слущивающимися клетками.
При недостаточности железа в организме (железодефицит) мобилизация резервов происходит в следующем порядке:
- Сначала используется железо из депо (ферритин),
- Затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
- Далее истощаются запасы сывороточного железа (холотрансферрин),
- В последнюю очередь страдает синтез гемоглобина.
Причинами нехватки железа являются
- недостаток его в пище (несбалансированное вегетарианство),
- заболевания ЖКТ со снижением всасывания (гипоацидные гастриты и энтериты),
- потери железа с кровью при менструальных, кишечных или иных кровотечениях,
- у новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии,
- в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
- ухудшение внимания и памяти у детей и взрослых,
- иногда детская гиперактивность,
- уплощение, волнистость и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
- выпадающий и секущийся волос,
- поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
- неинфекционный ларингофаринготрахеит (гиперемия, покраснение и охриплость), что дезориентирует врача,
- мышечная слабость:
– общая утомляемость,
– недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение капель мочи при резком кашле, смехе, чихании,
– недостаточное сокращение сфинктеров пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу.
- атрофический м анацидный гастрит – может быть как причиной, так и следствием железодефицита, половина больных гастритом имеет недостаток железа,
- обострение ишемической болезни сердца и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов дыхательной цепи в миокардиоцитах),
- извращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
- извращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
источник
Железодефицитная анемия (малокровие) обычно рассматривают скорее в качестве симптома другого заболевания или в виде состояния, возникающего при недостаточной концентрации в организме железа.
Причины и факторы, способствующие развитию анемического синдрома:
- Развивается болезнь у маленьких детей и взрослых, соблюдающих строгую диету, если они не получают необходимого количества железа с едой.
- На фоне нарушений в пищеварительной системе. Известно, что всасывание микроэлементов происходит в тонкой кишке (верхние отделы) и в желудке. А тем более, после удаления части желудка, способность пищеварительной системы к абсорбции нарушается.
- Анемический синдром может развиться из-за больших потерь крови. Это является основной причиной железодефицитных состояний. Часто синдром возникает у женщин из-за больших потерь крови во время обильной менструации и у тех, кто страдает от язвы пищеварительного тракта, рака желудка, геморроя, новообразований в толстой кишке.
- Сокращение времени жизни эритроцитов в крови или быстрое их разрушение. В норме срок жизни эритроцита – 4 месяца. В некоторых случаях причиной гемолиза является патология селезенки. Развивается гемолитическая или серповидно-клеточная анемия. При таком заболевании организмом вырабатывается аномальный гемоглобин.
При подозрении на анемию, важно оперативно обратится за помощью к специалисту. Врач поможет выявить причины и способы лечения болезни. Синдром приводит к снижению иммунитета, к упадку сил, ограничению работоспособности. Также анемия может стать важным сигналом о развитии других патологий и серьезных проблем в работе отдельных органов и их систем.
Диагноз ставят по анализу крови, а лечение, как правило, заключается в восстановлении количества железа с помощью лек. препаратов. Лекарства используют внутрь или вводят с помощью инъекций.
| Пол, возраст | Порог Нb (Г/Л) | Порог Нb (Г/%) |
| Дети от 3 месяцев до 5 лет | 110 | 11,0 |
| Дети от 5 до 12 лет | 115 | 11,5 |
| Дети от 12 до 15 лет | 120 | 12,0 |
| Мужчины от 15 лет | 130 — 160 | 13,0 — 16,0 |
| Женщины от 15 лет | 120 — 140 | 12,0 — 14,0 |
| Беременные женщины | 110 | 11,0 |
Можно выделить 3 основных механизма развития анемии:
- Вследствие нарушения процесса образования эритроцитов и образования гемоглобина. Такого рода механизм можно проследить при недостаточном поступлении железа, фолиевой кислоты и витамина В12, при заболеваниях костного мозга. Иногда дефицитное состояние может возникнуть из-за приема сверхбольших доз витамина С. При приеме сверх доз аскорбиновой к-ты происходит блокировка витамина В12 и нарушение процессов кроветворения.
- Острая потеря эритроцитов. Обычно – это последствия острых кровотечений, операций и травм. При хронических кровотечениях в небольших объемах причиной анемии выступает не просто потеря эритроцитов, но и недостаток железа на фоне хронической утраты крови.
- Анемический синдром — последствия от ускоренного разрушения эритроцитов крови. При нормальной работе костного мозга и иных органов кроветворения эритроциты живут порядка 4 месяцев, а затем разрушаются. При гемолитической анемии, гемоглобинопатии и так далее скорость разрушения эритроцитов выше, чем их производства. Иногда процесс протекает под влиянием внешних стимулов, химических веществ (уксус).
Рассмотрим различные виды у взрослых. Анемия является симптомом, а не отдельным заболеванием и может возникать при ряде болезней. Они, как правило, связаны с первичным поражением кроветворной системы или не зависят от нее. Невозможно провести четкую нозологическую классификацию анемий. Для этого используют принцип практической целесообразности. И в результате заболевание делят по единому классификационному признаку – по цветовому показателю.
Падение уровня гемоглобина в крови чаще всего наблюдают при одновременном снижении количества и качества эритроцитов. Любой вид анемии непременно приводит к снижению эффективности дыхательной функции крови, возникновению кислородного голодания тканей. Обычно это видно по бледности кожных покровов, слабости, высокой утомляемости, головным болям, головокружении, одышке, учащенному ритму сердца и т.д.
Врач назначает рутинное исследование мазка крови, в процессе анализа морфолог обязан указать на отклонения размера эритроцитов. Уменьшение может быть, как в меньшую (микроцитарная анемия), так и большую сторону (макроцитарная). Однако, если необходимую оценку производят без специальных микрометров, то она является весьма субъективной.
Анемии, которые могут развиться при болезнях почек, гипопластические, АХЗ и острую постгеморрагическую относят к нормоцитарным. Макроцитарные анемии бывают нормо- и гиперхромными, а микроцитарные – гипохромными.
Намного информативнее автоматический анализ крови, при котором соблюдается четкая стандартизация важных показателей. Учитывают средний корпускулярный объем (СКО), который можно измерить в фемтолитрах (fl, фл). Нормальное значение СКО составляет 80-90 фл и называется нормоцитозом. Если показатель повышен до 95 и более – то фиксируют развитие макроцитоза. При снижении менее 80 фл ставят диагноз микроцитоз. Есть у автоматического метода и свои недостатки: достаточно дорогое и чуткое оборудование, которому необходимо соответствующее обслуживание.
При замене цветового показателя на СКО не нарушается привычная классификация анемий по цветовому показателю. Анемии подразделяют на группы по различным признакам. Классификацию, как правило, основывают на удобстве и практической значимости для постановки диагноза.
Цветовой показатель покажет степень насыщения эритроцита гемоглобином. У здорового человека ЦП колеблется 0,86 до 1,1. В зависимости от него различают такие анемии:
- Гипохромная анемия, если ЦП меньше 0,86 (по некоторым классификациям ниже 0,8). При таких анализах ставят диагноз талассемия или железодефицитная анемия.
- При нормохромной анемии ЦП колеблется в пределах 0,86 — 1,1. В таком случае у пациента наблюдается постгеморрагическая анемии, гемолитические анемии, апластические анемии, неопластические заболевания костного мозга, внекостномозговые опухоли, анемия из-за снижения темпов выработки и количества эритропоэтина.
- Гиперхромная анемия – при ЦП более 1,1. Такие показатели характерны для фолиеводефицитной анемии, а также витамин B12-дефицитной анемии, для миелодиспластического синдрома.
Проводится в зависимости от выраженности снижения уровня гемоглобина в крови. Классификация по степени тяжести предполагает:
- легкую степень (когда уровень гемоглобина ниже нормы, но остается на уровне более 90 грамм на литр);
- среднюю степень тяжести (когда гемоглобин 70-90 г/л);
- тяжелую степень (когда уровень гемоглобина остается меньше 70 грамм на литр).
Разделение степени анемии по уровню гемоглобина достаточно распространено. Чаще всего именно по гемоглобину подтверждают диагноз, а потом уже проводят более детальную диагностику.
Характеризуется незначительным падением количества гемоглобина в крови. Обычно проявляются следующие симптомы:
- усталость;
- апатия;
- общее недомогание;
- часто развивается у беременных.
Как уже упоминалось выше, анемия 1 степени фиксируется, если уровень микроэлементов в крови ниже нормы, но выше 90 г на л.
Также первая степень заболевания часто поражает маленьких детей, появившихся на свет при многоплодной беременности или недоношенными. У детей постарше – это паразитические заболевания или погрешности в питании. Анемия легкой степени тяжести проще поддается лечению. Обычно рекомендуют соблюдать диету и усиленно питаться. При легкой степени анемии в рацион необходимо включать различные микроэлементы и витамины, в первую очередь – железо и витамин В12.
Анемия 2 степени или средней степени тяжести возникает не только при снижении уровня гемоглобина до 70 г/л. Возникает головокружение и головные боли, одышка, частое сердцебиение, трудности с дыханием. Дети часто болеют, у них наблюдается бледность губ и кожи. При 2 степени анемии может возникнуть кислородное голодание плода, снижается сократительная способность миокарда. Лечение медикаментозное + диета, следует больше находится и гулять по свежему воздуху.
На этой стадии острая анемия несет опасность для жизни человека. При 3 степени наблюдается ломкость ногтей и волос, острое снижение защитных сил организма, онемение конечностей, проблемы с сердцем и сосудами. Ребенок начинает часто болеть.
Особенно тяжелыми будут последствия такого симптома у беременных женщин. Это может негативно отразится на плоде, у матери развиться дистрофические изменения матки и плаценты. Анемия 3 степени лечится в стационаре, с переливанием эритроцитарной массы и другими видами медикаментозного лечения.
Основным признаком такого разделения принято считать количество молодых эритроцитов (ретикулоциты) в периферической картине крови. В норме показатель колеблется от 0,5 до 2%.
- Арегенераторную анемию (например, апластическая анемия) — ретикулоциты отсутствуют.
- Гипорегенераторная (витамин B12-дефицитная анемия или железодефицитная анемия) – ретикулоциты ниже 0,5%.
- Регенераторная или норморегенераторная (постгеморрагическая) — ретикулоциты 0,5 — 2%.
- Гиперрегенераторная (гемолитические анемии) — количество ретикулоцитов больше 2%.
Такая классификация основывается на различных механизмах развития анемии, как патологического процесса.
- Ассоциированные с дефицитом Fe — железодефицитные анемии.
- Гемолитические анемии — связанные с повышенным разрушением эритроцитов.
- Гис-гемолитические анемии — при нарушении кровообразования, протекающего в красном костном мозге.
- Постгеморрагические анемии — при острой или хронической кровопотере.
- В12- и фолиеводефицитные анемии.
Мегалобластные анемии: миокардит гемолитический и пернициозная анемия.
Гипохромия — это общее название для разных форм анемии, при которых цветовой показатель крови, вследствие недостатка гемоглобина, меньше 0,8. Не включена в список нозологических единиц. В анализе крови средний показатель для гемоглобина при таком состоянии меньше 30 пикограмм, а средняя концентрация гемоглобина в эритроците составляет менее 330 г на литр. Меняется не только цвет, но и диаметр (макро- или микроцитоз) и форма. Чаще всего при такого рода патологии красной крови кровяные тельца приобретают вид колец с бледно-красной серединой и темно-красными краями (обесцвечиваются).
Патологические формы эритроцитов могут возникать вследствие:
- Железодефицитной анемии при кровопотерях (геморрагическая), нарушении усвоения железа, при невынашивании плода и т.д.
- Хронического отравления свинцом.
- Талассемии – нарушения нормального процесса синтеза полипептидных цепей в структуре гемоглобина.
- Нарушения синтеза и утилизации порфиринов.
- Гиповитаминоза В6.
- При нарушении обмена вещества, хронических воспалительных процессах неинфекционного и инфекционного генезиса.
Дизэритропоэтическая анемия – целая группа достаточно редко встречающихся заболеваний крови, которые возникают из-за нарушения процессов эритропоэза. При этом, большая часть молодых эритроцитов погибает сразу после образования в костном мозге, а количество нормоцитов значительно снижается. Такого рода расстройство предполагает качественный, количественный, кинетический или совмещенный характер нарушения эритропоэза.
Следует упомянуть такую разновидность заболевания — гиперхромная макроцитарная анемия или малокровие. При котором также наблюдают снижение числа эритроцитов и уровня гемоглобина в единичном объеме крови. Как правило, при такого рода нарушениях параллельно дают сбой сердце и сосуды.
По коду МКБ-10 — D62 острая постгеморрагическая анемия. Такой симптом возникает после кровопотери. Подразделяют на острую постгеморрагическую анемию и хроническую постгеморрагическую анемию. Острая анемия развивается после острых и обильных кровотечений, хронические анемии возникают после длительных несильных кровотечений.
Во время быстрой кровопотери значительно снижается объем циркулирующей крови. В ответ на такое событие происходит компенсаторная реакция, которая заключается в возбуждении симпатического отдела нервной системы и рефлекторного спазма сосудов. Пульс ускоряется и ослабевает. Сосуды кожи и мышц максимально сужаются, кровь приливает к сосудам мозга, коронарным сосудам, что поддерживает снабжение кровью жизненно важных органов. При прогрессировании процесса начинает развиваться постгеморрагический шок.
Характерным клиническим симптомом постгеморрагической анемии является острая сосудистая недостаточность из-за гиповолемии (опустошение сосудистого русла). Внешне это проявляется ортостатическим коллапсом, одышкой, учащенным сердцебиением. В первые минуты кровопотери уровень гемоглобина может даже быть высоким, но после поступления тканевой жидкости в русло сосудов данный показатель снижается, даже если кровотечение уже прекратилось. Цветовой показатель остается в норме, одновременно происходит утрата эритроцитов и железа, нормохромная анемия. Ко вторым суткам увеличивается число ретикулоцитов, максимальных показателей достигает на 4-7 день (гиперрегенераторная анемия).
Диагноз ставят на основании клинических признаков и лабораторных показателей, повышения уровня остаточного азота, если кровотечение происходила в верхних отделах ЖКТ. Самое важное при такой нормохромной анемии – это устранить саму кровопотерю, восполнить устраненный объем крови эритроцитарной массой и гепарином (до 60% утраченной крови), кровезаменителями (5% р-р Альбумина, Раствор Рингера, Реополиглюкин).
При постановке диагноза постгеморрагическая анемия необходимо учитывать сведения о произошедшей острой кровопотере при наличии внешнего кровотечения. После массивного внутреннего диагноз основывают на клинических признаках и, в обязательном порядке, лабораторных пробах (Вебера, Грегерсена). Основанием для постановки диагноза также послужит рост уровня остаточного азота при кровотечении из верхнего отдела пищеварительного тракта.
После того, как кризис и острый период миновали, пациенту назначают препараты железа, витамины группы В, Е и С. Такая терапия производится в течение 6 месяцев. При утрате более 50% от объема циркулирующей крови — прогноз неблагоприятный.
Состояние может развиться в результате снижения поступления в организм фолиевой кислоты или нарушения процессов ее всасывания в пищеварительном тракте. Лечение заключается в дополнительном приеме недостающего вещества.
В отличии от патологии, ассоциированной с недостатком В12, фолиеводефицитная анемия диагностируется значительно реже.
Одной из основных причин фолиеводефицитной анемии является недостаточное содержание фолиевой к-ты в рационе. Следует помнить, что нужно включать в свое ежедневное меню больше зелени и печени. Также на здоровье значительно влияет алкогольная интоксикация, беременность, злокачественные новообразования, некоторые дерматиты, гемолиз.
Такого вида заболевания возникает при нарушении всасывания (например, при целиакии), под действием лекарственных средств, Метотрексата, Триамтерена, противосудорожных средств, барбитуратов, Метформина и др. Значительно повышается нужна организма в фолиевой кислоте после гемодиализа и при болезнях печени.
Также на здоровье оказывает влияние дефицит цианокобаламина и его кофермента – метилкобаламина. В таких условиях не происходит трансформации фолиевой кислоты в коферментную форму. В результате нарушается процесс нормального клеточного деления, начинают страдать клетки кроветворной ткани, которые ранее активно размножались. Тормозятся процессы созревания и размножения эритроцитов, сокращается их продолжительность жизни. Изменения касаются и лейкоцитов, возникает лейкопения и тромбоцитопения.
Далее в результате неправильного митоза появляются гигантские клетки эпителия пищевого канала и развиваются воспалительные процессы в слизистой оболочке, стоматиты, гастриты, эзофагиты, энтерит. Еще больше усугубляется первичное нарушения секреции и процесс всасывания внутреннего фактора, усиливается дефицит витаминов. Возникает порочный круг.
Из-за возникшего недостатка цианокобаламина, в организме начинают накапливаться продукты обмена, которые токсичны для нервных клеток. В волокнах тем временам начинают синтезироваться жирные кислоты уже с искаженной структурой. Наблюдается плавное изменение качества клеток спинного мозга и поражаются периферические и черепные нервные сплетения, развивается неврологическая симптоматика.
При таком виде анемии, как правило симптомы у пациента наблюдаются стандартные: высокая утомляемость, учащенное сердцебиение, бледность ногтей и губ, ярко-красный язык. На начальных стадиях отследить признаки поражения НС и ЖКТ практически невозможно. По результатам обследования выявляется гиперхромная макроцитарная анемия, лейкопения, тромбоцитопения. А лечение с помощью витамина В12 не вызывает улучшений лабораторных показателей. Диагноз можно подтвердить с помощью определения уровня сывороточной фолиевой к-ты и в эритроцитах. В норме ее содержание составляет от 100 до 450 нг/л. При фолиеводефицитной анемии концентрация фолиевой кислоты в эритроцитах значительно снижается.
Если проводят анализ периферической картины крови, то отмечают гиперхромную (макроцитарную) анемию при общем снижении уровня гемоглобина и эритроцитов. Непрямой билирубин меняется редко.
В качестве профилактики и для лечения фолиеводефицитной анемии должны назначить фолиевую кислоту в дозе 1 мг/сут, внутрь. Если есть необходимость врач может увеличить дозу. Улучшения должны наступать через в течение 3-4 суток, в том числе проходить должны и неврологические симптомы. В противном случае приходится говорить о недостатке именно витамина В12, а не фолиевой к-ты.
Обязательно проводить профилактику недостатка фолиевой к-ты у беременных женщин и пациентов, принимающих некоторые группы лек. препаратов. Для профилактики назначают 5 мг вещества в сутки.
Относится к виду витаминодефицитных (мегалобластных) анемий, которые возникают при недостаточном поступлении в организм витамина В12 (цианокобаламина). В результате В12-дефицитной анемии поражается кроветворная функция, нервная и пищеварительная система. В отличие от фолиеводефицитной В12-анемии, она развивается в преклонном или старческом возрасте, чаще всего у мужской половины. Проявляется заболевание постепенно.
Человек, страдающий В12-дефицитной анемией, будет испытывать общие симптомы: слабость, пониженная работоспособность, одышка, головокружение, жжение за грудиной, боли в ногах и языке, парестезии, шаткость походки. Такие симптомы будут сочетаться с желтушным цветом кожи, глосситом, незначительным увеличением печени и селезенки, негромким систолическим шумом, глухостью тонов сердца. Нередко поражается и нервная система, развивается комбинированный склероз или фуникулярный миелоз, нарушается чувствительность, полиневрит, атрофия мышц, паралич нижних конечностей.
Развивается анемия из-за недостатка витамина В12, из-за несбалансированности питания, голодания, алкоголизма и отсутствия аппетита. Также синдром может наблюдаться на фоне мальабсорбции, целиакии, изменений в слизистой оболочке кишечника, спру, лимфомы кишечника, болезни Крона, регионарного илеита, из-за длительного приема противосудорожных препаратов.
Вероятность развития В12-дефицитной анемии будет выше при беременности, гемолитической анемии, псориазе, эксфолиативном дерматите. При приеме алкоголя, препаратов–антагонистов фолатов, врождённых нарушениях метаболизма и атрофическом гастрите также может наблюдаться это заболевание.
Как правило, поставить диагноз В12-дефицитная анемия можно без особых проблем. Это может сделать гематолог, невролог, нефролог или гастроэнтеролог по результатам общего и биохимического анализа крови, наличию метилмалоновой кислоты. Также проводят УЗИ брюшной полости и исследование всасывания витамина В12 с помощью радиоизотопов. По показаниям можно провести аспирационную биопсию костного мозга.
Лечение проводят витамином В12 внутримышечно. В течение 1-1,5 месяцев используют поддерживающую дозу. Если уровень гемоглобина упал менее 60 г на л, при нарушении гемодинамики и угрозе анемической комы проводят трансфузии эритроцитов.
В качестве профилактики при заболеваниях, сопровождающихся нарушением всасывания витамина В12, а также после операций нужно под контролем содержания витамина В12 в моче и крови применять профилактические и лечебные курсы витаминотерапии.
Что это такое простыми словами? Это процесс ускоренного разрушения красных кровяных телец, он сопровождается значительным ростом уровня прямого билирубина в крови. Заболевание встречается достаточно редко.
Общим признаком можно считать ускоренное разрушение эритроцитов, сопровождающееся с одной стороны анемией и повышенным образованием продуктов распада эритроцитов, а с другой – реактивно усиленным эритропоэзом.
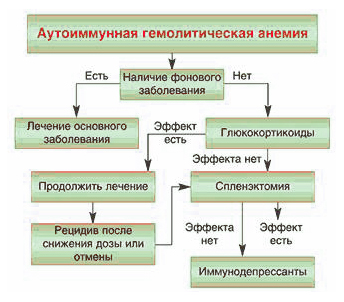
Аутоиммунная гемолитическая анемия, как правило вызвана генетическими дефектами мембран эритроцитов, что вызывает их повышенное разрушение. Аутоиммунное заболевание и гемолиз эритроцитов при приобретенных анемиях наступает под действием внутренних факторов или каких-либо факторов окружающей среды.
На развитие иммунных гемолитических анемий влияют посттрансфузионные реакции, вакцинации, прием некоторых препаратов (сульфаниламидов, анальгетиков, противомалярийных лекарств, производных нитрофуранового ряда). Также такой симптом может проявляться при гемобластозах, аутоиммунных патологиях (НЯК, СКВ), инфекционных болезнях (мононуклеоз, вирусная пневмония, сифилис, токсоплазмоз).
Гемолитические анемии можно поделить на два обширные группы заболеваний: приобретенные и врожденные.
Формы наследственных заболеваний:
- Эритроцитарные мембранопатии, такие как анемия Минковского-Шоффара или болезнь Минковского-Шоффара (микросфероцитоз), акантоцитоз, овалоцитоз, вызванные аномалиями в структуре мембран эритроцитов. Отметим, что сфероцитоз – самый распространенный вид среди патологий (микросфероцитоз).
- Энзимопении, вызванные дефицитом некоторых ферментов (пируваткиназа, глюкозо-6-фосфатдегидрогеназа).
- Гемоглобинопатии, возникшие из-за качественных нарушений структуры гемоглобина или изменения соотношения его нормальных форм.
Приобретенные гемолитические анемии делят на:
- Приобретенные мембранопатии (шпороклеточная анемия, болезнь Маркиафавы-Микели).
- Изо- и аутоиммунные, вызванные действием антител.
- Токсические, возникшие вследствие воздействия ядов, токсинов или других хим. агентов.
- Анемии, ассоциированные с механическими повреждениями в структуре эритроцитов.
Рост концентрации остаточных следов после распада эритроцитов в организме внешне будет проявляться желтухой лимонного оттенка. Также будет наблюдаться повышение концентрации в крови непрямого билирубина и железа. Отмечается уробилинурия и плейохромия кала и желчи. При внутрисосудистом гемолизе дополнительно развивается гипергемоглобинемия, гемоглобинурия, гемосидеринурия. Об усилении эритропоэза говорит ретикулоцитоз и полихроматофилия в составе периферической крови, либо эритронормобластоз костного мозга.
Если у пациента не микросфероцитарная анемия, обусловленная наследственным сфероцитозом или эллиптоцитозом, то необходимо, прежде всего проводить адекватную терапию заболевания, вызвавшего причину гемолитической анемии.
Для лечения обычно применяют:
- медикаменты (например, Десферал);
- спленэктомию;
- трансфузию эритроцитов при кризе;
- ГСК при аутоимунных заболеваниях в средней дозировке.
Апластическая анемия — заболевание, которое относят к категории миелодисплазий. При таком заболевании происходит резкое угнетение или прекращение роста и созревания клеток в костном мозге, еще называемое панмиелофтизом.
Типичными симптомами болезни являются: лейкопения, анемия, лимфопения и тромбоцитопения. Сам термин впервые появился в начале 20 века. Такое заболевание имеет достаточно тяжелое течение и без лечения (в том числе медикаментозного препаратом Атгам) имеет неблагоприятный прогноз.
Очень долго эту болезнь рассматривали в качестве синдрома, объединяющего различные патологические состояния в костном мозгу. В настоящее время термин «апластическая анемия» выделяется в качестве самостоятельной нозологической единицы. Его следует четко разграничивать от синдрома гипоплазии в кроветворной системе.
Апластическая анемия может быть вызвана различными причинами:
- химическими агентами, бензолом, солями тяжелых металлов и так далее;
- ионизирующим излучением;
- приемом некоторых лекарств, цитостатиков, НПВС, Анальгина, Мерказолила, Левомицетина;
- вирусами;
- наличием других аутоиммунных заболеваний.
Также существует форма апластической анемии, передающейся по наследству — анемия Фанкони. Лечение болезни заключается в приеме иммунодепрессантов и проведении пересадки костного мозга.
При серповидно-клеточной анемии человека происходит нарушение строения белка гемоглобина, он приобретает нетипичное кристаллическое строение, в виде серпа. Такую форму называют S-гемоглобином. Заболевание связывают с мутацией НВВ-гена, из-за которой в костном мозге начинает синтезироваться аномальный вид S-гемоглобина, в шестом положении в В-цепи вместо глутаминовой кислоты находится валин. Происходит полимеризация S-гемоглобина, образуются длинные тяжи, эритроциты приобретают форму серпа.
Тип наследования серповидноклеточной анемии – аутосомно-рецессивный при неполном доминировании. У гетерозиготных носителей в эритроцитах находится примерно равное количество гемоглобина А и S. Носители сами не болеют, а выявить серповидные эритроциты можно случайно при проведении лабораторного обследования. Симптомы же могут и вовсе не проявляться. Иногда такие люди начинают ощущать недомогание при гипоксии или тяжелом обезвоживании.
У гомозигот в крови есть только гемоглобин S, заболевание протекает достаточно тяжело. У таких больных высокий уровень степени разрушенных эритроцитов в селезенке, значительно короче срок жизни, часто проявляются признаки хронической недостаточности кислорода.
Такой вид анемии достаточно распространен в регионах, где высокий уровень заболеваемости малярией. У таких больных выше устойчивость к разным штаммам малярийного плазмодия. Поэтому столь вредные аллели часто проявляются у жителей Африки.
Симптомы сильно различаются и их можно наблюдать у детей уже с 3-х месячного возраста. Анемия может приводить к потере сознания, меньшей выносливости, вызвать желтуху. У младенцев наблюдается худоба, слабость, искривление конечностей, удлиненность туловища, изменения в строение черепа и зубов. Также у больных детей повышенная склонность к развитию сепсиса. У подростков наблюдают задержку развития на 2-3 года. Женщины, как правило, способны к зачатию и рождению ребенка.
Мегалобластная анемия (болезнь Аддисона-Бирмера, В12-дефицитная, пернициозная) — заболевание, вызванное недостатком фолиевой кислоты или витамина В12. Происходит это из-за недостатка веществ в пище или при заболеваниях пищеварительного тракта. Также мегалобластическая анемия может возникнуть при врожденных нарушениях процессов синтеза ДНК, приобретенных патологиях и из-за приема некоторых лекарств (антиметаболитов, противосудорожных).
При постоянном недостатке фолиевой кислоты и В12 развивается хроническая анемия, эритроциты изменяют свою форму и размеры. Более легкие стадии иногда протекают бессимптомно, далее начинают уже проявляться внешние признаки. Такое дефицитное состояние часто также называют пернициозной анемией. Заболевание получило статус анемии хронических заболеваний, так как проявляется у пациентов после 60 лет и у перенесших гепатит больных, при энтерите и раке кишечника. Подробнее о такого рода анемиях описано выше.
Развивается вследствие эндогенного В12-авитаминоза, вызванного атрофией желез фундального отдела желудка, которые в норме должны вырабатывать гастромукопротеин. В результате нарушаются процессы всасывания витамина В12 и возникает злокачественная анемия «пернициозного» типа. Чаще всего такой диагноз ставят в возрасте от 50 лет.
Болезнь сопровождается нарушениями нервной, сердечно-сосудистой, кроветворной и пищеварительной системы. Больные обычно жалуются на одышку, общую слабость, отечность ног, боли в сердце, «мурашки» по стопам и кистям, жгучие боли в языке и шаткость походки. По лабораторным показателям наблюдают анемию гиперхромного типа, лейкопению, тромбоцитопению.
Сидеробластная анемия также имеет название сидероахрестическая анемия (САА), железорефрактерная, железонасыщенная или сидеробластическая. Это патологическое состояние нарушений процесса синтеза микроэлементов и кроветворения, чаще всего – железа. Эритроциты содержат малое количество железа, из-за того, что микроэлемент активно расходуется костным мозгом и начинает накапливаться во внутренних органах. Заболевание развивается на фоне недостаточного содержания протопорфирина.
Выделяют две формы болезни:
- пиридоксин-зависимую, возникающую вследствие дефицита пиридоксальфосфата;
- пиридоксин-резистентную, развивающуюся из-за ферментного дефекта (дефицита гемсинтетазы).
Приобретенные формы сидероахрестической анемии чаще наблюдаются в пожилом возрасте, но болезнь не наследуется от родителей. Часто такого рода анемия развивается, как побочный эффект от лечения препаратами от туберкулеза или истощении пиридоксальфосфата при отравлении свинцом, при алкоголизме, миелопролиферативных болезнях крови, кожной порфирии. Встречаются и идиопатические формы САА.
Это редкое, передающееся по наследству заболевание. Анемия Фанкони встречается у 1 из 350000 детей. Наибольшее распространение заболевание получила среди евреев-ашкеназов и жителей Южной Африки.
Возникает из-за наличия дефектов в белковых кластерах, отвечающих за процесс репарации ДНК. Для заболевания характерная высокая ломкость у хромосом, наличие у пациентов старше 40 лет миелоидного лейкоза и апластической анемии.
Для новорожденных с таким недугом характерны врожденные дефекты развития, необычная пигментация, низкорослость, аномалии развития скелета и некоторые неврологические симптомы (косоглазие или недоразвитость одного из глаз, глухота, умственная отсталость), аномалии развития внутренних органов. К сожалению, в среднем такие пациенты живут не более 30 лет.
У диагноза неуточненная анемия код по МКБ-10 D64.9. Это первичный диагноз, который уточняется после проведения обследования у врача, так как он является вторичным признаком какого-либо основного заболеваний. Прежде всего следует исключить возможность кровопотери вследствие травм, хирургических вмешательств, внутренних кровотечений, далее проводится лабораторная диагностика.
По международной классификации МКБ-10 для миелодиспластического синдрома:
- D46.0 Рефрактерная анемия без сидеробластов, так обозначенная;
- D46.1 Рефрактерная анемия с сидеробластами;
- D46.2 Рефрактерная анемия с избытком бластов;
- D46.3 Рефрактерная анемия с избытком бластов с трансформацией;
- D46.4 Рефрактерная анемия неуточненная;
- D46.7 Другие миелодиспластические синдромы;
- D46.9 Миелодиспластический синдром неуточненный.
Приставка «рефрактерная» означает устойчивость заболевания к приему витаминов, препаратов железа, соблюдению диеты. Чаще всего такого вида анемия является наиболее распространенным видом миелодиспластического синдрома. Из-за нарушений процессов созревания бластов в крови значительно понижено содержание гемоглобина, проявляются признаки острого лейкоза. Примерно у 40% пациентов с миелодиспластическим синдромом проявляется рефрактерная анемия. Чаще всего гемоглобинопатия такого рода развивается у пациентов от 50 лет.
Заболевание можно считать промежуточным этапом между рефрактерной анемией и острым лейкозом. Как правило, болезнь проявляется снижением уровня гемоглобина и общей слабостью. Если у больного не нашли других причин для таких изменений картины крови, то основной задачей врачей становится дообследовать пациента и максимально затормозить наступление острого лейкоза.
Что за болезнь талассемия? Это наследуемое по рецессивному типу заболевание, развивающееся из-за снижения синтеза полипептидных цепей в структуре гемоглобина. В зависимости от того, какой мономер перестал нормально синтезироваться различают альфа-, бета-талассемию и дельта-талассемию. Также болезнь классифицируют по степени клинических проявлений, разделяют на тяжелую, легкую и среднюю.
Альфа-талассемия ассоциирована мутациями в генах HBA2 и HBA1. Альфа-цепь кодируется четырьмя локусами и, в зависимости от количества аномальных – различают разные степени тяжести заболевания. Симптомы и течение гемоглобинопатии варьируют от легкой до тяжелой степени гипохромной микроцитарной анемии.
Бета-талассемия существует в двух наиболее распространенных вариантах: малая (minor) и CD8(-AA) – большая (наиболее тяжелая форма заболевания). Анемия развивается из-за мутаций обоих аллелей бета-глобина, когда гемоглобин А начинает вытесняться гемоглобином F. Обычно малая талассемия имеет легкое течение и лечение не требуется.
Согласно Википедии, анемия Даймонда-Блекфена представляет собой наследственную форму красноклеточной аплазии с точно не выявленным типом наследования. Предполагают, что заболевание имеет аутосомно-доминантный тип наследования, который встречается у одной четвертой всех больных. У таких больных обычно проявляются проявления анемии в течение первого года жизни, слабость, бледность, повышенная утомляемость, снижение количества эритроцитов в плазме крови.
Диагноз ставят по общему анализу крови, показателям уровня эритропоэтинов, микроскопии и биопсии костного мозга. Лечению болезнь поддается плохо, назначают ГКС, гемотрансфузии.
Повышение концентрации свободного гемоглобина в плазме крови называют гемоглобинемией. Заболевание возникает вследствие приобретенных и врожденных заболеваний эритроцитов, при повышенном их разрушении. Симптом может проявиться после неправильно проведенного переливания крови, из-за воздействия паразитарных и инфекционных факторов (сепсиса, вирусной инфекции, малярии), после сильного переохлаждения, отравления ядами, бензином, уксусной кислотой, грибами. Проявляется внешне это гиперемией кожных покровов и слизистой, повышением концентрации гемоглобина и билирубина в крови.
Существуют настолько разные причины заболевания, что выявить некоторые из них можно только после проведения лабораторных исследований. Часто бывает, что показатели гемоглобина в норме, а железо низкое. Недуг может наблюдаться при недостатке витаминов группы В, фолиевой к-ты. Малокровие у человека возникает вследствие различных травм и обильных внутренних или внешних кровотечений.
Такой диагнозе женщине могут поставить, если уровень гемоглобина в крови падает ниже 120 г на литр. В целом у женщин, из-за некоторых физиологических особенностей выше склонность к данному недугу. Ежемесячные кровопотери во время менструации, когда в течение недели женщина может потерять до 100 мл крови, беременность, лактация и снижение концентрации ферритина – самые распространенные причины анемии. Часто заболевание развивается из-за психосоматики, когда у женщины депрессивное состояние, она плохо питается, редко выходят на свежий воздух, не занимается спортом или во время климакса, когда происходят глобальные изменения в физиологии женщины.
У мужской половины данный диагноз ставится, если уровень гемоглобина снизился менее 130 г на л. По статистике заболевание возникает реже. Чаще всего из-за каких-то хронических заболеваний, нарушений работы органов и их систем (язвенная болезнь, геморрой, эрозии в кишечнике, доброкачественные и злокачественные новообразования, паразиты, апластическая анемия). Существуют и генетические причины (анемия Фанкони) заболевания, которые не связаны с полом.
Малокровие проявляется по-разному, в зависимости от конкретного вида заболевания. Известно, что при малокровии у человека уменьшается количество эритроцитов, изменяется их строение, содержание железа в крови, падает гемоглобин. Ткани человека испытывают недостаток кислорода и это оказывает влияние на общее состояние и внешний вид человека.
Общие признаки анемии, следующие:
- значительно сниженная работоспособность, общая слабость;
- раздражительность, повышенная утомляемость, сильная сонливость;
- шум в ушах и головные боли, «мушки» перед глазами, головокружения;
- дизурия;
- непреодолимое желание полакомится мелом или известью;
- постоянная одышка;
- тонкие и ломкие волосы, ногти, сухая, неэластичная кожа;
- стенокардия, низкое артериальное давление;
- шум в ушах и частые обмороки;
- изменение цвета стула, желтуха, бледность;
- ломота в теле и суставах, мышечная слабость.
Также существуют специфические симптомы малокровия, характерные для той или ной разновидности:
- Железодефицитная анемия. Для данного диагноза характерная парорексия, у пациента появляется сильное желание жевать мел, землю, бумаги и прочие несъедобные материалы. Можно также выделить койлонихию, трещинки в уголках рта, заеды, воспаленный язык. Иногда может повыситься температура до субфебрильной.
- Основным симптомом В12-дефицитной анемии можно назвать покалывание в конечностях, нестойкость походки, скованность и стесненность в движениях, низкое чувство осязания. У пациента снижаются когнитивные способности, могут возникать галлюцинации. В крайне тяжелых случаях может развиться паранойя или шизофрения.
- Характерным симптомом серповидноклеточной анемии может быть слабость, приступообразные боли в брюшной полости и суставах.
- При отравлении свинцовыми отходами у пострадавшего наблюдаются характерные темно-синие линии на деснах, тошнота и болезненные ощущения в области живота.
- Хроническое разрушение эритроцитов может быть симптомом злокачественной опухоли. В таком состоянии развивается проступающая желтуха, язвы и ссадины на ногах, покраснение мочи. Часто образуются камни в желчном пузыре.
Поставить точный диагноз гемолитическая, мегалобластная или апластическая анемия можно после проведения дифференциальной диагностики. Диф. диагностика проводится по соответствующим таблицам и результатам лабораторных исследований.
источник