Признаком мегалобластной анемии служит выраженный макроцитоз . Макроцитоз (средний эритроцитарный объем свыше 100 куб.мкм) бывает также при гемолизе , болезнях печени , алкоголизме , гипотиреозе и апластической анемии , но если средний эритроцитарный объем превышает 110 мкм3, у больного скорее всего мегалобластная анемия.
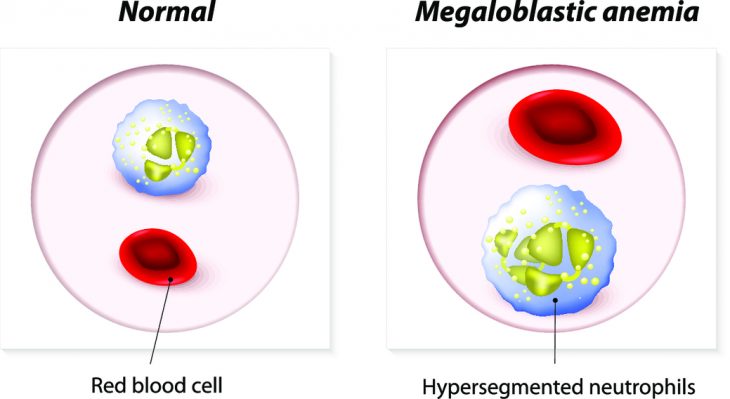
При сопутствующем дефиците железа или талассемии эритроциты могут быть нормальных размеров. Содержание ретикулоцитов при мегалобластной анемии понижено. Число лейкоцитов и тромбоцитов тоже может быть снижено, особенно у больных с тяжелой анемией. В мазке крови (цв. рис. IV.2 ) обнаруживают выраженный анизоцитоз и пойкилоцитоз , а также крупные гиперхромные эритроциты овальной формы — овальные макроциты. Они очень типичны для мегалобластной анемии. Обнаруживают также базофильную зернистость эритроцитов, иногда — ядросодержащие эритроциты. Среди лейкоцитов видны нейтрофилы с гиперсегментированными ядрами (цв. рис. IV.18 ). Это настолько характерный признак, что, обнаружив хотя бы один нейтрофил с шестью и более сегментами ядра, следует в первую очередь заподозрить мегалобластную анемию. Могут попадаться единичные миелоциты. Тромбоциты деформированы, причудливой формы.
Очень помогает в диагностике мегалобластной анемии исследование костного мозга. В нем обнаруживают гиперплазию, снижение лейкоэритробластического отношения и обилие гранул гемосидерина.
Клетки-предшественники эритроцитов крупнее, чем в норме, с выраженным асинхронизмом созревания ядра и цитоплазмы (замедленное созревание ядра при нормальном созревании цитоплазмы). Их называют мегалобластами.
Степень дисперсности хроматина в них больше обычной, поэтому окрашивается он менее интенсивно. Глыбки хроматина разделены светлыми промежутками; такой вид хроматиновой сети очень характерен для мегалобластного эритропоэза.
Возможны патологические митозы.
Поражаются и предшественники гранулоцитов. Большинство из них крупнее, чем в норме; появляются, например, гигантские палочкоядерные нейтрофилы и метамиелоциты. Число мегакариоцитов уменьшено, в них обнаруживают морфологические изменения.
Характерная особенность мегалобластных анемий — неэффективный эритропоэз. В тяжелых случаях до 90% клеток-предшественников эритроцитов разрушаются до выхода в кровоток (в норме эта цифра не превышает 10-15%).
Усиленное разрушение мегалобластов в костном мозге ведет к повышению уровня непрямого билирубина и активности ЛДГ1 в сыворотке. О неэффективном эритропоэзе свидетельствует также усиление оборота железа плазмы при пониженном включении радиоактивного железа в гем.
При обследовании больного с мегалобластной анемией важно выяснить, имеется ли у него дефицит витамина В12 или дефицит фолиевой кислоты . Для этого измеряют их сывороточные концентрации. Нормальная концентрация витамина В12 составляет 200-900 пг/мл, а концентрация ниже 100 пг/мл указывает на дефицит; для фолиевой кислоты эти цифры составляют соответственно 6-20 нг/мл и 4 нг/мл.
Сывороточная концентрация фолиевой кислоты (в отличие от витамина В12) быстро реагирует на изменения поступления фолиевой кислоты с пищей. Более точным показателем содержания фолиевой кислоты в организме служит ее содержание в эритроцитах. На него не влияют кратковременные колебания поступления фолиевой кислоты с пищей.
Если обнаружен дефицит витамина В12, для выяснения его причины проводят пробу Шиллинга. Больному дают внутрь витамин В12, меченный радиоактивным изотопом, и вскоре после этого вводят в/м немеченый витамин В12. Доля принятого внутрь витамина В12, выделенная с мочой в течение последующих 24 ч, позволяет точно оценить всасывание витамина В12 (при условии, что суточная моча собрана полностью).
Дефицит витамина В12 почти всегда обусловлен нарушением всасывания ( табл. 108.1 ), поэтому результат этого, первого этапа пробы Шиллинга обычно положителен — моча содержит незначительное количество меченого витамина В12. В этом случае больному дают меченый витамин В12, связанный с внутренним фактором Касла . Если всасывание нарушено из-за недостаточности внутреннего фактора Касла, то витамин В12 будет всасываться нормально. Если же всасывание по-прежнему снижено, у больного может быть бактериальное обсеменение тонкой кишки ( синдром слепой петли ) или заболевание подвздошной кишки (в том числе нарушение всасывания в ней витамина В12 вследствие его же дефицита).
При синдроме слепой петли всасывание витамина В12 нормализуется после антибиотикотерапии.
Парентеральная заместительная терапия цианокобаламином не влияет на результат пробы Шиллинга.
Нормальный результат пробы Шиллинга при подтвержденном дефиците витамина В12 может означать плохое всасывание пищевого витамина В12. Чтобы это доказать, повторяют пробу Шиллинга, но при этом меченый витамин В12 дают с яичным белком.
Полезную информацию для диагностики мегалобластных анемий дают сывороточные концентрации метилмалоновой кислоты и гомоцистеина. Уровень обоих повышается при дефиците витамина В12 , а уровень гомоцистеина (но не метилмалоновой кислоты) — при дефиците фолиевой кислоты . Эти показатели отражают содержание витамина В12 и фолиевой кислоты в тканях и позволяют выявить их дефицит даже при нормальных сывороточных концентрациях.
При повышенной сывороточной концентрации метилмалоновой кислоты и нормальном уровне витамина В]2 возможны неврологические и психические расстройства , особенно у пожилых . Устранить их можно только с помощью препаратов витамина В12.
источник
Анемии, связанные с нарушением синтеза ДНК и РНК, представляют большую группу как наследственных, так и приобретенных заболеваний.
• Синтез ДНК нарушается при дефиците витамина В12, фолиевой кислоты, при некоторых наследственных заболеваниях, возникающих при нарушении активности ферментов, участвующих в образовании коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия).
• Эти анемии объединяет наличие в КМ мегалобластов, характеризующихся асинхронной дифференцировкой ядра и цитоплазмы и своеобразием их морфологии.
• Задержка синтеза ДНК приводит к дисбалансу клеточного роста. Синтез РНК остается неповрежденным. В результате этого происходит нарушение дифференцировки ядра, а цитоплазматические компоненты, особенно Hb, синтезируются в повышенном количестве, что способствует расширению площади эритроидных предшественников и появлению гиперхромных эритроцитов крупных размеров (макроцитов).
• Мегалобластические изменения характерны также для гранулоцитарных предшественников и мегакариоцитов.
• Основной причиной развития дефицита витамина В12 являются тяжелые атрофические гастриты, приводящие к нарушению его всасывания.
• Различают три гистологических стадии гастрита:
• атрофия слизистой желудка.
• Последние две стадии характеризуются прогрессивным уменьшением секреции, среди факторов которой происходит потеря соляной кислоты, пепсина и внутреннего фактора (ВФ), который является гастрогликопротеидом и секретируется париетальными клетками фундальной части желудка.
• В норме ВФ образует комплекс с витамином В12 и в таком виде всасывается в тонком кишечнике.
• Причины развития гастритов многочисленны и до настоящего времени не совсем понятны. Они могут являться следствием:
• химического, термического и механического повреждения слизистой желудка;
• пищевого дефицита железа, фолатов, аскорбиновой кислоты;
• эндокринной патологии — заболеваний щитовидной железы, надпочечников и поджелудочной железы;
• Существуют наследственные формы мегалобластных анемий, которые наследуются, вероятно, по аутосомно-рецессивному типу.
• Природа генетических повреждений до конца не выяснена, но предполагается существование двух главных факторов возникновения анемии:
• дефект иммунологической толерантности к группе антигенов, обнаруженных в желудке, щитовидной железе, поджелудочной железе и коже.
• дефект метаболических или ферментных систем этих органов и тканей.
• В сыворотке крови больных В12-дефицитной анемией обнаружено несколько типов ауто-АТ, AT к париетальным клеткам и клеткам щитовидной железы.
• Наиболее значимыми в этиологии анемии являются AT к ВФ. Различают три типа ауто-АТ (рис. 10.1):
• Наиболее распространенными являются так называемые блокирующие AT , которые предотвращают соединение витамина В12 и ВФ.
• Другой тип получил название присоединяющих AT . Присоединяющие AT состоят из 2-х вариантов: (рис. 10.1).
• Причины возникновения мегалобластных анемий представлены в таблице 10.1.
• Заболевание встречается у лиц старше 40 лет, обычно вследствие нарушения секреции ВФ клетками слизистой желудка.
• У некоторых больных наблюдается наследственная предрасположенность.
• Патогенез: наличие аутоиммунных заболеваний, при которых наблюдается иммунная деструкция клеток желудка, секретирующих соляную кислоту и пепсин. У всех больных наблюдается атрофия слизистой желудка и ахлоргидрия.
• Отмечена повышенная частота возникновения рака желудка.
АНЕМИЯ ПОСЛЕ РЕЗЕКЦИИ ЖЕЛУДКА
• Дефицит витамина В12 обычно развивается через 5-6 лет после тотальной гастрэктомии, вследствие уменьшения секреции ВФ и связанного с этим нарушения всасывания кобаламина.
• Задержка появления симптомов анемии отражает время, необходимое для истощения запасов кобаламина после прекращения его всасывания.
• Всасывание кобаламина может быть также нарушенным вследствие субтотальной гастрэктомии.
• Сочетание гиперпаратиреоза, множественных язв в желудке и двенадцатиперстной кишке, диареи, множественных аденом островков поджелудочной железы, вследствие чего происходит инактивация панкреатических протеаз, необходимых для всасывания кобаламина.
Рис. 10.1 СХЕМАТИЧЕСКОЕ ИЗОБРАЖЕНИЕ ВЗАИМОДЕЙСТВИЯ ВНУТРЕННЕГО ФАКТОРА (ВФ), ВИТАМИНА В12 (В12) И АНТИТЕЛ К ВФ ( AT ) (по G . R . Lee , 1993)
А: взаимодействие ВФ и В12;
Б: блокирующие AT (Б- AT ) предотвращают соединение ВФ и В12;
В: два типа соединяющих антител:
БАТ 1 имеют одинаковую аффинность для ВФ и ВФ-В12 и присоединяются на расстоянии от места присоединения В12 ВФ. БАТ 2 имеют большую аффинность для комплекса ВФ-В12 и, возможно, присоединяются как к ВФ, так и к В12.
• Причины дефицита витамина В12 указаны в таблице 10.1.
• Наиболее часто дефицит витамина В12 возникает вследствие нарушения всасывания.
Таблица 10.1 Причины возникновения мегалобластных анемий
А. Дефицит витамина в пище (редко)
б) субтотальная резекция желудка
3. Ожог слизистой желудка каустическими веществами
В. Функциональная патология ВФ
Г. Биологическая конкуренция
1. Развитие обильной бактериальной флоры в кишечнике при:
г) соустьях с выключением петель тонкой кишки
2. Инвазия широким лентецом
Д. Семейное селективное нарушение всасывания витамина B12 (синдром Иммерслунда)
Е. Лекарственно-индуцированное нарушение всасывания витамина B12
Ж. Хронические заболевания поджелудочной железы
3. Синдром Золлингера-Эллисона
К. Заболевания или резекция кишечника
1. Алкоголизм и цирроз печени
4. Заболевания, протекающие с быстрой клеточной пролиферацией
В. Врожденное нарушение всасывания
Г. Лекарственно-индуцированный дефицит
Д. Значительная резекция тонкого кишечника
III . Комбинированный дефицит фолатов и B 12
Б. Энтеропатия,чувствительная к глютену
IV. Врожденные расстройства с интеза ДНК
В. Тиамин-зависимая мегалобластная анемия
Г. Дефицит ферментов, необходимых для метаболизма фолатов
Д. Дефицит транскобаламина II
Е. Патология транскобаламина
Ж. Гомоцистинурия и метилмалоновая ацидурия
V. Лекарственно-и токсин-индуцированные расстройства синтеза ДНК
• Кишечный стаз из-за анатомических повреждений или нарушения подвижности приводит к колонизации кишечных бактерий, которые связывают кобаламин еще до его всасывания.
• Эти паразиты связывают кобаламин, однако только у 3 % лиц, зараженных паразитами, развивается анемия.
БОЛЕЗНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
• Поражение поджелудочной железы приводит к возникновению дефицита панкреатических протеаз, необходимых для всасывания кобаламина. Тесты Шиллинга часто положительны у больных с поражением поджелудочной железы, но клинически значимый дефицит кобаламина развивается редко.
ДЕФИЦИТ КОБАЛАМИНА ПРИ НАРУШЕНИИ ДИЕТЫ
• Появляется редко, обычно у вегетарианцев, которые полностью избегают употребления продуктов животного происхождения (даже яиц и творога).
• Начало В12-дефицитной анемии постепенное. Обычно степень анемии не соответствует тяжести симптомов.
• Анемия чаще развивается у светловолосых и голубоглазых людей с гиперстеническим типом телосложения.
• Классическим комплексом симптомов анемии являются поражение пищеварительной системы и неврологические нарушения, которые обычно появляются раньше и быстро прогрессируют, маскируя симптомы анемии.
• Кожные покровы обычно лимонно-желтого цвета, что обусловлено комбинацией бледности и желтухи. Может наблюдаться диффузная или ограниченная гиперпигментация кожи. Кожа чаще бархатистая и гладкая на ощупь, но может быть сухой. У больных В12-дефицитной анемией наблюдается иктеричность склер.
• При тяжелой анемии наблюдается повышение температуры тела даже при отсутствии инфекции.
• У 50 % больных мегалобластной анемией наблюдаются патологические изменения со стороны пищеварительной системы.
• Характерна потеря вкусовых ощущений, снижение аппетита; у 7-50 % больных появляется отвращение к пище, особенно мясной, чувство жжения языка, слизистой оболочки рта и прямой кишки.
• Для В12-дефицитной анемии характерен «лакированный» с участками воспаления язык, с изъязвлениями ярко-розового цвета (глоссит Хантера). Изменения со стороны слизистой языка могут появляться и в отсутствии анемии, что свидетельствует об обострении заболевания у лечившихся больных.
• Интенсивность глоссита обычно убывает после начала терапии, но чувство жжения языка может возобновляется через различные промежутки времени.
• Неврологическая симптоматика может появляться и в отсутствии анемии, и в этом случае является обратимой.
• Клинические проявления поражения нервной системы включают: парестезии, слабость, шаткую походку, нарушение тактильной и температурной чувствительности.
• При тяжелой анемии могут наблюдаться нарушения психики: появляются галлюцинации, развивается маниакально-депрессивный синдром, параноидный и шизофренический статус («мегалобластное слабоумие»).
• Если лечение не проводится, то заболевание прогрессирует, развивается спастическая атаксия и клиническая картина псевдотабеса вследствие демиелинизации волокон задних и латеральных столбов спинного мозга.
• Анемия является макроцитарной с MCV от 100 до 150 фл, но сопутствующий дефицит железа, талассемия или воспаление могут маскировать макроцитоз. Цветовой показатель выше нормы.
• Эритроциты: выраженный анизо- и пойкилоцитоз с большим количеством овальных гиперхромных макроцитов; в тяжелых случаях наблюдается базофильная пунктация эритроцитов, наличие в них телец Жолли и колец Кебота.
• Количество ретикулоцитов обычно низкое.
• Часто наблюдаются лейкопения и тромбоцитопения.
• Гиперсегментация нейтрофилов является первой гематологической патологией при мегалобластном статусе. Обычно в норме нейтрофилы имеют от 3-х до 5-ти долей; у здорового человека в периферической крови может циркулировать до 2 % гиперсегментированных нейтрофилов (имеющих более 5-ти ядерных долей). У больных мегалобластной анемией количество гиперсегментированных нейтрофилов превышает 5 %.
• Тромбоциты обычно небольших размеров.
• Костный мозг: эритроидная гиперплазия с характерными мегалобластическими изменениями. Наличие промегалобластов с митотической картиной характерно для тяжелой анемии. Количество сидеробластов и содержание железа в макрофагах повышено.
• Одновременное наличие дефицита железа может уменьшать мегалобластный эритроидный ответ, но присутствие в КМ гигантских метамиелоцитов и палочкоядерных нейтрофилов, а в периферической крови — гиперсегментированных нейтрофилов, свидетельствует в пользу мегалобластной анемии.
• Сыворотка крови: повышение концентрации билирубина, железа, ферритина.
• Активность сывороточной ЛДГ значительно повышена и увеличивается по мере прогрессирования заболевания.
• Уровень сывороточного кобаламина обычно низкий у большинства больных, но может быть нормальным в случаях врожденной патологии метаболизма кобаламина.
• Уровень сывороточного кобаламина может быть низким с нормальным тканевым уровнем витамина В12:
• у лиц, получающих большие дозы витамина С;
• при дефиците транскобаламина 1;
• Уровень сывороточных фолатов обычно высокий при дефиците кобаламина, но может быть и нормальным при комбинированном дефиците витамина В12 и фолатов.
• Метилмалоновая ацидурия и повышенный уровень метилмалоновой кислоты являются надежными индикаторами дефицита кобаламина.
• Нарушение всасывания кобаламина может быть установлено путем исследования радиоактивности выделенной мочи после приема внутрь радиоактивного кобаламина (тест Шиллинга). Если радиоактивность выделяемой мочи низкая, тест повторяется с добавлением внутрь ВФ. Нормальная экскреция радиоактивности указывает на дефицит ВФ.
• У некоторых лиц сохранена способность всасывать свободный кобаламин, но нарушен процесс выделения его из пищи, поэтому у них развивается дефицит витамина В^. У таких больных наблюдается положительный тест Шиллинга, а патология может быть установлена модификацией теста при использовании радиоактивного кобаламина в пище.
• Наибольшим источником ошибок при использовании теста Шиллинга является неполный сбор мочи. Почечная патология также приводит к задержке экскреции радиоактивного кобаламина.
• Деструкция эритроидных предшественников в КМ (неэффективный эритропоэз) является характерной чертой мегалобластной анемии. Кроме того, наблюдается неэффективный гранулоцито-и тромбоцитопоэз.
• Продолжительность жизни эритроцитов значительно укорочена; это является причиной гемолиза эритроцитов.
• При тяжелой анемии наблюдается нарушение функции сегментоядерных нейтрофилов и тромбоцитов.
• При обнаружении макроцитарной анемии врачу необходимо разграничить мегалобластную и немегалобластную анемии (рис. 10.2).
• Решающее значение в диагностике мегалобластной анемии имеет морфологическое исследование КМ и крови.
• Дифференциальная диагностика В12-дефицитной анемии проводится с:
• дефицитом фолиевой кислоты, который наблюдается обычно в более молодом возрасте, не сопровождается атрофическими изменениями слизистой оболочки желудка и неврологической симптоматикой;
• аутоиммунной гемолитической анемией (АИГА), протекающей с панцитопенией; при АИГА отсутствует мегалобластный тип кроветворения, характерны ретикулоцитоз и позитивный ПАТ;
• болезнью Маркиафавы-Миккели, для которой характерен внутрисосудистый гемолиз, гемосидеринурия, положительные сахарозный и кислотный тесты. Кроме того, при данной патологии анемия носит характер нормохромной или гипохромной.
• При проведении дифференциальной диагностики В12-дефицитной анемии необходимо установление ее причины.
• Лечение заключается в парентеральном введении витамина В12 или гидрооксикобаламина в дозах, обеспечивающих удвоение запасов депо и удовлетворение дневной потребности.
Рис. 10.2 АЛГОРИТМ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С МАКРОЦИТАРНОЙ АНЕМИЕЙ
• Токсическое действие витамина В12 не наблюдается, но высокие дозы (более 1000 мкг) подавляют транспорт белков и способствуют потере их с мочой.
Схемы введения витамина В12
• 1000 мкг витамина В12 внутримышечно ежедневно в течение 2-х недель, затем 1 раз в неделю до нормализации Hb , после чего переходят на введение 1 раз в месяц в течение всей жизни.
• Оксикобаламин (в дозе 500-1000 мкг через день или ежедневно) более активно усваивается организмом.
• При наличии неврологической симптоматики необходимо введение препарата в дозе 1000 мкг каждые 2 недели в течение 6 месяцев.
• При дефиците витамина В12 часто наблюдаются инфекционные осложнения, которые исчезают при хорошем ответе больных на терапию.
• Трансфузии эритроцитарной массы показаны для срочной ликвидации симптомов гипоксии.
• Начало терапии кобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз превращается из мегалобластного в нормобластный через 12 часов после введения витамина В12.
• Ретикулоцитоз появляется на 3-5 день, пик появления ретикулоцитов наиболее выражен на 4-10 дни. Концентрация Hb нормализуется через 1-2 месяца.
• Количество тромбоцитов и лейкоцитов нормализуется быстро, хотя гиперсегментация нейтрофилов сохраняется до 10-14 дня.
• Повышенные концентрации сывороточного железа и ЛДГ быстро снижаются после начала специфического лечения.
• После терапии кобаламином может развиваться тяжелая гипокалиемия (описаны летальные исходы), поэтому во время введения витамина В12, уровень калия должен тщательно контролироваться; при необходимости показана заместительная терапия.
• Терапию кобаламином следует назначать всем больным после тотальной гастрэктомии. После частичной гастрэктомии необходимо тщательное наблюдение за больными для ранней диагностики анемии.
• Анемия при синдроме «слепой кишки» уменьшается после терапии кобаламином, но применение антибиотиков или коррекция анатомической патологии способствует нормализации содержания Hb без назначения витамина В12.
• Около 1 % дозы витамина В12, принятой внутрь, всасывается даже при отсутствии ВФ. Поэтому больные с пернициозной анемией могут успешно лечиться приемом витамина В12 в дозе 1000 мкг/день.
ОСТРАЯ МЕГАЛОБЛАСТНАЯ АНЕМИЯ
• Острая мегалобластная анемия отражает синдром быстрого развития тромбоцитопении и (или) лейкопении с очень небольшими изменениями уровня Hb. Костный мозг при этом редко является мегалобластным.
• В большинстве случаев развивается при вдыхании паров закиси азота. Закись азота разрушает метилкобаламин, индуцируя дефицит кобаламина. Костный мозг переключается на мегалобластическое кроветворение через 12-24 часа. Гиперсегментированные нейтрофилы появляются в крови через 5 дней.
• Эффект воздействия закиси азота исчезает через несколько дней. Назначение фолиевой кислоты или витамина В12 значительно ускоряет выздоровление.
• Жизнеугрожающая мегалобластная анемия развивается у больных со столбняком, которые для снятия судорожного синдрома получают закись азота.
• Острая мегалобластная анемия может развиться у тяжелых больных при проведении интенсивной терапии, а также у лиц, получающих интенсивные трансфузии, диализ, полное парентеральное питание, антагонисты фолиевой кислоты в течение недели. Диагностика основана на обнаружении мегалобластического кроветворения.
Лечение: парентеральное введение кобаламина (1 мг) и прием фолиевой кислоты (5 мг).
МЕГАЛОБЛАСТНАЯ АНЕМИЯ, ВЫЗВАННАЯ ЛЕКАРСТВАМИ
Частичный список лекарственных препаратов, которые вызывают мегалобластную анемию, представлен в таблице 10.2. Метотрексат ингибирует дигидрофолатредуктазу — энзим, который превращает фолиевую кислоту в активную тетрагидроформу. Токсичность метотрексата устраняется назначением фолиевой кислоты.
Таблица 10.2 Медикаменты, вызывающие развитие мегалобластной анемии
Потенцируют влияние ингибитора дигидрофолатредуктазы.
Лечение: высокие дозы фолиевой кислоты
Воздействие слабее, чем у метотрексата и аминоптерина.
Могут вызывать острую мегалобластную анемию у больных с повышенной чувствительностью, особенно с низкими запасами фолиевой кислоты
Мегалобластоз при использовании больших доз препаратов
Блокирует продукцию уридин-монофосфата путем ингибирования оротидил декарбоксилазы
Главным побочным эффектом является тяжелая мегалобластная анемия
Выраженный мегалобластоз через 1-2 дня от начала терапии. Быстрое выздоровление при отмене препарата
Характерен ранний мегалобластоз
Редкий мегалобластоз, сочетающийся с низким уровнем фолатов. Купируется высокими дозами фолиевой кислоты (1-5 мг/день)
МЕГАЛОБЛАСТНАЯ АНЕМИЯ У ДЕТЕЙ
• Нарушение всасывания кобаламина развивается при нормальном содержании ВФ при ряде наследственных заболеваний у детей.
Селективное нарушение всасывания кобаламина или синдром Иммерслунда-Гресбека
• Этиология: системный дефект эпителия наследственного характера.
• Патогенез: нарушение всасывания кобаламина вследствие поражения эпителия кишечника и отсутствия специфического белка — акцептора кобаламина.
• Клиника: обычно заболевание проявляется на 1-2 году жизни. Характерны жалобы на отсутствие аппетита, рвоту. При объективном исследовании обнаруживают сухость и шелушение кожи, атрофический глоссит. Наблюдаются частые пневмонии с десквамацией эпителия бронхов и альвеол.
• Диагностика основана на оценке характера анемии, морфологического исследования пунктата КМ, обнаружения постоянной протеинурии.
• Лечение: симптоматическое и парентеральное введение витамина В12.
• Наследственный дефицит ВФ наследуется аутосомно-рецессивно и характеризуется дефицитом или резким снижением секреции ВФ клетками желудка.
• Заболевание возникает в возрасте 6-24 месяцев. Лечение — парентеральное введение кобаламина.
• Дефицит транскобаламина II — заболевание, наследуемое по аутосомно-рецессивному типу, характеризующееся возникновением мегалобластной анемии в раннем детстве. Уровень сывороточного кобаламина нормальный, но наблюдается тяжелый дефицит кобаламина в тканях, так как отсутствует транскобаламин II (форма для обеспечения транспорта витамина В^ в ткани). Диагностика основана на исследовании уровня транскобаламина II в сыворотке. Лечение — высокие дозы кобаламина.
• Ювенильная пернициозная анемия — очень редкое расстройство, обычно возникающее у подростков. Диагностика и лечение проводится аналогично терапии В12-дефицитной анемии у взрослых.
• Причины возникновения дефицита фолиевой кислоты представлены в таблице 10.1.
• Запасы фолиевой кислоты в организме ограничены, поэтому ее дефицит развивается очень быстро. Если полностью ограничить содержание фолатов в пище, фолиево-дефицитная анемия развивается через 2-4 месяца.
• Неадекватная диета является главной этиологической причиной дефицита фолиевой кислоты.
• Нарушение всасывания фолиевой кислоты наблюдается при поносах, энтеритах, после резекции тонкого кишечника, при синдроме «слепой кишки».
• Применение лекарственных препаратов, являющихся аналогами или антагонистами фолиевой кислоты (табл. 10.2), может вызвать развитие фолат-дефицитной анемии.
• Алкоголь угнетает метаболизм фолатов в организме. Развитие фолиево-дефицитной анемии наблюдается у 20-40 % лиц, злоупотребляющих алкоголем.
• Дефицит фолатов очень быстро развивается у беременных женщин.
• Фолиевая кислота совместно с витамином В12 участвует в синтезе уридина, глютаминовой кислоты, пуриновых и пиримидиновых оснований, необходимых для образования ДНК.
• Чаще всего болеют лица молодого возраста.
• Проявления заболевания связаны с анемическим синдромом.
• Изменения функции желудочно-кишечного тракта выражены меньше, чем при анемии вследствие дефицита витамина В12
• Могут наблюдаться атрофические изменения слизистой оболочки языка и полости рта, но атрофический гастрит и ахилия при сниженной желудочной секреции не развиваются.
• Неврологическая симптоматика отсутствует.
• Изменения крови и КМ соответствуют морфологической картине В12-дефицитной анемии.
• Диагностическое значение имеет определение концентрации фолиевой кислоты в эритроцитах крови.
• Дифференциальная диагностика проводится с заболеваниями по тем же признакам, что и при В12-дефицитной анемии.
• Фолиевая кислота назначается внутрь в дозе 1-5 мг/день. При назначении этих доз больным с нарушенным кишечным всасыванием происходит регрессия анемии.
• Беременным женщинам следует назначать фолиевую кислоту в дозе 1 мг/день. У женщин с повышенным риском развития дефицита кобаламина (вегетарианцы) необходимо назначать парентерально витамин В12 в дозе 1мг каждые три месяца в течение беременности.
ВРОЖДЕННОЕ НАРУШЕНИЕ СИНТЕЗА ДНК
• Оротовая ацидурия — врожденное расстройство метаболизма пиримидинов, характеризуется мегалобластной анемией и высокой экскрецией с мочой оротовой кислоты.
• Клиника: повышенная чувствительность к инфекциям, вследствие повреждения клеточного иммунного ответа.
• Лечение: витамин В12 и фолиевая кислота неэффективны. Положительный эффект оказывает уридин по 1-1,5 г/день.
• Расстройство (наследуется сцеплено с Х-хромосомой) пуринового метаболизма, характеризующееся гиперурикемией, уродствами, умственными и неврологическими дефектами, мегалобластной анемией.
ТИАМИН-ЗАВИСИМАЯ МЕГАЛОБЛАСТНАЯ АНЕМИЯ
• Наследуется по аутосомно-рецессивному типу, природа метаболической патологии неизвестна.
• Характеризуется тяжелой мегалобластной анемией, диабетом, глухотой.
• Лечение: высокие дозы (20-25 мг/день) тиамина.
ДЕФИЦИТ МЕТИЛТЕТРАФОЛАТ ТРАНСФЕРАЗЫ
• Врожденная мегалобластическая анемия в сочетании с умственной отсталостью и высоким уровнем фолатов в сыворотке крови.
• Характеризуется функциональным дефицитом фолатов, мегалобластной анемией, гиперсегментацией нейтрофилов. Иногда наблюдается задержка умственного и физического развития.
• Врожденная мегалобластная анемия, характеризующаяся снижением активности печеночной дегидрофолатредуктазы.
• Макроцитарные анемии развиваются не только вследствие дефицита ДНК и фолиевой кислоты, но и при многих других заболеваниях (немегалобластные макроцитарные анемии (табл. 10.4)).
Таблица 10.4 Немегалобластные макроцитарные анемии
Расстройства, связанные с усиленным эритропоэзом
Расстройства, связанные с увеличением поверхности мембраны эритроцитов
Синдром В12-рефрактерной анемии
Приобретенная пиридоксиндефицитная анемия
Наследственная дизэритропоэтическая анемия, тип
Хронические обструктивные заболевания легких
СИНДРОМ 5q-РЕФРАКТЕРНОЙ АНЕМИИ
• Синдром 5 q -отражает сочетание рефрактерной макроцитарной анемии с морфологической патологией мегакариоцитов в КМ и изолированной делецией длинного плеча ( q ) 5 хромосомы.
• Появление клиники синдрома характерно для лиц пожилого возраста (60 лет и старше), хотя описаны случаи манифестации патологического процесса у больных моложе 50 лет.
• Женщины болеют чаще мужчин (2:1-5:1).
• Характерной гематологической особенностью являются выраженный анизо-, пойкилоцитоз, анемия средней и тяжелой степени, со снижением уровня Hb до 80 г/л и ниже; наличие гигантских тромбоцитов, тромбоцитоз (700-1000•10 9 /л). Количество лейкоцитов обычно нормальное.
• Костный мозг: клеточность вариабельна, но всегда наблюдается эритроидная гиперплазия. Количество мегакариоцитов повышено, ядра мегакариоцитов обычно небольшого размера, часто наблюдается одноядерность мегакариоцитов, активность клеток повышена.
МАКРОЦИТОЗ ПРИ АЛКОГОЛИЗМЕ
• Умеренный макроцитоз наблюдается у 40-90 % лиц, злоупотребляющих алкоголем.
• Причиной развития макроцитоза у больных алкоголизмом может быть дефицит фолатов, однако наиболее часто алкогольный макроцитоз развивается в результате прямого токсического действия на КМ.
• Диагноз алкогольного макроцитоза основан на отсутствии морфологической картины мегалобластной анемии, наличии макроцитоза в периферической крови, нормальном содержании фолатов в сыворотке крови и в эритроцитах. Алкогольный макроцитоз не исчезает при назначении фолиевой кислоты.
• При прекращении приёма алкоголя размеры эритроцитов (исходя из параметров MCV ) возвращаются к нормальным только через 2-4 месяца.
источник
Определение. Мегалобластные анемии – группа заболеваний крови, общим признаком которых является подавление нормального кроветворения с переходом на эмбриональный мегалобластный тип эритропоэза, что обусловлено дефицитом в организме цианкобаламина (витамин В12) и/или фолиевой кислоты.
МКБ-10: D51. — Витамин-В12-дефицитная анемия.
D52. – Фолиеводефицитная анемия.
Этиология. Причиной мегалобластных анемий являются недостаточное содержание в организме больного витамина В12 (цианкобаламина) и/или фолиевой кислоты.
Витамин В12 и фолиевая кислота эндогенно не продуцируются и поступают в организм с мясными продуктами, дрожжами. Фолиевая кислоты присутствует практически во всех зеленых овощах и фруктах, мясных продуктах, не подвергавшихся длительной и интенсивной термической обработке.
Поступающий с пищей витамин В12 связывается с гастромукопротеином и всасывается в кровь в тонком кишечнике. Депонируется главным образом в печени.
Фолиевая кислота всасывается в кишечнике без посредников. Она лучше всасывается в присутствии аскорбиновой кислоты.
Имеющиеся в организме запасы витамина В12 могут обеспечить нормальное кроветворение в течение 3-4 лет, запасы фолиевой кислоты – 4-5 месяцев.
Длительное недостаточное поступление с пищей. Встречается у строгих вегетарианцев, пожилых малообеспеченных людей
Нарушение усвоения витамина при отсутствии его переносчика — гастромукопротеина, секретируемого слизистой желудка. Причиной такой патологии чаще всего является атрофический гастрит типа А, при котором имеет место гистаминрезистентная ахлоргидрия, аутоиммунная реактивность к обкладочным клеткам. Наблюдается также при опухолях желудка, после операций гастрэктомии.
Нарушение всасывания витамина в тонком кишечнике. Встречается при хронических заболеваниях кишечника (терминальный илеит, дивертикулез, опухоли, состояние после резекций тонкой кишки).
Избыточный расход поступающего с пищей витамина на этапах его транспортировки. Встречается при инвазии кишечника широким лентецом, при гемобластозах.
Недостаточная способность накапливать и сохранять витамин в его основном депонирующем органе – печени. Встречается у больных с циррозом, фиброзом печени.
Врожденные дефекты механизмов транспорта и утилизации витамина В12.
К дефициту фолиевой кислоты ведут следующие причины:
Алиментарная недостаточность (однообразная консервированная животная пища – у моряков, участников длительных экспедиций).
Побочные эффекты фармакотерапии (при лечении антагонистами фолиевой кислоты, противосудорожными препаратами, сульфаниламидами и др.).
Хронические воспалительные заболевания тонкого кишечника, резекции тонкой кишки.
Патогенез. Витамин В12 является предшественником двух коферментов: метилкобаламина и дезоксиаденозилкобаламина.
Метилкобаламин необходим для синтеза ДНК. При его недостатке нарушается цикл преобразования фолиевой кислоты, обеспечивающий переход уридинмонофосфата в тимидинмонофосфат. Возникающие в связи с этим нарушения структуры ДНК аналогичны таковым при дефиците фолиевой кислоты. Происходит торможение деления клеток быстро пролиферирующих тканей, в первую очередь клеток кроветворной системы.
Дезоксиаденозилкобаламин участвует в обмене жирных кислот. При его недостатке не происходит переход метилмалоновой кислоты в янтарную. Метилмалоновая кислота токсична для нервной системы. При ее избытке возникает дегенерация заднебоковых столбов спинного мозга — фуникулярный миелоз. Дефицит фолиевой кислоты таких сдвигов не вызывает.
Клиническая картина. Внешне больные выглядят бледными с легкой зеленоватой иктеричностью – кожа цвета слоновой кости. Для пожилых больных характерна яркая, серебристая седина. Иктеричность, а нередко и выраженная желтуха обусловлены неконьюгированной гипербилирубинемией, являющейся результатом внутрикостномозгового гемолиза гемоглобинсодержащих эритрокариоцитов (шунт-гемолиз). В период обострения заболевания может повышаться температура тела от субфебрилитета до 38 градусов и выше.
В клинической картине мегалобластной анемии можно выделить три синдрома: анемический, поражения органов пищеварения, расстройств нервной системы.
Анемический синдром при мегалобластной анемии в основных чертах такой же, как и при других вариантах анемий. Проявляется общей слабостью, сердцебиением, одышкой при небольшой физической нагрузке. Возможны жалобы на шум в ушах, головокружение, колющие боли в сердце, пастозность нижних конечностей. Выраженность клинических проявлений анемического синдрома зависит от степени и быстроты развития анемии. Быстрая анемизация нередко приводит к ишемии головного мозга с возникновением коматозного состояния, декомпенсированной недостаточности кровообращения.
Синдром патологии органов пищеварения проявляется ощущениями жжения в языке, потерей вкусовых ощущений, жалобами на слабый аппетит, чувство тяжести, боли в подложечной области, поносы. Типично поражение языка — глоссит Гунтера. Характеризуется появлением вначале ярких воспалительных участков, афтозных высыпаний, трещин на кончике и на боковых поверхностях языка. Затем язык становится гладким, блестящим («лакированным»), темно-малинового цвета. Дистрофические изменения в слизистой оболочке желудка и кишечника проявляются симптомами атрофического гастрита, энтерита. Печень постоянно умеренно увеличена, безболезненная. Изредка выявляется небольшая спленомегалия. У отдельных больных обнаруживаются выраженная гепатоспленомегалия, симптомы нарушения портальной гемодинамики, другие признаки цирроза печени. В некоторых случаях имеют место диарея, симптомы мальабсорбции, что может являться свидетельством нарушения всасывания витамина В12 в кишечнике.
Синдром неврологических расстройств связан с поражением заднебоковых столбов спинного мозга — фуникулярным миелозом. В некоторых случаях это один из ранних признаков заболевания. Характеризуется парастезиями, нарушениями вибрационной и глубокой чувствительности. Расстройства глубокой чувствительности появляются раньше и более выражены в дистальных отделах нижних конечностей. В связи с расстройствами глубокой чувствительности развивается атаксия. Наблюдаются двигательные расстройства, слабость, парезы нижних конечностей, снижение или исчезновение сухожильных рефлексов. Появляются патологические симптомы Бабинского, Россолимо. Иногда возникают офтальмоплегия, атония мочевого пузыря, ретробульбарные невриты. Очень редко происходят изменения психики с галлюцинациями, маниакальными вспышками, параноидным состоянием, которые быстро исчезают при своевременно начатом лечении.
Диагностика. Общий анализ крови: отмечается нормохромная или гиперхромная анемия, лейкопения, тромбоцитопения. Имеет место резко выраженный макроовалоцитоз, анизоцитоз, пойкилоцитоз. Наряду с эритроцитами неправильной формы (шизоциты) выявляются крупные клетки — мегалоциты. В эритроцитах повышено содержание гемоглобина – гиперхромия (цветной показатель больше 1). Видны внутриклеточные включения – тельца Жоли, кольца Кебота, диффузная полихроматофилия клеток. Выявляются гиперсегментированные нейтрофилы. Количество тромбоцитов умеренно снижено.
Биохимическое исследование крови: определяется повышение содержания в плазме крови билирубина за счет неконьюгированной фракции, небольшое увеличение концентрации сывороточного железа.
Иммунологическое исследование: выявляются антитела класса IgG специфичные против антигенов цитоплазмы париетальных клеток желудка и гастромукопротеина.
Анализ мочи: обнаруживается уробилин (свидетельство внутрикостномозгового шунт-гемолиза эритрокариоцитов)
Копрограмма: у отдельных больных выявляются яйца и фрагменты стробилы широкого лентеца.
Стернальная пункция: обнаруживается мегалобластный тип эритропоэза. Эритроидный росток преобладает (соотношение лейко/эритро становится большим, чем 1/2, тогда как в норме – 3/1-4/1). Видны признаки аномального лейкопоэза – необычно большие гранулоциты разных стадий созревания, гигантские гиперсегментированные нейтрофилы. Уменьшено количество мегакариоцитов. При обработке стернального пунктата ализариновым красным у больных с В12 дефицитной анемией наблюдается окрашивание клеток, тогда как у больных с дефицитом фолиевой кислоты такой окраски не происходит.
По данным лабораторной диагностики желудочной секреции имеет место гистаминоустойчивая ахлоргидрия, с отсутствием секреции гастромукопротеина.
ФГДС: признаки атрофического гастрита. При морфологическом исследовании биоптатов слизистой желудка определяются признаки кишечной метаплазии желудочного эпителия. В некоторых случаях диагностируется клинически латентный рак желудка.
Рентгенологическое исследование: наблюдается сглаженность, уплощение складок слизистой, снижение тонуса, нарушение моторной функции желудка. Возможна диагностика опухолевого поражения органа.
УЗИ: у некоторых больных выявляются признаки цирроза печени, нарушения портальной гемодинамики.
ЭКГ: тахикардия, диффузные изменения (дистрофия) миокарда желудочков.
ЭхоКГ: дилатация полостей желудочков и предсердий, увеличение систолического индекса (при выраженном анемическом синдроме).
Дифференциальный диагноз. Дифференциально-диагностическими критериями В12-дефицитной анемии являются сочетание мегалобластного типа кроветворения по данным стернальной биопсии костного мозга с атрофическим глосситом, атрофическим гастритом, умеренной гипербилирубинемией, нормальным или умеренно повышенным содержанием железа в сыворотке, наличием специфических неврологических расстройств, относительно пожилым возрастом больных.
Для фолиеводефицитной анемии при сходных с обнаруживаемыми у больных с В12-дефицитом морфологических изменениях в костном мозге отсутствует окрашивание мегалобластов ализариновым красным, нет признаков атрофического глоссита, атрофического гастрита, абсолютно не характерны неврологические симптомы фуникулярного миелоза, преобладает молодой возраст больных.
В отличие от микросфероцитарной гемолитической анемии, при которой больные «в большей степени желтушны, чем анемичны» у больных с В12 и/или фолиеводефицитной анемией характерен макроцитоз, гиперхромия эритроцитов, гиперсегментированные нейтрофилы в периферической крови, мегалобластный тип кроветворения по данным стернальной биопсии костного мозга.
Для диагностики и дифференциальной диагностики В12-дефицитной анемии как причины желтухи и гипербилирубинемии у больных с клиническими признаками цирроза печени обязательно следует выполнять стернальную пункцию и морфологический анализ костного мозга.
Наличие морфологических признаков мегалобластного кроветворения в костном мозге обязательно требует детального обследования всеми методами, включая компьютерную рентгеновскую, ЯМР томография, ультразвуковой скрининг с целью выявления или исключения возможного опухолевого поражения внутренних органов.
Биохимическое исследование крови с обязательным определением концентрации билирубина, железа.
Стернальная пункция и морфологический анализ костного мозга.
источник
Одной из разновидностей анемий является мегалобластная, или В12-фолиеводефицитная анемия. Это заболевание, развивающееся вследствие нарушения процесса созревания эритроцитов в связи с нарушением синтеза в клетке РНК и ДНК, сопровождающееся наличием в костном мозге большого количества видоизмененных предшественников эритроцитов – мегалобластов.
Частота мегалобластной анемии составляет 9-10% всех случаев анемии. Страдают ею лица всех возрастов, однако у пожилых людей она встречается чаще, чем у молодых (4% и 0.1% соответственно). Мегалобластная анемия — это состояние, которое можно и нужно лечить. Причины, симптомы и лечение данного недуга рассмотрим в этой статье.
Причиной развития В12-фолиеводефицитной анемии является недостаток в организме витамина В12 (цианокобаламина) и фолиевой кислоты (витамина В9).
Дефицит фолиевой кислоты, как правило, возникает по следующим причинам:
- недостаточное поступление витамина с пищей при голодании;
- недостаточное всасывание его в кишечнике по причине различных заболеваний, таких как целиакия и другие энтеропатии;
- частичное или полное отсутствие у пациента тонкой кишки в результате резекции (удаления);
- повышенная потребность в витамине В9 в период беременности и кормления грудью, а также при некоторых формах гемолитических анемий, при эксфолиативном дерматите или в случае инвазии лентеца широкого — при дифиллоботриозе;
- повышенные потери его, например, при гемодиализе;
- хронические гепатиты, цирроз печени;
- хронический панкреатит;
- злоупотребление алкоголем;
- длительный прием некоторых медикаментов – комбинированных пероральных контрацептивов, противосудорожных препаратов, препаратов, замедляющих обмен веществ.
Причинами недостатка в организме цианокобаламина являются:
- вегетарианство;
- полипоз или рак дна желудка;
- хронический гастрит А;
- частичное или полное удаление желудка;
- синдром Золлингера-Эллисона;
- беременность и период кормления грудью;
- глистная инвазия;
- энтеропатии, в частности, целиакия;
- резекция тонкой кишки;
- болезнь Крона;
- цирроз печени и хронические гепатиты;
- недостаток фермента – транскобаламина II.
При дефиците в организма витаминов В9 и В12 нарушается синтез в клетках генетического материала – ДНК и РНК. Больше других при этом страдают клетки костного мозга и эпителия пищеварительного тракта – то есть клетки с высокой скоростью обновления. Клетки-предшественники эритроцитов теряют способность к дифференцировке (переходу из более молодых к более зрелым формам), однако их цитоплазма развивается, как и раньше: в результате образуются клетки огромных размеров, называемые мегалобластами.
Витамин В12 в организм человека поступает со всевозможными продуктами животного происхождения. Попадая в желудок, он связывается с особым веществом – гастромукопротеином, с которым продвигается по пищеварительному тракту далее – в тонкую кишку, где и всасывается. Суточная потребность в витамине В12 равна 3-7 мкг. Запасы его имеются в печени и составляют 3-5 мг. Потребность в фолиевой кислоте выше – 100 мкг в сутки, но и попадает в организм ее больше – при стандартной диете – 300-750 мкг. Запасы же витамина В9 составляют 5-10 мг.
Состоит витамин В12 из 2-х важных частей – коферментов. При недостатке первого нарушается синтез ДНК – нарушается созревание эритроидных клеток – формируется мегалобластный тип кроветворения. Помимо эритроцитов нарушается формирование лейкоцитов и тромбоцитов, однако эти изменения выражены в меньшей степени.
Также дефицит первого кофермента приводит к нарушению синтеза незаменимой аминокислоты – метионина, отвечающей за нормальную работу нервной системы. Вследствие недостатка второго кофермента в организме нарушается обмен жирных кислот – накапливаются токсичные вещества, частично поражающие спинной мозг – развивается состояние, называемое фуникулярный миелоз.
Подавляющее число мегалобластных анемий – В12-дефицитные. Клинические проявления их можно объединить в 4 группы – признаки поражения пищеварительного тракта, симптомы фуникулярного миелоза, циркуляторно-гипоксический синдром, психо-неврологические расстройства. Рассмотрим подробнее.
1. Признаки поражения пищеварительного тракта (возникают в связи с атрофией слизистой желудка, поражением слизистой верхнего отдела кишечника, недостаточной продукцией ферментов и вызванными этими изменениями нарушениями процессов переваривания и всасывания пищи):
- снижение аппетита;
- полное отвращение к мясной пище;
- пощипывание и боль кончика языка, нарушение вкуса, «лакированный» язык – эти симптомы объединили термином атрофический глоссит Хюнтера;
- тошнота, рвота;
- расстройства стула.
2. Симптомы фуникулярного миелоза:
- головная боль;
- ощущения покалывания, пощипывания, жжения в коже – парестезии;
- ощущение холода;
- шаткая, неустойчивая походка;
- ощущение онемения в конечностях;
- вялость в нижних конечностях;
- ограничение двигательной активности – парезы и, в особо тяжелых случаях, параличи.
3. Циркуляторно-гипоксический синдром:
- выраженная общая слабость;
- быстрая утомляемость;
- одышка при небольшой физической нагрузке или даже в покое;
- сердцебиение;
- разной интенсивности боли в области сердца;
- бледность, иногда – желтушность кожи.
4. Психо-неврологические расстройства:
- раздражительность;
- галлюцинации;
- судороги;
- сложность выполнения простых математических функций.
Заболевание, как правило, протекает в 2 стадии – субклиническую и клиническую. На первой стадии явные признаки гиповитаминоза отсутствуют, а пациенты предъявляют жалобы на легкое недомогание и незначительные диспепсические явления. Несмотря на отсутствие внешних клинических признаков снижение содержания витаминов в крови уже имеется. Когда истощаются запасы витаминов в организме либо же раньше, но после воздействия сильного провоцирующего фактора (например, на фоне психоэмоционального стресса или после серьезного оперативного вмешательства) заболевание вступает во вторую стадию – клиническую.
На фоне мегалобластной анемии обостряются и активно прогрессируют хронические соматические заболевания – стенокардия, аритмии. Появляются отеки.
Стоит отметить особенность течения мегалобластной анемии у пожилых лиц. Данная категория больных даже при достаточно низких значениях гемоглобина жалоб предъявляет мало, в то время как при железодефицитной анемии снижение этого показателя лишь до 110 г/л сопровождается значительным ухудшением состояния больного и множеством жалоб.
Врач заподозрит наличие анемии еще на этапе сбора жалоб, анамнеза и объективного обследования больного.
Обратят на себя внимание следующие изменения:
- бледность, иногда желтушность кожных покровов; цвет кожи при данном заболевании сравнивают с цветом пергамента;
- увеличенный в размере лакированный язык;
- при аускультации сердца – учащение его сокращений – тахикардия, систолический шум;
- при пальпации живота – увеличение селезенки – спленомегалия;
- при неврологическом обследовании – признаки фуникулярного миелоза.
В общем анализе крови отмечается снижение уровня гемоглобина и эритроцитов, повышение цветового показателя выше 1.1 (то есть, анемия – гиперхромная). У некоторых больных параллельно с эритропенией выявляется тромбо- и лейкопения. Также в крови определяются видоизмененные предшественники эритроцитов – мегалобласты, макроциты. Характерен анизоцитоз (изменение размеров клеток) и пойкилоцитоз (изменение их формы). В цитоплазме эритроцитов определяются специфичные элементы – кольца Кеббота и тельца Жолли. Также отмечается ретикулоцитопения.
Уровень витаминов В9 и/или В12 в сыворотке крови, конечно, ниже нормальных значений.
Поскольку мегалобластная анемия нередко сопровождается гемолизом эритроцитов, уровень железа в сыворотке крови не снижен, а находится в пределах нормы или же повышен. По этой же причине в сыворотке крови повышен и уровень свободного билирубина.
Для подтверждения диагноза проводят стернальную пункцию. В пунктате определяется мегалобластная трансформация костного мозга. Важно проводить пункцию до начала терапии больного витамином В12, так как уже через несколько часов после его введения состав костного мозга начинает возвращаться в норму, а через 1-2 суток проявления мегалобластного типа кроветворения исчезают вовсе.
Практически у всех больных помимо описанных выше изменений определяются атрофические изменения слизистой оболочки желудка, сниженное содержание соляной кислоты в нем – гипо- или даже ахлоргидрия.
В целом весь процесс обследования больного на предмет наличия у него мегалобластной анемии можно разделить на 3 этапа:
- Клинический анализ крови, в котором определяются вышеописанные, характерные для данного вида анемии, изменения.
- Определение уровня витаминов В9 и В12, стернальная пункция с последующим исследование пунктата.
- Установление причинного фактора анемии – подробное изучение данных анамнеза, обследование желудка (фиброгастроскопия, определение кислотности и так далее), кишечника, печени, определение наличия или отсутствия гельминтозов (исследование кала). Объем проводимых клинических исследований индивидуален для каждого больного и определяется конкретной клинической ситуацией.
В случае, если определена точная причина – этиологический фактор анемии, главным направление терапии является устранение его. Это может быть дегельментизация (если обнаружены глисты), удаление полипов или другой опухоли желудка хирургическим путем, адекватная терапия болезней кишечника, борьба с алкоголизмом и так далее.
Параллельно проведению этиологического лечения больному следует уделять много внимания питанию. Диета больного с мегалобластной анемией должна включать достаточное количество мясных и молочных продуктов, печени, листовых овощей, фруктов.
Суть патогенетической терапии заключается во введении парентеральным путем витамина В12 – цианокобаламина. Доза, необходимая для лечения, зависит от исходных показателей крови и варьируется в пределах 200-1000 мкг в сутки.

Обычно первый признак гематологической ремиссии появляется через 6-10 дней после начала терапии и представляет собой резкое – до 2-3% – повышение уровня ретикулоцитов. Это явление получило название «ретикулярный криз». В дальнейшем постепенно приходят в норму показатели гемоглобина, эритроцитов, а также лейкоцитов и тромбоцитов, снижается цветовой показатель.
Когда показатели общего анализа крови нормализуются, дозу цианокобаламина снижают до поддерживающей – вводят его по 100-200 мкг раз в 1-2 недели. Если у больного диагностирована анемия Аддисона-Бирмера, витамин В12 ему рекомендован пожизненно.
В отдельных случаях болезни – например, при уже развившемся фуникулярном миелозе – назначаются более высокие дозы витамина В12 – 800-1000 мг каждый день. Снижают дозу препарата лишь тогда, когда не только пришли в норму показатели периферической крови, но и полностью исчезла неврологическая симптоматика данного состояния.
В особо тяжелых клинических ситуациях – когда больной находится в прекоматозном состоянии либо уже впал в кому – ему назначают гемотрансфузии. Как правило, вводят отмытые эритроциты. При доказанном аутоиммунном механизме заболевания (такое имеет место быть у ряда больных) больному показано введение глюкокортикоидов в минимальных лечебных дозировках коротким курсом.
В случае дефицита фолиевой кислоты вводятся препараты, ее содержащие. Суточная доза препарата обычно равна 1-5 мг. Путь введения – пероральный.
Для профилактики рецидива заболевания в дальнейшем больному должны быть назначены профилактические курсы витамина В9, доза его при этом составляет треть от лечебной.
Среди мероприятий, уменьшающих риск развития данного вида анемии, следует отметить рациональное питание – употребление в пищу достаточного количества продуктов, содержащих витамины В9 и В12, борьбу с вредными привычками – в частности, с алкоголизмом, профилактику гельминтозов, своевременное лечение болезней пищеварительного тракта, введение витамина В12 больным после операции по удалению желудка или тонкой кишки.
При условии своевременного начала адекватного лечения прогноз при обоих видах мегалобластной анемии (и В12, и фолиеводефицитной) благоприятный.
Если вас беспокоят описанные выше признаки, или вы уже сдавали кровь и знаете, что у вас какая-то анемия, обратитесь к терапевту. После проведения дополнительной диагностики пациента с мегалобластной анемией направляют к гематологу, который и назначает лечение. Дополнительно часто требуется консультация невролога (при фуникулярном миелозе) и гастроэнтеролога (при нарушении пищеварения). Так как нередкой причиной анемии становятся болезни печени и глистные инвазии — рекомендован осмотр гепатолога и инфекциониста. Большое значение в лечении имеет питание, полезна будет консультация диетолога.
источник
Мегалобластные анемии — большая группа анемий врожденного и приобретенного характера, характеризующаяся изменением морфологии эритроцитов, нарушением синтеза ДНК и РНК в эритрокариоцитах, а также процессов их созревания. Характерной особенностью указанных анемий является возникновение мегалобластического типа кроветворения, при котором в костном мозге появляются мегалобласты с необычным расположением хроматина в ядре, асинхронной дифференцировкой ядра и цитоплазмы.
Наиболее частыми причинами развития мегалобластных анемий являются нарушения метаболизма витамина В12, фолиевой кислоты, дефицит указанных соединений в организме. Комбинированный дефицит витамина В12 и фолиевой кислоты встречается редко.
В12-дефицитные анемии
Прежде всего, необходимо остановиться на метаболической значимости витамина В12,
Витамин В12, относится к группе кобаламинов, содержится в пище животного происхождения: мясе, яйцах, сыре, молоке, печени, почках в комплексной связи с белком. Продукты растительного происхождения не содержат витамин В12. Витамин В12, содержащийся в пище, получил название внешнего фактора, впервые в чистом виде одновременно был выделен в 1948 г. в Великобритании и в США. Для обеспечения всасывания витамина В12, необходим так называемый внутренний фактор — термолабильный гликопротеин с молекулярной массой порядка 50 000–60 000 Да, секретируемый париетальными клетками тела и дна желудка.
В процессе всасывания витамина В12 выделяют несколько стадий. В желудке под действием соляной кислоты витамин В12 высвобождается из пищи и соединяется с R‑белком слюны (транскобаламином I). После расщепления в 12‑перстной кишке R‑белка панкреатическими протеазами витамин В12 связывается с внутренним фактором (ВФ), вырабатываемым париетальными клетками желудка. Связь витамина В12 с ВФ стабилизируется в щелочной среде кишечника и становится устойчивой к действию протеолитических ферментов. Молекулы ВФ-В12 абсорбируются в подвздошной кишке с помощью специальных рецепторов в присутствии ионов кальция. На следующем этапе включается механизм активного транспорта через кишечные клетки. В плазме крови витамин В12, связывается с транспортными белками — транскобаламинами I, II, III, причем транскобаламин I — белок с электрофоретической подвижностью, свойственной (a‑глобулинам, имеет полупериод жизни 9–10 дней и нелегко обменивается с тканями. Между тем связанный с транскобаламином II витамин В12 имеет короткий полупериод жизни, причем транскобаламин II усиливает поглощение витамина В12 клетками различных органов и тканей, в частности эритроцитами. Транскобаламин II является основным транспортным белком для витамина В12, обеспечивая его доставку к костному мозгу.
Дефицит витамина В12, в организме приводит к развитию В12‑дефицитной анемии, описанной впервые в 1849 г. Аддисоном, а затем в 1872 г. — Бирмером, назвавшим ее пернициозной прогрессирующей анемией.
Касаясь этиологических факторов развития В12‑дефицитной анемии, необходимо отметить возможность или недостаточного поступления его в организм, или нарушения процесса его усвоения.
Как известно, суточная потребность витамина В12, для новорожденных составляет 0,5 мкг, для детей в возрасте до 1 года — 1,5 мкг, для мужчин и женщин — 3 мкг, для беременных и кормящих женщин — около 4 мкг (А. Ленинджер, 1985).
В связи с тем, что витамин В12 содержится в разнообразных продуктах, алиментарная недостаточность его встречается редко, при крайнем ограничении диеты, в которой отсутствуют молоко, яйца, масло, мясо и другие продукты животного происхождения. В12‑дефицитные анемии алиментарного происхождения возникают у грудных детей, находящихся на грудном вскармливании, матери которых страдали пернициозной анемией.
Таким образом, в большинстве случаев В12‑дефицитные анемии обусловлены нарушением его всасывания. Принимая во внимание важную роль слизистой желудка в секреции внутреннего фактора, необходимо отметить важную роль в развитии В12‑дефицитной анемии нарушений секреторной активности желудка врожденного или приобретенного характера.
Наиболее частой причиной нарушения всасывания витамина В12 является атрофия слизистой желудка, при которой отсутствует секреция соляной кислоты, пепсина, внутреннего фактора. Причины развития атрофических процессов в слизистой желудка различны: они могут носить наследственный или приобретенный характер. Описана анемия у детей старше 10 лет, характеризующаяся дефицитом внутреннего фактора, гистаминустойчивой ахлоргидрией, атрофией слизистой желудка и наличием антител к внутреннему фактору. Однако в отличие от анемии взрослых у данного контингента детей старше 10 лет отмечается большая частота эндокринных расстройств, проявляющихся идиопатичеоким гипопаратиреозом, гипотиреозом, болезнью Аддисона, недостаточностью яичников. По-видимому, эти сопутствующие нарушения обусловлены генетически детерминированной тенденцией к развитию аутоиммунных заболеваний.
Во многих случаях развития В12‑дефицитной анемии не удается установить ее наследственный характер. У многих больных так называемой пернициозной анемией в сыворотке крови обнаруживают антитела или против цитоплазмы париетальных клеток желудка, или против внутреннего фактора. Нарушение секреции внутреннего фактора может быть следствием воздействия на слизистую желудка различных токсических факторов экзогенной природы, а также субтотальной или тотальной резекции желудка.
Нередко нарушения всасывания витамина В12 обусловлены заболеваниями кишечника также врожденного и приобретенного характера. Недостаточность всасывания витамина В12 в кишечнике отмечается после резекции терминального отдела подвздошной кишки, при тяжелом хроническом энтерите у лиц, перенесших резекцию тощей кишки, при целиакии, при тропической спру. Нарушение всасывания витамина В12, может быть связано с наличием слепой петли, анастомозов и свищей, появляющихся после оперативных вмешательств, что приводит к изменению бактериальной кишечной флоры, и, по-видимому, усилению конкурентного потребления витамина бактериями или интенсивному расщеплению в кишечнике комплекса витамин В12–внутренний фактор. Конкурентный расход витамина В12 отмечен при инвазии широким лентецом.
Таким образом, вышеизложенное позволяет выделить следующие основные этиологические и патогенетические факторы развития В12‑дефицитных анемий:
1. Алиментарный фактор (при резком ограничении диеты, включающей длительное использование лишь продуктов растительного происхождения; у детей, находящихся на грудном вскармливании, матери которых страдают В12‑дефицитной анемией).
2. Гастрогенный фактор (наследственная и приобретенная недостаточность внутреннего фактора — гастромукопротеина, обусловленная нарушением секреторной активности париетальных клеток желудка).
3. Энтерогенный фактор (недостаточность процессов всасывания в дистальном отделе подвздошной кишки врожденного и приобретенного характера).
4. Фактор недостаточности гематогенного транспорта врожденного и приобретенного характера.
Патогенез основных клинических проявлений В12‑дефицитной анемии, гематологическая характеристика.Характерной особенностью В12‑дефицитной анемии является возникновение мегалобластного типа кроветворения, когда нарушается синтез нуклеиновых кислот; созревание и дифференцировка ядра эритрокариоцитов отстают от созревания цитоплазматических структур, в частности гемоглобина. Одновременно нарушается дифференцировка и других клеток миелоидного ряда: мегакариобластов, миелобластов,
Содержание эритроцитов в периферической крови резко снижено, иногда до 0,7 × 10 12 /л, что обусловлено, с одной стороны, снижением осмотической резистентности мегалоцитов, укорочением их сроков циркуляции в периферической крови, а с другой стороны, возрастанием сроков дифференцировки клеток красной крови в костном мозге. Количественные изменения эритроцитов периферической крови при В12‑дефицитной анемии сочетаются с выраженными качественными сдвигами: анизоцитозом и пойкилоцитозом. Эритроциты имеют большие размеры — до 10–12 мкм, нередко овальную форму без центрального просветления, в цитоплазме эритроцитов обнаруживаются остатки ядерного вещества (тельца Жолли) и нуклеолеммы (кольца Кебота), базофильная пунктация. Мегалоциты избыточно насыщены гемоглобином, в связи с чем анемия носит гиперхромный характер. Цветовой показатель может превышать 1,1–1,2. Несмотря на высокий цветовой показатель, общее содержание гемоглобина в крови резко падает в связи с эритропенией. Анемия носит гипорегенераторный характер, содержание ретикулоцитов в крови, как правило, снижено. Нейтрофилы отличаются крупными размерами, нередко возникают гиперсегментоз, нейтропения, сдвиг лейкоцитарной формулы вправо, что свидетельствует о нарушении регенераторной активности костного мозга и в отношении элементов белой крови. Лейкопения в далеко зашедших случаях сочетается и с тромбоцитопенией. В связи с усилением гемолиза эритроцитов нередко увеличивается содержание непрямого билирубина в крови.
Клинические признаки В12‑дефицитной анемии обусловлены нарушением функций кроветворного аппарата, пищеварительной и нервной системы. Помимо комплекса неспецифических симптомов, обусловленных развитием анемии и гемической гипоксии (слабости, быстрой утомляемости, сердцебиения, одышки), у больных появляются признаки глоссита, стоматита, гастрита, желтушность склер, нередко увеличение селезенки, иногда — печени. Развитие воспалительного процесса в желудочно-кишечном тракте может быть не только причиной, но и следствием В12‑дефицитной анемии, в частности: при недостаточности одной из коферментных форм витамина В12 — метилкобаламина, нарушается синтез тетрагидрофолиевой кислоты, тимидинмонофосфата, ДНК, а следовательно, подавляется митотическая активность не только клеток костного мозга, но и слизистой желудочно-кишечного тракта.
Поражение нервной системы у больных с В12‑дефицитной анемией связано с недостаточностью другой коферментной формы витамина — 5‑дезоксиаденозилкобаламина, что приводит к нарушению трансформации метилмалоновой кислоты в янтарную и избыточному накоплению ее. Метилмалоновая кислота в повышенных концентрациях обладает выраженным цитотоксическим, в частности нейротропным, действием. Поражения нервной системы при В12‑дефицитной анемии характеризуются как фуникулярный миелоз, наиболее ранними признаками которого являются парестезии, атаксия, гипорефлексия, появление патологических рефлексов, развитие клонуса и комы. Иногда у больных появляются психические нарушения, бред, галлюцинации.
Не нашли то, что искали? Воспользуйтесь поиском:
источник