Насколько важную роль играет аминокислотная последовательность в формировании вторичной, третичной и четвертичной структур глобулярных белков, а следовательно, и в возникновении у них биологической активности, было особенно наглядно показано на примере серповидноклеточной анемии — наследственного заболевания, связанного с генетической аномалией гемоглобина. У таких больных периодически (чаще под влиянием физической нагрузки) возникают приступы резкой слабости, тошноты и одышки; эти симптомы сопровождаются тахикардией и появлением шумов в сердце. Содержание гемоглобина в крови таких больных резко снижено вдвое против нормы, которая составляет 15-16 г на 100 мл; поэтому и говорят об «анемии» (малокровии).
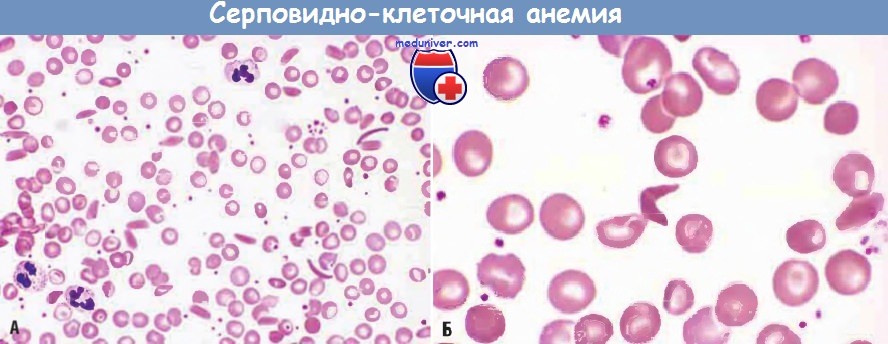
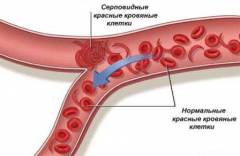
Рис. 8-20. А. Фотография серповидных эритроцитов, полученная при помощи сканирующего электронного микроскопа. Для сравнения в центре помещена нормальная клетка (см. также рис. 8-15). Б. Несколько серповидных клеток причудливой формы, показанные при большом увеличении. В. Электронная микрофотография серповидного эритроцита, снятая в проходящем пучке; видны продольные ряды полимерных молекул серповидноклеточного гемоглобина, придающих клетке необычную форму.
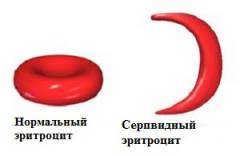
При исследовании крови таких больных обращает на себя внимание не только резкое уменьшение числа эритроцитов, но и неправильная их форма. Наряду с необычно большим количеством незрелых эритроцитов часто попадаются удлиненные и тонкие — серповидные клетки (рис. 8-20). Число таких эритроцитов сильно возрастает при недостатке кислорода в крови. Серповидные клетки очень хрупки, легко разрываются, чем и объясняется низкий уровень гемоглобина у таких больных. Наблюдаются и еще более серьезные последствия: кровеносные капилляры там, где они особенно узки, блокируются удлиненными эритроцитами неправильной формы, что и служит главной причиной ранней смерти во многих случаях этой болезни.
Серповидноклеточная анемия — это генетическая болезнь, при которой больной наследует мутантные гены от обоих родителей. В тех случаях, когда мутантный ген унаследован только от одного из родителей, его обладатель становится носителем признака серповидноклеточности без явных патологических симптомов. При такой форме серповидноклеточности (ею поражено примерно 8% негритянского населения Соединенных Штатов) серповидные эритроциты составляют всего около 1 % их общего числа.
Рис. 8-21. Ассоциация молекул дезоксигемоглобина S. образующих пучки нерастворимых трубчатых нитей, которые придают эритроцитам искаженную серповидную форму.
Люди со скрытой формой серповидноклеточности могут вести вполне нормальный образ жизни, но должны избегать больших физических нагрузок и всякого рода неблагоприятных воздействий на систему кровообращения.
Необычная форма эритроцитов у больных серповидноклеточной анемией обусловлена присутствием в них аномального гемоглобина. Гемоглобин серповидных клеток получил название гемоглобина S, тогда как гемоглобин, содержащийся в эритроцитах нормальных взрослых людей, называется гемоглобином А. При дезоксигенации гемоглобин S становится нерастворимым и образует пучки трубчатых волокон (рис. 8-21), что совершенно несвойственно гемоглобину А, сохраняющему растворимость и после освобождения кислорода. Именно нерастворимые волокна дезоксигемоглобина S приводят к деформации эритроцитов, принимающих серповидную форму.
источник
Гемоглобинопатии (гемоглобинозы).
Гемоглобинопатии занимают одно из первых мест среди наследственных заболеваний крови. Согласно данным ВОЗ в мире насчитывается 100 миллионов носителей аномального гемоглобина. Чаще всего гемоглобинозы возникают у лиц, проживающих в «малярийном поясе» (Африка, Средиземноморье, в России — Закавказье). Примером гемоглобинопатий является серповидно- клеточная анемия.
Серповидноклеточная анемия — аутосомно-рецессивное заболевание, в основе лежат способность гемоглобина менять свою структуру в условиях гипоксии. Наследуемый дефект заключается в том, что в каждой β-цепи в ее 6-ом положении глутаминовая аминокислота заменена на валин (точковая мутация). Такой гемоглобин носит название гемоглобина S.
Патогенез (схема 1).У гемоглобина, отдавшего кислород, обычно снижается растворимость. Но степень снижения растворимости для гемоглобина А и гемоглобина S различна. Гемоглобин А, лишенный кислорода, растворим вдвое меньше, чем гемоглобин А, насыщенный кислородом. Растворимость гемоглобина S, отдавшего кислород, уменьшается в 100 раз. Гемоглобин S переходит в гелеобразное состояние, кристаллизуется, выпадает в осадок в форме серпа — отсюда названии анемии — «серповидноклеточная». Предполагают, что выраженное снижение растворимости отдавшего кислород гемоглобина S связано с тем, что замена глютаминовой кислоты на валин приводит к усилению связи одной молекулы гемоглобина с другой.
Так называемое серпление эритроцитов вначале носит обратимый характер, и гемоглобин после окисления восстанавливается, а эритроциты принимают свою прежнюю форму. Однако повторное серпление приводит и к повреждению эритроцитарной мембраны, и повреждение становится необратимым, несмотря на дезаггрегацию гемоглобина. Нарушается структура и функция мембраны, в частности, в ней повреждаются механизмы фосфорилирования. С повреждением мембраны эритроциты теряют калий и в то же время накапливают кальций. Это приводит к затруднениям в поддержании нормального объема клетки и увеличению ее плотности из-за концентрации гемоглобина. По-видимому, именно нарушения в эритроцитарной мембране и являются причиной окклюзии мелких сосудов и тромбозов при серповидноклеточной анемии.
Замещение глутаминовой аминокислоты на валин в β-цепи
Образование нестабильной (аномальной) молекулы гемоглобина S
Аггрегация и полимеризация гемоглобина под влиянием гипоксии.
Серповидность эритроцитов
Застой серповидных клеток
Ускоренное разрушение эритроцитов
Стазы и микрортромбозы легких и почек
Стимуляция костного мозга гипоксией
и продуктами гемолиза активация эритропоэза
Гиперплазия костного мозга
Болевой синдром с признаками гиперпластического кроветворения
Периферическая кровь и кроветворение. При гемолитических кризах отмечается резкое снижение гемоглобина — до 30-50 г/л., ретикулоцитоз резко выражен — 70-80%, значительно увеличивается содержание железа в сыворотке, что крайне неблагоприятно в плане возникновения гемохроматоза. Выражена гипохромия эритроцитов.
Талассемии (болезнь Кули) –это группа заболеваний с наследственным дефектом темпа синтеза глобиновых цепей, вследствие чего образование ά- и β-цепей не сбалансировано. Кули — американский педиатр, впервые описавший это заболевание.
Различают ά-талассемию и β-талассемию. Для ά-талассемии (талассемия minor) характерно снижение синтеза или полное отсутствие ά-цепей и в гемоглобине превалируют β-цепи. При β-талассемии (талассемия major) не образуются β-цепи и имеется избыток ά-цепей. Последовательность аминокислот в цепях не нарушена. Наиболее распространенной формой является β-талассемия (талассемия major).
Молекулярные основы и клинические варианты β-талассемии.Различают β-талассемию с полным отсутствием продукции β-цепей и с уменьшением их продукции (β°- и β + талассемии).
Патогенез β-талассемии
Мутация в генах синтеза β-цепей глобина.
Избыточная продукция α-цепей
Агрегация и полимеризация избытка α-цепей
Распределение гемоглобина в форме мишени
Нарушение формы эритроцита, повреждение его мембраны
Повышение проницаемости мембран для ионов кальция
Синтез глютамил-лизиновых мостиков
Усиление ригидности мембраны эритроцита
Задержка эритроцитов в селезенке, агрегация в мелких сосудах с тромботическими явлениями, увеличение селезенки,
ишемическое повреждение различных органов
Гиперплазия костного мозга.усиление эритропоэза
Усиление апоптоза клеток-предшественниц эритропоэза
Деформации скелета, болевой синдром
При отсутствии достаточного количества β-цепей α-цепи не находят для себя комплементарные пары, и эти свободные α-цепи быстро преципитируются и образуют нерастворимые включения в костномозговых нормобластах, которые распределяются в форме мишени. Включения эти достаточно ригидны, они способны вызывать механическую травму и повреждения мембран эритрокариоцитов и образующихся из них эритроцитов.
Повреждение мембран костномозговых эритрокариоцитов приводит к потере клеткой калия, нарушения синтеза ДНК в эритробластах, внутрикостномозговому гемолизу эритрокариоцитов-предшественников. Потомство сохранившихся эритрокариоцитов подвергается гемолизу в сосудистом русле. Периферические эритроциты имеет форму мишени, отсюда название анемии – мишеневидная.
Обильное преципитирование α-цепей в костном мозге влечет за собой неэффективный эритропоэз и крайнюю степень гиперплазии костного мозга.
Таким образом в патогенезе β-талассемии, связанный с избытком α-цепей, имеет место неэффективный эритропоэз наслаивается на несостоятельность образования нормального гемоглобина со снижением содержания гемоглобина в клетках (гипохромия) и частичной блокадой синтеза гема (схема 3).
Энзимопатии— гемолитические анемии, обусловленные дефектами эритроцитарных ферментов. Среди них наиболее распространена анемия вследствие недостатка фермента глюкозо-6-фосфатдегидрогеназы. Это наиболее частый вариант энзимопатии. Заболевание передается по аутосомно-рецессивному типу и является краевой патологией, так как оно наиболее распространено в странах Средиземноморья, на Среднем Востоке и среди черного населения Америки (10%).
Существует несколько генетических форм этой энзимопатии, но наиболее значимыми являются те, что приводят к гемолизу эритроцитов. Биологическое значение этой генной аномалии рассматривается как защита организма от малярийного плазмодия.
При этой патологии основным биохимическим дефектом эритроцитов является недостаточный синтез ферментов пентозофосфатного цикла, обеспечивающих ликвидацию перекисных соединений, образующихся на поверхности эритроцита при воздействии на него сильных окислителей.
Среди окислителей преобладают лекарства (противомалярийные препараты, сульфаниламиды, левомицетин, фурацилин, амидопирин) и эндогенные первичные и вторичные оксиданты.
В норме перекисные радикалы инактивируются за счет окисления донатора электронов — восстановленного глютатиона мембраны эритроцита. Для восстановления глютатиона необходимы ионы водорода, источником которых является восстановленная НАДФ. При дефиците глюкозо-6-фосфатдегидрогеназы:
• восстановление НАДФ резко сокращается,
• истощаются запасы восстановленного глютатиона в эритроцитах,
• резко усиливаются окислительные процессы,
• повышается проницаемость мембраны для ионов Na.
Острый гемолиз может возникнуть и у здоровых лиц при попадании в их организм очень сильных окислителей (хлораты, перхлораты). Нужно отметить, что мишенью для гемолиза при этой форме энзимной недостаточности, чаще всего служат стареющие эритроциты, в какой-то мере потерявшие запас этого энзима.
Клиника и гематологические показатели энзимопатий.Клинически проявления обычные для гемолитических анемий. Бледность кожных покровов и желтушность после воздействия провоцирующего фактора. Частый гемолиз может привести к увеличению и легкой болезненности селезенки.
Анемия, как правило, нормохромная, нормоцитарная и регенераторная. При просмотре мазка крови можно обнаружить в эритроцитах включения, носящие название телец Гейнца. Это внутриэритроцитарные кристаллы гемоглобина, образующиеся в результате его окисления и последующей денатурации.
Диагностика заболевания проводится с помощью количественного анализа глюкозо-6-ФДГ в эритроцитах больного.
Приобретенные гемолитические анемии — это группа заболеваний с различным патогенезом. Их объединяет гемолиз эритроцитов в периферической крови (внутрисосудистый гемолиз). По механизму разрушения эритроцитов различают приобретенные гемолитические анемии иммунного и неиммунногохарактера.
Клинические признаки этих анемий, как правило, совпадают, несмотря на разные патогенетические механизмы.
Иммунные гемолитические анемии.Классификация иммунных гемолитических анемий основана на характере вовлекаемых в иммунный гемолиз антител, а их основным диагностическим критерием является выявление антиэритроцитарных антител в антиглобулиновом тесте Кумбса. Этот тест базируется на способности антител, полученных от животных путем их иммунизации человеческим глобулином, агглютинировать эритроциты больного, если на их поверхности имеются глобулины (про-тивоэритроцитарные антитела).
Гемолитическая анемия, вызванная тепловыми (IgG)_антителами. Это наиболее распространенный тип иммунной гемолитической анемии, однако, в 50% случаев она является идиопатической — с нераспознанной этиологией. В остальных 50% случае у больных имеется предрасположенностьк лекарственному гемолизу. Такие лекарства, как пенициллин и цефалоспорины являются гаптенами, но в комбинации с белками мембраны они способны вызывать иммунизацию организма. Эта форма гемолитической анемии обычно возникает после внутривенного введения большой дозы антибиотиков через 1-2 недели после начала терапии. Гибель эритроцитов при лекарственно-зависимых иммуногемолитических анемиях, как правило, происходит внутри сосудов после фиксации на них комплемента, хотя возможно и участие в этом процессе селезенки и гибель эритроцитов по типу АЗКЦ (антителозависимой клеточной цитотоксичности), здесь же происходит и иммунный фагоцитоз эритроцитов.
Наряду с «гаптеновой» моделью гемолиза эритроцитов существет и другая — «модель аутоантител». Некоторые антигипертензивные вещества, например, а-метилдофа, вызывают образование антител, направленных против внутриклеточных компонентов, в частности, против Rh-антигена эритроцитов Приблизительно у 10% больных, получающих этот препарат, обнаруживаются антитела к этому антигену, однако только в 1% случаев у них возникает аутоиммунная гемолитическая анемия.
Иммунная гемолитическая анемия с холодовыми агглютининами (JgM-антитела).Эта форма иммунной гемолитической анемии вызывается антителами, которые приобретают сродство к эритроцитам при низкой температуре (4°С), и поскольку они агглютинируют эритроциты на холоду, называются холодовыми. Эта форма анемии хорошо компенсируется самим организмом и редко проявляется клинически подтвержденным гемолизом. Такого рода антитела постоянно обнаруживаются в крови больных лимопролиферативными заболеваниями, а также при идиопатической форме. Тот факт, что по своей природе они являются моноклональными антителами, предполагает, что заболевания, при которых они обнаруживаются, принадлежат к группе моноклональных гамма-глобулинопатий.
Симптомы анемии (побледнение и цианоз областей, подвергшихся охлаждению) связаны с агглютинацией эритроцитов в присутствии комплемента в дистальных частях тела (конечности), когда их температура снижается ниже 30°С.
Анемия с холодовыми (IgG) гемолизинами. Эти антитела характерны для пароксизмальной холодовой гемоглобинурии, клиническим проявлением которой являются острые приступы массивного гемолиза эритроцитов, часто сопровождающиеся гемоглобинурией после охлаждения больного. Лизис имеет четкий комплементзависимый характер. Случаи пароксизмальной холодовой гемоглобинурии связывают с такими инфекциями, как микоплазменная пневмония, корь, свинка и инфекцией, вызванной респираторными вирусами.
Дата добавления: 2015-07-02 ; Просмотров: 802 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
82.Генные мутации. Сущность и механизм возникновения молекулярно-наследственных болезней человека (фенилкетонурия, серповидно-клеточная анемия и др.)
Генные мутации (точковые) не видны в микроскоп, связаны с изменением структуры гена (генные мутации изменяют последовательность нуклеотидов в молекуле ДНК и ген перестаёт работать). Эти мутации происходят в результате потери нуклеотида, вставки нуклеотида, замены одного нуклеотида другим. Эти мутации могут приводить к генным болезням: дальтонизм, гемофилия. Таким образом, генные мутации приводят к появлению новых признаков. Условно к наследственным болезням можно также отнести болезни, связанные с присутствием в организме некоторых редких вариантов белков (обычно ферментов) и развивающиеся в ответ на более или менее специфические внешнесредовые воздействия, например, на прием некоторых лекарственных средств. В узком смысле под термином «наследственные болезни» понимают моногенные заболевания, т. е. обусловленные мутациями отдельных генов. Многие наследственные болезни проявляются как врожденные состояния. Для наследственных болезней характерно также семейное накопление (заболевание встречается у нескольких членов семьи).
83. Количественная и качественная специфика проявления генов в признаках (пенетрантность, экспрессивность, плейотропия, полигенность). Генокопии, фенокопии. Вклад Н.В. Тимофеева-Ресовского в развитие генетики.
Пенетрантность — способность гена проявить свое действие в фенотипе. Выражается в виде процентного отношения количества организмов, у которых данный ген фенотипически проявляется к общему числу организмов, имеющих этот ген. Если ген проявляется в фенотипе у всех его носителей, то пенетрантность гена равна 100% (полная пенетрантность).
Плейотропия — множественное действие гена, влияние одного гена на возникновение нескольких признаков.
Экспрессивность — качественный показатель фенотипического проявления гена, характеризует степень выраженности признака.
Полигенность — наличие нескольких неаллельных близкосцепленных генов, белковые продукты которых сходны в структурном отношении и выполняют идентичные функции.
Генокопии (лат.genocopia) — это сходные фенотипы, сформировавшиеся под влиянием разных неаллельных генов. То есть это одинаковые изменения фенотипа, обусловленные аллелями разных генов, а также имеющие место в результате различных генных взаимодействий или нарушений различных этапов одного биохимического процесса с прекращением синтеза. Проявляется как эффект определенных мутаций, копирующих действие генов или их взаимодействие.
Фенокопии — изменения фенотипапод влиянием неблагоприятных факторов среды, по проявлению похожие намутации. Вмедицинефенокопии — ненаследственные болезни, сходные с наследственными. Распространенная причина фенокопий у млекопитающих — действие на беременныхтератогеновразличной природы, нарушающихэмбриональное развитиеплода(генотипего при этом не затрагивается). При фенокопиях изменённый под действием внешних факторов признак копирует признаки другого генотипа (например, у человека приём алкоголя во время беременности приводит к комплексу нарушений, которые до некоторой степени могут копировать симптомыболезни Дауна).
Природа генокопий и фенокопий Ряд сходных по внешнему проявлению признаков, в том числе и наследственных болезней, может вызываться различными неаллельными генами. Такое явление называется генокопией. Биологическая природа генокопий заключается в том, что синтез одинаковых веществ в клетке в ряде случаев достигается различными путями. В наследственной патологии человека большую роль играют также фенокопии -модификационные изменения. Они обусловлены тем, что в процессе развития под влиянием внешних факторов признак, зависящий от определенного генотипа, может измениться; при этом копируются признаки, характерные для другого генотипа. В развитии фенокопий могут играть роль разнообразные факторы среды — климатические, физические, химические, биологические и социальные. Врожденные инфекции (краснуха, токсоплазмоз, сифилис) также могут стать причиной фенокопий ряда наследственных болезней и пороков развития. Существование гено- и фенокопий нередко затрудняет постановку диагноза, поэтому существование их врач всегда должен иметь в виду.
Никола́й Влади́мирович Тимофе́ев-Ресо́вский (7 (20) сентября1900года,Москва—28 марта1981 года,Обнинск) —биолог,генетик. Основные направления исследований:радиационная генетика,популяционная генетика, проблемымикроэволюции.
Он положил начало экспериментальной генетике популяций и учению о микроэволюции вместе со своим учителем С.Четвериковым, стал сооснователем радиационной генетики вместе с Г.Дж.Мёллером, внес решающий вклад в основание феногенетики. Развивая идеи своего учителя Н.Кольцова о хромосоме как о макромолекуле и матричном принципе ее воспроизведения, Тимофеев-Ресовский сформулировал принцип ковариантной редупликации, принципы мишени и попадания в радиобиологии, дал оценку размеров гена и совместно с физиками К.Циммером и М.Дельбрюком показал возможность трактовки гена с позиций квантовой механики, тем самым создав фундамент открытия структуры ДНК и всей современной молекулярной биологии. Объединив свои натуралистические и экспериментальные интересы и развивая традиции В.Вернадского и В.Сукачева, он заложил основы радиационной биогеоценологии — науки эры Чернобыля.
источник
Серповидно-клеточная анемия представляет собой довольно частую наследственную гемоглобинопатию, возникающую в основном у лиц с темным цветом кожи. Известно несколько сотен различных гемоглобинопатий, обусловленных мутациями генов глобина, но заслуживают обсуждения лишь те, которые ассоциируются с серповидно-клеточной анемией. Напомним, что гемоглобин (Hb) является тетрамерным белком, состоящим из двух пар цепей глобина, каждая из которых имеет свою группу гема.
Нормальные зрелые эритроциты содержат главным образом гемоглобин А (HbA; а2b2), а также некоторое количество гемоглобина А2 (HbА2; a2δ2) и фетального гемоглобина (HbF; а2γ2). Серповидно-клеточная анемия возникает в результате точечной мутации в кодоне 6 гена b-глобина, приводящей к замене остатка глутамата остатком валина. За развитие заболевания ответственны измененные физико-химические свойства образующегося гемоглобина S (HbS; a2bs2).
Около 8-10% лиц с темным цветом кожи гетерозиготны по HbS (в США 2 млн человек). Это в основном бессимптомное состояние, известное как признак серповидно-клеточности. Дети двух гетерозигот имеют шанс 1 : 4 родиться гомозиготами по данной мутации, т.е. с симптоматической серповидно-клеточной анемией. У таких индивидов почти весь гемоглобин в эритроцитах является HbS. В США насчитывают 70 тыс. лиц с серповидно-клеточной анемией. В некоторых популяциях в Африке число гетерозигот достигает 30%. Вероятно, столь высокие цифры являются следствием защиты, создаваемой HbS от малярии, вызываемой Р. falciparum.
а) Патогенез. Молекулы HbS полимеризуются при деоксигенации. По мере образования агрегатов HbS цитозоль эритроцитов сначала превращается из свободно текущей жидкости в вязкий гель. При продолжающейся деоксигенации агрегаты HbS формируют в эритроцитах длинные, похожие на иглы волокна, вследствие чего образуются серповидные или похожие на листья падуба (остролиста) эритроциты.
Присутствие HbS лежит в основе главных патологических проявлений серповидно-клеточной анемии:
(1) хронического гемолиза;
(2) окклюзии микрососудов;
(3) повреждения тканей.
На скорость развития и тяжесть заболевания влияют различные факторы:
— взаимодействие HbS с другими типами гемоглобина в эритроците. У гетерозигот с признаком серповидно-клеточности « 40% гемоглобина представлено HbS, а оставшаяся часть — HbA, который препятствует полимеризации HbS. В результате эритроциты у гетерозигот не являются серповидными, исключая состояние глубокой гипоксии. HbF ингибирует полимеризацию HbS в еще большей степени, чем HbА, поэтому у детей симптомы не наблюдаются до возраста 5-6 мес, когда наступает естественное падение уровня HbF. Однако у некоторых индивидов уровень экспрессии HbF остается достаточно высоким — состояние, известное как наследственная персистенция HbF.
У таких пациентов серповидно-клеточная анемия гораздо менее тяжелая. Существует и другой вариант гемоглобина — HbС, у которого лизин замещен глутамином в позиции 6 аминокислотной последовательности гена b-глобина. В эритроцитах с HbSC содержание HbS составляет 50% по сравнению с 40% HbS в эритроцитах с HbAS. Кроме того, эритроциты с HbSC имеют тенденцию утрачивать соли и воду и становиться дегидратированными, что повышает внутриклеточную концентрацию HbS. Оба эти фактора усиливают тенденцию к полимеризации HbS. Вследствие этого у лиц с HbSC развивается симптоматическое серповидно-клеточное расстройство (гемоглобинопатия HbSC), менее тяжелое, чем серповидно-клеточная анемия. Примерно 1 из 1250 человек имеет гемоглобинопатию HbSC. Около 2-3% лиц с темным цветом кожи гетерозиготны по HbС и не имеют симптомов;
— средняя концентрация гемоглобина в эритроците. Более высокие концентрации HbS повышают вероятность агрегации и полимеризации во время деоксигенации. Так, дегидратация, увеличивающая среднюю концентрацию гемоглобина в эритроците, облегчает образование серповидных эритроцитов. И наоборот, условия, снижающие среднюю концентрацию гемоглобина в эритроците, уменьшают тяжесть заболевания. Это происходит, когда индивид гомозиготен по HbS, но также одновременно присутствует а-талассемия, снижающая синтез Hb, что приводит к более мягкому течению серповидно-клеточной анемии;
— внутриклеточный pH. Снижение pH уменьшает аффинность гемоглобина к кислороду, тем самым увеличивая фракцию деоксигенированного HbS при любом уровне напряжения кислорода и усиливая тенденцию к образованию серповидных форм;
— время перехода эритроцитов по микрососудам. Как будет указано далее, значительная часть патологических явлений при серповидно-клеточной анемии обусловлена микрососудистой окклюзией, вызванной серповидными эритроцитами. Время перемещения клеток в нормальных микрососудах слишком мало для значительной агрегации деоксигенированного HbS, поэтому образование серповидных форм идет там, где переход совершается медленно, — в нормальной селезенке и костном мозге (которые в результате этого существенно повреждаются при серповидно-клеточной анемии), а также в сосудистом ложе на фоне воспаления. Ток крови через воспаленные ткани замедляется вследствие адгезии эритроцитов и лейкоцитов к активированным эндотелиальным клеткам и выхода жидкости через сосуды с повышенной проницаемостью в результате воспаления. Вследствие этого сосудистое ложе склонно к формированию серповидных форм и окклюзии. Серповидные эритроциты могут усиленно экспрессировать некоторые молекулы адгезии, участвующие в связывании с эндотелиальными клетками.
Есть также данные о том, что серповидные эритроциты способны в определенной степени активировать эндотелий, что может содействовать адгезии эритроцитов и гранулоцитов, гипоксии, индуцированной окклюзией сосудов, и другим изменениям.
Образование серповидных форм обусловлено кумулятивным повреждением эритроцитов разными механизмами. По мере усиления полимеризации HbS выпячиваются через скелет мембраны из клетки, покрытой только липидным бислоем. Это серьезное нарушение скелета мембраны вызывает приток Са2+, индуцирующих перекрестное связывание мембранных белков и активирующих ионные каналы, через которые происходит отток К+ и воды. В случае повторных эпизодов болезни эритроциты становятся все более дегидратированными, плотными и ригидными. В итоге наиболее поврежденные клетки превращаются в необратимо серповидные эритроциты (сохраняющие серповидную форму даже при полной оксигенации). Тяжесть гемолиза коррелирует с процентом необратимо серповидных эритроцитов, которые быстро секвестрируются и удаляются мононуклеарными фагоцитами (внесосудистый гемолиз). Серповидные эритроциты также нестойки при механических воздействиях, что приводит к внутрисосудистому гемолизу определенной степени.
Патогенез микрососудистой окклюзии, ответственной за наиболее серьезные клинические проявления, менее изучен. Микрососудистая окклюзия не связана с количеством необратимо серповидных эритроцитов в крови, а может зависеть от ультраструктурных повреждений мембраны эритроцитов и других факторов, в частности воспаления, замедляющего или останавливающего перемещение эритроцитов через микрососудистое ложе. Как указано ранее, серповидные эритроциты экспрессируют более высокий, чем в норме, уровень молекул адгезии и обладают адгезивными свойствами. Медиаторы, высвобождаемые гранулоцитами в ходе воспалительной реакции, повышают экспрессию молекул адгезии эндотелиальными клетками и еще больше усиливают тенденцию эритроцитов задерживаться во время перехода по микрососудам. О возможной роли воспалительных клеток свидетельствует тот факт, что количество лейкоцитов коррелирует с частотой вазоокклюзионных кризов и других проявлений повреждений тканей. Застой эритроцитов в воспаленном сосудистом ложе приводит к длительному снижению напряжения кислорода, образованию серповидных форм и микрососудистой окклюзии.
Начинается цепь событий, создающих порочный круг: образование серповидных эритроцитов, обструкция, гипоксия и дальнейшее формирование серповидных эритроцитов.
Снижение уровня оксида азота (NO) также играет определенную роль в сосудистой окклюзии. Свободный гемоглобин, высвобождаемый из лизированных серповидных эритроцитов, может связывать и инактивировать NO, обладающий свойствами сильного вазодилататора и ингибитора агрегации тромбоцитов. Снижение уровня NO повышает сосудистый тонус (происходит сужение сосудов) и усиливает агрегацию тромбоцитов. Оба эффекта способствуют стазу, формированию серповидных эритроцитов и тромбозу (в некоторых случаях).
(А) При малом увеличении видны серповидные клетки, анизоцитоз и пойкилоцитоз.
(Б) При большом увеличении можно видеть в центре необратимо серповидную клетку.
б) Морфология. При полностью развившейся серповидно-клеточной анемии в периферической крови обнаруживаются значительное количество серповидных клеток, ретикулоцитоз и клетки-мишени (названные так потому, что гемоглобин скапливается в центре клеток), образующиеся в результате дегидратации эритроцитов. В некоторых эритроцитах также присутствуют тельца Хауэлла-Жолли (мелкие темные остатки ядра) вследствие асплении. Костный мозг гиперпластичный в результате компенсаторной эритроидной гиперплазии. Экспансия костного мозга приводит к костной резорбции и вторичному остеогенезу, что проявляется деформациями костей черепа. Также возможен экстрамедуллярный гемопоэз. Повышенное расщепление гемоглобина способно вызвать образование пигментных желчных камней и гипербилирубинемию.
В раннем детстве селезенка увеличивается до 500 г вследствие застоя крови в красной пульпе, обусловленного накоплением серповидных эритроцитов в тяжах и синусоидах. Однако со временем хронический стаз эритроцитов приводит к инфарктам селезенки, фиброзу и прогрессирующему сморщиванию органа, и уже в подростковом возрасте или у молодых взрослых от селезенки остается лишь незначительное количество фиброзной ткани. Этот процесс носит название аутоспленэктомии. Инфаркты, обусловленные сосудистыми окклюзиями, могут происходит во многих других тканях, включая кости, головной мозг, почки, печень, сетчатку глаза и сосуды легких (в последнем случае иногда развивается легочное сердце). У взрослых пациентов застой крови в сосудах подкожно-жировой ткани часто приводит к образованию язв нижних конечностей, у детей это осложнение наблюдается очень редко.
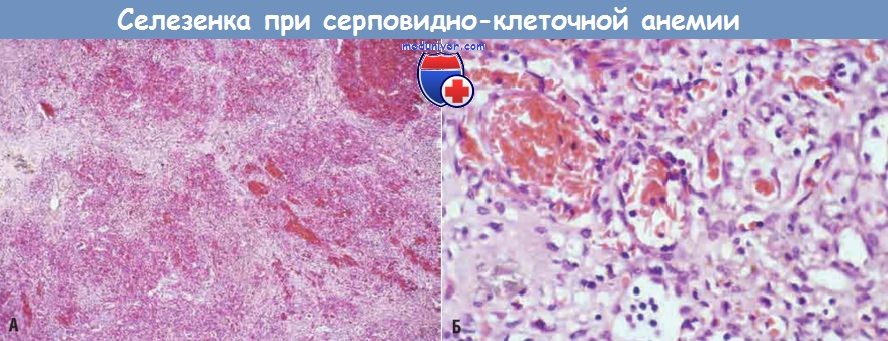
Тяжи красной пульпы и синусоиды заметно застойны; между районами застоя видны светлые участки фиброза, возникшего в результате ишемического повреждения.
(Б) При большом увеличении видны расширенные селезеночные синусоиды, заполненные серповидными эритроцитами.
Воспаление замедляет кровоток в ткани легких, что приводит к образованию серповидных эритроцитов и сосудистой окклюзии. Функция легких нарушается, и создается потенциально фатальный порочный круг: усиление легочной и системной гипоксемии ведет к образованию серповидных эритроцитов, что, в свою очередь, усиливает гипоксемию. Другие формы сосудистой окклюзии, особенно инсульт, также могут стать жизнеугрожающими состояниями. Предрасполагающими факторами служат адгезия серповидных эритроцитов к эндотелию артерий и вазоконстрикция, обусловленная связыванием NO свободным гемоглобином. Вазоокклюзионные кризы представляют собой наиболее частую причину смерти пациентов, но течение заболевания осложняют и другие острые процессы.
Секвестрационные кризы наблюдаются у детей с интактной селезенкой. Значительное накопление серповидных эритроцитов приводит к быстрому увеличению селезенки, гиповолемии, иногда к шоку. В некоторых случаях эти осложнения могут привести к летальному исходу. При секвестрационном кризе и остром грудном синдроме необходима экстренная обменная гемотрансфузия.
Апластические кризы происходят в результате инфицирования клеток-предшественников эритроцитов парвовирусом В19, вызывающим временное прекращение эритропоэза, в результате которого анемия утяжеляется.
Помимо неблагоприятного воздействия кризов отрицательное влияние, хотя и не сразу замечаемое, оказывает хроническая системная гипоксия. Она ответственна за нарушение роста и развития организма, а также повреждение органов, включая селезенку, сердце, почки и легкие. Образование серповидных эритроцитов на фоне повышенного давления в мозговом веществе почек вызывает повреждения, приводящие со временем к гипостенурии (неспособности концентрировать мочу), которая создает условия для дегидратации с присущим ей риском.
Другой опасностью является повышенная восприимчивость к инфекциям, вызываемым капсульными микроорганизмами. В значительной степени это связано с изменением функций селезенки в результате застоя и замедления кровотока (у детей) или инфарктов (у взрослых). Дефекты неизвестной этиологии альтернативного пути активации системы комплемента также нарушают процесс опсонизации бактерий. Частоту септицемии и менингита, вызываемых Р. pneumoniae и Н. influenzae и являющихся частой причиной смерти (особенно детей), можно снизить с помощью вакцинации и профилактического применения антибиотиков.
Следует подчеркнуть, что существуют различные клинические проявления серповидно-клеточной анемии. Некоторые пациенты страдают от повторных вазоокклюзионных кризов, тогда как у других отмечаются лишь незначительные симптомы. Причины такой широкой вариабельности заболевания неизвестны.
Диагноз ставят на основании клинических признаков и присутствия необратимо серповидных эритроцитов. Подтверждают диагноз различными тестами, с помощью которых выявляют HbS. Образцы крови смешивают с реагентами, потребляющими кислород (например, метабисульфитом), которые в случае присутствия HbS индуцируют образование серповидных эритроцитов. Используют также метод электрофореза, чтобы установить присутствие HbS и исключить серповидно-клеточные гемоглобинопатии, например гемоглобинопатию HbSC. Возможна пренатальная диагностика с помощью анализа фетальной ДНК, получаемой путем амниоцентеза или биопсии хориона.
Прогноз для пациентов с серповидно-клеточной анемией в последние 10-20 лет стал значительно лучше. Около 90% пациентов доживают до 20 лет, а 50% живут дольше 40 лет. Терапия заключается в назначении гидроксимочевины, ингибитора синтеза ДНК. Благоприятные эффекты гидроксимочевины: (1) повышение уровня HbF (механизм неизвестен); (2) противовоспалительный эффект вследствие ингибирования продукции лейкоцитов. Предполагают, что благодаря этим совместным эффектам (а возможно, и другим) вазоокклюзионные кризы удается купировать.

источник
Частота гена серповидноклеточности в некоторых областях Африки достигает 40%. До последнего времени индивиды, гомозиготные по этому гену, погибали, не достигнув зрелости; из этого следует, что высокая частота этого гена в популяции могла сохраниться только под сильным давлением естественного отбора. Джеймс Нил ( J . Neel ) высказал предположение, что гетерозиготное состояние должно давать какие-то преимущества по сравнению с гомозиготным по нормальному либо по дефектному гену. И действительно, Антони Аллисон ( A . Allison ) обнаружил, что носительство признака серповидноклеточности служит защитой от заболевания наиболее тяжелой формой малярии, приводящей обычно к смертельному исходу. Выявлена отчетливая корреляция между распространением малярии и частотой гена серповидноклеточности в Африке (рис. 5.15). Описанный феномен представляет собой типичный случай сбалансированного полиморфизма: гетерозиготы устойчивы в отношении малярии и не страдают от серповидноклеточной анемии, тогда как люди, гомозиготные по нормальному аллелю, восприимчивы к малярии.
Рис. 5.15. Распространение гена серповидноклеточности в Африке. Высокая частота этого гена ограничена районами, где малярия является основной причиной смертности
Сведения о молекулярном механизме возникновения серповидноклеточной анемии позволяют в настоящее время перейти к поиску специфических нетоксичных препаратов, предупреждающих или задерживающих развитие клинической картины заболевания. Поиски ведутся в трех направлениях. Одна группа перспективных средств-это вещества, тормозящие образование волокон из гемоглобина S . В качестве таких стереоспецифических ингибиторов гелеообразования проходят оценку синтетические олигопептиды, последовательность аминокислот в которых соответствует N-концевому участку β S -цепи и другим участкам контактов в молекуле гемоглобина S . Ко второй группе исследуемых веществ относятся соединения, повышающие сродство гемоглобина S к кислороду и тем самым снижающие концентрацию его дезоксиформы. Так, например, цианат проникает в эритроциты и повышает сродство гемоглобина к кислороду путем необратимого карбамоилирования а-аминогрупп. Гемоглобин быстро реагирует с цианатом, потому что НN=С= O (изоциановая кислота) в неионизированной форме является реакционно способным аналогом O =С= O . Вспомним, что концевые аминогруппы гемоглобина участвуют в обратимом связывании С O 2 (разд. 4.15). На использование цианата в лечении серповидноклеточной анемии возлагались большие надежды, пока обширные клинические испытания не выявили его побочных токсических эффектов. Так, у некоторых больных при лечении цианатом развивалось поражение периферических нервов, обусловленное, вероятно, тем, что карбамоилированию подвергаются не только гемоглобин, но и другие белки. Сейчас ведется поиск менее токсичных модификаторов гемоглобина. Третий возможный подход к лечению серповидноклеточной анемии -снижение общей концентрации гемоглобина S в эритроцитах. Этого можно достичь, например, увеличением объема клетки. Поскольку скорость образования волокон из дезоксигемоглобина в очень большой степени зависит от его концентрации, даже незначительное увеличение объема эритроцита оказало бы выраженный лечебный эффект. Отсюда следует, что ионные насосы и каналы эритроцитарной мембраны-это те потенциальные мишени, на которые должно быть направлено действие терапевтических средств, используемых для лечения серповидноклеточной анемии.
При обследовании больных с симптомами серповидноклеточной анемии, а также при проведении электрофоретического анализа гемоглобинов здоровых людей было обнаружено более 100 аномальных гемоглобинов. В северной Европе гетерозиготность по варианту гемоглобина А встречается у 1 человека из 300. Частота любого из мутантных аллелей обычно составляет менее 10 — 4; это на несколько порядков ниже, чем частота гена серповидноклеточности в районах, эндемичных по малярии. Другими словами, большинство аномальных гемоглобинов не дает организму никаких преимуществ в естественном отборе. Как правило, наличие аномальных гемоглобинов либо никак не влияет на здоровье человека, либо оказывается пагубным.
Различают несколько типов аномальных гемоглобинов.
1. Изменена наружная часть молекулы. Почти все замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S представляет собой поразительное исключение.
2. Изменен активный центр. В этом случае в дефектной субъединице не происходит
связывания кислорода, так как структурные изменения вблизи гема непосредственно влияют на связывание кислорода.
3. Изменена третичная структура. Замена аминокислот препятствует возникновению нормальной конформации молекулы. Такие гемоглобины обычно нестабильны.
4. Изменена четвертичная структура. Некоторые мутации, затрагивающие участки области контактов, приводят к потере аллостерических свойств. В результате нарушается сродство таких гемоглобинов к O 2.
Замена проксимального или дистального гистидина в группе гема на тирозин приводит к стабилизации, окисленной (ферри) формы гема, не способной к связыванию кислорода (рис. 5.16). В этом случае ионизированная боковая цепь тирозина образует комплекс с окисленным железом гема. Указанная замена может произойти как в а-, так и в β-цепи. Действительно, были обнаружены все четыре мутантных варианта. Мутантные гемоглобины, у которых два гема в молекуле постоянно находятся в ферри- форме, называют гемоглобином М. Буква М указывает, что мутировавшие цепи находятся в форме метгемоглобина (ферригемоглобина). У людей с гемоглобином М обычно отмечается цианоз. Заболевание встречается только у гетерозиготных особей, поскольку гомозиготность по этому признаку почти всегда приводит к летальному исходу.
Рис. 5.16. Замена проксимального гистидина ( F 8) тирозином приводит к образованию гемоглобина М. Отрицательно заряженный атом кислорода тирозина связывается с атомом железа, находящимся в ферри- форме. В шестое координационное положение встает вода, а не O 2
Еще один тип мутации, затрагивающей активный центр, выражается в том, что в щели, занимаемой гемом, на место неполярной группы становится полярная. Между гемом и полипептидной цепью существует 60 межатомных контактов, причем эти контакты по своей природе неполярны. Поскольку эти неполярные взаимодействия устойчиво сохраняются в нормальных гемоглобинах разных видов животных, можно думать, что большинство из них имеет существенное значение для функционирования молекулы гемоглобина. В самом деле, мутации в участках связывания гема почти всегда приводят к неблагоприятным последствиям. Рассмотрим для примера гемоглобин Hammersmith . На месте фенилаланина CD 1 (рис. 5.17) в этом гемоглобине находится серин. В результате такой замены нарушается связывание гема. Объяснить это можно следующим путем: вероятно, наличие полярного остатка серина способствует тому, что в щель, обычно занимаемую гемом, проникает вода.
Рис. 5.17. Локализация фенилаланина С D 1, одного из инвариантных остатков в гемоглобине. Ароматическое кольцо этого фенилаланина находится в контакте с гемом
источник
Серповидно-клеточная анемия – наследственная гемоглобинопатия, обусловленная синтезом аномального гемоглобина S, изменением формы и свойств эритроцитов крови. Серповидно-клеточная анемия проявляется гемолитическими, апластическими, секвестрационными кризами, тромбозами сосудов, костно-суставными болями и припухлостью конечностей, изменениями скелета, сплено- и гепатомегалией. Диагноз подтверждается по данным исследования периферической крови и пунктата костного мозга. Лечение серповидно-клеточной анемии является симптоматическим, направленным на предупреждение и купирование кризов; может быть показано переливание эритроцитов, прием антикоагулянтов, проведение спленэктомии.
Серповидно-клеточная анемия (S-гемоглобинопатия) – разновидность наследственной гемолитической анемии, характеризующаяся нарушением структуры гемоглобина и присутствием в крови эритроцитов серповидной формы. Заболеваемость серповидно-клеточной анемией распространена, главным образом, в странах Африки, Ближнего и Среднего Востока, Средиземноморского бассейна, Индии. Здесь частота носительства гемоглобина S среди коренного населения может достигать 40%. Любопытно, что больные серповидно-клеточной анемией имеют повышенную врожденную устойчивость к заражению малярией, поскольку малярийный плазмодий не может проникнуть в эритроциты серповидной формы.
В основе серповидно-клеточной анемии лежит генная мутация, обусловливающая синтез аномального гемоглобина S (HbS). Дефект структуры гемоглобина характеризуется заменой глутаминовой кислоты валином в ß-полипептидной цепи. Образующийся при этом гемоглобин S после потери присоединенного кислорода приобретает консистенцию высокополимерного геля и становится в 100 раз менее растворимым, чем нормальный гемоглобин А. В результате этого эритроциты, несущие деоксигемоглобин S, деформируются и приобретают характерную полулунную (серповидную) форму. Измененные эритроциты становятся ригидными, малопластичными, могут закупоривать капилляры, вызывая ишемию тканей, легко подвергаются аутогемолизу.
Наследование серповидно-клеточной анемии происходит по аутосомно-рецессивному типу. При этом, гетерозиготы наследуют дефектный ген серповидно-клеточной анемии от одного из родителей, поэтому, наряду с измененными эритроцитами и HbS, имеют в крови и нормальные эритроциты с HbА. У гетерозиготных носителей гена серповидно-клеточной анемии признаки заболевания возникают лишь в определенных условиях. Гомозиготы наследуют по одному дефектному гену от матери и от отца, поэтому в их крови присутствуют только серповидные эритроциты с гемоглобином S; заболевание развивается рано и протекает тяжело.
Таким образом, в зависимости от генотипа, в гематологии различают гетерозиготную (HbAS) и гомозиготную (HbSS, дрепаноцитоз) форму серповидно-клеточной анемии. К редко встречающимся вариантам заболевания относятся промежуточные формы серповидно-клеточной анемии. Обычно они развиваются у двойных гетерозигот, несущих один ген серповидно-клеточной анемии и другой дефектный ген — гемоглобина C (HbSC), серповидной β-плюс (HbS/β +) или β-0 (HbS/β0) талассемии.
Гомозиготная серповидно-клеточная анемия обычно проявляется у детей к 4-5 месяцу жизни, когда увеличивается количество HbS, а процентное содержание серповидных эритроцитов достигает 90%. В таких случаях раннее возникновение гемолитической анемии у ребенка обуславливает задержку физического и умственного развития. Характерны нарушения развития скелета: башенный череп, утолщение лобных швов черепа в виде гребня, кифоз грудного или лордоз поясничного отдела позвоночника.
В развитии серповидно-клеточной анемии выделяют три периода: I — с 6 месяцев до 2-3 лет, II — с 3 до 10 лет, III — старше 10 лет. Ранними сигналами серповидно-клеточной анемии служат артралгии, симметричное опухание суставов конечностей, боли в груди, животе и спине, желтушность кожи, спленомегалия. Дети с серповидно-клеточной анемией относятся к категории часто болеющих. Степень тяжести течения серповидно-клеточной анемии тесно коррелирует с концентрацией HbS в эритроцитах: чем она выше, тем тяжелее выражена симптоматика.
В условиях интеркуррентной инфекции, стрессовых факторов, обезвоживания, гипоксии, беременности и пр. у больных данным видом наследственной анемии могут развиваться серповидно-клеточные кризы: гемолитический, апластический, сосудисто-окклюзионный, секвестрационный и др.
При развитии гемолитического криза состояние больного резко ухудшается: возникает фебрильная лихорадка, в крови повышается непрямой билирубин, усиливается желтушность и бледность кожных покровов, появляется гематурия. Стремительный распад эритроцитов может привести к анемической коме. Апластические кризы при серповидно-клеточной анемии характеризуются угнетением эритроидного ростка костного мозга, ретикулоцитопенией, снижением гемоглобина.
Следствием депонированием крови в селезенке и печени служат секвестрационные кризы. Они сопровождаются гепато- и спленомегалией, сильными болями в животе, резкой артериальной гипотонией. Сосудисто-окклюзионные кризы протекают с развитием тромбоза сосудов почек, ишемии миокарда, инфаркта селезенки и легких, ишемического приапизма, окклюзии вен сетчатки, тромбоза мезентериальных сосудов и др.
Гетерозиготные носители гена серповидно-клеточной анемии в обычных условиях ощущают себя практически здоровыми. Морфологически измененные эритроциты и анемия у них возникают только в ситуациях, связанных с гипоксией (при тяжелой физической нагрузке, авиаперелетах, восхождении в горы и др.). Вместе с тем, остро развившийся гемолитический криз при гетерозиготной форме серповидно-клеточной анемии может иметь летальный исход.
Хроническое течение серповидно-клеточной анемии с повторными кризами приводит к развитию целого ряда необратимых изменений, нередко становящихся причиной гибели больных. Примерно у трети больных отмечается аутоспленэктомия – сморщивание и уменьшение размеров селезенки, вызванное замещением функциональной ткани рубцовой. Это сопровождается изменением иммунного статуса больных серповидно-клеточной анемией, более частым возникновением инфекций (пневмонии, менингита, сепсиса и др.).
Исходом сосудисто-окклюзионных кризов могут стать ишемические инсульты у детей, субарахноидальные кровоизлияния у взрослых, легочная гипертензия, ретинопатия, импотенция, почечная недостаточность. У женщин с серповидно-клеточной анемией отмечается позднее становление менструального цикла, склонность к самопроизвольному прерыванию беременности и преждевременным родам. Следствием ишемии миокарда и гемосидероза сердца служит возникновение хронической сердечной недостаточности; повреждения почек — хронической почечной недостаточности.
Длительный гемолиз, сопровождаемый избыточным образованием билирубина, приводит к развитию холецистита и желчнокаменной болезни. У больных серповидно-клеточной анемией часто возникают асептические некрозы костей, остеомиелит, язвы голеней.
Диагноз серповидно-клеточной анемии выставляется гематологом на основании характерных клинических симптомов, гематологических изменений, семейно-генетического исследования. Факт наследования ребенком серповидно-клеточной анемии может быть подтвержден еще на этапе беременности с помощью биопсии ворсин хориона или амниоцентеза.
В периферической крови отмечается нормохромная анемия (1-2х1012/л), снижение гемоглобина (50-80 г/л), ретикулоцитоз (до 30%). В мазке крови обнаруживаются серповидно измененные эритроциты, клетки с тельцами Жолли и кольцами Кабо. Электрофорез гемоглобина позволяет определить форму серповидно-клеточной анемии – гомо- или гетерозиготную. Изменение биохимических проб крови включает гипербилирубинемию, увеличение содержания сывороточного железа. При исследовании пунктата костного мозга выявляется расширение эритробластического ростка кроветворения.
Дифференциальная диагностика направлена на исключение других гемолитических анемий, вирусного гепатита А, рахита, ревматоидного артрита, туберкулеза костей и суставов, остеомиелита и др.
Серповидно-клеточная анемия относится к категории неизлечимых болезней крови. Таким пациентам требуется пожизненное наблюдение гематолога, проведение мероприятий, направленных на предупреждение кризов, а при их развитии – проведение симптоматической терапии.
В период развития серповидно-клеточного криза требуется госпитализация. С целью быстрого купирования острого состояния назначается кислородотерапия, инфузионная дегидратация, введение антибиотиков, обезболивающих средств, антикоагулянтов и дезагрегантов, фолиевой кислоты. При тяжелом течении обострений показано переливание эритроцитарной массы. Проведение спленэктомии не способно повлиять на течение серповидно-клеточной анемии, однако может на время уменьшить проявления заболевания.
Прогноз гомозиготной формы серповидно-клеточной анемии неблагоприятный; большая часть пациентов погибает в первое десятилетие жизни от инфекционных или тромбоокклюзионных осложнений. Течение гетерозиготных форм патологии гораздо более обнадеживающее.
Для предупреждения быстро прогрессирующего течения серповидно-клеточной анемии следует избегать провоцирующих условий (обезвоживания, инфекций, перенапряжения и стрессов, экстремальных температур, гипоксии и пр.). Детям, страдающим данной формой гемолитической анемии, в обязательном порядке показана вакцинация против пневмококковой и менингококковой инфекции. При наличии в семье больных серповидно-клеточной анемией необходима медико-генетическая консультация для оценки риска развития заболевания у потомства.
источник

Серповидноклеточная анемия (СКА) является наиболее тяжелой формой наследственных гемоглобинопатий (генетически обусловленных нарушений строения гемоглобина). Серповидные эритроциты быстро разрушаются в организме, а также закупоривают множество сосудов по всему организму, что может стать причиной тяжелых осложнений и даже смерти.
Данное заболевание крови широко распространено в странах Африки и является частой причиной смерти лиц негроидной расы. Это связано с широким распространением малярии в данном регионе (инфекционного заболевания, поражающего эритроциты человека). Ввиду миграции населения и смешивания этнических групп сегодня данный вид анемии может встречаться у людей любой расы в самых различных регионах мира. Мужчины и женщины болеют одинаково часто.
Интересные факты
- Первое документированное упоминание о серповидноклеточной анемии датируется 1846 годом.
- Около 0,5% населения Земли являются здоровыми носителями гена серповидноклеточной анемии.
- Как больные серповидноклеточной анемией, так и бессимптомные носители мутантного гена практически невосприимчивы к малярии. Это связано с тем, что возбудитель малярии (малярийный плазмодий) способен поражать только нормальные эритроциты.
- На сегодняшний день серповидноклеточная анемия считается неизлечимым заболеванием, однако при адекватном лечении больные люди могут доживать до глубокой старости и иметь детей.
Внутреннее пространство эритроцита почти полностью заполнено гемоглобином – особым белково-пигментным комплексом, состоящим из белка глобина и железосодержащего элемента – гема. Именно гемоглобин играет главную роль в транспорте газов в организме.
Каждый эритроцит содержит, в среднем, 30 пикограмм (пг) гемоглобина, что соответствует 300 миллионам молекул данного вещества. Молекула гемоглобина состоит из двух альфа (а1 и а2) и двух бета (b1 и b2) белковых цепей глобина, которые образуются путем соединения множества аминокислот (структурных компонентов белков) в строго определенной последовательности. В каждой цепи глобина находится молекула гема, включающая в себя атом железа.
Образование глобиновых цепей запрограммировано генетически и контролируется генами, расположенными в различных хромосомах. Всего в организме человека 23 пары хромосом, каждая из которых представляет собой длинную и компактную молекулу ДНК (дезоксирибонуклеиновой кислоты), которая включает в себя огромное число генов. Избирательная активация того или иного гена приводит к синтезу определенных внутриклеточных белков, которые в конечном итоге и определяют структуру и функцию каждой клетки организма.
За синтез а-цепей глобина ответственны четыре гена с 16 пары хромосом (ребенок получает по 2 гена от каждого из родителей, а синтез каждой цепи контролируется двумя генами). В то же время синтез b-цепей контролируется только двумя генами, расположенными в 11 паре хромосом (каждый ген отвечает за синтез одной цепи). К каждой образовавшейся цепи глобина присоединяется гем, в результате чего формируется полноценная молекула гемоглобина.
Важно отметить, что кроме альфа-цепей и бета-цепей, в эритроцитах могут образовываться и другие цепи глобина (дельта, гамма, сигма). Их комбинации приводят к образованию различных видов гемоглобина, что характерно для определенных периодов развития человека.
В организме человека определяется:
- HbA. Нормальный гемоглобин, состоящий из двух альфа и двух бета-цепей. В норме данная форма составляет более 95% гемоглобина взрослого человека.
- HbA2. Малая фракция, в норме составляющая не более 2% всего гемоглобина взрослого человека. Состоит из двух альфа и двух сигма-цепей глобина.
- HbF (фетальный гемоглобин). Данная форма состоит из двух альфа и двух гамма-цепей и преобладает в период внутриутробного развития плода. Она обладает большим сродством к кислороду, что обеспечивает тканевое дыхание ребенка в период рождения (когда доступ кислорода из организма матери ограничен). У взрослого человека доля HbF не превышает 1 – 1,5% и встречается в 1 – 5% эритроцитов.
- HbU (эмбриональный гемоглобин). Начинает образовываться в эритроцитах со 2 недели после зачатия и полностью замещается фетальным гемоглобином после начала кроветворения в печени.
Транспортная функция эритроцитов обусловлена наличием атомов железа в составе гемоглобина. При прохождении через легочные капилляры железо присоединяет к себе молекулы кислорода и транспортирует их ко всем тканям организма, где происходит отделение кислорода от гемоглобина и переход его в клетки различных органов. В живых клетках кислород принимает участие в клеточном дыхании, а побочным продуктом данного процесса является углекислый газ, который выделяется из клеток и также связывается с гемоглобином.
При повторном прохождении через легочные капилляры углекислый газ отсоединяется от гемоглобина и выделяется из организма с выдыхаемым воздухом, а к освободившемуся железу присоединяются новые молекулы кислорода.
Образование эритроцитов (эритропоэз) впервые отмечается на 19 день эмбрионального развития в желточном мешке (особом структурном компоненте эмбриона). По мере роста и развития человеческого организма кроветворение происходит в различных органах. Начиная с 6 недели внутриутробного развития основным местом образования эритроцитов являются печень и селезенка, а на 4 месяце появляются первые очаги кроветворения в красном костном мозге (ККМ).
Красный костный мозг представляет собой совокупность стволовых кроветворных клеток, расположенных в полостях костей организма. Больше всего вещества ККМ находится в губчатых костях (костях таза, черепа, тел позвонков), а также в длинных трубчатых костях (плеча и предплечья, бедра и голени). Постепенно доля кроветворения в ККМ увеличивается. После рождения ребенка кроветворная функция печени и селезенки угнетается, и костный мозг становится единственным местом образования эритроцитов и других клеток крови – тромбоцитов, обеспечивающих свертываемость крови, и лейкоцитов, выполняющих защитную функцию.
Все клетки крови образуются из так называемых стволовых клеток, которые появляются в организме плода на раннем этапе эмбрионального развития в небольшом количестве. Данные клетки считаются практически бессмертными и уникальными. Они содержат ядро, в котором располагается ДНК, а также множество других структурных компонентов (органоидов), необходимых для роста и размножения.
В скором времени после образования стволовая клетка начинает делиться (размножаться), в результате чего появляется множество ее клонов, которые дают начало другим клеткам крови.
Из стволовой клетки образуется:
- Клетка-предшественница миелопоэза. Эта клетка схожа со стволовой, но обладает меньшим потенциалом к дифференцировке (приобретению специфических функций). Под влиянием различных регуляторных факторов она может начать делиться, при этом происходит постепенная утрата ядра и большинства органоидов, а результатом описанных процессов является образование эритроцитов, тромбоцитов или лейкоцитов.
- Клетка-предшественница лимфопоэза. Данная клетка обладает еще меньшей способностью к дифференцировке. Из нее образуются лимфоциты (разновидность лейкоцитов).
Процесс дифференцировки (превращения) клетки-предшественницы миелопоэза в эритроцит стимулируется особым биологическим веществом – эритропоэтином. Он выделяется почками, если ткани организма начинают испытывать недостаток в кислороде. Эритропоэтин усиливает образование эритроцитов в красном костном мозге, их количество в крови повышается, что увеличивает доставку кислорода к тканям и органам.
Эритропоэз в красном костном мозге длится около 4 – 6 дней, после чего в кровоток выделяются ретикулоциты (молодые формы эритроцитов), которые в течение суток окончательно созревают, превращаясь в нормальные эритроциты, способные выполнять транспортную функцию.
Средняя продолжительность жизни нормального эритроцита оставляет 100 – 120 дней. Все это время они циркулируют в крови, постоянно изменяясь и деформируясь при прохождении через капилляры органов и тканей. С возрастом происходит уменьшение пластических свойств эритроцитов, они становятся более округлыми и утрачивают способность к деформации.
В норме небольшая доля красных клеток крови разрушается в красном костном мозге, в печени или непосредственно в сосудистом русле, однако абсолютное большинство стареющих эритроцитов разрушается в селезенке. Ткань данного органа представлена множеством синусоидных капилляров, имеющих в своих стенках узкие щели. Нормальные эритроциты без труда проходят через них, после чего возвращаются в кровоток. Старые эритроциты менее пластичны, в результате чего они застревают в синусоидах селезенки и разрушаются специальными клетками данного органа (макрофагами). Кроме того, изъятию из кровообращения и разрушению подвергаются эритроциты с нарушенной структурой (как при серповидноклеточной анемии) либо зараженные различными вирусами или микроорганизмами.
В результате разрушения эритроцитов, образуется и выделяется в кровоток пигмент желтого цвета – билирубин (непрямой, несвязанный). Это вещество плохо растворяется в воде. С током крови оно переносится в клетки печени, где связывается с глюкуроновой кислотой – образуется связанный, или прямой, билирубин, который включается в состав желчи и выделяется с калом. Часть его всасывается в кишечнике и выделяется с мочой, придавая ей желтоватый оттенок.
Железо, входящее в состав гема, также выделяется в кровоток при разрушении эритроцитов. В свободной форме железо токсично для организма, поэтому оно быстро связывается со специальным белком плазмы – трансферрином. Трансферрин переносит железо в красный костный мозг, где оно вновь используется для синтеза эритроцитов.
Артериальная кровь, оттекающая от легких, насыщена кислородом, поэтому никаких изменений в структуре гемоглобина не происходит. На тканевом уровне молекулы кислорода переходят в клетки различных органов, что приводит к полимеризации гемоглобина и образованию серповидных эритроцитов.
На начальных этапах заболевания данный процесс обратим — при повторном прохождении через легочные капилляры кровь насыщается кислородом, и эритроциты приобретают свою нормальную форму. Однако такие изменения повторяются каждый раз, когда эритроциты проходят через различные ткани и отдают им кислород (сотни или даже тысячи раз в день). В результате этого строение мембраны эритроцитов нарушается, повышается ее проницаемость для различных ионов (из клетки выходит калий и вода), что привод к необратимому изменению формы эритроцитов.
Пластические способности серповидного эритроцита значительно снижены, он не способен обратимо деформироваться при прохождении через капилляры и может закупоривать их. Нарушение кровоснабжения различных тканей и органов обуславливает развитие тканевой гипоксии (недостатка кислорода на тканевом уровне), что приводит к образованию еще большего количества серповидных эритроцитов (образуется так называемый порочный круг).
Мембрана серповидных эритроцитов отличается повышенной ломкостью, в результате чего продолжительность их жизни значительно укорачивается. Уменьшение общего количества эритроцитов в крови, а также местные нарушение кровообращения на уровне различных органов (в результате закупорки сосудов) стимулирует образование эритропоэтина в почках. Это усиливает эритропоэз в красном костном мозге и может частично или полностью компенсировать проявления анемии.
Важной отметить, что HbF (состоящий из альфа-цепей и гамма-цепей), концентрация которого в некоторых эритроцитах достигает 5 – 10%, не подвергается полимеризации и предотвращает серповидную трансформацию эритроцитов. Клетки с малым содержанием HbF подвергаются изменениям в первую очередь.
Половые клетки мужчины и женщины содержат в себе по 23 хромосомы. В процессе оплодотворения происходит их слияние, в результате чего образуется качественно новая клетка (зигота), из которой и начинает развиваться плод. Ядра мужских и женских половых клеток также сливаются между собой, восстанавливая, таким образом, полноценный набор хромосом (23 пары), присущий клеткам человеческого организма. При этом ребенок наследует генетический материал от обоих родителей.
Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу, то есть, чтобы родился больной ребенок, он должен унаследовать мутантные гены от обоих родителей.
В зависимости от набора генов, полученных от родителей, может родиться:
- Ребенок, больной серповидноклеточной анемией. Такой вариант возможен в том и только в том случае, если и отец, и мать ребенка больны данным заболеванием либо являются его бессимптомными носителями. При этом ребенок должен унаследовать по одному дефектному гену от обоих родителей (гомозиготная форма заболевания).
- Бессимптомный носитель. Данный вариант развивается в том случае, если ребенок наследует один дефектный и один нормальный ген, который кодирует образование нормальных цепей глобина (гетерозиготная форма заболевания). В результате в эритроците будет примерно одинаковое количество как гемоглобина S, так и гемоглобина А, которого достаточно для поддержания нормальной формы и функции эритроцита в обычных условиях.
На сегодняшний день не удалось установить точную причину возникновения генных мутаций, приводящих к возникновению серповидноклеточной анемии. Однако исследованиями последних лет выявлен ряд факторов (мутагенов), воздействие которых на организм может приводить к повреждению генетического аппарата клеток, вызывая целый ряд хромосомных заболеваний.
Причиной генетических мутаций может быть:
- Малярийная инфекция. Данное заболевание вызывается малярийными плазмодиями, которые при попадании в организм человека поражают эритроциты, вызывая их массовую гибель. Это может приводить к мутациям на уровне генетического аппарата красных клеток крови, обуславливая появление различных заболеваний, в том числе серповидноклеточной анемии и других гемоглобинопатий. Некоторые исследователи склонны считать, что хромосомные мутации в эритроцитах являются своего рода защитной реакцией организма против малярии, так как серповидные эритроциты практически не поражаются малярийным плазмодием.
- Вирусная инфекция. Вирус представляет собой неклеточную форму жизни, состоящую из нуклеиновых кислот РНК (рибонуклеиновой кислоты) или ДНК (дезоксирибонуклеиновой кислоты). Данный инфекционный агент способен размножаться только внутри клеток живого организма. Поражая клетку, вирус встраивается в ее генетический аппарат, изменяя его таким образом, что клетка начинает продуцировать новые фрагменты вируса. Данный процесс может вызывать возникновение различных хромосомных мутаций. В качестве мутагена могут выступать цитомегаловирусы, вирусы краснухи и кори, гепатита и многие другие.
- Ионизирующее излучение. Представляет собой поток невидимых невооруженным глазом частиц, которые способны воздействовать на генетический аппарат абсолютно всех живых клеток, приводя к возникновению множества мутаций. Количество и выраженность мутаций зависит от дозы и длительность облучения. Помимо естественного радиационного фона Земли дополнительными источниками радиации могут стать аварии на АЭС (атомных электростанциях) и взрывы атомных бомб, частные рентгенологические исследования.
- Вредные факторы окружающей среды. В данную группу входят различные химические вещества, с которыми сталкивается человек в процессе своей жизнедеятельности. Сильнейшими мутагенами являются эпихлоргидрин, используемый в производстве множества медикаментов, стирол, использующийся при изготовлении пластмасс, соединения тяжелых металлов (свинца, цинка, ртути, хрома), табачный дым и множество других химических соединений. Все они обладают высокой мутагенной и канцерогенной (вызывающей рак) активностью.
- Лекарственные препараты. Действие некоторых медикаментов обусловлено их влиянием на генетический аппарат клеток, что связано с риском возникновения различных мутаций. Наиболее опасными лекарственными мутагенами являются большинство противоопухолевых препаратов (цитостатиков), препараты ртути, иммунодепрессанты (угнетающие деятельность иммунной системы).
На тяжесть клинического течения серповидноклеточной анемии влияют:
- Наличие гемоглобина F. Чем его больше, тем менее выражена симптоматика заболевания. Этим объясняется отсутствие симптомов СКА у новорожденных – большая часть HbF замещается на HbA к шестому месяцу жизни ребенка.
- Климатические и географические условия. Давление кислорода во вдыхаемом воздухе обратно пропорционально высоте над уровнем моря. Другими словами, чем выше находится человек, тем меньше кислорода поступает в его легкие при каждом вдохе. Симптомы серповидноклеточной анемии могут проявляться и ухудшаться уже через несколько часов после поднятия на высоту более 2000 метров над уровнем моря (даже у людей с гетерозиготной формой заболевания). Больным СКА абсолютно противопоказано проживание в условиях высокогорья (некоторые города Америки и Европы располагаются на высоте в несколько километров).
- Социально-экономические факторы. Доступность и своевременность лечения осложнений серповидноклеточной анемии также влияет на выраженность клинических проявлений заболевания.
Внешние проявления серповидноклеточной анемии обусловлены, в первую очередь, скоростью разрушения (гемолиза) серповидных эритроцитов (срок жизни которых укорачивается до 10 – 15 дней), а также различными осложнениями, возникающими в результате закупорки серповидными эритроцитами капилляров по всему организму.
Среди симптомов серповидноклеточной анемии выделяют:
- симптомы, связанные с разрушением эритроцитов;
- гемолитические кризы;
- симптомы, обусловленные закупоркой мелких сосудов;
- увеличение селезенки;
- склонность к тяжелым инфекциям.
Данная группа симптомов обычно начинает проявляться через полгода жизни ребенка, когда уменьшается количество гемоглобина F (в тяжелых случаях гомозиготной формы заболевания) либо в более поздние сроки.
Наиболее ранними проявлениями серповидноклеточной анемии являются:
- Бледность. Развивается из-за уменьшения количества красных клеток в крови. Кожа и видимые слизистые оболочки (полости рта, конъюнктивы глаза и другие) становятся бледными и сухими, кожа становится менее эластичной.
- Повышенная утомляемость. Дети с серповидноклеточной анемией характеризуются вялым и малоподвижным образом жизни. При любой физической нагрузке увеличивается потребность организма в кислороде, то есть развивается гипоксия. Это приводит к тому, что большее число эритроцитов приобретают серповидную форму и разрушается. Транспортная функция крови снижается, в результате чего быстро появляется чувство усталости.
- Частые головокружения. Обусловлены недостатком кислорода на уровне головного мозга, что является опасным для жизни состоянием.
- Одышка. Данный термин подразумевает увеличение частоты и глубины дыхательных движений, возникающее в результате ощущения нехватки воздуха. У больных серповидноклеточной анемией этот симптом обычно возникает в периоды физической активности, однако возможно его появление и в покое (при тяжелых формах заболевания, в условиях высокогорья).
- Отставание в росте и развитии. Ввиду того, что транспортная функция крови значительно снижена, ткани и органы не получают достаточного количества кислорода, необходимого для нормального роста и развития организма. Следствием этого является отставание в физическом и умственном развитии — дети позже, чем их сверстники, начинают ходить, говорить, им хуже дается школьная программа. Также отмечается задержка в половом созревании ребенка.
- Желтушность кожи. Пигмент билирубин, выделяющийся в кровоток при разрушении эритроцитов, придает коже и видимым слизистым оболочкам желтоватую окраску. В норме данное вещество довольно быстро нейтрализуется в печени и выводится из организма, однако при серповидноклеточной анемии количество разрушающихся эритроцитов настолько велико, что печень оказывается не в состоянии обезвредить весь образующийся билирубин.
- Темная моча. Цвет мочи изменяется из-за увеличения концентрации билирубина в ней.
- Избыток железа в организме. Данное состояние может развиться в результате тяжелых, часто повторяющихся гемолитических кризов, когда в кровоток выделяется слишком много свободного железа. Это может привести к возникновению гемосидероза – патологического состояния, характеризующегося отложением оксида железа в различных тканях (в ткани печени, селезенки, почек, легких и так далее), что приведет к нарушению функции пораженных органов.
Гемолитические кризы могут возникать в различные периоды жизни. Длительность ремиссии (периода без кризов) может исчисляться месяцами или годами, после чего может наступить целый ряд приступов.
Развитию гемолитического криза может предшествовать:
- тяжелая генерализованная инфекция;
- тяжелая физическая работа;
- подъем на большую высоту (более 2000 метров над уровнем моря);
- воздействие чрезмерно высоких или низких температур;
- обезвоживание (истощение запасов жидкости в организме).
Для гемолитического криза характерно быстрое образование большого числа серповидных эритроцитов, которые закупоривают мелкие сосуды и разрушаются в селезенке, печени, красном костном мозге и других органах, а также непосредственно в сосудистом русле. Это приводит к резкому уменьшению количества красных клеток крови в организме, что проявляется нарастанием одышки, частыми головокружениями (вплоть до потери сознания) и другими симптомами, описанными ранее.
Как уже говорилось, серповидные эритроциты не способны проходить через мелкие сосуды, поэтому застревают в них, что приводит к нарушению кровообращения практически в любых органах.
Симптомами серповидноклеточной анемии являются:
- Болевые кризы. Возникают в результате закупорки сосудов, питающих определенные органы. Это приводит к развитию недостатка кислорода на тканевом уровне, что сопровождается приступами сильной острой боли, которые могут длиться от нескольких часов до нескольких дней. Результатом описанных процессов является гибель участка ткани или органа, доставка кислорода к которому нарушена. Болевые кризы могут возникать внезапно на фоне полного благополучия, однако чаще всего им предшествуют вирусные и бактериальные инфекции, выраженная физическая нагрузка или другие состояния, сопровождающиеся развитием гипоксии.
- Кожные язвы. Развиваются в результате закупорки мелких сосудов и нарушения кровообращения в различных участках кожных покровов. Пораженный участок изъязвляется и довольно часто инфицируется, что может стать причиной развития тяжелых инфекционных заболеваний. Наиболее характерным расположением язв является кожа верхних и нижних конечностей, однако возможно поражение кожи туловища, шеи и головы.
- Нарушения зрения. Развиваются в результате закупорки артерии, питающей сетчатку глаза. В зависимости от диаметра пораженного сосуда могут появляться различные нарушения, начиная от снижения остроты зрения и заканчивая отслойкой сетчатки и развитием слепоты.
- Сердечная недостаточность. Причиной поражения сердца может быть закупорка серповидными эритроцитами коронарных артерий (сосудов, доставляющих кровь к сердечной мышце) и развитие острого инфаркта миокарда (гибели части сердечной мышцы, вызванной нарушением доставки кислорода). Кроме того, длительная анемия и гипоксия рефлекторно вызывают увеличение частоты сердечных сокращений. Это может привести к гипертрофии (увеличению в размерах) сердечной мышцы с последующим истощением компенсаторных механизмов и развитием сердечной недостаточности.
- Гематурия (кровь в моче). Данный симптом может появляться в результате тромбоза почечных вен и поражения нефронов (функциональных единиц почечной ткани, в которых происходит образование мочи), в результате чего они становятся проницаемыми для эритроцитов. При длительном течении заболевания может наступить гибель более 75% нефронов и развитие почечной недостаточности, что является неблагоприятным прогностическим признаком.
- Приапизм. Данный термин подразумевает спонтанное возникновение длительной и болезненной эрекции полового члена у мужчин. Этот симптом обусловлен закупоркой мелких капилляров и вен, через которые происходит отток крови от органа, что иногда может привести к развитию импотенции.
- Изменение структуры костей. Для серповидноклеточной анемии характерны частые инфаркты костной ткани, что приводит к изменению структуры костей, они становятся менее прочными. Кроме того длительная гипоксия стимулирует выделение большого количества эритропоэтина почками, что приводит к разрастанию эритроидного ростка кроветворения в красном костном мозге и деформации костей черепа позвонков, ребер.
- Поражение суставов. Отмечаются припухлость и болезненность суставов конечностей (стоп, голеней, кистей, пальцев тук и ног).
- Неврологические проявления. Являются результатом закупорки артерий, питающих различные участки головного и спинного мозга. Неврологическая симптоматика у больных серповидноклеточной анемией может проявляться нарушениями чувствительности, парезами (нарушением двигательных функции), плегиями (полной утратой двигательных функций в конечностях), а также острым ишемическим инсультом (возникающим в результате закупорки артерии головного мозга), что может привести к смерти человека.
Увеличение селезенки происходит в результате задерживания и разрушения в ней большого числа серповидных эритроцитов. Кроме того, могут развиваться инфаркты селезенки, в результате чего значительно снижаются ее функциональные способности.
На начальных этапах серповидноклеточной анемии в селезенке задерживаются и разрушаются только серповидные эритроциты. По мере прогрессирования заболевания происходит закупорка синусоидов органа, что нарушает прохождение (фильтрацию) всех остальных клеток крови и обуславливает увеличение органа в размерах (спленомегалию).
В результате застоя крови в увеличенной селезенке может развиться состояние, называемое гиперспленизмом. Оно характеризуется разрушением не только поврежденных, но и нормальных клеточных элементов (тромбоцитов, лейкоцитов, неизмененных эритроцитов). Это сопровождается быстрым уменьшением количества данных клеток в периферической крови и развитием соответствующих симптомов (частых кровотечений, нарушения защитных свойств организма). Развитие гиперспленизма особенно опасно в раннем детском возрасте, когда в увеличенной селезенке может произойти быстрое разрушение большинства эритроцитов крови, что приведет к смерти ребенка.

В диагностике серповидноклеточной анемии применяется:
- общий анализ крови;
- биохимический анализ крови;
- электрофорез гемоглобина;
- ультразвуковое исследование (УЗИ);
- рентгенологическое исследование.
Один из первых анализов, назначаемых всем пациентам при подозрении на заболевание крови. Он позволяет оценить клеточный состав периферической крови, что дает информацию о функциональном состоянии различных внутренних органов, а также о кроветворении в красном костном мозге, наличии инфекции в организме. Для общего анализа могут брать как капиллярную кровь (из пальца), так и венозную.
Техника взятия капиллярной крови
Кровь берут утром, натощак. Накануне перед сдачей анализа не рекомендуется употреблять алкогольные напитки, курить или принимать наркотические препараты. Непосредственно перед взятием крови следует согреть пальцы левой руки, что улучшит микроциркуляцию и облегчит процедуру.
Забор материала для анализа производится медицинской сестрой в процедурном кабинете поликлиники. Кожу кончика пальца обрабатывают ватным тампоном, который предварительно смачивают 70% раствором спирта (с целью предотвращения занесения инфекции). После этого специальной иглой-скарификатором производят прокол кожи на боковой поверхности пальца (обычно используется 4 палец левой руки, однако это не принципиально). Первая появившаяся капля крови удаляется ватным тампоном, после чего медсестра начинает поочередно сдавливать и отпускать кончик пальца, набирая в стерильную градуированную трубку несколько миллилитров крови.
При подозрении на серповидноклеточную анемию палец, из которого будет браться кровь, предварительно перевязывают веревкой или жгутом (на 2 – 3 минуты). Это создает условия гипоксии, в результате чего образуется большее число серповидных эритроцитов, что облегчит постановку диагноза.
Техника взятия венозной крови
Забор крови также производится медицинской сестрой. Правила подготовки к анализу такие же, как при взятии крови из пальца. Обычно кровь берут из подкожных вен локтевой области, расположение которых довольно легко определить.
Пациент присаживается и кладет руку на спинку стула, максимально разгибая ее в локтевом суставе. Медсестра накладывает резиновый жгут в плечевой области (сдавливание подкожных вен приводит к переполнению их кровью и выбуханию над поверхностью кожи) и просит пациента несколько секунд «поработать кулаком» (сжимать и разжимать кулак), что также способствует наполнению вен кровью и облегчает их определение под кожей.
Определив расположение вены, медсестра дважды обрабатывает локтевую область ватным тампоном, предварительно пропитанным 70% спиртовым раствором. После этого стерильным одноразовым шприцем прокалывается кожа и стенка вены и производится забор необходимого количества крови (обычно нескольких миллилитров). К месту прокола прижимается чистый ватный тампон (также смоченный в спирте), и игла извлекается. Пациенту рекомендуют подождать в коридоре 10 – 15 минут, так как возможно возникновение определенных побочных реакций (головокружения, потери сознания).
Микроскопическое исследование крови
Несколько капель полученной крови переносится на предметное стекло, окрашивается специальными красителями (обычно метиленовым синим) и исследуется в световом микроскопе. Данный метод позволяет примерно определить количество клеточных элементов крови, оценить их размеры и строение.
При серповидноклеточной анемии возможно выявление серповидных эритроцитов (при исследовании венозной крови), однако их отсутствие не исключает диагноза. Обычное микроскопическое исследование не всегда позволяет выявить серповидные эритроциты, поэтому применяется исследование «влажного мазка» крови. Суть исследования заключается в следующем — каплю крови переносят на предметное стекло и обрабатывают особым веществом – пиросульфитом натрия. Он «вытягивает» кислород из эритроцитов, в результате чего они приобретают серповидную форму (если человек действительно болен серповидноклеточной анемией), что обнаруживается при исследовании в обычном световом микроскопе. Данное исследование является высокоспецифичным и позволяет подтвердить диагноз в большинстве случаев.
Исследование крови в гематологическом анализаторе
Большинство современных лабораторий оборудованы гематологическими анализаторами – аппаратами, позволяющими быстро и точно определить количественный состав всех клеточных элементов, а также многие другие параметры крови.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Концентрация эритроцитов (RBC) | При серповидноклеточной анемии отмечается выраженное разрушение эритроцитов (гемолиз), в результате чего их концентрация в крови будет снижена. Данное состояние особенно характерно для гемолитических кризов, когда может разрушаться более половины циркулирующих в крови эритроцитов. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Общий уровень гемоглобина (HGB) | В результате разрушения эритроцитов снижается и общий уровень гемоглобина в крови. | М: 130 – 170 г/л. | Менее 130 г/л. |
| Ж: 120 – 150 г/л. | Менее 120 г/л. | ||
| Концентрация лейкоцитов (WBC) | Лейкоциты защищают организм от различных инфекционных агентов. При серповидноклеточной анемии отмечается предрасположенность к инфекционным заболеваниям, ввиду чего данный показатель может повышаться. | 4,0 – 9,0 х 10 9 /л. | Повышение уровня лейкоцитов выше 9,0 х 10 9 /л говорит о наличии инфекционного процесса в организме. |
| Концентрация тромбоцитов (PLT) | В случае развития гиперспленизма в увеличенной селезенке разрушаются не только серповидные эритроциты, но и нормальные клетки крови. | 180 – 320 х 10 9 /л. | В норме или снижена. |
| Концентрация ретикулоцитов (RET) | Уменьшение концентрации эритроцитов стимулирует выделение эритропоэтина почками, что усиливает процессы кроветворения в красном костном мозге. Результатом этого является выделение в периферический кровоток большого количества ретикулоцитов. | М: 0,24 – 1,7%. | Повышена, особенно после гемолитических кризов. |
| Ж: 0,12 – 2,05%. | |||
| Гематокрит (Hct) | Гематокрит – лабораторный показатель, отражающий количественное соотношение между клеточными элементами крови и объемом плазмы. Выраженный гемолиз приводит к уменьшению общего количества эритроцитов и, следовательно, к уменьшению гематокрита. | М: 42 – 50%. | Ниже нормы, вплоть до 15 – 20% в периоды гемолитических кризов. |
| Ж: 38 – 47%. | |||
| Скорость оседания эритроцитов (СОЭ) | Определяется время, в течение которого произойдет оседание эритроцитов на дно пробирки. В нормальных условиях наружная поверхность мембран эритроцитов несет отрицательный заряд, в результате чего клетки отталкиваются друг от друга. Уменьшение концентрации эритроцитов, а также различные инфекционные процессы в организме способствуют более быстрому оседанию эритроцитов. | М: 3 – 10 мм/час. | Более 10 мм/час. |
| Ж: 5 – 15 мм/час. | Более 15 мм/час. |
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Уровень билирубина (несвязанная фракция) | Данный показатель отображает интенсивность процессов разрушения эритроцитов как в селезенке, так и непосредственно в сосудистом русле. | 4,5 – 17,1 мкмоль/л. | Значительно выше нормы. |
| Свободный гемоглобин плазмы | Данный показатель отображает интенсивность процесса разрушения эритроцитов непосредственно внутри сосудов (внутрисосудистого гемолиза), при котором в кровь выделяется большое количество свободного гемоглобина. | Менее 220 мг/л. | Значительно выше нормы, особенно в период гемолитического криза. |
| Уровень гаптоглобина в плазме | Гаптоглобин – это белок плазмы крови, образующийся в печени. Одной из основных его функций является связывание свободного гемоглобина в крови и транспортировка его в селезенку, где он подвергается разрушению. При гемолизе эритроцитов в сосудистом русле количество выделяемого в кровь гемоглобина настолько велико, что весь гаптоглобин находится в связанном с ним состоянии, поэтому его количество уменьшается. | 0,8 – 2,7 г/л. | Значительно ниже нормы, особенно в период гемолитических кризов. |
| Концентрация свободного железа в крови | Повышение количества свободного железа в плазме крови обычно характерно для гемолитического криза. Белок трансферрин не успевает связать все железо, поступающее в кровь в результате разрушения большого количества эритроцитов, поэтому его концентрация повышается. | М: 17,9 – 22,5 мкмоль/л. | В период гемолитического криза данный показатель может быть в несколько раз выше нормы. |
| Ж: 14,3 – 17,9 мкмоль/л. | |||
| Уровень аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) | Данные вещества являются внутриклеточными ферментами, содержащимися в клетках печени в больших количествах. Увеличение их концентрации в крови является маркером разрушения ткани печени, что может быть следствием микроинфарктов (в результате закупорки печеночных сосудов серповидными эритроцитами). | М: до 41 Ед/л. | При тяжелом течении заболевания значительно превышает норму. |
| Ж: до 31 Ед/л. |
Широко распространенный научный метод исследования, позволяющий определить качественный состав гемоглобина в крови. Суть метода заключается в следующем — на бумагу, расположенную в стационарном электрическом поле между двумя электродами, помещают раствор, содержащий различные белки, которые начинают перемещаться от катода (отрицательно заряженного электрода) к аноду (положительно заряженному электроду).
Скорость перемещения белковых молекул зависит от их молекулярной массы, пространственной конфигурации и электрического заряда. Данные параметры строго специфичны для каждой отдельной цепи глобина (как нормальной, так и патологической), в результате чего их электрофоретическая подвижность будет различной. На основании контрольных маркеров определяют виды гемоглобина в исследуемой крови и количество каждого из них.
| Вид гемоглобина | Нормальные значения | Возможные изменения при серповидноклеточной анемии |
| HbA | Более 95%. | Менее 50%. |
| HbA2 | Менее 2%. | В норме или снижено. |
| HbF | 1 – 1,5 %. | В норме или слегка повышено. |
| HbS | Отсутствует. | 50% и более. |
Современный метод исследования внутренних органов, основанный на принципе эхолокации, позволяющий определить расположение и структуру объекта по скорости возвращения звуковой волны, отраженной от его поверхности.
УЗИ является одним из наиболее простых и безвредных диагностических методов. За несколько часов перед исследованием пациенту необходимо исключить прием пищи и больших объемов жидкости. Сама процедура может проводиться как в специально оборудованном кабинете, так и непосредственно у постели больного. На кожу исследуемой области наносится специальный гель (это предотвращает попадание воздуха между датчиком и кожей пациента, что могло бы исказить результаты исследования). После этого врач прикладывает к коже пациента специальный датчик, излучающий ультразвуковые волны, и начинает перемещать его над исследуемой областью. Звуковые волны отражаются от поверхностей различных органов и структур, находящихся на их пути, и улавливаются специальным приемником. После компьютерной обработки на мониторе появляется примерное изображение исследуемых тканей и органов.
Разновидностью ультразвукового исследования является допплерография – метод, позволяющий оценить характер кровотока в сосудах.
При серповидноклеточной анемии метод УЗИ может выявить:
- увеличение селезенки и печени;
- наличие инфарктов во внутренних органах (в селезенке, печени, почках и других);
- нарушение кровообращения во внутренних органах;
- нарушение кровотока в конечностях.
Это исследование основано на способности рентгеновских лучей проходить через организм человека. При этом они частично поглощаются различными тканевыми структурами, в результате чего на специальной пленке формируется теневое отображение всех органов и тканей, оказавшихся на их пути.
Наибольшей поглощающей способностью в организме человека обладает костная ткань, что позволяет использовать данный метод для определения наличия и выраженности поражений костей при серповидноклеточной анемии.
Рентгенологическое исследование позволяет выявить:
- деформацию и расширение тел позвонков (из-за множественных инфарктов);
- деформацию и истончение костей скелета (из-за избыточного разрастания костномозговой ткани);
- наличие остеомиелита (гнойного инфекционного процесса в костной ткани).
Эффективного лечения серповидноклеточной анемии, позволяющего раз и навсегда избавиться от данного недуга, на сегодняшний день не существует. Помощь больным заключаются в предотвращении образования большого количества серповидных эритроцитов, а также в устранении симптомов заболевания.
Принципами лечения серповидноклеточной анемии являются:
- правильный образ жизни;
- повышение количества эритроцитов и гемоглобина;
- кислородотерапия;
- устранение болевого синдрома;
- устранение избытка железа в организме;
- профилактика и лечение инфекционных заболеваний.
Если у человека диагностирована серповидноклеточная анемия, ему следует соблюдать определенные рекомендации, которые позволят облегчить течение заболевания и минимизировать риск развития осложнений.
Пациентам с серповидноклеточной анемией рекомендуется:
- проживать на высоте не более 1500 метров над уровнем моря;
- проживать в зоне с умеренным климатом (исключающим воздействие экстремально низких или высоких температур);
- употреблять не менее 1,5 литров жидкости ежедневно;
- исключить прием алкогольных напитков и наркотиков;
- отказаться от курения (как самому больному человеку, так и членам его семьи);
- избегать тяжелых физических нагрузок;
- выбирать профессию, не связанную с тяжелой физической работой или воздействием высоких/низких температур.
| Название препарата | Механизм леченого действия | Способ применения и дозы | Оценка эффективности лечения | |
| Немедикаментозные методы | ||||
| Эритроцитарная масса | Перелитые донорские эритроциты в течение некоторого времени (обычно не более 100 дней) могут транспортировать дыхательные газы в организме больного. Данный метод используется крайне редко, ввиду возможности развития тяжелых побочных реакций. | Основным показанием для переливания донорских эритроцитов является резкое снижение уровня гемоглобина ниже 70 г/л (например, при гемолитическом кризе). В таком случае устанавливается катетер в одну или сразу в несколько центральных вен (в яремные, расположенные на шее или в подключичные), и производится переливание эритроцитарной массы. Целевой уровень гемоглобина при этом составляет не менее 100 г/л. | ||
Перед началом переливания проводится целый ряд тестов, направленных на определение совместимости крови донора и реципиента.
- повышение уровня гемоглобина (определенное лабораторно);
- исчезновение одышки;
- нормализация цвета кожи.
Применение гидроксимочевины в лечении серповидноклеточной анемии считается экспериментальной методикой. Широкомасштабных исследований, оценивающих эффективность препарата и возможные побочные реакции, еще не проводилось.
Частота и выраженность гемолитических кризов определяет тяжесть клинического течения серповидноклеточной анемии. Как уже говорилось, развитию гемолитического криза предшествуют различные состояния, сопровождающиеся гипоксией. Применение кислорода в первые минуты или часы после начала гемолиза предотвращает образование и последующее разрушение серповидных эритроцитов. Это облегчает течение заболевания, уменьшает риск развития осложнений и улучшает качество жизни пациента.
Пациент с развивающимся гемолитическим кризом должен быть госпитализирован как можно скорее. Непосредственно в машине скорой помощи ему дается кислородная маска, которая обеспечивает подачу кислорода со скоростью 4 – 6 литров в минуту. После поступления в стационар кислородотерапия продолжается на протяжении нескольких часов или дней.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Трамадол | Синтетическое наркотическое обезболивающее средство, действующее на уровне головного и спинного мозга. Активирует опиоидные рецепторы в организме, что уменьшает интенсивность болевого синдрома. | Внутривенно или внутрь, в дозе 50 – 100 мг. Максимальная суточная доза – 400 мг. Не рекомендуется принимать детям младше 1 года. | Обезболивающий эффект развивается примерно через 15 минут после приема внутрь (при внутривенном введении – через 5 – 10 минут) и длится до 6 часов. |
| Промедол | Активирует опиоидные рецепторы и нарушает передачу болевых импульсов в центральной нервной системе, чем и обусловлено его обезболивающее, противошоковое и легкое снотворное действие. | Внутрь, 3 – 4 раза в день. |
Рекомендуемые дозы:
- детям старше 2 лет – 0,1 – 0,5 мг/кг;
- взрослым – 25 – 50 мг.
Рекомендуемые дозы:
- детям – 0,2 – 0,8 мг/кг;
- взрослым – 10 – 20 мг.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Десферал (Дефероксамин) | Комплексообразующий препарат, который обладает способностью связывать и выводить свободное железо из организма. | Данный медикамент назначается после гемолитических кризов, при повышении уровня сывороточного железа. Вводится внутривенно. Начальная доза составляет 20 мг/кг. При повторном возникновении кризов доза может быть увеличена до 40 мг/кг. | Лечение проводится до нормализации уровня железа в крови, подтвержденной лабораторно. |
| Эксиджад | Препарат для приема внутрь, обладающий железосвязывающей способностью. Усиливает выведение железа из организма преимущественно с калом. | Внутрь, 1 раз в день, в дозе 10 – 30 мг/кг. | Лечение проводится до нормализации уровня железа в крови. |
| Название медикамента | Механизм лечебного действия | Способ применения и дозы |
| Амоксициллин | Полусинтетический антибиотик, подавляющий образование клеточной стенки различных видов бактерий (стафилококков, стрептококков, пневмококков и других), что приводит к их гибели. | Может назначаться с профилактической целью, начиная с шестимесячного возраста (при тяжелом течении гомозиготной формы серповидноклеточной анемии). Принимается внутрь, 2 – 3 раза в сутки. |
Рекомендуемые дозы:
- детям младше 2 лет – 20 мг/кг;
- детям от 2 до 5 лет – 125 мг;
- детям от 5 до 10 лет – 250 мг;
- детям старше 10 лет и взрослым – 500 мг.
Рекомендуемые дозы:
- детям – 10 – 30 мг/кг, 3 раза в сутки;
- взрослым – 750 мг 3 раза в сутки.
Рекомендуемые дозы:
- детям – 10 – 15 мг/кг, 2 – 3 раза в сутки;
- взрослым – 250 – 500 мг 3 – 4 раза в сутки.
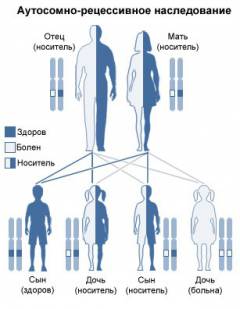
Если один или оба родителя больны серповидноклеточной анемией, то их ребенок также может унаследовать данный недуг. Одним из методов, позволяющим определить вероятность наследования гена, ответственного за развитие данного заболевания, является полимеразная цепная реакция (ПЦР). Суть метода заключается в исследовании генетического материала обоих родителей и выявлении мутантных генов. При этом определяется как их наличие (или отсутствие), так и форма заболевания (гомозиготная или гетерозиготная).
Результаты генетического исследования могут быть следующими:
- Оба родителя больны. Это подразумевает, что у обоих родителей имеется по 2 мутантных гена, кодирующих образование b-цепей глобина. Рождение здорового ребенка в таком случае практически невозможно.
- Оба родителя являются бессимптомными носителями. В данном случае вероятность рождения здорового ребенка составляет 25%, вероятность рождения больного ребенка (с гомозиготной формой заболевания) – 25%, и вероятность рождения бессимптомного носителя (с гетерозиготной формой заболевания) – 50%.
- Один из родителей болен, а второй является бессимптомным носителем. У таких родителей с одинаковой долей вероятности может родиться либо больной ребенок, либо бессимптомный носитель. Рождение абсолютно здорового ребенка в данном случае невозможно.
- Один из родителей болен, а второй здоров. В данном случае ребенок унаследует один мутантный ген от больного родителя и один нормальный ген от здорового родителя, то есть он будет бессимптомным носителем гена серповидноклеточной анемии.
С помощью ПЦР возможно выявить наличие мутантных генов у плода на ранних этапах внутриутробного развития и определить форму заболевания. Это позволяет своевременно поднять вопрос о прерывании беременности.
источник