При морфологическом исследовании красных клеток крови, которым свойственно в течение жизни сохранять все присущие им характеристики, лучше всего выявляются различные отклонения от нормы.
По форме эритроциты напоминают двояковогнутые диски диаметром 7-8 мкрн, их объем в среднем составляет 80-100 фемтолитров, окраску имеют нормохромную. В случае патологических изменений красных кровяных телец при микроцитозе, макроцитозе, нормоцитозе, гипохромии и гиперхпромии чаще всего обнаруживаются анемические состояния. Для понятия «микроцитоза» характерно присутствие в эритроцитах большого количества маленьких клеток-лилипутов. Это свидетельствует о развитии микроцитарной анемии.
Красные клетки крови выполняют многочисленные и весьма важные функции в организме. Также они могут рассказать об отклонениях своим размером в сравнении с нормальными значениями (80–100 фл или мкм 3 ):
- если их меньше нормы (MCV в гематологическом анализаторе 100 фл) – макроцитозом;
- а если у них нормальные размеры, то это считается нормоцитозом.
Немалую роль отводят в диагностике различных анемий такому лабораторному показателю, как окраска. Различают соответственно гипохромию, гиперхромию и нормохромию. В результате нарушения синтеза красного пигмента (его еще называют гемоглобином) из-за недостатка железа микроцитоз сопровождает гипохромию. Эта патология называется микроцитарная анемия.
В данном случае размер эритроцитов и их окраска являются постоянными признаками заболевания. По какой причине возникает микроцитоз, разберем в данной статье.
Из трех видов анизоцитоза эритроцитов микроцитоз наиболее распространен. Для него характерно присутствие в общем числе эритроцитов большого числа уменьшенных неестественным образом в объеме красных кровяных клеток.
Если выявлен микроцитоз в анализах крови, то врач может предположить, что у пациента развилась микроцитарная анемия. То есть она выступила основной причиной увеличения микроцитов в крови человека. Специалист должен обязательно выяснить причину такого отклонения, особенно если подобное явление раньше не диагностировалось, а обнаружилось впервые. Многим анемичным состояниям присущ данный признак, так что требуется дифференциальная диагностика.
Отдельные виды анемий могут выступать причинами микроцитоза. Что было первично – анемия или уменьшение размеров красных кровяных клеток? Этот вопрос часто задают.
По причине сложных биохимических реакций, происходящих в организме, появляется взаимосвязь между причинами анемии и появлением микроцитов в крови. Или гипохромная анемия возникает именно из-за уменьшения в размерах эритроцитов.
Самой распространенной среди всех является именно железодефицитная микроцитарная анемия, связанная с недостатком железа в организме.
В нее входит целая группа железодефицитных состояний, которые образуются в силу разных причин:
- Анемия, обусловленные гемоглобинурией (при которой повреждаются эритроциты и выходит гемоглобин в плазму, такое состояние называют гемолизом, что в первую очередь отражается в моче) и гемосидеринурией (гемоглобин накапливается в почках и удаляется продукт его окисления гемосидерин с мочой).
- Хронические постгеморрагические железодефицитные анемии — состояние формируется из-за многих болезней, которые сопровождаются кровотечениями (маточное, носовое, почечное, кровопотеря из желудочно-кишечного тракта).
- Анемии, связанные с:
- Тем, что уменьшается поступление железа с пищей (при вегетарианстве или других диетах, вынужденных или целенаправленных, ограничивающих насыщение организма железом и белком).
- Тем, что повышается потребность организма в этом незаменимом химическом элементе (в случае беременности, кормлении грудью, частых родах, при донорстве).
- Тем, что нарушается всасывание и транспорт железа (при хроническом воспалительном либо злокачественном процессе, локализованном на участке пищеварительного тракта или в поджелудочной железе, при этом нарушается ее секреторная функция, при обширной резекции кишечника).
Различают, кроме железодефицитных анемий, в зависимости от размера эритроцита и окраски, и другие гематологические патологии:
- Гемоглобинопатия (талассемия, заболевание Минковского-Шоффара, наследственный микросфероцитоз, гемоглобинопатия Н).
- Сидеробластная микроцитарная анемия — патологические состояния, при которых нарушается обмен железа. При такой анемии частое проявление микроцитоза, гипохромии, сниженного уровня железа в эритроцитах, повышенного — в крови (по причине того, что костным мозгом не забирается этот элемент для выработки гемоглобина). Патология может быть приобретенной, которая чаще развивается у взрослых людей и сопровождает другие болезни (при воспалительных процессах, злокачественных опухолях, хроническом алкоголизме), и наследственной (в Х-хромосоме располагается дефектный ген).
- Анемии, связанные с воздействием хронической инфекции.
- Анемичное состояние вследствие отравления солями тяжелых металлов, в частности, свинцом, который негативно влияет на утилизацию железа и выработку гемоглобина. Характерными признаками такой патологии будут – в крови обнаружат микроциты, гипохромию, грубые внутриклеточные включения (тельца Жолли, базофильную зернистость, кольца Кебота).
- Редких видов гипохромные микроцитарные анемии – причины их возникновения обусловлены врожденными аномалиями в обмене железа, нарушениями процессов транспорта и реутилизации этого ценного элемента, отсутствием протеина железосвязывающего.
Под контролем должны находятся параметры гемограммы, она показана в обязательном порядке растущему организму.
Гипохромия и микроцитоз при проведении общего анализа крови вместе с другими признаками неблагополучия (излишнего набора веса либо его потери, не естественной потребности пробовать на вкус и даже употреблять в пищу несъедобные продукты, изменения поведения, снижения концентрации внимания) говорят о наличие у ребенка анемии, которая возникла по причине недостаточного уровня железа. Ведь только от этого химического элемента зависит синтез гемоглобина (красного пигмента крови).
Еще он является переносчиком кислорода по тканям и органам, и при его уменьшении возникают неприятные симптомы, характерные для анемии.
У детей подобные нарушения случаются чаще. Это происходит из-за особенностей обмена железа и питания. Диета должна строиться таким образом, чтобы железа хватало малышу. Но не всегда это получается.
При употреблении материнского молока, из которого железо всасывается эффективнее, чем из коровьего или козьего, риск развития анемии невелик.
После года жизни в рацион малыша следует включать продукты с повышенным содержанием этого элемента для нормального развития организма.
При наличии признаков микроцитарную анемию (причины мы рассмотрели) легко определить по картине крови, ведь будет снижен уровень гемоглобина.
При уменьшении уровня железа в организме последуют следующие биохимические реакции:
- снижение запасов гемобразующих компонентов в костном мозге и печеночной ткани;
- упадок секреции и уровня ферритина (главный депонирующий железо белок);
- рост в сыворотке общей железосвязывающей способности крови;
- возрастание уровня свободных протопорфиринов эритроцитарных, которым не с чем соединиться для образования гема;
- упадок активности железосодержащих ферментов внутри клеток.
По мере того, как будет прогрессировать патологическое снижение железа в крови и, соответственно, падать уровень гемоглобина, все больше эритроцитами будет меняться окраска, их размеры и внешние очертания уменьшатся. В конечном итоге это приведет к деформации эритроцитов, их превращению в микроциты. А вместе с микроцитозом в красных клетках крови будет отмечаться гипохромия и пойкилоцитоз.
Это все отразиться в гемограмме и биохимическом исследовании крови. Сниженный уровень гемоглобина, измененные показатели сывороточного железа, эритроцитарные индексы поменяются, появятся гипохромия и микроцитоз в общем анализе крови – все это будет подтверждать развитие гипохромной микроцитарной анемии.
Полной уверенности, безусловно, нет в том, что у малыша или взрослого человека развилась именно железодефицитная анемия.
Поэтому патологическое состояние нужно дифференцировать от других видов анемий. Например, она может быть вызвана отравлением свинцом (при базофильных включениях в эритроцитах, повышении уровня свинца в сыворотке крови, появлении свободных эритроцитарных протопорфиринов и каптопорфиринов в моче). Также это может быть талассемия (ее можно заподозрить при повышении в крови HbA2, HbF). При диагнозе микроцитарная анемия лечение должно быть своевременным.
Нормальный уровень железа необходимо возмещать. Пересматривается меню пациента.
Если анемия связана с постоянными кровопотерями, устраняется их причина. При обильных менструациях потребуется лечение у гинеколога. Острая или травматическая природа кровотечений устраняется хирургическим вмешательством. Язвенные кровотечения подразумевают лечения болезней желудочно-кишечного тракта.
Когда недостаток микроэлемента провоцирует сам организм, вводят готовые препараты в виде таблеток или инъекций. У них имеются противопоказания и побочные действия. Передозировка железа так же опасна, как и нехватка его.
Нами подробно рассмотрены железодефицитная гипохромная микроцитарная анемия.
источник
Состояние гемодинамики при шоке
Гемодинамика
| Препарат | Системное сосудистое сопротивление | Ударный объем | Частота сердцебиений | Давление в легочной артерии | Сердечный выброс | Систоли- ческое АД |
| Допамин | ↑ | ↑ | ↑ | ↑ | ↑ | 0 — ↑ |
| Добутамин | ↓ | ↑ | 0 — ↑ | 0 — ↑ | ↑ | 0 — ↑ |
| Норадреналин | ↑ | 0 — ↑ | 0 — ↓ | ↑ | ↓ | ↑ |
| Причина | Сердечный выброс | Системное сосудистое сопротивление | Центральное венозное давление | Смешанная венозная оксигенация |
| Гиповолемический шок | ↓ | ↑ | ↓ | ↓ |
| Инфаркт миокарда левого желудочка | ↓ | ↑ | ↑ | ↓ |
| Инфаркт миокарда правого желудочка | ↓ | ↑ | ↑ | ↓ |
| Тампонада сердца | ↓ | ↑ | ↑ | ↓ |
| Массивная ТЭЛА | ↓ | ↑ | ↑ | ↓ |
| Ранний септический шок | ↓↑ | ↑↓ | ↑ | ↓ |
| Поздний септический шок | ↓ | ↑ | ↓ |
Нормальные величины:
Центральное венозное давление: 0 – 8
Давление заклинивания легочных капилляров: 4 – 12
Системное сосудистое сопротивление: 800 – 1200
Гематология 7
Определение.Гематокрит меньше 40 % у мужчин и меньше 37 % у женщин или гемоглобин меньше 130 г/л у мужчин и 120 г/л у женщин.
Этиология.Анемии легче всего классифицировать исходя из размеров клеток. Микроцитарная анемия означает, что средний объем клеток (СОК — MCV) маленький, менее 80. Чаще всего к их развитию приводят дефицит железа, талассемии, сидеробластоз и отравление свинцом. Анемия хронического заболевания может быть либо микроцитарной, либо нормоцитарной. Для макроцитарной анемии характерен подъем СОК более 96. Чаще всего это наблюдается при дефиците витамина В12 или фолиевой кислоты, но также при токсическом воздействии алкоголя, болезнях печени, применении таких препаратов как метотрексат, зидовудин или фенитоин. При нормоцитарной анемии СОК нормальный. Это характерно для начальных стадий всех видов анемий, перечисленных выше, а также для большинства форм гемолиза.
Клинические проявления.Преобладающие симптомы анемии зависят больше от тяжести заболевания, чем от его этиологии. К ранним проявлениям относятся утомляемость, слабость и плохая переносимость нагрузок. По мере прогрессирования присоединяется одышка и головокружение. В конце-концов, при снижении доставки кислорода к головному мозгу появляется спутанность сознания и нарушения работы мозга. Смерть при анемии наступает наиболее часто вследствие снижения доставки кислорода к миокарду и развития его ишемии. Степень выраженности проявлений в большой мере зависит от исходного состояния пациента. У молодого здорового человека симптомы могут вообще отсутствовать при гематокрите 27 – 29 %, в то время как при тех же цифрах у пожилого пациента будет наблюдаться одышка или стенокардия.
Диагностика.После выявления анемии на основании снижения уровня гемоглобина или гематокрита первым шагом будет измерение СОК. Для определения специфической этиологии может потребоваться измерение уровней железа, витамина В12, фолиевой кислоты, подсчет ретикулоцитов, мазок периферической крови, реакция Кумбса и иногда даже биопсия костного мозга. Выбор исследований зависит от специфики данного случая.
Лечение.Кроме переливаний крови, лечение не может быть однотипным. Переливание эритроцитарной массы используют для поддержания гематокрита выше 25 – 30 %. Ориентируются на изначальное состояние пациента. У молодого и здорового пациента с переливанием можно подождать пока гематокрит не опустится до 20 %. У пожилого пациента с коронарной болезнью необходимо поддерживать гематокрит не менее 30 %. С каждой упаковкой перелитой эр-массы гематокрит должен подниматься на 3 процента. Цельную кровь используют редко, если вообще используют.
Железо-дефицитная анемия (ЖДА)
Определение.Анемия со снижением продукции эритроцитов и СОК менее 80, с наличием характерных гипохромных клеток и уменьшением запасов железа в организме.
Этиология.ЖДА практически всегда вызывается потерей крови, чаще всего через ЖКТ или при менструациях. Баланс железа в организме очень легко нарушить. В среднем мужчине в день нужен 1 мг железа, а женщине 2 – 3 мг. Организму трудно увеличить степень абсорбции железа в ЖКТ. Даже при небольшой степени потерь железа с кровью (скрытая кровь в стуле, более обильные месячные, увеличение потребности во время беременности) организм едва способен поднять уровень абсорбции до 3 – 4 мг в день. К другим причинам относятся потеря крови с мочой, мальабсорбция, гемолиз и уменьшение поступления железа с пищей.
Клинические проявления.Легкая анемия может вообще никак не проявляться. По мере того, как гематокрит опускается до отметки в 30 % появляется утомляемость и плохая переносимость нагрузок. При уровне в 25 % присоединяются тахикардия, сердцебиения, одышка при нагрузке и бледность. Пожилые и пациенты с коронарной болезнью могут начать страдать от одышки и при более высоких уровнях гематокрита. Тяжелая анемия проявляется головокружениями, спутанностью сознания, синкопе и болью в груди. При достаточно выраженной анемии может иметь место систолический шум изгнания (это характерно не только для ЖДА, но и для любого другого вида анемии).
Патогномоничные для ЖДА симптомы проявляются очень редко и на них нельзя опираться при постановке диагноза. Сюда относятся хрупкость ногтей, ложковидные ногти, глоссит и пикаицизм (извращенный аппетит). Диагноз ЖДА ставится на основании данных лабораторных методов исследования, а не клинической картины.
Диагностика.Наиболее характерным для ЖДА будет снижение уровня ферритина плазмы до менее 10 нг/мл. Измерение уровня ферритина обладает хорошей специфичностью, но плохой чувствительностью, потому что бывают ложноположительные результаты вследствие того, что ферритин – один из белков острой фазы воспаления и его уровень повышается при воспалении или злокачественных новообразованиях. СОК снижается, за исключением самых ранних стадий заболевания. Уровень железа сыворотки низкий, а общая железо-связывающая способность повышена. Наиболее информативным тестом, хотя и редко используемым, является биопсия костного мозга со специальной окраской для выявления запасов железа. Число ретикулоцитов должно быть маленьким.
Лечение.Чаще всего применяется пероральная терапия преператами сульфата железа. Парентерально железо вводят при мальабсорбции, очень высокой потребности в нем и у тех, кто не переносит пероральное железо. Наиболее эффективным способом восполнения запасов железа является переливание крови, но по понятным причинам оно не относится к рутинным методам лечения ЖДА.
Дата добавления: 2014-12-16 ; Просмотров: 526 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Исследование морфологии эритроцитов позволяет на ранних этапах выявить различные нарушения в системе кроветворения. В том числе, это справедливо для такого заболевания, как микроцитарная анемия.
Эритроциты – это красные кровяные тельца крови, которые имеют форму двояковогнутого диска. Размер одного эритроцита составляет 7-8 мкрн (80-100 фемтолитров). При изменении в строении, структуре, численности и составе эритроцитов, врачи выставляют диагноз анемия. Микроцитарная анемия характеризуется появлением в составе крови эритроцитов, имеющих малые размеры.
Эритроциты позволяют поддерживать жизнедеятельность человеческого организма. В норме их размеры составляют 80-100 фл.
В зависимости от данного показателя, различают:
Микроцитарную анемию (микроцитоз) при которой размеры эритроцитов менее 80 фл.
Макроцитарная анемия, при которой размеры эритроцитов превышают 100 фл.
Если размеры эритроцитов сохраняются в пределах нормы, то врачи говорят о нормоцитозе.
Цветовой показатель крови имеет немаловажное значение при диагностике различных заболеваний. Анемия может быть гипохромной, гиперхромной и нормохромной. За окраску крови отвечает гемоглобин, который входит в состав эритроцитов. Если его в крови недостаточно, то микроцитоз сопровождается гипохромией. Такое состояние носит название микроцитарной анемии.
Микроцитоз является часто встречающимся нарушением, при котором эритроциты приобретают небольшие объемы. При исследовании крови удается обнаружить большое количество мелких эритроцитов, что является отклонением от нормы.
Недостаточно просто установить факт микроцитарной анемии, требуется выявить причину, приведшую к данному нарушению. Особенно это актуально при первичном установлении диагноза. Следует принять во внимание, что микроцитоз сопутствует различным патологиям. Поэтому обязательно нужно выставить дифференциальный диагноз.
Некоторые разновидности анемии сами по себе приводят к развитию микроцитоза. Поэтому важно понять, какое состояние возникло раньше: анемия или микроцитоз. Зачастую гипохромная анемия развивается именно из-за того, что эритроциты уменьшаются в размерах.
Железодефицитная микроцитарная анемия является самым распространенным заболеванием, которое встречается среди всех других видов анемий.
Железодефицитная микроцитарная анемия может быть обусловлена следующими причинами:
Анемия на фоне гемоглобинурии, когда поврежденные эритроциты подвергаются массивной гибели, а гемоглобин, вышедший из них, начинает свободно циркулировать в крови. Анемия на фоне гемосидеринурии, когда гемоглобин накапливается в почках. При этом в моче будет наблюдаться увеличение уровня гемосидерина (продукт окисления гемоглобина).
Хроническая постгеморрагическая анемия, которая развивается на фоне различных заболеваний органов пищеварительной системы. При этом у человека на постоянной основе наблюдаются скрытые или явные кровотечения (маточное, почечное, носовое, желудочно-кишечное).
Анемия, развивающаяся при погрешностях в питании. Когда в меню человека слишком мало продуктов, содержащих железо.
Анемия, развивающаяся во время определенных периодов жизни, когда организм нуждается в повышенных дозах железа. Например, во время вынашивания ребенка, во время кормления грудью, при частых родах, при участии в донорстве крови.
Анемия, развивающаяся при нарушении процесса усвоения железа, либо при проблемах в его транспортировке. Часто подобные сбои наблюдаются у людей, страдающих от раковых новообразований в области органов пищеварительного тракта, при хронических воспалениях, затрагивающих систему органов ЖК.
Хотя железодефицитная анемия является самым часто встречающимся вариантом малокровия, тем не менее, нельзя забывать об иных разновидностях этого нарушения.
Гемоглобинопатия: наследственный микросфероцитоз, болезнь Минковского-Шоффара, талассемия.
Сидеробластная микроцитарная анемия. Это общее название для анемий, развивающихся на фоне нарушения в обмене железа. Такая анемия часто протекает параллельно с микроцитозом, гиперхромией, сопровождается снижением уровня гемоглобина в крови. Сидеробластные микроцитарные анемии могут наследоваться по крови, либо быть приобретенными в течение жизни. Например, анемии этого вида часто сопутствуют злокачественным опухолям в организме, либо хроническому алкоголизму.
Анемии, развивающиеся на фоне хронических инфекционных заболеваниий.
Анемии, развивающиеся на фоне отравления организма ядами, тяжелыми металлами и иными патогенными веществами. Все это негативным образом сказывается на процессах всасывания железа и на продукции гемоглобина. Симптомами интоксикационных анемий являются: микроцитоз, гиперхромия, наличие в крови телец Жолли, базофильная зернистость.
Врожденные аномалии усвоения железа и его утилизации, встречаются редко, однако эти нарушения будут приводить к развитию микроцитарной анемии.
Детям с целью определения любого вида анемии требуется время от времени сдавать кровь на анализ. Это исследование выполняют в рамках возрастной диспансеризации, либо чаще, по мере возникновения необходимости.
Симптомы, которые способны навести на мысль об анемии:
Искажение вкуса, желание употреблять необычную пищу.
Нарушения в поведении: излишняя апатия, снижение активности, повышенная утомляемость.
Отставание в умственном развитии.
Чаще всего у детей с такими симптомами диагностируется именно железодефицитная анемия. Нехватка этого микроэлемента приводит к снижению уровня гемоглобина в крови, что провоцирует гипоксию органов тканей той или иной степени выраженности.
Чтобы не допустить развития анемии в детском возрасте, необходимо следить за питанием ребенка. Меню должно быть составлено таким образом, чтобы организм малыша не испытывал дефицита в основных минералах и витаминах.
Дети, которые находятся на грудном вскармливании, в меньшей степени подвержены анемии, чем дети, которые получают коровье или козье молоко. После ведения прикорма, нужно постепенно включать в рацион малыша продукты, которые являются источником железа. Естественно, согласно возрастным требованиям организма.
Если у ребенка развивается микроцитарная анемия, то необходимо обратиться к доктору и сдавать кровь на анализ. Главным признаком неблагополучия является снижение уровня гемоглобина в крови.
Если в организме снижается уровень железа, то это ведет к развитию следующих патологических реакций:
Снижение запасов гемообразующих компонентов, которые находятся в костном мозге и в печени.
Ухудшение выработки ферритина, что приводит к снижению его уровня. Этот белок отвечает за сохранность железа в клетках тканей.
Увеличение железосвязывающей способности крови.
Увеличение уровня протопорфирина в эритроцитах.
Снижение активности ферментов, отвечающих за связывание железа внутри эритроцитов.
Если заболевание не лечить, то оно будет прогрессировать. Уровень железа и гемоглобина может снизиться до критических отметок. Эритроциты будут все время уменьшаться в размерах. В итоге, в крови будут циркулировать преимущественно микроциты. Кроме того, гемограмма выдаст пойкилоцитоз и гипохромию. Обнаружить это можно, проведя биохимический и клинический анализ крови. Эти исследования позволят подтвердить диагноз гипохромной микроцитарной анемии.
Обязательно нужно проводить дифференциальную диагностику железодефицитной анемии с иными видами малокровия. Так, на анемию, спровоцированную интоксикацией организма, будут указывать: базофильные включения в эритроцитах, повышение уровня свинца в крови, наличие в урине протопорфиринов и копропорфиринов. При высоком уровне в крови HbF и HbA2 можно подозревать талассемию.
Лечение микроцитарной анемии требует своевременного лечения. Обязательно нужно откорректировать меню больного.
При условии, что заболевание развивается на фоне хронических кровопотерь, их нужно купировать. У женщин к развитию малокровия часто приводят обильные менструальные кровотечения. Поэтому все пациентки должны пройти обследование у гинеколога. Иногда требуется лечение органов пищеварительной системы. Для этого привлекают гастроэнтеролога.
Зачастую врач назначает препараты железа. По возможности, предпочтение отдают пероральному приему лекарственных средств. Инъекционное введение железа сопряжено риском развития аллергических реакций, а также дает множество побочных эффектов. Самолечение недопустимо, так как избыточное содержание в организме железа представляет не меньшую угрозу, чем его дефицит.
Автор статьи: Шутов Максим Евгеньевич | Врач-гематолог
Образование: В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
7 тревожных симптомов боли в животе
Вызывает ли рак повторное использование масла?
источник
Микроцитарная анемия ( МСV ) встречается в разы чаще, чем остальные виды анемий, и в ее основе почти всегда лежит недостаток железа. Только вот механизмы развития нехватки Fe при микроцитарной анемии бывают разные.
Самая частая форма микроцитарной анемии это железодефицитная . Ее развитие напрямую связано с нарушением поступления железа или повышенным расходом: вегетарианство, бедная железом пища; повышенными потерями железа в организме: микрокровотечения, беременность, опухоли, глистные инвазии; нарушение всасывания железа в желудочно-кишечном тракте.
Бывает еще так называемая анемия хронических заболеваний (АХЗ) , которая имеет очень сложный механизм развития, но так или иначе связана с недостатком железа. Нарушается гомеостаз железа, уменьшается выработка эритропоэтина, а также снижается время продолжительности жизни эритроцита. Под влиянием воспалительных стимулов снижается захват железа из кишечника и блокировка его выхода из макрофагов. Простыми словами железо поступает в организм, но плохо усваивается и неэффективно используется .
Лабораторная диагностика – алгоритм действия:
Общий анализ крови (наиболее значимые показатели)
- МСV (средний объем эритроцита) — микроцитоз ,
- МСН (среднее содержание гемоглобина в эритроците) – гипохромия.
- МСНС (средняя концентрация гемоглобина в эритроците) 320 г/л .
- RDW (ширина распределения эритроцитов) более 14%, анизоцитоз, пойкилоцитоз .
Данные показатели могут встречаться при нормальных значениях гемоглобина и эритроцитов, что означает, что железодефицит уже есть, но анемия еще не успела развиться – самое время начать лечение и предупредить болезнь.
Если ко всему к этому есть снижение гемоглобина и/или эритроцитов, то можно смело ставить диагноз гипохромная микроцитарная анемия и установить степень тяжести.
- Гемоглобин — Hb (у женщин СОЭ .
Тяжесть по уровню гемоглобина:
- Легкая М 110-129 г/л; Ж 110-119 г/л; Беременные Ж 100-109 г/л
- Средняя М 80-109 г/л; Ж 80-109 г/л; БЖ 70-99 г/л
- Тяжелая М гипохромная микроцитарная и указываем степень тяжести. С большой вероятностью это окажется железодефицитная, но пока не докажем диагноз не ставиться (только под вопросом: железодефицитная?).
Далее для уточнения типа анемии дополнительно провести биохимический анализ крови
Сывороточное железо (СЖ) в связи с циркадными ритмами организма рекомендуется определять в 7-10 часов утра .
- СЖ снижено→ определить трансферин→ повышен → ЖДА
- Если трансферин в норме → определить ферретин → снижен →ЖДА
- Если ферретин в норме или повышен → анемия хронических заболеваний (АХЗ)
- Если трансферин снижен → АХЗ
- Сывороточное железо норма или повышено → консультация гематолога для поиска редких форм анемии.
Биохимический анализ крови на данные показатели можно проводить поэтапно, как показано на схеме, но лучше, если есть возможность, определить все показатели: трансферин, ферретин, сывороточное железо и еще общую железосвязывающую способность (ОЖСС).
Не всегда удается определить эти показатели разом, в связи с особенностями медицины в РФ (ДМС – требует обоснованности назначения для страховых компаний, может отсутствовать в страховой программе пациента; ОМС – нет средств каждому проводить развернутый анализ на данные показатели; Платная –отсутствие финансовой возможности человека проверить все показатели).
- Норма железа у мужчин: 13-30 мкмоль/л, у женщин 12-25 мкмоль/л.
- Ферретин (депонированное Fe в клетках) в норме 15-20 мкг/л (при ЖДА снижен)
- Трансферин (транспортная форма Fe) в норме 2,0-3,8 г/л (при ЖДА повышен)
- ОЖСС в норме 30-85 (при ЖДА повышена)
Кроме этого перечня существует еще один показатель, характерный для железодефицитной анемии – это повышение уровня растворимых трансфериновых рецепторов (sTfR) . Но он еще не является общедоступным для экспресс диагностики в любой лаборатории (при ЖДА повышен). Уровень sTfR помогает дифференцировать железодефицитную анемию от анемии хронических заболеваний.
Синдромы, которые могут встречаться при анемии, связанной с дефицитом Fe.
Сидеропения: кожные покровы, придатки кожи и слизистые (сухость кожи, ломкость ногтей, койлонихии — ложкообразная форма ногтей); извращение вкуса, глоссит, дисфагия — нарушение глотания; диастолическя дисфункция миокарда.
Анемический синдром: головокружение, головные боли, шум в ушах, мелькание мушек, слабость, утомляемость, снижение работоспособности, хроническая усталость, бледность кожи и слизистых, сердцебиение, одышка при нагрузке.
Тревожные сигналы ( Красные флаги ) при которых необходимо белее детально подойти к выявлению причины анемии:
- ЖДА у мужчин
- Дефицит железа у женщин после менопаузы
- Отсутствие ответа на лечение пероральными препаратами железа
- Похудание, недомогание, озноб, потливость
- ЖКТ симптомы, особенно кровотечение (черный кал — милена).
Для поиска других причин железодефицитной анемии (не связанные с дефицитом Fe в пище) можно дополнительно подключить такие виды исследований как:
- Фиброгастроскопия и колоноскопия – выявление скрытых очагов микрокровотечений в органах желудочно-кишечного тракта. Предварительно можно сдать анализ кала на скрытую кровь. Особенно если анемия развилась поле 50 лет.
- Консультация гастроэнтеролога. Диагностика таких заболеваний как: атрофический гастрит, энтериты, колиты, целиакия, обусловленные нарушением всасывания железа из ЖКТ.
- Связь с повышенным конкурентным потреблением Fe: поиск паразитов в организме (глистные инвазии), опухоли.
- Для женщин консультация гинеколога, для исключения причин хронической кровопотери в связи с заболеваниями матки и придатков. Возможная беременность.
- Пристрастие к продуктам, способствующих нарушению всасывания железа: чай, кофе, продукты богатые кальцием.
Если по результатам обследования выявлено, что анемия связана с дефицитом железа. Попутно исключили или подтвердили причины анемии, не связанные с дефицитом железа в пище. Начинаем лечение.
Продуктами богатыми железом уже очень сложно восполнить железодефицит, так как максимальное усвоение железа из них в сутки составляет 2,5 мг. Из препаратов Fe3+ и Fe2+ оно усваивается в разы больше.
Начинаем лечение железосодержащими препаратами. Лучше использовать 3-х валентное железо ( Fe3+ ). Меньше факторов, влияющих на всасывание, чем у 2-х валентных препаратов, лучше переноситься, меньше побочных явлений.
Лечение не менее 3-х месяцев (чтобы создать и насытить депо железа в организме), даже если через 1 месяц нормализуется гемоглобин и все показатели.
Пример лечения 3-х валентным препаратом: железа гидроксид полимальтозат (мальтофер или феррумлек) по 100 мг 2-3 раза в стуки по назначению врача в зависимости от тяжести анемии в течение 3-х месяцев.
Пример лечения 2-х валентным препаратом: железа глюконата дигидрат +марганец+медь (Тотема) раствор для приема внутрь 1 ампула (50 мг железа) 2-3 раза в сутки 30 дней макс доза 200г (4 ампулы) по назначению врача в зависимости от тяжести анемии.
На 7-10 день, после начала терапии хорошо бы проверить ответ на лечение, определив в крови ретикулоциты. При хорошем ответе на лечение их количество резко повышается (ретикулоцитарный криз), означает что пошел активный синтез эритроцитов. Особенно ярко выражено, когда общее количество эритроцитов было значительно снижено.
После чего каждый месяц контрольный анализ крови до конца лечения.
Если попутно выявлены другие причины железодефицита, занимаемся их устранением.
Контроль за лечением. через 30 дней прирост гемоглобина +10, гематокрита +3% — продолжить лечение.
Если отсутствует улучшение, то консультация гематолога. Лечение минимум 3 месяца с ежемесячным контролем общего анализа крови.
источник
Макроцитарная и микроцитарная анемии являются наиболее распространенными видами гематологических заболеваний. Они выступают вторичной патологией системы кроветворения, и проявляются снижением уровня железа в красных тельцах. Заболевания поражает преимущественно детей, подростков и молодых женщин. Какие же причины способствуют развитию данного вида анемий? По каким признакам можно определить начальную стадию заболевания?
Макроцитарная анемия является патологическим состоянием, при котором происходит увеличение эритроцита в размерах больше 100 микрон, вследствие уменьшения их количества и снижения уровня гемоглобина. Состояние проявляется нарушением кроветворной функции на фоне патологического изменения баланса макроцитов, когда разрушение клеток происходит значительно быстрее, чем их формирование.
Макроцитарная гиперхромная анемия проявляется появлением мегалобластных клеток, неспособных переносить кислород.
В большинстве случаев патология носит наследственный характер, поскольку передается от матери к ребенку. Вторичный тип макроцитарной анемии развивается на фоне дефицита фолиевой кислоты или цианокобаламина (витамина В12).
Микроцитарная анемия характеризуется уменьшением размера эритроцита, на фоне уменьшения содержания в них гемоглобина, меньше 80 микрон. Нарушение синтеза гемоглобина, вследствие недостаточной концентрации железа приводит к гипохромному окрашиванию красных кровяных тел.
Обнаружение микроцитов в общем анализе крови служить характерным признаком формирования какого-либо вида анемий, которые и являются главной причиной размножения патологических клеток в крови.
Наиболее распространенной причиной микроцитарной анемии является недостаточное содержание железа в организме. Когда диагноз подтвержден, то специалисты выявляют причину, по которой микроэлемент не усваивается клетками.
Причины могут быть разнообразными:
- Кровотечения различного происхождения (красные тела не успевают стать полноценными клетками).
- Нарушение обмена веществ (снижается или прекращается усвоение железа).
- Нарушение механизма транспорта железа (происходит вследствие недостаточной концентрации трансферина).
- Недостаточность железа вследствие врожденных патологий.
Для развития макроцитарной анемии необходим пусковой механизм, который приведет к ряду патологических изменений в процессе кроветворения. Так, выделяют следующий ряд причин, способствующий формированию патологии:
- Дефицит фолиевой кислоты, меди, витамина В и С. Нарушение всасывания микроэлементов происходит в пищеварительном тракте или при избыточном расходе витаминов печенью. Как правило, наблюдается в пожилом возрасте в связи с физиологическими изменениями.
- Период беременности. Интенсивное использование витаминов и микроэлементов для построения организма плода и поддержания функционирования систем матери.
- Новообразования в печени. При поражении паренхимы органа происходит нарушение процессов деления клеток, необходимых для выработки ДНК-структур.
- Гипотиреоз. Снижение функций щитовидной железы приводит к нарушению обменных процессов.
- Нарушение процессов гомопоэза.
- Интоксикация различными видами токсинов. Злоупотребление алкоголем и некоторыми медикаментами приводят к расстройству обмена пуринов, и нарушению полноценного синтеза ДНК.
Анемии, связанные с патологическим увеличением эритроцитов, разделяют на виды:
- Мегалобластные . Возникают вследствие недостаточного поступления или усвоение микроэлементов и витаминов. В крови выявляют мегалобласты, разрушение эритроцитов во внутримозговом веществе, а также появление тромбоцитопении.
- Немегалобластные . Вызванные хроническими воспалительными процессами в печени. Формирование патологии наблюдается у пациентов с миелодиспластическим синдромом.
Классификация микроцитарных анемий связана с изменениями эритроцита, а именно его окраски, формы и вариабельности включений. В данную группу включены следующие гематологические патологии:
- Микросфероцитарная анемия. В периферической крови появляются сфероциты, что характерно для генетического микросфероцитоза или заболевания Минковского-Шоффара.
- Эллиптоцитоз, талласемия. В анализах наблюдаются эллиптоциты и недостаток пируваткиназы.
- Серповидноклеточная болезнь. Наследственная форма анемии, при которой эритроциты приобретают серповидную форму.
- Мишеневидные. Гемоглобинопатии связанные с заболеваниями печени.
- Тромботические микроангиопатические гемолитические анемии.
- Апластические. Возникают из-за изменений системе кроветворения, по цветному показателю такая анемия нормохромная.
Широкого распространения среди гемолитических заболеваний приобрел микросфероцитоз. Это наследственная форма заболевания, которая передается по аутосомно-доминантному типу, поражает преимущественно мальчиков. Механизм развития анемии основан на генетическом дефекте белкового вещества мембраны эритроцитов, или нарушением его функциональных способностей. Сфероцитарная патология приводит к изменению электролитного обмена, вследствие чего происходит уменьшение внутриклеточной среды красных клеток и их ригидности.
Типичным представителем группы микроцитарных гемолитических недугов стала железодефицитная анемия, связанная с дефицитом железа в организме.
Данный вид анемии включает в себя целый ряд железодефицитных состояний, которые возникают на фоне различных причин и факторов:
- Гемоглобинурия (патологический процесс, при котором происходит разрушение эритроцита, с дальнейшим выходом гемоглобина в плазму).
- Гемосидеринурия (происходит скопление гемоглобина в почках, с его дальнейшим выведением через мочу).
- Хронические постгеморрагические состояния (патология формируется на фоне длительного внутреннего или наружного кровотечения).
- Алиментарная анемия (дефицит поступления железа с продуктами питания).
- Физиологическая анемия (наблюдается в период беременности и лактации, когда происходит повышение потребностей в данном микроэлементе).
- Нарушение усвоения и транспорта железа (отмечается при формировании хронических воспалительных процессов в пищеварительном тракте, нарушая процесс всасывания микроэлементов в кишечнике).
При железодефицитной анемии наблюдаются различные по строению красные клетки. Так, в большинстве случаев, это микроциты. Однако может наблюдаться нормоцитарная анемия, связанная с постгеморрагическими состояниями. Увеличенные в размерах эритроциты свойственны патологиям, сформировавшихся на фоне дефицита фолиевой кислоты и витамина В12.
Симптоматика довольно разнообразна, от бессимптомной формы до тяжелого гемолитического состояния, с возможным летальным исходом. Как правило, диагностируется анемия средней тяжести. Патологические симптомы могут проявиться как в молодом, так и в пожилом возрасте. При раннем появлении симптомов заболевания, возможно более тяжелое течение с высоким риском осложнений.
В зависимости от тяжести клинической картины выделяют три вида течения заболевания:
- Легкая форма (состояние пациента удовлетворительное, а селезенка увеличена незначительно).
- Среднетяжелая форма (анемия умеренного характера, наблюдается гемолиз, желтушность кожных покровов, увеличение кроветворного органа).
- Тяжелая форма (анемия выраженного характера, интенсивная желтуха, значительное увеличение селезенки, пациенту необходимо переливание крови).
Основные клинические симптомы характерные для всех видов гемолитических патологий:
- быстрая утомляемость;
- расстройство внимания;
- головокружение и головные боли;
- избыточная сонливость;
- ускорение пульса;
- одышка.
Клиническая картина сидеропенического синдрома проявляется симптомами:
- Изменение вкусовых предпочтений (употребление в пищу сырого мяса или мела).
- Расстройство обаяния (желание вдыхать аромат бензина, ацетона, красителей).
- Ухудшение состояния придатков кожи (ломкость волос, образование белого пятна на ногтевой пластине).
- Изменение кожных покровов (сухость и снижение эластичности кожи, появление заед около уголков ротовой полости).
Макроцитарная анемия может носить цикличный характер, так период угасания симптомов, сменяется их обострением. Поскольку для недуга характерно медленное развитие, то патологический процесс поражает не только органы кроветворения, но и желудочно-кишечную и нервную систему. При поражении боковых и задних спинномозговых нервов возникает нарушение сердечной деятельности, которые проявляются ускорением сердечного ритма.
В период беременности происходит усиленное размножение клеток, для которых необходимо использовать высокие концентрации фолиевой кислоты и цианокоболамина. Эритроцитарная патология возникает при недостаточном употреблении микроэлементов с пищей, а также при заболеваниях пищеварительного тракта, когда происходит нарушение всасывания железа в кишечнике.
В основе механизма развития патологии лежат изменения в процессе кроветворения, что связано с расстройством образования эритроцитов, они приобретают больших размеров.
Женщины, которые входят в группу риска:
- многоплодная беременность;
- гемолиз различного происхождения;
- длительный прием противосудорожных медикаментов;
- хронические воспалительные процессы в органах желудочно-кишечного тракта.
Терапевтические мероприятия проводят в стационаре и амбулаторно, в зависимости от выраженности симптомов и наличия сопутствующих заболеваний.
Основные лечебные принципы:
- Инъекционное введение витаминных комплексов.
- Диетотерапия с высоким содержанием животного белка.
- Симптоматическая терапия включает применение анестетиков, и кровеостанавливающих препаратов.
Лечение анемических состояний должно быть направлено на устранение причины, вызвавшей их возникновение.
Таким образом, основной отличительной чертой между данными видами анемий является разный размер эритроцитов, а также причинами, которые спровоцировали их формирование. Так, увеличение красных телец связано с недостатком всасывания фолиевой кислоты и цианокоболамина, а их уменьшение, недостатком железа в микроорганизме. Обе формы связаны с несбалансированным рационом, поэтому их можно устранить при помощи лечебной диеты и приемом специальных медикаментов.
источник
АНЕМИЯ /anaemia, греч. an- и haima — бескровие, синоним малокровие/ — состояние, характеризующееся уменьшением числа эритроцитов и снижением уровня гемоглобина в единице объема крови.
По классификации Г.А.Алексеева /1970/, анемии делят на три основные группы: вследствие кровопотерь — постгеморрагические; вследствие нарушенного кровообразования; вследствие повышенного кроверазрушения — гемолитические.
Как указывает А.И. Воробьев /1985/, классифицирование анемий на основе патогенеза и назологическое классифицирование анемий невозможно с позиций научной строгости, поскольку каждую анемию нельзя вместить в рамки группы, к которой она принадлежит. Например, постгеморрагическая анемия железодефицитная относится к группе анемий, связанный с кровопотерей, и к группе анемий с нарушениями образования крови. К анемиям, вызванным нарушением кровообразования в детском возрасте, относят железодефицитную, витамин-В12-фолиево-дефицитную и апластические анемии.
За рубежом в основе классификации анемий лежит средний эритроцитарный объем /СЭО/ эритроцитов. Соответственно выделяют микро-, макро- и нормоцитарные анемии. Форма эритроцитов — серповидноклеточная, анемия, мишеневидная и т.д.
К МИКРОЦИТАРНЫМ АНЕМИЯМ относятся: железодефицитная анемия, малая и большая b-талассемия, отравление свинцом, анемии при хронических заболеваниях.
МАКРОЦИТАРНЫЕ АНЕМИИ часто сопровождаются мегалобластозом костного мозга, поэтому и классифицируются по наличию или отсутствию мегалобластоза.
МЕГАЛОБЛАСТНАЯ АНЕМИЯ наблюдается при дефиците витамина В12 и фолиевой кислоты, применении лекарственных средств, нарушающих метаболизм фолиевой кислоты /метотрекстат, триметоприм/, болезнях обмена веществ /оротовая ацидурия/, выделяют также тиамин-зависимую анемию.
ИЗОЛИРОВАННАЯ МАКРОЦИТАРНАЯ АНЕМИЯ /без мегабластоза/ встречается при заболеваниях печени, поражении костного мозга, гипотиреозе, применении некоторых лекарственных средств /вальпроевая кислота/.
НОРМОЦИТАРНЫЕ АНЕМИИ чаще возникают при кровотечениях, гемолизе и снижении продукции эритроцитов.
При КРОВОТЕЧЕНИИ необходимо выявить источник кровотечения. Острое кровотечение сопровождается пропорциональной потерей плазмы и клеток, поэтому уровни Нв и Нt не изменяются. Анемия возникает только после восстановления ОЦК /примерно через 3 суток/. Ретикулоцитоз возникает через 6-12 часов после кровопотери в связи с мобилизацией запасов костного мозга; развернутая гемолитическая картина наблюдается через 5-10 сут. Хроническая кровопотеря приводит к дефициту железа и, как следствие, к микроцитозу и уменьшению числа ретикулоцитов.
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ развиваются в результате преждевременного разрушения эритроцитов и включают множество заболеваний.
ПРИЧИНАМИ гемолиза эритроцитов могут быть: механическое повреждение эритроцитов /искусственные клапаны сердца, травма/, термическое повреждение, микроангиопатии, гиперспленизм, ауто- и изоиммунные анемии, отравления грибами, болезнь Вильсона /повышается уровень меди в крови/, инфекционные заболевания, нарушение структуры мембраны эритроцитов, гемоглобина, ферментопатии. Отсюда все гемолитические анемии делятся по принципу уточнения фактора, вызвавшего гемолиз.
Наследственные анемии делятся на следующие группы:
С нарушением мембраны эритроцитов — наследственный микросфероцитоз, наследственный овалоцитоз.
Связанные с нарушением активности ферментов эритроцитов — дефицит глюкозо — 6 — фосфат — дегидрогиназы.
Связанные с нарушением структуры и синтеза гемоглабина — В — талассемия и серповидноклеточная анемия.
Из наследственных гемолитических анемий у детей чаще встречается микросфероцитоз, реже бывает дефицит Г-6-ДГ. В тропических странах распространены семейные талассемия и серповидноклеточная анемия. Из приобретенных анемий чаще встречается — гемолитическая болезнь новорожденных, в тропиках — анемии, обусловленные дефицитом витаминов, паразитарные.
ДИАГНОСТИКА. В пользу гемолитической анемии свидетельствует бледность кожных покровов с желтушным оттенком, иногда внезапно возникшие. При лабораторном обследовании отмечается повышение уровня непрямого билирубина в сыворотке, снижение сывороточного гаптоглобина, при тяжелом гемолизе — снижение гемоглобина и гемоглобинурия. Отмечается изменение формы эритроцитов: микросфероциты, мишеневидные и т.д. Дальнейшее обследование включает проведение пробы Кумбса, электрофорез Нв, определение осмотической резистентности. Осмотическая резистентность при гемолитических анемиях резко снижается. Обязательно исследуется геммограмма с подсчетом числа ретикулоцитов. В зависимости от степени гемолиза отмечается рост числа ретикулоцитов. Во время гемолитических кризисов число их может достигнуть 100%. Число тромбоцитов всегда в норме. Число лейкоцитов в период кризисов растет, с нейтрофильным сдвигом в лево. В зависимости от уровня Цветного показателя /ЦП/ анемии могут быть нормохромные, гипохромные, гиперхромные. Все гемолитические анемии — нормо — или гиперхромные, за исключением талассемии, которая всегда гипохромная. Отмечается снижение числа эритроцитов и уровня Нв, а также изменение эритроцитометрической кривой Прайс-Джонса. Если средний диаметр нормальных эритроцитов 7,2-7,5 мкм, то при гемолитических анемиях кривая Прайс-Джонса растянута за счет анизацитоза, поскольку имеются эритроциты с диаметром от 4 до 9 мкм и более. Реакция Кумбса, как правило отрицательная. Костный мозг очень богат клеточными элементами за счет гиперплазии красного ростка.
ТАЛАССЕМИЯ /мишеневидно-клеточная анемия, болезнь Кули/ характеризуется повреждением /делецией/ гена, ответственного за синтез a-или b-цепей, При a- талассемии нарушен синтез a-цепей. Поскольку данная цепь входит в состав всех нормальных фракций гемоглобина, при a-талассемии наблюдается равномерное снижение этих цепей. В основе b-талассемии лежит наследственное угнетение b-цепей, входящих в состав НвА. Описаны случаи g-, d-, bd-талассемии с нарушением синтеза соответствующих цепей глобина. Чаще встречается b-талассемия.
Талассемия распространена в основном в зоне субтропического климата, в Средиземноморье, среди населения Юго-Восточной Азии, Африки, на островах Тихого океаны. Спорадические случаи встречаются во всех районах земного шара, они являются спорадически возникшими мутациями. Поскольку гемозиготы погибают, не достигнув детородного возраста, то отбор идет в пользу гетерозигот.
Малая талассемия (носительство признака (-талассемии).
Гетерозилотная форма (-талассемии сопровождается незначительной анемией. Уровень гемоглобина в среднем на 20-30% ниже возрастной нормы. Эритрциты гипохромны, отличаются микроцитарностью, отмечается пойкило- и овалоцитоз и часто грубые базофильные включения, Встречаются мишеневидные клетки, но в небольшом количестве; их не следует рассматривать в качестве специфического для таласемии признака, Может умеренно сокращаться продолжительность жизни эритроцитов, однако явные признаки гемолиза, как правило отсутствуют. Уровень железа в сыворотке не изменен или повышен.
У носителей гена талассемии нередко ошибочно ставят диагноз железодефцитной анемии, по поводу чего их в течение длительного времени лечат препаратами железа. Более чем у 90% лиц, носителей гена, уровень НвА2 повышен до 3,4-7,0%, что имеет диагностическое значение. Почти у половины из них несколько повышен (в пределах 2-6%) уровень НвF.
Если мать или отец являются носителями гена, при каждой беременности риск развития большой талассемии составляет 25%. Методики, позволяющие произвести забор крови плода, создают возможность ее препатальной диагностики. С помощью прямой аспирации крови из вен плаценты при фетоскопии, выполняемой в 16-20 недель беременности, может быть полчена небольшая проба крови плода. Ее инкубируют с лейцином 14С, после чего можно количественно оценить синтез (-,(- и (-цепей. У гомозиготных по (-талассемии плодов с помощью этого метода удается продемонстрировать заметное снижение синтеза (-цепей.
Выявление пораженных плодов сможет быть осуществлено при использовании ферментов, ограничивающих эндонуклеазу, для анализа ДНК фибробластов, полученных из амнистической жидкости. Биопсия трофобластов позволяет установть дианоз у плода в возрасте10-12 недель.
Большая В-талассемия /гомозиготная форма/ протекает тяжело вследствие гемолиза и нарушенного эритропоэза. Известна как болезнь Кули.
Патогенез. При талассемии не синтезируется или мало синтезируется одна из цепей глобина. В норме синтез цепей сбалансирован и свободных цепей нет. При талассемии появляются избыточные цепи глобина, что является главной причиной неэффективного эритропоэза. Эритрокариоциты разрушаются в костном мозге, а эритроциты и ретикулоциты периферической крови — в селезенке. При b-талассамии происходит избыточное накопление в эритроцитах фетального гемоглобина /НвF/, который обладает повышенным сродством к кислороду, в результате растет тканевая гипоксия, нарушается рост и развитие ребенка. Избыток миелокариоцитов в скелете вызывает деформацию костей.
КЛИНИЧЕСКАЯ картина. Проявления большой талассемии начинаются на первом году жизни. Характерна бледность, тяжелая анемия — гемоглобин до 60-20 г/л, эритроциты до 2 млн. В мазках периферической крови-мишеневидные эритроциты анизо- и пойкилоцитоз, гипохромия эритроцитов.
Увеличение числа клеток эритроидного ростка в костном мозге, является не истинной гиперплазией красного ростка, а результатом накопления функционально неполноценных эритроидных элементов. Увеличение их содержания происходит за счет накопления ядросодержащих клеток красного ростка, не способных к дифферецировке, т.е. отмечается неэффективный эритропоэз.
Кроме анемии и желтухи, для талассемии характерны отставание в росте и изменения в костной ткани /особенно со стороны костей черепа/, деформация черепа, приводящая к формированию “лица больного анемией Кули” — башенный череп, увеличение верхней челюсти, монголоидный разрез глаз, выступление резцов и клыков с нарушением прикуса. Рентгенологически определяется симптомом “волосатого черепа” или “ежика”, так называемый игольчатый периостоз. В длинных трубчатых костях расширены костномозговые полости, кортикальный слой истончен, часты патологические переломы.
Ранний признак талассемии — значительное увеличение печени и селезенки. При развитии гиперспленизма на фоне- лейко- и тромбоцитопении развиваются вторичные геморрации, инфекционные осложнения. Начиная с 8-10 лет возникают осложнения, связанные с перенасыщением органов железом / гемосидерозом внутренних органов/. Гемосидероз миокарда с развитием сердечной недостаточности — основная причина смерти больных анемией Кули.
Гепатомегалия является проявлением гемосидероза и заканчивается фиброзом, формированием цирроза печени. Фиброз поджелудочной железы осложняется развитием сахарного диабета; может развиться калькулезный холецистит. Снижение концентрационной способности почек усугубляет гипоксическую дистрофию. Даже больные, прошедшие лечение, умирают в возрасте 17 лет. Однако при хорошем диспансерном наблюдении и периодическом введении десферала срок жизни больного может быть продлен.
Выделяют 3 степени тяжести гомозиготной В-талассамии:
Тяжелую, развившуюся с первых месяцев жизни ребенка и быстро заканчивающуюся смертью ребенка;
Хроническую, наиболее часто встречающуюся, при которой дети доживают до 5-8 лет;
Легкую при которой больные доживают до взрослого возраста.
Выделяют также малую /гетерозиготную форму/ В-талассамии. Наблюдается у практически здоровых лиц со сбалансированным синтезом глобинов в костном мозге и отсутствием неэффективного эритропоэза, однако у них обнаруживаются мишеневидные эритроциты.
ЛЕЧЕНИЕ. Малоэффективно. Оно состоит в основном из трансфузионной терапии отмытыми эритроцитами и введения хелатора десферала (суточная доза 250-500 мг.), способствующего экскреции с мочой значительного количества железа, особенно при насыщении организма аскорбиновой кислотой. Назначают препараты, необходимые при напряженном эритропоэзе, в частности фолиевую кислоту и витамин В12, другие витамины группы В /В1,6,15/ и витамин Е. Применение глюкокортикоидов считается неоправданным.
При выраженной спленомегалии показана спленэктомия. По возможности операцию откладывают до 5 летнего возраста, чтобы уменьшить риск сепсиса.
СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ — также относится к гемоглабинопатиям — широко распространена в странах Средиземноморья, Ближнего и Среднего Востока, Индии, Америке. Серповидноклеточная анемия /СКА/ — гемоглобиноз S, “реологическая болезнь” описана в начале 20 в., когда были открыты эритроциты серповидной формы, в 1956 году было доказано, что Нв S отличается от Нв А тем, что в положении 6 в цепи глютаминовая кислота заменена на валин.
ЭТИОЛОГИЯ. Предполагают, что этот метаморфоз произошел впервые при инвазии плазмодия малярии как защитный акт, а затем стал наследоваться. Наследуется заболевание аутосомно и носит кодоминантный характер, поскольку нарушения выявляются у обоих партнеров, отсюда высокий уровень заболеваемости и смертности, обусловленный гомозиготностью.
ПАТОГЕНЕЗ. Замещение глютамина валином приводит к тому, что у Нв S вместо отрицательного заряда, характерного для Нв А, появляется нейтральный, а это усиливает связь одной молекулы с другой молекулой гемоглобина. Внутри эритроцита Нв переходит в состояние геля, а при пониженном парциальном давлении кислорода осаждается в виде тактоидов — веретенообразных остроконечных кристаллов. Тактоиды растягивают эритроциты придавая им серповидную форму. Появление серповидных эритроцитов значительно повышает вязкость крови, что уменьшает скорость кровотока и приводит к закупорке мелких капилляров. S-эритроциты теряют пластичность, застревают в капиллярах с последующим тромбозом /окклюзией/ сосудов, возникают инфаркты, сопровождаемые гипоксией.
КЛИНИЧЕСКАЯ КАРТИНА. При физикальном обследовании больных выявляются бледность кожи и слизистых оболочек, желтушность, усиливающаяся с возрастом. У младших детей начиная с 6 месяцев пальпируется селезенка, однако к 8 годам спленомегалию обнаруживают редко. Это объясняется фиброзом селезенки, развившимся на фоне частых инфарктов. У 60% детей обнаруживают гепатомегалию. Нередко отмечают кардиомегалию, при этом над областью сердца выслушивают различной интенсивности шумы. Характерным симптомом является аденопатия, в желчном пузыре выявляются камни /холелитиаз/, часто встречается язва 12 перстной кишки.
Больные СКА имеют характерный вид: удлиненный нижний сегмент тела, дорсальный кифоз и люмбальный лордоз, куполообразное /“готическое”/ небо, выступающий лоб и “башенный” череп, значительное удлинение конечностей. Нарушение процессов роста у этих детей имеет определенные закономерности: в возрасте до 3 лет, как правило, нет отставания от сверстников, затем некоторая задержка до 7-8 лет, а в взрослом возрасте больные имеют нормальный рост и даже несколько выше. Дети отстают в половом развитии, однако уровень интелектуального развития как правило нормальный.
Заболевание протекает хронически, больные тяжелой формой живут около 20 лет Бывают периодически острые состояния — кризы, которые делятся на 2 группы: 1 -клинические /болевые или вазоокклюзионные/, при которых показатели состава гемоглобина и ретикулоцитов не отличаются от нормы; 2- гематологические с резким снижением уровня Нв и высоким ретикулоцитозом. Нередко кризы сочетаются.
КЛИНИЧЕСКИЕ КРИЗЫ /болевые, вазоокклюзионные, секвестрационные / начинаются на 2-3 году жизни ребенка. Они провоцируются инфекционными заболеваниями, лихорадкой, дегидратацией организма, физическим переутомлением. Болевой синдром связан с возникновением инфарктов вследствие окклюзии серповидными эритроцитами сосудов. Инфаркты могут быть в костном мозге, костях, перартикулярных тканях суставов. Основной признак окклюзии — боль различной интенсивности с повышением температуры, возможным симметричным опуханием тыльных поверхностей кистей стоп – серповидно-клеточный дактилит,синдром “рук-ног”,что может быть первым клиническим проявлением. Рентгенологически наблюдаются остеосклеротические изменения. В костном мозге возникают некрозы, инфаркты, с повышением температуры, беспокойства, расстройства сознания. Со стороны легких — отдышка, кровохарканье. Со стороны ССС- тахикардия, цианоз.
Секвестрационный криз происходит при захвате серповидных эритроцитов селезеночными синусами, которые являются местом гибели утративших свою силу S –эритроцитов, что приводит к депонированию крови в селезенке и печени, уменьшению ОЦК , развитию гиповолемического шока. Причем быстрое увеличение селезенки сопровождается побледнением кожи и слизистых оболочек, напряжением мышц живота из-за болезненности селезенки, симптомами сердечной недостаточности, рвотой. У детей со спланомегалией наблюдаются частые рецидивы, и это нередко приводит к смертельному исходу.
ГЕМАТОЛОГИЧЕСКИЕ КРИЗЫ. /апластический, гипергемолитический, мегалобластный /
Наиболее тяжелый — апластический криз наблюдается у детей 5-8 лет. В результате временного прекращения образования эритроцитов резко падает уровень гемоглобина, исчезают ретикулоциты. Наступает аплазия только красного ростка; нарушение лейко- и тромбоцитопоэза нет. Отмечается бледность кожных покровов слизистых оболочек, лихорадка, боли. Боли в костях, почти всегда имеются признаки сердечной недостаточности. При этом в крови содержится около 20 г/л Нв.
Гипергемолитический криз развивается в результате резкого гемолиза эритроцитов. Кроме бледности и лихорадки, для этого криза характерно нарастание желтушности.
Мегалобластический криз имеет много общего с апластическим, но в данном случае кроме резкого снижения гемоглобина и ретикулоцитов, в костном мозге происходит мегабластная гиперплазия красного ростка. При этом кризе большое значение придают хроническому дефициту фолиевой кислоты.
ЛЕЧЕНИЕ. Специальных методов лечения серповидноклеточной анемии не существует, применяется симптоматическая терапия.
Назначаются анальгетики и гидратационная терапия с целью уменьшения вязкости крови. Назначают ингибиторы образования серповидных эритроцитов, в частности препараты цинка, повышающие химическое сродство гемоглабина к кислороду. /цинк уменьшает число серповидных эритроцитов, благодаря воздействию на мембранную проницаемость/. Такой же эффект обнаружен у новокаина. Показан эритроцитафарез с последующим введением эритроцитов. Трансфузии эритромассы рекомендуются при тяжелой степени анемии (НВ менее 60-70 г/л) и апластических кризах (4 мл эритроцитарной массы повышают уровень гемоглобина на 1 г/л.).
Учитывая тяжесть течения и неблагоприятный прогноз при серповидноклеточной анемии и талассемии необходимо проведение медико-генетического консультирования в семьях.
Пренатальная диагностика позволяет установить диагноз у плода с 10-12 нед.(при биопсии трофобласта), с 16-20 недель возможно проведение аспирации из вен плаценты.
Наследственный сфероцитоз — НС /болезнь Минковского-Шоффара/ является широко распространенным заболеванием (2-3 случая на 10000 населения) и встречается у лиц большинства этнических групп, однако чаще болеют жители северной части Европы.
ЭТИОПАТОГЕНЕЗ. Заболевание передается по аутосомно-доминантному типу. Как правило, у одного из родителей выявляют признаки гемолитической анемии. Возможны спорадические случаи заболевания (в 25%), представляющие собой новые мутации. В патогенезе НС бесспорны 2 положения: наличие генетически детерминированной аномалии белков, или спектринов, мембраны эритроцитов и элиминирующая роль селезенки в отношении сфероидальноизмененных клеток. У всех больных с НС отмечен дефицит спектринов в эритроцитарной мембране /до 1/3 нормы/, а у некоторых — нарушение их функциональных свойств, причем установлено, что степень дефицита спектрина может коррелировать с тяжестью заболевания.
Наследственный дефект структуры мембраны эритроцитов приводит к повышенной проницаемости ее для ионов натрия и накоплению воды, что в свою очередь ведет к чрезмерной метаболической нагрузке на клетку, потере поверхностных субстанций и формированию сфероцита. Формирующиеся сфероциты при движении через селезенку начинают испытывать механическое затруднение, задерживаясь в красной пульпе и подвергаясь всем видам неблагоприятных воздействий (гемоконцентрация, изменение рН, активная фагоцитарная система), т.е. селезенка активно наносит сфероцитам повреждения, вызывая еще большую фрагментацию мембраны и сферуляцию. Это подтверждается при электронно-микроскопических исследованиях, позволивших обнаружить ультраструктурные изменения в эритроцитах /утолщение клеточной мембраны с ее разрывами и образованием вакуолей/. Через 2-3 пассажа через селезенку сфероцит подвергается лизису и фагоцитозу. Селезенка является местом гибели эритроцитов; продолжительность жизни которых сокращается до 2 недель.
Хотя дефекты эритроцитов при НС обусловлены генетически, в организме возникают условия при которых углубляются эти дефекты и реализуется гемолитический криз. Кризы могут провоцироваться инфекциями, некоторыми химическими веществами, психическими травмами.
КЛИНИКА. Заболевание может проявляться с неонатального периода, однако более выраженные симптомы обнаруживают к концу дошкольного и в начале школьного возраста. Раннее проявление заболевания предопределяет более тяжелое течение. Чаще болеют мальчики.
НС — гемолитическая анемия с преимущественно внутриклеточным типом гемолиза, это обусловливает и клинические проявления болезни — желтуху, увеличение селезенки, большую или меньшую степень анемии, склонность к образованию камней в желчном пузыре.
Жалобы, клинико-лабораторная симптоматика во многом определяются периодом заболевания. Вне гемолитического криза жалобы могут отсутствовать. При развитии гемолитического криза отмечаются жалобы на повышенную утомляемость, вялость, головную боль, головокружение, бледность, желтуху, снижение аппетита, боли в животе, возможны повышение температуры до высоких цифр, тошнота, рвота, учащение стула, грозный симптом — появление судорог.
Симптоматика криза во многом определяется анемией и зависит от степени гемолиза.
При объективном обследовании кожа и видимые слизистые бледные или лимонно-желтые. У детей с ранними проявлениями НС возможны деформации скелета, особенно черепа (башенный, квадратный череп, изменяется расположение зубов и т.д.); нередки генетические стигмы. У больных обнаруживаются разной степени выраженности изменения со стороны сердечно-сосудистой системы, обусловленные анемией. Характерен гепатолиенальный синдром с преимущественным увеличением селезенки. Селезенка плотная, гладкая, нередко болезненная, что, по-видимому, объясняется напряжением капсулы вследствие кровенаполнения или периспленитом. Окраска экскрементов в момент криза интенсивная. Следует отметить возможные колебания в размерах селезенки: значительное увеличение при гемолитических кризах и уменьшение в период относительного благополучия.
В зависимости от тяжести НС клинические симптомы могут быть выражены незначительно. Иногда желтуха может быть единственным симптомом, по поводу которой больной обращается к врачу. Именно к этим лицам относится известное выражение Шоффара: “Они более желтушны, чем больны.”. Наряду с типичными классическими признаками заболевания встречаются формы НС, когда ГА может быть настолько хорошо компенсирована, что пациент узнает о заболевании лишь при проведении соответствующего обследования.
Наряду с наиболее типичными гемолитическими кризами при тяжелом НС возможны арегенераторные кризы с симптомами гипоплазии преимущественно красного ростка костного мозга. Такие кризы могут развиваться остро с довольно яркими симптомами анемии-гипоксии и наблюдаются обычно у детей после 3 лет жизни. Арегенераторные кризы кратковременны (1-2 недели) и носят обратимый характер в отличие от истинной аплазии.
НС осложняется образованием пигментных камней в желчном пузыре и желчных протоках, после 10 лет камни желчного пузыря встречаются у половины больных, не подвергнутых спленэктомии.
Диагноз НС ставится на основании генеалогического анамнеза, клинических данных, описанных выше и лабораторных исследований. Гемолитическую природу анемии подтверждают нормохромная нормоцитарная анемия с ретикулоцитозом, непрямая гипербилирубиннемия, степень выраженности которых зависит от тяжести гемолиза. Окончательный диагноз основывается на морфологических особенностях эритроцитов и характерном признаке НС — изменении осмотической резистентности эритроцитов. К морфологическим особенностям эритроцитов при НС относятся шарообразная форма (сфероциты), уменьшение диаметра (сред. диаметр э.
Снижение осматич. резистентности
Признак выражен: постоянно +, непостоянно ± , отсутствует-.
ДЕФИЦИТ АТИВНОСТИ Г-6-ФД ЭРИТРОЦИТОВ
Дефицит активности глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) встречается наиболее часто в государствах, расположенных на побережье Средиземного моря (Италия, Греция), в Африке и Латинской Америке и др. странах
Этиология. Причину нарушения активности Г-6-ДФ эритроцитов у населения различных этнических групп связывают с распространением малярии. Было обнаружено, что в нормальных эритроцитах паразитов меньше, чем в эритроцитах с дефицитом Г-6-ФД. Хорошо известна наследственная передача этого заболевания с Х-хромосомой.
Патогенез. В эритроцитах со сниженной активностью фермента Г-6-ФД уменьшается образование восстановленного некатинамидаденин-динуклеотидфосфата (НАДФ) и связывание кислорода, а также снижается скорость восстановления метгемоглобина и понижается устойчивость к воздействию различных потенциальных окислителей – аскорбиновой кислоты, метиленового синего и др. Известно более 40 медикаментов (хинин, сульфаниламидные препараты, нитрофураны, левомицетин, амфотерицин, аспирин и др.), не считая вакцин и вирусов, ряд растительных продуктов, которые потенциально способны вызывать острый внутрисосудистый гемолиз в эритроцитах у лиц с дефицитом Г-6-ФД.
Клиническая картина. Недостаточность Г-6- ФД отличается приемущественно у лиц мужского поля, обладающих, как известно, единственной Х-хромосомой. У женщин клиника гомозиготности на 3-5-й день после приема терапевтической дозы того или иного препарата.
Выделяют пять клинических форм недостаточности Г-6-ФД в эритроцитах: 1) острый внутрисосудистый гемолиз – классическая форма недостаточности Г-6-ФД. Чаще встречается у представителей европеоидной и монголоидной рас. Развивается в результате приема лекарств, вакцинации, диабетического ацидоза, в связи с вирусной инфекцией; 2) фавизм, связанный с употреблен6ием в пищу или вдыханием цветочной пыльцы некоторых бобовых (Vicia fava); 3) гемолитическая болезнь новорожденных, не связанная с гемоглобинопатией, с групповой или резус-несовместимостью, осложняющегося иногда “ядерной желтухой”; 4) наследственная хроническая гемолитическая анемия (несфероцитарная), обусловленная недостаточностью Г-6-ФД в эритроцитах; 5) бессимптомная форма.
Клинически заболевание проявляется желтушностью, увеличением печени,
В периферической крови выражена анемия с ретикулоцитозом, лейкоцитозом со сдвигом до миелоцитов. Отмечается анизо-, пойкилоцитоз, видны осколки эритроцитов (шизоциты), полихромазия, базофильная пунктация эритроцитов.
Характерный признак внутрисосудистого гемолиза – гипергемоглобинемия, сыворотка крови при стоянии приобретает коричневый цвет за счет образующегося метгемоглобина. Одновременно отмечается гипербилирубинемия, моча может быть цвета черного пива, что обусловлено выделяющимися гемоглобином, метгемоглобином, а также гемосидерином и уробилином.
Лечение. Начинается с отмены лекарства, вызвавшего гемолитический криз. При нетяжелом кризе назначаются антиоксиданты (эревит, vit Е). Применяются средства, способствующие увеличению восстановленного глутатиона в эритроцитах, количество которого снижается при гемолитических кризах, ксилит по 0,25-0,5 г. 3 раза внутрь. Одновременно дается фенобарбитал (или зиксорин) в суточной дозе в зависимости от возраста детям по 0,005-0,01 в течение 10 дней. Фенобарбитал, обладает билирубинконъюгирующим действием, индуцирует глюкуронилтрансферазную систему печени.
При тяжелых гемолитических кризах для профилактики острой почечной недостаточности внутривенно капельно в зависимости от возраста вводят 1-4% раствора натрия гидрокарбоната из расчета 5 мл на 1 кг массы в сутки, что способствует выведению продуктов гемолиза. Как слабый диуретик и антиагрегант тромбоцитов, улучшающий почечный кровоток, применяется 2,4% р-р эуфиллина внутривенно капельно 4-6 мг/кг в сутки в 250-500 мл физ. раствора.
ОСТРЫЙ ЛИМФОБЛАСТНЫЙ ЛЕЙКОЗ
Лейкозы – являются первичным опухолевым заболеванием костного мозга, при котором опухолевые клетки, поражая костный мозг, распространяются не только по органам кроветворения, но и в ЦНС, и в другие органы и системы. Это наиболее частые злокачественные новообразования у детей (частота 1:20000), в возрасте до 4 лет.
Согласно современной схеме кровотворения, острые лейкозы объединяет общий признак: субстракт опухоли составляют бластные клетки. При хронических лейкозах субстрактом опухоли являются созревающие и зрелые клетки.
По имеющимся данным, лейкозы “полиэтиологичны ”, т.к. не установлено какой-либо безусловно вызывающей лейкоз причины. Причинными факторами лейкоза человека могут быть химические (экзо- и эндогенные) и физические (ионизирующая радиация) факторы, а также вирусы.
Рауншенбах М.О. с соавт., 1974г., обнаружил у больных лейкозом людей некоторые в-ва из метаболитов триптофана и тирозина, которые способны индуцировать лейкозы и опухоли у мышей.
У человека найден вирус лимфомы Беркитта и выявлена транскриптаза, которая способствует синтезу ДНК на вирусной РНК, что приводит к образованию эндосимбиоза онкогенного вируса и клетки. Это позволило считать обоснованной вирусную этиологию лейкозов.
По гипотезе Р. Хабнера, 1976 г., в геноме каждой клетки заложена информация в виде ДНК-провируса, равноценная информации в геноме онковируса. В норме ДНК-провирус (онкоген) находится в репрессированном состоянии, однако под воздействием концерогенных факторов (химических, радиации) он активизируется и вызывает клеточную трансформацию. Провирус передается по наследству. Некоторые ученые допускают возможность существования систем, подавляющих вирусную лейкозную трансформацию в клетках хозяина, в частности системы, ответственной за иммунитет. Таким образом, в этиологии заболевания главную роль играет не инфицированность вирусом, а состояние контролирующих систем, стимулирующих факторов.
Радиационный этиологический фактор в последние десятилетия привлек внимание как реально существующий фактор внешней среды и внутренней среды человека, способный вызывать лейкоз.
Радиациональные лейкозы человека реально существуют. Это лейкозы у жителей Японии, возникающие много лет спустя после взрывов атомных бомб в Хиросиме и Нагосаки.
Нами была выявлена связь между ростом заболеваемостью лейкозом и загрязнением воздуха некоторыми полютантами воздуха в таких районах Крыма как Сакский, Бахчисарайский, Раздольненский и др.
Итак, этиология лейкозов находится в стадии изучения.
О патологической сущности лейкозов известно, что лейкоз это опухоль. В основе его лежит первичная патология клеток кроветворения, сопровождающаяся нарушением процессов их пролиферации и дифференцирования, возникновение клонов опухолевых (лейкозных) клеток. Прогрессирующая прлиферация этих клеток приводит к поражению органов кроветворения и уменьшению плацдарма нормального гемопоэза.
Учение о развитии лейкозного процесса, понятие об опухолевой прогрессии при лейкозах ввел А.И. Воробъев в 1965 г. В настоящее время это учение разработано применительно ко всем формам лейкоза с соответствующими патогенетическими мероприятиями терапии.
Бластные клетки при остром лейкозе теряют ферментную специфичность. Клетки становятся морфологически и цитохимически недифференцируемыми. Они характеризуются:
Изменением ядра и цитоплазмы (вместо крупных появляются клетки неправильной формы с увеличением площади ядра и цитоплазмы;
Обладают способностью расти вне органов гемопоэза (пролифераты из лейкозных клеток находят в коже, почках, головном мозге и в мозговых оболочках), они неравноценны и представляют разные этапы прогрессии;
Имеют скачкообразный уход опухоли из-под цитостатического воздействия, а также лучевого, гормонального;
Нарастание процесса в виде выхода бластных элементов в периферическую кровь, перехода от лейкопении к лейкоцитозу.
Этапы опухолевой прогрессии – это этапы злокачественности лейкоза. В основе данной прогрессии лежит нестабильность генетического аппарата лейкозных клеток, которым свойственен переход из неактивного состояния в активное. Раскрытие этапов лейкозного процесса имеет большое практическое значение, ибо главный его смысл заключается в поисках цитостатических препаратов, адекватных каждому этапу злокачественности.
Начиная разбор клинической картины лейкозов, необходимо коснуться вопроса о современной классификации заболевания, стадиях и диагностике.
Начиная с 1976 г. во всем мире клиницисты пользуются ФАБ (Франция, Америка, Британия) классификацией острых лейкозов. По которой лейкозы делятся на острый лимфобластный лейкоз /ALL/, 75-80% от всех лейкозов у детей, и острый нелимфобластный лейкоз ANLL, который включает в себя семь подтипов (М1 – М7) и составляет 20-25% лейкозов у детей.
М1,2 – острый миелобластный лейкоз, М 1 – недифференцируемая острая миелоидная лейкемия, М 2 – дифференцируемая миелоидная лейкемия, 15-18%, чаще у детей старшего возраста.
М 3 – острый промиелоцитарный лейкоз, 2-5%.
М 4 – острый миелобластный лейкоз, встречается очень редко.
М 5 – острая монобластная и моноцитарная лейкемия.
М 6 – острый эритромиелоз (эритролейкоз) – 1,25%.
М 7 — острая мегакариоцитарная лейкемия.
М 0 – острый недифференцируемый лейкоз.
Выживаемость при острых нелимфобластных лейкозах значительно ниже, чем при ОЛЛ. Однако в настоящее время она значительно возросла в связи с трансплантацией костного мозга от братьев или сестер, совместимых по HLA.
Для установления диагноза лейкоза необходимо цитологическое, цитохимическое и цитогенетическое исследование костного мозга и выявление поверхностных антигенных маркеров клеток (иммунофенотипирование L1, L2, L3).
С учетом морфологической характеристики ОЛЛ выделяют 3 подварианта (см. таблицу 4).
Сравнительная цитологическая характеристика острого лимфобластного и острого миелобластного лейкоза у детей.
ALL – L 1, малая, однороная,гомогенная популяция.
Скудная с редкими вакуолями
0-1, от мелких до неопределенных.
ALL – L 2 от средних до больших; разнородная, гетерогенная популяция.
от умеренной до большой; непостояннобазофильная с редкими вакуолями.
от круглых до неправильных, уродливых.
1, различимые или неразличимые.
ALL – L 3 от средних до больших.
AМL – М 1 от средних до больших.
от средней до большой, палочки Ауэра
от круглых до овальных, хроматин от тонкого до грубого.
1 или больше, обычно различимые.
ПРИМЕЧАНИЕ: М 1 – острая миелобластная лейкемия без зрелых форм.
Цитохимические реакции, характерные для острых лейкозов.
PAS – периодическая Шифф-кислота (реакция на гликоген)
ANB- альфа нафтил бутиратэстераза
Как видно из таблицы 5 L 1 и L 2 варианты ОЛЛ в большинстве PAS положительные, а L 3 вариант – отрицательный, в то время как нелимфобластные лейкозы дают положительную реакцию на миелопероксидазу и судан черный.
Для клинической практики выделение трех подвариантов ОЛЛ имеет очень большое значение, поскольку от подварианта зависит курс проводимой терапии и прогноз для жизни больного. Кроме того L 1 и L 2 подварианты могут быть Т-клеточной формой или ни-Т- ни В-клеточной формой, а L 3 подвариант В-клеточной формой.
При постановке диагноза ОЛЛ необходимо указать и стадию заболевания. В 1979 г. А.И. Воробьев и М.Д. Бриллиант предложили свою классификацию ОЛЛ. Согласно этой классификации выделяют начальный период, развернутую стадию болезни, полную ремиссию, выздоровление (состояние полной ремиссии на протяжении 5 лет), частичную ремиссию, рецидив с указанием, какой по счету, и уточнением очага локализации при локальном рецидиве, терминальная стадия.
Для прогноза заболевания имеет значение диагностирование на ранней стадии. Ни у кого нет сомнения сегодня, что ОЛЛ начинается постепенно и лишь его манифестация представляется острой. Многие исследователи пишут о “предлейкозе ”, но в предлейкозе поставить диагноз нельзя. Поставить диагноз лейкоза позволяет морфологическая картина костного мозга с наличием 30% бластов и более. В начальном периоде ОЛЛ протекает под видом болезней, “масок ”, связанных преимущественно с гиперпластическим поражением органов, либо с выраженным цитопеническим синдромом. Соответственно детям выставляется диагноз ревматизм, лимфаденит, инфекционный мононуклеоз, злокачественная лимфома и др., а с другой стороны апластическая анемия, геморрагический васкулит, тромбоцитопеническая пурпура, сепсис и др.
Следует подчеркнуть, что для раннего распознавания ОЛЛ у детей во всех неясных случаях о лейкозе надо думать чаще и прибегать к исследованию костного мозга. Особенно это имеет значение для постановки диагноза в алейкемическую стадию, когда в геммограмме еще отсутствуют бласты. К сожалению диагноз ОЛЛ чаще выставляется в лейкемическую стадию, при наличии бластов в геммограмме.
Пунктат костного мозга особенно необходимо исследовать в случаях, сопровождающихся цитопенией или увеличением лимфоузлов, либо тем и другим вместе, не применяя до этого никакого лечения (рентгеновское облучение, электрофорез, УВЧ, назначение преднизалона), так как такая терапия может ускорить течение лейкозного процесса и миелограмма будет нехарактерной, что затруднит постановку диагноза, оставит больного на долгое время без специфической терапии.
Для манифестных клинических проявлений ОЛЛ характерны увеличение лимфатических узлов, печени, селезенки, боли в костях и суставах, повышение температуры, бледность, быстрая утомляемость, недомогание, геморрагии. Реже появляется стоматит, головная боль, обмороки, изменения со стороны нервной системы.
В периферической крови находят либо алейкемическую картину, либо наличие бластных клеток, в костном мозге – 30% и более бластов. Если же диагноз острого лейкоза неубедителен (10-15% бластных клеток), то, возможно только симптоматическое лечение, необходимо повторно исследовать миелограмму через 3-4 недели.
В стадии полной ремиссии в пунктате костного мозга находят не более 5% бластных клеток, а общее количество бластных и лимфоидных клеток в нем не превышает 40%; в периферической крови бластных клеток не должно быть, в составе крови возможны умеренная лейкемия и тромбоцитопения, соответственно 3,0 * 10 9 /л и 100,0 * 10 9 /л из-за цитотоксического воздействия; должен быть нормальный состав спиномозговой жидкости и отсутствовать клинические признаки лейкозной пролиферации.
Частичная ремиссия может характеризоваться гематологическим улучшением, уменьшением бластных клеток в костном мозге, в спиномозговой жидкости при ликвидации клинических признаков нейролейкоза и (или) при подавлении очагов лейкозной инфильтрации в других органах, вне костного мозга.
Рецидив острого лейкоза бывает костномозговым (появление в пунктате более 5% бластных клеток) или внекостномозговым с различной локализацией лейкозной инфильтрации (нейролейкоз, лейкозная инфильтрация селезенки, лимфоузлов, гайморовых пазух, яичек и др.).
В терминальную стадию, клинически в значительной мере условную, вкладывается морфологическое понятие об исчерпании терапевтических резервов, о некурабельном этапе опухолевой прогрессии лейкоза. Вместе с этим отмечается условность этой стадии, поскольку она отражает лишь современный уровень терапевтических возможностей. Все цитостатические средства не только оказываются неэффективными, но и на их фоне прогрессирует лейкоз, нарастает цитопенический синдром, прежде всего агранулоцитоз, появляются некрозы на слизистых оболочках, сепсис, кровоизлияние. Терминальная стадия свидетельствует о необходимости отмены цитостатической терапии с сохранением симптоматической.
Причины смерти детей при лейкозах, в том числе лимфобластном, – это сепсис, кровоизлияния в мозг, интоксикация.
При остром лимфобластном лейкозе (ОЛЛ) выделяют прогностически неблагоприятные формы, которые влияют на выживаемость больного.
Особо выделяется нейролейкоз, который может присоединиться к любым локальным формам рецидива и стать самостоятельной формой, без проявления какой-либо другой клиники заболевания. В последние годы нейролейкоз стал частым проявлением рецидива заболевания. Это связывают с увеличением продолжительности жизни больных и с тем обстоятельством, что противолейкозные препараты не проникают через гематоэнцефалический барьер и для лейкозных клеток в центральной нервной системе создается определенное укрытие, благоприятные условия для проявления лейкозных инфильтратов.
НЕЙРОЛЕЙКОЗ (лейкозное поражение нервной системы) развивается вследствие метастазирования лейкознык клеток в оболочки головного и спинного мозга, в вещество мозга и нервные стволы. Диагноз нейролейкоза ставится на основании обнаружения бластных клеток в ликворе. При нейролейкозе в ликворе может наблюдаться вариобельный цитоз до нескольких тысяч клеток в 1 мкл., повышение уровня белка и снижение уровня глюкозы, цвет жидкости, как правило, сероватый, с положительной реакцией Панди.
Клинических проявлений при нейролейкозе, кроме обнаружения цитоза в ликворе, может и не наблюдаться; в то же время они могут быть самыми разнообразными. Это изменение поведения ребенка: раздражительность, вялость, необщительность. Появляется головная боль, тошнота, рвота (при менингиальной форме), очаговая симптоматика в виде поражения черепных нервов, пирамидной недостаточности, мозжечковых симптомов, судорог, нарушения речи и сознания (при менингоэнцефалической и энцефалической форме ), нижних парапарезов, нарушение походки и функции тазовых органов, корешковых симптомов (при менингомиелитической форме). Экзофтальм наблюдается, как правило, при хлорлейкозе.
Почти у половины больных при рецидиве лейкоза отмечается нормальный состав периферической крови, и поэтому большое значение имеет внимательный осмотр больного, своевременная костно-мозговая и люмбальная пункции при диспансерном наблюдении.
Прогностические признаки при ОЛЛ у детей (по Л.А. Махоновой и др., 1986г.).
Период от начала болезни до постановки диагноза.
Увеличение периферических лимфоузлов.
Морфология бластов по ФАБ-классификации.
Цитохимические данные: кислая фосфотаза.
Клинические маски острого лейкоза самые разнообразные: лимфаденит, эпид, паротит, туберкулез, лимфогранулематоз, ревматизм, ревматоидный артрит, гепатиты, инфекционный мононуклеоз, острый аппендицит, затяжные простудные заболеванияы, длительные язвено-некротические стоматиты, ангины, сепсис, апластическая анемия, гемолитическая анемия, тромбоцитопеническая пурпура, геморрагический васкулит, дизентерия, мелкоочаговая пневмония.
Тромбоцитопения – ниже 100*10 9
ЛЕЧЕНИЕ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА.
С 1990 года в гематологическом отделении Республиканской клинической детской больницы применяют современные терапевтические протоколы лечения острого лимфобластного лейкоза у детей ОЛЛ-БФМ-90 разработанные немецкими коллегами (1988, 1990, 1992гг.). По протоколам среди детей, больных ОЛЛ, выделяют три группы риска:
Группа стандартного риска – дети от 1 года до 6 лет. Количество бластов на 8 день терапии в периферической крови не превышает 1000 в 1 мкл. (после 7-дневного приема преднизалона); отсутствует пре-Т иммунофенотип лейкоза (если у пациента не проводилось иммуноспецифическое исследование бластов, но имеется медиастенальная опухоль, то пациент в любом случае из стандартной группы риска); не имеется первичного поражения ЦНС; установлена полная ремиссия на 33 –й день лечения;
Группа среднего риска – дети до 1 года и старше 6 лет, количество бластов в периферической крови на 8 –й день, после 7-дневной преднизолоновой профазы, не превышает 1000 в 1 мкл; полная ремиссия на 33 –й день лечения;
Группа высокого риска – отсутствие полной ремиссии на 33 –й день лечений.
Между 65 и 70 днем повторная контрольная костномозговая пункция для подтверждения ремиссии, если на 33 день в костном мозге 5% и более бластов
(в гемограмме не более 20 х 10 9 /л лейкоцитов).
КЛАССИФИКАЦИЯ ЦИТОСТАТИЧЕСКИХ СРЕДСТВ.
1 Антиметаболиты – нарушают синтез предшественников нуклеиновых кислот, путем конкуренции с последними в лейкозной клетке.
Метотрексат – антогонист фолиевой кислоты (эффект в стадии разгара и в качестве поддерживающей терапии, действует на S фазу).
Ланвис (Tioguaninum) ( Glaxo Wellcome) — 1 табл. содержит 40 мг тиогуанина : 25 табл. в упаковке. Тиогуанин является сульфгидрильным аналогом гуанина и проявляет свойства пуринового антиметаболита. Являясь структурными аналогами пуриновых нуклеотидов, метаболиты тиогуонина включаются в пуриновый обмен и ингибируют синтез нуклеиновых кислот в опухолевых клетках.
6-Меркаптопурин (пуринетол) – антогонист пурина, вмешивается в обмен нуклеиновых кислот, действует на S фазу.
Цитозар (цитозинарабинозид) – систематический аналог пиримидина, препятствует превращению цитидина в диоксицитидин (на S фазу лейк. клетки).
2 Алкилирующие соединения – подавляют синтез ДНК и в меньшей степени РНК в лейкозной клетке.
циклофосфан, обладающий цитостатическим и цитолитическим действием на лейкозные клетки.
Винкристин – практически воздействует на все фазы покоящейся клетки.
Этопозид (вепезид, VP –16) – из растений мондрагоры, предотвращает вхождение клетки в митоз.
L-аспарагиназа (краснитин) – разлагает аспарагин, необходимый для синтеза протеина, на аспарагиновую кислоту и амоний в лейкозной клетке, которая не способна к самостоятельному синтезу аспарагина и поэтому погибает от его эндогенного действия.
5 Противоопухолевые антибиотики.
Адриамицин, рубомицин – обладает цитостатическим действием, подавляет синтез нуклеиновых кислот путем взаимодействия с ДНК и РНК – полимеразами.
Преднизолон – обладает цитолитическим действием на лейкозные клетки (лимфобласты и недифференцируемые бласты) и не вызывает разрушения нормальных лимфоцитов.
Дозировка медикаментов осуществляется в соответствии с площадью поверхности тела пациента. Каждый раз перед началом нового этапа лечения вновь определяется площадь поверхности тела и расчитывается соответственно доза препаратов. При эндолюмбальной инъекции и при облучении головы дозировка осуществляется в соответствии с возрастом.
Полихимиотерапия больных со стандартным и средним факторами риска длится в течение 6-ти месяцев.
ПРОТОКОЛ I (направлен на редукцию ремиссии), см. рис.4.
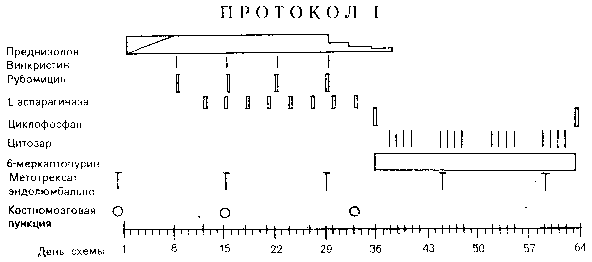
В зависимости от клинического ответа на терапию (уменьшение органов), лабораторных показателей (уменьшение числа лейкоцитов, содержания мочевой кислоты, мочевины, креатинина, калия) дозу преднизалона нужно быстро увеличивать до окончательной (60 мг/м 2 ) не позднее 5-го дня терапии.
Винкристин вводится в дозе 1,5 мг/м 2 внутривенно на 8, 15, 22, 29-й день.
Рубомицин вводится из расчета 30 мг/м 2 внутривенно капельно в течении 1 часа на 8, 15, 22, 29-й день. Перед первым введением рубомицина делается ЭКГ и эхография сердца (препарат кардиотоксичен).
L-Аспариназа (L-ASP) – вводится в дозе 10000 ед/м 2 внутривенно капельно в течении 1 часа на 8, 15, 18, 21, 24, 30, 33-й день.
Возможны тяжелые аллергические реакции, гипергликемия и нарушение свертывания крови. Необходимо проводить лабораторный контроль свертывания крови (фибриноген, АТ-Ш, плазминоген), уровня сахара. При развитии анафилаксии возможна замена на эрвиназу.
Профилактика нейролейкоза проводится эндолюмбальными введениями метотрексата в возрастной дозировке 1 раз в 2 недели.
Вторая фаза. Условия для начала фазы 2 протокола 1 следующие: полная ремиссия в костном мозге, менее 5% бластов в миелограмме; при начальном поражении ЦНС – полная ремиссия в ЦНС; при медиастенальной опухоли – уменьшение размеров опухоли до 30% ее начальной величины; удовлетворительное общее состояние; отсутствие тяжелой инфекции; креатинин в пределах возрастной нормы; лейкоциты более 2 * 10 9 /л; гранулоциты – более 0,5 * 10 9 /л.
Циклофосфан (ЦФ) – вводится в дозе 1000 мг/м 2 внутривенно капельно в течении часа на 36-й и 64-й день лечения. Контроль диуреза и профилактика геморрагического цистита проводятся следующим образом: гидратация 3000 мл/м 2 за 24 часа; фуросемид из расчета 0,5 мг/кг внутривенно на 6 и 12 час после циклофосфана; месна (урометоксан) 400мг/м 2 внутривенно на 0,4 и 8 часу от начала инфузии циклофосфана.
6-Меркаптопурин (6-МП) — 60 мг/м 2 в сутки внутрь, 36- 63-й дни лечения.
Цитозар (ARA-C) — 75 мг/м 2 в сутки внутривенно в виде 4 дневных блоков; 38-41 дни, 45-48, 52-55, 59-62 дни. После начала лечения цитозаровые блоки желательно не прерывать. Если начало цитозаровых блоков откладывается или прерывается, одновременно прекращается прием 6-МП. Выпавшее в лечении 6-МП нужно подтянуть до общей плановой кумулятивной дозы, равной 1680 мг/м 2 .
ПРОТОКОЛ М ( направлен на консолидацию ремиссии), см. рис.5.
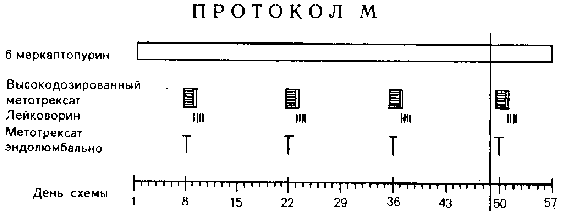
6-Меркаптопурин назначается из расчета 25 мг/м 2 в день (внутрь), в течение 8 недель.
Метотрексат назначается в дозе 1 г/м 2 ( 1/10 общей дозы, вводится в течение 30 мин; 9/10 общей дозы вводится в течение 35,5 ч.) путем непрерывной инфузии, на 8, 22, 36, 50 день от начала протокола М.
Лейковорин (антидот метотрексата) дается из расчета 15 мг/м 2 внутривенно струйно или внутрь в таблетках на 42, 48, 54 час от начала введения.
МТХ интралюмбально вводится через 2 часа от начала внутривенной инфузии МТХ в возрастной дозировке.
ПРОТОКОЛ II (также направлен на консолидацию ремиссии), см. рис.6.
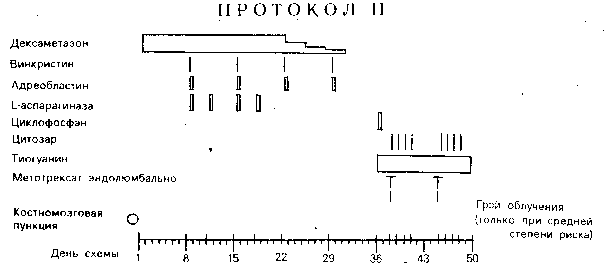
Дексаметазон 10 мг/м 2 внутрь с 1 по 21 день от начала протокола, затем дозу уменьшают каждые 3 дня на 50% до полной отмены.
Винкристин 1,5 мг/м 2 – 4 внутривенных введения с интервалом в одну неделю (максимальная доза 2 мг/м 2 ).
Адриамицин (ADR) 30 мг/м 2 , инфузия в течение 1 часа. Перед 1 и 3 назначением необходимо провести ЭКГ и эхокардиографическое исследование: при признаках снижения сократительной функции миокарда следует прекратить дальнейшее применение ADR.
L-Аспарагиназа 10000 ЕД/м 2 – инфузия в течение 1 часа на 8, 11, 15, 18 день.
Вторая фаза. Условия для начала второй фазы протокола П: хорошее общее состояние; отсутствие инфекций; нормальный возрастной уровень креатинина в сыворотке крови; лейкоциты больше 2 * 10 9 /л; гранулоциты больше 0,5 * 10 9 ; тромбоциты больше 50 * 10 9 /л.
Циклофосфан 100 мг/м 2 , инфузия в течение 1 часа на 36 день от начала протокола. Контроль диуреза и профилактика цистита такие же, как в протоколе 1.
6-Тиогуанин (6-TG) 60 мг/м 2 внутрь в 36-49 дни, всего 14 дней.
Цитозар (ARA-C) 75 мг/м 2 внутривенно двумя блоками через 4 дня: 38-41 день, 45-48 дни.
МТХ интралюмбально вводится в возрастных дозировках на 38 и 45 день от начала протокола.
Облучение головы. При хорошем клиническом состоянии облучение головы начинается с 38 дня протокола П для детей из групп среднего и высокого риска. Доза облучения зависит от возраста и от начального вовлечения ЦНС (от 12 до 18 Гр детям до 2 лет, от 18 до 24 Гр детям старше 2 лет).
В случае выявления нейролейкоза люмбальные пункции метотрексата осуществляются один раз в неделю, с одновременным введением цитозара, преднизолона. В конце полихимиотерапии подключается облучение головы.
Поддерживающая терапия проводится двумя препаратами сроком до 2-х лет .
6-Меркаптопурин 50 мг/м 2 внутрь, ежедневно.
Метотрексат 20 мг/м 2 внутрь 1 раз в неделю. В день приема необходимо контролировать общий анализ крови и регулировать дозу поддерживающей терапии в зависимости от уровня лейкоцитов (при уровне лейкоцитов 1-2 * 10 9 /л – 50% доза 6 МП/МТХ, 2-3 * 10 9 /л – 100%, более 3 * 10 9 /л – 150 %).
В республиканской детской больнице выживаемость детей с ОЛЛ была около 10-12%. 1990 г., после начала работы по протоколам БФМ выживаемость детей с первичным ОЛЛ составила 90%, ремиссия 95%, 5 -летняя выживаемость 69%.
После изложения основной терапии по протоколам БМФ – 90 необходимо остановиться на клиническом патоморфозе лейкозов.
Само понятие “патоморфоз” (греч.) – стойкое изменение количественных и качественных сдвигов нозологии под влиянием в данном случае лечения: стойкое изменение лимфобластных лейкозов.
К проявлениям патоморфоза относится поражение органов лейкозным процессом с присущими ему интоксикацией, инфильтрацией, кровоизлияниями и анемической гипоксией, а также побочным действием цитостатиков. В процессе лечения с наступлением ремисси редуцируется лейкозная опухоль и уходят ее проявления в органах и системах, но сохраняются побочные действия цитостатиков, ибо после наступления ремиссии продолжается специфическая химио- и лучевая терапия .
Самым важным звеном в этом патоморфозе является цитопенический синдром, когда разрушены бласты и нормальное кроветворение еще не восстановилось. В этом опустошении без кроветворных клеток организм подстеригает череда осложнений: синдром разрушения бластов (знаменитая тетрада – гиперурекимия, гиперкалиемия, гиперфосфатемия, гипокальциемия), ДВС-синдром, сепсис и кровоизлияния, поражение сердца, печени, кишечника и др. органов. В этот период даже при отсрочивании назначений цитостатиков, действие их на организм еще продолжается. Все это создает сложную ситуацию, в которой необходимо предусмотреть помощь всему организму в целом, поэтому большое значение при лечении ОЛЛ имеет, так называемая, сопроводительная терапия.
С целью противодействия синдрому лизиса опухоли, с первых дней лечения проводится массивная инфузионная терапия (3000 мл/кв.м в сутки) глюкозо-солевыми растворами. Для профилактики и лечения инфекционных осложнений широко используются противовирусные препараты Зовиракс (ацикловир), Вальтрекс Glaxo Wellcome и др., антибиотики цефалоспорины П-го поколения (Зинацеф, Glaxo Wellcome) и Ш-го поколения (Фортум, Glaxo Wellcome,Роцефин, F.Hoffmann-La Roche и др.), аминогликозиды и др., антиникотические средства — дифлюкан, амфотерицин.
Адекватным антиперетиком является парацетамол (Gllaxo Wellcome). Одним из наиболее эффективных антиэметических препаратов является Зофран (Glaxo Wellcome). Арсенал препаратов, используемых в качестве сопроводительной терапии при ОЛЛ у детей очень велик.
Хронический миелолейкоз (ХМЛ) – это опухоль кроветворной ткани, возникающая из клеток-предшественниц миелопоэза, сохраняющих способность дифференцироваться до зрелых форм. Хронический лейкоз отличается от острого не длительностью течения, а морфологическим субстратом опухоли. Основной морфологический субстрат ХМЛ составляют дифференцирующиеся и зрелые гранулоциты.
Опухолевый процесс при ХМЛ проходит две стадии:
1. Развернутую – моноклоновую, доброкачественную (зрелоклеточную), характеризующуюся длительностью течения.
2. Терминальную – поликлоновую, злокачественную (в терминальной стадии субстрат опухоли составляют бласты), значительно более короткую.
ХМЛ является опухолью, имеющей четкие хромосомные нарушения – вместо нормальной хромосомы из 22-й пары хромосому с укороченным длинным плечом – Ph 1 -хромосому (“филадельфийскую”), наличие которой считается патогмоничным признаком ХМЛ. В развернутой стадии заболевания 90% и более клеток содержат Ph 1 -хромосому. Она определяется в делящихся клетках миелоидного, эритроидного и мегакариоцитарного ряда, моноцитарно-макрофагальных элементах, В-лимфоцитах. Наличие маркерной хромосомы в этих клетках позволяет считать, что все они происходят из полипотентной стволовой клетки.
ХМЛ встречается в любом возрасте, но в отличие от острого лейкоза, редко (2-5,5% от всех лейкозов).
У детей выделяют две формы ХМЛ: взрослую и ювенильную (инфантильную), различающихся по клинико-гематологическим проявлениям, течению заболевания, наличию Ph 1 -хромосомы, ответной реакции на терапию.
Взрослая форма ХМЛ (ВХМЛ) встречается у детей чаще, чем ювенильная. В основном ВХМЛ наблюдается у детей школьного возраста. Ее клинико-гематологические проявления напоминают таковые у взрослых, чем и объясняется название этой формы. ВХМЛ начинается постепенно. Больные длительно не предъявляют жалоб и в начальную стадию болезнь обнаруживается случайно при обследовании по поводу других заболеваний или при оформлении в детские учреждения, когда выявляются изменения в периферической крови (лейкоцитоз со сдвигом влево до мета- и миелоцитов), иногда уже увеличивается селезенка. Миелограмма – без патологических отклонений. Патогмонично обнаружение клеток, содержащих Ph 1 -хромосому.
Как правило, болезнь диагностируется в развернутой стадии. В связи с постепенно нарастающей интоксикацией появляются жалобы на общую слабость, недомогание, ухудшение аппетита, похудание, повышение температуры, могут быть боли в животе, оссалгии, незначительная аденопатия, единичные геморрагии на теле. Кожа приобретает бледно-серый оттенок. Характерна спленомегалия, за счет которой изменяется конфигурация живота, появляется чувство распирания, иногда боли (за счет перерастяжения капсулы селезенки, переспленита), возможно развитие инфаркта селезенки. Селезенка плотная, может увеличиваться до таких размеров, что занимает пространство до области таза. Печень увеличена меньше.
Для периферической крови в развернутой стадии ВХМЛ характерен нейтрофильный гиперлейкоцитоз, сдвиг влево до миело- и промиелоцитов, встречаются единичные миелобласты, увеличивается количество базофилов и эозинофилов (“базофильно-эозинофильная ассоциация”). Почти у всех больных отмечается умеренная нормохромная анемия. Несмотря на нормальное и даже повышенное количество тромбоцитов наблюдается нарушение их функций, т.е. имеется дефицит “пула хранения”. СОЭ обычно увеличена. Костный мозг гиперпластичен, миелоидные клетки находятся на всех стадиях дифференцировки, л:э может составлять 10:1 – 20:1. Диагностически ценны результаты исследования костного мозга с изучением хромосом (обнаружение Ph 1 -хромосомы). Характерно также снижение активности щелочной фосфатазы (ЩФ) в нейтрофилах вплоть до полного ее отсутствия.
Клинические и гематологические проявления терминальной стадии (бластного криза ВХМЛ) отличаются от развернутой стадии и практически не отличаются от симптоматики острого лейкоза (ОЛ). Как правило, бластный криз развивается на фоне лечения ВХМЛ. К ранним предвестникам его относятся нарастающий лейкоцитоз и увеличение селезенки, что свидетельствует о развитии рефрактерности к проводимой терапии. У больного ухудшается самочувствие, нарастают слабость, потливость, бледность, появляется и прогрессирует геморрагический синдром, нередко повышение температуры до 38-40 0 С, некротические поражения кожи и слизистых, выраженный болевой синдром (боли в животе, спине, ногах, припухлость и боли в суставах). Увеличиваются селезенка, печень. У некоторых больных терминальная стадия может проявиться в виде экстрамедуллярных опухолевых образований (увеличения лимфоузлов, остеолитических изменений, нейролейкоза, лейкемидов в коже). При исследовании этих образований выявляются бласты, цитогенетически определяется Ph-хромосома. Экстрамедуллярная бластная трансформация может предшествовать бластной трансформации костного мозга за несколько месяцев. У некоторых больных заболевание может сразу проявиться бластным кризом. Следует отметить, что бластный криз может протекать по миелоидному, лимфоидному, смешанному типу, т.е. в период бластного криза ВХМЛ возможна пролиферация различных клеточных линий. Это также свидетельствует о том, что поражение происходит на уровне полипотентной стволовой клетки.
В периферической крови – нарастающая нормохромная анемия, выраженная тромбоцитопения, гиперлейкоцитоз с появлением в лейкоцитарной формуле большого количества бластов (суммарное содержание бластов и промиелоцитов > 30% свидетельствует в пользу бластного криза). Картина периферической крови становится похожей на таковую при остром миелобластном лейкозе. В миелограмме характерно нарастание бластных клеток; однако, бласты в периферической крови преобладают над бластами в костном мозге.
Ювенильная форма ХМЛ (ЮХМЛ) по частоте возникновения занимает 2-е место после “взрослого” типа ХМЛ и наблюдается преимущественно у детей до 2-х лет. Клинические проявления ЮХМЛ напоминают острый лейкоз. При ЮХМЛ трудно выделить и разграничить отдельные периоды заболевания в связи с быстрой распространенностью процесса. Появляется лихорадка, быстро нарастают симптомы интоксикации, анемический и геморрагический синдромы, увеличиваются печень и селезенка, нередки оссалгии, некротические поражения кожи, язвенно-некротический стоматит, значительно увеличиваются все группы лимфоузлов.
В периферической крови выражены нормохромная анемия, тромбоцитопения, лейкоцитоз. Лейкоцитарная формула напоминает таковую при ВХМЛ: имеются все переходные формы нейтрофильного ряда, но преобладают зрелые формы. Характерен моноцитоз, отсутствует “базофильно-эозинофильная ассоциация”. СОЭ увеличена. В эритроцитах резко повышено содержание НвF (30-70% и более), отмечается гипергаммаглобулинемия с превалированием IgG. В миелограмме в основном определяются клетки миелоидного ряда с увеличением элементов митотического пула, количество бластов нормальное или незначительно повышено (до 10%), соответствуя таковому числу бластов в периферической крови.
Ph 1 -хромосома отсутствует. По данным разных авторов у 50-82% детей с ЮХМЛ отмечается нормальный кариотип, однако нередко у больных в костномозговых клетках обнаруживались различные цитогенетические аномалии.
Диагностические критерии взрослой и ювенильной форм ХМЛ.
источник


