Гемолитическая анемия – это болезнь, которая характеризуется разрушением эритроцитов. При ней сокращается срок жизни эритроцитов. В норме они существуют около 120 дней.
Ежедневно около 1% красных клеток удаляется из крови. Количество погибших эритроцитов повышается на фоне гемолиза (разрушения). Из-за этого формируется гипоксия тканей головного мозга и внутренних органов.
Физиологически взамен погибших клеток из красного костного мозга в кровь выделяются молодые эритроциты и депо. Так происходит «омоложение» крови. При гемолитических состояниях (аутоиммунная, B12-дефицитная) – этот процесс нарушается.
Интенсивное разрушение красных клеток крови не уравновешивается образованием молодых форм. Расшифровка анализа крови в такой ситуации показывает ретикулоцитоз (повышенное количество несозревших эритроцитов).
Наличие ретикулоцитоза в лабораторных анализах подтверждает диагноз гемолитической анемии. Даже на фоне нормальной концентрации гемоглобина крови появление ретикулоцитов свидетельствует о наличии гемолиза.
Чтобы ответить на вопрос, опишем патогенез заболевания.
Первым признаком недуга является апластический (арегенераторный) криз. При нем формируется недостаточность костного мозга. На фоне патологии возникает раздражение эритроидного красного ростка. Арегенераторная гемолитическая анемия (апластическая) сопровождается снижением количества ретикулоцитов, поэтому расшифровка анализа крови не показывает специфических изменений.
Если пропустить начальную стадию заболевания, возникает тяжелая анемия гемолитического типа. Пациенты знают, выраженный гемолиз – это такое состояние, при котором возникает сильная слабость, не позволяющая выполнять обычную физическую нагрузку. При кризах человек может потерять сознание.
Аутоиммунная гемолитическая анемия – это разрушение эритроцитов, возникающее из-за поражения эритроидного ряда антителами иммунной системы. Причина этого заболевания неизвестна. Клинические эксперименты показали значительное влияние на возникновение патологии наследственных факторов.
Гемолиз – это такое состояние, которое сочетается с компенсаторной гиперплазией эритроидного ростка. На его фоне формируется уменьшение количества ретикулоцитов крови. При длительном течении болезни возникает тяжелая и угрожающая форма патологии. Сокращение сроков жизни красных клеток крови на этом фоне приводит к опасным состояниям и серьезным осложнениям.
Гемолиз – это состояние, при котором не только нарушен процесс образования эритроцитов в костном мозге, но и возникает нарушение работы внутренних органов.
При выраженной гемолитической анемии нарушается работоспособность печени, селезенки и почек. Они «забиваются» разрушенными частями красных клеток крови. При гемолитической анемии на фоне гемолиза образуются особые патологические виды гемоглобина:
Гаптоглобин образуется в печени и относится к классу альфа-глобулинов. Он имеет большую молекулу, которая не проникает через почечный фильтр. Последняя анатомическая структура «забивается», поэтому нарушается работоспособность почек. Функциональная способность мочевыделительной системы на этом фоне снижается. В результате поражаются почечные канальцы, что приводит к снижению экскреторной функции.
Комплекс гемоглобин-гаптоглобин накапливается в крови. При длительном существовании процесса резервы печени по синтезу гаптоглобина снижаются. Следствием состояние является накопление в крови токсических продуктов распада эритроцитов.
Продуктом катаболизма гема эритроцитов является билирубин. Он возникает на фоне разрушения этого белка в печени. За данный процесс отвечает фермент гемоксигеназа. Она содержится в селезенке, костном мозге, печени. Фермент приводит к разрушению альфа-метиленового мостика. Химическим веществом, формирующимся при данном процессе, является вердогемоглобин. Это продукт промежуточной стадии метаболизма билирубина (желтого пигмента). При его повышенном накоплении формируется не только токсическое поражение головного мозга, но и увеличивается риск образования камней желчного пузыря.
Следующим этапом процесса является образование биливердина с отщеплением железа. Фермент цитоплазматическая биливердин редуктаза приводит к превращению билирубина в биливердин. Определение этих веществ используется с целью изучения состояния гемолиза и выявления степени поражения печени.
Наблюдается накопление в сыворотке крови каждого из вышеописанных веществ. Билирубин и продукты его переработки в печени являются токсичными. Они приводят к гибели клеток головного мозга.
Токсические продукты в крови частично связываются белком гаптоглобин, что снижает их негативное влияние на организм. Резервные возможности печени по нейтрализации токсинов ограничены. При выраженной степени заболевания их будет недостаточно для предотвращения поражения головного мозга.
При гемолитических состояниях средней и большой степени выраженности белка гаптоглобина образуется мало, так как истощены резервы для его образования в печени. Интенсивный гемолиз приводит к разрушению красных кровяных клеток. Они выделяются с почками, поэтому у человека появляется моча цвета пива.
источник
Гемолитические анемии представляют собой совокупность как врожденных, так и приобретенных заболеваний, которые характеризуются разрушением эритроцитов внутри клеток или внутри сосудов. Аутоиммунные гемолитические анемии (сокращенно АГА) – наиболее часто встречающаяся разновидность гемолитических анемий.
Гемолитическая анемия может развиваться вследствие конфликта группы крови или резус-фактора между матерью и плодом или вследствие переливания донорской крови. Их называют изоиммунными.
Ко второй группе относят случаи, когда собственная иммунная система вырабатывает антитела к собственным же эритроцитам. Их называют аутоиммунными гемолитическими анемиями. При проведении диагностического анализа крови у больных с АГА иммуноглобулины IgG (редко IgM и IgA) демонстрируют отклонение от нормы.
В большинстве случаев аутоиммунные гемолитические анемии встречаются в виде различных специфических и неспецифических симптомов на фоне других заболеваний крови; могут протекать как в острой форме, так и в виде хронического процесса.
В острых случаях заболевание начинается со слабости, одышки и сердцебиения, повышается температура, отмечаются рвота и желтуха, боли в области сердца и в пояснице.
Хроническая аутоиммунная гемолитическая анемия часто протекает практически бессимптомно с периодическими обострениями. На фоне ремиссии отмечают увеличение печени и селезенки при пальпации, нередко желтуху.
В развернутом анализе крови у больных АГА отмечают, в частности, нормальный или повышенный гемоглобин, увеличение СОЭ, нормальный уровень тромбоцитов. В острой форме и при обострениях хронического течения увеличивается количество лейкоцитов, тогда как в стадии ремиссии их уровень находится в норме.
Диагноз «аутоиммунная гемолитическая анемия» чаще всего более точно дифференцируется специалистами после проведения специфических диагностических исследований.
Тактика лечения аутоиммунной гемолитической анемии при остром течении заболевания или обострении хронического процесса в обязательном порядке включает гормонотерапию. Среднюю суточную дозу преднизолона 60-80 мг делят на три приема в соотношении 3:2:1. В случае неэффективности лечения она может быть увеличена до 150 мг и выше, а по мере улучшения состояния больного – постепенно снижается (на 2,5-5 мг в сутки с целью избежать рецидивов) сначала до половины начальной дозировки и далее вплоть до полной отмены препарата.
При хроническом течении болезни, лечение аутоиммунной гемолитической анемии требует назначения преднизолона, но в суточной дозе 20-25 мг. Прием препарата осуществляется под лабораторным контролем, и по мере нормализации показателей крови его доза плавно снижается до поддерживающей — 5-10 мг в сутки.
Иногда целесообразным и оправданным в терапии АГА является также назначение препаратов из группы иммунодепрессантов, а при тяжелых гемолитических кризах показана инфузионная терапия: индивидуально подобранная эритроцитарная масса, гемодез и т.п. для интоксикации. Иногда переливают плазму крови, отмытые или замороженные эритроциты, прибегают к методу гемодиализа (искусственная почка) и празмофереза (удаление жидкой части крови – плазмы – вместе с антителами).
Ряд больных АГА отличается повышенной устойчивостью к действию гормональных препаратов. Течение болезни характеризуется у них частыми рецидивами и практически не поддается медикаментозной коррекции. Для лечения АГА у данной категории пациентов применяют радикальное лечение – спленэктомию (удаление селезенки), которое значительно улучшает качество жизни.
Несмотря на высочайший уровень развития современной медицины лечение гемолитических анемий весьма затруднительно, а диагноз нередко неблагоприятный.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
источник
В механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы:
1) начало аутоиммунного процесса и возможность образования аутоантител на собственные гематии;
2) механизм гемолиза, т.е. способ воздействия антител или комплексов антитело-комплемент на оболочку эритроцита, в целях развития гемолиза.
Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов.
Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена.
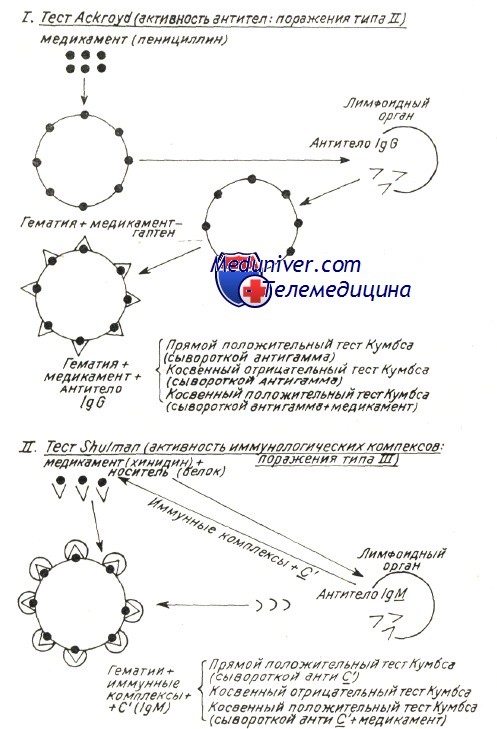
Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов.
Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии.
Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy)
В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%.
Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.).
Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr», h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1. IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM.
Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость.
Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии.
Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации.
Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета.
И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т.
Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным.
По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану).
Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin).
Расплавление крови за счет полных антител рассматривается как характерное иммуное поражение типа II классификации иммунных поражений по Gell и Coombs.
Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.).
Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.).
В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг.
Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану).
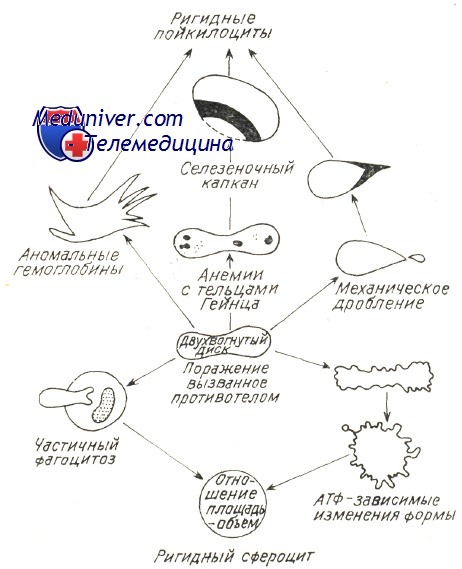
В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel).
При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток.
Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина.
источник
Аутоиммунная гемолитическая анемия (АИГА) — распространенная форма приобретенных ГА. Выделяют два варианта болезни:
• симптоматическую форму, при которой анемия развивается на фоне определенного заболевания (гемобластоза, системного заболевания соединительной ткани, хронического активного гепатита, опухоли, НЯК и др.);
• идиопатическую форму, когда обнаружить определенное заболевание не удается (острое инфекционное заболевание, беременность, роды и травма в анамнезе не служат причиной АИГА, а лишь провоцируют ее обострение).
При АИГА вырабатываются антитела к собственному антигену эритроцитов. Первый этап патогенеза АИГА — изменение антигена эритроцитов под влиянием лекарственных препаратов, вирусов или бактерий. Возможна также соматическая мутация единичного иммуноцита. Дальнейшая реакция антител и антигенов эритроцитов обусловливает развитие гемолиза и анемии.
АИГА может развиваться при участии различного вида аутоантител, вызывающих гемолиз при различной температуре. Различают два типа антител — тепловые (реагируют с эритроцитами при температуре тела не ниже 37 °С) и холодовые (реагируют с эритроцитами при температуре ниже 37 °С). На этом основании выделяют четыре вида АИГА:
• АИГА с неполными тепловыми агглютининами;
• АИГА с тепловыми гемолизинами;
• АИГА с холодовыми агглютининами;
• АИГА с двухфазными гемолизинами.
Образующийся комплекс «эритроцит + антитело» поглощают макрофаги селезенки (внутриклеточный гемолиз). Также могут вырабатываться аутоиммунные антитела к тромбоцитам, что приводит к развитию тромбоцитопении.
Чаще всего регистрируют АИГА, обусловленные тепловыми аутоантителами. Последние принадлежат к IgG и служат неполными тепловыми агглютининами, максимально демонстрирующими свое действие при температуре 37 °С. Гемолиз происходит внутриклеточно и существенно реже — внутри сосудов.
Холодовые аутоантитела принадлежат к IgM и представлены агглютининами. Гемолиз возникает в результате их соединения с эритроцитами и комплементом. Действие антител начинается при низкой температуре (ниже 32 °С): в мелких сосудах дистальных отделов тела (пальцы рук, ног, кончики ушей и носа) образуются крупные конгломераты из агглютинированных эритроцитов, а сами сосуды спазмируются. Гемолиз происходит преимущественно внутриклеточно, но обнаружение гемоглобинурии указывает и на внутрисосудистый гемолиз. При переходе пациента в теплое помещение гемолиз прекращается.
Значительно реже возникают АИГА, обусловленные действием двух других типов аутоантител — тепловых и двухфазных холодовых гемолизинов. При обоих вариантах агглютинации эритроцитов не происходит. Гемолиз возникает при осаждении аутоантител (гемолизинов) на эритроцитах, в связи с чем он происходит внутри сосудов и сопровождается выделением черной мочи (гемоглобинурия).
Под действием тепловых гемолизинов гемолиз происходит в обычных условиях (пребывание на холоде — не обязательное условие). Во время пребывания больного на холоде двухфазные гемолизины осаждаются на эритроцитах, но собственно гемолиз начинается лишь после перехода больного в теплое помещение.
Клиническая картина АИГА полиморфна и обусловлена:
• быстротой развития гемолиза (кризовое или более спокойное течение);
• преобладающим патогенетическим механизмом гемолиза (те или иные аутоантитела приводят к гемолизу при различных внешних условиях);
• изменениями в органах (в частности, в печени и селезенке);
• местом, где происходит гемолиз (селезенка, сосудистое русло);
• фоновыми заболеваниями (при вторичных АИГА).
В связи с этим при конечном сходном результате — гемолизе эритроцитов и развитии всех признаков ГА — на всех трех этапах диагностического поиска можно получить совершенно различные данные.
Ha первом этапе диагностического поиска больные с гемолитическими кризами, обычно развивающимися после травм и инфекционных заболеваний, предъявляют жалобы на повышение температуры тела, боли в пояснице, озноб и возникновение желтушности. При АИГА, спровоцированных воздействием холода, отмечают непереносимость низких температур: у больных синеют дистальные участки конечностей, нос и уши. Как правило, они плохо себя чувствуют в холодное время года.
На втором этапе диагностического поиска (без учета симптомов основного заболевания при вторичных формах АИГА) обычно возникают две ситуации:
• в период ремиссии, кроме легкой желтушности и незначительного увеличения селезенки (иногда — печени), можно не обнаружить никаких изменений;
• в период криза симптомы более яркие и представлены повышением температуры тела, более интенсивной желтухой и сосудистыми изменениями по типу синдрома Рейно (особенно при АИГА, провоцируемой действием низких температур).
Информация, полученная на первом и втором этапе, не дает оснований для установления диагноза АИГА, а тем более для идентификации ее серологического варианта. Может возникнуть лишь предположение об этом заболевании (особенно при развитии несомненных гемолитических кризов, синдроме Рейно или выделении черной мочи в период криза). Для уточнения диагноза необходимо доказать аутоиммунность ГА и отвергнуть ряд заболеваний печени и желчных путей, способных сопровождаться сходными симптомами.
На третьем этапе диагностического поиска обнаруживают в большей или меньшей степени выраженный синдром гемолиза (в зависимости от существования или отсутствия гемолитического криза). Чрезвычайно важно обнаружение аутоантител. Основной метод определения неполных тепловых агглютининов — проба Кумбса, основанная на агглютинации антиглобулиновой сывороткой эритроцитов больного с фиксированными на них антителами (прямая проба Кумбса) или агглютинации с помощью антиглобулиновой сыворотки эритроцитов здорового человека, «нагруженных» антителами из сыворотки крови больного (непрямая проба Кумбса). Аутоантитела также обнаруживают с помощью агрегатгемагглютинационной пробы, которая во много раз чувствительнее пробы Кумбса.
Полные холодовые агглютинины обнаруживают путем инкубации при различных температурах эритроцитов донора и сыворотки больного. Агглютинация происходит при определенных разведениях сыворотки и температуре, при этом чем выше температура, при которой возможна агглютинация, тем тяжелее протекает болезнь.
Двухфазные гемолизины определяют с помощью эритроцитов донора, фиксирующих на себе антитела больного при низкой температуре. В дальнейшем при инкубации такой смеси происходит гемолиз эритроцитов. Иногда для обнаружения гемолизинов используют пробу Кумбса: чем более высокая температура требуется для гемолиза, тем тяжелее протекает заболевание.
При формах АИГА, протекающих с выработкой гемолизирующих аутоантител (гемолизинов), в моче присутствуют гемоглобин и гемосидерин, так как гемолиз протекает внутри сосудов. Моча приобретает темную окраску (вплоть до черной).
На третьем этапе диагностического поиска при симптоматических формах АИГА можно обнаружить изменения, обусловленные основным заболеванием: опухолью, гемобластозом, диффузным заболеванием соединительной ткани, поражением печени и др.
Диагностика АИГА основана на обнаружении сочетания признаков гемолиза и определении аутоантител. Естественно, что в процессе диагностики следует исключить ГА, обусловленные воздействием различных химических средств, малярийного плазмодия, механическим повреждением оболочки эритроцита, а также наследственной этиологии.
При назначении лечения учитывают фазу аутоиммунной ГА (ремиссия или гемолитический криз).
В период криза средством выбора служат глюкокортикоиды, которые всегда прекращают или уменьшают гемолиз. В острой фазе назначают большие дозы преднизолона (по 60-90 мг/сут) или эквивалентные дозы других глюкокортикоидов. При наступлении ремиссии их постепенно уменьшают, переводя больного на поддерживающие дозы (по 5-10 мг/сут). Продолжительность гормонального лечения при проведении гематологического и серологического контроля (до исчезновения или существенного уменьшения количества аутоантител) составляет 2-3 мес.
В межприступном периоде можно назначать другие иммунодепрессанты, например аминохинолиновые препараты (хлорохин), которые следует принимать длительно (до одного года).
При плохой переносимости глюкокортикоидов, противопоказаниях к их применению или недостаточной эффективности рекомендовано применение цитостатических иммунодепрессантов (циклофосфамид, метотрексат). Эти средства особенно эффективны при АИГА, связанной с холодовыми агглютининами.
В случаях, когда применение глюкокортикоидов и цитостатических средств не позволяет достичь четкого улучшения, хороший эффект может оказать спленэктомия. При выраженной анемии рекомендовано переливание эритроцитарной массы, но кровь необходимо подбирать индивидуально, с помощью непрямой пробы Кумбса, когда переливаемые эритроциты «нагружают» антителами сыворотки крови больного. Если проба Кумбса с эритроцитами донора отрицательная, то такую кровь можно переливать.
При незначительном гемолизе и отсутствии гемолитических кризов прогноз удовлетворительный. Усиление гемолиза с резким снижением концентрации гемоглобина значительно ухудшает прогноз.
Меры первичной профилактики ГА в настоящее время разработаны недостаточно. При установлении диагноза ГА больных ставят на диспансерный учет и периодически проводят исследования крови. Кроме того, им запрещают контакт с веществами, способствующими усилению гемолиза.
источник
Гемолитическая анемия — анемия, возникающая в результате повышенного эритродиереза, когда разрушение эритроцитов преобладает над их образованием.
Классификация. По этиологии гемолитические анемии подразделяются на приобретенные и наследственные. В свою очередь в зависимости от этиологических факторов, вызвавших гемолиз эритроцитов, приобретенные гемолитические анемии делятся на токсические, обусловленные действием экзогенных и эндогенных гемолитических ядов; иммунные (гетеро-, изо-, аутоиммунные), когда гемолиз происходит под влиянием комплекса антиген — антиэритроцитарное антитело; механические — при механическом повреждении эритроцитов; мембранопатии, связанные с соматической мутацией пролиферирующих клеток эритроцитарного ряда и образованием популяции эритроцитов с дефектом структуры мембраны.
На основании того, какие генетические нарушения привели к усилению гемолиза эритроцитов, наследственные гемолитические анемии подразделяют на наследственные мембранопатии, ферментопатии и гемоглобинопатии, вызванные генетическими дефектами структуры мембраны, активности ферментов эритроцитов и синтеза гемоглобина. Имеется две разновидности наследственных гемоглобинопатии: анемии, связанные с нарушением синтеза цепей глобина, и анемии, обусловленные наследственным дефектом первичной структуры цепей глобина.
Этиология приобретенных гемолитических анемий. Токсическая гемолитическая анемияможет развиться под влиянием гемолитических ядов (соединения мышьяка, свинца, нитробензол, фенилгидразин; алкоголь, желчные кислоты, токсические продукты азотистого обмена; змеиный, грибной, пчелиный яды и др.), а также при действии возбудителей инфекционных и паразитарных заболеваний (гемолитический стрептококк, анаэробная инфекция, малярийный плазмодий, лейшмания).
Иммунная (гетеро-, изо-, аутоиммунная) гемолитическая анемияразвивается при переливании видо-, группо- и резус-несовместимой крови; резус-несовместимости матери и плода; образовании аутоантител против собственных эритроцитов при изменении их антигенных свойств под влиянием лекарственных препаратов, вирусов, микроорганизмов или в результате соматической мутации иммуноцитов, когда возникает «запретный» клон лимфоцитов, продуцирующих антитела к нормальным антигенам эритроцитов (при лейкозе, системной красной волчанке и др.).
Механическое повреждение эритроцитовможет возникнуть при протезировании кровеносных сосудов и клапанов сердца, длительном марше или беге по твердому грунту (маршевая гемоглобинурия), спленомегалии.
Причиной приобретенной мембранопатииможет стать соматическая мутация эритробластов под действием вирусов, микроорганизмов, лекарственных препаратов с образованием патологической популяции эритроцитов, у которых нарушается структура мембраны и повышается чувствительность к комплементу (пароксизмальная ночная гемоглобинурия).
Патогенез.Механизм гемолиза при приобретенной гемолитической анемиизаключается в повреждении структуры мембран эритроцитов. Одни гемолитические факторы (например, механические) оказывают прямое повреждающее действие, другие (мышьяковистый водород, нитриты), являясь сильными окислителями, вызывают сначала метаболические, а затем функциональные и структурные изменения в мембране и строме эритроцитов, приводящие к их гемолизу. Многие гемолитические яды биологического происхождения обладают ферментной активностью (лецитиназная активность стрепто-, стафилолизинов, яда насекомых и змей), разрушая лецитин мембран. При иммунных гемолитических анемиях IgG и IgM присоединяют к эритроцитарной мембране комплемент, который при этом активируется и вызывает ее ферментативный лизис.
Под влиянием гемолитических агентов в мембранах эритроцитов образуются поры, через которые из клетки выходят ионы калия, фосфаты, а ионы натрия поступают в клетку. Вследствие сдвигов ионного баланса вода проникает в эритроцит, который при этом набухает, приобретает сферическую форму, его клеточная поверхность уменьшается, снижается способность к деформации. Такие сфероциты не могут пройти через межэндотелиальные поры синусов селезенки и фагоцитируются селезеночными макрофагоцитами. Когда объем эритроцита достигает критического (146 % первоначального), а размер пор мембраны превышает 6 нм, наступает гемолиз с выходом гемоглобина в плазму.
Гемолиз эритроцитов при приобретенных гемолитических анемиях происходит преимущественно в кровеносном русле. Однако при резус-конфликте (гемолитическая болезнь новорожденных) антирезусные агглютинины, образовавшиеся в организме резус-отрицательной матери, вызывают гемолиз резус-положительных эритроцитов плода или новорожденного не только внутри сосудов, но и в печени и селезенке (внутриклеточный гемолиз).
При наследственной гемолитической анемиигемолиз обусловлен снижением осмотической и механической резистентности эритроцитов с генетически детерминированными нарушениями структуры мембраны, метаболизма, синтеза гемоглобина.
Так, при наследственной мембранопатии(микросфероцитарная гемолитическая анемия или болезнь Минковского—Шоффара с аутосомно-доминантным наследованием) генетический дефицит в мембране — эритроцитов Са 2+ -зависимой АТФазы и фосфолипидов приводит к повышению проницаемости мембраны. В клетки поступают ионы натрия и вода, эритроциты превращаются в сфероциты с резко пониженной способностью деформироваться при прохождении через синусы селезенки. Отрыв части оболочки у таких эритроцитов ведет к образованию микросфероцитов с укороченной продолжительностью жизни (8—14 дней вместо 120 дней в норме) в связи с захватом их макрофагоцитами селезенки и печени (внутриклеточный гемолиз).
При наследственной ферментопатии, например глюкозо-6-фосфатдегидрогеназодефицитной анемии (доминантное, сцепленное с X-хромосомой наследование), острый внутрисосудистый гемолиз эритроцитов, возникающий при приеме лекарств с высокой окислительной способностью (противомалярийные препараты, фтивазиди др.), обусловлен повреждением клеточных мембран перекисями, так как в эритроцитах с дефицитом Г-6-ФДГ понижено содержание восстановленного глутатиона (антиоксиданта).
Внутриклеточный гемолиз эритроцитов при наследственной гемоглобинопатии связан с синтезом аномального или не свойственного данному возрасту гемоглобина 1 . Так, при серповидноклеточной анемии 2 образуется HbS (в β-цепи глобина глутаминовая кислота заменена валином), который в восстановленном состоянии выпадает в кристаллы и вызывает деформацию эритроцитов (серповидная форма); гипоксия способствует усилению гемолиза таких эритроцитов. При α-талассемии (генетический дефект синтеза α-цепей) происходит гемолиз эритроцитов с аномальным гемоглобином — Bart—НЬ(γ4) у новорожденных и НЬН(β4) у взрослых людей; при β-талассемии, когда нарушен синтез β-цепей и не образуется НЬА,(α2β2), гемолизируются эритроциты, содержащие фетальный гемоглобин (α2γ2) или же НbА2(α2δ2).
Следствием массивного гемолиза эритроцитов является анемия с нарушением дыхательной функции крови и развитием гипоксии. Образовавшийся при распаде эритроцитов гемоглобин циркулирует в крови (гемоглобинемия) и соединяется с гаптоглобином в крупномолекулярный комплекс, не проходящий через почечный фильтр. Если же содержание свободного гемоглобина в плазме превышает 20,9 ммоль/л (337 г/л) или исходный уровень гаптоглобина низкий, тогда не связанный с последним гемоглобин начинает выделяться с мочой (гемоглобинурия). Частично гемоглобин поглощается клетками макрофагоцитарной системы и расщепляется в них до гемосидерина. Гемосидероз селезенки, почек, печени, костного мозга сопровождается реактивным разрастанием соединительной ткани и нарушением функций этих органов. Повышенное образование из гемоглобина желчных пигментов обусловливает развитие гемолитической желтухи (см. раздел XXII — «Патологическая физиология печени»). Кроме того, внутрисосудистый распад эритроцитов может привести к появлению тромбов и нарушению кровоснабжения тканей, отсюда — трофические язвы конечностей, дистрофические изменения в селезенке, печени, почках. В результате поступления в сосудистое русло большого количества эритроцитарного тромбопластина возможно развитие ДВС-синдрома.
Картина крови. Приобретенная гемолитическая анемия по типу кроветворения является эритробластической, по степени регенерации костного мозга — регенераторной, по цветовому показателю — нормо-или гипохромной, реже — ложногиперхромной (вследствие абсорбции гемоглобина на эритроцитах). Степень уменьшения количества эритроцитов и гемоглобина зависит от интенсивности гемолиза. В мазке крови обнаруживаются клетки физиологической регенерации и дегенеративно измененные эритроциты (пойкилоцитоз; разорванные, фрагментированные эритроциты, анизоцитоз). Появление большого количества эритробластов и нормобластов характерно для гемолитической болезни новорожденных.
При наследственной гемолитической анемии отмечается усиленная регенерация эритроцитарного ростка часто с неэффективным эритропоэзом, когда в костном мозге разрушаются ядерные формы эритроцитов. В мазке крови наряду с регенеративными формами (высокий ретикулоцитоз, полихроматофилия, единичные ядерные формы эритроцитов) находятся дегенеративно измененные клетки (микросфероциты при болезни Минковского — Шоффара, серповидные при S-гемоглобинопатии, мишеневидные, базофильно пунктированные — при талассемии). При частых гемолитических кризах может возникнуть гипорегенераторная анемия.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2016
Аутоиммунные гемолитические анемии (АИГА) — гетерогенная группа аутоагрессивных заболеваний и синдромов, обусловленных разрушением эритроцитов, которое вызвано неконтролируемой продукцией антител против собственных эритроцитов.
Соотношение кодов МКБ-10 и МКБ-9:
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| D59.0 | Медикаментозная аутоиммунная гемолитическая анемия | 283.0 | Аутоиммунные гемолитические анемии |
| D59.1 | Другие аутоиммунные гемолитические анемии Аутоиммунная гемолитическая болезнь (холодовый тип) (тепловой тип) Хроническая болезнь, вызываемая холодовыми гемагглютининами «Холодовая агглютининовая»: болезнь . гемоглобинурия Гемолитическая анемия: . холодовый тип (вторичная) (симптоматическая) . тепловой тип (вторичная) (симптоматическая) Исключены: синдром Эванса (D69.3) гемолитическая болезнь плода и новорожденного (P55.-) пароксизмальная холодовая гемоглобинурия (D59.6) | ||
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: врачи скорой медицинской помощи, врачи общей практики, терапевты, гематологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| A | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| B | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| C | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация [2]:
АИГА делят на идиопатические (первичные) и симптоматические (вторичные). У более чем 50% пациентов развитие АИГА имеет вторичный характер (таблица 1).
В 10% случаев АИГА причиной гемолиза являются различные лекарственные препараты. [2] Список препаратов, которые могут вызывать развитие аутоиммунного гемолиза или приводить к выявлению антиэритроцитарных антител – см. приложение 1.
Cерологические свойства аутоантител легли в основу деления АИГА на четыре формы:
· с неполными тепловыми агглютининами (80% всех больных);
· с полными холодовыми агглютининами (12—15% всех случаев);
· с тепловыми гемолизинами;
· с двухфазными холодовыми гемолизинами Доната—Ландштейнера (крайне редкая и, как правило, вторичная форма при сифилисе и вирусных инфекциях).
Таблица 1 — Частота и типы антител при вторичной АИГА[1]
| Заболевание или состояние * | Частота АИГА, % | АИГА с тепловыми аутоантителами | АИГА с холодовыми аутоантителами |
| ХЛЛ | 2.3-4.3 | 87% | 7% |
| НХЛ (кроме ХЛЛ) | 2,6 | Более часто | м |
| IgM гаммапатия | 1,1 | нет | все |
| Лимфома Ходжкина | 0,19-1,7 | Почти все | редко |
| Солидные опухоли | Очень редко | 2/3 | 1/3 |
| Дермоидная киста яичников | Очень редко | все | нет |
| СКВ | 6,1 | Почти все | редко |
| Неспецифический язвенный колит | 1,7 | все | нет |
| Общий вариабельный иммунодефицит | 5,5 | все | нет |
| Аутоиммунные лимфопролиферативные заболевания | 50 | все | нет |
| После аллогенной ТКМ | 44 | да | да |
| После трансплантации органов | 5,6 (поджелудочная железа) | да | нет |
| Медикаментозно-индуцированная при ХЛЛ | 2.9-10.5 очень редко | Почти все | редко |
| Интерферон | Частота 11.5/100 000 пациент-лет | все | нет |
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ (УД – В) [1]
Диагностические критерии:
Жалобы и анамнез:
Основными синдромами при гемолитических анемиях являются:
· нормоцитарная анемия с быстро нарастающей слабостью и плохой адаптацией даже к умеренному снижению гемоглобина.
В зависимости от уровня гемоглобина выделяют 3 степени тяжести анемии:
· I (легкая степень)- Нв более 90 г/л;
· II (средняя степень)- от 90 до 70 г/л;
· III (тяжелая степень)- менее 70 г/л.
Клинически тяжесть состояния пациента не всегда соответствует уровню гемоглобина: остро развившаяся анемия сопровождается значительно более выраженной симптоматикой, чем хроническая, при которой есть время для адаптации органов и тканей. Пожилые пациенты переносят анемию хуже, чем молодые, поскольку компенсаторные возможности сердечно-сосудистой системы у них, как правило, снижены.
При гемолитическом кризе признаки тяжелой анемии являются выраженными на фоне острого начала:
· лихорадки;
· боли в животе;
· головной боли;
· рвоты;
· олигурии и анурии с последующим развитием шока.
Синдром гемолиза, который может проявляться жалобами на:
· иктеричность кожи и видимых слизистых оболочек (желтуха);
· потемнение мочи.
· при внутрисосудистом гемолизе цвет мочи может быть от розового до почти черного. Цвет зависит от концентрации гемоглобина, степени диссоциации гема. Цвет мочи при гемоглобинурии необходимо отличать от гематурии, когда при микроскопическом исследовании видны целые эритроциты. Цвет мочи может быть также красным из-за приема лекарственных препаратов (антипирин), пищи (свеклы) или при порфирии, миоглобинурии, которая развивается при определенных состояниях (массивное травматичное повреждение мышц, электрический шок, артериальный тромбоз и др.).
· появление чувствительности при давлении, чувства тяжести или боли в левом подреберье, связанные с увеличением селезенки. Чаще степень увеличения селезенки имеет незначительный или умеренный характер.
У более чем 50% пациентов развитие АИГА имеет вторичный характер, в связи с чем в клинической картине могут доминировать симптомы основного заболевания (таблица 1).
Физикальное обследование:
Результаты физикального обследования определяются темпом и степенью гемолиза, наличием или отсутствием коморбидности, заболеваний, вызвавших развитие АИГА. В стадии компенсации состояние удовлетворительное, может отмечаться легкая субиктеричность кожных покровов, видимых слизистых, небольшая спленомегалия, признаки основного заболевания, например, СКВ, лимфопролиферативного заболевания и др. В этой ситуации наличие легкой АИГА может быть не диагностировано.
При гемолитическом кризе:
· состояние средней тяжести или тяжелое;
· бледность кожи и слизистых;
· расширение границ сердца, глухость тонов, тахикардия, систолический шум на верхушке;
· одышка;
· слабость;
· головокружение;
· билирубиновая интоксикация: иктеричность кожи и слизистых, тошнота, рвота, боли в животе, головокружение, головные боли, лихорадка, в некоторых случаях расстройства сознания, судороги;
· при внутриклеточном гемолизе: гепатоспленомегалия;
· при смешанном и внутрисосудистом гемолизе: изменение мочи за счет гемоглобинурии.
Лабораторные исследования:
· Общий анализ крови, в т. ч. тромбоцитов и ретикулоцитов: анемия разной степени тяжести нормохромная; ретикулоцитоз, лейкоцитоз со сдвигом лейкоцитарной формулы влево в период криза; в мазке периферической крови, как правило, микросфероциты;
· биохимический анализ крови:
· билирубин с фракциями (гипербилирубинемия, преобладает непрямая, неконъюгированная фракция),
· ЛДГ (повышение активности ЛДГ в сыворотке в 2—8 раз в зависимости от интенсивности гемолиза),
· гаптоглобин – показатель гемолиза;
· общий белок, альбумин, креатинин, мочевина, АЛТ, АСТ, ГГТП, С-реактивный белок, щелочная фосфотаза – оценка состояния печени, почек
· глюкоза – исключение диабета;
· прямая проба Кумбса в большинстве случаев – положительная, но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, может быть отрицательной.
· титр холодовых агглютининов;
· непрямая проба Кумбса (обязательна при интенсивном гемолизе и предшествующих трансфузиях эритроцитов);
· гемосидерин в моче – исключение внутрисосудистого гемолиза;
· общий анализ мочи (обязательна визуальная оценка цвета мочи);
· определение меди в суточной моче, церулоплазмина в сыворотке крови – исключение болезни Вильсона-Коновалова;
· пункция костного мозга (гиперплазия и морфология эритроидного ростка, количество и морфология лимфоцитов, комплексы метастатических клеток);
· трепанобиопсия (при необходимости) – исключение вторичной АИГА;
· иммунофенотипирование лимфоцитов (при лимфоцитозе периферической крови и удаленной селезенке) – исключение вторичной АИГА;
· витамин В12, фолат – исключение мегалобластных анемий ;
· показатели обмена железа (в том числе трансферрин, ферритин сыворотки и эритроцитов)- исключение железодефицита;
· развернутая коагулограмма + волчаночный антикоагулянт – оценка состояния гемостаза, исключение АФС;
· ревматологические пробы (антитела к нативной ДНК, ревматоидный фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену) — исключение вторичной АИГА;
· иммуноглобулины сыворотки (G, A, M) + криоглобулины;
· при необходимости—гормоны щитовидной железы, простатический специфический антиген, онкомаркеры- исключение вторичной АИГА;
· определение группы крови по системе АВ0, резус-фактора;
· анализ крови на ВИЧ – при необходимости трансфузии;
· анализ крови на сифилис – стандартное обследование на любом уровне;
· определение HBsAg в сыворотке крови методом ИФА – скрининг на гепатит В;
· определение суммарных антител к вирусу гепатита С (HCV) в сыворотке крови методом ИФА – скрининг на гепатит С.
Инструментальные исследования:
· рентгенография легких (при необходимости КТ);
· ФГДС;
· ирригоскопия/ректороманоскопия/колоноскопия;
· УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы.
Диагностический алгоритм (схема 1 [1]):
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ [1]
Диагностические мероприятия:
· сбор жалоб, анамнеза;
· физикальное обследование.
Медикаментозное лечение: нет.
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ [1,5]
Диагностические критерии: см. амбулаторный уровень.
Диагностический алгоритм: см. амбулаторный уровень.
Перечень основных диагностических мероприятий:
· общий анализ крови (подсчет лейкоформулы, тромбоцитов и ретикулоцитов в мазке);
· биохимический анализ крови (общий билирубин, прямой билирубин, ЛДГ);
· прямая проба Кумбса.
Перечень дополнительных диагностических мероприятий:
· определение уровня гаптоглобина;
· группа крови и резус фактор;
· биохимический анализ крови (общий белок, альбумин, общий билирубин, прямой билирубин, креатинин, мочевина, АЛаТ, АСаТ, глюкоза, ЛДГ, ГГТП, С-реактивный белок, щелочная фосфотаза);
· обмен железа (определение уровня сывороточного железа, общей железосвязывающей способности сыворотки и уровень ферритина);
· определение концентрации фолиевой кислоты и витамина В12;
· иммунофенотипирование лимфоцитов (при лимфоцитозе, подозрении на лимфопролиферативное заболевание, неэффективности терапии кортикостероидами);
· Электрофорез белков сыворотки и мочи с иммунофиксацией (при лимфоцитозе, подозрении на лимфопролиферативное заболевание, неэффективности терапии кортикостероидами);
· миелограмма;
· ИФА на маркеры вирусных гепатитов;
· ИФА на маркеры ВИЧ;
· ИФА на маркеры вирусов герпес-группы;
· коагулограмма, волчаночный антикоагулянт;
· проба Реберга-Тареева (определение скорости клубочковой фильтрации);
· титр холодовых агглютининов;
· непрямая проба Кумбса (обязательна при интенсивном гемолизе и предшествующих трансфузиях эритроцитов);
· определение гемосидерина, меди и гемоглобина в моче;
· трепанобиопсия костного мозга с гистологическим исследованием;
· витамин В12, фолат;
· показатели обмена железа (в том числе трансферрин, ферритин сыворотки и эритроцитов);
· коагулограмма + волчаночный антикоагулянт;
· ревматологические пробы (антитела к нативной ДНК, ревматоидный
· фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену);
· иммуноглобулины сыворотки (G, A, M) + криоглобулины;
· гормоны щитовидной железы, простатический специфический антиген, онкомаркеры;
· общий анализ мочи;
· рентгенография органов грудной клетки;
· эзофагогастродуоденоскопия;
· ирригоскопия/ректороманоскопия/колоноскопия;
· УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы;
· УЗДГ артерий и вен;
· ЭКГ;
· эхокардиография;
· суточное мониторирования АД;
· суточное мониторирование ЭКГ.
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии подтверждения диагноза |
| АИГА с неполными тепловыми агглютининами (первичная) | Наличие анемии, гемолиза | Прямая проба Кумбса, пункция костного мозга (гиперплазия и морфология эритроидного ростка, количество и морфология лимфоцитов, комплексы метастатических клеток); иммунофенотипирование лимфоцитов (при лимфоцитозе периферической крови и удаленной селезенке); Ревматологические пробы (антитела к нативной ДНК, ревматоидный фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену); иммуноглобулины сыворотки (G, A, M) + криоглобулины; гормоны щитовидной железы, простатический специфический антиген, онкомаркеры); • УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы; • рентгенография легких (при необходимости КТ); колоноскопия | положительная прямая проба Кумбса, отсутствие данных за вторичный характер анемии |
| АИГА с полными холодовыми агглютининами | Наличие анемии, синдрома гемолиза | титр холодовых агглютининов; общий анализ мочи (обязательна визуальная оценка цвета мочи); определение гемосидерина иммуноглобулины сыворотки (G, A, M) + криоглобулины; | В клинической картине- непереносимость холода (посинение, а затем побеление пальцев рук, ног, ушей, кончика носа, резкая боль в конечностях), сезонность заболевания. При обследовании- невозможность определения группы крови и подсчета эритроцитов, появление М-градиента, высокий титр холодовых антител при t 4 0 |
| Наследственные гемолитические анемии | Наличие анемии, синдрома гемолиза | Прямая проба Кумбса, УЗИ желчного пузыря, селезенки, морфология эритроцитов, при необходимости- определение активности ферментов эритроцитов, электроферез гемоглобина | Анамнез с детства, оттягощенная наследственность, при осмотре- стигмы эмбриогенеза, отрицательная прямая проба Кумбса |
| В12-дефицитная анемия | Наличие анемии, синдрома гемолиза | Исследование витамина В12 | Фуникулярный миелоз, снижение витамина В12 Отрицательная прямая проба Кумбса |
| Болезнь Вильсона | Наличие анемии, синдрома гемолиза в дебюте заболевания | Прямая проба Кумбса, исследование меди в моче, церулоплазмина в крови, консультация невропатолога, окулиста | Признаки поражения нервной системы, печени, наличие колец Кайзера — Флейшера, снижение уровня церулоплазмина в плазме крови, снижение содержания меди в плазме крови, повышение экскреции меди с мочой |
| ПНГ | Наличие анемии, синдрома гемолиза | иммунофенотипирование периферической крови для выяления процента ПНГ эритроцитов I, II и III типов методом проточной цитофлуориметрии | пробы сахарозная и Хема положительные; иммунофенотипирование- экспрессия GPI-связанных протеинов; сыворотка больного не вызывает гемолиз эритроцитов донора |
Получить консультацию по медтуризму
Получить консультацию по медтуризму
| Азатиоприн (Azathioprine) |
| Алемтузумаб (Alemtuzumab) |
| Алендроновая кислота (Alendronic acid) |
| Альфакальцидол (Alfakaltsidol) |
| Амикацин (Amikacin) |
| Амлодипин (Amlodipine) |
| Амоксициллин (Amoxicillin) |
| Атенолол (Atenolol) |
| Ацикловир (Acyclovir) |
| Валацикловир (Valacyclovir) |
| Валганцикловир (Valganciclovir) |
| Вода для инъекций (Water for Injection) |
| Ганцикловир (Ganciclovir) |
| Декстроза (Dextrose) |
| Допамин (Dopamine) |
| Дротаверин (Drotaverinum) |
| Золедроновая кислота (Zoledronic Acid) |
| Имипенем (Imipenem) |
| Калия хлорид (Potassium chloride) |
| Кальция карбонат (Calcium carbonate) |
| Каптоприл (Captopril) |
| Кетопрофен (Ketoprofen) |
| Клавулановая кислота (Clavulanic acid) |
| Левофлоксацин (Levofloxacin) |
| Лизиноприл (Lisinopril) |
| Маннитол (Mannitol) |
| Меропенем (Meropenem) |
| Метилпреднизолон (Methylprednisolone) |
| Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil)) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия хлорид (Sodium chloride) |
| Небиволол (Nebivolol) |
| Омепразол (Omeprazole) |
| Парацетамол (Paracetamol) |
| Пневмококковая вакцина (Pneumococcal vaccine) |
| Преднизолон (Prednisolone) |
| Рабепразол (Rabeprazole) |
| Ризедроновая кислота (Risedronic acid) |
| Ритуксимаб (Rituximab) |
| Торасемид (Torasemide) |
| Фамцикловир (Famciclovir) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Хлоропирамин (Chloropyramine) |
| Циклоспорин (Cyclosporine) |
| Циклофосфамид (Cyclophosphamide) |
| Ципрофлоксацин (Ciprofloxacin) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эритроцитная взвесь лейкофильтрованная |
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ (УД – В) [1]
Тактика лечения [3]: только при отсутствии показаний к госпитализации: на амбулаторном этапе часто продолжается лечение, начатое в стационаре, мониторинг клинико-лабораторных показателей с дальнейшей коррекцией терапии.
Немедикаментозное лечение:
Режим II. При длительной терапии ГКС регулярные физические упражнения, устранение факторов риска случайных потерь равновесия, падений (С), отказ от курения. При АИГА с холодовыми антителами избегать переохлаждений.
Диета: с целью профилактики глюкокортикоидного остеопороза адекватное потребление кальция и витамина D, ограничение потребления алкоголя (D).
Медикаментозное лечение:
Перечень основных лекарственных средств:
· Преднизолон;
Перечень дополнительных лекарственных средств
· Ритуксимаб концентрат для приготовления раствора для инфузии 100 мг;
· Циклоспорин;
· Амлодипин;
· лизиноприл;
· атенолол;
· торасемид;
· фолиевая кислота;
· алендронат;
· ризедронат;
· золендронат;
· альфакальцидол;
· карбонат кальция;
· парацетамол;
· хлорпирамин;
· омепразол;
· эноксапарин;
· надропарин;
· амоксициллин/клавулановая кислота;
· левофлоксацин;
· раствор натрия хлорида.
Терапия АИГА в настоящее время не базируется исключительно на основе ретроспективных и нескольких проспективных исследований при отсутствии рандомизированных исследований и не имеет высокого уровня доказательности. Также отсутствуют формальные консенсусы по определению полной или частичной ремиссии. Таким образом, описанные далее рекомендации по терапии АИГА имеют уровень доказательности Д.
Первая линия терапии.
Глюкокортикостероиды.
Первой линией терапии для пациентов с АИГА с тепловыми антителами являются глюкокортикостероиды. Стартовая доза преднизолона или метипреднизолона 1 мг/кг (внутрь или внутривенно[1]). Обычно в течение 1-3 недель стартовой терапии (проводимой в стационаре) уровень гематокрита увеличивается более чем 30% или уровень гемоглобина более 100 г/л (необходимости в нормализации уровня гемоглобина нет). В случае, если терапевтическая цель достигнута, доза преднизолона снижается до 20-30 мг в сутки в течение нескольких недель. В случае, если данные цели не достигаются к концу 3й недели, то подключают терапию второй линии. Снижение дозы преднизолона продолжается на амбулаторном этапе. Медленное снижение дозы преднизолона проводят в случае достижения терапевтического эффекта. Снижать дозу преднизолона начинают по 5—10 мг за 2—3 дня и продолжают до тех пор, пока суточная доза не достигнет 20—30 мг. Далее отмена препарата проводится значительно медленнее — по 2,5 мг за 5—7 дней. После достижения дозы ниже 10—15 мг темп отмены должен быть еще больше замедлен: по 2,5 мг каждые 2 недели с целью полной отмены препарата. Такая тактика предполагает продолжительность приема преднизолона в течение 3—4 месяцев. Проводится мониторинг уровня гемоглобина, ретикулоцитов. В случае, если в течение 3-4 месяцев при приеме преднизолона в дозе 5 мг в сутки сохраняется ремиссия, должна быть предпринята попытка полной отмены препарата. Стремление к быстрому уменьшению дозы с момента нормализации гемоглобина из-за побочного действия ГК (кушингоид, стероидные язвы, артериальная гипертензия, угревая сыпь с формированием гнойничков на коже, бактериальные инфекции, сахарный диабет, остеопороз, венозные тромбозы) всегда приводит к рецидиву гемолиза. Фактически, пациенты, получающие низкие дозы ГКС более 6 месяцев имеют меньшую частоту рецидивов и большую продолжительность ремиссии по сравнению с пациентами, которые прекратили терапию до 6 месяцев терапии [2]. Сопроводительная терапия при лечении стероидами может включать бифосфонаты, витамин Д, кальций, поддерживающую терапию фолиевой кислотой. Проводится мониторинг уровня глюкозы крови и активное лечение диабета, так диабет является большим фактором риска смерти из-за инфекции. Необходимо оценивать риска тромбоэмболии легочной артерии, особенно у пациентов с АИГА и волчаночным антикоагулянтом или рецидивом АИГА после спленэктомии 38.
Терапия 1 линии ГКС эффективна у 70–85% пациентов; однако большинству пациентов для сохранения уровня гемоглобина в пределах 90-100 г/л требуется поддерживающая терапия ГКС, у 50% достаточной является доза 15 мг/сутки и меньше и приблизительно 20-30% пациентов необходимы более высокие дозы преднизолона. Считают, что монотерапия ГКС эффективна менее чем у 20% пациентов[3]. У пациентов с резистентностью к 1 линии терапии необходимо повторно оценить возможность вторичной АИГА, так как АИГА с тепловыми агглютининами, ассоциированная с злокачественными опухолями, НЯК, тератомой яичников или с IgM являются часто стероидорефрактерными.
Вторая линия терапии.
Спленэктомия.
После проведения спленэктомии повышается риск тяжелых инфекций, связанных с Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae. Пациентам назначаются поливалентные пневмококковые, менингококковые, Капсулярный полисахарид Haemophilus influenzaе типа b (PRP) конъюгированного со столбнячным анатоксином (TT) вакцины за 2-4 недели до спленэктомии. У пациентов, получавших в последние 6 месяцев ритуксимаб вакцинация может быть неэффективной. После операции- тромбопрофилактика низкими дозами низкомолекулярных гепаринов; постепенная отмена ГКС согласно описанной выше схеме, пневмококковая вакцина- каждые 5 лет. Пациенты после спленэктомии должны быть информированы о риске инфекций и необходимости при любом фебрильном эпизоде принимать антибиотики из группы пенициллинов или респираторных фторхинолонов (левофлоксацин); также они должны быть информированы о риске венозных тромбоэмболий.
Ритуксимаб.
Показания для назначения ритуксимаба:
· резистентные формы АИГА с нарастающим количеством различных осложнений;
· отказ от спленэктомии;
· пожилой возраст с высокой степенью риска осложнений первой и второй линий терапии
· противопоказания к спленэктомии, высокий риск венозных тромбоэмболий.
Противопоказания к назначению ритуксимаба:
· непереносимость препарата;
· активный гепатит В и С;
· острая вирусная или бактериальная инфекция.
Стандартный режим — 375 мг/м2 в 1, 8, 15 и 22й дни. Пациенты, находящиеся на терапии ГКС до начала терапии ритуксимабом, должны продолжать прием ГКС до первых признаков ответа на ритуксимаб.
Эффективность ритуксимаба в стандартной дозе при АИГА с тепловыми антителами: общий ответ 83-87%, полный ответ 54-60, безрецидивная выживаемость у 72% в течение 1 года и 56%- в течение 2 лет [4].
Время наступления ответа варьирует от 1 месяца у 87,5% до 3 месяцев- 12,5 % [5]. При повторном курсе эффективность ритуксимаба может быть более высокой по сравнению с первым курсом. Ответ на терапию наблюдается в монорежиме или в комбинации с ГКС, иммуносупресантами иинтерфероном –α и не зависит от первичной терапии [7].
Токсичность терапии: Препарат имеет хороший профиль безопасности. Очень редко, как правило, после первой инфузии лихорадка, озноб, сыпь, или боль в горле. Более серьезные реакции включают сывороточную болезнь и (очень редко), бронхоспазм, анафилактический шок, тромбоэмболии легочной артерии, тромбоз артерий сетчатки, инфекции (эпизоды инфекции приблизительно у 7%), и развитие фульминантного гепатита за счёт реактивации гепатита В. В редких случаях прогрессивная мультифокальная лейкоэнцефалопатия.
Ритуксимаб в низкой дозе (100 мг/неделю в течение 4 недель) в качестве первой или второй линии терапии дает общий ответ в 89% (полный ответ в 67%) и безрецидивный период в течение 36 месяцев у 68%. Приблизительно 70% пациентов, получавших ГКС и ритуксимаб имели ремиссию 36 месяцев по сравнению с 45% пациентов, которые получали монотерапию стероидами [6].
Иммуносупрессивные препараты.
Основным фактором выбора иммуносупрессивного препарата должна быть безопасность пациента, потому что ожидаемая эффективность всех препаратов низкая и лечение может быть более опасным для пациента, чем лечение заболевания (таблица 2). При длительном лечении поддерживающая терапия может проводиться на амбулаторном этапе под контролем специалиста.
Таблица 2 — Иммуносупрессивная терапия АИГА
| Препарат | Дозировка | Эффективность | Примечание |
| Азатиоприн | 100-150 мг/день или 1—2,5 мг/сут на длительный период (4—6 мес). Поддерживающая терапия (25 мг через день) в последующем может продолжаться от 4 месяцев до 5—6 лет | Ответ меньше, чем у 1/3 пациентов[1] | Трудности дозировки из-за узкого терапевтического окна, гиперчувствительности из-за генетических особенностей или взаимодействия с другими препаратами. Редко проявляются: слабость, потливость, повышение трансаминаз, тяжелая нейтропения с инфекцией, панкреатит. |
| Циклофосфамид | 100 мг/день | Ответ меньше, чем у 1/3 пациентов | При длительном лечении имеет существенный мутагенный потенциал |
| Циклоспорин А | 5 мг/кг/сут 6 дней, затем до 3 мг/кг/сут (уровень циклоспорина в крови в пределах 200-400пг/мл) | Имеются ограниченные сведения об эффективности у ¾ пациентов с АИГА с тепловыми антителами и жизнеугрожающим, рефрактерным гемолизом 48 Комбинация циклоспорина, преднизолона и даназола дала полный ответ у 89% по сравнению с 58% пациентов, находящихся на терапии преднизолоном и даназолом. | увеличение креатинина в сыворотке крови, гипертония, повышенная утомляемость, парестезии, гиперплазия десен, миалгия, диспепсия, гипертрихоз, тремор |
| Микофенолата мофетил | Начальная доза 500 мг/сут с увеличением до 1000 мг/сут от 2 до 13 мес | Ограниченные данные по применению у пациентов с рефрактерной АИГА с тепловыми антителами. Был успешно применен в сочетании с ритуксимабом в случае рефрактерной АИГА после ТГСК [7] | головная боль, боли в пояснице, вздутие живота, анорексия, тошнота |
Алгоритм действий при неотложных ситуациях:
· при подозрении на наличие гемолитического криза (лихорадка, бледность, желтушность кожных покровов, потемнение мочи, спленомегалия, сердечно-сосудистая недостаточность, анемический шок, анемическая кома) – вызов бригады СМП для экстренной транспортировки пациента в гематологическое отделение или отделение интенсивной терапии в зависимости от тяжести состояния;
· мониторинг жизненно-важных функций: частота и характер дыхания, частота и ритмичность пульса, показатели систолического и диастолического АД, количество и цвет мочи;
· при наличии признаков нарушения витальных функций (острая сердечная недостаточность, признаки шока, почечной недостаточности) – неотложная помощь: обеспечение венозного доступа, инфузия коллоидных препаратов, при подозрении на внутрисосудистый гемолиз – профилактика почечной недостаточности (фуросемид), оксигенация кислородом.
Показания для консультации специалистов:
· консультация врача по рентгенэндоваскулярной диагностике и лечению – установка центрального венозного катетера из периферического доступа (PICC);
· консультация гепатолога – для диагностики и лечения вирусного гепатита;
· консультация гинеколога – при беременности, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов;
· консультация дерматовенеролога – при кожном синдроме;
· консультация инфекциониста – при подозрении на вирусные инфекции;
· консультация кардиолога – при неконтролируемом АГ, хроническая сердечная недостаточность, нарушения сердечного ритма и проводимости;
· консультация невропатолога – при остром нарушении мозгового кровообращения, менингите, энцефалите, нейролейкозе;
· консультация нейрохирурга – при остром нарушении мозгового кровообращения, дислокационный синдром;
· консультация нефролога (эфферентолог) – при почечной недостаточности;
· консультация онколога – при подозрении на солидные опухоли;
· консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
· консультация офтальмолога – при нарушении зрения, воспалительные заболевания глаза и придатков;
· консультация проктолога – при анальной трещине, парапроктите;
· консультация психиатра – при психозах;
· консультация психолога – при депрессиях, анорексии и т.п.;
· консультация реаниматолога – при лечении тяжелого сепсиса, септического шока, синдрома острого легочного повреждения при синдроме дифференцировки и терминальных состояний, установка центральных венозных катетеров.
· консультация ревматолога – при СКВ;
· консультация торакального хирурга –при экссудативном плеврите, пневмотораксе, зигомикозе легких;
· консультация трансфузиолога – для подбора трансфузионных сред при положительном непрямом антиглобулиновом тесте, неэффективности трансфузий, остром массивном гемолизе;
· консультация уролога – при инфекционно-воспалительных заболеваниях мочевыделительной системы;
· консультация фтизиатра – при подозрении на туберкулез;
· консультация хирурга –при хирургических осложнениях (инфекционные, геморрагические);
· консультация челюстно-лицевого хирурга – при инфекционно-воспалительных заболеваниях зубо-челюстной системы.
Профилактические мероприятия:
· при вторичной АИГА- адекватное лечение основного заболевания;
· при АИГА с холодовыми антителами – избегать переохлаждений.
Мониторинг состояния пациента:
Для мониторинга эффективности лечения в амбулаторной карте отмечается: общее состояние пациента, показатели общего анализа крови, включая ретикулоциты и тромбоциты, биохимические показатели – уровень билирубина, ЛДГ, иммуноферментное определение количества иммуноглобулинов на мембране эритроцитов, прямую пробу Кумбса.
Индивидуальная карта наблюдения пациента
| Категория пациентов | Общий анализ крови, включая ретикулоциты | Биохимический анализ (билирубин с фракциями, ЛДГ) | Прямая проба Кумбса | Иммуноферментное определение количества иммуноглобулинов на мембране эритроцитов | Консультация гематолога |
| Консервативное лечение | В процессе лечения-не реже 1 раз в 10 дней; После достижения ремиссии –1 раз в месяц; | В процессе лечения-не реже 1 раз в 10 дней; После достижения ремиссии –1 раз в 2 месяца; | 1 раз в 3-6 месяцев | 1 раз в 2 месяца | Д учёт и наблюдение у гематолога по месту жительства в течение 5 лет. |
Индикаторы эффективности лечения [12]:
Критерии ответа
· Критерии ремиссии: полное восстановление показателей гемограммы (гемоглобин > 120 г/л, ретикулоциты 100 г/л, ретикулоциты менее двух норм, уровень непрямого билирубина 25 мкмоль/л и ниже продолжительностью не менее 2 месяцев.
· Отсутствие ответа на терапию констатируют при незначительной положительной динамике или ответе продолжительностью менее 1 месяца.
источник


