Анемия хронических заболеваний (ее по-другому еще называют анемией воспаления) является распространенным типом патологии, которая развивается у больных, страдающих тем или иным инфекционным, воспалительным или опухолевым заболеванием. Отличительной особенностью такой анемии является понижение сывороточного железа, но, в отличие от истинной нехватки железа, этот микроэлемент может сохраняться в макрофагах.
Анемия хронических заболеваний выступает в настоящее время наиболее распространенной проблемой. Этот тип недуга занимает второе место после железодефицитной анемии. Данная патология может сопровождать любой инфекционный, ревматический или опухолевый недуг, а, кроме того, недостаточность сердца, хронические болезни почек, диабет, цирроз печени и так далее.
Анемию хронических заболеваний (АХЗ) определяют при инфекционном процессе, который ассоциирован с микробными патогенами (бактериальными, вирусными или грибковыми инфекциями), а кроме того, с аутоиммунными заболеваниями, в частности, с такими как системная волчанка, ревматоидный артрит и другие. К возникновению анемии хронических патологий также ведут хронические заболевания, которые сопровождаются воспалением низкой градации, например, онкологическое новообразование, хронические болезни почек, недостаточность сердца и тому подобное. Кроме того, отмечается подобный патогенез анемии хронических заболеваний в ходе старения, на фоне чего у больных отмечают активацию воспалительных цитокинов.
Исследования, которые были проведены в последние десятилетия, позволяют установить патофизиологический механизм анемии хронических заболеваний. Болезни, которые сопровождаются дефицитом железа, весьма многочисленны. Но главным является железодефицитная недостаточность наряду с АХЗ.
Сложность для медиков представляет в первую очередь дифференциальная диагностика анемий хронических заболеваний. При наличии анемии хронических патологий имеет место гипохромный дефицит гемоглобина с низким показателем сывороточного железа, но с увеличенным при этом ферритином. Стоит отметить, что лечение такой анемии с помощью препаратов железа не ведет к компенсации эритропоэза. Использование современных диагностических исследований позволяет улучшать и ускорять диагностику анемии.
Учитывая то, что анемия хронических заболеваний выступает вторичным проявлением базового заболевания, терапия последнего корригирует и анемию. Правда, такая терапия не всегда возможна. Современной тенденцией в медицине является изучение молекул новых лекарственных средств, чьей мишенью служат основные патогенетические звенья хронических заболеваний, в особенности это цитокины наряду с корректорами ветви ферропортина. Но большая часть лекарств находится еще на стадии экспериментального исследования.
Картина крови при описываемом недуге наблюдается следующая:
- Показатель сывороточного железа снижен.
- При наличии у пациента анемии хронических заболеваний железосвязывающая способность эритроцитов будет понижена. Если же этот показатель увеличен, то можно исключить дефицит гемоглобина. Правда, изменение данного значения не является специфичным признаком для того, чтобы дифференцировать анемию хронических недугов от железодефицитной болезни.
- При данном диагнозе насыщенность сыворотки трансферрином, как правило, бывает в норме. Значение выше десяти процентов говорит о снижении железа. А показатель менее десяти процентов свидетельствует о наличии дефицита этого микроэлемента. Железодефицитная болезнь может быть во многом связана с желудочно-кишечными кровотечениями вследствие лечения рефрактерной анемии посредством нестероидных противовоспалительных препаратов.
- На фоне этого заболевания сывороточный ферритин обычно бывает в норме или повышается в противоположность недостаточности железа.
- При наличии ревматоидного артрита, болезней печени или на фоне новообразований нормальное значение сывороточного ферритина не исключает сопутствующий дефицит железа. Правда, уровень ферритина менее 40 нанограмм на миллилитр указывает на значительное снижение запасов железа в организме.
- Такой показатель, как свободный эритроцитарный порфирин, при наличии анемии хронических патологий будет повышен.
Анемия хронических патологий по причине своего медленного развития и протекания в легкой форме, как правило, практически никакой симптоматики не дает. Любые проявления имеют отношение обычно к тем недугам, на фоне которых либо вследствие которых в организме возникает анемия.
Итак, к симптомам, которые свойственны развивающейся анемии, можно отнести наличие у пациентов повышенной утомляемости организма наряду с общей его слабостью и резким снижением работоспособности. Помимо всего прочего, к характерной симптоматике стоит причислить явную раздражительность с частыми головокружениями, сонливостью, шумовыми ощущениями в ушах, мушками перед глазами, учащенным сердцебиением и одышкой при физической нагрузке или даже в состоянии покоя.
Таким образом, в случае возникновения подобной симптоматики стоит начинать бить тревогу и обращаться к врачу для проведения необходимых диагностических исследований и дальнейшего адекватного лечения.
Лучше выяснить заранее, что это такое анемия и чем опасна данная патология.
Анемии свойственны определенные общие признаки. Обычно это наличие нормоцитарной анемии легкой степени тяжести, когда гемоглобин держится в районе более 90 грамм на литр. Такая анемия развивается в течение первых двух месяцев при наличии инфекций, воспалительной патологии либо на фоне злокачественного образования, при этом она не прогрессирует. При показателе гемоглобина ниже 80 грамм на литр следует подумать о присутствии дополнительных факторов, которые участвуют в патогенезе анемии. Кроме этого, выраженность анемии зачастую может коррелировать с продолжительностью и активностью базового заболевания (хроническая инфекция, болезни соединительных тканей и так далее).
Все методы, применяемые для диагностики анемии хронических заболеваний, напрямую зависят от самого основного недуга, на фоне которого развивается дефицит железа в организме. Но, тем не менее, в том случае, если анемия имеет место, то в обязательном порядке больным назначается сдача общего и биохимического анализа крови наряду с пункцией костного мозга для того, чтобы установить характер и тип анемии.
Помимо всего прочего, во время диагностики требуется исключить такие причины нехватки железа, как наличие травматических кровотечений и внутренних кровопотерь.
При сборе у пациентов жалоб, как правило, выясняют наличие у больного следующих симптомов:
- Сердцебиения и одышки, усиливающейся при физической нагрузке.
- Головокружений и шума в ушах.
- Слабости и повышенной утомляемости.
Как лечится анемия хронического заболевания (по МКБ-10, кстати, код недуга — D63.8)?
Учитывая то, что анемия хронических заболеваний выступает вторичным проявлением базового заболевания, терапия последнего будет корригировать и дефицит железа. Однако, такая терапия не всегда возможна. К принципам ведения больных с анемией хронических патологий относят следующие пункты:
- Проведение лечения основного заболевания.
- Использование специфических средств лечения анемии. Таковые назначаются только при наличии тяжелой степени болезни, которая ограничивает трудоспособность наряду с повседневной активностью пациента.
- При развитии тяжелой анемии назначается переливание эритроцитарных масс.
- Назначение эритропоэзстимулирующих препаратов с сочетанием с внутривенными медикаментами железа.
- Методики лечения дополнительно могут включать в себя различные эритропоэзстимулирующие инновационные средства наряду с антицитокиновыми препаратами и лекарствами, влияющими на гепсидин и ферропортин.
Стоит отметить, что патология не выступает зарегистрированным показанием к назначению пациентам эритропоэзстимулирующих лекарств, однако таковые могут быть рассмотрены в качестве альтернативного лечения для замещения многократных трансфузий эритроцитов. В некоторых исследованиях отмечаются положительные результаты использования эритропоэзстимулирующих средств в лечении анемии хронических заболеваний.
Среди пациентов с хронической недостаточностью сердца распространенность анемии составляет тридцать семь процентов. Среди этого числа более чем у половины пациентов регистрируют анемию хронических заболеваний. В целом, общая распространенность железодефицитной болезни у пациентов с недостаточностью сердца колеблется от четырнадцати до пятидесяти шести процентов. Такой широкий диапазон напрямую связан с отсутствием единого утвержденного подхода к диагностике анемий, а, кроме того, с возрастными различиями больных.
В настоящее время доказано, что у страдающих недостаточностью сердца пациентов чаще выявляют нормоцитарную анемию, которая составляет до пятидесяти семи процентов случаев. Чаще всего это заболевание бывает ассоциировано с дисфункцией почек и понижением секреции эритропоэтина. Для хронического течения заболевания свойственна плохая утилизация железа наряду с выраженной активацией цитокинов, что на сегодняшний день встречается у пятидесяти трех процентов пациентов.
Возникновению анемии при хронической сердечной недостаточности способствует, как правило, возникновение в крови дефицита железа. В настоящее время доказано, что основными причинами появления анемии у пациентов с недостаточностью сердца являются гемодилюция наряду с хроническими заболеваниями почек и дефицитом витамина В12.
К таковым можно отнести все методики профилактики хронических недугов и их рецидивов. Одной из рекомендаций является соблюдение правильного и сбалансированного питания, богатого железом. Таким образом, для профилактики любых анемий врачи рекомендуют делать упор на мясные и рыбные блюда, так как именно в них содержится наибольшее число этого столь необходимого для организма микроэлемента. В этой связи необходимо отметить, что в особенности больше всего железа содержится в красных сортах мяса, например в говядине. Не стоит забывать и о фруктах, например, свое предпочтение следует отдавать яблокам, гранатам и так далее.
Всем известно, что движение наряду с прогулками являются отличной профилактической мерой при наличии любого заболевания. В связи с этим для предупреждения симптоматики неприятной анемии крайне важно регулярно поддерживать свой организм в тонусе. Занятия умеренными физическими нагрузками в виде фитнеса, аэробики, плавания и лыж, значительно улучшают кровообращение, способствуя в целом хорошему самочувствию.
Помимо всего прочего, нельзя забывать о том, что любая анемия в первую очередь является недостатком кислорода. Поэтому самой лучшей профилактикой анемии считается возможность пополнения запасов кислорода в организме. Для этого врачи советуют много гулять на свежем воздухе. К сожалению, в настоящее время у большинства людей сидячая работа, многие постоянно находятся в душном помещении, а это все непременно сказывается на здоровье организма и отражается на нем не лучшим образом.
Все вышеперечисленные рекомендации являются довольно действенными при наличии дефицита железа любой разновидности и при анемии хронических заболеваний в том числе. Главное, что все эти рекомендации достаточно просты, и следовать им может абсолютно каждый человек. Можно, разумеется, периодически употреблять для профилактики и железосодержащие препараты, но сразу стоит отметить, что злоупотреблять таковыми все же не стоит. Поэтому лучше всего предупредить заболевание, которое может вызвать дефицит железа в организме посредством банального ведения здорового образа жизни.
Мы выяснили, что это такое анемия и чем опасна данная болезнь.
источник
Анемия определяется как снижение концентрации гемоглобина в периферической крови ниже показателя 120 г/л у женщин и 140 г/л у мужчин. Заболевание может протекать в разных формах, которые определяются по характерным признакам анемии.
Чтобы предотвратить анемию, необходима эффективная и слаженная работа почек, спинного мозга и питательных веществ в организме. Если хоть с одним из элементов этой системы что-то не так, возникает анемия.
Признаки анемии различны в зависимости от причины ее возникновения и тяжести патологии. На первый взгляд, может показаться, что у пациента обычная простуда или усталость. Но при появлении слабости, головокружения, бледности кожных покровов и слизистых оболочек, раздражительности можно предположить наличие анемии. При легкой форме анемии ее признаки могут какое-то время оставаться незамеченными, но становятся очевидными по мере ухудшения состояния, прогрессировании болезни.
В запущенной форме хроническая анемия проявляется одышкой, холодностью конечностей, нерегулярными менструациями или аменореей, замедленным заживлением ран, болью в груди, быстрым или нерегулярным пульсом, а также выпадением волос и ломкостью ногтей.
Нечастыми признаками анемии могут также быть обмороки, покалывания в руках и ногах (парестезии), низкое кровяное давление (при серьезной потере крови), низкая устойчивость к инфекции, болезненное учащенное сердцебиение (тахикардия), иногда увеличение селезенки.
Уменьшение количества красных кровяных клеток — еще не показатель анемии, потому что при некоторых ее разновидностях (например, гипохромная анемия) количество эритроцитов остается нормальным, но средняя концентрация гемоглобина низкая. Кроме того, образ жизни, рост, возраст и пол, могут существенно повлиять как на количество эритроцитов, так и на концентрацию гемоглобина. Если развитие анемии идет медленно, организм может адаптироваться к ней, вплоть до уровня гемоглобина 60 г/л.
При таком недуге, как анемия, в первую очередь, страдает иммунитет. Проблемы с иммунной системой отражаются на общем состоянии всего организма. И в данном случае возникшую простуду или вирусную инфекцию можно считать наименьшим злом, потому что хроническая анемия может способствовать развитию более серьезных заболеваний, например, сердечно—сосудистой системы, а также привести к нарушению работы центральной нервной системы.
Анемия особенно опасна для женщин «в положении». Она может привести к выкидышу, как на раннем, так и на позднем сроке, плацентарной недостаточности и даже преждевременным родам, что в результате может негативно повлиять на дальнейшее развитие малыша. Анемичные дети чаще подвержены простудам, могут отставать в физическом и умственном развитии.
Сама анемия является скорее состоянием (признаком) какого-либо недуга, а не самим заболеванием. Врачами анемия рассматривается либо в хронической, либо в острой форме. Хроническая анемия развивается в течение относительно длительного времени, в то время как острая анемия начинается внезапно. Только врач может определить наличие той или иной формы заболевания.
Хроническую анемию могут спровоцировать различные нарушения в работе органов и систем: функции костного мозга, печени, аутоиммунные состояния, почек, эндокринной и пищеварительной систем, а также инфекционные и онкологические заболевания, гельминтозы (инвазии паразитами).
Эритроциты живут в среднем 100 дней, поэтому организм постоянно меняет отмершие красные клетки на новые. Красные клетки (эритроциты) синтезируются в костном мозге. В качестве причины анемии, в первую очередь, рассматриваются кровотечение или расстройство процесса синтеза красных кровяных клеток в кости. Анемия встречается у взрослых и детей, но в преклонном возрасте она проявляется чаще. Примерно 10% населения страдает анемией, женщины в два раза чаще мужчин.
Существует множество заболеваний, которые вызывают хроническую анемию. Среди них:
- наружное кровотечение (кровоизлияние), вызванное менструацией, язвой;
- дефицит железа (костный мозг нуждается в железе для синтеза красных кровяных клеток);
- хронические заболевания (любое такое заболевание может привести к анемии);
- болезни почек (почки выделяют гормон эритропоэтин, необходимый для стимуляции эритропоэза — процесса образования эритроцитов);
- снижение чрезмерного объема крови при остром или хроническом кровотечении;
- чрезмерное разрушение эритроцитов при гемолитических заболеваниях;
- снижение эритропоэза из-за угнетенного синтеза нуклеопротеидов, которые в норме его стимулируют;
- дефицит железа в рационе питания;
- угнетение костного мозга (при отравлении);
- беременность (задержка воды и жидкостей во время беременности приводит к разжижению крови и уменьшению процентного содержания красных кровяных телец);
- плохое питание (витамины и минералы имеют жизненно важное значение для синтеза эритроцитов),
- алкоголизм (включая низкий уровень витаминов и минералов),
Другие причины являются менее распространенными. Среди них заболевания печени, нарушения свертываемости крови, инфекции, рак, артрит, дефицит ферментов, токсины или наследственные заболевания.
Лечение анемии основывается, в первую очередь, на устранение ее причины, потому что в некоторых случаях она угрожает жизни пациента и требует переливания крови.
Некоторыми лекарственными средствами и методами лечения анемии являются:
- железо (во время беременности, когда уровень железа в организме низкий),
- витаминные добавки (для покрытия потребности в фолиевой кислоты и витамина В 12)
- антибиотики, когда речь идет о инфекции.
Быстрее всего восстанавливаются молодые пациенты, в то время как для людей преклонного возраста необходимо более длительное лечение. И это связано с преобладанием у них хронических заболеваний. Анемия ухудшает почти все физиологические недомогания.
Профилактика анемии состоит в полноценном и сбалансированном питании, с употреблением мяса, молочных продуктов, овощей и фруктов. Эти продукты являются источником железа и витаминов, необходимых организму для выработки гемоглобина в крови.
источник
Анемия при хроническом заболевании (анемия вследствие нарушения реутилизации железа) является мультифакториальной и часто сопровождается дефицитом железа. Для постановки диагноза обычно требуется наличие хронической инфекции, воспаления, рака, микроцитарной или погранично-нормоцитарной анемии, показателей сывороточного трансферрина и ферритина, которые определяются в значениях между типичными для железодефицитной анемии и сидеробластной анемии. Терапия направлена на лечение основного заболевания, а если оно носит необратимый характер, сводится к применению эритропоэтина.
Во всем мире анемия при хроническом заболевании является второй по распространенности. На ранних этапах эритроциты нормохромные, но с течением времени они становятся микроцитарными. Основной проблемой является неспособность эритроидного ряда костного мозга к пролиферации в ответ на анемию.

Этот тип анемии следует заподозрить при наличии хронического заболевания чаще инфекционного, воспалительного процесса (особенно ревматоидного артрита) или злокачественного новообразования, однако аналогичный процесс имеет место при любой инфекции или воспалении.

Выделяют три патофизиологических механизма:
- умеренное укорочение времени жизни эритроцитов по пока неясным причинам у больных раком или с хроническими гранулематозными инфекциями;
- нарушение эритропоэза вследствие снижения продукции ЭПО и ответа костного мозга на него;
- нарушение внутриклеточного метаболизма железа.
Ретикулярные клетки удерживают железо, полученное из старых эритроцитов, делая недоступным для синтеза гемоглобина; таким образом, невозможна компенсация анемии путем повышения продукции эритроцитов. Макрофагальные цитокины (например, IL-1, фактор некроза опухоли а, интерферон ) у больных с инфекцией, воспалительным процессом и раком вызывают или способствуют уменьшению продукции ЭПО и нарушают метаболизм железа.

Клинические проявления, как правило, те, которые определяют основное заболевание (инфекция, воспаление или злокачественное новообразование).

Анемия на фоне хронического заболевания предполагается у больных с микроцитарной или погранично-нормоцитарной анемией с хронической инфекцией, воспалением или раком. Если есть подозрение на хроническую анемию, необходимо исследовать сывороточное железо, трансферрин, рецептор трансферрина и сывороточный ферритин. Уровень гемоглобина обычно превышает 80 г/л, пока дополнительные процессы не приведут к прогрессированию анемии. Если в дополнение к хроническому заболеванию имеется железодефицитное состояние, уровень сывороточного ферритина обычно составляет менее 100 нг/мл, и, если при наличии инфекции, воспаления или злокачественного новообразования уровень ферритина несколько меньше 100 нг/мл, предполагается, что параллельно с вызванной хроническим заболеванием анемией имеется и железодефицит. Вместе с тем, учитывая возможность ложного повышения уровня сывороточного ферритина в качестве маркера острой фазы, в случаях высокого уровня сывороточного ферритина (> 100 нг/мл) в дифференциальной диагностике железодефицита и анемии на фоне хронического заболевания помогает определение рецептора сывороточного трансферрина.

источник
Анемия хронических заболеваний (АХЗ) – не нозологическая форма, не синдром, а собирательное понятие, характеризующееся общностью патогенеза этого осложнения различных заболеваний. К данным анемиям относят:
анемии при злокачественных опухолях, как с поражением костного мозга (гемобластозы, метастазы в костный мозг), так и без него;
анемии воспаления, в том числе: — при острых инфекциях (сепсис, пневмония, инфекционный эндокардит, перитонит); — при хронических инфекциях (остеомиелит, хр. пиелонефрит, туберкулез); — хр. воспалительных заболеваниях с преобладанием иммунокомплексного механизма (ревматоидный артрит, гепатит, СКВ, болезнь Крона);
анемия при острой и хронической почечной недостаточности, в том числе и у больных, находящихся на гемодиализе;
анемия при хронической сердечной недостаточности;
анемии при эндокринопатиях (гипофункция щитовидной железы, сахарный диабет).
Характерной особенностью АХЗ является многофакторность патогенеза. Выделяют следующие механизмы:
Угнетение эритропоэза: — активация ингибиторов эритропоэза, — ингибиция эритропоэза цитостатиками, — конкурентное вытеснение эритрона из костного мозга опухолевыми клетками.
Сокращение продолжительности жизни эритроцитов: — внутрисосудистый механический гемолиз при ДВС-синдроме, — аутоиммунный гемолиз. — кровопотери
Нарушение обмена железа: — повышенное потребление железа неэритроидными клетками, в том числе бактериями, — нарушение высвобождение железа запасов макрофагами, — дефицит железа при хронических кровопотерях.
Клиническая картина. Специфической клинической картины при данной анемии нет. Анемия легкая или умеренная, чаще всего больные адаптированы к анемии, поэтому не вызывает жалоб, но у пожилых людей может приводить к сердечно-сосудистым нарушениям, не выражена желтушность, не увеличена селезенка. Важной особенностью служит независимость анемии от основных симптомов заболевания, являющегося причиной анемии: нет корреляции между уровнем гемоглобина и азотистых шлаков при уремии, активности СКВ и ревматоидного артрита, тяжестью инфекционного процесса.
нормохромные эритроциты обычных размеров и форм;
уровень гемоглобина не опускается ниже 100г/л (исключая больных тяжелой почечной недостаточности).
отсутствие лейкоцитопении и тромбоцитопении или разнонаправленные изменения их концентрации, не коррелирующие с анемией;
нормальный или несколько повышенный уровень ретикулоцитов;
нормальный или слегка повышенный уровень эритропоэтина в крови;
наличие в сыворотке крови ингибиторов эритропоэза ( ТNFa,IL-1 и др)
нормальный уровень в крови витамина В12 и фолиевой кислоты;
нормальный уровень запасов железа, нормальные показатели ОЖСС, ферритина и растворимых рецепторов к трансферрину (если нет выраженного железодефицитного компонента).
Коррекция анемии при АХЗ нужна не всем пациентам. Необходимо оценить переносимость пациентом анемии. Часто анемия компенсируется при лечении основного заболевания.
Нет оснований рекомендовать назначение витамина В12 или фолиевую кислоту, без прямого определения недостаточности уровня этих витаминов в крови.
Терапия эритропоэтином проводится больным с хронической почечной недостаточностью, ВИЧ- инфицированным больным, у больных с онкологической патологией. Оценивая антианемический эффект эритропоэтина при опухолях, отмечено не столько прирост гемоглобина, сколько улучшение качества жизни больных.
Анемия при злокачественных опухолях. Распространенность данного вида анемии колеблется от 30 до 90%. У 40% больных лимфомами анемия выявлена к моменту постановки диагноза. У пациентов, госпитализированных по поводу анемии, частота злокачественных новообразований с локализацией в ЖКТ составляет от 5до 15%. Активация воспалительных и опухолевых цитокинов (фактор некроза опухоли, интерлейкины, интерферон) приводит к подавлению выработки эритропоэтина, нарушению высвобождения железа из макрофагов и подавлению пролиферацию клеток предшественников эритропоэза.
Анемии воспаления. Воспалительные цитокины действуют быстро и эффективно, при острой бактериальной инфекции легкая анемия может развиться уже через 24-48 часов. Сначала концентрация Нb падает из-за кратковременного гемолиза, макрофаги удаляют из крови отжившие эритроциты (перераспределение железа в организме – увеличенное потребление макрофагами), в последующем угнетение эритропоэза идет воспалительными цитокинами. При хроническом воспалении тяжесть и характер анемии зависит от природы основного заболевания.
Анемия при воспалительных заболеваниях характеризуется снижением, как сывороточной концентрации железа, так и ОЖСС. Насышение трансфферина уменьшается до 10-20% и на этом фоне повышенный уровень ферритина, а при исследовании костного мозга нормальные или увеличенные запасы железа в сочетании с гипоплазией эритроидного ростка.
Определение сывороточных концентраций провоспалительных цитокинов, эритропоэтина, рецептора трасферрина не имеет дифференциально-диагностического значения. При выраженной гипорегенераторной анемии, с поражением костного мозга отмечается панцитопения. В этой ситуации измерение концентрации эритропоэтина позволит определить, чему принадлежит основная роль в возникновении анемии — поражению костного мозга или воспалению. Низкая концентрация эритропоэтина указывает на преимущественную воспалительную этиологию анемии, таким больным показаны препараты эритропоэтина.
Анемия при хронической сердечной недостаточности (ХСН) варьирует от 14,4 до 55%. Считается, что анемия является независимым показателем выживания больных с ХСН. Важным фактором развития данной анемии является почечная дисфункция, воспаление, резистентность к эритропоэтину, кишечная мальабсорбция, постоянное использование аспирина и протеинурия. Значение почечной дисфункции подтверждалось в исследованиях К.К. Witte et al., установивших, что снижение уровня гемоглобина ниже 125г/л сопровождалось повышением уровня креатенина, отсутствует корреляция между уровнем гемоглобина и уровнем эритропоэтина. Отмечается значительное повышение сывороточного натрий уретического пептида В. Не изучалась влияние гидремии на снижение концентрации гемоглобина. Является ли анемия следствием развития сердечной дисфункции и роль анемии в развитии сердечной недостаточности – вопросы остаются открытыми.
Анемия при хронических болезнях почек (ХБП) — нормоцитарная нормохромная, при развитии недостаточности железа – гипохромная, является одним из осложнений ХБП, влияющих на качество жизни и общую выживаемость больных, появляется у больных с заболеваниями почек при уменьшении скорости клубочковой фильтрации (СКФ) ниже 50 мл/мин/1,73 м 2 . Анемия усиливается при прогрессировании ХБП, так как сморщивание почек приводит к падению синтеза гормона эритропоэтина. До назначения средств, стимулирующих эритропоэз, необходимо провести первичное клинико-лабораторное исследование для выявления иных возможных причин анемии, усугубляющих относительный дефицит эритропоэтина.
снижение продукции эритропоэтина
укорочение жизни эритроцитов,
тромбоцитарная дисфункция, ДВС — синдром с присущей ему кровоточивостью и внутрисосудистым гемолизом
действие уремических токсинов на эритроциты
снижение уровня железа из-за неадекватного всасывания в кишечнике и гемодиализных кровопотерь
Выраженность и длительность почечной анемии при ХБП во многом определяют тяжесть астенического синдрома, степень переносимости ими физической нагрузки, чувствительность к инфекции. В консервативной стадии ХБП лишь 25% больных получают антианемическую терапию. В настоящее время установлено, что частота обнаружения эксцентрической формы гипертрофии левого желудочка прямо пропорционально тяжести эритропоэтиндефицитной анемии. При значительной ГЛЖ смертность больных с ХБП увеличивается в 4 раза, риск развития инфаркта миокарда в 3-6 раз. Уменьшение уровня гемоглобина на 1 г/дл повышает летальность от сердечно-сосудистых и инфекционных осложнений ХБП почти на 20%.
Лабораторное обследование включает следующие показатели:
Нb, эритроцитарные индексы, концентрацию ферритина, определение С- реактивного белка для выявления воспалительной реакции.
В случае недостаточной информативности данных, полученных на начальном этапе, проводят развернутое клиническое обследовании, которое включает: выявление кровопотерь через ЖКТ (тест на скрытую кровь), исследование витамина В12 и фолата, концентрацию интактного паратиреоидного гормона, гемолитические тесты (гаптоглобин, билирубин, тест Кумбса), электрофорез белков крови или мочи, концентрацию алюминия в плазме.
для диагностики почечной анемии редко требуется измерение уровня эритропоэтина в сыворотке крови, поскольку имеется прямая корреляция между выраженностью анемии и степенью снижения почечной функции.
Принципы лечения анемии при ХБП (EBPG II):
Лечение анемии с использованием средств, стимулирующих эритропоэз (ССЭ) должно назначаться всем пациентам с ХБП, имеющим уровень Нb ниже 110г/л, данный уровень следует достигнуть в течении 4 месяцев от начала противоанемического лечения;
всем больным, получающим ССЭ дополнительно назначают препараты железа, с регулярной оценкой концентрации сывороточного ферритина целевые значения 200-500мкг/л
способ введения ССЭ определяется категорией пациентов, а так же зависит от типа используемого препарата. Доза ССЭ титруется в соответствии с уровнем Нb. У больных ХБП 1-V стадии без диализа эпоэтин бета вводится п/к 1-3 раза в неделю, поддерживающие дозы 1-3 раза в недель, дарбепоэтин альфа: 1 раз в неделю, поддерживающая доза 1 раз в 1 или 2 недели
Эпоэтин альфа не разрешен для п/к применения в большинстве стран Европы из- за риска развития красноклеточной аплазии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МИКРОЦИТАРНЫХ АНЕМИЙ
Число заболеваний, с которыми проводится дифференциальный диагноз ЖДА, невелико – это талассемия, анемии связанные с нарушением синтеза порфиринов и гемма, анемия вследствие хронических заболеваний. При гипохромных анемиях с высоким содержанием железа не наблюдается трофические расстройства, свойственные ЖДА – выпадение волос, ломкость ногтей, извращение вкуса, дисфагия.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОРЕГЕНЕРАТОРНЫХ АНЕМИЙ
источник

Анемия хронических заболеваний (АХЗ) была выделена в отдельную нозологическую единицу в 1952 году после публикации Кертврайта (G.E. Cartwright) и Винтроба (M.M. Wintrobe). Некоторые специалисты считают не совсем корректным термин «анемия хронических заболеваний» и предлагают использовать термин «анемия воспаления». Такие разногласия вызваны тем, что этот вид анемии может развиваться не только при хронических, но и при острых воспалительных патологиях (снижение уровня гемоглобина в крови обнаруживается менее чем через 14 дней – это умеренная анемия с уровнем гемоглобина 90-130 г/л, гематокрита – 30-40%). Тем не менее, чтобы диагностировать анемию хронических заболеваний, необходимо наличие длительно текущего заболевания (инфекционного, аутоиммунного или онкологического).
Анемия хронических заболеваний – иммунорегулируемое состояние. Важными аспектами патогенеза является изменения в гомеостазе железа, нарушение продукции эритропоэтина, угнетение пролиферации эритроидных клеток-предшественников и продолжительность жизни эритроцитов. Ранее ученые предполагали наличие гормонов, участвующих в регуляции гомеостаза железа и обеспечивающих связь между процессами усвоения, рециклирования и депонирования этого микроэлемента. Но открытие гепцидина позволило специалистам значительно расширить понимание патогенеза анемии хронических заболеваний (см статью «Эритропоэз: Гемоглобин и Эритроциты» ).
Так, в случае дефицита гепцидина в организме, может возникать серьезная перегрузка железом, что рассматривается рядом специалистов как один из основных патогенетических механизмов гемохроматоза. Продукция гепцидина печенью стимулируется воспалением и инфекционным процессом. Ученые выяснили, что ряд цитокинов (например, интерлейкин-6) при хронических заболеваниях, индуцирует синтез гепцидина в клетках печени, и повышение уровня гепцидина ингибирует процесс усвоения железа в желудочно-кишечном тракте и реутилизацию железа из макрофагов ретикулоэндотелиальной системы (см рисунок 1)
Рисунок 1. Роль гепцидина в регуляции гомеостаза при воспалительном процессе
Анемия и гипоксия ингибируют процесс образования гепцидина в печени, в результате чего снижается угнетающее влияние гепцидина на процесс усвоения железа в кишечнике и реутилизацию железа из макрофагов ретикулоэндотелиальной системы.
Сегодня специалисты отдают гепцидину главную роль в центральном механизме развития анемии хронических заболеваний. Принципиальным отличием анемии хронических заболеваний от железодефицитной анемии (ЖДА) считается то, что анемия хронических заболеваний является мультифакторной патологией, тогда как железодефицитная анемия вызвана абсолютным дефицитом железа в организме (см статью «Железодефицитная анемия» ).
Именно комплекс факторов занимает ведущую роль в развитии анемии хронических заболеваний. К основным факторам относят:
- Нарушения гомеостаза железа
- Угнетение эритропоэза
- Ингибирование синтеза эритропоэтина
Благодаря современным технологиям, используемых в изучении патофизиологии анемии хронических заболеваний, специалисты разрабатывают новые средства и методы лечения. Большой интерес в терапии анемии хронических заболеваний представляют препараты антагонисты гепцидина, применение которых дает возможность восстановить угнетение процесса реутилизации железа из клеток ретикулоэндотелиальной системы, а также гормоны (препараты рекомбинантного эритропоэтина человека; ЭСА – эритропоэтин-стимулирующих агентов) и цитокины, которые стимулируют эритропоэз.
При постановке диагноза важно дифференцировать железодефицитную анемию и анемию хронических заболеваний, диагностика которой довольно сложная. На практике часто встречаются случаи сочетания анемии хронических заболеваний и железодефицитной анемии. Как и при железодефицитной анемии, анемия хронических заболеваний характеризуется снижением уровня железа в крови, что отражает абсолютный дефицит железа при железодефицитной анемии и гипоферремию на воне воспалительного процесса при анемии хронических заболеваний, вызванную нарушением реутилизации железа из клеток ретикулоэндотелиальной системы. Поэтому в основу дифференциальной диагностики этих состояний не может быть положено только анализ уровня железа в крови.
Уровень ферритина является основным маркером запасов железа в организме. Поэтому анализ на содержание ферритина – самый надежный критерий дефицита железа в организме. Но ферритин также является одним из острофазовых белков, поэтому при воспалительном процессе его уровень повышается, что затрудняет диагностику дефицита железа у больных с разными воспалениями или онкологическими патологиями (например, у пациентов с раком толстой кишки на фоне кровотечений или язвенным колитом). В этом случае рекомендуется проводить анализ на уровень сывороточного трансферринового рецептора.
Концентрация трансферринового рецептора в крови при дефиците железа в организме повышается и остается в пределах нормы при анемии хронических заболеваний или в случаях анемии смешанного генеза (ЖДА + АХЗ). Концентрация провоспалительных цитокинов в крови при анемии хронических заболеваний значительно повышается и не изменяется при железодефицитной анемии.
В отличие от анемии хронических заболеваний, анемия смешанного генеза (АХЗ + ЖДА) характеризуется повышением уровня микроцитов и значительно низким уровнем гемоглобина. Поэтому анализ концентрации гипохромных эритроцитов и уровня гемоглобина в эритроцитах, проводимый в современных лабораториях, считается надежным методом определения железодефицитного эритропоэза у больных АХБ.
В теории на дифференциальную диагностику анемии хронических заболеваний и железодефицитной анемии может влиять адекватность продукции эритропоэтина в зависимости от степени тяжести анемии. Так, при анемии хронических заболеваний характерно недостаточное образование эритропоэтина, которое не соответствует степени тяжести анемии. Оценка адекватности продукции эритропоэтина проводится на основании определения отношения логарифма, определяемого (О) уровня эритропоэтина к предполагаемому (П) уровню эритропоэтина, который определяется в группе пациентов с железодефицитной анемией – О / П log ЭПО. Продукция эритропоэтина считают неадекватно низкой в отношении степени анемии при О/П log ЭПО
источник
Хронические воспалительные заболевания часто вызывают развитие анемии, характеризующейся снижением уровня гемоглобина в плазме крови. Патология приводит к кислородному голоданию клеток, пациент жалуется на общее недомогание, быструю утомляемость, учащенное сердцебиение. Кожные покровы бледнеют, появляется одышка. Воспаление и анемия взаимосвязаны, на фоне хронических заболеваний ухудшается усвояемость железа, возникает дефицит гемоглобина и эритроцитов.
Анемия хронических заболеваний развивается в результате действия противовоспалительных цитокинов, это пептиды, участвующие в иммунологических процессах. Вещества подавляют выработку эритропоэтина почками, высвобождение молекул железа из клеток-макрофагов, блокируют разрастание эритроидного ростка.
Клетки гемоглобина содержатся в эритроцитах и выполняют функцию транспортировки кислорода из легких ко всем тканям организма. При снижении концентрации эритроцитов происходит ухудшение дыхательной функции, голодают клетки организма. Это негативно сказывается на работе кровеносной системы, возникает бледность слизистых оболочек и кожи.
Степень тяжести анемии зависит от прогрессирования хронического воспаления. Чаще всего развивается нормохромная и нормоцитарная форма патологии.
Нормохромная анемия развивается на фоне хронического заболевания легких, почек, печени, суставов. Чаще всего вторичная патология диагностируется в следующих случаях:
- злокачественные опухоли;
- аутоиммунные заболевания;
- сердечная недостаточность;
- инфекционный эндокардит;
- остеомиелит;
- ревматоидный артрит;
- язвенная болезнь желудка;
- пневмония, бронхиальная астма;
- почечная недостаточность, пиелонефрит;
- гепатит, цирроз печени;
- СПИД;
- туберкулез.
Анемия в большинстве случаев развивается в результате аутоиммунной реакции организма на собственные здоровые клетки. Происходит нарушение обменных процессов и эритропоэз. Патология имеет длительное течение, может более 1–2 месяцев не проявляться четкими симптомами.
Основные признаки нормохромной анемии – это снижение уровня гемоглобина (70–110 г/л), ретикулоцитов, повышение концентрации лейкоцитов, ферритина в составе крови, ускорение скорости оседания эритроцитов (10–15 мм/ч), дефицит меди и цинка.
У пациентов продолжительное время наблюдается повышение температуры тела до 37,5°, происходит это ближе к вечеру, а утром состояние нормализуется. Общий анализ крови указывает на развитие нормохромной анемии на фоне хронического воспаления. Иногда такие признаки свидетельствуют о латентном течении хронических недугов мочеполовой системы.
Чтобы вылечить анемию, необходимо устранить основное заболевание. Дополнительно назначают препараты железа, эритропоэтина, гормональные средства. В тяжелых случаях требуется переливание эритроцитной массы.
Такая анемия чаще всего встречается у пациентов зрелого возраста, механизм ее развития до конца не выяснен. Нормоцитарная форма патологии сопровождает хронические воспаления, злокачественные опухоли, механические травмы, ревматоидные артриты.
Анемия не появляется сразу с основным заболеванием, а развивается постепенно в течение 2–3 недель. Общий анализ крови показывает незначительное снижение уровня гемоглобина, остальные показатели находятся в пределах нормы. При воспалении печени или желчного пузыря в крови появляются плазматические клетки. Чем дольше присутствует заболевание и не проводится лечение, тем сильнее проявляются признаки нормоцитарной анемии. Клинические симптомы патологии:
- головокружение;
- шум в ушах;
- бледность кожных покровов и слизистых оболочек;
- головные боли;
- слабость, быстрая утомляемость;
- одышка;
- учащенное сердцебиение;
- потеря аппетита;
- расстройства менструального цикла у женщин;
- половое бессилие у мужчин.
Симптоматика выражена слабо, дополнительно присутствуют признаки основного заболевания. При латентном течении хронического недуга анемия может никак себя не проявлять длительный период, нарушения показывает только лабораторный анализ крови. Существует прямо пропорциональная связь между выраженностью клинической картины анемии и текущего воспаления. Без проведения лечения патологии у пожилых людей могут произойти серьезные нарушения работы сердечно-сосудистой системы.
Анемия хронических заболеваний может появляться на фоне злокачественных новообразований крови, лимфатической системы, легкого и молочных желез. В таких случаях причиной анемии может быть кровотечение, инфильтрация костного мозга раковыми клетками, лечение противоопухолевыми препаратами и лучевая, химиотерапия. Метастатические клетки могут нарушать процесс костномозгового кроветворения, подобный эффект дает и длительный прием цитостатических средств.
Клинический анализ при такой форме анемии указывает на значительное снижение уровня гемоглобина до 10 г/дл. Лечение больных проводят путем введения эритропоэтина, железа и эритроцитной массы.
Для выявления патологии пациентам назначают общий и биохимический анализ крови, пункцию костного мозга. В результатах понижен уровень гемоглобина, но показатели редко падают ниже 90 г/л, объем эритроцитов в норме или немного понижен 80–90 мкм³. Ферритин сыворотки крови может быть незначительно повышен > 150–350 мкг/л, сидеробласты в костном мозге в допустимых пределах или повышены.
Анализ показывает сниженную концентрацию железа Лечение анемии при хронических заболеваниях
Терапия, прежде всего, должна быть направлена на устранение основного недуга. Лечить отдельно анемию обычно не нужно. Во время реабилитации показатели гемоглобина нормализуются. В некоторых случаях развивается тяжелая форма патологии, при этом требуется внутривенное введение железосодержащих препаратов и эритропоэтина.
Хронические очаги воспаления в организме вызывают нарушение метаболизма, что приводит к дефициту гемоглобина и эритроцитов. Клетки крови не выполняют функцию транспортировки кислорода в нужном объеме, происходит гипоксия тканей. Во время проведения диагностики важно правильно определить форму анемии для назначения целенаправленной терапии.
источник
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Анемии хронической болезни (АХБ) по частоте занимают второе место после ЖДА. АХБ является частью так называемого гематологического стресс – синдрома, который можно определить, как гематологические реакции на повреждение тканей, вызванное инфекцией, воспалением, новообразованиями или травмой. Уровень влияния хронической болезни в настоящее время принято условно определять по ускорению СОЭ, повышению С-реактивного белка (СРБ), фактору некроза опухоли (ФНО). Повышенное значение СОЭ является косвенным признаком текущего воспалительного или иного патологического процесса и относится к параметрам АХБ. Показатели СРБ используют, как критерий влияния хронического заболевания на развитие анемии, так как он является основным из белков острой фазы воспаления (Первушин Ю. В. И др., 2007). Для доказательства наличия именно «опухолевой интоксикации» иногда применяют параметр ФНО-1α, который признан одним из главных провоспалительных цитокинов и имеет выраженный противоопухолевый эффект. Общими чертами АХБ являются: необратимость ее развития при указанных заболеваниях, зависимость ее тяжести от активности и распространенности основной болезни, упорство течения, гипо – и нормохромный характер анемии, чаще всего умеренное снижение Hb (80 – 100 г/л), отсутствие эффекта от антианемических средств и улучшение показателей крови при успешном лечении основного заболевания.
При АХБ развитие малокровия обусловлено преимущественным нарушением продукции эритроцитов в костном мозге и частичной невозможностью костного мозга компенсировать усиление разрушения эритроцитов в периферической крови.
Нарушение продукции эритроцитов обусловлено перераспределением железа в организме, проявляющееся снижением количества железа необходимого для синтеза гема в эритробластах при достаточном или избыточном содержании железа в депо. При хронических заболеваниях происходит активация системы мононуклеарных фагоцитов (макрофагов), при которой усиливается их фагоцитарная активность и блокируется способность к передаче железа эритробластам. Повышение фагоцитарной активности макрофагов в отношении железа, вероятно обусловлено действием интерлейкина-1 и ФНО.
Другой механизм снижения продукции эритроцитов в костном мозге связан со снижением уровня ЭПО, который не соответствует выраженности анемии.
Анемия при хронических заболеваниях развивается обычно через две недели активного течения процесса и носит гипо – и нормохромный характер при снижении сывороточного железа и ОЖСС и повышенном содержании ферритина сыворотки, отражающего увеличение запасов железа в депо. Концентрация трансферрина в сыворотке и число ретикулоцитов нормальные или несколько сниженные, тогда как уровни сывороточных рецепторов к трансферрину нормальные или несколько повышены. Содержание сывороточного ферритина более 100 мкг/л является достоверным показателем, характеризующим АХБ.
Основные сложности в дифференциальной диагностике ЖДА и АХБ возникают при уровне ФС 30 – 100 мкг/л. Сопоставимая распространенность АХБ и ЖДА и нередко гипохромный характер обеих анемий обуславливают их внешнее сходство. В отличие от ЖДА, АХБ имеют наиболее выраженное снижение гемоглобина за счет снижения количества эритроцитов, менее значительно сниженные показатели MCV и MCH, нормальное или сниженное количество ретикулоцитов.
Анемии хронических заболеваний наиболее часто наблюдаются при: хронических инфекциях, коллагенозах и диссеминированных злокачественных новообразованиях.
1. Лабораторные критерии АХБ:
— гипо-нормохромный характер анемии: МСН ≤ 32 пг, МСV ≤ 100 фл, ЦП ≤ 1,0;
— повышение ФС > 30 мкг/л, НТЖ > 20%;
— неадекватно низкая продукция ЭПО степени тяжести анемии: О/П log ЭПО
— увеличение гепцидина выше референсных значений. Наибольший вклад в исследование этого белка внес проф. Демихов В.Г., к.м.н. Левина А.А.
Наличие доказанного хронического воспалительного заболевания, системного заболевания, инфекции, гиперпластического процесса, доброкачественной опухоли.
У больных с анемией, развившейся без клинически выраженной кровопотери, с доказанными хроническими воспалительными заболеваниями, гиперпластическими процессами, доброкачественными опухолями женской репродуктивной системы при наличии неадекватно низкой продукция ЭПО степени тяжести анемии (О/П log ЭПО
Рисунок. Зависимость между концентрацией Н b (г/л) и уровнем сывороточного ЭПО (МЕ/л) (логарифмическая шкала) у больных ЖДА (пунктирная линия) и АХБ (сплошная линия).
Показания к включению в протокол – присутствие всех параметров 1 – 3:
2. наличие критериев диагноза АХБ, О/П log ЭПО
3. наличие слабости, головокружения.
Противопоказания к включению в протокол:
1. другие причины анемии (недостаток железа, кровотечение, недостаток питания и гемолиз);
2. неконтролируемая артериальная гипертензия;
3. предшествующие нарушения мозгового и / или коронарного кровообращения, тромбозы.
1. Использовать стандартные дозы (эритропоэтин альфа или бета) (1000 – 2000 МЕ 3 раза в неделю подкожно);
2. Проводить на фоне приема пероральных препаратов железа (100 мг железа II) 2 раза в день.
3. Контроль эритроцитарных показателей 1 раз в неделю, ФС раз в месяц.
4. Проводить 4 недели с последующей оценкой эффективности лечения и коррекцией дозы.
5. Целевая концентрация Нb = 120 г/л
Оценка эффективности лечения:
Эффективность лечения анемии оценивать каждые 4 недели после начала лечения по следующим параметрам:
1. прирост Hb за время лечения (> 10 г/л через 4 недели);
2. улучшение субъективного состояния больных до и после лечения.
Использование трансфузий эритроцитарной массы при лечении анемии хронического заболевания.
Трансфузии эритроцитарной массы показаны анемиях, сопровождающие хронические заболевания желудочно-кишечного тракта и других органов и систем, интоксикации при отравлениях, ожогах, гнойной инфекции и др.Заместительную терапию эритроцитарной
источник
Ф.Ю.Копылов, Д.Ю.Щекочихин
Первый МГМУ им. И.М. Сеченова Кафедра профилактической и неотложной кардиологии ФППОВ, Москва
Анемия с давних времен является спутником человечества. Выдающийся немецкий врач Йоханнес Ланге (Johannes Lange) уже в 1554 г. дал название анемии как «болезни девственниц (morbus virgineus)». Он считал эту болезнь специфичной для целомудренных девушек, а причиной указывал задержку менструальной крови [1], ссылаясь на описание Гиппократа, представленное в сочинении «О болезнях девушек».
За последующие несколько столетий мы существенно продвинулись в понимании патофизиологии анемии, и в настоящий момент крупные исследования посвящаются оценки роли анемии в развитии и течении различных заболеваний на популяционном уровне. Касательно сердечно-сосудистых заболеваний (ССЗ) доказано, что анемия является независимым фактором риска неблагоприятных исходов ССЗ у пациентов с хронической сердечной недостаточностью (ХСН) и хронической почечной недостаточностью (ХПН). Для общей популяции больных ССЗ большинство данных свидетельствует о том, что анемия является и здесь независимым фактором риска, однако данных для включения в официальные рекомендации пока недостаточно [2].
Определение понятия и распространенность
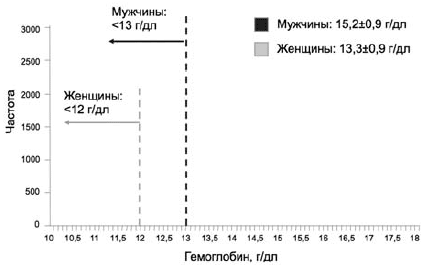
Согласно определению ВОЗ, анемия регистрируется у взрослых женщин при снижении концентрации гемоглобина ниже 12 г/дл, а у мужчин ниже 13 г/дл [3]. На рис. 1 проиллюстрировано применение данных критериев на примере крупной выборки исследования NHANES III (n=40 000) [4]. Применение критерия 12 г/дл для женщин позволяет включить в число страдающих анемией существенно большее число лиц, по сравнению с мужчинами. Этот факт находит свое отражение и в других исследованиях, в которых распространенность анемии у женщин почти в 3 раза превышает таковую у мужчин: 13 и 4,8% соответственно [5], и должен быть принят во внимание при оценке результатов различных исследований.
Рис 1. Применение критериев ВОЗ для определения анемии на популяционном уровне [4]
Распространенность анемии среди пациентов с сердечно-сосудистыми заболеваниями относительно хорошо изучена. Среди пациентов с ишемической болезни сердца (ИБС) составляет от 10 до 30% [6, 7], а на примере ХСН — варьирует в широком диапазоне от 4 до 61% (в среднем 18%) в зависимости от тяжести основного заболевания и применяемых критериев анемии [8].
Этиология и патогенез
Причинами анемии у пациента кардиологического профиля могут быть все факторы характерные для общей популяции. Однако если рассматривать группу больных с прогрессирующими ССЗ и в первую очередь с ХСН, то основными этиопатогенетическими факторами анемии можно считать следующие:
1. Анемия хронических заболеваний.
2. Анемия за счет гемодилюции (псевдоанемия).
3. Анемия за счет недостатка железа/витаминов.
4. Нарушение функции почек — снижение продукции эритропоэтина.
5. Действие лекарств.
Анемия хронических заболеваний
Анемия, возникающая у пациентов с инфекцией, воспалением, неоплазиями, хронической почечной недостаточностью и продолжающаяся более 1-2 мес, обозначается как анемия хронических заболеваний (АХЗ) — «анемия воспаления», «цитокинопосредованная анемия». Характерной чертой этого типа анемии является сочетание пониженного уровня железа сыворотки с достаточными его запасами в ретикулоэндотелиальной системе (РЭС). АХЗ по распространенности занимает 2-е место среди анемий (после железодефицитной — ЖДА) [9]. В случае наличия ХСН данный вид анемии является самым распространенным и отмечается у 58% пациентов [10].
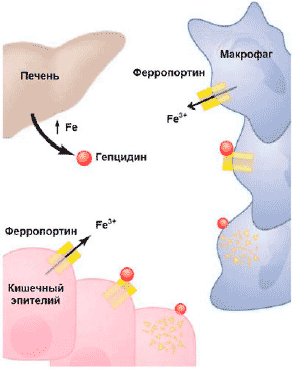
В настоящее время считается, что в основе АХЗ лежит иммуноопосредованный механизм: цитокины и клетки РЭС вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [11]. Открытие гепсидина (hepcidin) — железорегулирующего острофазового белка — позволило во многом прояснить связь между иммунным механизмом нарушения гомеостаза железа и развитием АХЗ: именно через усиление синтеза в печени гепсидина под влиянием воспалительных стимулов, (главным образом интерлейкина-6), происходят снижение абсорбции железа в кишечнике и блокирование высвобождения железа из макрофагов (рис. 2). Дизрегуляция гомеостаза железа ведет к последующей недостаточности доступного для эритроидных предшественников железа, ослаблению пролиферации этих клеток вследствие негативного влияния на них нарушения биосинтеза гема.
Рис 2. Механизм действия гепцидина: угнетение всасывание железа в кишечнике, замедление мобилизации железа из депо, способствуя его накоплению в макрофагах
Анемия вследствие гемодилюции (псевдоанемия)
Данная причина анемии связана с избыточным «разбавлением» крови и характерна для пациентов с повышенным объемом плазмы (ХСН, ХПН, беременность). Предполагается, что у многих больных ХСН анемия может быть вызвана гемодилюцией [12]. Однако, несмотря на увеличение общего объема плазмы у всех пациентов с систолической и у 71% с диастолической ХСН, истинный дефицит эритроцитов имеется у 88% больных анемией при диастолической ХСН и у 59% при систолической ХСН [13].
Анемия вследствие недостатка железа/витаминов
Еще 50 лет назад было показано непосредственное влияние железодефицита на ферментативные процессы, даже в отсутствии анемии [14]. Экспериментальные исследования на животных показали возможность непосредственного влияния железодефицита на диастолическую функцию, провоцирование сердечной недостаточности, фиброза миокарда, уменьшение уровня циркулирующего эритропоэтина, влияние на молекулярные сигнальные пути и активацию воспаления [15].
Железодефицитная анемия является самой распространенной формой в популяции, однако у пациентов кардиологического профиля уступает первенство АХЗ и составляет до 21% [16].
Распространенность железодефицитного состояния при ХСН во многом зависит от критериев определения. Если учитывать лишь снижение насыщения трансферина менее 16%, то его можно обнаружить у 78% анемичных и 61% неанемиченых больных ХСН, если к критериям добавить уровень ферритина 30-100 мг/л, то распространенность снизится до 20 и 15% соответственно [17]. В другом исследовании, где критериями железодефицита были значения ферритина менее 100 мг/л при насыщении трансферина менее 16%, нарушения выявлены у 61% анемичных и 43% неанемичных пациентов ХСН [18].
Таким образом, можно говорить о высоком распространении у больных ХСН как абсолютного (определяемого как уровень ферритина 100 мг/л и процента сатурации трансферина 200 мкг/л.
Разграничение АХЗ и ЖДА имеет важное практическое значение: некорректная трактовка пациента с АХЗ как имеющего дефицит железа влечет за собой неэффективную терапию железом с риском развития осложнений (перегрузки железом, особенно при внутривенном введении). Показатели дифференциальной диагностики при АХЗ, ЖДА и их сочетаниях представлены в таблице.
Показатели дифференциальной диагностики при АХЗ и ЖДА
| Показатели | ЖДА | АХЗ |
| Сывороточное железо | Снижено | Снижено |
| ОЖСС | Повышена | Снижена или N |
| Средний корпускулярный объём | Снижен | Снижен (30%) |
| Насыщение трансферрина | Снижено | N или снижено |
| Сывороточный ферритин | Снижен | N |
| Железо костного мозга | Снижено или отсутствует | N |
| Тест с пероральным железом | Подъем hb | Нет подъема Hb |
Анемия при почечной недостаточности
У больных с хроническими заболеваниями почек наиболее важный вклад в развитие анемии вносят снижение продукции эритропоэтина вследствие уменьшения массы функциональных тканей почек и антипролиферативное действие уремических токсинов. Кроме того, развитие анемии может быть вызвано сокращением продолжительности жизни эритроцитов со 120 дней до 70-80 дней, а также потерей крови, ингибированием эритропоэза в результате хронического воспаления, недостатком свободного железа в организме и дефицитом нутриентов, побочным действием лекарств. По современным представлениям, в случае ХПН можно говорить о едином патогенетическом механизме с АХЗ [20].
У большинства пациентов с ХСН и анемией имеется хроническая болезнь почек (ХБП) различной степени, то есть снижение скорости клубочковой фильтрации (СКФ) 2 . Такое сочетание анемии, ХБП и ХСН D.S.Silverberg и соавт. предложили называть кардиоренальным анемическим синдромом, каждое из трех составляющих которого ухудшает течение остальных двух (рис. 3) [21].
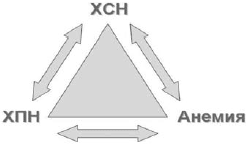
Рис 3. Взаимосвязь при кардиоренальном анемическом синдроме (модифицированна по [21])
Действие лекарств
Применительно к кардиологической практике можно выделить три основных лекарственных воздействия, которые могут провоцировать возникновение и поддержание анемии:
1. Непосредственное подавление костного мозга (вплоть до апластической анемии) могут вызывать следующие лекарственные препараты: НПВС, цитостатики, мерказолил, метамизол (анальгин).
2. Невозможность восстановления присутствующего в пище трехвалентного железа до двухвалентного (всасывающегося во много раз быстрее, нежели трехвалентное) в связи с относительной гипоацидностью (обусловленной сопутствующим применением антисекреторных или антацидных препаратов).
3. Ингибиторы ангиотензинпревращающего фермента и антагонисты к рецепторам ангиотензина могут уменьшать продукцию эритропоэтина и чувствительность к нему костного мозга, так как ангиотензин является мощным стимулятором синтеза эритропоэтина и эритропоэза [22].
Кроме того, необходимо помнить, что нитраты способны вызывать метгемоглобинемию и привести к снижению кислородной емкости крови, однако этот эффект наблюдается в основном при использовании очень высоких доз [23].
Анемия — фактор риска ССЗ
Наличие анемии у пациентов само по себе ассоциировано с пожилым возрастом, нарушением функции почек, сахарным диабетом, тяжелой сердечной недостаточностью, снижением переносимости физических нагрузок и низкими показателями качества жизни [24]. В этой связи наибольшую ценность представляют исследования, выполненные на больших выборках, позволяющие при анализе провести коррекцию на другие факторы риска.
Из исследований, проведенных на популяционном уровне, по данному вопросу можно выделить ARIC-study (Atherosclerosis Risk in Communities), в котором проводилось наблюдение более 6 лет за почти 14 000 пациентов без ССЗ [25]. При оценке анемии как фактора риска ССЗ оказалось, что пациенты со сниженным уровнем гемоглобина имели риск развития указанных заболеваний почти в 1,5 раза выше вне зависимости от всех остальных факторов риска ССЗ (рис. 4).
Рис 4. Кривые Каплана-Мейера для ССЗ у мужчин и женщин, стратифицированных по наличию или отсутствию анемии [25]
Анализ других работ по оценке популяционного риска анемии дал противоречивые результаты. Исследователи пришли к выводу о необходимости дополнительных изысканий для определенных рекомендаций в этой области [2].
Анемия и ИБС
Широко известно, что ряд некоронарных заболеваний, в патогенезе которых имеет место гемическая или тканевая гипоксия, может инициировать клинические проявления ИБС, оказывать отягчающее влияние на характер течения основного заболевания. Возможным механизмом представляется усиление симпатической активности и сердечного выброса за счет длительной индуцированной гипоксией вазодилятации, что приводит к гипертрофии левого желудочка и увеличению размеров сердца и, соответственно, к повышению потребления кислорода [26]. Также у пациентов с ИБС по сравнению со здоровыми отмечена сниженная толерантность миокарда к низким уровням гемоглобина [27].
Вопросы сочетания ИБС и анемий представлены в научной литературе немногочисленными источниками. При рассмотрении вопроса влияния анемии на исходы ИБС можно выделить три основных направления исследований:
Наличие анемии перед проведением чрескожного коронарного вмешательства у пациентов с инфарктом миокарда (ИМ) с подъемом сегмента ST достоверно увеличивает риск большого кровотечения как на протяжении 30 сут после ИМ, так и в течение 1 года [28]. Анализ более чем 45 000 случаев чрескожного коронарного вмешательства при ОКС и стабильной ИБС показал, что анемия является независимым фактором риска госпитальной летальности у мужчин и серьезных сердечно-сосудистых осложнений и у мужчин, и у женщин [7]. Повышенный риск неблагоприятных исходов также отмечается у пациентов со сниженным уровнем гемоглобина перед аортокоронарным шунтированием [29].
Сходные результаты показывают исследования, посвященные исходам ОКС в зависимости от наличия анемии, в которых снижение уровня гемоглобина признается значительным фактором риска прогрессирования ИБС, развития ХСН и нарушений ритма, а также смертности [30]. N.C.Meneveau и соавт., помимо признания анемии как независимого фактора риска смерти при ОКС, предлагают включить ее наравне с другими факторами в шкалу риска GRACE (Global Registry of Acute Coronary Events) для более точного прогноза [31].
Исследования, проведенные на популяционном уровне [32] и у больных ИБС [33], подтверждают наличие U-образной зависимости между уровнем гемоглобина и сердечно-сосудистой заболеваемостью и смертностью, т. е. высокий уровень гемоглобина (>13 г/дл) ассоциирован с плохим прогнозом, наряду с низким уровнем.
Анемия и ХСН
Факт увеличения общей и сердечно-сосудистой смертности при наличии анемии у больных с ХСН подтвержден в большом количестве исследований. Так, в ретроспективном исследовании SOLVD показано, что снижение гематокрита на 1% увеличивает общую смертность больных ХСН на 2,7% [34]. Исследование OPTIME продемонстрировало увеличение риска смерти или повторной госпитализации на 12% при уровне гемоглобина менее 12 г/дл [35]. При этом более тяжелый функциональный класс СН по NYHA ассоциировался с более низким уровнем гемоглобина и высоким уровнем креатинина. Имеются данные о наиболее худшем прогнозе относительно сердечно-сосудистой смертности при ЖДА по сравнению другими видами анемии [36].
Анемия при ХСН также является независимым фактором риска более тяжелого течения заболевания: высокого функционального класса, сниженной переносимости физических нагрузок, когнитивных нарушений, низкого качества жизни [37].
Анемия и гипертоническая болезнь
Данные о соотношениях анемии с гипертонической болезнью, несмотря на их широкое распространение, достаточно немногочисленны. Имеются указания на связь анемии с повышением артериального давления в ночные часы и среднего артериального давления (сумма диастолического давления плюс 1/3 пульсового) по данным суточного мониторирования [38], а также на достоверно более широкую распространенность нормоцитарной анемии у пациентов с неконтролируемым уровнем артериального давления — 20%, по сравнению с пациентами поддерживающих нормотонию — 16% (р=0,03) [39].
Лечение
Терапевтические мероприятия, направленные на устранение анемии, должны быть обращены, в первую очередь, на устранение этиологического фактора. В соответствие с этим пациенты должны проходить полноценное обследование для выяснения причины анемии. В рамках данного обзора мы остановимся на АХЗ и ЖДА, составляющих по отдельности или в сочетании подавляющее большинство анемий в кардиологической практике. В данных ситуациях в качестве основной терапии применяются пероральные и внутривенные препараты железа, а также препараты эритропоэтина.
Препараты железа
В случаях выявления устранимой причины ЖДА лечение должно быть направлено на устранение этиологического фактора (эрозивно-язвенные и опухолевые поражения ЖКТ, миома матки, энтериты, алиментарная недостаточность и др.). В этом случае, а также при наличии неустранимой причины непроходимо проводить патогенетическую терапию препаратами железа (ПЖ).
Необходимо отметить ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа. Предвидя установление данного факта, врач Мелампас (Melampus) в Греции за 1500 лет до н. э. для избавления принца Ификласа Тезалия (Iphyclus of Thesaly) от полового бессилия, возникшего у него на почве постгеморрагической анемии, давал ему вино с ржавчиной, соскобленной с лезвия старого ножа [40].
В настоящее время мы имеем широкий выбор препаратов железа (ПЖ) для приема внутрь, которые назначаются в большинстве случаев (при отсутствии специальных показаний). Основные ПЖ в виде солей представлены сульфатом, глюконатом, хлоридом, фумаратом, глицинсульфатом. Среди ПЖ в виде железосодержащих комплексов, обладающих большей степенью абсорбции, имеются железо-полимальтозный комплекс, железо-сорбитоловый комплекс, протеин сукцинилат железа, железо-сахаратный комплекс.
Необходимо учитывать, что всасывание железа может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ — фитинов (рис, соя), фосфатов (рыба, морепродукты), танин (чай, кофе). Препараты железосодержащих комплексов (в частности, гидрокси-полимальтозный комплекс) лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияния на всасываемость железа в виде трехвалентной формы.
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 3-4 нед, при этом минимальная суточная доза свободного железа должна составлять не менее 100 мг (оптимальная 150-200 мг). Поддерживающая терапия показана в тех ситуациях, когда сохраняется или трудно устранима причина дефицита железа (меноррагии, беременность, патология кишечника).
Оценка результатов лечения:
1. Изменение содержания ретикулоцитов. Считается, что ретикулоцитарный криз появляется на 3-7 сут от начала лечения препаратами железа. Содержание ретикулоцитов может при этом возрастать до 10-20 промилле. Максимальная ретикулоцитарная реакция наступает на 7-10 сут от начала лечения.
2. Прирост гемоглобина начинается с 5 сут при правильном лечении. Если в течение этого периода прироста гемоглобина нет, то это говорит о плохом усвоении препаратов железа. Нормальным считается прирост гемоглобина 1% в сутки или на 0,15 г/сут.
3. Восстановление числа эритроцитов и цветного показателя.
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Показания для внутривенного введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, основными являются: состоянием кишечного всасывания и переносимостью пероральных ПЖ.
При переводе на парентеральный прием обязательно надо контролировать уровень сывороточного железа. Без этого показателя вводить внутривенно препараты железа противопоказано (кроме массивной кровопотери). При переводе с перорального на парентеральный прием, пероральное железо должно быть отменено за 2-3 дня.
Несколько другой взгляд относительно пути введения препаратов железа при ХСН представлен в обзоре D.S.Silverberg и соавт. [41]. При сравнении применения пероральных и внутривенных форм ПЖ оказалось, что при отдельном применении, а также в сочетании с эритропоэтином пероральных форм у больных с ХСН не удается достичь того положительного эффекта, получаемого при внутривенном введении, вероятно, за счет блокирования всасывания железа гепсидином. Данное заключение стало возможно после ряда исследований в этой области, которые начались с в некотором смысле революционного подхода в лечении пациентов с ХСН и дефицитом железа, предложенного английскими исследователями, по аналогии с лечением у больных с почечной патологией — внутривенного введения препаратов железа вне зависимости от наличия анемии без эритропоэтина [42]. В данном исследовании, а также в двух других[43, 44] показано достоверное увеличение уровня гемоглобина, фракции выброса левого желудочка, функционального класса ХСН, качества жизни, функции почек, снижение натрийуретических пептидов, С-реактивного белка, а также уменьшение частоты госпитализаций.
В другом исследовании терапии внутривенным железом при ХСН у больных с дефицитом железа вне зависимости от наличия анемии показано улучшение функционального класса ХСН, потребления кислорода и общего состояния даже при отсутствии повышения гемоглобина [45]. Эти данные подтверждают возможность непосредственного влияния железа на митохондриальные процессы окисления. Учитывая существенные различия по клинико-фармакологическим параметрам между препаратами железа необходимо отметить, что в данных исследованиях применялось железо в форме гидроксидсахарозного комплекса (венофер), по применению которого у больных ХСН накоплена в настоящий момент наибольшая доказательная база.
На этом фоне интересным представляется появление в распоряжении врачей нового препарата железа в виде карбоксимальтозатного комплекса (феринъект), обладающего существенно более удобным режимом введения (1 раз в неделю) и лучшим профилем безопасности по отношению к другим препаратам железа. Данная форма железа изучалась в одном из недавних крупных исследований, аналогичном упомянутым выше, у пациентов с ХСН и дефицитом железа вне зависимости от наличия анемии -FAIR-HF, показавшем при 6-месячном наблюдении достоверный переход в более низкий функциональный класс ХСН и улучшение показателей качества жизни при применении внутривенного препарата железа вне зависимости от снижения уровня гемоглобина [46]. Результаты данной работы позволяют частично ответить на вопрос о первичной роли железодефицита по сравнению с наличием анемии в патогенезе ХСН и необходимости его максимально безопасной коррекции.
В настоящий момент отсутствуют полноценные данные о влиянии монотерапии внутривенными препаратами железа на смертность и другие неблагоприятные исходы ХСН при долговременном наблюдении, для окончательного решения этого вопроса необходимы длительные крупные исследования, по результатам которых будут внесены изменения в соответствующие рекомендации.
Эритропоэтины
Применение рекомбинантного эритропоэтина и его в 3 раза более длительно действующего деривата дарбепоэтина в кардиологии наиболее всего изучено у пациентов с ХСН. В нескольких небольших исследованиях применения эритропоэтина в качестве монотерапии или в сочетании с парентеральными препаратами железа было показано снижение смертности и частоты госпитализаций [47]. Наряду с этим показан положительный эффект от данной терапии на различные клинические и функциональные показатели: систолическую и диастолическую функцию правого и левого желудочка, дилатацию камер сердца, гипертрофию левого желудочка, функциональный класс сердечной недостаточности, переносимость физических нагрузок, потребление кислорода, калорийность потребляемой пищи, качество жизни, активность эндотелиальных прогениторных клеток [47]. Данные эффекты не могут полностью объяснены воздействием на эритропоэз и связываются с плеотропными эффектами эритропоэтина, в частности активацией эндотелиальной NO синтетазы и AKT (протеинкиназа В), которая медиирует фосфорилирование, приводя к длительной NO-зависимой вазодилатации [48].
Эритропоэтины, позволяющие увеличить уровень гемоглобина в среднем на 2 г/дл, считаются основными препаратами для коррекции выраженной анемии, в том числе из-за редкости возникновения побочных реакций. Однако данные полученные в онкологических исследованиях свидетельствуют о повышенной частоте сердечно-сосудистых неблагоприятных исходов (в основном за счет тромботических осложнений) при превышении уровня гемоглобина более 12 г/дл [49]. При этом стоит отметить, что дозы эритропоэтинов в данных исследованиях в несколько раз превышали, используемые при ХСН. С другой стороны, у пациентов с ХСН и ХПН не выявлено дополнительного преимущества повышения уровня гемоглобина выше 11-12 г/дл, более того отмечено повышенное количество неблагоприятных исходов при повышении уровня гемоглобина выше 13 г/дл, так называемая U-образная зависимость уровня гемоглобина и смертности [50]. В настоящий момент, в отсутствии официальных рекомендаций по целевому уровню гемоглобина при ХСН, большинство исследователей сходятся на значении 12 г/дл [47].
Заключение
В настоящее время существуют достоверные данные о необходимости активного выявления и коррекции анемии у пациентов кардиологического профиля. Особый интерес вызывает вопрос терапии анемии при длительно протекающей сердечно-сосудистой патологии, в частности ХСН. Накопленная доказательная база у данных больных по лечению анемии эритропоэтинами и/или препаратами внутривенного железа не позволяет однозначно определить целесообразность и безопасность такого подхода. Данные исследований по применению внутривенных препаратов железа в качестве монотерапии у больных ХСН и железодефицитом вне зависимости от наличия анемии могут существенно расширить показания для их применения при данной патологии. Этот и некоторые другие вопросы, как например, наличие универсального маркера ответа при терапии препаратами железа, целевых уровнях гемоглобина при различных заболеваниях и многие другие требуют своего разрешения в научных работах.
До получения результатов крупных исследований лучшим подходом остается считать применение пероральных препаратов железа у пациентов с умеренной ЖДА, а у больных с тяжелой анемией возможна комбинация внутривенного железа и препаратов эритропоэтина, что позволит уменьшить дозы и снизить частоту побочных эффектов. При ХСН даже только с дефицитом железа без анемии можно рассмотреть назначение внутривенных препаратов железа.
источник