Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В соответствии с рекомендациями ВОЗ, стандартизованы следующие критерии диагностики железодефицитных анемий у детей:
- снижение уровня СЖ менее 12 мкмоль/л;
- повышение ОЖСС более 69 мкмоль/л;
- насыщение трансферрина железом менее 17%;
- содержание гемоглобина ниже 110 г/л в возрасте до 6 лет и ниже 120 г/л — в возрасте старше 6 лет.
Таким образом, ВОЗ рекомендует достаточно точные критерии для диагностики железодефицитной анемии, однако методы диагностики требуют забора крови из вены и проведения достаточно дорогих биохимических исследований, что не всегда возможно в украинских лечебных учреждениях. Имеются попытки минимизации критериев диагностики железо-дефицитной анемии.
Федеральная служба по заболеваемости, эпидемиологии и образованию (United States Federal Government Centers for Disease Control — CDC) со штаб-квартирой в Атланте (Джорджия, США) рекомендует использовать для диагностики железо-дефицитной анемии 2 доступных критерия: снижение концентрации гемоглобина и гематокрита (Ht) при отсутствии у больного других заболеваний. Устанавливают предположительный диагноз железодефицитной анемии и назначают лечение препаратами железа на 4 нед из расчёта 3 мг элементарного железа на 1 кг массы тела больного в сутки. Достоинство данных рекомендаций — регистрация ответа на терапию препаратами железа по строго фиксированным критериям. К концу 4-й нед лечения концентрация гемоглобина должна повыситься на 10 г/л по отношению к исходной, a Ht — на 3%. Такой ответ подтверждает диагноз «железодефицитная анемия», и лечение продолжают в течение нескольких месяцев. Если ответ не получен, рекомендуют остановить лечение препаратами железа и пересмотреть данный случай с точки зрения диагностики процесса. Перегрузка железом организма за 4 нед при приёме препаратов железа внутрь маловероятна.

Лабораторную диагностику железодефицитной анемии осуществляют с помощью:
- общего анализа крови, выполненного «ручным» методом;
- анализа крови, выполненного на автоматическом анализаторе крови;
- биохимических исследований.
При диагностике любой анемии обязательно выполнение общего анализа крови с определением количества ретикулоцитов. Врач ориентируется на гипохромный и микроцитарный характер анемии. В общем анализе крови, выполненном «ручным» методом, выявляют:
- снижение концентрации гемоглобина ( 12 /л) количество эритроцитов;
- снижение цветового показателя ( 12-16 мм/ч);
- анизоцитоз (характерны микроциты) и пойкилоцитоз эритроцитов.
Ошибка определения параметров может достигать 5% и более. Стоимость одного общего анализа крови составляет около 5 долларов США.
Точным и удобным методом диагностики и дифференциальной диагностики служит метод определения эритроцитарных показателей на автоматических анализаторах крови. Исследование проводят как в венозной, так и в капиллярной крови. Ошибка в определении параметров значительно ниже, чем при «ручном» методе, и составляет менее 1%. При развитии дефицита железараньше всего повышается показатель выраженности анизоцитоза эритроцитов — RDW (норма
Портал iLive не предоставляет медицинские консультации, диагностику или лечение.
Информация, опубликованная на портале, предназначена только для ознакомления и не должна использоваться без консультации со специалистом.
Внимательно ознакомьтесь с правилами и политикой сайта. Вы также можете связаться с нами!
Copyright © 2011 — 2019 iLive. Все права защищены.
источник
Диагностика и первичная дифференцировка анемии должна проводиться по полному гематологическому анализу, включающему в себя определение параметров эритроцитов (код теста dh 0101).
Различают три вида АНЕМИИ по эритроцитарным индексам:
- Микроцитарные гипохромные (MCV • Наиболее частые причины: ЖДА (железодефицитная анемия), нарушение синтеза и утилизации порфиринов, гетерозиготная талассемия и др.
- Нормоцитарные нормохромные (MCV,MCH и MCHC в пределах нормы; RDW обычно в норме).
• Наиболее частые причины: Анемии при заболеваниях почек, гипопластические анемии, острая постгеморрагиечская анемия, АХЗ (анемии хронических заболеваний); - Макроцитарные нормо- и гиперхромные (MCV > 100 фл; MCH > 32 пг; МСНС в пределах нормы; RDW увеличен).
• Наиболее частые причины: В12-дефицитная анемия, фолиеводефицитная анемия, анемия при хронических заболеваниях печени, АИГА (аутоиммунные гемолитические анемии).
Далеко не каждая анемия по своей причине является железодефицитной, даже если она микроцитарная и гипохромная. Прежде чем делать вывод о железодефиците и назначать лечение, необходимо исследовать полный обмен железа в организме:
— Ферритин (код теста dx 0317)
— Сывороточное железо (код теста dx 0314)
— Железосвязывающая способность (ОЖСС) и % насыщения железом (код теста dx 0315)
— Трансферрин (код теста dx 0316)
— Растворимые рецепторы трансферрина (sTfR)
В случае гиперхромной, макроцитарной анемии в первую очередь необходимо исследовать концентрацию в сыворотке крови:
— витамина В12 (код теста dx 0315)
— фолиевой кислоты (код теста dx 0315)
— гомоцистеина (код теста dm 0540)
МАКРОЦИТАРНЫЕ АНЕМИИ:
Мегалобластные анемии:
• Витамин В12-дефицитная анемия
• Анемия при дефиците фолиевой кислоты
• Нарушение синтеза ДНК:
— врожденная
— в результате химиотерапии
Немегалобластные анемии:
• Алкоголизм
• Болезни печени
Помимо вышеперечисленных тестов для диагностики вида анемии, выбора правильной тактики лечения и оценки эффективности терапии должны применяться дополнительные тесты:
— ретикулоциты (код теста dh 0102)
— С-реактивный белок (код теста dх 0330)
— Эритропоэтин (код теста dm 0547)
— Гаптоглобин (код теста dх 0340)
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА В ОРГАНИЗМЕ:
- Сывороточное железо (код теста dx 0314). При оценке уровня железа в организме необходимо принять во внимание, что данный параметр является алиментарно-зависимым (зависит от диеты и приёма различных добавок), существует суточный ритм содержания железа в крови (у каждого индивидуально!).
• Причины снижения сывороточного железа: нарушение абсорбции в кишечнике; увеличение потребности (например, при беременности или в период бурного роста); потери железа (кровотечения, диализ, лактация); ускоренная утилизация при инфекционных процессах.
• Причины повышения сывороточного железа: заболевания печени; повышение абсорбции (гемохроматоз); снижение эритропоэза и другие нарушения потребления; гемолиз. - Ферритин (код теста dx 0317) – белок, депонирующий железо. Ферритин в сыворотке отражает общую концентрацию железа. При оценке уровня ферритина в организме необходимо принять во внимание, что ферритин отражает объёмы хранящегося железа, но при состояниях с избытком железа не позволяет правильно оценить запасы доступного для обмена железа. Также необходимо помнить, что ферритин является одним из белков острой фазы и онкомаркёром.
• Причины снижения уровня ферритина: дефицит железа (железо-дефицитная анемия); целиакия.
• Причины повышения уровня ферритина: избыток железа при гемохроматозе; патология печени; острые и хронические инфекционно-воспалительные заюолевания; лимфопролиферативные и другие злокачественные заболевания; голодание; приём оральных контрацептивов. - Железосвязывающая способность (ОЖСС) и % насыщения железом (код теста dx 0315).
Данный параметр тесно связан с концентрацией трансферрина в крови.
• Причины повышения ОЖСС: железо-дефицитная анемия; приём оральных контрацептивов; патология печени (острый гепатит, цирроз); избыточное поступление в организм; частое переливание крови; гемохроматоз; детский возраст; поздние сроки беременности.
• Причины снижения ОЖСС: снижение содержания общего белка в плазме крови (например, патология почек, голодание, онкология и др.); хронические инфекции; гемосидероз.
• Причины повышения ОЖСС: гемолиз эритроцитов; талассемия; отравление железом; дефицит пиридоксина (витамин В6); нефротический синдром; гепатит (иногда). - Трансферрин (код теста dx 0316) – это транспортный белок, основной переносчик железа к клеткам.
При оценке уровня трансферрина в крови необходимо помнить, что концентрация этого белка зависит от состояния синтеза белков в печени, на его синтез влияет уровень эстрогенов, трансферрин теряется с мочой при нефротическом синдроме.
• Причины снижения уровня трансферрина: инфекции; голодание; хронические заболевания печени; избыточная потеря белка; злокачественные новообразования.
• Причины повышения уровня трансферрина: железодефицит; беременность; приём эстрогенов; вирусные гепатиты. - Растворимые рецепторы трансферрина (sTfR).
Рецепторы трансферрина — это белки, расположенные на поверхности клеток, которые обеспечивают перенос ионов железа внутрь клетки с её поверхности. Часть из них растворима и находится в крови. Количество sTfR пропорционально количеству трансферрина. При снижении концентрации сывороточного железа концентрация sTfR возрастает (как и концентрация трансферина). Однако, концентрация sTfR не зависит от стадии воспаления, состояния печеночной ткани, гормонального фона и пола пациента.
• Увеличение концентрации sTfR является свидетельством дефицита железа и усиления эритропоэза!
Помимо выявления железодефицита очень важно диагностировать его форму (классический железодефицит, латентный железодефицит, нормальный эритропоэз с торможением пролиферации или функциональный железодефицит). Это важно для правильного выбора лечения (препараты железа или эритропоэтин).
Для диагностики железодефицита необходим весь комплекс лабораторной диагностики обмена железа (определение ферритина обязательно!). Для правильной диагностики различных форм железодефицита определение ферритина и sTfR обязательно!
источник
Комплексное исследование количественного и качественного состава форменных элементов и биохимических показателей крови, которое позволяет оценить насыщенность организма железом и обнаружить недостаточность данного микроэлемента даже до появления первых клинических признаков железодефицита.
Результаты исследований выдаются с бесплатным комментарием врача.
Колориметрический фотометрический метод, SLS (натрий лаурил сульфат) – метод, кондуктометрический метод, проточная цитофлуориметрия, иммунотурбидиметрия.
Мкмоль/л (микромоль на литр), *10^9/л, *10^12/л, г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за 24 часа до исследования.
- Прекратить принимать пищу за 8 часов до исследования, можно пить чистую негазированную воду.
- Не употреблять лекарственные препараты в течение 24 часов перед анализом (по согласованию с врачом).
- Исключить прием лекарственных препаратов, содержащих железо, в течение 72 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Нехватка железа встречается довольно часто. Около 80-90 % всех форм анемий связано с дефицитом данного микроэлемента.
Железо содержится во всех клетках организма и выполняет несколько важных функций. Основная его часть входит в состав гемоглобина и обеспечивает транспорт кислорода и углекислого газа. Некоторое количество железа является кофактором внутриклеточных ферментов и участвует во многих биохимических реакциях.
Железо из организма здорового человека постоянно выводится с потом, мочой, слущивающимися клетками, а также менструальными выделениями у женщин. Для поддержания количества микроэлемента на физиологическом уровне необходимо ежедневное поступление в организм 1-2 мг железа.
Всасывание данного микроэлемента происходит в двенадцатиперстной кишке и верхних отделах тонкой кишки. Свободные ионы железа токсичны для клеток, поэтому в организме человека они транспортируются и депонируются в комплексе с белками. В крови железо переносится белком трансферрином к местам использования или накопления. Апоферритин присоединяет железо и образовывает ферритин, который является основной формой депонированного железа в организме. Его количество в крови взаимосвязано с запасами железа в тканях.
Общая железосвязывающая способность сыворотки (ОЖСС) является непрямым показателем уровня трансферрина в крови. Она позволяет оценить максимальное количество железа, которое может присоединить транспортный белок, и степень насыщения трансферрина микроэлементом. При уменьшении количества железа крови насыщение трансферрина снижается и, соответственно, ОЖСС возрастает.
Дефицит железа развивается постепенно. Вначале возникает отрицательный баланс железа, при котором потребности организма в железе и потери данного микроэлемента превышают объемы его поступления с пищей. Это может быть связано с потерей крови, беременностью, скачками роста в период полового созревания или недостаточным употреблением продуктов, содержащих железо. В первую очередь железо мобилизируется из запасов ретикулоэндотелиальной системы для компенсации потребностей организма. Лабораторные исследования в этот период выявляют уменьшение количества ферритина сыворотки крови без изменения других показателей. Вначале клинические симптомы отсутствуют, уровень железа в крови, ОЖСС и показатели клинического анализа крови находятся в пределах референсных значений. Постепенное истощение депо железа в тканях сопровождается повышением ОЖСС.
На этапе железодефицитного эритропоэза синтез гемоглобина становится недостаточным и развивается железодефицитная анемия с клиническими проявлениями малокровия. В клиническом анализе крови обнаруживаются небольшие бледноокрашенные эритроциты, снижаются показатели МНС (среднее количество гемоглобина в эритроците), MCV (средний объем эритроцита), МСНС (средняя концентрация гемоглобина в эритроците), падает уровень гемоглобина и гематокрит. При отсутствии лечения количество гемоглобина в крови прогрессивно снижается, изменяется форма красных кровяных телец, сокращается интенсивность деления клеток в костном мозге. Чем глубже дефицит железа, тем ярче становится клиническая симптоматика. Утомляемость переходит в выраженную слабость и вялость, утрачивается трудоспособность, бледность кожных покровов становится более выраженной, изменяется структура ногтей, появляются трещины в углах губ, возникает атрофия слизистых, кожа становится сухой, шелушащейся. При дефиците железа у больного меняется способность чувствовать вкус и запах – возникает желание есть мел, глину, сырые крупы и вдыхать запахи ацетона, бензина, скипидара.
При своевременной и правильной диагностике железодефицита и причин, вызвавших его, лечение препаратами железа позволяет восполнить запасы этого элемента в организме.
Для чего используется исследование?
- Для ранней диагностики железодефицита.
- Для дифференциальной диагностики анемий.
- Для контроля за лечением препаратами железа.
- Для обследования лиц, у которых существует высокая вероятность железодефицита.
Когда назначается исследование?
- При обследовании детей в период интенсивного роста.
- При обследовании беременных.
- При симптомах недостаточности железа в организме (бледность кожных покровов, общая слабость, утомляемость, атрофия слизистой языка, изменение структуры ногтей, аномальные вкусовые предпочтения).
- При выявлении гипохромной микроцитарной анемии по данным клинического анализа крови.
- При обследовании девушек и женщин с обильными менструальными выделениями и маточными кровотечениями.
- При обследовании ревматологических и онкологических больных.
- При контроле за эффективностью применения препаратов, содержащих железо.
- При обследовании пациентов с астенией неясного генеза и выраженной утомляемостью.
источник
Причины анемических состояний
Анемией называется клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в крови. Самые разнообразные патологические процессы могут служить основой развития анемических состояний, в связи с чем анемии следует рассматривать как один из симптомов основного заболевания. Распространенность анемий значительно варьирует в диапазоне от 0,7 до 6,9%.
Причиной анемии может быть один из трех факторов или их сочетание: кровопотеря, недостаточное образование эритроцитов или усиленное их разрушение (гемолиз).
Среди различных анемических состояний железодефицитные анемии являются самыми распространенными и составляют около 80% всех анемий.
По данным Всемирной организации здравоохранения (ВОЗ), каждая 3-я женщина и каждый 6-й мужчина в мире (200 миллионов человек) страдают железодефицитной анемией.
Этиология и патогенез железодефицитной анемии
Основной этиопатогенетический фактор развития ЖДА — дефицит железа.
Наиболее частыми причинами возникновения железодефицитных состояний являются:
- потери железа при хронических кровотечениях (наиболее частая причина, достигающая 80%):
кровотечения из желудочно-кишечного тракта (язвенная болезнь, эрозивный гастрит, варикозное расширение эзофагеальных вен, дивертикулы толстой кишки, инвазии анкилостомы, опухоли, НЯК, геморрой);
длительные и обильные менструации, эндометриоз, фибромиома;
макро- и микрогематурия (хронический гломеруло- и пиелонефрит, мочекаменная болезнь, поликистоз почек, опухоли почек и мочевого пузыря);
носовые, легочные кровотечения;
потери крови при гемодиализе;
- недостаточное усваивание железа( резекция тонкого кишечника, хронический энтерит, синдром мальабсорбции, амилоидоз кишечника);
- повышенная потребность в железе( интенсивный рост, беременность, период кормления грудью, занятия спортом);
- недостаточное поступление железа с пищей (новорожденные, маленькие дети, вегетарианство).
Рекомендуемая ежедневная норма поступления железа с пищей :
для мужчин — 12 мг, для женщин — 15 мг, для беременных — 30 мг.
Патогенетически развитие железодефицитного состояния можно условно разделить на несколько стадий
- Прелатентный дефицит железа (недостаточность накопления) — отмечается снижение уровня ферритина и снижение содержания железа в костном мозге, повышена абсорбция железа;
- Латентный дефицит железа (железодефицитный эритропоэз) — дополнительно снижается сывороточное железо, повышается концентрация трансферрина, снижается содержание сидеробластов в костном мозге;
- Выраженный дефицит железа (железодефицитная анемия) — дополнительно снижается концентрация гемоглобина, эритроцитов и гематокрит.
Диагностика железодефицитной анемии основана на характерной клинической картине и изменении лабораторных показателей.
Лабораторный
Микроциты — 15,2%
Макроциты — 16,8%
Женщины — 12-25 мкмоль/л
Основные ориентиры в лабораторной диагностике железодефицитной анемии следующие:
- Среднее содержание гемоглобина в эритроците в пикограммах снижено (в норме оно составляет 27-35 пг). Для его вычисления цветовой показатель умножают на 33,3. Например, при цветовом показателе 0,7 х 33,3 содержание гемоглобина равно 23,3 пг.
- Средняя концентрация гемоглобина в эритроците снижена (в норме она составляет 31-36 г/дл).
- Гипохромия эритроцитов определяется при микроскопии мазка периферической крови и характеризуется увеличением зоны центрального просветления в эритроците (в норме соотношение центрального просветления к периферическому затемнению равно 1:1; при железодефицитной анемии – 2:1,3:1).
- Микроцитоз эритроцитов (уменьшение их размеров).
- Разная по интенсивности окраска эритроцитов (анизохромия), наличие как гипо-, так и нормохромиых эритроцитов.
- Разная форма эритроцитов (пойкилоцитоз).
- Количество ретикулоцитов при отсутствии кровопотери и периода ферротерапии при железодефицитной анемии остается в норме.
- Содержание лейкоцитов также в пределах нормы (за исключением случаев кровопотери или онкопатологии).
- Содержание тромбоцитов чаще остается в пределах нормы. Умеренный тромбоцитоз возможен при кровопотере в момент обследования, а содержание тромбоцитов уменьшается, когда в основе железодефицитной анемии лежит кровопотеря вследствие тромбоцитопении (например, при ДВС-синдроме, болезни Верльгофа).
- Уменьшение количества сидероцитов вплоть до их исчезновения (сидероцит — это эритроцит, содержащий гранулы железа). С целью стандартизации изготовления мазков периферической крови рекомендуется использовать специальные автоматические устройства. Образующийся при этом монослой клеток повышает качество их идентификации.
Биохимический анализ крови
- Снижение содержания железа в сыворотке крови. В норме у мужчин 13-30 мкмоль/л, у женщин 12-25 мкмоль/л.
- ОЖСС повышена (отражает количество железа, которое может быть связано за счет свободного трансферрина) В норме — 30-86 мкмоль/л.
- Исследование трансферриновых рецепторов иммуноферментным методом. Их уровень повышен у больных железодефицитной анемией. У больных анемией хронических заболеваний — в норме или снижен, несмотря на аналогичные показатели обмена железа.
- Латентная железосвязывающая способность сыворотки крови повышена (определяется путем вычитания из показателей ОЖСС показателя содержания сывороточного железа).
- Процент насыщения трансферрина железом снижен (отношение показателя железа сыворотки крови к ОЖСС). В норме 16-50%.
- Уровень сывороточного ферритина тоже снижен. В норме 15-150 мкг/л.
Вместе с тем у больных железодефицитной анемией увеличено количество трансферриновых рецепторов и повышен уровень эритропоэтина в сыворотке крови (компенсаторные реакции кроветворения).
Объем секреции эритропоэтина обратно пропорционален величине кислородтранспортной емкости крови и прямо пропорционален кислородному запросу крови.
Следует учитывать, что уровень сывороточного железа выше в утренние часы. Перед началом и во время менструации он выше, чем после менструации. Содержание железа в сыворотке крови в первые недели беременности выше, чем в последнем ее триместре. Уровень сывороточного железа повышается на 2-4-й день после лечения железосодержащими препаратами, а затем снижается. Значительное потребление мясных продуктов накануне исследования сопровождается гиперсидеремией. Эти данные необходимо учитывать при оценке результатов исследования сывороточного железа.
Не менее важно соблюдать технику лабораторного исследования, правила забора крови. Так, пробирки, в которые собирают кровь, предварительно должны быть промыты соляной кислотой и бидистиллированной водой.
Исследование миелограммы выявляет умеренную нормобластическую реакцию и резкое снижение содержания сидеробластов (эритрокариоцитов, содержащих гранулы железа).
О запасах железа в организме судят по результатам десфералевой пробы. У здорового человека после внутривенного введения 500 мг десферала с мочой выводится от 0,8 до 1,2 мг железа, в то время как у больного с железодефицитной анемией выведение железа снижается до 0,2 мг.
Препарат дефериколиксам идентичен десфералу, но дольше циркулирует в крови и поэтому точнее отражает уровень запасов железа в организме.
Врач лабораторной диагностики ЦДЛ
Новополоцкой городской больницы
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
источник
Периферическая кровь при железодефицитной анемии. Свойственные крови морфологические изменения заключаются в микроцитозе и гипохромии. Однако эти признаки отражают длительную недостаточность железа, сочетающуюся с тяжелой анемией. Исходно, когда в процессе гемоглобиногенеза отмечается отрицательное влияние недостаточного подвоза железа в костный мозг, кроветворение начинает приспосабливаться к новым условиям. По началу сокращается объем эритроцитов.
Микроцитоз и нормохромия обычное явление у женщин при показателе гемоглобина от 9 до 10 г на 100 мл. Гипохромия развивается, когда показатель уровня гемоглобина падает до меньших значений, причем вначале она умеренная, а затем становится все более выраженной. При тяжелой форме анемии эритроциты имеют кольчатый аспект (аннулоциты) или обретают вид клеток-мишень. Пойкилоцитоз наблюдается лишь при тяжелых формах анемии (Дачие и сотр.).
Показатели эритроцитов свидетельствуют о небольшом объеме (менее 80 мкг3), о количестве гемоглобина менее 27 пг и о средней концентрации гемоглобина на каждый эритроцит (менее 30 г/100/мл.). В принципе число ретикулоцитов в норме или немного больше; лишь е редких случаях их число занижено. Число эритроцитов обычно нормальное или немного меньшее нормы. Вот почему определение не дает точную справку о тяжести анемии. В отдельных случаях, особенно у детей, число эритроцитов превышает 5 млн/мм3. Следует отметить, что, при железодефицитной анемии увеличивается устойчивость эритроцитов к гипотонии.
Наиболее часто число лейкоцитов укладывается в норму. При длительной недостаточности железа развивается умеренная гранулоцитопения. В некоторых случаях выявляются гиперсегментированные нейтрофилы. Их появление при недостатке железа можно объяснить развитием вторичной недостаточности фолиевокислых солей или витамина В12 (Брукнер и сотр.).
В большинстве случаев показатель численности тромбоцитов высокий, однако еше не разработано четкое объяснение этому явлению. Высказана мысль о возможности появления тромбоцитоза в результате активной кровоточивости. В случаях тяжелой или длительной анемии отмечена умеренная тромбоцитопения, обратимая после проведения железотерапии.
У страдающих железодефицитной анемией количество клеточной массы в костном мозге выше нормы. Рост показателя костномозговых клеток объясняется увеличением числа эритробластов. Последние, в частности полихроматофильные и оксифильные меньших размеров, чем нормальные эритробласты в связи с сокращением количества цитоплазмы. Исследование мазка в условиях железодефицитной анемии выявляет не только малые размеры эритробластов, но также их нерегулярный, «изорванный» контур. В таких клетках были описаны аспекты дисэритропоэза и кариорексиса, почкования ядер, в некоторых случаях многоядерность и ядерные фрагменты.
Непосредственное исследование, без окраски, размозженных на стекле зерен костного мозга не выявляет наличие аггрегатов мелких, нерегулярных, золотистых, характерных гемосидерину частиц. Окраска по Перлсу выявляет отсутствие запасного железа в макрофагах и наличие менее 10% сидеробластов (Дачие и сотр.). В целях определения заболевания железодефицитной анемией этот тест представляет наибольшее диагностическое значение.
Сывороточное железо при железодефицитной анемии. Концентрация железа в сыворотке всегда меньше 50 мкг/100 мл., причем в отдельных случаях она не больше 10 мкг/100 мл. Общая связывающая способность железа (ОССЖ), отражающая количество находящегося в кровотоке трансферина, чаще завышена и лишь в редких случаях укладывается в норму или занижена. У больных с заниженной ОССЖ возможно вмешательство и других факторов, например гипопротеинемии (McGibbon и Mollin5). Насыщение трансферином (железо сыворотки/ОССЖ х 100) в любом случае меньше 16%, однако встречаются и случаи 1%-ой насыщенности.
Следует обратить особое внимание на интерпретацию насыщения трансферином у женщин на последнем квартале беременности. У последних насыщение трансферином менее 16% не всегда указывает на наличие недостатка железа. Объяснение такому явлению следует искать в повышении количества трансферина, что характерно беременным независимо от возможного дефицита железа.
Показатель свободного протопорфирина эритроцитов (СПЭ) в принципе характеризуется высокими значениями — более 70 мкг/100 мл. а в отдельных случаях даже больше 300 мкг/мл. При этом следует обратить внимание на тот факт, что на повышение уровня СПЭ влияет больше продолжительность железо дефицита, чем его интенсивность (Dameshek).
Показатель феритина в сыворотке — растворимой формы находящегося в запасе железа—составляет менее 12 мкг/л. у женщин и детей раннего возраста и менее 35 мкг/л. у мужчин. Существует четкая взаимосвясь сывороточного феритина и количеством железа выявляемого в костном мозге и печени путем окраски по Перлсу.
Кинетика железа. В процессе выявления недостатка железа кинетика последнего не применяется как текущий метод. При использовании этого метода обнаруживается весьма быстрый клиренс железа плазмы, перенос железа в костный мозг и его расход нормальными или увеличенными эритроцитами, при этом интенсивность и скорость метаболизма железа эритроцитов больше нормы. Эти данные свидетельствуют о наличии неэффективного кроветворения в условиях недостатка железа:
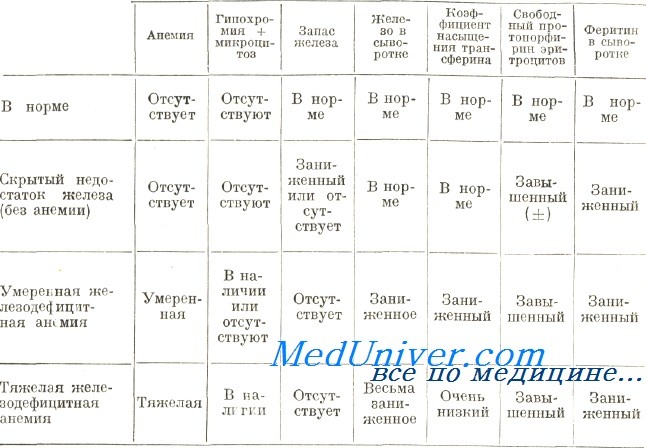
Диагностирование тяжелой железодефицитной анемии по клиническим и лабораторным данным дело несложное, при этом сделанное определение подтверждается терапевтическим испытанием. Осложнения появляются при мало выраженной форме анемии и нечетких клинических и лабораторных признаках. Ниже в таблице приведены морфологические, биохимические и цитохимические данные, на основе которых дифференцируются этапы недостатка железа.
Элементы лабораторного диагноза стадий железной недостаточности
Железодефицитную анемию следует отличать от остальных видов гипохромной анемии. Среди последних, на втором месте по частоте после железодефицитной анемии, находится бета-талассемия (по данным приема для страдающих болезнями крови при Центре гематологии). Учитывая тяжесть заболевания, ранный возраст страдающего и характерную клиническую картину тяжелая бета-талассемия (анемия Кули) распознается без затруднений.
В противоположность этому легкая форма бета-талассемии в отдельных случаях не различима от железодефицитной анемии по клиническим признакам и результатам морфологического исследования крови. Возможные кровоточивость в анамнезе, наблюдаемые в слизистых оболочках и роговых образованиях изменения, равно как и бледность сыворотки подсказывают диагноз железодефицитной анемии. Гипохромия и микроцитоз общее, для обеих групп явление, однако при талассемии они выделяются более ярко.
Отмечаем, что, при талассемии, более характерной чертой микроцитоза это не сокращенный диаметр эритроцитов, а их значительно уменьшенная толщина (микроплатициты). Вот почему выраженная гипохромия с показателем гемоглобина примерно 10 г/100 мл или более подсказывает диагноз талассемии. Также, при железодефицитной анемии с более 8 г/100 мл гемоглобина пойкилоцитоз единичное явление, в то время как при талассемии наблюдается часто. В условиях талассемии выраженный микроцитоз отражается ростом численности эритроцитов, по сравнению с железодефицитной анемией.
Что касается остальных лабораторных данных следует не забывать, что при талассемии чаще наблюдаются такие признаки, как повышенное число ретикулоцитов, полихроматофильных эритроцитов и наличие точечно-базофильных красных кровяных клеток, к тому же осмотическая устойчивость последних больше.
В связи со сказанным для различения этих двух заболеваний наибольшую ценность представляют тесты метаболизма железа. В принципе, при талассемии показатель железа в крови характеризуется нормальными или завышенными значениями. Редко, у больных с хронической кровоточивостью развивается гипосидеремия. В таких случаях ОССТЖ, показатель которой при талассемии отличается низкими значениями (обычно менее 250 мкг/100 мл), увеличивается до нормы и даже более.
За исключением случаев, осложненных недостатком железа, костномозговые запасы железа при талассемии укладываются в норму или несколько больше. В отдельных случаях количество железа в митохондриях нормобластов очень велико, что создает аспект кольчатых сидеробластов.
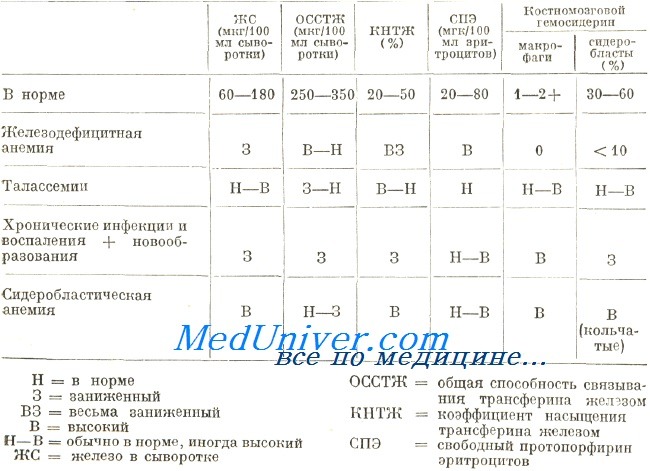
Анемия с многонедельным течением, развивающаяся при инфекциях и хронических воспалениях, в принципе носит нормоцитный и нормохромный характер, причем эта характеристика действительна и в отношение анемий, наблюдаемых при свежих новообразованиях. Но после длительного течения в условиях этих заболеваний анемия становится микроцитной и гииохромной. В подобном случае различение этой анемии от железодефицитной возможна путем выявления первичного заболевания, в частности посредством лабораторных исследований. Морфологическое исследование крови не представляет данные, способствующие дифференциальному диагнозу.
Элементы дифференциальной диагностики при гипохромной анемии
Концентрация железа в сыворотке невелика в обеих группах заболеваний, в то время как показатель ОССТЖ в принципе высокий при железодефицитной анемии и низкий при хронических воспалениях и новообразованиях. По этой причине коэффициент насыщенности трансферина меньше у страдающих железодефицитной анемией. Обследование дополняется определением гемосидерина на костномозговом мазке. В костном мозге страдающих хроническим воспалением и новообразованием содержатся макрофаги, загруженные гемосидерином, который всегда отсутствует в условиях железодефицитной анемии. При обоих заболеваниях сидеробласты обнаруживаются в малом количестве или совсем отсутствуют.
В процессе, диагностирования возникают затруднения и в случае сидеробластической анемии. Тем не менее, в условиях сидеробластической анемии, эритроциты отличаются частным видом. На мазге различаются две популяции эритроцитов, из них одна микроцитная и гипохромная) другая — макроцитная и нормохромная («частичная гипохромия»). Дифференциальная диагностика основывается на определении метаболизма железа, который, при сидеробластической анемии, отражает нормальную или завышенную сидеремию, нормальную или низкую ОССТЖ и высокий показатель гемосидерина в костном мозге с наличием кольчатых сидеробластов.
Из гемолитических анемий наличие гипохромии отмечается при гемоглобинопатиях К, КС, Е, Кёлн. В отдельных случаях наблюдаются клетки мишень. Высокие показатели сидеремии и гемосидерина в костном мозге исключают возможность наличия железодефицитной анемии. Гемолитическая анемия с хроническим внутрисосудистым гемолизом, в частности ночной пароксизмальной гемоглобинурией сочетается с характерной для железодефицитной анемии картиной. Дифференциация возможна по признакам гемолиза и данным лабораторных анализов специфических ночной пароксизмальной гемоглобинурии.
После проведения курса лечения витамином В12 или фолиевой кислотой сидеремия и запасы железа быстро сокращаются под влиянием ускоренного эритропоэза. Это сокращение четко выражено у женщины с небольшим запасом железа. Дифференциальная диагностика представляет трудности, поскольку признаки мегалобластоза в костном мозге исчезают после проведения специфической терапии. В таком случае наиболее важным представляется исследование мазка крови, выявляющее наличие макроцитоза с нормохромией и гиперсегментирование нейтрофилов.
Нередко исследование мазка крови страдающего недостатком железа указывает на наличие нормохромии. Вот почему представляется важной постановка дифференциального диагноза по сравнению с группой нормохромных анемий. Отсутствие костномозгового гемосидерина характеризует железодефицитную анемию, даже при ее умеренной форме.
Необходимо отметить, что в условиях истинной полицитемии, эритроциты нередко гипохромные уже при первом обследовании врача, до вскрытия вен. К тому же обнаруживается невысокая сидеремия и отсутствие костномозгового запаса железа. Тем не менее истинная полицитемия отличается характерной клинической и лабораторной симптоматологией.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Железодефицитная анемия (ЖДА) составляет 70–90% всех случаев анемий [1]. Наиболее предрасположены к развитию ЖДА женщины репродуктивного возраста, беременные, дети раннего возраста (особенно до 1 года), а также пациенты старше 65 лет, нередко страдающие хроническими заболеваниями ЖКТ, почек, алиментарной недостаточностью. ЖДА наблюдается не менее чем у 10–15% взрослого населения России, достигая в отдельных регионах 25–30% среди женщин детородного возраста [2].
Важно помнить, что латентный (скрытый) дефицит железа, при котором ЖДА до определенного времени отсутствует, но транспортные и органные запасы железа уже истощены, наблюдается еще чаще – не менее чем у трети населения, обусловливая многочисленные проявления так называемого сидеропенического синдрома.
В целом, по данным ВОЗ, во всем мире насчитывается сегодня 1,6 млрд больных ЖДА и 3,6 млрд пациентов со скрытым дефицитом железа [3], что подчеркивает медико-социальное значение своевременной диагностики и лечения ЖДА и профилактики дефицита железа.
В норме в организме поддерживается баланс между поступлением и потерями железа. Суточная потребность в железе у взрослого здорового человека составляет примерно 15–20 мг. Около 90% железа, поступающего в костный мозг и другие органы, – это эндогенное железо, освобождающееся при распаде эритроцитов в макрофагах ретикулоэндотелиальной системы селезенки и печени. Экзогенное железо поступает в организм с пищей обычно в количестве 10–15 мг, хотя всасывается не более 10% от этого количества (1,0–1,5 мг). Кстати, обычные потери железа составляют примерно 1 мг/сут. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. В желудке под действием соляной кислоты происходит частичная ионизация железа (Fe2+) с образованием его закисной 2-валентной формы. Только в этой форме железо всасывается в кишечнике, преимущественно в двенадцатиперстной кишке. Железо 3-валентное экзогенное (Fe3+), не всосавшееся в кишечнике, выводится из организма в виде окисных соединений.
Абсорбированное 2-валентное железо может быть либо сохранено в пределах клетки в форме ферритина, либо перенесено через базолатеральную мембрану энтероцита в кровь при помощи еще одного белка – ферропортина. Здесь под действием медьсодержащего фермента ферроксидазы (церулоплазмина) железо окисляется до Fe3+ и связывается с трансферрином – гликопротеином, который является основной транспортной формой Fe3+. В составе трансферрина железо доставляется по системе воротной вены в печень и далее в костный мозг и другие органы, где оно используется для синтеза железосодержащих белков (гемоглобина (Hb), миоглобина, цитохромов, Fe-содержащих ферментов и др.) или депонируется в ферритине, который содержится почти во всех тканях и органах, особенно в большом количестве – в печени, селезенке и костном мозге [4].
1. Хронические кровопотери: маточные (меноррагии, миома матки, эндометриоз, внутриматочные контрацептивы); пищеводно-желудочные (язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит, цирроз печени, злокачественные опухоли); кишечные (болезнь Крона, язвенный колит, дивертикулез кишечника, геморрой, опухоли кишечника); почечные (геморрагический цистит, опухоли почек и мочевого пузыря); геморрагический синдром при нарушениях свертывания крови, заболеваниях печени, системных васкулитах, передозировке антикоагулянтов и т. д.
2. Нарушения всасывания пищевого железа и пристеночного (мембранного) пищеварения в тонком кишечнике и развитие синдрома мальабсорбции: хронические энтериты (инфекционные, болезнь Крона, болезнь Уиппла); дисахаридазная недостаточность, глютеновая энтеропатия (целиакия); опухоли тонкой кишки (лимфомы); пострезекционные синдромы (синдром короткой кишки, синдром слепой кишки); паразитарные инвазии; дивертикулез тонкой кишки; эндокринные заболевания (диабетическая энтеропатия, болезнь Аддисона, гиперпаратиреоидизм, гипертиреоз, гастринома, карциноид с метастазами); внешнесекреторная недостаточность поджелудочной железы; гастрогенная недостаточность всасывания железа (хронический атрофический гастрит, рак желудка, резекция желудка, гастрэктомия).
3. Повышенная потребность в железе: беременность, лактация, интенсивный рост (у детей), заместительная терапия рекомбинантным эритропоэтином больных с хронической почечной недостаточностью, пациентов с миелодиспластическим синдромом и др.
4. Алиментарная недостаточность железа: недостаточное питание, анорексии различного происхождения, вегетарианство.
Важно подчеркнуть, что при перечисленных выше поражениях ЖКТ, являющихся причиной развития ЖДА, как правило, наблюдается также нарушение всасывания витамина В12, фолиевой кислоты и микроэлементов, которые стимулируют процессы нормального созревания эритроцитов в костном мозге [4].
Следует помнить еще об одной важной причине развития гипохромной анемии, особенно у лиц пожилого и старческого возраста, связанной с низким содержанием железа в сыворотке крови. Этот вариант анемии нередко возникает при тяжелых хронических или острых воспалительных и онкологических заболеваниях внутренних органов (сепсис, тяжелые пневмонии, системные заболевания соединительной ткани, злокачественные опухоли различной локализации и др.), при которых развивается анемия, сопровождающаяся снижением содержания сывороточного железа и рефрактерная к лечению пероральными препаратами железа. В патогенезе этой анемии, которая получила название «анемия хронических заболеваний» (АХЗ), или «анемия воспаления», ведущую роль играет нарушение функции белков, регулирующих метаболизм железа в организме, – гепсидина и ферропортинов.
Гепсидин – пептид, синтезируемый печенью. Свою основную функцию обеспечивает, взаимодействуя с рецепторами транспортировки железа из клеток – ферропортинами, ограничивая их функцию и снижая или прекращая транспортировку железа из энтероцитов и макрофагов в плазму крови [5].
При тяжелых хронических и острых заболеваниях внутренних органов, как известно, повышается уровень провоспалительных цитокинов (фактор некроза опухоли-α, интерлейкин (ИЛ) -6, ИЛ-10), стимулирующих образование гепсидина [6, 7], чрезмерная концентрация которого приводит к прекращению функции ферропортинов. В результате железо не поступает в кровь ни из энтероцитов, ни из макрофагов, оказываясь как бы в «клеточной ловушке». Содержание сывороточного железа снижается, что сопровождается развитием анемии, тогда как паренхиматозные органы перегружены железом.
Клиническая картина ЖДА складывается из 2-х основных синдромов: анемического и сидеропенического. Неспецифический анемический синдром, обусловленный гемической гипоксией органов и тканей, характеризуется появлением немотивированной слабости, быстрой утомляемости, головокружений, синкопальных и предсинкопальных состояний, одышки и сердцебиений при небольшой физической нагрузке, повышенной раздражительности, плаксивости. При объективном исследовании у больных выявляются бледность кожных покровов и видимых слизистых, тенденция к снижению АД, тахикардия, функциональный систолический шум над сердцем. О тяжести течения болезни судят обычно по уровню Hb. Легкая степень анемии характеризуется снижением Hb до 120–90 г/л; средняя степень – от 89 до 70 г/л; тяжелая – 69 г/л и ниже.
Сидеропенический синдром, обусловленный тканевым дефицитом железа, нередко выявляемый даже при нормальном уровне Hb, приводит к снижению активности многих ферментов, в состав которых входит железо (цитохромоксидазы, пероксидазы, сукцинат-дегидрогеназы и др.). Это приводит к весьма характерным симптомам – извращению вкуса (pica chlorotica) и обоняния. У лиц с дефицитом железа возникает желание употреблять в пищу мел, уголь, глину, песок, сырое тесто, фарш, крупу, лед, а также пристрастие к неприятным запахам (бензин, ацетон, запах лаков, красок, гуталина и т. д.). Кроме того, у пациентов с дефицитом железа появляются выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы в связи с дефицитом миоглобина и ферментов тканевого дыхания. При объективном исследовании определяются сухость кожи, истончение, ломкость и поперечная исчерченность ногтей, койлонихии, ангулярный стоматит, глоссит («лакированный» язык), а также атрофические изменения слизистой оболочки пищевода (сидеропеническая дисфагия), желудка и кишечника (атрофический гастрит, энтерит). Возможно повышение температуры тела до субфебрильных цифр («сидеропенический субфебрилитет»).
Диагностическими критериями анемий считают снижение уровня Hb Литература
- Дворецкий Л. И. Железодефицитные анемии // Русский медицинский журнал. 1997. № 19. С. 1234–1242.
- Цветкова О.А. Медико-социальные аспекты железодефицитной анемии // Русский медицинский журнал. 2009. № 5. С. 387–391.
- WHO/NHD. Iron Deficiency Anaemia. Assessment, Prevention and Control: A guide for programme managers, 2001.
- Ройтберг Г.Е., Струтынский А.В. Внутренние болезни. Лабораторная и инструментальная диагностика. М.: МЕДпресс-информ, 2011. 800 с.
- Kaushansky K., Lichtman M., Beutler E. et al. // Williams Hematology. Anemia of Chronic Disease, 2010.
- Дворецкий Л.И., Дятлов Н.В. Анемия у больных ХСН // Фарматека. 2011. № 14. С. 24–29.
- Бирюкова Л.С. Оптимальная терапия железом и средствами, стимулирующими эритропоэз, у пациентов с ХБП // Лечебное дело. 2012. № 1. С. 44–48.
- Андреичев Н.А., Балеева Л.В. Железодефицитные состояния и железодефицитная анемия // Вестник современной клинической медицины, 2009. № 3. С. 60–65.
- Демидова А.В. Анемии // М.: МЕДпресс-информ, 2005. 64 с.
- Weiss G., Goodnough L.T. Anemia of Chronic Disease // N. Engl. J. Med. 2005. Vol. 352 Р. 1011–1023.
- Сельчук В.Ю., Чистяков С.С., Толокнов Б.О. и др. Железодефицитная анемия: современное состояние проблемы // Русский медицинский журнал. 2012. № 1. С. 1–8.
- Идельсон Л.И. Гипохромные анемии. М.: Медицина, 1981. 192 с.
- Alleyne M., Horne M.K., Miller J.L. Individualized treatment for iron deficiency anemia in adults // Am. J. Med. 2008. Vol. 121 (11). Р. 943–948.
- Коноводова Е.Н., Бурлев В.А. Эффективность применения препарата Ферро-Фольгамма у беременных и родильниц с железодефицитной анемией // Русский медицинский журнал. 2003. Т. 11. № 16. С. 899–901.
- Верткин А.Л., Городецкий В.В., Годулян О.В. Сравнительная эффективность и переносимость различных железосодержащих препаратов у больных железодефицитной анемией // Русский медицинский журнал. 2004. № 5. С. 309–313.
- Мурашко Л.Е. Коноводова Е.Н, Бурлев В.А., Сопоева Ж.А. Объемный транспорт кислорода у беременных с анемией и гестозом при лечении Ферро-Фольгаммой // Русский медицинский журнал. 2002. Т. 10. № 7. С. 364–367.
- Петрухин В.А., Гришин В.Л. Лечение анемии беременных с использованием препарата Ферро-Фольгамма // Проблемы репродукции. 2002. № 6. С. 28–33.
- Серов В.Н., Шаповаленко С.А., Флакс Г.А. Диагностика и лечение железодефицитных состояний у женщин в различные периоды жизни // Кардиология. 2008. № 2. С. 17–20.
- Лебедев В.А., Пашков В.М. Принципы терапии железодефицитной анемии у беременных // Трудный пациент. 2010. № 8. С. 28–31.
- Сопоева Ж.А. Коррекция железодефицитных анемий у беременных с гестозом: Автореф. дис. … канд. мед. наук. М., 2002.
- Бурлев В.А., Коноводова Е.Н., Мурашко Л.Е. и др. Коррекция железодефицитных состояний у беременных с гестозом // Проблемы репродукции. 2002. № 6. С. 30–34.
- Коколина В.Ф. Опыт применения препарата Ферро-Фольгамма в лечении железо-дефицитных анемий у больных с ювенильными маточными кровотечениями // Справочник педиатра. 2005. № 6. С. 13.
- Шилов А.М., Мельник М.В., Ким И.Р. и др. Особенности течения ИБС на фоне анемического синдрома различной этиологии // Фарматека. 2006. № 11. С. 32–36.
- Городецкий В.В., Годулян О.В. Железодефицитные состояния и железодефицитная анемия: лечение и диагностика. М.: Медпрактика, 2004. Т. 3. 28 с.
- Никитин Е.Н., Красноперова О.В., Никитин Ю.Е. Опыт лечения железодефицитной анемии препаратом Ферро-Фольгамма // Клиническая медицина. 2009. № 3. С. 64–67.
Только для зарегистрированных пользователей
источник
Выдыборец С.В., д.м.н., профессор кафедры гематологии и трансфузиологии
Национальная медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины
Показатели метаболизма железа при ЖДА характеризуются уменьшением содержания железа в сыворотке (в норме у мужчин и женщин соответственно 13-30 и 12-25 мкмоль/л), увеличением общей железосвязывающей способности сыворотки крови (в норме 30-85 мкмоль/л). Разница между показателями общей железосвязывающей способности сыворотки крови и сывороточного железа отражает латентную железосвязывающую способность сыворотки (в норме менее 47 мкмоль/л). При ЖДА этот показатель повышен. Соотношение показателя железа сыворотки и общей железосвязывающей способности выражает насыщение трансферрина железом (норма 16-50%). При ЖДА этот показатель снижается. ЖДА характеризуется уменьшением содержания ферритина в сыворотке крови (норма 15-150 мкг/л). Оценка запасов железа в организме, кроме определения показателя ферритина, может быть осуществлена по десфераловому тесту. Суть последнего состоит в том, что после внутривенного введения 500 мг десферала у здорового человека с мочой выделяется от 0,8 до 1,2 мг железа, в то время, как у больных ЖДА этот показатель снижен. Следует помнить, что показанием для назначения данного теста может быть только невозможность доказать другими методами предполагаемый дефицит железа в организме больного [5, 6]. Определение протопорфиринов в эритроцитах больных ЖДА показывает их увеличение (норма 18-89 мкмоль) [15, 18]. По данным радиологических исследований выявляют увеличение клиренса железа плазмы [19, 20]. На сегодняшний день наиболее точными методами количественного определения железа в биологических жидкостях и тканях являются методы: спектрального анализа, нейтронно-активационный, атомно-абсорбционный, рентген-флюоресцентный [4, 15, 18]. Таким образом, ЖДА характеризуется нарушениями метаболизма железа в сыворотке, изменениями транспортного и депонированного фондов железа в организме.
Считают, что для диагностики ЖДА морфологическое исследование костного мозга малоинформативно [1, 9, 16, 20]. Однако, значимость его существенно возрастет, если применить цитохимическое исследование с окрашиванием мазков на железо. Существуют три классические метода выявления неорганического железа: 1) метод Perisс берлинской лазурью; 2) с турбуленовым синим; 3) реакции с образованием сульфидов железа. В гематологии, чаще всего, используют метод окраски с берлинской лазурью, что базируется на образовании ферриферрицианида при взаимодействии ионов трехвалентного железа с ферроцианидом в кислой среде [10]. Реакция проявляется в виде образования синего или сине-зеленого осадка ферриферрицианида.
Определение содержания железа в костном мозге при помощи реакции с берлинской лазурью дает ценную информацию для оценки адекватности накопления железа в организме. Большие зерна или конгломераты окрашенного в синий цвет железа в норме наблюдают в макрофагальных клетках костного мозга или свободно лежащими между клеток. Более мелкие гранулы могут наблюдаться в молодых красных клетках мазков костного мозга после соответствующей обработки, а также в клетках системы фагоцитирующих макрофагов. В макрофагальных элементах железо просматривается в виде неплотных агрегатов и предполагают, что оно не идентично гранулам, которые наблюдаются в созревающих красных клетках. Такое железо рассматривают как форму накопления, которая используется на синтез гемоглобина. Истощение отложений железа наблюдают при ЖДА, а избыточное накопление при гемохроматозе, хронических гемолитических анемиях, талассемии, рефрактерных анемиях [10, 18].
Критерии лабораторной диагностики ЖДА приведены в табл. 3.
Таким образом, лабораторными критериями ЖДА является гипохромная анемия, которая сопровождается морфологическими изменениями эритроцитов, уменьшением содержания сывороточного железа, увеличением общей железосвязывающей способности сыворотки крови, уменьшением насыщения трансферрина железом и снижением концентрации ферритина в сыворотке крови.
Во избежание ошибок при интерпретации результатов исследований, необходимо помнить следующее. Полученные результаты исследований могут не отражать истинное содержание железа в сыворотке, если больной перед исследованием, даже кратеовременно принимал препараты железа. Для определения железа следует использовать пластиковые или стеклянные пробирки, промытые перед исследованием соляной кислотой и дважды – дистиллированной водой, поскольку обычное промывание не гарантирует защиту от внесения незначительных количеств железа. При центрифугировании пробирки следует закрывать пробками из пластмассы, поскольку в них может попасть железная пыль из центрифуги. Кровь для исследований следует брать натощак утром, поскольку существуют суточные биоритмы колебания концентрации железа в сыворотке. Показатели сывороточного железа могут изменяться в зависимости от фаз менструального цикла.
Учет вышеизложенных фактов позволит избежать неточностей в исследованиях и ошибок в диагностике ЖДА.
Критерии лабораторной диагностики ЖДА
Лабораторный показатель
Изменения при ЖДА
источник
КЛИНИКО-ЛАБОРАТОРНАЯ ДИАГНОСТИКА АНЕМИЙ
Анемия — это гематологический синдром или самостоятельное заболевание, для которого характерно уменьшение количества эритроцитов и / или содержания гемоглобина в единице объема крови, что приводит к развитию гипоксии тканей.
Патогенетическая классификация анемий .
1. Анемии вследствие кровопотери (постгеморрагические):
2. Анемии вследствие нарушения образования эритроцитов и гемоглобина:
2.1 Анемии, связанные с нарушением образования Нb
— Н арушение реутилизации железа;
2.2 М егалобластн ые анеми и , связанные с нарушением синтеза ДНК или РНК ( В 12-фолиево-дефицитн ые анемии вследствие наследственного дефицита ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований);
— Гипопролиферативн ые анемии
-Анемии, связанные с костномозговой недостаточностью (гипоапластичн ые , рефрактерные анемии при миелодиспластическо м синдроме)
— Метапластические анемии (при гемобластозах, метастазах рака в костный мозг);
— Наследственные (мембранопатии — Миньковского-Шафар а , овалоцитоз; ферментопатии — дефицит глюкозо-6-фосфатдегидрогеназы, пируваткиназы, глутатион-редуктазы; гемоглобинопатии — талассемия, серповидно-клеточная анемия);
-Приобретенные (аутоиммунные, пароксизмальная ночная гемоглобинурия, медикаментозные, травматические и микроангиопатическ ие , в результате отравления гемолитическими ядами и бактериальными токсинами).
Морфологическая классификация (по размерам эритроцитов).
1. Макроцитарная анемия (MCV — mean corpuscular volume-средний объем эритроцита> 100 мкм3, диаметр эритроцита> 8 мкм);
— Мегалобластические (дефицит витамина В12 и фолиевой кислоты, врожденные нарушения синтеза ДНК, лекарственно-индуцированные нарушения синтеза ДНК);
— Немегалобластич еские (ускоренный эритропоэз при гемолитической анемии, увеличение поверхности эритроцитарной мембраны в ответ на кровопотерю, при заболеваниях печени, механической желтухе, после спленэктомии, при микседеме, гипо-апластической анемии, при хронических обструктивных заболеваниях легких, алкоголизме, миелодиспластическ ом синдроме).
2. Микроцитарная анемия (MCV
— Нарушение синтеза гемоглобина (талассемия, гемоглобинопатии);
— Нарушение синтеза порфирина и гема;
— Другие нарушения обмена железа.
3. Нормоцитарная анемия (MCV 81-99 мкм3, диаметр эритроцита 7,2-7,5 мкм):
— Значительное увеличение объема плазмы (беременность, гипергидратация)
— Гипо-, апластические анемии;
— Инфильтративные изменения в костном мозге (лейкемии, множественные миеломы, миелофиброз);
— Эндокринная патология (гипотиреоз, надпочечниковая недостаточность);
По регенераторной способност и красного костного мозга
— Регенераторные (например, острая постгеморрагическая анемия);
— Гиперрегенераторна я (например, приобретенная гемолитическая анемия);
— Гипорегенераторн ая (например, железодефицитная анемия);
— Арегенераторна я (например, апластическая анемия).
1 . Н ормохромная ( Ц П — 0,85-1,05):
— При хронической почечной недостаточности;
— При гипофизарной недостаточности;
— Гипопластическая (апластическая) анемия;
— Анемия при миелодиспластическ м синдроме
— Медикаментозная и лучевая цитостатическая болезнь;
— Анемии при злокачественных новообразованиях, гемобластозах;
— При системных заболеваниях соединительной ткани;
— При хроническом активном гепатите и циррозе печени (кроме хронической постгеморрагической)
— Гемолитические (кроме талассемии);
— Острая постгеморрагическая анемия.
— Фолиево-дефицитная анеми я .
— Анемии с э ритробластичн ы м типом кроветворения (например, железодефицитная анемия);
— Анемии с мегалобластн ым типом кроветворения (например, В-12 и / или фолиево-дефицитная анемия).
— Острые (например, анемии после гемотрансфузионного шока);
— Хронические (например, апластическая анемия).
Железодефицитн ая анеми я
Железодефицитная анемия обусловлена дефицитом железа в сыворотке крови, костном мозге и депо, в результате чего нарушается образование гемоглобина, а затем и эритроцитов.
Этиология. В зависимости от причин, вызывающих дефицит железа, выделяют 5 групп ЖДА.
1 Хронические постгеморрагические ЖДА.
2 ЖДА, связанные с нарушением всасывания и / или недостаточным поступлением в организм с пищей.
3 ЖДА, связанные с недостаточным исходным уровнем железа в организме (чаще у детей).
4 ЖДА, связанные с повышенной потребностью в железе (без кровопотери).
5 ЖДА, связанные с нарушением транспорта железа.
Патогенез. В организме здорового человека в среднем содержится 3 — 5 г железа, 72,9% которого входит в состав гемоглобина (Hb), 3,3% — миоглобина и 16,4% находится в запасах (депо) в виде ферритина (80%) и гемосидерина. Физиологические потери железа составляют 0,6-1,2 мг / сут у мужчин и 1,5- 2 г / сут у женщин и компенсируются за счет железа, попадает с пищей. В пище при обычном питании содержится около 14 мг железа или в виде составляющей гема. (Мясо, рыба), или негемового железа (овощи, фрукты). Стенки кишок содержат фермент гемоксигеназы, который расщепляет гем пищевых продуктов на билирубин, оксид углерода (II) и ионы железа. Органическое железо (Fe +2) хорошо всасывается (до 20-30%), а неорганическое — (Fe +3) — не более 5%. Всего за сутки в верхних отделах тонкой кишки абсорбируется 1-2 мг железа, или 8-15% от того, что содержится в пище. Всасывание железа регулируется клетками кишечника-энтероцитами: увеличивается при дефиците железа и неэффективном эритропоэза и блокируется при избытке железа в организме. Улучшают процесс всасывания аскорбиновая кислота, фруктоза. Абсорбция железа из просвета кишечника происходит с помощью белка — мукозные апотрансферину, который синтезируется в печени и поступает в энтероциты. С энтероцитов выделяется в просвет кишечника, в котором соединяется с железом и снова попадает в энтероцитов. Транспорт от кишечной стенки до предшественников эритроцитов и клеток-депо происходит с помощью белка плазмы — трансферрина. Небольшая часть железа в энтероцитов сочетается с ферритином, который можно считать пулом железа в слизистой тонкой кишки, медленно обменивается. В крови железо циркулирует в комплексе с плазменным белком трансферрином, который синтезируется преимущественно в печени, в небольшом количестве в лимфоидной ткани, молочной железе, тестикулах и яичниках. Трансферрин захватывает железо из энтероцитов, из депо в печени и селезенке и переносит его к рецепторам на еритрокариоцитах костного мозга. Каждая молекула трансферрина может связать два атома железа. У здоровых лиц трансферрин насыщен железом только на одну треть. Мерой количества свободного трансферрина в плазме, который способен полностью насыщаться железом, есть общая железосвязывающая способность. Ненасыщенная железом часть трансферрина обозначается как латентная железосвязывающая способность. Основные запасы железа в организме в течение наиболее длительного времени находятся в печени (в виде ферритина). Также депо есть в селезенке (фагоцитирующими макрофаги), в костном мозге и в незначительном количестве в эпителии кишечника.
Расходы железа на эритропоэз составляют 25 мг в сутки, что значительно превышает возможности всасывания в кишечнике. Поэтому для гемопоэза постоянно используется железо, освободившееся при распаде эритроцитов в селезенке.
Другой формой депонированного железа является гемосидерин-малорастворимое производная ферритина с более высокой концентрацией железа без апоферитиновои оболочки. Гемосидерин накапливается в макрофагах костного мозга, селезенки, купферовських клетках печени.
Таким образом, в организме человека железо распределяется так:
-Железо еритрону (в составе гемоглобина эритроцитов костного мозга и тех, которые циркулируют в крови, -2,8- 2,9 г );
-Железо депо (в составе ферритина и гемосидерина — 0,5- 1,5 г );
-Железо тканевое (миоглобин, цитохромы, ферменты — 0,125 — 0,140 г );
-Железо транспортное (связано с белком крови — трансферрином — 0,003 — 0,004 г ).
Итак, патогенез ЖДА схематично можно отобразить следующим образом:
1) дефицит железа нарушение синтеза гема и гемоглобина анемия
2) дефицит железа нарушение синтеза гема нарушение образования цитохромов нарушения клеточного дыхания (нарушение утилизации кислорода) тканевая гипоксия;
3) дефицит железа нарушение синтеза гема уменьшение активности каталазы нарушения функции антиоксидантных систем активация свободнорадикального окисления повреждения клеток гемолиз эритроцитов и развитие дистрофических изменений в клетках;
4) дефицит железа нарушение синтеза гема уменьшения синтеза миоглобина ухудшение приспособления клеток к гипоксии.
Лабораторная диагностика ЖДА
Диагностика ЖДА основана на анализе данных клинических и лабораторных исследований.
Общий анализ крови с определением количества тромбоцитов и ретикулоцитов, а также определение:
-Среднего объема эритроцита — MCV (mean corpuscular volume-N 75-95мкм3),
— Среднего содержания гемоглобина в эритроцитах-MCH (mean corpuscular hemoglobin-N 24-33 пг),
— Средней концентрации гемоглобина в эритроцитах — MCHC (mean corpuscular hemoglobin concentration — N 30-38%),
— Гистограммы объема эритроцитов, оценивает степень Анизоцитоз — RDW (red cell distribution width).
2. Биохимические исследования.
Определение железа в сыворотке крови, общей железосвязывающей способности сыворотки крови, насыщение железом трансферрина, содержание трансферрина, ферритина в сыворотке крови, Десфераловый тест.
Вычисление показателей миелограммы, определение костномозговых индексов, количества сидеробластов.
4. Исследование свободного протопорфирина в эритроцитах.
В начале заболевания количество эритроцитов не уменьшается, но они уменьшены по размерам (микроциты) и недостаточно насыщены гемоглобином (гипохромия). Уровень снижения гемоглобина опережает уменьшение эритроцитов. Наблюдается низкий цветной показатель (0,7-0,5) и уменьшение MCHС. В мазках крови преобладают небольшие гипохромные эритроциты, анулоциты (эритроциты с отсутствующим гемоглобином в центре в виде колец), неодинакового размера и формы (анизоцитоз, пойкилоцитоза). При тяжелой анемии могут появляться эритробласты. Количество ретикулоцитов не меняется. Но если анемия вызвана острым кровотечением, непосредственно после нее уровень ретикулоцитов повышается, что является важным признаком кровотечения. Осмотическая резистентность эритроцитов мало изменяется или несколько повышена.
Количество лейкоцитов имеет нерезко выраженную тенденцию к снижению, но лейкоцитарная формула не меняется. Уровень тромбоцитов не меняется, только при кровотечениях несколько повышается.
Уровень ферритина сыворотки крови определен радиоиммунным методом, уменьшается уже на прелатентний стадии ЖДА. В норме его содержание составляет 85-130 мкг / л у мужчин и 58-150 мкг / л у женщин.
Уровень железа в сыворотке крови здоровых людей, определяемый по методу Henry, составляет 0,7-1,7 мг / л, или 12,5-30,4 мкмоль / л, при ЖДА он уменьшается до 1,8-5,4 мкмоль / л. Общая железосвязывающая способность плазмы крови (или общий трансферрин сыворотки) увеличивается (N-1,7-4,7 мг / л, или 30,6 -84,6 мкмоль / л). Около трети (30-35%) всего трансферрина сыворотки крови связано с железом (показатель насыщения трансферрина железом). Остальные трансферрина свободная и характеризует скрытую железосвязывающей способность сыворотки крови. У больных ЖДА процент насыщения трансферрином уменьшается до 10-20, при этом увеличивается скрытая железосвязывающая способность плазмы.
В костном мозге — еритробластична реакция с задержкой созревания и гемоглобинизации эритробластов на уровне полихроматофильного нормоцита (количество последних увеличивается). Количество сидеробластов резко уменьшается —
Больным ЖДА проводят Десфераловый тест — определяют количество железа, которое выделяется с мочой после введения 500 мг Десферала (комплексон, продукт жизнедеятельности актиномицетов, который связывает железо). Этот тест позволяет определить депо железа в организме. У здоровых лиц с мочой после введения Десферала выделяется 0,8-1,8 мг железа в сутки. У больных ЖДА этот показатель уменьшается до 0,4 мг и меньше уже на прелатентний стадии дефицита железа. Если же показатель остается нормальным при наличии клинических признаков ЖДА, скорее всего причиной патологического состояния может быть инфекционный или иной воспалительный процесс в организме. Увеличение количества выделенного железа с мочой при наличии анемии свидетельствует о наличии железа в депо без его реутилизации (гемосидероз внутренних органов).
Для установления причин и факторов ЖДА необходимо провести дополнительное обследование:
-Исследовании кислотности желудочного сока (рН-метрия);
-Исследование кала на наличие паразитов;
-Исследование кала на скрытую кровь;
-Рентгенологическое и эндоскопическое (ФЭГДС, при необходимости — ирригоскопия, ректороманоскопия, колоноскопия) исследование пищеварительного тракта;
-Гинекологическое и урологическое обследование больных.
-Наличие анемического и сидеропеничного синдромов;
-Низкий цветной показатель (
-Микроцитоз, пойкилоцитоза, анизоцитоз эритроцитов (в мазке периферической крови);
-Уменьшение средней концентрации Hb в эритроците;
-Уменьшение содержания железа в сыворотке крови;
-Увеличение общей железосвязывающей способности сыворотки
-Увеличение ненасыщенной железосвязывающей способности сыворотки крови;
-Уменьшение количества сидеробластов в костном мозге.
Изменения в полости рта. Основным признаком железодефицитной анемии являются бледность слизистой оболочки. Кроме того, эпителиальные клетки становятся атрофические, с потерей нормального ороговения. Язык может стать гладким в связи с атрофией нитевидных сосочков. В запущенных случаях может развиваться стриктура пищевода, в результате дисфагии. Недавние клинические исследования показали, языковые признаки и симптомы гораздо менее распространены, чем считалось ранее. Гистологическое исследование слизистой оболочки языка показывает уменьшение толщины эпителия, с уменьшением количества клеток, несмотря на увеличение слоя клеток-предшественников. Эти изменения слизистой оболочки могут происходить при отсутствии других явных клинических проявлений.
Мегалобластические анемии — группа анемий, вызванных нарушением синтеза ДНК и РНК в клетках, в результате чего нарушается их размножения; характеризуется мегалобластную типом кроветворения.
Витамин В12 (цианокобаламин) содержится в продуктах животного происхождения — мясе, яйцах, сыре, печени, молоке, почках. В них цианокобаламин связан с белком. При кулинарной обработке, а также в желудке витамин В12 освобождается от белка (в последнем случае — под действием протеолитических ферментов). Недостаток витамина В12 в продуктах, голодание или отказ от употребления продуктов животного происхождения (вегетарианство) нередко обусловливает развиток 12 — дефицитной анемии. Витамин В12, поступающего с пищей, по предложению Кастла (1930), называют «внешним фактором» развития анемии. Париетальные клетки желудка синтезируют термолабильный лужностийкий фактор (его обозначают как «внутренний фактор» Кастла), который представляет собой гликопротеин с молекулярной массой 50 000 — 60 000. Комплекс витамина и гликопротеина связывается со специфическими рецепторами клеток слизистой оболочки средней и нижней частей подвздошной кишки и далее поступает в кровь.
Этиология. Причины, вызывающие развитие названной анемии, могут быть разделены на три группы:
нарушения всасывания витамина В12 в организме:
-Атрофия желез фундального отдела желудка (болезнь Аддисона-Бирмера):
-Опухоли желудка (полипоз, рак);
-Заболевания кишечника (терминальный илеит, дивертикулы, опухоли);
-Оперативные вмешательства на желудке, кишечнике (резекция, гастроктомия)
• повышенные затраты витамина и нарушение утилизации в костном мозге:
-Кишечные паразиты (дифилоботриоз)
-Гемобластозы (острый лейкоз, эритромиелоз, остеомиелофиброз)
• недостаточное поступление витамина В12 в организм с продуктами питания (достаточно редко).
Патогенез. В клетках с витамина В12 образуются две его коферментные формы: метилкобаламин и 5 — дезоксиаденозилкобаламин. Метилкобаламин участвует в обеспечении нормального, еритробластичного кроветворения. Дефицит витамина В12, а в дальнейшем метилкобаламин, приводит к нарушению созревания эпителиальных клеток пищеварительного тракта (они также быстро делятся), что способствует развитию атрофии слизистой оболочки желудка и тонкой кишки с соответствующей симптоматикою.Другий кофермент витамина В12 — 5-дезоксиаденозилкобаламин участвует в обмене жирных кислот путем катализации образования янтарной кислоты с метилмалоновой. Вследствие дефицита витамина В12 образуется избыток метилмалоновой кислоты, которая является токсичной для нервных клеток. Это приводит к нарушению образования миелина в нейронах головного и спинного мозга (особенно задних и боковых его столбов) с последующим расстройством в нервной системе.
Клиника. Наблюдаются 3 основные синдромы:
-Синдром Макроцитарная-мегалобластической анемии.
В периферической крови значительно снижено число эритроцитов, иногда до 0,7 — 0,8 x1012 / л. Они большого размера — до 10 — 12 мкм, часто овальной формы, без центрального просветления. Обычно наблюдаются мегалобласты. Во многих эритроцитах наблюдаются остатки ядра (тельца Жолли) и нуклеолемы (кольца Кебота). Характерные анизоцитоз (преобладают макро-и мегалоциты), пойкилоцитоза, полихроматофилия, базофильная пунктация цитоплазмы эритроцитов. Эритроциты в избытке насыщенные гемоглобином. Цветной показатель повышен более чем на 1,1 — 1,3. Однако общее содержание гемоглобина в крови существенно уменьшается за счет значительного снижения количества эритроцитов. Количество ретикулоцитов обычно уменьшена, реже — нормальная. Наблюдается лейкопения (за счет нейтрофилов), сочетающаяся с полисегментованимы, гигантских размеров нейтрофилами, а также тромбоцитопения. В связи с повышенным гемолизом эритроцитов (всего в кистовому мозга) развивается билирубинемия.
В костном мозге наблюдаются мегалобласты диаметром до 15 мкм, а также мегалокариоциты. Мегалобласты характеризуются десинхронизацией созревания ядра и цитоплазмы. Быстрое образование гемоглобина (уже в мегалобластов) сочетается с опозданием дифференциации ядра. Названные изменения в клетках еритрону сочетаются с нарушением дифференциации и других клеток миелоидного ряда: мегакариобласты, миелоциты, метамиелоциты, Стилус и сегментоядерные лейкоциты, также увеличены по размерам, их ядра имеют более нежную, чем в норме, структуру хроматина.
Следует отметить, что мегалобласты при В12-дефицитной анемии не является особой популяцией клеток, поскольку способны при наличии соответствующей Коферментные формы дифференцировать в обычные еритрокариоциты течение нескольких часов. Это означает, что одна инъекция витамина В12 в состоянии полностью изменить морфологическую картину костного мозга, что иногда приводит к усложнению диагностики заболевания, появления стертой клинической картины.
•-атрофический гастрит (гунтеровський глоссит, лакированный язык);
•-признаки поражения нервной системы (фуникулярный миелоз);
•-снижение количества эритроцитов и Нb;
•-высокий цветной показатель;
•-нормобласты в крови, тельца Жолли и кольца Кебота;
•-ретикулоцитопения (при отсутствии лечения витамином В12);
•-нейтрофилоцитопения, гиперсегментация нейтрофилов;
•-повышенное содержание сывороточного железа, билирубина;
•-признаки мегалобластического кроветворения в миелограмме (мегалобласты в большом количестве, полисегментарнисть нейтрофилов).
В специализированных лабораториях с диагностической целью можно определить: уровень цианокобаламина в сыворотке крови, оценить его функцию всасывания; активность гастрогликопротеиду и найти антитела к нему; повышенный уровень выделения метилмалоновой кислоты с мочой после нагрузки гистидина. Необходимо также провести дополнительные обследования для установления диагноза (ФЭГДС с биопсией для подтверждения атрофии слизистой, при необходимости-колоноскопию, УЗИ ограни брюшной полости).
Фолиевая кислота состоит из птерилинового кольца, парааминобензойной и глутаминовой кислот. Ее запасы в организме составляют 5-20 мг. В отличие от цианокобаламина, запасы которого истощаются при нарушении поступления в организм только через несколько лет, запасы фолиевой кислоты исчерпываются течение 4-5 месяцев.
Этиология. Причины развития фолиево-дефицитной анемии, так же как и В12-дефицитной анемии следует разделить на три группы:
• нарушение всасывания фолиевой кислоты в организме (понос, кишечные инфекции, резекция тонкой кишки, синдром слепой петли, алкоголизм);
• повышенные затраты (беременность, период повышенного роста) и нарушение утилизации в костном мозге (принятие медикаментов, которые являются аналогами или антагонистами фолиевой кислоты — противоэпилептические, химиопрепараты, гемолитические анемии с частыми кризами);
• недостаточное поступление фолиевой кислоты в организм с продуктами питания (у недоношенных новорожденных, при однообразном кормлении порошковым или козьим молоком).
Патогенез. Фолиевая кислота хорошо всасывается преимущественно в верхнем отделе тонкой кишки и превращается в конечном этапе в тетрагидрофолиевую кислоту. Именно последняя является метаболически активной (Коферментные) формой фолиевой кислоты и трансформируется в полиглютаминовий тетрафолиат. Она необходима для регуляции образования тимидинмонофосфату с уридинфосфату (вместе с витамином В12), синтеза пуринов и пиримидинов, т.е. синтеза не только ДНК, но и РНК. Участвует в образовании глютаминовой кислоты из гистидина.
Дефицит фолиевой кислоты приводит к таким же морфологических изменений, как и дефицит витамина В12, т.е. мегалобластического типа кроветворения.
На фолиево-дефицитную анемию чаще страдают лица молодого возраста, беременные женщины. В клинике фолиево-дефицитной анемии так же, как и при В12-дефицитной анемии, выделяют гастроэнтерологический синдром и синдром Макроцитарная-мегалобластической анемии. Симптомы макроцитарной анемии преобладают. Патологические изменения в пищеварительном тракте по сравнению с В12-дефицитной анемией менее выражены.
Диагностическое и дифференциально-диагностическое значение имеют следующие тесты:
• определение содержания фолиевой кислоты в сыворотке крови и эритроцитах (микробиологическим и радиоиммунным методами): в норме содержание фолиевой кислоты в сыворотке колеблется в пределах 3,0-25нг / мл (в зависимости от методики определения), в эритроцитах -100-420 нг / мл . При дефиците фолиевой кислоты ее содержание уменьшается как в сыворотке, так и в эритроцитах, тогда как при В12-дефицитной анемии содержание фолиевой кислоты в сыворотке повышается;
• тест с гистидина: у здоровых лиц основная часть гистидина образует глютаминовую кислоту с мочой выводится 1-18 мг формиминглютаминовои кислоты. Через 8 часов после принятия 15 г гистидина при фолиево-дефицитной анемии с мочой выделяется от 20 до 1500 мг формиминглютаминовои кислоты, что значительно выше, чем при В12-дефицитной анемии. Особенно ее много выделяется у лиц, принимающих метотрексат;
• определение содержания метилмалоновой кислоты в моче: не изменяется при фолиево-дефицитной анемии и значительно увеличивается при В12-дефицитной;
• окраска костного мозга ализарин красным предложено кассу: окрашиваются в красный цвет только мегалобласты, связанные с В12-дефицитной анемией, мегалобласты при дефиците фолиевой кислоты остаются желтыми;
• пробное лечение витамином В12: отсутствие эффекта при фолиево-дефицитной анемии.
Острая постгеморрагическая анемия
Возникает вследствие разрыва или разъедание сосудистой стенки при механической травме, язвенной болезни желудка, туберкулезе легких, бронхоэктатической болезни, злокачественных опухолях, портальной гипертензии.
Картина крови в различные фазы заболевания неодинакова.
Первая фаза — Рефлекторная компенсация (1-2 ч после кровотечения) в связи с поступлением депонированной крови в сосудистое русло и уменьшением ее объема вследствие рефлекторного сужения большого числа капилляров характеризуется нормальными показателями содержания гемоглобина, числа эритроцитов, цветового и других показателей периферической крови.
Ранними признаками кровопотери является тромбоцитоз и лейкоцитоз
Вторая фаза — Гидремична компенсация (первые 1-2 дня) характеризуется восстановлением первоначального объема циркулирующей крови за счет поступления в периферическое сосудистое русло большого количества тканевой жидкости, плазмы. В этой фазе проявляют истинную анемизации без снижения цветового показателя. Наблюдается практически одинаковое снижение содержания гемоглобина, числа эритроцитов, а также уменьшение гематокрита
Третья фаза — Костномозговая фаза компенсации (4-5 суток от начала кровотечения). Наряду со снижением содержания гемоглобина и числа эритроцитов, хранящейся в периферической крови наблюдается ретикулоцитоз. Одновременно может определяться умеренный лейкоцитоз, большое количество молодых форм нейтрофилов (палочкоядерных, метамиелоцитов, иногда — миелоцитов), сдвиг лейкоцитарной формулы влево, а также кратковременный тромбоцитоз.
Итак, острая постгеморрагическая анемия при лабораторными признаками нормохромная, нормоцитарная, гиперрегенераторна.
Хроническая постгеморрагическая анемия
Возникает как следствие длительных повторных кровопотерь у больных с язвенной болезнью желудка и двенадцатиперстной кишки, раком желудка, геморроем, гемофилией, у женщин с маточными кровотечениями.
В костном мозге наблюдаются явления выраженной регенерации, появляются очаги экстрамедуллярного кроветворения. Вследствие истощения запасов железа анемия постепенно приобретает гипохромной характера. В кровь выбрасываются гипохромные эритроциты и микроциты. Со временем еритропоетична функция костного мозга подавляется, и анемия становится гипорегенераторною.
Гемолитические анемии делятся на наследственные (врожденные) и приобретенные.
Наследственные гемолитические анемии
а) мембранопатии (еритроцитопатии) — связанные с нарушением структуры и обновление белковых и липидных компонентов мембран эритроцитов (микросфероцитарна анемия — болезнь Минковского-Шоффара);
б) ферментопатии — связанные с дефицитом эритроцитарных ферментов, обеспечивающих пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов;
в) гемоглобинопатии — связанные с нарушением структуры или синтеза цепей гемоглобина (талассемия, серповидно-клеточная анемия).
Этиология. Генетический дефект мембраны эритроцитов.
Патогенез. Мембранный дефект заключается в высокой проницаемости эритроцитарных оболочек для ионов натрия. Несмотря на активацию калий-натриевого насоса, они пассивно диффундируют внутрь эритроцита и повышают осмотическое давление внутриклеточной среды. В эритроциты направляется вода, и они набирают сферической формы.
Картина крови. Имеет циклическое течение с обострениями и ремиссиями. При гемолитического кризис гемоглобин и эритроциты значительно уменьшаются. КП в норме. Это микроцитарная, нормохромная, гиперрегенераторна анемия. Анизоцитоз, пойкилоцитоза: эритроциты сферической формы, уменьшенные в диаметре, равномерно окрашенные, без зоны просветления. Содержание ретикулоцитов резко повышен. В период обострения — лейкоцитоз с нейтрофилезом, СОЭ ускорена. Осмотическая резистентность эритроцитов снижена. Характерно повышение количества непрямого билирубина в крови.
Кроме микросфероцитоза, в группу мембранопатий относят
1. наследственный елиптоцитоз,
2. наследственный пиропойкилоцитоз, наследственный стоматоцитоз,
3. наследственный акантоцитоз,
4. наследственный ехиноцитоз.
Примером ферментопатии может служить анемия на почве дефицита глюкозо-6-фосфатдегидрогеназы. Болезнь наследуется доминантно, сцеплено с Х-хромосомой. Постоянная анемия наблюдается редко. Как правило, болезнь проявляется гемолитическими кризами после приема некоторых лекарств-сульфаниламидных препаратов (норсульфазола, сульфодиметоксину, этазол, бисептола), противомалярийных (хинина, Акрихин) и противотуберкулезных средств (тубазид, фтивазида, ПАСК). Все названные препараты способны окислить гемоглобин и исключить его из дыхательной функции. У здоровых лиц этого не происходит благодаря существованию антиоксидантной системы, важным компонентом которой является восстановленный глутатион. При дефиците глюкозо-6-фосфатдегидрогеназы количество восстановленного глутатиона уменьшается. Поэтому медикаменты с окислительными свойствами даже в терапевтических дозах окисляют и разрушают гемоглобин. От его молекулы отрывается гем, а цепи глобина выпадают в осадок (тельца Гейнца). Эти включения элиминируются в селезенке, но в процессе их удаления теряется часть поверхности эритроцита, который затем быстро распадается в кровеносном русле. Такую же провоцирующую роль могут сыграть некоторые инфекционные болезни — грипп, вирусный гепатит, сальмонеллез. В отдельных лиц гемолитические кризы возникают после употребления конских бобов или вдыхание пыльцы этого растения (фавизм). Активные факторы конских бобов (Вицин, конвицин) окисляют восстановленный глутатион, уменьшая мощность антиоксидантной системы.
С гемоглобинопатий наиболее распространенная серповидно-клеточная анемия. У таких больных вместо гемоглобина А синтезируется гемоглобин S. Отличается он тем, что глутаминовая кислота в нем замещена валином в шестом положении -цепи. Эта замена резко снижает растворимость гемоглобина в условиях гипоксии. Восстановленный гемоглобин S в 100 раз менее растворим, чем окисленный, и в 50 раз менее растворим от гемоглобина А. В кислой среде он выпадает в осадок в виде кристаллов и деформирует эритроциты, предоставляя им серповидной формы. Мембрана их теряет прочность, и наступает внутрисосудистый гемолиз.
Изменения в полости рта при серповидно-клеточной анемии. Помимо желтухи и бледности слизистой оболочки полости рта, пациенты часто указывают на задержка прорезывания и гипоплазию зубов наряду с общей задержкой. Из-за хронической повышенную активность эритропоэза и гиперплазию костного мозга, которые являются попытками компенсировать гемолиз, повышение просветления в результате уменьшения числа трабекул видно на стоматологических рентгенограммах. Это изменение чаще наблюдается особенно в альвеолярном отростке между корнями зубов, где трабекулы могут отображаться в виде горизонтальных рядов
Картина крови. Серповидно-клеточная анемия.
Когда заторможен синтез — или -цепей гемоглобина, развивается талассемия. Для нее характерны мишенеподибни еритроцити.У гетерозигот развивается так называемая малая талассемия, у гетерозигот — большая талассемия Шары с высшей степенью гемолиза эритроцитов.
Изменения в полости рта при талассемии. При тяжелых формах заболевания разрастаются кости верхней челюсти с участками выпячивание костной ткани вокруг скул, очень бледную кожу. Раннее начало гемолиза, который сопровождается резкой гиперплазией (увеличением массы) костного мозга, приводит к грубым нарушениям в строении лицевой части черепа, нос приобретает седловидной формы, нарушается прикус и расположение зубив.Рентгенографични изменения заметны и в челюстях включая просветление альвеолярных отростков, истончение кортикальной кости , увеличения пространства мозга и грубых трабекул, которые похожи на изменения, наблюдаемые при серповидно-клеточной анемии пациентов. Высокая концентрация железа объясняет изменение цвета зубов у пациентов с β-талассемии.
1. Выраженный анизоцитоз и пойкилоцитоза
2. базофильная зернистость
3. Спорадические клетки-мишени
> 3. Полихроматический эритроциты
> Приобретенные гемолитические анемии
Токсичные гемолитические анемии вызываются гемолитическими ядами. Нитробензол, фенилгидразин, фосфор, соли свинца окисляющие липиды или денатурируют белки оболочек и частично стромы эритроцитов, что ведет к их распаду. Яды биологического происхождения (пчелиный, змеиный, грибная, стрепто-и стафилолизины) имеют ферментативную активность и расщепляют лецитин эритроцитарных мембран.
Иммунные гемолитические анемии возникают вследствие действия антиэритроцитарных антител, вызывающих повреждения и повышенный гемолиз эритроцитов. В зависимости от характера антигена, действующего различают изоиммунные, гетеро иммунные и аутоиммунные гемолитические анемии.
Во изоиммунного анемиями понимают такие, когда в организм извне проникают антитела против эритроцитов или же эритроциты, против которых у больного есть собственные антитела. Пример — гемолитическая анемия плода и новорожденного. Еще один пример изоиммунной гемолитической анемии — гемолиз после трансфузии групповых-или резус-несовместимых эритроцитов.
Картина крови. Содержание гемоглобина и эритроцитов снижен о . Анемия нормохромного типа. Отмечается анизоцитоз эритроцитов, ретикулоцитоз. Осмотическая резистентность эритроцитов снижена. Количество лейкоцитов в норме. СОЭ ускорена.
Гетероимуннимы гемолитическими анемиями называют такие, которые связаны с появлением на поверхности эритроцита нового антигена, который представляет собой комплекс «гаптен-эритроцит». Чаще всего такие комплексные антигены образуются вследствие фиксации на эритроцитах медикаментозных препаратов — пенициллина, цепорин, фенацетина, хлорпромазина, ПАСК. Гаптенами могут быть и вирусы.
При аутоиммунных гемолитических анемиях антитела вырабатываются против собственных неизмененных эритроцитов. Гемолизом усложняются такие болезни, как хронический лимфолейкоз, лимфосаркома, миеломная болезнь, системная красная волчанка, ревматоидный полиартрит, злокачественные опухоли. Эти формы анемии называют симптоматическими, поскольку они возникают на фоне других заболеваний.
Изменения в полости рта. Есть определенные признаки, которые являются общими для всех гемолитических анемий. Следствием гемолиза является анемия-как результат бледность слизистых. Чаще бледность наблюдается на ногтевой пластине и конъюнктиве глаза. Бледность слизистой оболочки полости рта, особенно на мягком небе, языке, и подъязычных тканях наблюдается если анемия прогрессирует. В отличие от некоторых анемий при гемолитической анемии отмечается желтуха вызвана гипербилирубинемией, которая наблюдается при разрушении эритроцитов. Это лучше всего видно в склере, однако и слизистая неба и тканей дна полости рта также становятся желтушные, когда в сыворотке крови увеличивается билирубин.
Апластическая анемия характеризуется недостаточностью кроветворения — гипоклитинним костным мозгом и панцитопенией в периферической крови.
Этиологические факторы апластических анемий:
2. Цитотоксические химические агенты (алкилирующие, бензол и др..). Химические вещества, лекарства (вследствие иммунологически-опосредованного механизма и идиосинкразии (левомицитин, сульфаниламиды, антитиреоидные, антигистаминные препараты, золото, бутадион и др.).
3. Инфекционные вирусные гепатиты В, С, краснуха, инфекционный мононуклеоз, эпидемический паротит, грипп и др.)., Бактериальные инфекции, микозы, паразитарные инвазии (вследствие прямого и иммунологически-опосредованной цитотоксичности)
4. Аутоиммунная деструкция стволовых клеток.
5. Наследственный (генетический) дефект стволовых клеток.
Патогенез. Резкое снижение численности стволовых клеток в костном мозге приводит к дефициту пула созревающих и зрелых форм, проявлением чего является панцитопения в периферической крови, гипоклитиннисть и жировая инфильтрация костного мозга.
Ст е пен и тяжести апластич еской анем ии
источник