Новые медикаменты и пересадка костного мозга помогут людям с апластической анемией жить полноценной жизнью гораздо дольше.
Кровь — это жизнь. Но редкая болезнь под названием апластическая анемия лишает организм жизни, лишая организм крови. (23.03.2008 — HealthDay Новости). Кровь пациентов с апластической анемией становится обедненной клетками крови, так как костный мозг замедляет их производство. Симптомы заболевания могут варьироваться в зависимости от того, какого типа клеток крови больше всего не хватает. Это может быть хроническая усталость, болезни сердца, бесконечные инфекций, понижение свертываемости крови.
Но есть надежда. Не смотря на то, что как два десятилетия назад, так и как в последнее время, болезнь часто оканчивается смертельным исходом, в настоящее время апластическая анемия становится гораздо более управляемым заболеванием. Достижения в области медикаментозной терапии и успехи в области трансплантации позволили сократить число летальных исходов, что позволяет пациентам жить полноценной жизнью гораздо дольше.
«Мы совершенствуем методы лечение апластической анемии — либо полностью вылечиваем заболевание, либо лечим ее симптомы», говорит д-р Ярослав П. Мациежевский (Dr. Jaroslaw P. Maciejewski, Cleveland Clinic’s Department of Hematologic Oncology and Blood Disorders). И эти успехи помогают врачам лучше понять другие, имеющие более широкое распространение заболевания, такие как болезни сердца и лейкемия.
По данным Национальных институтов здравоохранения ежегодно в США регистрируется 50 тысяч случаев апластической анемии и 20-30 тысяч случаев миелодиспластического синдрома (миелодиспластический синдром или МДС — это подобное апластической анемии заболевание крови, которое возникает тогда, когда костный мозг начинает производить плохо функционирующие или незрелые клетки крови).
Важно отметить, что многие симптомы апластической анемии, такие как усталость и инфекции, также могут быть вызваны другими заболеваниями, говорит д-р Роналд Пакетт (Dr. Ronald Paquette, a blood disease researcher with the University of California, Los Angeles’ Jonsson Comprehensive Cancer Center) специалист по заболеваниям крови в Калифорнийском университете.
Костный мозг — это губчатый материал внутри кости, который производит стволовые клетки, которые в свою очередь превращаются в три типа клеток крови — эритроциты, лейкоциты и тромбоциты. «По существу, костный мозг – это завод крови», — говорит Мациежевский. У больных с апластической анемией, стволовые клетки повреждаются, вследствие чего происходит замедление или остановка производства всех клеток крови.
Причина повреждения стволовых клеток остается неизвестной в более чем половине случаев заболеваний апластической анемией. Согласно научным исследованиям Национального института здоровья есть предположение, что стволовые клетки повреждаются, когда иммунная система человека атакует свои собственные клетки организма по ошибке.
Некоторые случаи апластической анемии были связаны с воздействием токсинов, таких как пестициды, мышьяк и бензол. Инфекционные заболевания также могут привести к нарушениям приводящим к апластической анемии. Это инфекционные заболевания как гепатит, вирус Эпштейна-Барра, цитомегаловирус, парвовирус B19, ВИЧ, а также аутоиммунные заболевания, такие как системная красная волчанка и ревматоидный артрит. Наконец, некоторые генетические нарушения могут привести к апластической анемии.
Симптомы апластической анемии зависят от типа клеток крови, которых больше всего не хватает в организме:
— Недостаток эритроцитов может привести к нехватке кислорода в организме. Люди, у которых низкий уровень эритроцитов нередко чувствуют себя усталыми. Из-за того, что сердце должно работать быстрее и напряженнее, чтобы снабдить органы и ткани кислородом, со временем могут развиться сердечно-сосудистые заболевания.
— Недостаток лейкоцитов может ослабить иммунитет человека. Человек может чаще болеть инфекционными заболеваниями, и обычные болезни могут проходить в тяжелой форме.
— Недостаток тромбоцитов, снижает способность крови свертываться. Пациенты с низким уровнем тромбоцитов могут иметь большое количество синяков и гематом. Возможны кровотечения, которые трудно остановить.
«После того, как человеку поставлен диагноз апластическая анемия необходимо сразу начать лечение», — говорит д-р Пакетт. «Очень важно, чтобы лечение было в специализированном центре, так как это очень редкое заболевание» — сказал он. «Самое главное заключается в том, чтобы вас наблюдал специалист с большим опытом лечения заболеваний на ранней стадии».
Для пациентов моложе 30 лет трансплантация стволовых клеток является предпочтительным методом лечения. Для тех, у кого есть родственный донор (подходящие брат или сестра), проводят трансплантацию стволовых клеток, здоровые стволовые клетки донора заменяет дефектные клетки костного мозга больного человека. По данным Международного фонда апластической анемии и МДС более 80% процентов пациентов полностью выздоравливают (Aplastic Anemia & MDS International Foundation Inc.)
По мнению д-ра Пакетта достижения в области исследования стволовых клеток и препаратов против отторжения донорских клеток привели к тому, что трансплантации от неродственных доноров также становятся все более успешными.
Одним из перспективных направлений лечения является трансплантация стволовых клеток пуповинной крови. «Стволовые клетки пуповинной крови новорожденных младенцев можно замораживать и сохранять в банке клеток, чтобы позже использовать как донорские клетки, как для новорожденного (в случае возникновения у него тяжелых заболеваний), так и для неродственной трансплантации», говорит д-р Пакетт. — «Это очень обнадеживает».
Для пациентов с апластической анемией важно начать лечение как можно скорее. «Как показывают исследования, чем раньше была сделана пересадка костного мозга с момента постановки диагноза, тем лучше результат» — считает Пакетт.
Больные, у которых нет донора, или те, для которых трансплантация невозможна по медицинским показаниям, часто получают иммуносупрессивную терапию такими препаратами как антитимоцитарный глобулин и циклоспорин. По данным Международного фонда апластической анемии и МДС положительная динамика в результате иммуносупрессивной терапии наблюдается в 70-80% случаев.
Переливание крови от подходящего донора также помогает поддержать показатели крови на высоком уровне. Это помогает облегчить симптомы заболевания, хотя этот метод не является эффективными при длительном лечении.
«Так или иначе, вылечиваем ли мы болезнь или нет, в любом случае состояние пациента можно улучшить «, говорит д-р Ярослав П. Мациежевский. — «Теперь мы можем сохранить жизнь людям с апластической анемией или продлить им жизнь на долгие годы».
источник
О халатности врачей, о влиянии связей на выздоровление и о стрессе, который помог справиться с болезнью без операции
Апластическая анемия — крайне редкое заболевание кровеносной системы. В Европе на миллион человек приходится двое больных. В Азии же апластическая анемия встречается в три раза чаще. Каждый год погибает не менее 2/3 заболевших. Примерно половина больных может прожить более пяти лет без трансплантации костного мозга, но с полноценным современным медикаментозным лечением. В 50% случаев причина недуга неизвестна.
Февраль 2014 года. Все началось с того, что в десятом классе меня ударила своим тяжелым сапожищем одноклассница. До сих пор не понимаю, что на нее нашло. Было невероятно больно. На ноге размером с кулак появился синяк, который долгое время не проходил.
Через неделю возле синяка появились красные точки на ноге. Я стал жаловаться на плохое самочувствие, и мама дала мазь, которая «должна помочь». Результата не было. Тогда мы пошли в поликлинику.
Стоит сказать, что из себя представляют казахстанские медицинские заведения. Наши поликлиники – та еще параша. Там сидел самый ******** (непрофессиональный) хирург. Он взглянул на мои ноги и смог определить плоскостопие, когда я был в зимних сапогах. Огромные зимние сапоги на широкой подошве. Во время приема он не мог оторваться от планшета. Наконец, когда врач решил сделать осмотр ноги, он выдал: «Видишь, у тебя синяк. Пространство загноилось. Нужно резать и чистить. Красные точки пройдут, когда вы все прочистите».
После мы направились в другую поликлинику, где меня должны были прооперировать. Врачи той больницы посмотрели мою ногу и уверили, что красные точки — не последствие синяка. Если быть точнее, назвали точки «системным сбоем» в кровоснабжении. Однако мама не поверила и настояла на том, чтобы мне сделали рентген ноги. Они очень долго спорили, но все же пришли к компромиссу: я пошел и на рентген, и на сдачу крови.
На снимке ноги ничего страшного не было: ни воспалений, ни явных нарушений. Самое интересное было в анализе крови, потому что спустя 15 минут после сдачи к нам подошли врачи и предупредили: «Наш аппарат сломался. Он показывает совершенно невероятные цифры». Когда прибор починили, я сдал кровь заново. Оказалось, что проблема не в устройстве. Результаты анализа очень печальные. Мама без лишних слов сказала: «Все, сынок, мы уходим».
Мама звонила всем знакомым, родственникам в поиске правильных врачей; она отказывалась верить результатам. Я же еще не до конца понимал, что происходит. Когда она предложила поехать в суперкрутую частную клинику для важных людей, все, что я сказал — «завтра же школа».
В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала
В той клинике договорились о полном обследовании: провели анализ крови и осмотрели не только ногу, но и брюшную полость, сердце, голову. Взяли кровь — их аппарат тоже «дал сбой». Я чувствовал неладное. Врачи сделали повторный забор. Нам принесли анализы, и это был первый раз, когда я успел выхватить листочек с анализами и просмотреть его до мамы. Стало понятно, в какой ситуации я оказался. В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала.
Наши поиски хороших врачей этим не закончились. Мы поехали в Центр детской хирургии. Я к тому времени просто запарился ездить и ждать; я устал. Мама разговаривала с бесконечным количеством врачей центра. Однако позиция заместителя главного врача была довольно ясна: не могут принять меня. Затянулось бы надолго, если бы мама не позвонила человеку, которому можно было позвонить. Только тогда больница согласилась меня принять, и врач уверил мою маму, что мной займутся профессионалы.
Именно в этом центре и поставили предварительный диагноз — апластическая анемия. Костный мозг перестал производить достаточные количества всех основных видов клеток крови. Никто так и не понял, почему недуг у меня появился. Я не подходил ни по одной из причин развития болезни. Опять-таки диагноз был пока только догадкой. Для того чтобы поставить точное заключение, нужно было меня оперировать, но этого они сделать не могли. Анализы выявили 3 тысячи тромбоцитов из нужных 180 тысяч. Это означало: кровь практически не свертывается. Поэтому мне начали переливать кровь, чтобы подготовить к операционному столу, но вены не выдерживали тех объемов, что вливали. Нужно было ставить катетер, а для этого нужна операция. Получался замкнутый круг. В итоге мои руки стали похожи на руки отпетого наркомана из-за синяков, появлявшихся каждое переливание.
Походы на процедуры, бесконечные кабинеты — всё это надоело. Я делал на автомате то, что мне говорили, и перестал следить за действиями врачей. Контролировала мама. Дошло до того, что она проверяла каждую ампулу. Иммунитет начал стремительно лететь к чертям. Организм стал воспринимать костный мозг как враждебный и чужеродный орган, поэтому включил все ресурсы для его ликвидации. Вся ирония в том, что иммунные клетки вырабатывает именно костный мозг. Мой организм боролся сам с собой. Отказывать стала печень. Началась поддерживающая терапия. Так долго продолжаться не могло, еще немного и организм бы просто не выдержал. Родственники морально готовили маму к моей смерти. Врачи же решили разорвать этот круг. Влили мне большее, чем обычно, количество крови. Провели операцию, чтобы поставить катетер в вену и узнать процент оставшегося костного мозга.
После операции выяснилось, что в организме всего десять процентов незараженного участка костного мозга. Местные и даже республиканские врачи отказывались меня лечить. Все ссылались на то, что не потянут. Предупредили: «Если хотите, чтобы сын выжил, нужно искать врача за пределами страны». Мы решили обратиться в другие клиники. Когда я выписывался из больницы в Алматы, мне дали пройтись без катетера целые сутки. То был блаженный день: не нужно было таскаться с огромным штативом, на котором висела куча препаратов. Наконец, я принял ванну как нормальный человек.
Вообще, у нас был выбор: Россия, Литва или Беларусь. Мы решили поехать в Россию.
В Москве есть клиника, которая строилась под надзором Путина. Национальный научно-практический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва. Невероятно элитарная больница в Москве, куда мы и отправились. Изначально они нас не приняли. Тогда мы через знакомых вышли на директора этой клиники. Как оказалось, что в Казахстане, что в России, всё решают связи.
В этом центре врач решил заново подтвердить диагноз и поставить катетер. Это значит — новая операция. Когда диагноз подтвердился, на удивление, врачи не стали пугать меня. Прогнозировали 70 % полного выздоровления. Не было разговоров о том, что я останусь инвалидом или умру. Они сказали забыть о всяческих терминах и специальных словах, потому что в процессе выздоровления я и мое стремление будут играть огромную роль.
На дворе был апрель. Лечение долго не могли начать. Показатели кровяных клеток оставались на минимальном уровне, иммунитет крайне ослаб. Количество лейкоцитов стало меньше допустимого в четыре раза. Если рядом со мной кто-то чихал, я мог слечь с температурой под 40. Мне давали жаропонижающее, но препарат помогал только в течение получаса. А потом температура вновь поднималась и меня лихорадило. Именно из-за такого состояния химиотерапию начали только через полторы недели после приезда в Москву.
Химиотерапия — процесс, когда я в принципе не чувствовал ничего. Мне было стабильно нормально. Вот после терапии стало намного хуже: если раньше хватало пол-литра крови на три дня, то после мне стали вводить это количество в день, затем — 750 мл, 850 мл и так далее. Я практически потреблял по литру крови в сутки. Параллельно с этим печень стала сильно сдавать от этого количества крови и от препаратов. Чтобы хоть как-то помочь организму, мне выписали строжайшую диету: нельзя жареное из-за нагрузки на печень, нельзя мучное или кисломолочное. За две недели я похудел практически на 15 килограмм.
Через месяц после химиотерапии показатели крови стали расти. Конечно, они не доходили даже до 50 % нужной цифры, но жить уже было можно. Прогресс был. Поэтому процесс переливания завершился. Меня переселили в корпус для тех, у кого была ремиссия, и я смог выбираться гулять по Москве. В июне было состояние, когда я мог передвигаться сам. Правда, всего 20 метров, но и это была маленькая победа. Я попросил врачей выписать меня, и мы улетели в Алматы.
Два месяца я довольно хорошо себя чувствовал, пока в августе на очередном обследовании мои показатели крови опять не упали. Две недели подряд после этого вновь началось: врачи, анализы, бесконечные звонки. За это время на фоне стресса показатели крови повысились, но местные врачи опасались таких скачков. Они предложили полететь в Турцию, чтобы сделать пересадку костного мозга. Опять стресс — количество кровяных клеток поднялось почти до нормы. Можно было остаться здесь, но в Турцию мы все же поехали. Правда, там операцию проводить отказались, бессмысленно было делать трансплантацию при нормальных результатах. Мы вернулись уверенные в том, что теперь все нормально. Такое чудесное выздоровление не редкость: одному знакомому не помогали таблетки, но сильный стресс нормализовывал результаты.
Мы платили за процесс лечения сами, потратили за три месяца 5 миллионов рублей по старому курсу. Государство никак не участвовало в этом, хотя просьбы были. Финансово помогали друзья и знакомые. Они перечисляли деньги на наш счет.
Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь
В Казахстане болеть вообще зашкварно. Если у вас нет денег лечиться за границей, то мне вас искренне жаль. Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь.
Сейчас мне 20 лет, и вот уже три года чувствую себя нормально. По сей день рецидивов не было. Я постоянно на дорогостоящих таблетках; это и поддерживает мою жизнь. Кратчайшее прекращение курса лечения может привести к скачку в анализе крови. Прогнозы говорят, что скоро заболевание может проявиться вновь, но я не живу в ожидании очередного черного периода и стараюсь радоваться каждому благополучно прожитому дню.
источник
Апластическая анемия – это состояние, при котором организм перестает вырабатывать достаточное количество новых кровяных телец.
Апластическая анемия вызывает у больных слабость и утомляемость, а также делает их очень подверженными инфекциям и кровотечениям.
Апластическая анемия, редкое и серьезное состояние, может возникнуть в любом возрасте.
Апластическая анемия может развиться внезапно, но может прогрессировать медленно, месяцами ухудшая состояние больного. Современное лечение апластической анемии включает переливания крови, лекарственные препараты и трансплантацию костного мозга.
Апластическая анемия возникает при повреждении костного мозга, которое приводит к замедлению или полному прекращению выработки клеток крови. Костный мозг представляет собой красное губчатое вещество внутри костей, которое постоянно вырабатывает новые клетки крови – эритроциты, лейкоциты, тромбоциты. При апластической анемии больной костный мозг описывают терминами «апластический» или «гипопластический», что означает либо полное отсутствие в нем молодых кровяных телец, либо очень малое их количество.
Факторы, которые временно или необратимо нарушают кроветворную функцию костного мозга, включают:
• Радиоактивное облучение. Человек может стать жертвой радиации как в результате аварий на атомных объектах, так и в результате медицинского облучения – например, при лечении рака.
• Химиотерапия при раке. Воздействие многих химиотерапевтических препаратов плохо сказывается не только на раковых клетках, но и на других интенсивно делящихся клетках организма.
• Токсичные вещества. Воздействие токсинов из окружающей среды, таких как инсектициды, пестициды, лабораторные реактивы, может пагубно повлиять на костный мозг. При этом больному иногда становится лучше, если воздействие химикатов прекратится.
• Некоторые лекарства. Препараты для лечения ревматоидного артрита, некоторые антибиотики могут вызывать апластическую анемию. Данный побочный эффект обязательно должен быть указан в инструкции к препарату.
• Аутоиммунные заболевания. Это большая группа заболеваний, при которых иммунная система организма ошибочно атакует клетки хозяина. Жертвами иммунитета могут стать и клетки костного мозга.
• Вирусная инфекция. Некоторые вирусы играют роль в развитии апластической анемии. Последние исследования позволяют причислить к таким опасным организмам вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), парвовирус В19 и вирус иммунодефицита человека (ВИЧ).
• Беременность. Апластическая анемия, которая возникает при беременности, может быть связана с аутоиммунной проблемой – иммунная система беременной иногда ошибочно атакует костный мозг.
• Неизвестные факторы. Во многих случаях врачи не могут установить точную причину апластической анемии. Тогда говорят о так называемой идиопатической апластической анемии.
Апластическую анемию не стоит путать с миелодиспластическим синдромом.
Это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При миелодиспластическом синдроме костный мозг иногда характеризуют как «гиперпластический» — это означает, что в нем содержится много кровяных телец. Но у некоторых больных с этим синдромом костный мозг почти пуст, поэтому болезнь иногда путают с апластической анемией.
Апластическая анемия связана с некоторыми другими заболеваниями. У части больных с апластической анемией имеется другая редкая болезнь – пароксизмальная ночная гемоглобинурия. Эта болезнь характеризуется слишком быстрым разрушением эритроцитов.
Анемия Фанкони – это редкая, наследственная болезнь, которая приводит к апластической анемии. Дети с болезнью Фанкони могут иметь различные врожденные дефекты, такие как недоразвитие конечностей. Болезнь диагностируется при помощи генетического анализа.
Апластическая анемия встречается редко.
• Лучевая или химиотерапия рака в прошлом.
• Воздействие токсичных веществ на производстве и в быту.
• Использование рецептурных препаратов, таких как хлорамфеникол (Левомицетин) и некоторые средства против ревматоидного артрита.
• Некоторые заболевания кроветворной системы.
• Тяжелые инфекционные заболевания.
• Аутоиммунные процессы.
• Беременность (редко).
Признаки болезни появляются в результате снижения количества тех или иных кровяных телец.
Признаки апластической анемии могут быть следующими:
• Слабость.
• Одышка при напряжении.
• Быстрое или нерегулярное сердцебиение.
• Бледность кожных покровов.
• Частые и тяжелые инфекции.
• Склонность к появлению синяков.
• Кровотечения из десен и носа.
• Длительные кровотечения после порезов.
• Кожная сыпь.
• Головокружение.
• Головные боли.
Апластическая анемия может прогрессировать медленно, неделями и месяцами. Болезнь может быть короткой и проходящей, а может стать хронической. Апластическая анемия требует серьезного отношения, потому что в тяжелых случаях она заканчивается фатально.
Для диагностики этого заболевания врач может назначить следующее:
• Анализы крови. В крови здорового человека уровень эритроцитов, лейкоцитов и тромбоцитов находится в определенных пределах. Эти пределы могут варьировать в зависимости от возраста, пола, расы и других особенностей организма. Но если в анализах обнаружится очень низкий уровень всех трех классов клеток крови, то врач заподозрит апластическую анемию.
• Биопсия костного мозга. Для подтверждения диагноза больному придется пройти болезненную, но необходимую процедуру биопсии. Во время биопсии врач введет специальную иглу в одну из костей и возьмет образец костного мозга. Клетки костного мозга изучат под микроскопом, чтобы увидеть признаки апластической анемии или других заболеваний. При апластической анемии костный мозг будет содержать мало кровяных клеток.
После того, как подтвердится апластическая анемия, врачи назначат дополнительные обследования, чтобы выяснить причину болезни. Это может быть длительный и сложный процесс.
Лечение апластической анемии в легких случаях может состоять в простом наблюдении за пациентом. При более тяжелой форме болезни могут применяться переливания крови, трансплантация костного мозга и специальные препараты, которые стимулируют кроветворение. Тяжелая апластическая анемия угрожает жизни человека и требует обязательной госпитализации.
При низком уровне тромбоцитов или эритроцитов больным переливают донорскую кровь. Это не вылечит апластическую анемию, но поможет контролировать ее симптомы, восполняя кровяные клетки, которые не вырабатывает больной костный мозг. Для переливания могут использовать отдельную массу, состоящую из эритроцитов или тромбоцитов – в зависимости от потребностей больного.
Обычно нет ограничения количества переливаний для одного больного. Но у такой процедуры могут быть осложнения. Переливаемые кровяные тельца содержат железо, которое высвобождается при их разрушении и накапливается в теле. При многократном переливании в организме откладываются большие запасы железа, которые повреждают жизненно важные органы, если не назначить специальные препараты для его выведения.
Другое осложнение заключается в том, что организм может вырабатывать антитела к переливаемым клетках. А это сделает лечение менее эффективным.
Пересадка стволовых клеток, чтобы «перезапустить» костный мозг больного – это иногда единственный способ успешного лечения апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является методом выбора для больных молодого возраста, имеющих подходящего донора. Чаще всего подходящим донором выступает брат или сестра.
Если донор найден, то костный мозг больного сначала истощают высокими дозами радиации или химиотерапией. Далее здоровые стволовые клетки донора фильтруют из его крови, после чего вводят их в кровоток больного. Клетки сами мигрируют в полости костей и начинают там вырабатывать кровяные тельца, как это предусмотрено природой. Но вся процедура очень сложная, дорогостоящая и требует длительного пребывания в больнице. После трансплантации больной должен получать лекарства для профилактики отторжения донорских клеток.
Трансплантация влечет за собой риски. Есть вероятность, что организм начнет отторгать трансплантат. Эта реакция может быть фатальной для реципиента. Кроме того, не каждому больному удается найти донора, который совместим по всем параметрам.
Больные с аутоиммунными заболеваниями, которые повредили костный мозг, нуждаются в лечении иммуносупрессорами – препаратами, подавляющими иммунитет.
Препарат циклоспорин (Генграф, Неорал) и антитимоцитарный глобулин (Тимоглобулин) могут использоваться в качестве примера. Эти лекарства подавляют активность иммунных клеток, которые атакуют костный мозг. Лечение помогает восстановить костный мозг и повысить уровень клеток крови. Два названных выше препарата нередко используют в комбинации.
Кортикостероидные гормоны, такие как метилпреднизолон (Солу-Медрол, Медрол, Метипред), также назначают для подавления иммунитета, иногда наряду с другими лекарствами.
Иммуносупрессоры могут быть очень эффективными при апластической анемии. Обратной стороной медали является то, что подавление иммунитета приводит к риску инфекций. Кроме того, есть возможность, что после отмены лекарств апластическая анемия вернется.
Некоторые препараты помогают усилить кроветворение в костном мозге. Среди них колониестимулирующие факторы, такие как сарграмостин (Лейкин), филграстим (Нейпоген), пегфилграстим (Нейласта) и эпоэтин-альфа (Прокрит, Эпоген). Эти препараты разработаны относительно недавно, их получение является очень дорогим и трудоемким процессом, поэтому стоимость препаратов для среднестатистического больного просто фантастическая. Колониестимулирующие факторы нередко назначают наряду с иммуносупрессорами.
Апластическая анемия сопровождается понижением уровня лейкоцитов и ослаблением иммунной защиты организма. Это делает организм больного очень восприимчивым к различным бактериальным, вирусным и грибковым инфекциям.
При первых признаках инфекций, таких как жар, следует сразу же обращаться к врачу. У человека с ослабленным иммунитетом мало шансов на то, что банальная простуда пройдет «просто так». Безобидная для других людей инфекция может стать опасной для жизни, поэтому врач будет использовать антибиотики, противовирусные и другие препараты для лечения и профилактики.
Апластическая анемия, вызванная радиацией или химиотерапией рака, обычно улучшается после отмены лечения. То же самое касается многих лекарств и токсинов, которые поражают костный мозг.
Беременные женщины с апластической анемией получают переливания крови, потому что другие способы лечения нанесут непоправимый вред ребенку. У многих беременных апластическая анемия проходит сама по себе вскоре после родов. Если этого не произошло, требуется дальнейшее лечение.
Советы для больных апластической анемией:
• Отдыхайте, когда вам это нужно. Анемия может вызвать утомляемость и одышку, даже при незначительной нагрузке. Делайте перерывы в работе, если вы устали, берегите свои силы.
• Избегайте контактных видов спорта. Из-за высокого риска кровотечений, связанных с тромбоцитопенией, контактный спорт может вызвать проблемы. Незначительный порез, синяк, падение – и кровь будет трудно остановить.
• Защитите себя от микробов. Вы можете уменьшить риск инфекций, если будете чаще мыть руки, избегать больных людей и соблюдать правила гигиены. При первых незначительных признаках инфекции немедленно обращайтесь к врачу.
источник
На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
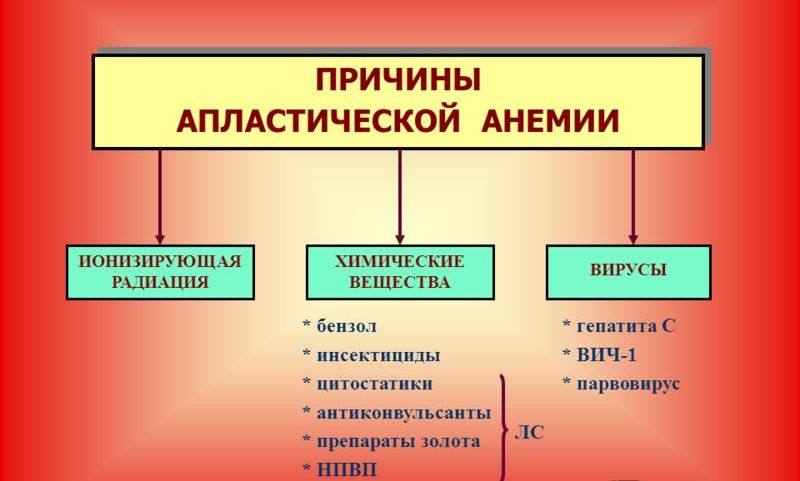
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
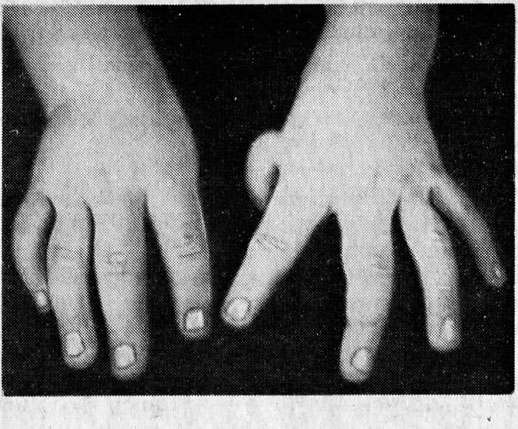
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
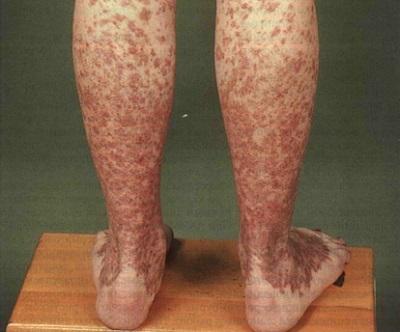
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
источник
Апластическая анемия – заболевание системы крови, заключающееся в аплазии (отсутствии формирования) клеток костного мозга, в результате чего развивается дефицит форменных элементов крови – панцитопения. Сходным с этим являются процессы гипоплазии, когда процессы кроветворения происходят в меньшем объёме, чем необходимо и развивается гипопластическая анемия. Обычно эти два понятия объединяют общим понятием апластической анемии.
Когда не известны причины, вызвавшие развитие заболевания, оно носит название идиопатическое. Такое встречается в большинстве случаев. Но иногда всё-таки удаётся установить причину. Ей может быть:
- действие ионизирующего излучения;
- токсины – бензол, инсектициды;
- лекарственные препараты – хлорамфеникол, нестероидные противовоспалительные средства, цитостатики;
- вирусы гепатита, Эбштейна — Барра;
- заболевания иммунной системы;
- генетические нарушения при созревании клеток костного мозга.
Наличие дефекта в стволовых клетках или снижение количества приводит к их низкой пролиферативной активности. Другим механизмом развития апластической анемии является нарушение регуляции иммунокомпетентными клетками процессов созревания ростков крови (гемопоэз). Патология микроокружения – один из возможных путей, приводящих к угнетению синтеза клеток крови или их полному отсутствию.
Возможно сочетание нескольких механизмов в развитии апластической анемии.
Анемия Фанкони – наследственное заболевание с аутосомно-рецессивным типом наследования. В результате мутации образуются белки, нарушающие процессы репарации (восстановление структуры) ДНК. Это приводит к высокой чувствительности и к повреждениям нуклеиновой кислоты, сопровождается прогрессированием нарушений костномозгового кроветворения и повышенной вероятностью развития опухолей.
Все основные симптомы апластической анемии возникают из-за дефицита клеток крови и нарушения их функции. Дефицит тромбоцитов приводит к развитию геморрагического синдрома, лейкоцитов (агранулоцитоз) – пониженному иммунитету, эритроцитов – анемическому синдрому.
Как уже было отмечено ранее, возможны острое и хроническое течение апластической анемии. У 15% больных заболевание протекает остро и сопровождается повышенной температурой тела, множественными кровоизлияниями. При врождённой форме (анемия Фанкони) возможны отставание в росте и развитии, «кофейные» пятна на кожном покрове.
Анемический синдром проявляется головокружением, мельканием «мушек» перед глазами, слабостью.
Лейкоцитопения – низкий уровень лейкоцитов сопровождается присоединением бактериальной инфекции.
Геморрагический синдром – проявляется кровотечениями (носовыми, десневыми, маточными), высыпаниями на коже. При кровоизлиянии в глазное дно это может проявляться снижением остроты зрения. Чаще всего это характерно для лиц молодого возраста с тяжёлой степенью апластической анемии.
Диагноз подтверждается на основании клинических симптомов, лабораторных и инструментальных методов исследования. Характерные симптомы апластической анемии указаны выше.
В первую очередь из лабораторных анализов назначается общий анализ крови, в котором отражается уровень всех форменных элементов. Как уже упоминалось не раз, будет наблюдаться панцитопения – низкие уровни клеток крови.
Обнаруженная анемия характеризуется по цветному показателю. При апластической анемии она нормохромная или возможна незначительная гиперхромность. Ретикулоциты снижены или отсутствуют. Показатели СОЭ (скорость оседания эритроцитов) будут повышены. Низкий уровень лейкоцитов возникает за счёт дефицита гранулоцитов, отмечается относительный лимфоцитоз. Нарушается структура тромбоцитов и их функциональные способности.
Проводят пункцию костного мозга. Характеристика полученного пунктата будет зависеть от того попала ли игла в угнетённый очаг или в остатки нормально функционирующего костного мозга. В первом случае пунктат будет обеднён клеточными элементами, снижено количество молодых форм гранулоцитов, повышено процентное количество лимфоцитов, также нарушены процессы дифференцировки и пролиферации.
Обнаружение бластных клеток в пунктате не имеет отношения к апластической анемии, значит, следует искать другой патологический процесс, сходный с этим по клиническим проявлениям и нарушениям созревания кроветворных клеток.
Отмечается отложение избытка железа в виде пигмента в печени, селезёнке, костном мозге. Для правильной диагностики необходимо выяснить, что могло привести к сниженному уровню лейкоцитов (токсические вещества, лекарственные средства, инфекционные агенты, аутоиммунные поражения, хронические воспалительные процессы, гипотиреоз).
Анемия, похожая на апластическую, может возникать при парциальной красноклеточной аплазии. При таком состоянии изолированно нарушаются процессы синтеза и дифференцировки клеток эритроидного ряда, возможна выработка антител к клеткам костного мозга.
Диагноз апластической анемии ставится при наличии любых 2 критериев из перечисленных ниже:
- уровень гемоглобина менее 100 г/л;
- уровень лейкоцитов менее 3,5 * 109 /л (содержание гранулоцитов менее 1,5 * 109/л);
- гипоклеточный костный мозг и уровень тромбоцитов менее 50 * 109/л.
Характеристика степеней тяжести апластической анемии представлена в таблице 1.
Таблица 1. Критерии степени тяжести апластической анемии.
| Степень тяжести | Критерии |
| Умеренная |
|
| Тяжёлая |
|
| Очень тяжёлая |
|
Основным методом лечения апластической анемии является восстановление количества кроветворных клеток, а также назначение иммуносупрессивной терапии для подавления иммунных реакций. Самым действенным методом считается пересадка стволовых кроветворных клеток.
При трансплантации костного мозга необходимо тщательно проводить оценку на совместимость донора и реципиента во избежание патологии «трансплантат против хозяина».
Отмечается тот факт, что при апластической анемии, вызванной химиотерапией и врождённых формах, терапия иммуносупрессорами не является эффективной.
К иммуносупрессивной терапии относятся:
- антилимфоцитарный иммуноглобулин;
- циклоспорин;
- глюкокортикоиды;
- цитостатики.
Обратите внимание, что самолечением не стоит заниматься, так как у каждого лекарственного средства есть свои показания, противопоказания, побочные эффекты.
Не разрешается употреблять иммуносупрессивные препараты при наличии инфекционно-воспалительного процесса, тяжёлых нарушении сердечно-сосудистой системы, печени, почек, не купируемом геморрагическом синдроме.
При любой терапии необходим контроль за пациентом со стороны медицинского персонала для оценки возможных аллергических реакций, которые могут возникнуть на компоненты лекарственного средства. Может быть отсроченная аллергическая реакция, проявляющаяся спустя 2 – 3 дня.
Использование ростовых факторов обеспечивает поддержание гранулоцитов на уровне 1 – 1,5 * 109/л. В качестве дополнительного метода лечения может быть назначен лимфоцитоплазмаферез. Он оправдан при наличии аллергической реакции или формировании антител к форменным элементам крови. Ещё одним направлением лечения апластической анемии является терапия, проводимая против основных осложнений: инфекционных, геморрагических, аллергических. В некоторых случаях проводится переливание тромбоцитарной и эритроцитарной масс.
Таблица 2. Показания к назначению трансфузии эритроцитарной массы и тромбоконцентрата.
| Комноненты крови для гемотрансфузии | Показания |
| Эритроцитарная масса | Гемоглобин менее 90 г/л Гематокрит менее 30% |
| Тромбоцитарная масса | Кровотечения на фоне низкого уровня тромбоцитов (10 – 20 * 109/л) |
Для оценки терапии используют понятие ремиссии. Улучшение костномозгового кроветворения – неполная (частичная) ремиссия, позволяет пациенту избегать зависимости от переливания крови. Число гранулоцитов в крови составляет более 0,5 * 109/л, что снижает риск тяжёлых инфекционных осложнений. Полная ремиссия сопровождается отсутствием клинических проявлений, уровень гемоглобина приходит в норму, количество тромбоцитов больше 100 * 109/л, гранулоцитарных лейкоцитов – 1 * 109/л.
Исход заболевания зависит от глубины и тяжести поражения костномозгового кроветворения. Прогноз может быть неблагоприятным при неожиданном резком развитии апластической анемии.
Профилактика развития апластической анемии заключается в ограничении влияния на организм неблагоприятных внешних факторов. Необходимо соблюдать правила техники безопасности при работе с ионизирующими излучениями, бензолом, избегать бесконтрольного приёма лекарственных средств, лечить заболевания органов и систем, приводящих к снижению гемопоэза, например, патология почек, цирроз печени.
При подтверждённой апластической анемии необходимо наблюдение за состоянием пациентов, постоянный контроль за уровнями форменных элементов, чтобы не пропустить рецидив и возможные осложнения.
Подводя итог всему вышесказанному, следует обратить внимание на то, что апластическая анемия может развиться неожиданно без какого-либо провоцирующего действия, приводить к геморрагическому, анемическому синдрому, вызывать инфекционно-воспалительные осложнения. Однако своевременно назначенная терапия грамотного специалиста позволит избежать неблагоприятного исхода.
Мы приложили много усилий, чтобы Вы смогли прочитать эту статью, и будем рады Вашему отзыву в виде оценки. Автору будет приятно видеть, что Вам был интересен этот материал. Спасибо!
источник
Апластическая анемия – это наследственная или приобретенная патология крови, обусловленная поражением стволовых клеток костного мозга, вследствие которого развивается глубокое угнетение гемопоэза. Первые сведения о апластической анемии были получены еще в 1888 году, однако как самостоятельная нозологическая единица апластическая анемия была зарегистрирована только в 1904 году.
Гипопластическая анемия относится к самой тяжелой форме нарушения кроветворения, так как летальность при апластической анемии достигает порога 80%.
Не следует путать апластичесую анемию, которая является отдельной нозологической формой с гипопластическим синдромом, который является лишь одним из многочисленных проявлений различных заболеваний, сопровождающихся нарушением функции кроветворения костного мозга.
К счастью, частота встречаемости случаев апластической анемии не превышает 5 эпизодов на 1000000 населения, но опасность данной патологии заключается в том, что она поражает в основном лиц детского и молодого возраста. Половая принадлежность не имеет влияния на течение и исход заболевания.
Данная патология относится к категории полиэтиологичных заболеваний, то есть существует множество причин, одна из которых может занять доминирующую позицию и спровоцировать нарушение в системе кроветворения у того или иного больного. Кроме того, различают так называемые факторы риска, то есть предрасполагающие факторы, совокупность которых может не только поспособствовать развитию заболевания, но и усугубить течение патологического процесса. К счастью, в большинстве случаев удается распознать этиологический фактор, который стал первопричиной развития признаков анемии, но встречаются ситуации, когда определить этиопатогенетический фактор не удается и в таком случае устанавливается диагноз «идиопатическая апластическая анемия».
Часто апластическая анемия выступает в роли побочной реакции от применения определенных групп лекарственных средств, причем возникновение ее не зависит ни от дозы, ни от продолжительности приема данного препарата. К лекарственным средствам, способным провоцировать нарушения всех ростков кроветворения в костном мозге относятся: антигистамины, сульфаниламиды, антибиотики тетрациклинового ряда, а также препараты золота. Особенно часто апластическая анемия встречается у лиц, принимающих Левомецитин.
Отдельно следует упомянуть роль ионизирующего излучения, применяющегося в рентгенологических методах исследования, в возникновении признаков апластической анемии. Данная патология встречается среди лиц, работающих в рентгенологических кабинетах и у пациентов, подвергающихся радиоволновой терапии.
Кроме того, провокаторами апластической анемии могут стать заболевания вирусной этиологии в остром периоде (вирусный , и герпетическая инфекция, ВИЧ).
Среди гематологов существует мнение, что во время беременности повышается риск возникновения апластических нарушений в костном мозге, однако патогенетического объяснения этому процессу пока не найдено. Следует отметить, что выявление признаков апластической анемии является абсолютным показанием для прерывания беременности, и зарегистрированы случаи перехода заболевания в стадию ремиссии после искусственного родоразрешения.
Еще одной причиной возникновения апластической анемии является токсическое воздействие на организм препаратов, применяющихся в качестве химиотерапии для лечения онкопатологии, а также длительное пребывание в условиях воздействия паров пестицидов и инсектицидов.
Среди причин нарушения кроветворной функции костного мозга следует рассматривать и аутоиммунные заболевания, при которых иммунные механизмы направлены на уничтожение не только болезнетворных агентов, но и на повреждение собственных клеток костной ткани.
Для апластической анемии характерно медленно-прогрессирующее течение со склонностью к переходу в хроническую форму с периодами обострений.
Все клинические симптомы, наблюдающиеся при апластической анемии можно отнести к одному из трех основных синдромов: анемического, геморрагического или симптомокоплекса инфекционных осложнений. Появление признаков того или иного синдрома является следствием угнетения одного или нескольких ростков кроветворения.
Основными жалобами пациентов при развитии признаков анемического синдрома, обусловленного недостаточным уровнем гемоглобина и эритроцитов в периферической крови, являются: выраженная слабость и снижение трудоспособности, и шум в ушах при сохранности слуха, чувство нехватки воздуха и приступы учащения сердцебиения.
Первыми признаками возникновения геморрагического синдрома у пациента с апластической анемией является появление кровоподтеков и гематом на кожных покровах нетравматического происхождения. Пациенты с апластической анемией часто жалуются на носовые кровотечения, а также кровоточивость десен. При выраженном угнетении тромбоцитарного ростка кроветворения может возникнуть кровоизлияние в головной мозг.
Симптомами снижения уровня лейкоцитов, как одного из патогенетических звеньев апластической анемии, является предрасположенность к заболеваниям инфекционной природы. Такие больные относятся к категории «часто болеющие», то есть в течение года у них наблюдается более десяти эпизодов инфекционных заболеваний. Выраженное угнетение выработки лейкоцитов провоцирует гнойно-септические осложнения (язвенно-некротическая , отит, постинфекционные абсцессы, генерализованный сепсис).
Уже при первичном осмотре пациента можно определить характерные симптомы апластической анемии: выраженная бледность и синюшность кожных покровов с наличием кровоподтеков, не имеющих четких границ, а иногда и мелкоточечной петехиальной сыпи. Увеличение границ печени и появление отеков нижних конечностей свидетельствуют о развитии признаков . Аускультативно отмечается склонность к гипотензии, и грубый систолический шум во всех аускультативных точках. Важным диагностическим признаком апластической анемии является неизмененная в размерах селезенка.
Степень проявления того или иного симптомокомплекса напрямую зависит от степени угнетения ростков кроветворения. Апластическая анемия тяжелой формы имеет такие диагностические критерии: уровень нейтрофилов менее 0,5×109/л, тромбоциты менее 20×109/л, корригированное увеличение ретикулоцитов менее 1%. Если у больного имеется хотя бы один из этих критериев в сочетании с выраженным снижением клеточности костного мозга, то это является поводом для установления пациенту диагноза «гипопластическая анемия тяжелой степени».
В детском возрасте чаще дебютируют врожденные типы апластических анемий, к которым относятся анемии Фанкони и Блекфена-Даймонда.
Анемия Фанкони представляет собой наследственную патологию, наследуемую по аутосомно-рецессивному типу, то есть случаи заболевания наблюдаются только в семьях, где оба родителя являются носителями патологического гена. Проявляется анемия Фанкони не только в глубоком угнетении всех типов кроветворения, но и в появлении аномалий развития.
Дебют заболевания приходится на возраст 4-12 лет, но гематологические проблемы могут возникнуть непосредственно после рождения ребенка. К врожденным аномалиям относятся: несоответствие костного возраста паспортному, аномалии развития костной ткани, органов мочеполовой системы, отставание в психомоторном развитии. Гематологические изменения проявляются в более позднем возрасте (в среднем по достижению 9 лет) и в клинической картине преобладают симптомы геморрагического симптомокомплекса, после чего прогрессивно нарастают признаки лейкоцитопении и эритроцитопении.
Данная патология имеет стремительное прогрессирующее течение, поэтому при отсутствии адекватного лечения летальный исход наступает в течение 6 месяцев. Причиной смерти чаще всего является массивное желудочно-кишечное кровотечение или мозговое кровоизлияние. Осложнениями анемии Фанкони является трансформация заболевания в острый , а также онкопатология органов желудочно-кишечного тракта. Единственным эффективным методом лечения врожденной анемии Фанкони является трансплантация костного мозга.
Анемия Блекфена-Даймонда относится к группе спорадических наследственных патологий крови и характеризуется поражением исключительно эритроцитарного ростка кроветворения. Дебют заболевания наблюдается в течение первого года жизни ребенка.
Дети с анемией Блекфена-Даймонда имеют типичный фенотип: бледные кожные покровы, крупная верхняя губа, широко поставленные глаза, сухие секущиеся волосы, отставание костного возраста от паспортного.
Характерным изменением лабораторных показателей периферической крови является прогрессирующая нормохромная анемия при полной сохранности пролиферации клеток тромбоцитарного и гранулоцитарного ряда.
Данная патология характеризуется вялотекущим хроническим течением со склонностью к спонтанной ремиссии. Предпочтительным методом лечения является применение кортикостероидной терапии, а также по жизненным показаниям переливание эритроцитарной массы.
В детском возрасте приобретенные формы апластической анемии встречаются крайне редко и проявляются теми же симптомами, что и у взрослых при полном отсутствии врожденных патологий.
При наличии у ребенка признаков нарушения кроветворной функции костного мозга обязательно необходимо проводить дифференциальную диагностику с такими заболеваниями как: острый лимфобластный и миелобластный лейкоз, мегалобластная анемия, синдром гиперспленизма, метастатическое поражение костного мозга.
Ребенок с подозрением на врожденную апластическую анемию обязательно подлежит комплексному обследованию, к которому относятся: цитогенетический анализ после трепанобиопсии, анализ крови на предмет наличия антител к клеткам крови, рентгенография с определением костного возраста, миелограмма. Также обследованию подлежат все ближайшие родственники больного ребенка.
Залогом скорейшего выздоровления пациентов с апластической анемией является ранняя диагностика данного патологического состояния, адекватная оценка тяжести состояния пациента, а также индивидуальный подход к выбору целесообразного в каждом конкретном случае метода лечения.
Впервые диагностированная апластическая анемия является поводам для госпитализации больного в стационар, независимо от выраженности клинических проявлений и лабораторных показателей.
В ситуации, когда известен этиопатогенетический фактор, спровоцировавший развитие апластической анемии, лечение необходимо начинать с устранения первопричины, во избежание дальнейшего прогрессирования угнетения процессов кроветворения.
В качестве лечебных мероприятий при диагностированной апластической анемии гематологи во всем мире применяют следующие методики: заменное переливание цельной крови или ее элементов, трансплантация костного мозга, а также применение лекарственных средств, направленных на стимуляцию процессов кроветворения.
Заместительная терапия апластической анемии подразумевает использование заменного переливания подходящей донорской крови или отдельных ее элементов (тромбоцитарная, эритроцитарная масса и гранулоциты). Данный метод лечения является превентивным, так как переливание крови лишь восполняет запас необходимых элементов крови, но не восстанавливает функцию кроветворения в костном мозге. Кроме того, при такой форме апластической анемии, как аутоиммунная, данный метод не применяется, так как на введение чужеродных клеток организм начинает вырабатывать иммунный ответ, что обусловливает неэффективность лечения.
Следует учитывать, что многократные вливания донорской крови сопровождаются избыточным накоплением железа в организме, которое откладывается в жизненно-важных органах, нарушая их структуру. В этом случае целесообразно сочетать переливание крови с приемом препаратов, способствующих выведению железа из организма. Во избежание процесса отторжения трансплантата перед процедурой пересадки костного мозга больному нецелесообразно применять переливание компонентов крови.
Самым эффективным и в то же время самым опасным методом лечения апластической анемии является трансплантация костного мозга, так как только этот метод может стать пусковым механизмом для нормализации функции кроветворения костного мозга. Данный метод используется предпочтительно в молодом возрасте пациента после тщательного подбора подходящего донора, коим может стать ближайший родственник пациента. Подготовительными процедурами при трансплантации стволовых клеток костного мозга являются воздействие на организм больного высоких доз радиоактивного облучения, а также применение препаратов химиотерапии. Подготовительным этапом со стороны донора является забор крови, фильтрация из нее здоровых стволовых клеток и введение их в общий кровоток пациента, с помощью которого они попадают в костномозговые полости, где и происходит пролиферация здоровых кровяных клеток.
Во избежание осложнений, больному назначаются препараты, предотвращающие отторжение трансплантата, однако не всегда удается избежать этой фатальной для пациента ситуации. Данный метод лечения является дорогостоящим и требует соблюдения определенных условий, которые доступны только в специализированных клиниках, в связи с чем не получает широкого использования в качестве терапии апластической анемии.
Больные с апластической анемией аутоиммунного генеза нуждаются в применении иммуносупрессивных препаратов, действие которых направлено на подавление неадекватного функционирования иммунной системы. Препаратами выбора в данной ситуации считаются: Циклоспорин (суточная доза составляет 10 мг/кг перорально), Антитимоцитарный глобулин (суточная доза 15 мг/кг внутривенно) и Антилимфоцитарный глобулин (суточная доза 130 мг внутривенно капельно). Применение иммунодепрессантов в большинстве случаев сопровождается выраженными побочными реакциями, угрожающими жизни пациента ( , сывороточная болезнь, инфекционные заболевания), для предотвращения которых целесообразно применять кортикостероидные препараты (Преднизолон в суточной дозе 1 мг/кг). Бесспорно, иммуносупрессивная терапия является одним из самых эффективных методов лечения апластической анемии, однако встречаются случаи, когда после приема препаратов этой группы наблюдается рецидив заболевания.
В качестве дополнительной терапии к основному направлению в лечении апластической анемии применяются препараты, стимулирующие кроветворную функцию костного мозга, так называемые колониестимулирующие факторы (Молграмостин, Филграстим, Лейкомакс). Препараты этой группы эффективны в отношении стимуляции пролиферации клеток гранулоцитарного ряда, поэтому областью их применения являются случаи апластической анемии, сопровождающиеся выраженной лейкоцитопенией. Курс терапии колониестимулирующими факторами составляет не менее двух недель и предпочтительным методом введения препаратов является парентеральный в суточной дозе 5 мг/кг. Ограничивающим фактором в применении средств этой группы является их высокая стоимость.
Научно доказано стимулирующее действие андрогенов на все ростки кроветворения, в связи с чем, в настоящее время широко применяется терапия андрогенами в лечении апластической анемии. Данные препараты целесообразно применять только в случае заболеваемости среди мужчин, и рекомендованы длительные курсы введения препаратов (Тестостерона пропионат дважды в сутки по 1 мл 5% раствора или пролонгированный препарат Сустанон — 250 1 мл 1 раз в месяц).
В качестве паллиативного метода лечения используется радикальная спленэктомия, которая в 85% случаев имеет положительный эффект в лечении апластической анемии. Патогенетической обоснованностью данного метода является то, что при удалении селезенки прекращается секвестрация кровяных клеток и резко ограничивается продукция антител против собственных здоровых клеток костного мозга. Данный метод лечения показан всем больным без признаков инфекционных осложнений.
Прогноз для жизни, трудоспособности и состояния здоровья пациентов с признаками апластической анемии напрямую зависит от степени тяжести заболевания и глубины снижения уровня жизненно важных клеток кроветворения.
К сожалению, по сей день, мировая статистика показывает неутешительные данные в отношении показателя смертности от апластической анемии, независимо от того, насколько прогрессивно развивается фармацевтическая отрасль в отношении лечения болезней крови. Высокая смертность наблюдается среди пациентов с тяжелой формой панцитопении и в большей степени причиной смерти является генерализованная форма сепсиса, как конечная стадия лейкоцитопении.
Значительно улучшились прогнозы после начала применения радикальных методов лечения (трансплантация стволовых клеток костного мозга, использование иммунодепрессантов). В 50-90% случаев применение этих способов лечения можно добиться полного выздоровления пациента.
Применение Антитимоцитарного и Антилимфоцитарного иммуноглобулинов в сочетании с терапией Циклоспорином позволяют лишь в 60-70% случаев добиться ремиссии заболевания.
В этой группе больных не существует семейной тенденции к анемии, нет сопутствующих врожденных аномалий и нет нарушений в неонатальном периоде. Апластическая анемия может возникнуть в любом возрасте у детей и у взрослых, иногда может быть связана со специфической интоксикацией или инфекцией, но часто такой связи не наблюдается и тогда анемия считается «идиопатической».
Некоторые медикаменты, например 6-меркаптопурин, метотрексат, циклофосфамин и бусулфан, обладают определенной, заранее предсказуемой, зависящей от дозы способностью угнетать костный мозг. Если это угнетение будет продолжаться, оно приведет к аплазии костного мозга, которая обычно быстро проходит после отмены препарата. Эти медикаменты повреждают нормальные костномозговые клетки посредством того же механизма, что при подавлении ими роста лейкемических клеток. Биохимические принципы их действия довольно хорошо изучены. К этой же категории относится лучевое повреждение костного мозга.
Другие медикаменты, например акрихин, хлорамфеникол, фенилбутазон и противосудорожные препараты, применяемые в нормальных лечебных дозах, могут вызвать глубокую аплазию костного мозга у очень небольшого количества людей, причем предсказать заранее эту аплазию нельзя. Часто она необратима и примерно половина больных умирают. К этой же категории относится интоксикация инсектицидами, такими, как ДДТ, и некоторыми органическими растворителями. Часто остается неясным, можно ли связать анемию с тем или иным медикаментом. Необходимым условием для такой связи является прием медикаментов в течение последних 6 мес. Наиболее известен и изучен из них хлорамфеникол. Этот препарат стоит во главе списка известных этиологических агентов у группы больных с приобретенной апластической анемией, описанной Скоттом и соавторами, и у таких же групп больных детей у Шахиди. Гурман наблюдал в Сиднее за 8 лет 16 случаев, в которых болезнь была связана, как предполагается, с приемом хлорамфеникола. Абсолютная частота летальной приобретенной апластической анемии в популяциях, в которых не было известно о контактах с каким-либо опасным медикаментом и был известен контакт с различными медикаментами, включая хлорамфеникол.
Лечение хлорамфениколом увеличивает вероятность развития апластической анемии в 13 раз, однако ясно также, что этот рост невелик. Для других медикаментов риск еще меньше. Тем не менее Британский комитет по безопасности медикаментов рекомендует при всех заболеваниях, кроме брюшного тифа и гемофилического гриппозного менингита, применять хлорамфеникол системно, только после тщательного клинического и обычно лабораторного исследования, указывающего, что другого антибиотика будет недостаточно. Никогда не следует применять его системно при банальной инфекции.
Механизм развития апластической анемии под действием хлорамфеникола неясен. Возникновение апластической анемии не связано с дозой и продолжительностью лечения, его также нельзя объяснить недостаточной экскрецией у подверженных лиц. In vitro можно доказать подавление синтеза нуклеиновых кислот в нормальных костномозговых клетках, но только при такой концентрации медикамента, которая превышает применяемую in vivo. Существует предположение, что небольшие количества хлорамфеникола могут потребляться с молоком от коров, леченных по поводу мастита, что эти малые количества могут сенсибилизировать костный мозг к терапевтическим дозам, применяемым в дальнейшем. Предполагалось также, что существует неоткрытый пока синергизм с другими медикаментами, вероятно, безвредными, если они применяются в отдельности. Обсуждая этиологию панцитопенической летальной аплазии, вызванной хлорамфениколом, следует заметить, что у значительной части больных, получающих этот медикамент, наблюдается совершенно иное, обратимое и зависимое от дозы угнетение костного мозга. У 10 из 22 больных, получавших хлорамфеникол, в ранних эритробластах костного мозга были найдены множественные большие вакуоли, что часто сопровождалось падением числа эритроцитов и ретикулоцитов. Эти изменения исчезают через неделю после отмены медикамента. Развитию их, по-видимому, способствуют повышенные дозы, замедленный клиренс из плазмы и ускоренный эритропоэз. Такие же вакуоли можно видеть при дефиците фенилаланина или рибофлавина.
В отношении этиологии других медикаментозных аплазий всегда возникал соблазн предположить действие иммунных механизмов, возможно, типа медикамент — гаптен. Однако эти механизмы никогда не были продемонстрированы. Только в одной клинической ситуации, а именно при реакции трансплантат против хозяина у иммунологически несостоятельных грудных детей, получивших трансфузии, установлено иммунологическое происхождение апластической анемии. Развитие резко выраженной анафилактоидной реакции после случайного повторного контакта с ДДТ у чувствительного больного также позволяет предполагать иммунный механизм. Ньювиг предложил три объяснения медикаментозной аплазии: а) прямое и токсическое действие на костномозговые клетки, например, после хронического производственного контакта с бензолом; б) истинная аллергия, проявления которой возникают быстро после контакта с малой дозой; в) длительный контакт с большими дозами, т. е. «аллергия высоких доз». Это наиболее обычная форма. Автор объясняет это прежде всего повреждением клеточных мембран. Можно предполагать также генетическую предрасположенность, на что указывает случай дискразии крови после контакта с хлорамфениколом у однояйцевых близнецов. Недавно были опубликованы обзорные статьи по медикаментозной апластической анемии Ньювига в журнале «Lancet».
Аналогичные проблемы возникают в связи с предшествующей развитию апластической анемии вирусной инфекцией. Это явление хорошо изучено при инфекционном гепатите. Апластическая анемия у 5 больных в возрасте от 4 до 19 лет развилась через 1-7 недель после начала гепатита. Описан ряд аналогичных случаев, включая 3 случая Шварца и соавторов. Эти авторы отмечали, что при инфекционном гепатите часто наблюдается временное снижение количества гранулоцитов, тромбоцитов и гемоглобина и что прогрессирующие изменения, ведущие к костномозговой аплазии, у очень небольшого количества больных могут представлять собой продолжение всего процесса, зависящего, вероятно, от генетического предрасположения. Здесь можно видеть аналогию с интоксикацией хлорамфениколом. Панцитопения с временной гипоплазией костного мозга описана также в связи с рядом инфекций, вызванных РНК-содержащими вирусами, включая вирусы краснухи и микровирусы гриппа , парагриппозные вирусы, вирусы свинки и кори. Две экспериментальные вирусные инфекции у мышей, т. е. MVH-3 и тринидадский штамм венесуэльского лошадиного энцефалита, вызывают панцитопению и гипоплазию костного мозга, и из костного мозга можно высеять вирус. Как и при других причинах апластической анемии предполагается аутоиммунный процесс.
Примерно в половине случаев приобретенной апластической анемии нельзя обнаружить в анамнезе серьезной предшествующей инфекции или контакта с токсическими агентами. Вольф опубликовал большой материал, включающий 334 случая приобретенной панцитопении, причем в 191 случае, т. е. 57,2%, анемия признана идиопатической.
В материале Гурмана относительное число больных с идиопатической анемией было меньше, т. е. 28 из 104, страдавших приобретенной аплазией. В 5 из 17 случаев по материалам Шахиди и в 5 из 9 случаев по материалу Деспосито анемия была идиопатической. Пока не ясно, вызываются ли болезни в этих случаях инфекцией неидентифицированным вирусом. По крайней мере некоторые из идиопатических случаев, по-видимому, можно выделить в особую группу, которую можно было бы назвать предлейкозом или лейкозом в апластической фазе.
Мельхорн и соавторы описывают 6 детей, у которых на основании прочных, бесспорных доказательств был поставлен диагноз апластической анемии в возрасте от 1 года 11 месяцев до 6 лет, однако у всех этих детей в дальнейшем, через 9 недель — 20 месяцев, развился острый лимфобластный лейкоз. У этих 6 больных наблюдалась одна общая особенность — более быстрый, чем обычно, терапевтический эффект в сравнении с апластической анемией на начальную терапию кортикостероидами. То же отмечал Гурман, и мы также наблюдали этот эффект в одном случае, в котором через 3 месяца развился острый лимфобластный лейкоз. Эта быстрая реакция панцитопении на лечение только одними кортикостероидами заметно отличается от обычного отсутствия эффекта в остальных случаях апластической анемии. Следует отметить, что описана аналогичная лейкемическая трансформация апластической анемии, вызванной бензолом и хлорамфениколом.
Ньюман и соавторы описали 14 детей с идиопатической панцитопенией и отметили, что, кроме трех главных признаков — анемии, лихорадки и пурпуры, имеются важные отрицательные признаки, т. е. отсутствие гепатоспленомегалии, лимфоаденопатии, язв в полости рта и желтухи. Однако можно наблюдать пурпуру слизистой рта и кровотечение из десен. Иногда может быть воспалительная лимфоаденопатия, связанная с местным сепсисом.
Если у ребенка появится красная моча, то следует предполагать развитие пароксизмальной ночной гемоглобинурии.
Аминацидурия, наблюдаемая примерно у половины больных с конституциональной формой, отсутствует и нет отставания костного возраста.
Более чем у половины взрослых больных, страдающих этим заболеванием, обнаружены лимфопения и гипогаммаглобулинемия с субнормальным уровнем IgG.
Сопутствующий гемолиз, в том числе пароксизмальная ночная гемоглобинурия . У части больных с апластической анемией укорочена продолжительность жизни эритроцитов. Это говорит о том, что дефект эритроцитов иногда бывает не только количественным, но и качественным. При этом можно наблюдать увеличенную секвестрацию в селезенке. Ретикулоцитоз, который при этом должен был бы быть, обычно исключается из-за аплазии костного мозга. В некоторых случаях понижено содержание гаптоглобина. Одной из причин гемолиза при этой болезни является необычный синдром сочетания пароксизмальной ночной гемоглобинурии (ПНГ) и апластической анемии. Этот синдром надо предполагать, когда у больного с апластической анемией повышается билирубин или появляется спонтанный ретикулоцитоз. Диагноз подтверждается тестом кислотного сывороточного гемолиза (КСГ) на ПНГ, а также тестами на гемосидеринурию. В некоторых случаях ПНГ можно обнаружить только при исследовании самой чувствительной популяции эритроцитов, т. е. ретикулоцитов и юных эритроцитов, полученных при тщательном удалении пипеткой слоя ниже лейкоцитарно-тромбоцитарного сгустка после центрифугирования 20-35 мл крови при 500 G.
Обычно при этом синдроме ПНГ выявляется на фоне апластической анемии, часто после того, как эритропоэз в известной мере восстановился. В нескольких случаях наблюдалась обратная последовательность, т. е. на фоне ПНГ развилась тяжелая или фатальная недостаточность костного мозга. Левис и Дэйс систематически ставили тесты у всех своих больных с апластической анемией и установили, что у 7 из 46 (15%) имеются лабораторные критерии ПНГ. У 2 из них в дальнейшем развилась типичная картина ПНГ. Подойдя к этому вопросу с другой точки зрения, авторы установили, что по крайней мере у 15 из 60 больных с ПНГ вначале имелись признаки аплазии. Обычно ПНГ — это болезнь взрослых мужчин. Однако та форма, которая наступает при аплазии, по-видимому, встречается в более молодом возрасте и может поражать детей. Гарднер наблюдал 11 таких больных, включая 6 до 25 лет, 2 больным было 7 и 9 лет. Эти двое были мальчики. У них апластическая анемия до постановки диагноза ПНГ продолжалась 2 года и 5 лет.
Интересной особенностью этого сочетанного синдрома является то, что апластическая анемия может быть типа Фанкони, может быть приобретенной после контакта с хлорамфениколом, транквилизаторами, инсектицидами, гербицидами и другими веществами, а может быть и идиопатической. Левис и Дэйс полагают, что основная связь существует между аплазией костного мозга и ПНГ, а не между этиологическими факторами, вызвавшими повреждение костного мозга и ПНГ. Оба эти автора, а также Гарднер и Блум предполагают, что в периоде аплазии происходит соматическая мутация костномозговых стволовых клеток, что ведет к появлению вторичного клона патологических эритроцитов, присущих ПНГ, которые начинают продуцироваться при последующей регенерации костного мозга. Следует добавить, что, хотя характерный дефект при ПНГ сосредоточен в эритроцитах, изменены также гранулоциты. Метод «кожного окна» показывает снижение их фагоцитарной активности и активности щелочной фосфатазы. Напротив, при неосложненной апластической анемии активность щелочной фосфатазы в гранулоцитах обычно повышена.
Поддерживающие меры включают также переливания крови, в то время как анемия достаточно глубокая, чтобы вызывать симптомы, обычно на уровне гемоглобина 4-6 г%. Эритроцитная масса применяется не только для лечения явных кровотечений, и надо стремиться к повышению уровня до 8-9 г%. Более высокий уровень гемоглобина ведет к более резкому угнетению эритропоэза. Тромбоцитопеническое кровотечение лечат быстрыми вливаниями обогащенной тромбоцитами плазмы или тромбоцитарных концентратов (4 ед/м2). Внутримышечных инъекций надо избегать. При всех процедурах необходимо строго соблюдать асептику и энергично лечить инфекции бактерицидными антибиотиками. Поскольку нейтропения обычно бывает особенно глубокой при приобретенных формах апластической анемии, во время нейтропенической фазы можно пользоваться особым нейтропеническим режимом: промывание полости рта 0,1% раствором гибитана 4 раза в день после еды (изготовляется из чистого антисептика без детергентов и красителей); смазывание насептиновой мазью ноздрей 3 раза в день; ежедневно ванна. Смазывание десен 1% гибитановым зубным гелем 2 раза в день (вместо чистки зубов щеткой). Когда больные находятся в больнице, необходима какая-то изоляция с реверсивным барьером, чтобы уменьшить опасность заражения больничной микрофлорой. Профилактическую системную антибиотикотерапию надо абсолютно отвергнуть, так как она увеличивает склонность к грибковым инфекциям и инфекциям, резистентным к антибиотикам. Начинающаяся инфекция может проявиться увеличением тенденции к кровоточивости. При инфекции не только снижается число тромбоцитов, но и увеличивается геморрагическая тенденция при данном числе тромбоцитов.
Андрогены . Специфическая терапия андрогенами+кортикостероидами проводится так же, как при конституциональных формах, т. е. оксиметалон внутрь — 4-5 мг/кг в сутки + преднизолон по 5 мг 2 раза в сутки у детей с массой тела до 20 кг, 5 мг 3 раза в сутки при массе тела от 20 до 40 кг и 4 раза в сутки при массе тела более 40 кг. Разница заключается в том, что при приобретенных формах анемии эффект достигается у меньшего процента больных, реакция на лечение более медленная, но зато ремиссия у больных, поддающихся лечению, продолжается после отмены андрогена и кортикостероидов. При анемии Фанкони недостаточность костного мозга быстро рецидивирует после прекращения этой терапии. Указывалось даже, что это обстоятельство можно использовать в сложных случаях при дифференцировании приобретенной формы от конституциональной.
Первые результаты лечения андрогенами и стероидами были весьма впечатляющими. Из 17 детей с приобретенной апластической анемией (в 12 случаях токсическая, в 5 — идиопатическая) у 10 наблюдался стойкий ретикулоцитоз, который достиг вершины в 5-15% после 1-7-месячного комбинированного лечения андрогенами и кортикостероидами. Из этих детей 9 выжили, и в дальнейшем содержание гемоглобина у них повысилось. У 3 детей наблюдался преходящий ретикулоцитоз без других реакций. Расхождение между сроками появления ретикулоцитоза и повышением гемоглобина у этих больных объясняли гемолизом. Кроме того, эритроциты, которые образуются в ранней стадии регенерации костного мозга, гипохромны при нормальном уровне железа в сыворотке и повышенном, содержании свободного протопорфирина в эритроцитах, что указывает на клеточный блок синтеза гемоглобина. Максимальное повышение гемоглобина наблюдалось через 2-15 месяцев после начала лечения андрогенами. При исследовании костного мозга в динамике в ранней стадии лечения найдены группы ретикулярных клеток, которые созревают и превращаются в эритроидные очаги, у тех больных, у которых в дальнейшем развивается реакция на лечение. У всех больных с повышением гемоглобина наблюдалось также повышение числа сегментоядерных клеток более чем до 1500 в 1 мкл, однако реакция тромбоцитов была менее выраженной и они достигали только 25 000-90 000 в 1 мкл. Обычно количество сегментоядерных нейтрофилов увеличивалось медленнее, чем уровень гемоглобина, еще медленнее увеличивалось количество тромбоцитов. Общая продолжительность лечения андрогенами у этих больных составляла от 2 до 15 месяцев, после прекращения лечения у них сохранялась ремиссия неопределенно долго. У 2 положительно реагировавших на лечение больных была идиопатическая аплазия, у 8 — токсическая. Среди больных, которые не реагировали, у 3 была идиопатическая и у 4 — токсическая форма аплазии. Авторы высказали предположение, что длительное лечение высокими дозами кортикостероидов может нарушить функцию костного мозга вследствие увеличения количества жировой ткани в костном мозге.
Сходные результаты получили Деспосито и соавторы, применявшие андрогены + стероиды. У 5 из 9 детей с приобретенной апластической анемией наступило выраженное гематологическое улучшение, которое оказалось стабильным. У 2 детей была идиопатическая и у 3 — токсическая форма. (Из больных, не поддавшихся лечению, у 3 была идиопатическая и у 1-токсическая анемия.) Наблюдались аналогичные соотношения сроков. Число тромбоцитов значительно увеличилось только через 9-17 месяцев после начала лечения, и даже тогда оно достигло лишь 50 000 у одного больного и 100 000 в 1 мкл у 2 больных, в то время как гемоглобин и сегментоядерные клетки были нормальными. Лечение прекратили через 7-11 месяцев; у 4 из 5 больных временно упал уровень гемоглобина на 1-3 мес. Больные были под наблюдением от 1 года до 3 лет. За это время у них не было рецидивов.
Согласно этим двум сообщениям, положительная реакция наблюдалась немногим более чем у половины детей, причем лечение было эффективно как при идиопатической, так и при токсических формах апластической анемии. Среди больных с токсическими формами частота реакций была, может быть, несколько больше.
Пока не появились последние из этих статей, было впечатление, что без лечения андрогенами больные редко выживают. Повышенная выживаемость, отмеченная в двух самых последних сообщениях, объясняется успехами симптоматической терапии, включая антибиотики и трансфузии тромбоцитов. В частности, материал Хейна и соавторов проливает новый свет на естественное течение болезни и, по-видимому, заполняет брешь между больными, леченными андрогенами, и без андрогенов (у 30 из 33 больных этиология анемии была токсической, а не идиопатической, что, возможно, объясняет более благоприятный прогноз). Гурман в обзоре, охватывавшем 104 больных детей с приобретенной апластической анемией из Бостона и Сиднея, указывает, что общая выживаемость была равна 34% при комбинированном лечении андрогенами и кортикостероидами и 19% при лечении только кортикостероидами или поддерживающей терапией.
В более новых сообщениях, включая результаты, полученные в той же детской больнице Бостона, данные менее удовлетворительные. Смертность составляла 70-80%, несмотря на андрогены, кортикостероиды и поддерживающую терапию. Кривая выживаемости двухфазная. Многие больные в раннем периоде умирают от инфекций и кровотечений в течение первых 6 месяцев. В настоящее время эффективность андрогенов у больных с тяжелой приобретенной аплазией ставится под сомнение.
Прогностические признаки . Согласно работе Гурмана, прогноз, по-видимому, хуже при апластической анемии после инфекций, особенно инфекционного гепатита, или после одного короткого курса хлорамфеникола. Прогноз лучше в идиопатических случаях, а также у больных с анемией, которую можно объяснить приемом противосудорожных или повторными курсами хлорамфеникола. Предполагалось, что костный мозг ребенка, у которого развилась апластическая анемия после одного короткого курса, нередко больше угнетен, чем у ребенка, у которого панцитопения вызывается только повторными курсами медикаментов. Известно, что у детей с резкой гипоклеточностью костного мозга на особенно тяжелый прогноз указывает число лимфоцитов более 85% в костном мозге, число нейтрофилов менее 200 в 1 мкл или тромбоцитов менее 20 000 в 1 мкл. На основании этих данных Гамитт и соавторы предположили, что тяжелая аплазия после гепатита должна рассматриваться как показание к ранней пересадке костного мозга ввиду того, что лишь около 10% больных этого рода выживают при поддерживающей терапии + + андрогены и стероиды.
Трансплантация костного мозга . Из-за неудач лечения андрогенами тяжелых приобретенных апластических анемий исследователи обратились к возможностям перспективы трансплантации костного мозга. После внутривенных вливаний костного мозга от однояйцевых близнецов в 5 из 10 случаев наступило быстрое восстановление функции костного мозга. Если доноры в виде однояйцевых близнецов отсутствуют, то серьезным препятствием является возможное отторжение трансплантата или, если он приживается, реакция трансплантат против хозяина. Однако среди обычных сибсов имеется один шанс из 4, что будет найден гистосовместимый донор, подобранный при помощи типирования HL-A и смешанной лимфоцитарной культуры, чтобы выявить остальные локусы гистосовместимости. Эти меры предосторожности уменьшают значение проблемы несовместимости трансплантата, но не решают ее полностью. Для того чтобы уменьшить или исключить возможность отторжения, требуется дополнительная иммунодепрессивная терапия, например высокие дозы циклофосфамида перед пересадкой костного мозга и курс метотрексата после пересадки. Прежде чем попытаться осуществить эту лечебную меру, надо проводить массивную поддерживающую терапию, включая выхаживание больного в стерильной среде, лейкоцитарные и тромбоцитарные трансфузии в течение критических первых дней, а также наличие врачебной бригады с большим опытом. Томас и соавторы описывают технику забора, обработки и вливания костного мозга. 24 больных (в том числе 8 моложе 14 лет) с тяжелой апластической анемией (14 случаев идиопатической анемии, 4 случая анемии после гепатита, 4 — медикаментозной, 1 — ПНГ, 1 — анемия Фанкони), которые не поддавались обычному лечению, получили трансплантаты от сибсов, идентичных по HL-A. У 21 больного наблюдалась быстрая регенерация костного мозга, которая в большинстве случаев, как было установлено при помощи генетических маркеров, была обусловлена донорскими клетками. У 4 больных трансплантат был отторгнут и они умерли. Четверо больных умерли от вторичной болезни, 11 человек живут с функционирующими трансплантатами. Срок наблюдения от 141 дня до 823 дней. Десять больных вернулись к нормальному активному образу жизни. Эти результаты, полученные группой исследователей из Сиетла, побудили и других воспользоваться этим методом. На рис. 25 показан результат пересадки в первом случае в Великобритании, осуществленный бригадой по пересадкам костного мозга в Королевской больнице Royal Marsden. Возможно, что именно таким будет идти дальнейшее лечение отдельных больных с плохими прогностическими признаками при первом обращении за помощью.
Различные виды лечения . Больным, не поддающимся другому лечению, с клеточным костным мозгом показана спленэктомия. Однако предполагаемый эффект этой операции не подтвердился при анализе большой группы случаев, и, так как спленэктомия довольно опасна у этих больных с тромбоцитопенией, то в общем она не рекомендуется. Возможным исключением являются больные с элементом гемолиза и с обнаруженной секвестрацией эритроцитов в селезенке. Установлено, что спленэктомия увеличивает продолжительность жизни тромбоцитов у больных с аплазией, которым перестала помогать трансфузия тромбоцитов.
При апластической анемии предлагали вводить внутривенно фитогемагглютинин, но собранные на настоящий момент данные не поддерживают предположения о целесообразности этого метода. Лечение железом противопоказано, так же как и лечение кобальтом, вызывающим тошноту, рвоту и увеличение щитовидной железы. Фолиевая кислота и витамин В12 неэффективны даже у больных с мегалобластными изменениями.
- Симптомы Апластической анемии
- К каким докторам следует обращаться если у Вас Апластическая анемия
Под апластической анемией понимают группу патологических состояний, при которых наряду с панцитопенией обнаруживается снижение кроветворения в костном мозге и отсутствуют признаки гемобластоза. Апластическая анемия является скорее самостоятельной формой, а не синдромом. Из группы апластических анемий четко выделяется конституциональная анемия Фанкони. Среди большинства приобретенных апластических анемий выделяют формы с достаточно хорошо выученной этиологией. К таким относят апластические анемии, спровоцированные воздействием ионизирующей радиации либо вызванные приемом чрезмерно больших доз цитостатиков.
Особая группа апластических анемий возникает после острого вирусного гепатита. Описываются апластические анемии после приема лекарств, которые у большинства людей никаких изменений крови не вызывают. К таким препаратам относятся хлорамфеникол (левомицетин), фенилбутазон (бутадион), соединения золота, толбутамид (бутамид), сульфаметоксипиридазин (сульфапиридазин, кинекс), мепробамат (мепротан, андаксин триметадион (триметин), карбутамид (букарбан), хлорпромазин (аминазин).
Смертельная апластическая анемия бывает в 10 раз чаще у лиц, которые принимали левомицетин. Наиболее часто встречаются идиопатические формы апластических анемий, где при самом тщательном обследовании больного не удается выяснить причину болезни.
Принципиально возможны следующие механизмы развития апластической анемии: уменьшение количества стволовых клеток; нарушение микроокружения, приводящее к изменению функции стволовых клеток; внешние гуморальные или клеточные воздействия, в основном иммунные, нарушающие нормальную функцию стволовой клетки.
Ионизирующая радиация может вызвать апластическую анемию; она четко зависит от дозы радиации. При этом наблюдается гибель стволовых клеток.
Механизм развития аплазии после вирусной инфекции также недостаточно ясен. Аплазия развивается чаще после гепатита А или гепатита, не относящегося ни к группе А, ни к группе В. Описаны случаи аплазии после инфекционного мононуклеоза и 2 случая трансплантации костного мозга однояйцевым близнецам с постгепатитной аплазией. В одном случае отмечен эффект от трансплантации, в другом костный мозг не прижился; потребовалась подготовка циклофосфаном, а после нее трансплантация была удачной. Это не отвечает на вопрос, поражает вирус непосредственно стволовую клетку или существует гетероиммунный механизм развития аплазии (антитела против вируса, фиксированного на стволовой клетке, вызывают гибель этой стволовой клетки).
В пользу поражения стволовой клетки при апластических анемиях говорит эффективность трансплантации костного мозга от однояйцевых близнецов и братьев или сестер, совместимых по системе HLA.
Об иммунной природе апластической анемии у ряда больных свидетельствует отсутствие приживления трансплантированного костного мозга от однояйцевого близнеца без предварительной иммунодепрессии.
Клиническая картина идиопатической апластической анемии может быть разной. Иногда болезнь начинается остро и очень быстро прогрессирует, почти не поддается никакой терапии. Но чаще она начинается исподволь, больной адаптируется к анемии и обращается к врачу уже тогда, когда выраженность панцитопении значительная. Клиническая картина депрессии кроветворения складывается из анемии различной глубины, тромбоцитопении со всеми клиническими проявлениями тромбоцитопенического синдрома (такими как кровоподтеки, петехиальные высыпания на коже, носовые, десневые кровотечения, маточные кровотечения). Нередко следствием тяжелой нейтропении становятся пневмония, воспаление уха и другие воспалительные процессы. Иногда нагнаиваются ушибы, кровоизлияния, возможно инфицирование организма.
Анемия у больных связана как с нарушением образования эритроцитов, так и с кровотечениями.
Для таких больных характерна бледность, кожные кровоизлияния, достаточно специфичны воспалительные изменения на слизистой оболочке рта прямой кишки.
Врач при выслушивании сердца выявляет систолический шум. При идиопатической форме болезни селезенка не прощупывается. Ее увеличение отмечается уже при гемосидерозе в результате массивных переливаний эритроцитов. Увеличение печени может быть связано с недостаточностью кровообращения при анемии.
В одних случаях болезнь прогрессирует быстро и за несколько недель или месяцев приводит к смерти, в других — протекает хронически, с периодическими обострениями и улучшениями. Иногда наступает полное выздоровление.
Анемия выражена очень сильно, иногда гемоглобин снижается до 20-30 г/л. Анемия чаще нормохромная, макроцитарная. Содержание ретикулоцитов колеблется от 0 до 4-5%. Тяжелые формы сопровождаются большим снижением уровня ретикулоцитов. Эритрокариоциты в периферической крови появляются редко. Отмечается выраженная гранулоцитопения. Иногда количество гранулоцитов снижается до 0,2 Ч 109/л, при этом развиваются инфекционные осложнения. Иногда снижается абсолютное количество моноцитов. Абсолютный уровень лимфоцитов в большинстве случаев остается нормальным. Снижается количество тромбоцитов, при этом значительно удлиняется время кровотечения и, как следствие, развивается геморрагический синдром, СОЭ ускоряется до 30-50 мм/ч.
Количество миелокариоцитов костного мозга заметно снижается. Иногда отмечается раздражение красного ростка. Увеличено количество лимфоцитов, плазматических, тучных клеток. Мегакариоциты могут полностью отсутствовать. В костном мозге резко увеличивается количество железа, расположенного как в эритрокариоцитах, так и внеклеточно.
Содержание железа сыворотки у большинства больных увеличено, насыщение трансферрина приближается к 100%. При исследовании феррокинетики при помощи радиоактивного железа выявляются удлинение времени выведения железа из плазмы и снижение количества железа, включенного в эритроциты. Продолжительность жизни эритроцитов, измеренная при помощи радиоактивного хрома, чаще всего укорочена, реже — нормальная. Иногда повышается уровень фетального гемоглобина. Агрегатгемагглютинационная проба часто оказывается положительной. На поверхности эритроцитов выявляют IgG. Необходимо исключить присутствие аллоантител на поверхности недавно перелитых эритроцитов.
Диагностика апластической анемии возможна только после гистологического исследования костного мозга. Выявление панцитопении в периферической крови служит показанием к стернальной пункции (костномозговая пункция, производимая через переднюю стенку грудины) для исключения гемобластоза и витамин-В12-дефицитной анемии. После этого производится исследование взятого материала. При выявлении большого количества жира в костном мозге диагностируют апластическую анемию. Если при исследовании обнаруживается нормальное соотношение между кроветворной тканью и жиром или имеется структурное увеличение клеток, то диагноз апластической анемии отпадает. При этом нередко увеличивается селезенка, иногда бывает положительная проба Кумбса, но чаще антитела обнаруживаются при помощи агрегатгемагглютинационной пробы. В костном мозге — нормальное количество мегакариоцитов, тогда как при апластической анемии мегакариоциты почти полностью отсутствуют. При периферической панцитопении у пожилых людей, у лиц с удалением части желудка следует в первую очередь исключить витамин-В12-дефицитную анемию, у детей -фолиеводефицитную анемию.
Апластическая анемия – патология крови, при которой угнетается кроветворная функция костного мозга. Эта редкая болезнь, однако, она имеет тяжелое течение, поскольку при отсутствии лечения высока вероятность летального исхода. Состояние отмечается коварностью, поскольку оно никоим образом себя не проявляет длительный промежуток времени. У апластической анемии много причин, при этом заболевание развивается в любом возрасте. Чтобы своевременно его обнаружить следует регулярно проходить обследование.
Подобные нарушение кроветворения костного мозга имеют два варианта происхождения – врожденные и приобретенные. Важно учитывать, что зачастую страдают все типы клеток крови, и этот вариант встречается наиболее часто. При исследовании заболевания было обнаружено, что на разных этапах развития апластических анемий ростки костного мозга угнетаются по-разному, поэтому на некоторых из них отмечается нормальное количество тех или иных элементов.
Выделяют такие поражения костномозговых ростков:
- одного (отмечается дефицит одного форменного элемента крови);
- двух (дефицит двух из трех элементов);
- трех (всех стволовых клеток производится недостаточно).
Развитие апластических анемий зачастую протекает типично, поэтому грамотному врачу установить диагноз не составит особых проблем.
Причины заболевания более чем в половине случаев установить невозможно. Лучше всего врачи выяснили, почему возникают врожденные анемии, поскольку они имеют связь с генными мутациями. Существуют экзогенные и эндогенные факторы. К экзогенным относят:
- радиация;
- взаимодействие с химическими соединениями;
- медикаментозные средства – антибиотики, цитостатики, противотуберкулезные препараты;
- инфекционные агенты.
- гормональная дисфункция;
- нарушения работы иммунной системы.
Также, помимо вышеперечисленных триггеров, имеет место сбой работы системы антиген-антитело.
Методы диагностики включают определенные процедуры. Пациенты должны сдать клинический (его еще называют общим) анализ крови, который позволит заподозрить угнетение всех ростков кроветворения. Необходимо выполнить биопсию костного мозга с целью уточнения тяжести процесса. Обычно при апластической анемии костный мозг заменяется жировой тканью, что провоцирует нарушение его основной функции. Важно понимать, что это неприятное и болезненное обследование. Диагностика включает в себя и другие методики, такие как цитогенетические, но они по большей мере применяются для обнаружения определенных форм заболевания – анемии Фанкони.
Выполненный при апластической анемии анализ крови показывает панцитопению, то есть снижение количества всех кровяных клеток. Больше всего страдают нейтрофилы. Иногда отмечаются признаки воспалительного процесса, это зависит от этапа заболевания. Критерии установки диагноза представлены ниже.
- Снижение гемоглобина в периферической крови.
- Эритроциты, лейкоциты и тромбоциты также падают за счет низкого количества зрелых клеток, при этом эритроциты имеют различную форму и размеры.
- Цветной показатель остается нормальным.
- Гематокрит снижается.
- Тромбоциты – менее 20 при минимальном значении 180.
- Выраженная лейкопения за счет снижения продукции молодых форм и зрелых клеток.
- Появляются миелоциты.
- Увеличивается процентное соотношение лимфоцитов и моноцитов лейкоцитарной формулы.
- Растет скорость оседания эритроцитов.
Начальные стадии патологии никак не проявляют себя, возможны лишь некоторые общие симптомы – слабость, бледность, одышка. Иногда встречаются головокружения, пониженное внимание. Люди редко обращают на это внимание, списывая все на усталость. Но апластическая анемия имеет свои типичные симптомы, которые встречаются на поздних стадиях. К ним относят:
- гипертермию;
- склонность к инфекционным процессам;
- кровоточивость десен;
- носовые кровотечения.
Эти проявления указывают не только на нарушение эритропоэза, но и на снижение производства других форменных элементов. Другие изменения функции кроветворения можно определить после прохождения обследования.
Определить у ребенка малокровие можно по разным симптомам. Важно понимать, что эта патология не развивается сама по себе, поэтому зачастую она имеет некоторые предвестники, сказывающиеся на состоянии здоровья беременной женщины. Клинические проявления анемии у новорожденных детей:
- сухая, бледная кожа;
- язвочки в углах рта;
- трещины на ладонях или ступнях;
- наличие выраженной диспепсии;
- общие признаки – вялость, раздражительность, плаксивость;
- снижение цифр артериального давления, развитие тахикардии.
Апластическая анемия у детей устанавливается исключительно на основании пункционного исследования костного мозга, показанием к проведению которого служит панцитопения в результате обычного клинического анализа крови. Эта диагностическая манипуляция позволяет исключить другие виды малокровия.
Отмечаются и другие признаки, которые не характерны для данного заболевания при глубоком обследовании – спленомегалия (увеличение селезенки, может встречаться при апластической анемии), наличие антител, положительный тест Кумбса.
Типичными симптомами являются:
- бледность и сухость кожи;
- повышенная кровоточивость из носа, десен;
- вялость, сонливость;
- снижение аппетита, диспепсические явления;
- заеды;
- изменение показателей гемодинамики – гипотония, тахикардия, тахипноэ.
Угнетение кроветворения в костном мозге возможно не только при апластической анемии. Поэтому ее необходимо дифференцировать от других заболеваний.
- Онкологические процессы. Здесь важно обращать внимание на возраст больного и результаты стернальной пункции, при которой костный мозг не замещается жировой тканью.
- При агранулоцитозах не возникает анемии.
- Гепатоспленомегалия в течение 6 месяцев или больше может встречаться при заболеваниях печени, тромбофлебите. Они протекают с изменением окраски кожных покровов.
- Большинство случаев апластической анемии в возрасте 30-35 лет следует дифференцировать от пароксизмальной ночной гемоглобинурии. Является очень редкой патологией.
- Необходимо проводить диагностику с любой другой формой анемии.
Апластическая анемия характеризуется длительным лечением. Это тяжелый процесс, требующий комплексного подхода. На первых этапах применяются гормональные средства, цитостатики, которые позволяют подавить реактивность иммунной системы. Зачастую такой подход показывает положительный результат по причине связи с аутоиммунными реакциями самого заболевания.
Терапия апластической анемии включает три основные группы лекарственных средств:
- иммунодепрессанты гормонального происхождения;
- цитостатики;
- антибиотики.
Лечить заболевание монотерапией также возможно, особенно на ранних стадиях процесса. Для этого используются иммуносупрессоры. Но наибольший эффект достигается при их комбинации с цитостатиками и антибактериальными средствами, которые показаны по причине выраженного и стойкого снижения защитных свойств организма.
Для проведения гемотрансфузии используется цельная кровь, содержащая все ее компоненты – эритроциты, лейкоциты, тромбоциты, а также эритроцитарная или тромбоцитарная массы. Они заготавливаются на станциях переливания крови. Это временная мера, поскольку клетки имеют свой срок жизни, а воздействия на причину заболевания не происходит. Частые гемотрансфузии способствуют накоплению железа внутренними органами, что способствует нарушению их нормальной работоспособности.
Такой шаг включает пересадку костного мозга донора реципиенту. Важно понимать, что это очень сложная процедура, которая требует соблюдения определенных условий и правил. Организм реципиента должен быть совместим с донорским как минимум по двум комплексам HLA и трем антигенам. Если это условие не соблюдается, то риск осложнения трансплантации костного мозга значительно увеличивается.
Согласно статистике, около 70% занимает гетерогенная трансплантация костного мозга, аллогенная же происходит в 30% случаев. При этом, если была обнаружена совместимость по всем антигенам и HLA комплексам, то пол или возраст донора не имеют решающего значения.
Важно отметить, что аллогенная трансплантация бывает трех видов – сингенная, от родственников или от совместимого донора.
Операция по забору клеток костного мозга донора является очень болезненной, поэтому выполняется под анестезией. Для получения необходимого количество клеток необходимо получить 10-15 миллилитров на килограмм массы тела. В среднем количество костного мозга, взятого у донора, составляет 700-1500 миллилитров. Осложнений от такой манипуляции практически не бывает. Следующим этапом трансплантации является внутривенное вливание полученного костного мозга реципиенту.
Важно отметить, что прямая пересадка – явление редкое, поэтому костный мозг после взятия у донора помещается в специальное хранилище. Там он хранится в замороженном виде в специальном растворе, а температура хранения достигает -200 градусов. Размораживание происходит при 45 градусах.
Перед введением стволовых клеток реципиенту клетки костного мозга обрабатывают цитостатиками для борьбы с атипичными или злокачественными клетками. После проведения процедуры пересадки пациентам назначается курс иммуносупрессивной терапии для предупреждения отторжения трансплантанта.
Удаление селезенки широко используется при лечении апластической анемии. Это связано с тем, что орган продуцирует лимфоциты, которые принимают участие в реакциях цитотоксичности, что проявляется снижением клеточности крови.
Эффект от такой операции наступает менее, чем у половины пациентов, при этом он виден не сразу. Проведение спленэктомии включает увеличение вдвое дозировок гормональных средств, а с целью профилактики кровотечений в день операции больному назначается введение больших доз тромбоцитарной массы.
При обнаружении вышеописанных симптомов следует обратиться за консультацией к терапевту, а также сдать общий анализ крови. При обнаружении отклонений пациенты направляются к смежным специалистам – гематологу, инфекционисту (по причине возможных инфекционных осложнений), ЛОР, стоматолог, хирург, гинеколог (для остановки или предупреждения кровотечений различной локализации).
Важно понимать, насколько тяжелым заболеванием являются апластические анемии, так же как и гипопластические, прогноз жизни при которых зависит от различных факторов:
- степень тяжести процесса;
- ответ на проводимую терапию;
- возраст и состояние здоровья пациента.
У молодых лиц прогноз считается более благоприятным при легкой и средней тяжести заболевания, при тяжелых формах – наоборот. При получении только симптоматического лечения вероятность однолетнего выживания не превышает 10%. При проведении патогенетической коррекции, а также трансплантации костного мозга возможно полное излечение от болезни.
Апластическая анемия — нормохромная, нормоцитарная анемия, обусловленная снижением количества клеток — предшественников гемолоэза. Симптоматика обусловлена развитием тяжелой анемии, тромбоцитопении (петехии, кровотечения), лейкопении (инфекции). Диагностика основана на выявлении панцитопении в периферической крови и отсутствия клеток-предшественников в костном мозге. Может быть полезным применение эритропоэтина, гранулоцит-макрофаг-колониестимулирующего фактора.
Термин «апластическая анемия» включает в себя пангипоплазию костного мозга и сочетается с лейкопенией и тромбоцитопенией.
Редкая форма бурно протекающей анемии, быстро приводящая к смерти с явлениями геморрагического диатеза и некротических язв при отсутствии в периферической крови молодых эритроцитов. Активный костный мозг подвергается сплошному жировому или слизистому перерождению, почему болезнь называют также «чахоткой» костного мозга (панмиэлофтиз).
Такое поражение костного мозга могут вызвать различные яды (например, бензол), инфекции, лучевые воздействия (рентгеновы лучи). Случаи апластической анемии, развивающейся без видимой внешней причины, правильнее считать также результатом воздействия различных внешних факторов, токсических или сенсибилизирующих организм, но остающихся нераспознанными. При бурно развивающемся торможении костномозговой деятельности, как это наблюдается, например, при токсико-аллергической алейкии, несомненно, велико участие нарушения регуляции кроветворения. Против наличия неполноценности костного мозга говорит дальнейшее течение излеченных случаев, где возврата болезни не наступает десятилетиями при обычной жизни больных. Апластическая анемия неясной природы чаще наступает в возрасте до 25-30 лет и в 2/3 случаев встречается у женщин.
Это редкая патология в развитых странах — 2-4 новых случая на 1 млн населения в год; в некоторых частях мира, например, в восточной Азии, заболевание встречается чаще. Основная проблема — недостаточность полипотентных стволовых клеток, вызывающая гипоплазию костного мозга с панцитопенией в крови. Обычно установить причину не удается, но необходимо тщательно собранным анамнезом выявить потенциальные причины, такие, как приём лекарств, воздействие химических веществ и радиации, вирусные инфекции, особенно гепатит; дополнительно следует исключить редкие врождённые случаи, такие как анемия Фанкони.
У больного налицо признаки подавления гемопоэтической функции костного мозга, как правило, анемия или кровотечение, и реже инфекции. В анализе крови обнаруживают панцитопению, низкое число ретикулоцитов и часто макроцитоз. Аспирационный и трепанобиопсийный материал костного мозга обеднён клеточными элементами.
Всем больным требуется поддержка препаратами крови и агрессивное лечение инфекций. Если проводится только поддерживающая терапия, прогноз при тяжёлой апластической анемии плохой — более 50% больных умирают, обычно в первый год. Излечивающее лечение больных в возрасте до 30 лет с тяжёлой идиопатической апластической анемией — аллотрансплантация костного мозга при наличии подходящего донора. Больному, у которого есть совместимый донор, его брат или сестра, пересадку следует осуществить как можно быстрее, и при этом шанс на долговременное излечение — 75-90%. У пожилых людей иммуносуппрессивное лечение циклоспорином и антитимоцитарным глобулином даёт 5-летнюю выживаемость в 75%. У таких больных возможны рецидивы или переход в другую клональную патологию гемопоэза, такую, как пароксизмальная ночная гемоглобинурия, МДС и даже ОМЛ, и за ними следует длительное время наблюдать.
Важно проверить известные побочные эффекты препаратов, которые были приняты в предшествующие месяцы. В некоторых случаях цитопения может быть более селективной и вовлекать только одну клеточную линию, чаще нейтрофилы. Часто это обнаруживают случайно у внешне здорового человека. Возможно, это имеет иммунную основу, но доказать это трудно.
- Лекарства
- Цитотоксические препараты — идиосинкразия.
- Антибиотики — хлорамфеникол, сульфонамиды.
- Антиревматические препараты — пеницилламин, препараты золота, фенилбутазон, индометацин.
- Антитиреоидные препараты.
- Противосудорожные препараты.
- Иммуносуппрессоры — азатиоприн
- Химические вещества
- Злоупотребление бензол-толуоловыми растворителями — вдыхание паров клея.
- Инсектициды — хлорсодержащие углеводороды (ДЦТ), фосфорорганические соединения и карбаматы.
- Радиация
- Вирусные гепатиты
- Беременность
- Пароксизмальная ночная гемоглобинурия
Клинические признаки и методы диагностики такие же, как для первичной идиопатической анемии. Лежащую в основе причину следует лечить или устранить, но в остальном терапия такая же, как при идиопатической форме.
Истинная апластическая анемия является идиопатической почти в 1/2 случаев. К установленным причинам заболевания относится воздействие определенных химических веществ, радиации, лекарственных препаратов. Механизмы данного воздействия неизвестны, однако его основой считается селективная гиперчувствительность.
Анемия Фанкони — это крайне редкое заболевание, которое является наследственной формой апластической анемии, оно сопровождается костными аномалиями, микроцефалией, гипогонадизмом и коричневой пигментацией кожи. Часто может иметь скрытое течение до возникновения определенных сопутствующих заболеваний, вызывающих периферическую цитопению. После излечения сопутствующего заболевания показатели периферической крови нормализуются, несмотря на снижение массы костного мозга.
Острая эритробластопения характеризуется краткосрочным исчезновением клеток — предшественников эритропоэза из костного мозга при различных острых вирусных заболеваниях (в особенности при парвовирусных инфекциях человека), чаще встречается у детей. Анемия сохраняется в течение длительного периода после излечения острой инфекции. Хроническая парциальная эритроидная аплазия может быть обусловлена гемолитическими состояниями, тимомами, аутоиммунными механизмами, реже — воздействием определенных лекарственных препаратов (транквилизаторов, антиконвульсантов), токсинов (органические фосфаты). Анемия Даймонда — Блекфена, редкая врожденная форма апластической анемии, обычно возникает в раннем детском возрасте, но может встречаться и у взрослых.
Хотя начало апластической анемии, как правило, постепенное, часто спустя несколько недель или месяцев после воздействия токсина, однако в некоторых случаях дебют заболевания может быть острым. Признаки анемии (к примеру, бледность) обычно являются ярко выраженными.
Тяжелая тромбоцитопения может сопровождаться образованием петехий и экхимозов, кровотечениями из десен, конъюнктивы и других тканей. Агранулоцитоз обычно приводит к возникновению жизнеугрожающих инфекций. Спленомегалия отсутствует до момента развития трансфузионного гемосидероза.
Клиническая картина состоит из ряда быстро нарастающих тяжелых синдромов.
Анемический синдром характеризуется развивающимся па глазах побледнением больных, губы обескровливаются и по цвету почти не отличаются от кожи, ушные раковины бледны. Больные жалуются на одышку, частые обмороки. Гемоглобин каждые два-три дня падает на -5-8%, снижаясь через немного недель до катастрофически низких цифр- 10-8% и ниже. Признаки повышенного распада крови отсутствуют: нет следов желтушности, сыворотка крови бесцветна, дуоденальная желчь слабо окрашена, селезенка не увеличена. Эритроциты сохраняют нормальную форму и окраску, цветной показатель близок к единице, пойкилоцитоз и анизоцитоз отсутствуют; несмотря на резкую анемию, не удается обнаружить регенеративные формы: ядерные эритроциты, полихроматофилы, ретикулоциты. В пунктате костного мозга не находят молодых форм, что подтверждает паралич кроветворения.
Геморрагический синдром тромбопенического типа проявляется бурно нарастающими петехиями, экхимозами на коже и слизистых, упорными, требующими тампонады носовыми кровотечениями, кровавой рвотой, меленой, гематурией. Кровоизлияния в коже легко вызвать, ущипнув кожу или перетянув конечность жгутом; обычный укол иглой при подкожном введении лекарств уже дает кровоподтеки и т. д. В мазке крови отсутствуют пластинки, а в пунктате костного мозга-мегакариоциты; ретракция кровяного сгустка не наступает; время кровотечения резко удлинено. Свертываемость крови изменяется мало.
Некротически-язвенный синдром характеризуется тягостным поражением миндалин, неба, десен, слизистой щек и т. д., как при острой лейкемии,-характера номы за счет фузоспириллярного симбиоза.
Больные жалуются на кровотечение из десен, foetor ex ore, не могут глотать пищу, при распаде небной занавески поперхиваются даже при попытке пить и т. д. Изъязвления могут локализоваться и на коже, в фолликулах кишечника, вызывая болезненные явления со стороны живота и т. д. Число нейтрофилов падает до немногих сотен в 1 мм 3 или они полностью исчезают так же, как и эозинофилы. Вследствие этого агранулоцитоза (т. е. отсутствия зернистых форм лейкоцитов-нейтрофилов и эозинофилов в первую очередь) и происходит внедрение в ткани анаэробных и гноеродных возбудителей, что часто приводит к смертельному сепсису. Общее число лейкоцитов падет до 1 000-800 и ниже. Лимфоциты относительно преобладают, составляя до 85-90% всех белых шариков.
Селезенка, лимфатические узлы, печень не увеличены, нет усиления кроветворения и в костном мозгу; грудина и ребра безболезненны при поколачивании. Ахилии желудка не находят. Отсутствуют и признаки органического поражения нервной системы.
При быстром течении болезни постоянным признаком является изнуряющая лихорадка, особенно в терминальной стадии. Больные адинамичны, испытывают крайнюю слабость; жалобы могут вариировать от случая к случаю, в зависимости, например, от различных локализаций кровоизлияний — в забрюшинной клетчатке, в мозговых оболочках и т. д.
В типичных тяжелых случаях болезнь приводит к смерти через 1-2 месяца, т. е. течение болезни как бы укладывается в простую схему доживания имевшихся к началу болезни эритроцитов при полном прекращении нового образования их. При подостром течении болезнь затягивается до полугода и более с обманчивыми улучшениями, особенно в весенне-летние месяцы.
Апластическую анемию необходимо подозревать у пациентов, особенно молодых, с панцитопенией. Парциальную эритроидную аплазию (в т.ч. анемию Даймонда — Блекфена) необходимо подозревать у пациентов с наличием костных аномалий и нормоцитарной анемии. При наличии подозрения на другое заболевание должно быть выполнено исследование костного мозга.
Для апластической анемии характерны нормоцитоз и нормохромия эритроцитов (иногда макроцитоз с пограничными значениями показателей). Наблюдается снижение количества лейкоцитов, преимущественно гранулоцитов. Ретикулоциты отсутствуют либо их количество резко снижено. Клеточность костного мозга снижена. Клеточность костного мозга и индекс созревания могут быть нормальными, несмотря на отсутствие клеток — предшественников эритропоэза.
Клинические формы. Диагноз апластической анемии ставится на основании совокупности клинических синдромов. Эритроциты в мазке крови представляются нормальными, что может дезориентировать в отношении диагноза тяжелого заболевания крови.
Практически важно отличить симптоматические формы апластической анемии, обусловленные воздействием известных вредных внешних моментов инфекционной и токсической природы, рентгеновых лучей; при этих формах прогноз несколько лучше. Из лекарств новарсенол, другие бензоловые, сульфонамидные препараты, производные сурьмы, золота и пр. приводят к поражению костного мозга, притом в порядке не столько прямого токсического действия, сколько приобретенной биологической непереносимости.
Особого внимания заслуживает так называемая септическая ангина, или алиментарно-токсическая алейкия, при отравлении перезимовавшим в поле зерном (просом, реже пшеницей, ячменем, рожью), зараженным особым видом плесневых грибков. Болезнь наблюдалась в конце апреля-в мае. Начальные жалобы-жжение во рту, тошнота и рвота в связи с местным раздражающим действием испорченного зерна, затем постепенно развивается общая слабость, утомляемость на фоне удовлетворительного общего состояния, хотя исследование крови обнаруживает уже лейкопению, а тщательный осмотр больных- петехиальную сыпь на туловище и ногах (лейкопеническая стадия). В части случаев наблюдаются кожные аллергические проявления, что дает возможность предполагать токсико-аллергическое происхождение заболевания. При прогрессировании заболевания температура повышается до 39-40°, отмечаются явления некротически-язвенной ангины: серовато-грязные налеты, припухание шейных лимфатических узлов, распространение некроза на мягкое небо; нарастание геморрагического диатеза с кишечными кровотечениями, аспирационной пневмонией, терминальным сепсисом. Число лейкоцитов падает до 1 500-500, даже до 300 в 1 мм3, нейтрофилов-до 1 % с соответствующим повышением числа лимфоцитов до 98 %; содержание гемоглобина снижается до 10%, эритроцитов-почти до 1000000. Цветной показатель около единицы, ретикулоцитарная реакция отсутствует, отмечается тромбопения. В пунктате костного мозга эритробластический росток представлен микронормобластами с пикнотическим ядром; крайне мало фигур деления эритроцитов, мегакариоцитов; преобладают лимфатические элементы. РОЭ резко ускорена, билирубин крови не повышен, холестерин понижен. Смертность достигает 50%. При выздоровлении некротические участки постепенно отторгаются, язвы очищаются.
Помимо апластической анемии с поражением всех трех ростков костномозгового кроветворения, известны формы поражения только двух компонентов (эритролейкопенические, лейкотромбопгничоскис, эритро-тромбопеничсскпс) или лишь одного: агранулоцитоз и тромбопения, разбираемые ниже особо и дающие-близкую клиническую картину.
При псевдоапластической анемии кроветворение продолжается, в чем можно убедиться, исследуя иунктат костного мозга; нарушено лишь выплывание молодых форм эритроцитов в периферическую кровь. В дальнейшем течении болезни может наступить неожиданно резкое улучшение и полное выздоровление. Клиническая картина при псевдоапластической анемии обычно несколько легче и, наряду с тяжелой анемией, может не наблюдаться такого же тяжелого угнетения белой крови и резкого уменьшения числа пластинок периферической крови.
Сходную с апластической анемией картину представляют имеющие такой же плохой прогноз острые лейкемии, в частности, лейкопенические их формы, распознать которые позволяют не столько детали клинической картины (незначительное увеличение лимфатических узлов, селезенки), сколько внимательное изучение морфологии одноядерных лейкоцитов.
За апластическую анемию можно принять злокачественное малокровие на высоте обострения процесса, когда при очень низких цифрах гемоглобина может быть очень мало регенеративных форм эритроцитов. Однако подробное изучение анамнеза, указывающее на волнообразное длительное течение, наличие признаков повышенного распада крови, пожилой обычно возраст больных и наличие нервных симптомов (фуникулярпый миэлоз) дают основание поставить диагноз злокачественного малокровия.
- Лошадиный антитимоцитарный глобулин, кортикостероиды, циклоспорин.
- В некоторых случаях может потребоваться трансплантация гемопоэтических клеток.
- Может применяться цитокиновая терапия.
- При аплазии эритроидного ростка, обусловленной наличием тимомы, применяется хирургическое лечение.
На терапию АТГ отвечают около 60% пациентов. Некоторые эксперты рекомендуют предварительное выполнение кожных проб (для определения аллергии к лошадиной сыворотке) и одновременное назначение кортикостероидов. Применение циклоспорина имеет аналогичную эффективность: ответ на лечение наблюдается приблизительно у 50% пациентов, не отвечающих на применение АТГ, что свидетельствует о различии механизмов действия. Комбинация АТГ и циклоспорина также является эффективной. Если апластическая анемия достигает тяжелой степени, отсутствует ответ на лечение АТГ и циклоспорином, может применяться трансплантация костного мозга или цитокиновая терапия.
источник







