ЖДА – клинико-гематологический синдром, в основе которого лежит нарушение синтеза гемоглобина, из-за дефицита железа в организме или вследствие негативного баланса этого микроэлемента длительное время.
Различают три стадии развития дефицита железа:
1. Предлатентный дефицит железа или уменьшение запасов железа.
2. Латентный дефицит железа характеризуется истощением железа в депо, но концентрация Нв периферической крови остается выше нижней границы нормы. Клинические симптомы на этой стадии мало выражены, проявляются снижением толерантности к физическим нагрузкам.
3. Железодефицитная анемия развивается при падении концентрации Нв ниже физиологических величин.
Этиологические факторы ЖДА
ЖДА наиболее распространенная анемия, она встречается у 10-30% взрослого населения Украины. Причинами развития данной патологии являются: неполноценное питание, заболевания пищеварительного тракта, сопровождающиеся хроническими кровопотерями и нарушением всасывания железа (геморрой и трещины прямой кишки, гастриты, язвенная болезнь желудка и т.д.) Заболевания мочеполовой системы, осложненные микро- и макрогематуриею (хронический гломеруло- и пиелонефрит, полипоз мочевого пузыря и т.д) Повышенная потребность в железе: беременность, лактация, не контролируемое донорство, частые воспаления.
Железо очень важный микроэлемент в организме человека он принимает участие в транспорте кислорода, окислительно-восстановительных и иммунобиологических реакциях. Недостаточное количество железа для организма пополняется с пищей. Для нормального всасывания пищевого железа необходима свободная соляная кислота в желудке, которая переводит его в окисленную форму, последняя в тонкой кишке связывается с белком апоферетином, образуя ферретин, который и всасывается в кровь.т
Железо, которое появляется при разрушении эритроцитов в селезенке ( из гемма) включается в состав феретина и гемосидерина ( резервное железо) и так же частично попадает в костный мозг и используется эритробластами.
Железо, содержащееся в организме, условно можно разделить на функциональное (в составе гемоглобина, миоглобина, ферментов и коферментов), транспортное (трансферин), депонированное (ферритин, гемосидерин) и железо, которое образует свободный пул. Из железа, которое содержится в организме (3-4,5 мг), только 1 мг участвует в обмене с внешней средой: выделяется с испражнениями, теряется при выпадении волос, деструкции клеток.
Суточная потребность в железе взрослого человека в состоянии физиологического равновесия составляет (1 — 1, 5) мг, у женщин во время менструаций — (2,5 — 3,3) мг.
Кроме АНЕМИЧЕСКОГО СИНДРОМА для ЖДА характерен и СИДЕРОПЕНИЧЕСКИЙ СИНДРОМ, который связан с нарушением трофики эпителиальных клеток в результате снижения активности железосодержащих ферментов – цитохромов. Он проявляется изменениями на коже и ее придатках – кожа становиться сухой вялой снижается тургор появляется ломкость ногтей выпадения волос, изменяется восприятие запахов и вкуса – возникает пристрастие к запахам бензина, мела ацетона и т.д. Изменениями в слизистых оболочках желудочно-кишечного тракта хейлит, ангулярный стоматит, склонность к парадантозу, дисфагия (синдром Пламера-Винсона) атрофический гастрит. Происходит атрофия слизистых оболочек глаз в виде сухости глазного яблока, «симптома синих склер», изменяютя слизистые оболочеки верхних и нижних дыхательных путей, развиваются атрофические риниты, фарингиты, бронхиты. Поражается мышечная система — происходит задержка роста и физического развития, мышечная слабость ослабление мышечного аппарата сфинктеров – императивные позывы на мочеиспускание, ночной анурез и т.д.
Диагностика железодефицитной анемии
Отмечается эритропения, снижение содержания гемоглобина до 30-40 г/л, анизоцитоз, пойкилоцитоз, гипохромия, снижение ретикулоцитарного индекса, лейкопения за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита в костном мозге – резкое снижение местных запасов железа (снижается количество сидеробластов – клеток, содержащих гранулы железа). Отмечается умеренная гиперплазия эритроидного ростка. Гемоглобинизация клеток эритрона нарушена: увеличено количество базофильных и полихроматофильных форм, снижено количество оксифильных. По мере истощения запасов железа ферритин и гемосидерин исчезают и из костного мозга, и из других мест хранения.
Особую роль в диагностике играют биохимические показатели:
1. Уровень ферритина сыворотки снижен – менее 12 нг/мл.
2. Железо сыворотки снижено.
3. Увеличена общая железосвязывающая способность.
4. Увеличена ненасыщенная, латентная железосвязывающая способность.
5. Резко снижено насыщение трансферрина.
Лечение железодефицитной анемии: выявление и устранение причины развития ЖДА; коррекция дефицита железа, путем назначения железосодержащих препаратов для внутреннего употребления.
Синдром почечной колики.
Почечная колика — это болевой синдром, возникающий при остром нарушении оттока мочи вследствие обтурации верхних мочевых путей конкрементом, сгустком крови, слизи или гноя, конгломератом мочевых солей, казеозными массами, отторгнувшимися некротизированными сосочками, в результате перегиба мочеточника или спазма почечной лоханки, мочеточника.
Причины почечной колики
§ Камни почек и верхних отделов мочевых путей
§ Перегиб и сужение мочеточника
§ Отек мочеточника из-за аллергической реакции
Симптомы почечной колики
§ Количественные и качественные изменения мочи
§ Тошнота и рвота, задержка отхождения кишечных газов
§ Повышение артериального давления
Диагностика почечной колики
§ Рентгенологические методы исследования
§ Лабораторное исследование мочи
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
источник
Отмечается эритропения, снижение содержания гемоглобина до 30-40 г/л, анизоцитоз, пойкилоцитоз, гипохромия, снижение ретикулоцитарного индекса, лейкопения за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита в костном мозге – резкое снижение местных запасов железа (снижается количество сидеробластов – клеток, содержащих гранулы железа). Отмечается умеренная гиперплазия эритроидного ростка. Гемоглобинизация клеток эритрона нарушена: увеличено количество базофильных и полихроматофильных форм, снижено количество оксифильных. По мере истощения запасов железа ферритин и гемосидерин исчезают и из костного мозга, и из других мест хранения.
Особую роль в диагностике играют биохимические показатели:
Уровень ферритина сыворотки снижен – менее 12 нг/мл.
Увеличена общая железосвязывающая способность.
Увеличена ненасыщенная, латентная железосвязывающая способность.
Резко снижено насыщение трансферрина.
Витамин В12 содержится в мясе, яйцах, сыре, молоке, почках, печени. Витамин В12 в продуктах связан с белком, от которого он освобождается в процессе кулинарной обработки и под воздействием протеолитических ферментов ЖКТ, после чего он связывается в желудке с внутренним фактором Кастла. Внутренний фактор – это гликопротеид, который образуется в фундальной части и в области тела желудка париетальными клетками. Комплекс «витамин В12 – фактор Кастла» связывается со специфическими рецепторами клеток подвздошной кишки. Витамин В12 всасывается медленно, за сутки может всосаться не более 6-9 мкг. Незначительная часть витамина В12 может всосаться без фактора Кастла.
Витамин В12 в плазме связывается с транскобаламинами. Известно три транскобаламина – I, II, III. Основное количество витамина переносится транскобаламином II. Этот белок синтезируется в печени.
Содержание витамина В12 в организме здорового человека составляет 2-5 мг, депо находится в печени. Запасы витамина В12 настолько велики, что их хватает на 3-6 лет.
Все клетки организма имеют рецепторы для комплекса «транскобаламин II – витамин В12».
У человека выявлены две метаболически активные формы витамина В12:
1. Метилкобаламин. Эта активная форма обеспечивает нормальное эритробластическое кроветворение и нормально протекающие метотические процессы в других клетках организма. В ходе реакции с метилкобаламином из уридинмонофосфата образуется тимидинмонофосфат, который включается в ДНК. Необходимым условием для течения этой реакции является участие активной коферментной формы фолиевой кислоты – 5, 10 – метилен-тетрагидрофолиевой кислоты.
Метилкобаламин участвует в метилировании гомоцистеина в метионин.
2. 5-дезоксиаденозилкобаламин. Этот метаболит необходим для нормального обмена жирных кислот. Так при распаде некоторых жирных кислот образуется пропионовая кислота. Распад пропионовой кислоты обеспечивается рядом ферментативных реакций, в ходе которых синтезируются производные янтарной кислоты, входящие в цикл Кребса. Одним из промежуточных продуктов является метилмалоновая кислота. Метилмалоновая кислота образуется также при распаде валина и метионина. 5-дезоксиаденозилкобаламин участвует в образовании янтарной кислоты из метилмалоновой. Предполагается участие аденозилкобаламина в биосинтезе миелина. При дефиците витамина В12 накапливается избыток пропионовой и метилмалоновой кислот. Они переходят в жирные кислоты с физиологическим нечетным числом атомов углерода в молекуле. Включаясь в липиды нейронов, они нарушают процессы миелинизации и вызывают жировую дистрофию клеток.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
В диагностике и лечении различных заболеваний крови специализируется врач-гематолог (записаться). Поэтому, теоретически, при анемии необходимо обращаться к врачу-гематологу, однако на практике это не совсем оправдано. Ведь часто анемия может быть вызвана заболеваниями, которые входят в компетенцию другого специалиста, и в таких случаях для успешной терапии анемии нужно одновременно принимать специфические гематологические препараты и лечить основную патологию, спровоцировавшую анемический синдром.
На практике представляется рациональным при анемии обращаться к врачу-терапевту (записаться), который назначит необходимые обследования, выявит возможную причину снижения уровня гемоглобина в крови и на основании этого предложит лечение. А если терапевт не сможет назначить лечение из-за нехватки специфических знаний, врач просто направит больного к гематологу.
Такое обращение к терапевту при анемии представляется оправданным – так как большинство анемий обусловлено дефицитом железа, фолиевой кислоты или витамина В12 или же хронической кровопотерей при заболеваниях пищеварительного тракта, с этими проблемами справится именно врач-терапевт, назначив и лечение основной патологии, и порекомендовав диету, и выписав препараты железа и необходимых витаминов. И только если анемия вызвана непосредственно патологией системы крови (например, апластические анемии), врач-терапевт направит пациента к гематологу, так как в подобной ситуации наблюдать и вести человека должен очень узкий специалист с весьма специфическими знаниями, каковым и является гематолог.
При сборе анамнеза врачу необходимо выяснить:
- место рождения и проживания пациента с анемией;
- увлечения и хобби (например, усиленные занятия спортом);
- чувствует ли больной повышенную утомляемость и слабость в повседневной жизни;
- пищевые предпочтения (необходимо выяснить, какие продукты пациент ест и которых избегает, а также оценить количество их потребления);
- какие лекарственные препараты пациент принимает на данный момент или принимал ранее в течение длительного времени;
- у женщины необходимо уточнить количество беременностей, заканчивались ли они осложненными родами, имелись ли аборты, а также характер менструаций (обильные или нет, субъективная оценка ежемесячных потерь);
- имелись ли острые или хронические кровопотери вследствие травм, ранений или заболеваний (например, язва желудка и двенадцатиперстной кишки, миома матки, раковая опухоль);
- имеются ли заболевания пищеварительной системы (например, гастриты, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит);
- имелись ли за последнее время у пациента изменения в массе тела (снижение массы тела может быть связано с наличием у больного синдрома мальабсорбции (нарушение всасывания питательных веществ в тонком кишечнике) или недавно перенесенным инфекционным заболеванием, а увеличение веса может быть вследствие гормональных нарушений);
- не беспокоит ли пациента ломкость ногтей, а также сечение или раннее поседение волос;
- ощущает ли больной жжение языка (при В12 дефицитной анемии);
- беспокоят ли больного чувство онемения в конечностях;
- имелась ли у близлежащих родственников анемия, желчекаменная болезнь, хронические заболевания желудочно-кишечного тракта или выделительной системы;
- была ли у кого-то в семье произведена спленэктомия (удаление селезенки).
- наличие у больного заболеваний сердца (например, пороки сердца), почек (например, рак почек) или печени (например, гепатит).
При осмотре пациента врач обследует:
- Кожу и слизистые оболочки. Выявляется бледность кожных покровов, неправильная пигментация или желтуха. Также на поверхности кожи у больного могут наблюдаться кровоподтеки, петехии или ангиомы (могут быть вследствие тромбоцитопении или других причин, приводящих к потере крови). В уголках рта могут присутствовать хейлиты.
- Лимфатические узлы. Их увеличение, а также болезненность может указывать на наличие воспалительного или неопластического (злокачественного) процессов.
- Пищеварительную систему. С помощью пальпации можно определить, имеются ли у пациента боли в эпигастральной зоне, увеличение размеров печени или селезенки.
- Дыхательную систему. У больного может наблюдаться увеличение количества дыхательных движений (тахипноэ), а также одышка.
- Нервную систему. Позволяет определить наличие нарушений периферической чувствительности.
- Сердечно-сосудистую систему. При измерении артериального давления у больного наблюдается гипотония, при определении частоты пульса отмечается тахикардия.
Метод диагностики, который заключается в исследовании всех видов клеток крови, в определении соотношения их объема к жидкой части крови, а также выявления уровня гемоглобина и лейкоцитарной формулы.
При анемии в общем анализе крови определяются следующие показатели:
- уровень эритроцитов, их средний объем, а также распределение по объему;
- гемоглобин;
- ретикулоциты;
- гематокрит (соотношение клеток крови к плазме);
- среднее содержание и концентрация гемоглобина в эритроците;
- уровень лейкоцитов;
- уровень тромбоцитов.
Биохимический анализ крови
Анализ, позволяющий оценить работу внутренних органов и систем организма.
При анемии определяются следующие показатели:
- уровень ферритина (определяет резервы железа в организме);
- трансферрин (белок, переносящий железо);
- сывороточное железо (определяет уровень железа в сыворотке крови);
- железосвязывающая способность сыворотки крови (указывает на способность сыворотки крови связывать железо);
- уровень витамина В12 и фолиевой кислоты;
- уровень билирубина.
Исследование, позволяющее выявить наличие кровотечения в желудочно-кишечном тракте. За три дня до сдачи анализа пациенту необходимо будет начать соблюдать диету, исключив из рациона продукты, содержащие железо (например, печень, яблоки), а также некоторые лекарственные препараты (например, слабительные и нестероидные противовоспалительные средства, препараты железа).
Собранные каловые массы исследуются с помощью бензидиновой или гваяковой пробы.
Реакция окрашивания может быть:
- слабоположительной;
- положительной;
- резко положительной.
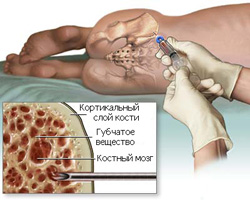
Костный мозг — это губчатое вещество, которое находится внутри костей. В большей степени оно располагается в тазовых костях, ребрах, а также грудине.
Костный мозг является важнейшим органом, отвечающим за кроветворение, так как именно здесь формируются все клетки крови.
Как производится пункция красного костного мозга?
Больного укладывают на бок (или на живот), производят местное обезболивание, после чего перпендикулярно сверлящими движениями вводят специальную иглу в гребень подвздошной кости. Проникновение иглы в кость происходит на глубину два сантиметра, после чего производится аспирация (забор) красного костного мозга. Взятый материал впоследствии наносится на предметные стекла для микроскопического исследования.
В результатах исследования определяют следующие показатели:
- индекс созревания нейтрофилов и эритробластов;
- количество клеточных элементов костного мозга;
- абсолютное содержание миелокариоцитов и мегакариоцитов.
Также во время данного исследования производится трепан-биопсия подвздошной кости. Впоследствии устанавливается соотношение паренхимы, жировой и костной ткани.
Рентгенологическое исследование легких, при котором выявляются анатомические изменения органа, костей, а также мягких тканей.
Рентген может помочь выявить заболевания, ставшие причиной развития анемии у пациента, например, туберкулез, а также рак легких.
Эндоскопическое исследование, позволяющее с помощью гастроскопа осмотреть пищевод, желудок и двенадцатиперстную кишку. Также данное исследование позволяет во время проведения процедуры взять кусочек ткани на биопсию (записаться) с последующим исследованием полученного материала под микроскопом.
С помощью данного исследования можно выявить следующие заболевания:
- варикозное расширение вен пищевода;
- атрофический гастрит;
- язва желудка и двенадцатиперстной кишки;
- полипы желудка;
- рак желудка.
Метод исследования с помощью ультразвуковых волн. Помогает изучить расположение, форму, а также структуру органов и мягких тканей.
При анемии могут исследоваться органы брюшной полости, забрюшинного пространства, а также органы малого таза:
- печень (увеличение размеров органа, цирроз);
- селезенка (увеличение размеров органа);
- почки (рак почек, наличие камней в почках, инфекционно-воспалительных заболеваний);
- матка (миома матки, внематочная беременность, рак матки).
Эндоскопический метод диагностики, позволяющий исследовать толстый кишечник. Процедура производится под общим наркозом.
Данное исследование поможет выявить следующие заболевания:
- кровоточащие язвы желудочно-кишечного тракта;
- полипы;
- неспецифический язвенный колит;
- болезнь Крона;
- дивертикулез толстого кишечника;
- злокачественную опухоль.
Метод диагностики, с помощью рентгеновского излучения позволяющий послойно исследовать органы и ткани. При необходимости перед проведением процедуры пациенту внутривенно могут ввести контрастное вещество для лучшей визуализации исследуемых органов и систем.
При анемии может быть назначено исследование:
- печени (например, гепатит, цирроз печени);
- легких (например, туберкулез, рак легких);
- почек (например, рак, туберкулез почек).
Профилактически проводить противопаразитарное лечение
Кишечные паразиты, находясь в организме человека, часто могут стать причиной развития анемии. Это происходит вследствие того, что паразиты, присасываясь к стенке органа, потребляют питательные вещества, что впоследствии может привести развитию дефицита того или иного витамина или микроэлемента. Также существуют паразиты, которые питаются клетками крови (например, шистосомы, личинки аскарид), поэтому их наличие в организме человека по истечении времени приведет к анемии. Исходя из этого, очень важно регулярно мыть руки перед едой, а также овощи и фрукты перед их употреблением. При наличии домашних животных необходимо ежегодно профилактически проводить противопаразитарное лечение.
Скудное и нерегулярное питание приводит к тому, что в организм не поступают витамины и микроэлементы, необходимые для кроветворения. С течением времени это может привести к развитию железодефицитной, В12 или фолиеводефицитной анемии. Для профилактики анемии человеку ежедневно необходимо потреблять белки (в особенности животного происхождения), так как именно они участвуют в формировании стромы эритроцитов и синтезе гемоглобина. Из-за того, что жиры подавляют кроветворение, их употребление рекомендуется снизить, в особенности жирные сорта мяса и рыбы. Предпочтение необходимо отдать таким продуктам как оливковое, подсолнечное и сливочное масла, так как данные жиры легко усваиваются. Прием углеводов должен оставаться в пределах нормы (для взрослого человека 300 – 500 грамм в сутки), в питании следует увеличить потребление меда, ягод, овощей, фруктов и различных каш (например, овсяная, гречневая, рисовая). Следует заметить, что важную роль в здоровье человека играет адекватное поступление в организм витаминов. Так, например, витамины B9 (фолиевая кислота) и В12 принимают участие в кроветворении, а такие микроэлементы как железо, медь и цинк способствуют формированию гемоглобина и эритроцитов.
Снизить контакт с ядохимикатами
Регулярный контакт с ядохимикатами (например, пестициды, бензол) приводит к кому что они, попадая в кровь, действуют негативно на ее элементы. Так, например, при хроническом отравлении бензолом (входит в состав бензина) в крови наблюдается снижение уровня эритроцитов и гемоглобина, а также увеличение ретикулоцитов. Эритроциты приобретают различную форму (пойкилоцитоз) и размер (анизоцитоз). У человека появляются такие симптомы как повышенная утомляемость, головная боль, головокружение, потеря аппетита, тошнота. Также может наблюдаться развитие маточных, десневых или носовых кровотечений. Именно поэтому человеку, по возможности, строго рекомендуется ограничивать контакт с ядохимикатами.
Курение негативно влияет на все органы и системы организма человека. Со стороны кровеносной системы табачный дым действует негативно на кровеносные сосуды, а также на состав крови, сгущает ее (увеличивает риск образования тромбов). Угарный газ, входящий в табачный дым, связываясь с гемоглобином, снижает его способность доставлять кислород к органам и тканям. Поэтому очень важно избегать контакта с посторонним сигаретным дымом, а также отказаться от самостоятельного курения.
Ежедневно выполнять умеренные физические нагрузки
Регулярное занятие спортом действует благоприятно на кровообращение, улучшая микроциркуляцию в органах и тканях, а также увеличивая количество эритроцитов в крови. Умеренные физические нагрузки снижают риск образования тромбов. Для профилактики развития анемии рекомендуется ежедневно выполнять гимнастику и осуществлять прогулки на свежем воздухе.
Своевременно лечить заболевания желудочно-кишечного тракта
Заболевания желудочно-кишечного тракта влияют на процессы переваривания и усвоения пищи, а также на всасываемость витаминов и микроэлементов. Так, например, фолиевая кислота и витамин B12 всасываются в тонком и толстом кишечнике, нарушение работы данных органов может привести к развитию недостатка данных витаминов и со временем привести к развитию В12 или фолиеводефицитной анемии. Такие заболевания как полипы желудка или кишечника, язва желудка и двенадцатиперстной кишки могут привести к развитию у человека хронического кровотечения. То есть, в течение длительного времени организм будет регулярно терять небольшое количество крови, что со временем приведет к развитию анемии. Поэтому очень важно при наличии риска развития желудочно-кишечных заболеваний (например, наследственная предрасположенность, перенесенные заболевания органов пищеварения) регулярно наблюдаться у врача, своевременно лечить имеющееся заболевание, соблюдать диету и предписанное лечение.
Соблюдать правила введения прикорма для детей
Дети попадают в группу риска развития анемии, в большинстве случаев это связано с неправильным питанием. Очень важно с самого раннего возраста организовать правильное питание и режим ребенка. Начиная с шести месяцев необходимо начать вводить в прикорм такие продукты как овощные пюре, яйца, мясо и каши. Начиная с восьми месяцев вводится рыба. Частота прикорма до восьми месяцев должна составлять три раза в день, в девять – одиннадцать месяцев четыре раза в день, в один год пять – шесть раз в день.
Правильно питаться во время беременности
Часто анемия развивается во время беременности. Дефицит железа или фолиевой кислоты может привести к серьезным осложнениям, связанным с течением беременности и развитием плода. Так, например, дефицит железа у беременной может привести к задержке развития плода, фетоплацентарной недостаточности, патологическим родам, развитию кровотечения. Беременной рекомендуется придерживаться правильного питания – ежедневно потреблять мясо, рыбу, свежие овощи и фрукты. При необходимости женщине может быть назначен прием профилактических доз препаратов железа (например, Сорбифер, Ферретаб).
источник
Анемии, обусловленные дефицитом железа в организме, относятся к числу наиболее распространенных заболеваний в мире и составляют 80-95% всех форм малокровия. Наиболее часто они встречаются у детей младшего возраста, девушек-подростков и женщин детородного возраста.Этиология.: недостаточным поступлением железа с пищей, нарушением всасывания его в тонком кишеч-нике, повышенной потребностью в период роста, беременностью, лактацией, кровотечениями из различных органов. По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп : 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа
Патогенез. снижение содержания железа в сыворотке крови, костном мозгу и депо. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мы-шечная слабость . Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Картина крови. гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным., анизоцитоз эритроцитов с преобладанием микроцитов. В костном мозгу отмечаются нарушение процессов гемоглобинизации эритрокариоцитов, сопровождающееся увеличением количества базофильных и полихроматофильных нормобластов при параллельном снижении числа их оксифильных форм, а также резкое уменьшение количества сидеробластов — нормобластов, содержащих единичные гранулы железа в цитоплазме (в норме до 20-40%).Количество железа в сыворотке крови при выраженной железодефицитной анемии падает до 5,4-1,8 мкМ/л при норме 12,5-30,4 мкМ/л (мужчины; у женщин этот показатель на 10-15% ниже).
Мегалобластическое кроветворение, причины возникновения и последствия. Злокачественное малокровие. Патогенез и картина крови.
Пернициозная анемия (болезнь Аддисона-Бирмера, злокачественное малокровие) представляет собой одну из форм заболевания, связанного с дефицитом витамина В12. Чаще развивается у лиц пожилого возраста .часто развивается в период беременности и лактации у очень молодых женщин. В основе ее этиологии и патогенеза лежит дефицит внешнего фактора кроветворения (чаще фолиевой кислоты).
П а т о г е н е з . Переход на мегалобластический тип кроветворения обусловлен резким снижением активности В12-зависимых энзимов, участвующих в метаболизме фолатов (соли фолиевой кислоты), необходимых для синтеза ДНК. При этом наблюдается уменьшение активности метилтрансферазы, сопровождающееся кумуляцией в клетках неактивного метилтетрагидрофолата и снижением синтеза ДНК, что приводит к нарушению клеточного деления или развитию мегалобластоза .Нарушение кроветворения связано с замедлением темпа мегалоб-ластического эритропоэза в результате удлинения времени митоти-ческого цикла и сокращения числа митозов: вместо трех митозов, свойственных нормобластическому эритропоэзу, наблюдается один. Срок жизни эритроцитов сокращается до 30-40 дней (в норме 120 дней). Распад мегалобластов, не успевших превратиться в эритроциты, наряду с их замедленной дифференциацией приводит к тому, что процессы кроветворения не компенсируют процессы кровораз-рушения. Развивается анемия..Клинические признаки. Основными являются: общая слабость, головокружение, головные боли, одышка и сердцебиение при движении, тошнота, жжение языка, понос, резкая бледностьКлассический симптом — глоссит Хантера (воспаление языка) — выражается в появлении гиперемии по краям и на кончике языка, сопровождающейся чувством жжения и боли, в дальнейшем развивается атрофия сосочков языка, и он становится «лакированным».Отмечается желудочная ахилия и увеличение печени.
Картина крови. Содержание эритроцитов и гемоглобина снижено, отмечается гиперхромия (цветовой показатель — 1,2-1,5), макроцитоз, пойкилоцитоз, появление в эритроцитах включений в виде колец Сабо, телец Жолли, появление мегалобластов и мегалоци-тов. Наблюдается умеренная лейкопения с нейтропенией, встречаются гиперсегментированные нейтрофилы (сдвиг вправо), редко — гигантские формы нейтрофилов. Количество тромбоцитов уменьшено, часть их представлена крупными формами кровяных пластинок
Лейкоцитоз и лейкопения.. Агранулоцитоз Патологические формы лейкоцитов. Изменение лейкоцитарной формулы при патологических процессах Ядерные сдвиги нейтрофилов (регенеративный, дегенеративный, смешанный.) их значения для клиники
Лейкоцитоз— увеличение общего количества лейкоцитов (более 9,0-10 9 /л) или числа их отдельных морфологических форм.Лейкоцитоз носит временный характер и исчезает вместе с причиной,его обусловившей; это не самостоятельное заболевание, а реакция крови на соответствующие этиологические фактор.
Механизмы развития. Лейкоцитозы развиваются в результате:
1) стимуляции нормального процесса лейкопоэза и выхода лейкоцитов из гемопоэтической ткани в периферическую кровь;
2) опухолевой активации лейкопоэза при лейкозах;
3) перераспределения лейкоцитов в сосудистом русле;
К физиологическим лейкоцитозамотносят алиментарный (пищеварительный),; миогенный; эмоциональный , лейкоцитоз новорожденных (в течение первых двух дней жизни).
Среди патологических лейкоцитозовразличают:
инфекционный — при пневмонии, менингите, скарлатине; воспалительный (особенно при гнойных воспалительных процессах).;
токсогенный — при действии вредных веществ как экзогенного (бензол, мышьяковистый водород, анилин и др.),;
постгеморрагический — наступающий после острых кровопотерь;
новообразовательный — при распаде опухолей;
лейкемический — при острых и хронических лейкозах.
центрогенный(при шоковых состояниях, эпилепсии, агонии; послеоперационный).
Нейтрофильный лейкоцитоз (нейтрофилия)— увеличение содержания нейтрофилов свыше 70% в гемограмме. Отмечается при острых инфекционных заболеваниях, гнойных воспалительных процессах. Шесть видов нейтрофильного лейкоцитоза 1) без ядерного сдвига — при острой кровопотере, стрессреакции;2) с гипорегенеративным ядерным сдвигом влево — при легком течении ряда инфекций и воспалений;3) с регенеративным ядерным сдвигом влево — при гнойносептических процессах;4) с гиперрегенеративным ядерным сдвигом влево — признак неблагоприятного течения инфекционных и гнойно-септических заболеваний;5) с дегенеративным ядерным сдвигом влево
Эозинофилия— увеличение содержания эозинофилов свыше 5% в гемограмме. эозинофилия является своеобразной реакцией организма на чужеродные белки, гистамин, инвазию паразитами и связана с антитоксической, антигистаминной , фагоцитарной и противогельминтной функцией эозинофилов.
Базофилия(более 1% базофилов в гемограмме) — редкая форма лейкоцитоза, встречающаяся при анафилактических и реагиновых аллергических реакциях (крапивница, отек Квинке, пищевая и лекарственная аллергия и др.), что обусловливается способностью базофилов фиксировать IgE и IgG, высвобождать медиаторы гранул
Лимфоцитоз— увеличение содержания лимфоцитов свыше 45% в гемограмме. развивается при ряде инфекционных заболеваний (брюшной тиф, свинка, коклюш, малярия,.),
Моноцитоз— увеличение содержания моноцитов свыше 9% в гемограмме. (туберкулез, инфекционный мононуклеоз, корь, краснуха
Лейкопения— уменьшение общего количества лейкоцитов ниже 4,0-10 9 /л. ).
Механизмы развития. К числу основных механизмов развития лейкопений относят:
1) нарушения и (или) угнетение процесса лейкопоэза;
2) разрушение лейкоцитов в сосудистом русле и органах гемопоэза;
3) перераспределение лейкоцитов в сосудах;
4) повышенная потеря лейкоцитов организмом;
Нейтропении, обусловленные угнетением лейкопоэтической функции костного мозга.Развитие их в основном связано:1) с нарушением пролиферации и дифференцировки стволовых гемопоэтических клеток 2) с разрушением клеток-предшественниц нейтрофилов в костном мозгу при действии токсических веществ;3) с патологией гемопоэзиндуцирующего микроокружения, 4) с уменьшением площади гранулоцитопоэза в результате замещения кроветворной ткани костного мозга опухолевой,фиброзной, костной, жировой тканью.
Нейтропении, обусловленные повышением разрушения нейтрофилов.Разрушение нейтрофилов в крови может происходить под влиянием антител типа лейкоагглютининов, которые образуются при переливании крови (особенно лейкоцитарной массы), при действии некоторых лекарственных препаратов, являющихся аллергенами-гаптенами (сульфаниламиды, амидопирин и др.), токсических факторов инфекционного происхождения (тяжелые инфекционные заболевания, обширные воспалительные процессы), при заболеваниях, сопровождающихся увеличением количества циркулирующих иммунных комплексов в крови (аутоиммунные заболевания, лимфомы, опухоли, лейкозы и др.).)
Агранулоцитоз — клинико-гематологический синдром, характеризующийся полным или почти полным отсутствием нейтрофильных гранулоцитов в крови.Условно за агранулоцитоз принимают состояние, при котором уровень гранулоцитов ниже 0,75-10 9 /л и/или общее количество лейкоцитов менее 1-10 9 /л. Наиболее часто развитие агранулоцитоза связано с приемом медикаментов (цитостатические препараты, амидопирин, аминазин, антитиреоидные средства, сульфаниламиды, некоторые антибиотики и др.)
В основе миелотоксического агранулоцитозалежит угнетающее действие медикаментозных препаратов и других повреждающих факторов на пролиферативную активность гранулоцитарных элементов костного мозга,.
Ведущее значение в патогенезе иммунный(гаптеновых) агранулоцитозов имеет появление в организме антител (агглютинины, лизины и т.д.), действие которых направлено против собственных гранулоцитов периферической крови или их клеток-предшественниц в костном мозгу.
Лейкоцитарная формула крови взрослых здоровых людей выглядит следующим образом:
| Виды | Содержание % | Абсолютное значение (кол-во клеток X 10?/л) |
| Лимфоциты | 19-37 | 1,2-3 |
| Моноциты | 3-11 | 0,09-0,6 |
| Нейтрофилы палочкоядерные (незрелые) | 1-6 | 0,04-0,3 |
| Нейтрофилы сегментоядерные | 47-72 | 2-5,5 |
| Базофилы | 0-1 | 0-0,065 |
| Эозинофилы | 0,5-5 | 0,02-0,3 |
Изменения лейкограммы принято обозначать терминами с определенными окончаниями.
Когда проводится расшифровка лейкограммы, учитывают ядерные сдвиги. Это изменения соотношения нейтрофилов зрелых и незрелых. В формуле крови разные формы нейтрофилов указаны в порядке от молодых к зрелым (слева направо).
Существует три типа сдвигов: влево, влево с омоложением и вправо.
При левом сдвиге присутствуют в крови миелоциты и метамиелоциты. Такое изменение происходит при следующих процессах:
· воспаления острые: пиелонефрит, простатит, орхит;
· высокие физические нагрузки.
При левом сдвиге с омоложением можно обнаружить в крови такие формы, как миелоциты, метамиелоциты, промиелоциты, миелобласты, эритробласты. Это наблюдается при таких состояниях, как:
· лейкозы (хронические, острые);
кома.
При уменьшении числа палочкоядерных (незрелых) нейтрофилов и повышении уровня сегментоядерных (зрелых форм, содержащих 5-6 сегментов) говорят о правом сдвиге. При таком изменении лейкограммы можно говорить о следующих патологиях и состояниях:
· последствия переливания крови;
· дефицит витамина B12, фолиеводефицитная анемия.
Степень сдвига оценивается с помощью специального индекса, который определяется отношением общего количества всех юных нейтрофилов (миелоцитов, метамиелоцитов, промиелоцитов, палочкоядерных) к зрелым сегментоядерным. Нормы для здоровых взрослых людей находятся в пределах 0,05-0,1
1. Ядерный сдвиг нейтрофилов влево — характеризуется появлением в гемограмме молодых и дегенеративных форм нейтрофилов, что наблюдается при:
- инфекционных заболеваниях,
- воспалительных процессах,
- злокачественных новообразованиях,
- интоксикациях.
По характеру ядерного сдвига нейтрофилов различают:
а) регенеративный сдвиг — при котором увеличивается количество палочкоядерных (П) и юных (Ю) нейтрофилов на фоне лейкоцитоза, что является показателем повышенной деятельности костного мозга; наблюдается при воспалительных и гнойно-септических процессах;
б) дегенеративный сдвиг — отмечается увеличение количества только палочкоядерных нейтрофилов и появление дегенеративных изменений в клетках. Это является показателем функционального угнетения костного мозга. Может протекать как с лейкоцитозом, так и с лейкопенией.
Дегенеративный сдвиг на фоне лейкоцитоза характерен для:
- сальмонеллеза,
- токсической дизентерии,
- острого перитонита,
- уремической и диабетической комы.
Дегенеративный сдвиг на фоне лейкопении характерен для:
- вирусных инфекций,
- тифопаратифозных заболеваний.
в) лейкемоидные реакции характеризуются появлением незрелых форм: миелоцитов (М), промиелоцитов и даже миелобластов на фоне выраженного лейкоцитоза.
- инфекционных болезней,
- туберкулеза,
- злокачественных новообразований (рак желудка, молочной железы, толстой кишки).
Тяжесть степени заболевания по индексу сдвига:
- тяжелая степень — индекс от 1,0 и выше,
- средней степени — индекс 0,3-1,0,
- легкая степень — индекс не более 0,3.
2. Ядерный сдвиг нейтрофилов вправо — среди нейтрофилов преобладают зрелые формы с 5-6 сегментами вместо обычных трех.
Ядерный сдвиг нейтрофилов вправо встречается:
- в норме у 20 процентов практически здоровых людей,
- при аддисонобирмеровской анемии,
- полицетемии,
- при лучевой болезни.
Ядерный сдвиг нейтрофилов вправо при инфекционных и воспалительных заболеваниях указывает на благоприятное течение.
источник
При уменьшении снабжения костного мозга железом, когда его количество становится меньше необходимого для нормальной продукции эритроцитов уровня, развивается анемическое состояние. Именно дефицит железа служит наиболее частой причиной анемии.
Этиология. Причинами развития железодефицита могут быть: 1) увеличенная потребность организма в железе; 2) недостаточное его поступление с продуктами питания; 3) снижение его всасываемости в желудочно-кишечном тракте и 4) кровопотери. Соответственно могут быть выявлены и группы риска по железодефицитным анемиям.
Потребность в железе увеличивается в период роста, в подростковом возрасте и при беременности. В США дефицит железа выявляют у 10 % детей дошкольного возраста, пик его частоты приходится на возраст 1—2 года. Увеличенная потребность в железе детского организма не может быть удовлетворена детским питанием, в котором преобладают молоко и злаковые и содержится очень мало мяса и овощей. Количество железа в этой диете невелико, а его ассимиляция может быть затруднена из-за присутствия железосвязывающих анионов, особенно фосфатов. В связи с этим детское питание следует обогащать железом. В подростковом возрасте дефицит железа может быть обусловлен нерегулярным режимом питания и недостаточным пережевыванием пищи. В период беременности плод потребляет из организма женщины около 500 мг железа, даже если у нее уже развилось железодефицитное состояние. Потребность организма в железе при беременности увеличивается примерно в три раза. Большинство беременных с профилактической целью должны принимать препараты железа в виде его солей. Если подобная профилактика не проводится, то частота развития железодефицитных состояний у беременных увеличивается более чем на 50 %.
Анемия вследствие недостаточного поступления железа в организм чаще всего развивается у представителей популяций, в диете которых очень невелико количество животных белков. Уже упоминалось о причинах недостаточного потребления железа детьми и подростками. У представителей низких социальных слоев населения и пожилых потребление железа с пищей находится на субоптимальном уровне из-за материальных трудностей, отсутствия зубов, безразличия к образу жизни.
Процессы всасываемости железа могут снижаться при многих заболеваниях. После частичной или полной гастрэктомии нарушаются процессы ассимиляции пищевого железа, в результате чего пиша с большей скоростью проходит те участки кишечника, в которых в основном всасывается железо. Ахлор- гидрия также сопровождается снижением процессов его всасывания. У больных с хронической диареей или мальабсорбцией также развивается недостаточность железа, особенно при вовлечении в процесс двенадцатиперстной и проксимальных отделов тонкой кишки. Иногда железодефицитная анемия служит предвестником нетропической спру (целиакия).
К ровопотери относятся к наиболее важным причинам развития железодефицитных состояний у взрослого человека. У женщин детородного возраста менструальные кровотечения ответственны за большинство случаев этих состояний. У женщин, принимающих противозачаточные эстроген-прогестероновые пилюли, менструальные кровопотери невелики, тогда как у женщин с внутриматочными спиралями они увеличены.
У взрослого мужчины самой частой причиной железодефицитного состояния бывают желудочно-кишечные кровотечения, однако их следует предположить у любого больного с дефицитом железа. В обследовании этих больных первостепенное значение имеет анализ кала на скрытую кровь. Поскольку желудочно-кишечные кровотечения бывают интермиттирующими, исследования кала на скрытую кровь необходимо проводить многократно в течение продолжительного периода. Пептические язвы, диафрагмальная грыжа, дивертикулез и рак служат наиболее частыми причинами этих кровотечений. Нередко скрытую кровь в кале выявляют при геморрое или у лиц, принимающих салицилаты, однако кровотечения при этом редко бывают значительными. Почти у 15 % лиц с точно диагностированным желудочно-кишечным кровотечением выявить его источники не удается даже с помощью тщательного рентгенологического и эндоскопического исследования. В странах тропического пояса основной причиной кровотечений у больных служат глистные инвазии, особенно анкилостомоз. Иногда при наследственной телеангиэктазии или геморрагическом диатезе кровотечения происходят из многочисленных участков желудочно-кишечного тракта. При тромбоцитопении, качественных изменениях тромбоцитов и при болезни Виллебранда желудочнокишечные кровотечения более часты, нежели при дефиците факторов свертывания крови.
Регулярное донорство чревато прогрессивным уменьшением резервов железа в организме, а у менструирующих женщин при этом может развиться истинный железодефицитный эритропоэз. Истощение запасов железа усиливается по мере учащения эпизодов сдачи крови. _
У некоторых, очень немногих, больных дефицит железа может быть обусловлен нарушением поступления в эритроидные клетки-предшественники железа, связанного с трансферрином. Это может быть врожденным состоянием или оно обусловлено образованием аутоантител к рецепторам трансферрина.
Клинические признаки. Поскольку дефицит железа развивается исподволь, у анемичных больных его симптомы часто отсутствуют. В основном клинические признаки железодефицитной анемии сходны с таковыми при других анемиях той же тяжести (см. гл. 53). Больные чаще всего жалуются на слабость, утомляемость, вялость, сердцебиение. Могут определяться изменения в тонких механизмах поведенческих реакций. Даже при незначительно выраженной железодефицитной анемии может заметно снижаться работоспособность, которая, однако, быстро нормализуется при лечении препаратами железа. До настоящего времени неясна роль снижения активности в определенных тканях железосодержащих ферментов и кофакторов. Многие лица с дефицитом железа, не сопровождающимся выраженными признаками анемии, жалуются на повышенную утомляемость и слабость, однако эти неспецифические симптомы довольно трудно оценить. Иногда у них извращается вкус, что проявляется желанием грызть твердые вещества. Больной не может преодолеть желания есть глину (геофагия), крахмал (амилофагия) или лед (пагофагия). Эти симптомы быстро исчезают после приема препаратов железа. При дефиците железа могут появиться симптомы со стороны желудочнокишечного тракта. При длительном и выраженном дефиците у больного может наступить дисфагия вследствие истончения слизистой оболочки части пищевода, которая расположена ниже перстневидного хряща гортани (симптом Пламмера— Винсона). Чаще у больного выявляют менее специфичные проявления, такие как снижение аппетита, тошнота, отрыжка, запоры, хотя и не установлено, связаны ли они непосредственно с дефицитом железа. У больных с продолжительным дефицитом нередко обнаруживают ахлоргидрию и атрофию слизистой оболочки желудка, женщины обычно страдают меноррагиями. Однако чаще всего атрофия слизистой оболочки желудка и меноррагии служат причиной железодефицитного состояния, а не его следствием.
При физикальном обследовании обращают на себя внимание бледность кожных покровов и слизистых оболочек, тахикардия и «агемические» сердечные шумы, т. е. то же, что и при других формах анемий. При продолжительном дефиците железа ногтевые пластинки становятся сухими, ломкими и исчерченными, иногда они деформируются и их поверхность становится вогнутой (койлонихия). В углах рта появляются эрозии (ангулярный стоматит), язык болезнен, а его сосочки атрофируются (глоссит). Спленомегалия определяется редко. Негематологические проявления дефицита железа, такие как койлонихия, ангулярный стоматит, глоссит и изменения слизистой оболочки пищевода, в настоящее время определяются редко, вероятно, вследствие того, что дефицит железа стали рано диагностировать и проводить соответствующее лечение.
Лабораторные данные. Для диагностики железодефицитных состояний разной степени прибегают к помощи разнообразных лабораторных методов исследования. У взрослых железодефицитное состояние развивается поэтапно, и для каждого этапа характерны определенные изменения лабораторных данных. В самом начале уменьшаются запасы железа, что, однако, не сопровождается уменьшением количества железа, предназначенного для эритропоэза. В аспирате костного мозга, окрашенном Ргшяап Ыие, выявляют заметное уменьшение или даже отсутствие запасов железа в макрофагах на фоне снижения уровня сывороточного ферритина. На следующем этапе ‘ -развивается железодефицитный эритро- п о э з со снижением захвата железа эритроидными клетками, но без развития анемии. При этом вначале повышается железосвязывающая способность сыворотки, а затем снижается уровень сывороточного железа, в результате чего заметно уменьшается фракционное насыщение трансферрина. Эритроциты крови становятся микроцитарными и гипохромными, в них увеличивается содержание свободного протопорфирина.
При развившейся железодефицитной анемии эритроциты становятся все более гипохромными и микроцитарными. Нередко в них определяется очень тонкий слой цитоплазмы в виде кольца. В крови можно также видеть их обломки и причудливой формы пойкилоциты. Период жизни в крови этих деформированных эритроцитов укорочен. Относительное число ретикулоцитов обычно остается в пределах нормы, но после острой кровопотери может временно увеличиваться. Число лейкоцитов и тромбоцитов соответствует норме, но иногда может увеличиться число последних. В костном мозге происходит умеренная гиперплазия эритроид- ного ростка. Многие поздние эритробласты отличаются скудностью цитоплазмы.
Дифференциальная диагностика. При диагностике у больного с гипохромной микроцитарной анемией следует иметь в виду прежде всего железодефицитное состояние, талассемию, сидеробластную анемию и анемию вследствие хронических воспалений. В дифференциальной диагностике помощь оказывают некоторые лабораторные методы исследования (табл. 284-1). Железодефицитные состояния легкой и средней степени могут быть легко спутаны с р-талассемией либо с двумя делеционными формами а-талассемии (а — /а— или — —/аа). При этих формах талассемии более выражен микроцитоз, нежели гипохромия, соответственно среднее количество гемоглобина в одном эритроците обычно находится в пределах нормы. Распределение эритроцитов по размеру более однородно, чем при железодефицитной анемии. Для талассемии в большей степени, нежели для железодефицитных состояний, характерны клетки-мишени и базофильные включения. Концентрация гемоглобина Аг увеличена при признаке р-талассемии и уменьшена при дефиците железа и а-талассемии. Признак (3-талассемии может быть замаскирован при нормальном уровне гемоглобина Аг у больного с дефицитом железа. При талассемиях уровень сывороточного железа находится в пределах нормы или
Таблица 284-1. Дифференциальная диагностика микроцитарных гипохромных анемий
Важно помнить, что некоторые лекарственные средства (и другие вещества) могут в значительной степени ускорять либо замедлять скорость всасывания железа в кишечнике. Применять их совместно с препаратами железа стоит осторожно, так как это может привести к передозировке последних, или, наоборот, к отсутствию лечебного эффекта.
При неосложненном течении и правильно проводимом лечении необходимости в данной процедуре нет. Показаниями к переливанию эритроцитов являются:
Эритроциты следует переливать максимально короткий промежуток времени, пока не будет устранена угроза жизни пациента. Данная процедура может осложниться различными аллергическими реакциями, поэтому перед ее началом необходимо провести целый ряд тестов на определение совместимости крови донора и реципиента.
Причиной затруднений в лечении железодефицитной анемии может быть:
При нарушениях в диагностике и лечении заболевания возможно развитие различных осложнений, некоторые из которых могут представлять опасность для здоровья и жизни человека. Осложнениями железодефицитной анемии могут быть:
источник | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Железодефицитная анемия (ЖДА) – заболевание крови, вызываемое недостаточным поступлением железа в организм либо нарушением процессов его утилизации. ЖДА не является первичным заболеванием, а всегда обусловлена какой-либо патологией. Дефицит железа в организме приводит к нарушению процессов кроветворения – нарушается синтез гемоглобина в эритроцитах, в результате чего снижается их количество и функциональные способности.
Железодефицитная анемия (ЖДА) – заболевание крови, вызываемое недостаточным поступлением железа в организм либо нарушением процессов его утилизации. ЖДА не является первичным заболеванием, а всегда обусловлена какой-либо патологией. Дефицит железа в организме приводит к нарушению процессов кроветворения – нарушается синтез гемоглобина в эритроцитах, в результате чего снижается их количество и функциональные способности.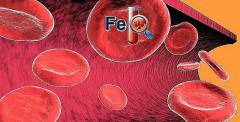 Анемия – это патологическое состояние, характеризующееся уменьшением концентрации эритроцитов и гемоглобина в крови. Если развитие данного состояния обусловлено недостаточным поступлением железа в красный костный мозг и связанным с этим нарушением эритропоэза, то анемия называется железодефицитной.
Анемия – это патологическое состояние, характеризующееся уменьшением концентрации эритроцитов и гемоглобина в крови. Если развитие данного состояния обусловлено недостаточным поступлением железа в красный костный мозг и связанным с этим нарушением эритропоэза, то анемия называется железодефицитной. Железодефицитная анемия может развиться как в результате недостаточного поступления железа в организм, так и при нарушении процессов его использования.
Железодефицитная анемия может развиться как в результате недостаточного поступления железа в организм, так и при нарушении процессов его использования.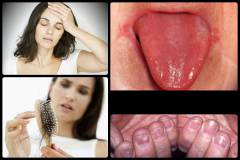 Симптомы данного заболевания обусловлены, недостатком железа в организме и нарушением кроветворения в красном костном мозге. Стоит отметить, что дефицит железа развивается постепенно, поэтому в начале заболевания симптоматика может быть довольно скудной. Латентный (скрытый) дефицит железа в организме может привести к появлению симптомов сидеропенического (железодефицитного) синдрома. Несколько позже развивается анемический синдром, тяжесть которого обусловлена уровнем гемоглобина и эритроцитов в организме, а также скоростью развития анемии (чем быстрее она развивается, тем выраженнее будут клинические проявления), компенсаторными возможностями организма (у детей и пожилых людей они менее развиты) и наличием сопутствующих заболеваний.
Симптомы данного заболевания обусловлены, недостатком железа в организме и нарушением кроветворения в красном костном мозге. Стоит отметить, что дефицит железа развивается постепенно, поэтому в начале заболевания симптоматика может быть довольно скудной. Латентный (скрытый) дефицит железа в организме может привести к появлению симптомов сидеропенического (железодефицитного) синдрома. Несколько позже развивается анемический синдром, тяжесть которого обусловлена уровнем гемоглобина и эритроцитов в организме, а также скоростью развития анемии (чем быстрее она развивается, тем выраженнее будут клинические проявления), компенсаторными возможностями организма (у детей и пожилых людей они менее развиты) и наличием сопутствующих заболеваний. Врач любой специальности может заподозрить наличие анемии у человека, основываясь на внешних проявлениях данного заболевания. Однако установлением вида анемии, выявлением ее причины и назначением соответствующего лечения должен заниматься врач-гематолог. В процессе диагностики он может назначить целый ряд дополнительных лабораторных и инструментальных исследований, а при необходимости привлечь специалистов из других областей медицины.
Врач любой специальности может заподозрить наличие анемии у человека, основываясь на внешних проявлениях данного заболевания. Однако установлением вида анемии, выявлением ее причины и назначением соответствующего лечения должен заниматься врач-гематолог. В процессе диагностики он может назначить целый ряд дополнительных лабораторных и инструментальных исследований, а при необходимости привлечь специалистов из других областей медицины. На современном этапе развития медицины железодефицитная анемия является относительно легко излечимым заболеванием. Если диагноз поставлен своевременно, проведена комплексная, адекватная терапия и устранена причина дефицита железа, никаких остаточных явлений не будет.
На современном этапе развития медицины железодефицитная анемия является относительно легко излечимым заболеванием. Если диагноз поставлен своевременно, проведена комплексная, адекватная терапия и устранена причина дефицита железа, никаких остаточных явлений не будет.