Анемия хронических заболеваний (АХЗ) – не нозологическая форма, не синдром, а собирательное понятие, характеризующееся общностью патогенеза этого осложнения различных заболеваний. К данным анемиям относят:
анемии при злокачественных опухолях, как с поражением костного мозга (гемобластозы, метастазы в костный мозг), так и без него;
анемии воспаления, в том числе: — при острых инфекциях (сепсис, пневмония, инфекционный эндокардит, перитонит); — при хронических инфекциях (остеомиелит, хр. пиелонефрит, туберкулез); — хр. воспалительных заболеваниях с преобладанием иммунокомплексного механизма (ревматоидный артрит, гепатит, СКВ, болезнь Крона);
анемия при острой и хронической почечной недостаточности, в том числе и у больных, находящихся на гемодиализе;
анемия при хронической сердечной недостаточности;
анемии при эндокринопатиях (гипофункция щитовидной железы, сахарный диабет).
Характерной особенностью АХЗ является многофакторность патогенеза. Выделяют следующие механизмы:
Угнетение эритропоэза: — активация ингибиторов эритропоэза, — ингибиция эритропоэза цитостатиками, — конкурентное вытеснение эритрона из костного мозга опухолевыми клетками.
Сокращение продолжительности жизни эритроцитов: — внутрисосудистый механический гемолиз при ДВС-синдроме, — аутоиммунный гемолиз. — кровопотери
Нарушение обмена железа: — повышенное потребление железа неэритроидными клетками, в том числе бактериями, — нарушение высвобождение железа запасов макрофагами, — дефицит железа при хронических кровопотерях.
Клиническая картина. Специфической клинической картины при данной анемии нет. Анемия легкая или умеренная, чаще всего больные адаптированы к анемии, поэтому не вызывает жалоб, но у пожилых людей может приводить к сердечно-сосудистым нарушениям, не выражена желтушность, не увеличена селезенка. Важной особенностью служит независимость анемии от основных симптомов заболевания, являющегося причиной анемии: нет корреляции между уровнем гемоглобина и азотистых шлаков при уремии, активности СКВ и ревматоидного артрита, тяжестью инфекционного процесса.
нормохромные эритроциты обычных размеров и форм;
уровень гемоглобина не опускается ниже 100г/л (исключая больных тяжелой почечной недостаточности).
отсутствие лейкоцитопении и тромбоцитопении или разнонаправленные изменения их концентрации, не коррелирующие с анемией;
нормальный или несколько повышенный уровень ретикулоцитов;
нормальный или слегка повышенный уровень эритропоэтина в крови;
наличие в сыворотке крови ингибиторов эритропоэза ( ТNFa,IL-1 и др)
нормальный уровень в крови витамина В12 и фолиевой кислоты;
нормальный уровень запасов железа, нормальные показатели ОЖСС, ферритина и растворимых рецепторов к трансферрину (если нет выраженного железодефицитного компонента).
Коррекция анемии при АХЗ нужна не всем пациентам. Необходимо оценить переносимость пациентом анемии. Часто анемия компенсируется при лечении основного заболевания.
Нет оснований рекомендовать назначение витамина В12 или фолиевую кислоту, без прямого определения недостаточности уровня этих витаминов в крови.
Терапия эритропоэтином проводится больным с хронической почечной недостаточностью, ВИЧ- инфицированным больным, у больных с онкологической патологией. Оценивая антианемический эффект эритропоэтина при опухолях, отмечено не столько прирост гемоглобина, сколько улучшение качества жизни больных.
Анемия при злокачественных опухолях. Распространенность данного вида анемии колеблется от 30 до 90%. У 40% больных лимфомами анемия выявлена к моменту постановки диагноза. У пациентов, госпитализированных по поводу анемии, частота злокачественных новообразований с локализацией в ЖКТ составляет от 5до 15%. Активация воспалительных и опухолевых цитокинов (фактор некроза опухоли, интерлейкины, интерферон) приводит к подавлению выработки эритропоэтина, нарушению высвобождения железа из макрофагов и подавлению пролиферацию клеток предшественников эритропоэза.
Анемии воспаления. Воспалительные цитокины действуют быстро и эффективно, при острой бактериальной инфекции легкая анемия может развиться уже через 24-48 часов. Сначала концентрация Нb падает из-за кратковременного гемолиза, макрофаги удаляют из крови отжившие эритроциты (перераспределение железа в организме – увеличенное потребление макрофагами), в последующем угнетение эритропоэза идет воспалительными цитокинами. При хроническом воспалении тяжесть и характер анемии зависит от природы основного заболевания.
Анемия при воспалительных заболеваниях характеризуется снижением, как сывороточной концентрации железа, так и ОЖСС. Насышение трансфферина уменьшается до 10-20% и на этом фоне повышенный уровень ферритина, а при исследовании костного мозга нормальные или увеличенные запасы железа в сочетании с гипоплазией эритроидного ростка.
Определение сывороточных концентраций провоспалительных цитокинов, эритропоэтина, рецептора трасферрина не имеет дифференциально-диагностического значения. При выраженной гипорегенераторной анемии, с поражением костного мозга отмечается панцитопения. В этой ситуации измерение концентрации эритропоэтина позволит определить, чему принадлежит основная роль в возникновении анемии — поражению костного мозга или воспалению. Низкая концентрация эритропоэтина указывает на преимущественную воспалительную этиологию анемии, таким больным показаны препараты эритропоэтина.
Анемия при хронической сердечной недостаточности (ХСН) варьирует от 14,4 до 55%. Считается, что анемия является независимым показателем выживания больных с ХСН. Важным фактором развития данной анемии является почечная дисфункция, воспаление, резистентность к эритропоэтину, кишечная мальабсорбция, постоянное использование аспирина и протеинурия. Значение почечной дисфункции подтверждалось в исследованиях К.К. Witte et al., установивших, что снижение уровня гемоглобина ниже 125г/л сопровождалось повышением уровня креатенина, отсутствует корреляция между уровнем гемоглобина и уровнем эритропоэтина. Отмечается значительное повышение сывороточного натрий уретического пептида В. Не изучалась влияние гидремии на снижение концентрации гемоглобина. Является ли анемия следствием развития сердечной дисфункции и роль анемии в развитии сердечной недостаточности – вопросы остаются открытыми.
Анемия при хронических болезнях почек (ХБП) — нормоцитарная нормохромная, при развитии недостаточности железа – гипохромная, является одним из осложнений ХБП, влияющих на качество жизни и общую выживаемость больных, появляется у больных с заболеваниями почек при уменьшении скорости клубочковой фильтрации (СКФ) ниже 50 мл/мин/1,73 м 2 . Анемия усиливается при прогрессировании ХБП, так как сморщивание почек приводит к падению синтеза гормона эритропоэтина. До назначения средств, стимулирующих эритропоэз, необходимо провести первичное клинико-лабораторное исследование для выявления иных возможных причин анемии, усугубляющих относительный дефицит эритропоэтина.
снижение продукции эритропоэтина
укорочение жизни эритроцитов,
тромбоцитарная дисфункция, ДВС — синдром с присущей ему кровоточивостью и внутрисосудистым гемолизом
действие уремических токсинов на эритроциты
снижение уровня железа из-за неадекватного всасывания в кишечнике и гемодиализных кровопотерь
Выраженность и длительность почечной анемии при ХБП во многом определяют тяжесть астенического синдрома, степень переносимости ими физической нагрузки, чувствительность к инфекции. В консервативной стадии ХБП лишь 25% больных получают антианемическую терапию. В настоящее время установлено, что частота обнаружения эксцентрической формы гипертрофии левого желудочка прямо пропорционально тяжести эритропоэтиндефицитной анемии. При значительной ГЛЖ смертность больных с ХБП увеличивается в 4 раза, риск развития инфаркта миокарда в 3-6 раз. Уменьшение уровня гемоглобина на 1 г/дл повышает летальность от сердечно-сосудистых и инфекционных осложнений ХБП почти на 20%.
Лабораторное обследование включает следующие показатели:
Нb, эритроцитарные индексы, концентрацию ферритина, определение С- реактивного белка для выявления воспалительной реакции.
В случае недостаточной информативности данных, полученных на начальном этапе, проводят развернутое клиническое обследовании, которое включает: выявление кровопотерь через ЖКТ (тест на скрытую кровь), исследование витамина В12 и фолата, концентрацию интактного паратиреоидного гормона, гемолитические тесты (гаптоглобин, билирубин, тест Кумбса), электрофорез белков крови или мочи, концентрацию алюминия в плазме.
для диагностики почечной анемии редко требуется измерение уровня эритропоэтина в сыворотке крови, поскольку имеется прямая корреляция между выраженностью анемии и степенью снижения почечной функции.
Принципы лечения анемии при ХБП (EBPG II):
Лечение анемии с использованием средств, стимулирующих эритропоэз (ССЭ) должно назначаться всем пациентам с ХБП, имеющим уровень Нb ниже 110г/л, данный уровень следует достигнуть в течении 4 месяцев от начала противоанемического лечения;
всем больным, получающим ССЭ дополнительно назначают препараты железа, с регулярной оценкой концентрации сывороточного ферритина целевые значения 200-500мкг/л
способ введения ССЭ определяется категорией пациентов, а так же зависит от типа используемого препарата. Доза ССЭ титруется в соответствии с уровнем Нb. У больных ХБП 1-V стадии без диализа эпоэтин бета вводится п/к 1-3 раза в неделю, поддерживающие дозы 1-3 раза в недель, дарбепоэтин альфа: 1 раз в неделю, поддерживающая доза 1 раз в 1 или 2 недели
Эпоэтин альфа не разрешен для п/к применения в большинстве стран Европы из- за риска развития красноклеточной аплазии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МИКРОЦИТАРНЫХ АНЕМИЙ
Число заболеваний, с которыми проводится дифференциальный диагноз ЖДА, невелико – это талассемия, анемии связанные с нарушением синтеза порфиринов и гемма, анемия вследствие хронических заболеваний. При гипохромных анемиях с высоким содержанием железа не наблюдается трофические расстройства, свойственные ЖДА – выпадение волос, ломкость ногтей, извращение вкуса, дисфагия.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОРЕГЕНЕРАТОРНЫХ АНЕМИЙ
источник
Анемия при хроническом заболевании (анемия вследствие нарушения реутилизации железа) является мультифакториальной и часто сопровождается дефицитом железа. Для постановки диагноза обычно требуется наличие хронической инфекции, воспаления, рака, микроцитарной или погранично-нормоцитарной анемии, показателей сывороточного трансферрина и ферритина, которые определяются в значениях между типичными для железодефицитной анемии и сидеробластной анемии. Терапия направлена на лечение основного заболевания, а если оно носит необратимый характер, сводится к применению эритропоэтина.
Во всем мире анемия при хроническом заболевании является второй по распространенности. На ранних этапах эритроциты нормохромные, но с течением времени они становятся микроцитарными. Основной проблемой является неспособность эритроидного ряда костного мозга к пролиферации в ответ на анемию.

Этот тип анемии следует заподозрить при наличии хронического заболевания чаще инфекционного, воспалительного процесса (особенно ревматоидного артрита) или злокачественного новообразования, однако аналогичный процесс имеет место при любой инфекции или воспалении.

Выделяют три патофизиологических механизма:
- умеренное укорочение времени жизни эритроцитов по пока неясным причинам у больных раком или с хроническими гранулематозными инфекциями;
- нарушение эритропоэза вследствие снижения продукции ЭПО и ответа костного мозга на него;
- нарушение внутриклеточного метаболизма железа.
Ретикулярные клетки удерживают железо, полученное из старых эритроцитов, делая недоступным для синтеза гемоглобина; таким образом, невозможна компенсация анемии путем повышения продукции эритроцитов. Макрофагальные цитокины (например, IL-1, фактор некроза опухоли а, интерферон ) у больных с инфекцией, воспалительным процессом и раком вызывают или способствуют уменьшению продукции ЭПО и нарушают метаболизм железа.

Клинические проявления, как правило, те, которые определяют основное заболевание (инфекция, воспаление или злокачественное новообразование).

Анемия на фоне хронического заболевания предполагается у больных с микроцитарной или погранично-нормоцитарной анемией с хронической инфекцией, воспалением или раком. Если есть подозрение на хроническую анемию, необходимо исследовать сывороточное железо, трансферрин, рецептор трансферрина и сывороточный ферритин. Уровень гемоглобина обычно превышает 80 г/л, пока дополнительные процессы не приведут к прогрессированию анемии. Если в дополнение к хроническому заболеванию имеется железодефицитное состояние, уровень сывороточного ферритина обычно составляет менее 100 нг/мл, и, если при наличии инфекции, воспаления или злокачественного новообразования уровень ферритина несколько меньше 100 нг/мл, предполагается, что параллельно с вызванной хроническим заболеванием анемией имеется и железодефицит. Вместе с тем, учитывая возможность ложного повышения уровня сывороточного ферритина в качестве маркера острой фазы, в случаях высокого уровня сывороточного ферритина (> 100 нг/мл) в дифференциальной диагностике железодефицита и анемии на фоне хронического заболевания помогает определение рецептора сывороточного трансферрина.

источник
Одним из самых редких, но тяжелых заболеваний системы кровообращения считается апластическая анемия, симптомы, причины, методы лечения этого вида малокровия бывают различны. Все зависит от формы, вида и степени тяжести данной патологии.
Люди, далекие от медицины, зачастую не имеют представления о том, что такое апластическая анемия. Так называется расстройство кроветворной функции костного мозга, ведущее к снижению выработки кровяных клеток. Это приводит к серьезным патологическим изменениям во всех системах человеческого организма. Очень часто заболевание заканчивается летально.
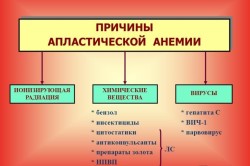
Этиология апластической анемии до сих пор досконально не изучена. Поэтому окончательный список причин данного заболевания все еще полностью не составлен. На данный момент основными причинами апластического малокровия считаются:
- плохая экология в регионе проживания;
- ионизирующая радиация;
- постоянные контакты с опасными химическими веществами в течение долгого времени;
- отдельные инфекционные заболевания: гепатит, цитомегаловирус;
- разрушение костного мозга под воздействием некоторых медикаментозных средств при их длительном приеме в высоких дозах, особенно левомицетина, мышьяка, бензола, химических препаратов, противоопухолевых средств, антибиотиков;
- генетическая предрасположенность;
- беременность;
- патологии костного мозга;
- злоупотребление алкоголем.
Возникновение апластической анемии у детей сразу после рождения может быть спровоцировано такими причинами, как:
- врожденный сифилис;
- токсоплазмоз;
- генерализованный мегалоцитоз.
Часто у детей диагностируется идиопатическая апластическая анемия. В этом случае определить точную причину возникновения патологии не представляется сегодня возможным.
При гипопластической анемии наблюдается еще более серьезное расстройство кроветворной функции костного мозга. В целом гипопластические и апластические анемии вызывают сходные патологии органов и систем организма, имеют похожую симптоматику и лечатся примерно одинаково.
Костный мозг образуется губчатой структурой и располагается в глубине трубчатых костей. Посредством его структуры происходит выработка различных клеток крови: лейкоцитов, тромбоцитов, эритроцитов.
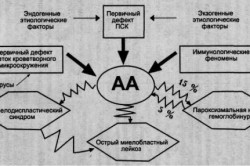
При апластической анемии, прежде всего, нарушается эритрогенез. Стимулировать этот процесс медикаментозными средствами невозможно. В этом случае может помочь только пересадка донорского костного мозга.
Помимо этого, апластичная анемия развивается на фоне уменьшения количества и изменения функций стволовых клеток.
Причиной этого становится нарушение микроокружения, клеточное или гуморальное воздействие иммунного характера, препятствующее нормальному функционированию стволовых клеток.
Апластическая анемия, симптомы которой часто незаметны, является серьезной патологией. В отдельных случаях недуг начинается в острой форме с быстрым нарастанием симптоматических проявлений. Развитие болезни может быстро прогрессировать, приводя к летальному исходу. Возможно также хроническое с периодическими ремиссиями и рецидивами протекание анемии.
Апластическая анемия симптомы имеет следующие: анемический, геморрагический и лейкоцитопенический синдромы. Для каждого из них характерны определенные признаки.
Анемический синдром (снижение уровня гемоглобина) возникает при нарушении формирования эритроцитов и сопровождается такими симптомами, как:
- общая слабость;
- сонливость;
- бессонница;
- раздражительность;
- одышка;
- шум в ушах;
- тахикардия;
- бледность кожных покровов;
- быстрая утомляемость.
Геморрагический синдром (повышение кровоточивости) вызван понижением уровня тромбоцитов в крови. Его сопровождают такие симптомы, как:
- петехии, т. е. точечные кровоизлияния на коже и слизистых оболочках и гематомы;
- плохая свертываемость крови;
- десневые и носовые кровотечения;
- появление крови в моче;
- обильные менструальные выделения у женщин.

Он сопровождается следующими симптомами:
- появление хронических очагов инфекции в различных органах и на поверхности кожи больного;
- учащение инфекционных заболеваний, протекающих длительно и со многими осложнениями;
- стоматит;
- внезапная гипертермия без видимых причин.
По форме апластическая и гипопластическая анемия может быть как врожденной, так и приобретенной.
После проведения анамнестической беседы врач проводит общий осмотр пациента. При этом обязательно применяются такие методы, как:
- выслушивание (аускультация) сердечных шумов;
- простукивание (перкуссия) живота, показывающая увеличение таких органов, как печень и селезенка;
- прощупывание (пальпация) для уточнения результатов перкуссии.
Для получения дополнительных сведений больному назначается:
- общий анализ крови;
- биохимический анализ крови;
- клинический анализ крови — гемограмма;
- забор мазка — биопсия, костного мозга;
- анализ мазка костного мозга, на основании которого составляется миелограмма.
При необходимости больному проводятся специальное тестирование, помогающее уточнить причину заболевания.
На основании всех полученных данных составляется точная клиническая картина заболевания, необходимая для определения курса лечения.
Когда больному диагностируется апластическая анемия, лечение проводится по 3 направлениям: этиологическому, симптоматическому и патогенетическому. Если известна точная причина возникновения заболевания, ее необходимо ликвидировать: прекратить контакт с токсинами, сменить лекарственные препараты, используемые для лечения других заболеваний и т. д.
Восстановлению кроветворного функционирования костного мозга помогают следующие препараты:
- кортикостероиды;
- андрогены;
- цитоксины;
- иммуносупрессоры.
Помимо медикаментозной терапии лечение апластической анемии проводится при помощи таких процедур, как переливание крови и ТКМ. Посредством переливания донорской крови организм больного частично обеспечивается недостающими кровяными клетками.
В особых случаях больным проводится трансплантация костного мозга. Костный мозг донора должен максимально соответствовать костному мозгу реципиента. Поэтому этот метод особенно эффективен, если у больного есть однояйцевый близнец. Процент выживаемости после трансплантации костного мозга выше у реципиентов более молодого возраста.

Основными факторами, влияющими на получение положительных эффектов, являются:
- Степень тяжести заболевания.
- Правильный выбор и хорошая переносимость лечения.
- Возраст больного. Легкая апластическая анемия у детей и молодых людей, не достигших 30-летнего возраста, полностью вылечивается чаще, чем у людей среднего и старшего возраста. При тяжелых формах болезни прогнозы не столь благоприятные.
Основным условием ремиссии и значительного продления жизненного срока является хорошая переносимость патогенетической терапии и успешное проведение трансплантации костного мозга.
Профилактика анемии различного вида может быть первичной или вторичной. Первичная профилактика предполагает исключение возможности развития данной патологии у относительно здорового человека. Этого можно добиться при помощи таких способов, как:
- ведение здорового образа жизни;
- правильное питание;
- постоянное укрепление иммунной системы;
- исключение или сведение к минимуму контакта с ионизирующими излучателями и токсичными веществами, вызывающими патологии костного мозга;
- контролированный прием лекарственных препаратов во время лечения других заболеваний;
- периодические визиты к терапевту и гематологу;
- полный отказ от употребления алкоголя и никотина.
Вторичная профилактика анемии проводится для замедления развития заболевания, избегания его осложнения сопутствующими патологиями. Для этого необходимо:
- аккуратное проведение лечения;
- постоянный контроль специалистов — гематолога и терапевта;
- тщательное контролирование больным своего состояния, немедленное посещение врача при появлении новых симптомов;
- постоянный прием поддерживающих препаратов в течение долгого времени.
Апластическая анемия — опасная патология, которую лечат годами. Только под наблюдением специалиста можно добиться стойкой ремиссии патологии. Самолечение в этом случае неприемлемо и может привести к плачевным последствиям.
источник
Анемия определяется как снижение концентрации гемоглобина в периферической крови ниже показателя 120 г/л у женщин и 140 г/л у мужчин. Заболевание может протекать в разных формах, которые определяются по характерным признакам анемии.
Чтобы предотвратить анемию, необходима эффективная и слаженная работа почек, спинного мозга и питательных веществ в организме. Если хоть с одним из элементов этой системы что-то не так, возникает анемия.
Признаки анемии различны в зависимости от причины ее возникновения и тяжести патологии. На первый взгляд, может показаться, что у пациента обычная простуда или усталость. Но при появлении слабости, головокружения, бледности кожных покровов и слизистых оболочек, раздражительности можно предположить наличие анемии. При легкой форме анемии ее признаки могут какое-то время оставаться незамеченными, но становятся очевидными по мере ухудшения состояния, прогрессировании болезни.
В запущенной форме хроническая анемия проявляется одышкой, холодностью конечностей, нерегулярными менструациями или аменореей, замедленным заживлением ран, болью в груди, быстрым или нерегулярным пульсом, а также выпадением волос и ломкостью ногтей.
Нечастыми признаками анемии могут также быть обмороки, покалывания в руках и ногах (парестезии), низкое кровяное давление (при серьезной потере крови), низкая устойчивость к инфекции, болезненное учащенное сердцебиение (тахикардия), иногда увеличение селезенки.
Уменьшение количества красных кровяных клеток — еще не показатель анемии, потому что при некоторых ее разновидностях (например, гипохромная анемия) количество эритроцитов остается нормальным, но средняя концентрация гемоглобина низкая. Кроме того, образ жизни, рост, возраст и пол, могут существенно повлиять как на количество эритроцитов, так и на концентрацию гемоглобина. Если развитие анемии идет медленно, организм может адаптироваться к ней, вплоть до уровня гемоглобина 60 г/л.
При таком недуге, как анемия, в первую очередь, страдает иммунитет. Проблемы с иммунной системой отражаются на общем состоянии всего организма. И в данном случае возникшую простуду или вирусную инфекцию можно считать наименьшим злом, потому что хроническая анемия может способствовать развитию более серьезных заболеваний, например, сердечно—сосудистой системы, а также привести к нарушению работы центральной нервной системы.
Анемия особенно опасна для женщин «в положении». Она может привести к выкидышу, как на раннем, так и на позднем сроке, плацентарной недостаточности и даже преждевременным родам, что в результате может негативно повлиять на дальнейшее развитие малыша. Анемичные дети чаще подвержены простудам, могут отставать в физическом и умственном развитии.
Сама анемия является скорее состоянием (признаком) какого-либо недуга, а не самим заболеванием. Врачами анемия рассматривается либо в хронической, либо в острой форме. Хроническая анемия развивается в течение относительно длительного времени, в то время как острая анемия начинается внезапно. Только врач может определить наличие той или иной формы заболевания.
Хроническую анемию могут спровоцировать различные нарушения в работе органов и систем: функции костного мозга, печени, аутоиммунные состояния, почек, эндокринной и пищеварительной систем, а также инфекционные и онкологические заболевания, гельминтозы (инвазии паразитами).
Эритроциты живут в среднем 100 дней, поэтому организм постоянно меняет отмершие красные клетки на новые. Красные клетки (эритроциты) синтезируются в костном мозге. В качестве причины анемии, в первую очередь, рассматриваются кровотечение или расстройство процесса синтеза красных кровяных клеток в кости. Анемия встречается у взрослых и детей, но в преклонном возрасте она проявляется чаще. Примерно 10% населения страдает анемией, женщины в два раза чаще мужчин.
Существует множество заболеваний, которые вызывают хроническую анемию. Среди них:
- наружное кровотечение (кровоизлияние), вызванное менструацией, язвой;
- дефицит железа (костный мозг нуждается в железе для синтеза красных кровяных клеток);
- хронические заболевания (любое такое заболевание может привести к анемии);
- болезни почек (почки выделяют гормон эритропоэтин, необходимый для стимуляции эритропоэза — процесса образования эритроцитов);
- снижение чрезмерного объема крови при остром или хроническом кровотечении;
- чрезмерное разрушение эритроцитов при гемолитических заболеваниях;
- снижение эритропоэза из-за угнетенного синтеза нуклеопротеидов, которые в норме его стимулируют;
- дефицит железа в рационе питания;
- угнетение костного мозга (при отравлении);
- беременность (задержка воды и жидкостей во время беременности приводит к разжижению крови и уменьшению процентного содержания красных кровяных телец);
- плохое питание (витамины и минералы имеют жизненно важное значение для синтеза эритроцитов),
- алкоголизм (включая низкий уровень витаминов и минералов),
Другие причины являются менее распространенными. Среди них заболевания печени, нарушения свертываемости крови, инфекции, рак, артрит, дефицит ферментов, токсины или наследственные заболевания.
Лечение анемии основывается, в первую очередь, на устранение ее причины, потому что в некоторых случаях она угрожает жизни пациента и требует переливания крови.
Некоторыми лекарственными средствами и методами лечения анемии являются:
- железо (во время беременности, когда уровень железа в организме низкий),
- витаминные добавки (для покрытия потребности в фолиевой кислоты и витамина В 12)
- антибиотики, когда речь идет о инфекции.
Быстрее всего восстанавливаются молодые пациенты, в то время как для людей преклонного возраста необходимо более длительное лечение. И это связано с преобладанием у них хронических заболеваний. Анемия ухудшает почти все физиологические недомогания.
Профилактика анемии состоит в полноценном и сбалансированном питании, с употреблением мяса, молочных продуктов, овощей и фруктов. Эти продукты являются источником железа и витаминов, необходимых организму для выработки гемоглобина в крови.
источник
При уменьшении снабжения костного мозга железом, когда его количество становится меньше необходимого для нормальной продукции эритроцитов уровня, развивается анемическое состояние. Именно дефицит железа служит наиболее частой причиной анемии.
Этиология. Причинами развития железодефицита могут быть: 1) увеличенная потребность организма в железе; 2) недостаточное его поступление с продуктами питания; 3) снижение его всасываемости в желудочно-кишечном тракте и 4) кровопотери. Соответственно могут быть выявлены и группы риска по железодефицитным анемиям.
Потребность в железе увеличивается в период роста, в подростковом возрасте и при беременности. В США дефицит железа выявляют у 10 % детей дошкольного возраста, пик его частоты приходится на возраст 1—2 года. Увеличенная потребность в железе детского организма не может быть удовлетворена детским питанием, в котором преобладают молоко и злаковые и содержится очень мало мяса и овощей. Количество железа в этой диете невелико, а его ассимиляция может быть затруднена из-за присутствия железосвязывающих анионов, особенно фосфатов. В связи с этим детское питание следует обогащать железом. В подростковом возрасте дефицит железа может быть обусловлен нерегулярным режимом питания и недостаточным пережевыванием пищи. В период беременности плод потребляет из организма женщины около 500 мг железа, даже если у нее уже развилось железодефицитное состояние. Потребность организма в железе при беременности увеличивается примерно в три раза. Большинство беременных с профилактической целью должны принимать препараты железа в виде его солей. Если подобная профилактика не проводится, то частота развития железодефицитных состояний у беременных увеличивается более чем на 50 %.
Анемия вследствие недостаточного поступления железа в организм чаще всего развивается у представителей популяций, в диете которых очень невелико количество животных белков. Уже упоминалось о причинах недостаточного потребления железа детьми и подростками. У представителей низких социальных слоев населения и пожилых потребление железа с пищей находится на субоптимальном уровне из-за материальных трудностей, отсутствия зубов, безразличия к образу жизни.
Процессы всасываемости железа могут снижаться при многих заболеваниях. После частичной или полной гастрэктомии нарушаются процессы ассимиляции пищевого железа, в результате чего пиша с большей скоростью проходит те участки кишечника, в которых в основном всасывается железо. Ахлор- гидрия также сопровождается снижением процессов его всасывания. У больных с хронической диареей или мальабсорбцией также развивается недостаточность железа, особенно при вовлечении в процесс двенадцатиперстной и проксимальных отделов тонкой кишки. Иногда железодефицитная анемия служит предвестником нетропической спру (целиакия).
К ровопотери относятся к наиболее важным причинам развития железодефицитных состояний у взрослого человека. У женщин детородного возраста менструальные кровотечения ответственны за большинство случаев этих состояний. У женщин, принимающих противозачаточные эстроген-прогестероновые пилюли, менструальные кровопотери невелики, тогда как у женщин с внутриматочными спиралями они увеличены.
У взрослого мужчины самой частой причиной железодефицитного состояния бывают желудочно-кишечные кровотечения, однако их следует предположить у любого больного с дефицитом железа. В обследовании этих больных первостепенное значение имеет анализ кала на скрытую кровь. Поскольку желудочно-кишечные кровотечения бывают интермиттирующими, исследования кала на скрытую кровь необходимо проводить многократно в течение продолжительного периода. Пептические язвы, диафрагмальная грыжа, дивертикулез и рак служат наиболее частыми причинами этих кровотечений. Нередко скрытую кровь в кале выявляют при геморрое или у лиц, принимающих салицилаты, однако кровотечения при этом редко бывают значительными. Почти у 15 % лиц с точно диагностированным желудочно-кишечным кровотечением выявить его источники не удается даже с помощью тщательного рентгенологического и эндоскопического исследования. В странах тропического пояса основной причиной кровотечений у больных служат глистные инвазии, особенно анкилостомоз. Иногда при наследственной телеангиэктазии или геморрагическом диатезе кровотечения происходят из многочисленных участков желудочно-кишечного тракта. При тромбоцитопении, качественных изменениях тромбоцитов и при болезни Виллебранда желудочнокишечные кровотечения более часты, нежели при дефиците факторов свертывания крови.
Регулярное донорство чревато прогрессивным уменьшением резервов железа в организме, а у менструирующих женщин при этом может развиться истинный железодефицитный эритропоэз. Истощение запасов железа усиливается по мере учащения эпизодов сдачи крови. _
У некоторых, очень немногих, больных дефицит железа может быть обусловлен нарушением поступления в эритроидные клетки-предшественники железа, связанного с трансферрином. Это может быть врожденным состоянием или оно обусловлено образованием аутоантител к рецепторам трансферрина.
Клинические признаки. Поскольку дефицит железа развивается исподволь, у анемичных больных его симптомы часто отсутствуют. В основном клинические признаки железодефицитной анемии сходны с таковыми при других анемиях той же тяжести (см. гл. 53). Больные чаще всего жалуются на слабость, утомляемость, вялость, сердцебиение. Могут определяться изменения в тонких механизмах поведенческих реакций. Даже при незначительно выраженной железодефицитной анемии может заметно снижаться работоспособность, которая, однако, быстро нормализуется при лечении препаратами железа. До настоящего времени неясна роль снижения активности в определенных тканях железосодержащих ферментов и кофакторов. Многие лица с дефицитом железа, не сопровождающимся выраженными признаками анемии, жалуются на повышенную утомляемость и слабость, однако эти неспецифические симптомы довольно трудно оценить. Иногда у них извращается вкус, что проявляется желанием грызть твердые вещества. Больной не может преодолеть желания есть глину (геофагия), крахмал (амилофагия) или лед (пагофагия). Эти симптомы быстро исчезают после приема препаратов железа. При дефиците железа могут появиться симптомы со стороны желудочнокишечного тракта. При длительном и выраженном дефиците у больного может наступить дисфагия вследствие истончения слизистой оболочки части пищевода, которая расположена ниже перстневидного хряща гортани (симптом Пламмера— Винсона). Чаще у больного выявляют менее специфичные проявления, такие как снижение аппетита, тошнота, отрыжка, запоры, хотя и не установлено, связаны ли они непосредственно с дефицитом железа. У больных с продолжительным дефицитом нередко обнаруживают ахлоргидрию и атрофию слизистой оболочки желудка, женщины обычно страдают меноррагиями. Однако чаще всего атрофия слизистой оболочки желудка и меноррагии служат причиной железодефицитного состояния, а не его следствием.
При физикальном обследовании обращают на себя внимание бледность кожных покровов и слизистых оболочек, тахикардия и «агемические» сердечные шумы, т. е. то же, что и при других формах анемий. При продолжительном дефиците железа ногтевые пластинки становятся сухими, ломкими и исчерченными, иногда они деформируются и их поверхность становится вогнутой (койлонихия). В углах рта появляются эрозии (ангулярный стоматит), язык болезнен, а его сосочки атрофируются (глоссит). Спленомегалия определяется редко. Негематологические проявления дефицита железа, такие как койлонихия, ангулярный стоматит, глоссит и изменения слизистой оболочки пищевода, в настоящее время определяются редко, вероятно, вследствие того, что дефицит железа стали рано диагностировать и проводить соответствующее лечение.
Лабораторные данные. Для диагностики железодефицитных состояний разной степени прибегают к помощи разнообразных лабораторных методов исследования. У взрослых железодефицитное состояние развивается поэтапно, и для каждого этапа характерны определенные изменения лабораторных данных. В самом начале уменьшаются запасы железа, что, однако, не сопровождается уменьшением количества железа, предназначенного для эритропоэза. В аспирате костного мозга, окрашенном Ргшяап Ыие, выявляют заметное уменьшение или даже отсутствие запасов железа в макрофагах на фоне снижения уровня сывороточного ферритина. На следующем этапе ‘ -развивается железодефицитный эритро- п о э з со снижением захвата железа эритроидными клетками, но без развития анемии. При этом вначале повышается железосвязывающая способность сыворотки, а затем снижается уровень сывороточного железа, в результате чего заметно уменьшается фракционное насыщение трансферрина. Эритроциты крови становятся микроцитарными и гипохромными, в них увеличивается содержание свободного протопорфирина.
При развившейся железодефицитной анемии эритроциты становятся все более гипохромными и микроцитарными. Нередко в них определяется очень тонкий слой цитоплазмы в виде кольца. В крови можно также видеть их обломки и причудливой формы пойкилоциты. Период жизни в крови этих деформированных эритроцитов укорочен. Относительное число ретикулоцитов обычно остается в пределах нормы, но после острой кровопотери может временно увеличиваться. Число лейкоцитов и тромбоцитов соответствует норме, но иногда может увеличиться число последних. В костном мозге происходит умеренная гиперплазия эритроид- ного ростка. Многие поздние эритробласты отличаются скудностью цитоплазмы.
Дифференциальная диагностика. При диагностике у больного с гипохромной микроцитарной анемией следует иметь в виду прежде всего железодефицитное состояние, талассемию, сидеробластную анемию и анемию вследствие хронических воспалений. В дифференциальной диагностике помощь оказывают некоторые лабораторные методы исследования (табл. 284-1). Железодефицитные состояния легкой и средней степени могут быть легко спутаны с р-талассемией либо с двумя делеционными формами а-талассемии (а — /а— или — —/аа). При этих формах талассемии более выражен микроцитоз, нежели гипохромия, соответственно среднее количество гемоглобина в одном эритроците обычно находится в пределах нормы. Распределение эритроцитов по размеру более однородно, чем при железодефицитной анемии. Для талассемии в большей степени, нежели для железодефицитных состояний, характерны клетки-мишени и базофильные включения. Концентрация гемоглобина Аг увеличена при признаке р-талассемии и уменьшена при дефиците железа и а-талассемии. Признак (3-талассемии может быть замаскирован при нормальном уровне гемоглобина Аг у больного с дефицитом железа. При талассемиях уровень сывороточного железа находится в пределах нормы или
Таблица 284-1. Дифференциальная диагностика микроцитарных гипохромных анемий
|