Красные кровяные тельца, которые называются эритроцитами, содержат в себе гемоглобин. Этот белок является очень важным для организма, ведь именно он отвечает за процесс обмена железом, также транспортирует кислород к каждой клеточке нашего тела. Но при каких показателях анемия диагностируется у человека? Это происходит в том случае, когда количество эритроцитов и уровень гемоглобина начинают стремительно снижаться.
О том, что в организме начинает протекать такое заболевание, как малокровие, можно узнать по определенным симптомам, но только лабораторные исследования крови помогут специалисту действительно засвидетельствовать этот факт и установить тип малокровия и степень его тяжести.
Для того чтобы специалист мог установить максимально точный диагноз протекающего недуга, пациенту необходимо сдать несколько анализов:
- Общий анализ крови.
- Расширенный анализ крови.
- Биохимический анализ крови.
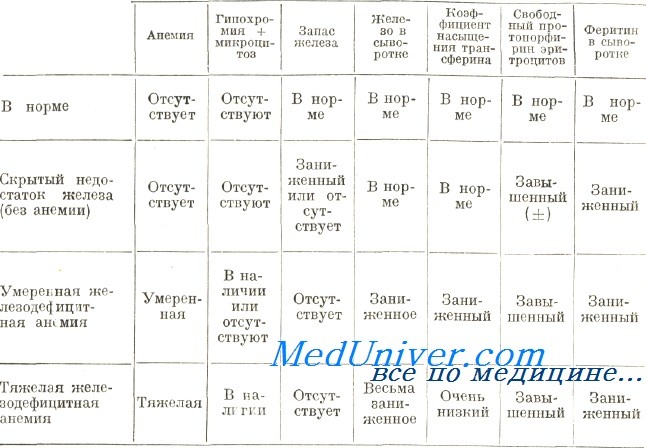
Если дополнительные анализы могут назначаться специалистом по требованию, то общий анализ крови является обязательным. Основным признаком малокровия будет сниженный уровень гемоглобина. Также учитывается цветовое изменение эритроцитов при анемии. Оптимальный его показатель составляет не ниже 0,8, но при малокровии он всегда будет падать.
Также гемограмма при анемиях (тот же общий анализ крови) позволяет установить специалисту степень тяжести малокровия:
- Легкая степень. Гемоглобин снижается до 90 г/л.
- Средняя степень. Концентрация гемоглобина снижается до 70 г/л.
- Тяжелая степень. Гемоглобин опустился ниже 70 г/л.
Расшифровка картины результатов общего анализа крови будет включать следующие моменты:
- Количество красных кровяных телец.
- Уровень лейкоцитов. Они выполняют защитную функцию в теле человека.
- Тромбоциты. Это бесцветные и очень мелкие клетки в крови. Они отвечают за процесс свертывания крови, а также является первой помощью при повреждениях.
- Гемоглобин. Является белком, основу которого составляет железо. Именно гемоглобин придает эритроцитам их нормальный цвет, а также переносит кислород по кровеносной системе.
- СОЭ. Этот показатель свидетельствует о скорости оседания эритроцитов. На основании полученных результатов, специалист может оценить уровень свертываемости крови.
- Цветовой показатель. Он позволяет оценить содержание гемоглобина в каждом эритроците.
Исходя из полученных результатов, специалист может диагностировать форму недуга, а также назначить правильное лечение малокровия. Стоит отметить, что общий анализ крови необходимо сдавать не только при проявлениях симптоматики малокровия. Если делать это систематически, то можно быстрее среагировать на протекающий недуг и пресечь любые осложнения.
Также общий анализ крови позволяет специалист определит размер эритроцитов, их форму и цветовой показатель. Анизоцитоз при анемии будет свидетельствовать о том, что размер эритроцитов отдалился от нормы. Если диагностировано серьезное отклонение, то без оперативного лечения могут возникнуть серьезные осложнения.
Чаще всего у пациентов диагностируется железодефицитная анемия. Вместе с этим, отмечается анемия и тромбоцитоз, который и возникает в результате резкого снижения железа, что может быть спровоцировано сильными кровотечениями или обычными процессами, протекающими во время беременности.
На основании этого анализа, специалист может судить о патогенности процесса, который протекает в организме пациента. Если СОЭ повышен при анемии, то это свидетельствует о сниженном гемоглобине в эритроцитах. Показатели скорости оседания эритроцитов практически всегда зависят от уровня гемоглобина. Это значит, что если уровень гемоглобина увеличен, то СОЭ буден снижен. Если у пациента диагностируется низкий уровень гемоглобина, но высокий показатель оседания эритроцитов, то специалисты диагностируют развитие патогенного процесса в организме пациента. Если быстро компенсировать дефицит гемоглобина, то всего за несколько дней можно нормализировать положение.
Ретикулоцитами называют клетки эритроидного ряда, которые являются основной для создания будущих эритроцитов. Трансформация одной клетки в другую происходит в результате влияния определенного гормона – эритропоэтина. Если же эритроциты начинают быстро разрушаться, то костный мозг начинает вырабатывать ретикулоциты в больших количествах, чтобы компенсировать недостачу.
Специалисты проверяют ретикулоцитоз при анемиях для того, чтобы оценить состояние костного мозга, почек, а также патогенный процесс разрушения эритроцитов. Стоит отметить, что увеличение количества этих клеток не всегда является негативным проявлением.
источник
Железодефицитная анемия относится к группе анемий, обусловленных недостаточностью эритропоэза. Эта группа анемий является наиболее распространенной во всем мире. Нарушение обмена железа на уровне его поступления в организм, утилизации или реутилизации из состарившихся эритроцитов является ключевым моментом большинства из них.
Железодефицитная анемия — гипохромная анемия.
Распространенность железодефицитных состояний у женщин детородного возраста и детей в некоторых регионах России достигает 30-60%, а по данным ВОЗ, число лиц с дефицитом железа в мире составляет 500-600 млн человек. При проведении оценки заболеваемости болезнями крови и кроветворных органов ликвидаторов аварии на ЧАЭС, работников атомной промышленности России выявлено преобладание анемий, среди которых основную часть занимают железодефицитные анемии (84,9% — у женщин и 78,4% — у мужчин). Железодефицитные состояния являются причиной снижения работоспособности у взрослых, увеличения восприимчивости к острым респираторным вирусным инфекциям, вызывают задержку роста и развития детей. В связи с этим важное значение имеет своевременная диагностика нарушений обмена железа, железодефицитной анемии (ЖДА), мониторинг в процессе лечения и профилактика дефицита железа у населения. Основные причины дефицита железа представлены в табл. 5 [показать] .
Таблица 5. Наиболее частые причины железодефицитной анемии
Хроническая кровопотеря
- Кровопотери у женщин
- меноррагии, метроррагии, роды
- Кровопотери из желудочно-кишечного тракта
- язвенная болезнь
- язвенный колит
- опухоли, полипы
- геморрой
- дивертикулез
- глистные инвазии (анкилостомидоз)
- варикозное расширение вен пищевода
- Кровопотери в замкнутые полости (нарушение реутилизации железа)
- гломические опухоли
- изолированный легочный сидероз
- наличие эндометриотических полостей, не связанных с полостью матки
Повышенная потребность в железе
- беременность
- лактация
- быстрый рост в пубертатном периоде
Алиментарный фактор (растительно-молочная диета)
Причины дефицита железа у детей
- недоношенность многоплодие искусственное вскармливание быстрый рост инфекции
Нарушение транспорта железа
- наследственная атрансферринемия
- приобретенная гипотрансферринемия (нарушение белоксинтезирующей функции печени)
Нарушение всасывания
- хронический энтерит
- резекция тонкой кишки, желудка
- лямблиоз
- глистные инвазии
Заместительная терапия рекомбинантным эритропоэтином (хроническая почечная недостаточность, анемии хронических заболеваний, миелодиспластический синдром и др.)
Обильные месячные кровотечения (дисфункция яичника, миома матки), кровопотери из желудочно-кишечного тракта и мочевых путей являются частой причиной дефицита железа. Дефицит железа неизбежен у женщин, имевших четверо и более родов, так как при каждой беременности, родах, лактации оно теряется в значительной степени. В последний месяц беременности ребенку передается около 300 мг железа, кроме того, осуществляется транспорт 200 мг железа в кровь плаценты и примерно 400 мг железа в молоко за период лактации. Суммарная потеря железа составляет около 1400 мг, для восполнения ее требуется 1,5-2 года. При повторных беременностях может развиться ЖДА.
В период внутриутробного развития плода концентрация железа во всех органах и тканях плода остается примерно одинаковой и только в последние недели беременности происходит его накопление в печени и селезенке в виде депо. У недоношенных детей депо не успевает образоваться, вследствие чего развивается дефицит железа. У детей в возрасте от 2 месяцев до 1 года развитию ЖДА способствует искусственное питание, отсутствие в рационе мясных блюд, интенсивный рост. Согласно литературным данным, 85% детей раннего возраста и более 30% школьного страдают дефицитом железа.
Частая сдача крови донорами истощает запасы железа и может привести к ДЖА. Мужчинам, сдающим кровь более 4 раз (женщинам более 2 раз) в год, необходимо проведение обязательного исследования метаболизма железа, включая определение ферритина.
Дефицит железа возможен в результате нарушения всасывания в кишечнике (после обширной резекции тонкой кишки, при хроническом энтерите).
Дефицит железа у пожилых людей обычно связан с однообразным питанием, в основном молочно-растительной пищей.
У спортсменов дефицит железа может наблюдаться у стайеров (бегунов на длинные дистанции), пловцов на длинные дистанции.
Нарушение транспорта железа из депо к эритрону имеет место при отсутствии синтеза трансферрина (наследственная атрансферринемия — встречается с частотой 1:100 000 новорожденных), а также заболеваниях печени, сопровождающихся нарушением белоксинтетической функции (гепатиты, цирроз, рак печени).
Терапия рекомбинантным эритропоэтином (рЭПО) приводит к стимуляции эритропоэза и усиленному потреблению железа эритрокариоцитами, что способствует развитию железодефицитной анемии.
В каждом случае дефициту железа предшествует в первую очередь истощение его запасов (латентный железодефицит), затем уменьшается транспортное железо, далее — снижается активность железосодержащих ферментов и в последнюю очередь — нарушается синтез гемоглобина.
Клинические проявления. Выделяют три формы железодефицитных состояний: дефицит железа без анемии (предлатентный и латентный железодефицит) и железодефицитная анемия. Первые две характеризуются снижением содержания депонированного и транспортного железа при сохраненном эритроцитарном пуле железа, вторая — уменьшением уровня всех метаболических пулов железа.
Предлатентный дефицит железа — состояние, предшествующее дефициту железа, сопровождается увеличенной абсорбцией железа в желудочно-кишечном тракте. Клинические симптомы отсутствуют. Лабораторные показатели (картина периферической крови, сывороточное железо, трансферрин, ферритин) обычно остаются в пределах нормы. Единственный тест, позволяющий реально определить истощение депонированного железа, — тест абсорбции 59 Fе 3+ . Примерно в 60% случаев выявляется повышение абсорбции более 50% при норме 10-15%.
Латентный дефицит железа сопровождается так называемыми сидеропеническими симптомами, обусловленными дефицитом железа в тканях. К ним относятся: сухость кожи, ломкость ногтей, выпадение волос, изменение слизистых, мышечная слабость. Многообразие клинических симптомов дефицита железа объясняется широтой спектра метаболических нарушений, вызываемых дисфункцией железосодержащих ферментов.
Лабораторные показатели метаболизма железа характеризуются снижением концентрации ферритина (5-15 мкг/л), сывороточного железа в плазме, увеличением трансферрина. При истощении запасов железа развивается недостаток транспортируемого железа, хотя синтез гемоглобина на этой стадии не нарушен и, следовательно, показатели красной крови (Нb, RВС, МСV, МСН, МСНС) сохраняются в пределах нормы. Однако при дополнительных стрессах или потерях железа латентный дефицит железа может перейти в железодефицитную анемию.
Железодефицитная анемия проявляется гипоксическим и сидеропеническим синдромами. Снижение гемоглобина сопровождается недостаточным обеспечением тканей кислородом, что сопровождается слабостью, головокружением, сердцебиением, одышкой. Дефицит железа в организме приводит к нарушению клеточных механизмов иммунорезистентности, инфекциям, что является причиной частых острых респираторных и вирусных заболеваний. К обычным симптомам анемии присоединяются признаки, специфичные для недостаточности железа. При хроническом тяжелом дефиците железа у больных появляется извращенный аппетит (пристрастие к мелу, глине, зубному порошку). Наличие извращенного аппетита должно наводить на мысль о дефиците железа.
Регенераторная стадия ЖДА характеризуется нормальной клеточностью костного мозга, умеренной гиперплазией клеток красного ряда (количество их достигает 40-60% от общего количества миелокариоцитов), преобладанием базофильных и полихроматофильных эритробластов.
В пунктатах костного мозга обращает на себя внимание наличие микрогенераций полихроматофильных эритробластов (рис. 18, 19), с узким, чаще неотчетливым ободком цитоплазмы, имеющим неправильные контуры. Образование этих клеток связано с медленным накоплением гемоглобина, в результате чего на стадии среднего полихроматофильного эритробласта клетки вступают в добавочный митоз. Образуется популяция клеток с меньшим объемом и более низким содержанием гемоглобина (МСН), в эритрокариоцитах наблюдается «пустая цитоплазма». Другие миелоидные ростки не изменены.
Важным исследованием, отражающим запасы железа в организме, является подсчет количества сидеробластов в костном мозге, окрашенном по методу Перлса. При снижении содержания железа в депо или полном его истощении число сидеробластов резко сокращается (менее 10%). О наличии депо железа можно судить также по проценту гипохромных эритроцитов в периферической крови. Последний показатель рассчитывается на некоторых гематологических анализаторах (Technicon H, H2, H3), а также на анализаторах клеточного изображения. В норме количество гипохромных эритроцитов составляет менее 2,5%, при дефиците железа превышает 10%.
Общий анализ крови. Подсчет количества эритроцитов (RВС), определение концентрации гемоглобина, среднего содержания и концентрации гемоглобина в эритроцитах (МСН, МСНС), среднего объема эритроцитов (МСV) позволяют оценить процессы, происходящие в эритроне и принадлежат к обязательным анализам при различных нарушениях обмена железа.
Количество эритроцитов обычно находится в пределах нормы (рис. 19). При ЖДА отмечается снижение гемоглобина, МСН (менее 27 пг) или цветового показателя (ниже 0,7), МСНС (менее 31 г/дл), МСV (менее 78 фл). Показатель анизоцитоза — RDW может оставаться нормальным, что свидетельствует о преобладании однородных клеток с малым объемом (рис. 20).
Использование гематологических анализаторов позволяет, помимо эритроцитарных индексов, получить графики распределения клеток по их объему (гистограммы). В регенераторной стадии железодефицитной анемии эритроцитарная гистограмма имеет обычную форму и лишь смещается влево.
Содержание ретикулоцитов при ЖДА в пределах нормы либо несколько повышено при наличии кровотечения у больного. Количество лейкоцитов и тромбоцитов при ЖДА остается в пределах нормы. При хронических кровотечениях может наблюдаться небольшой тромбоцитоз либо тромбоцитопения. СОЭ чаще бывает нормальной.
Морфологическим признаком железодефицитной анемии является гипохромия эритроцитов и анизоцитоз со склонностью к микроцитозу (рис. 21).
По мере дальнейшего нарушения процессов гемоглобинообразования происходит еще большее снижение МСV, МСН и МСНС. У таких больных эритроцитарная гистограмма имеет вид одиночного пика, значительно сдвинутого в левую сторону, RDW (показатель анизоцитоза эритроцитов) в пределах нормы либо немного увеличено. При этом на тромбоцитарной гистограмме происходит подъем правой части графика выше зоны локализации нормальной гистограммы (рис. 22, а), либо появляется второй пик в области 30-35 фл, что указывает на наличие в образце популяции микроэритроцитов (рис. 22, б).
Гипорегенераторная стадия. При длительном течении ЖДА истощается пролиферативная активность костного мозга, возрастает неэффективный эритропоэз, что приводит к уменьшению количества миелокариоцитов, снижению числа эритроцитов, появлению популяции красных клеток с увеличенным объемом, возможна задержка созревания гранулоцитов. В анализе крови наблюдается снижение количества эритроцитов, гемоглобина, возможна лейкопения с нейтропенией, СОЭ — в норме или незначительно повышена.
Эритроцитарная гистограмма уплощается и значительно растягивается вдоль оси X (рис. 23) в некоторых случаях приобретая вид двугорбой кривой, указывающей на наличие двух популяций эритроцитов — микро- и макроцитов.
МСV может увеличиваться, так как является усредненным показателем объемов эритроцитов. Присутствие микро- и макроцитов приводит к повышению RDW, что коррелирует с наличием смешанного анизоцитоза в мазках периферической крови (рис. 23, 24). Может наблюдаться анизохромия эритроцитов, а также незначительный пойкилоцитоз.
Железодефицитный характер анемии подтверждается показателями обмена железа, для характеристики которого определяют содержание сывороточного железа (СЖ), общую железосвязывающую способность (ОЖСС), ферритин и трансферрин сыворотки крови. ОЖСС отражает резервную, незаполненную железом, емкость транспортного белка — трансферрина. При ЖДА наблюдается снижение СЖ и повышение ОЖСС. Увеличение уровня трансферрина при ЖДА объясняется усилением его синтеза как компенсаторная реакция в ответ на тканевой дефицит железа. Снижение трансферрина имеет место при тяжелых нарушениях белоксинтетической функции печени.
Информативным показателем оценки метаболизма железа является коэффициент насыщения трансферрина железом (НТЖ), который рассчитывается по формуле
При ЖДА показатель НТЖ снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%). Концентрация ферритина в сыворотке крови отражает величину запасов железа в организме. Снижение уровня ферритина (менее 15 мкг/л) наблюдается как при латентном дефиците железа, так и при ЖДА. Однако этот показатель следует оценивать с осторожностью, так как уровень ферритина в сыворотке может быть повышен при болезнях печени и некоторых опухолях.
Величина запасов железа также может быть определена с помощью десфералового теста. У здоровых людей после введения 500 мг десферала выводится за сутки 0,8-1,3 мг железа, а при его дефиците — менее 0,4 мг.
В последние годы для характеристики железодефицитного состояния определяют в сыворотке крови концентрацию растворимых рецепторов к трансферрину (СD 71), отражающих адекватное поступление железа в клетки эритропоэза. При ЖДА отмечается усиление синтеза и экспрессии мембранных транферриновых рецепторов и повышение концентрации их в крови.
- Беркоу Р. Руководство по медицине The Merck manual. — М.: Мир, 1997.
- Руководство по гематологии / Под ред. А.И. Воробьева. — М.: Медицина, 1985.
- Долгов В.В., Луговская С.А., Почтарь М.Е., Шевченко Н.Г. Лабораторная диагностика нарушений обмена железа: Учебное пособие. — М., 1996.
- Козинец Г.И., Макаров В.А. Исследование системы крови в клинической практике. — М.: Триада-Х, 1997.
- Козинец Г.И. Физиологические системы организма человека, основные показатели. — М., Триада-Х, 2000.
- Козинец Г.И., Хакимова Я.Х., Быкова И.А. и др. Цитологические особенности эритрона при анемиях. — Ташкент: Медицина, 1988.
- Маршалл В.Дж. Клиническая биохимия. — М.-СПб., 1999.
- Мосягина Е.Н., Владимирская Е.Б., Торубарова Н.А., Мызина Н.В. Кинетика форменных элементов крови. — М.: Медицина, 1976.
- Рябое С.И., Шостка Г.Д. Молекулярно-генетические аспекты эритропоэза. — М.: Медицина, 1973.
- Наследственные анемии и гемоглобинопатии / Под ред. Ю.Н. Токарева, С.Р. Холлан, Ф. Корраля-Альмонте. — М.: Медицина, 1983.
- Троицкая О.В., Юшкова Н.М., Волкова Н.В. Гемоглобинопатии. — М.: Изд-во Российского университета дружбы народов, 1996.
- Шиффман Ф.Дж. Патофизиология крови. — М.-СПб., 2000.
- Baynes J., Dominiczak M.H. Medical Biochemistry. — L.: Mosby, 1999.
Источник: В.В.Долгов, С.А.Луговская, В.Т.Морозова, М.Е.Почтарь. Лабораторная диагностика анемий: Пособие для врачей. — Тверь: «Губернская медицина», 2001
источник
Вид анемии в зависимости от МСV
Патогенетический вариант анемии
Гетерозиготная талассемия, при хронических болезнях
ЖДА, серповидноклеточная, бета-талассемия, гемоглобин Н фрагментация эритроцитов (два пика на гистограмме)*
При хронических болезнях, энзимопатии эритроцитов, гемоглобинопатии, наследственный сфероцитоз, острая постгеморрагическая, при хроническом миелолейкозе, при цитостатической миелодепрессии
Смешанный дефицит (ЖДА и В12), сидеробластные, миелофиброз
Апластичекая анемия, миелодиспластический синдром
Аутоиммунная гемолитическая, мегалобластная
*Гистограмма графически отражает частоту встречаемости эритроцитов разного объема и является аналогом кривой Прайс-Джонса. Обычно гистограмма имеет форму одиночного пика.
Повышение количества ретикулоцитов более 3%
Снижение количества ретикулоцитов менее 0,5%
Мембранопатии, энзимопатии, нестабильность гемоглобина, промежуточная форма талассемии, микроангиопатические гемолитические анемии
Апластическая анемия, В12-дефицитная анемия, фолиеводефицитная анемия, ЖДА тяжелая, врожденная дизэритропоэтическая анемия*, большая форма талассемии*, сидеробластные анемии*, пароксизмальная ночная гемоглобинурия
*Количество ретикулоцитов может быть повышенным, но не соответствовать степени гемолиза.
Наследственный сфероцитоз, аутоиммунная гемолитическая анемия, криз дефицита Г-6-ФД, нестабильный гемоглобин
Наследственный элиптоцитоз, может быть при ЖДА, талассемии, мегалобластной анемии, миелофиброзе, миелофтизе, миелодиспластическом синдроме, дефиците пируваткиназы
Талассемия, гемоглобин С, заболевания печени
Шизоциты (фрагментация эритроцитов)
Механические гемолитические анемии
Анемии при заболеваниях печени, абета-липопротеинемии
Врожденный и приобретенный стоматоцитоз
Анизохромия, пойкилоцитоз (эхиноциты, шизоциты)
Анемии при хронической почечной недостаточности
Макроовалоцитоз (мегалоцитоз), тельца Жолли, кольца Кабо
Тельца Гейнца в эритроцитах
Железодефицитная анемия (ЖДА) – полиэтиологичное заболевание, являющееся результатом снижения общего содержания железа в организме и характеризующееся прогрессирующими микроцитозом и гипохромией эритроцитов.
По данным литературы, 90% случаев анемий вызваны дефицитом железа. 43% детей до 4 лет и 37% дошкольников и школьников в возрасте 5 — 12 лет в мире страдают железодефицитным состоянием (ЖДС). Частота ЖДА у детей в среднем по России достигает 12%, а в раннем возрасте по разным регионам – от 15% до 47,8% (Хотимченко С.А., Алексеева И.А., Батурин А.К.,1999). Предрасполагают к развитию ЖДС у детей от 6 месяцев до 3 лет высокие темпы роста, функциональная незрелость пищеварительной системы, однообразность питания, частые интеркуррентные заболевания, дисфункции желудочно-кишечного тракта, дефекты вскармливания.
Метаболизм железа определяется потребностью в этом нутриенте, содержанием и биодоступностью его в пищевом рационе, утилизацией в желудочно-кишечном тракте, транспортом к клеткам, синтезом железопротеинов, потерями (выделением с калом и мочой). Сидеропения может развиться вследствие недостаточного поступления железа с пищей, нарушения его утилизации или повышенных потерь. Существуют четыре группы причин ЖДА у детей.
1. Снижение депонирования железа в антенатальном периоде. В первом полугодии жизни алиментарное железо, поступающее в минимальных количествах с молоком, важной роли в эритропоэзе младенца не играет. Гемопоэз осуществляется преимущественно за счет депо железа, создание которого у плода в виде ферритина идет с ранних сроков гестации, интенсивно нарастая в позднем фетальном периоде. 70% гемового железа у детей до двух лет имеет материнское происхождение. Обеспеченность плода ферритином зависит от содержания железа в организме женщины и состояния фетоплацентарного барьера. Имеются убедительные данные о снижении тканевого железа плаценты и сывороточного железа в пуповине новорожденного при сидеропении у матери. Предрасполагают к развитию ЖДС у женщины кровопотери, чаще связанные с менометроррагиями, повторные беременности и роды, несбалансированное питание. Гестозы, обострения хронических воспалительных процессов во второй половине беременности нарушают функции фетоплацентарного барьера и затрудняют утилизацию железа плодом. Недоношенные и новорожденные дети от многоплодной беременности всегда имеют низкий уровень депонированного железа. В перинатальном периоде предрасполагает к снижению депонированного железа постгеморрагические анемии новорожденных.
2. Алиментарный дефицит — наиболее частая причина развития ЖДС. Суточная потребность организма в железе зависит от возраста, пола, физической активности, потерь и составляет для младенцев до 3 месяцев — 4 мг, в первом полугодии жизни — 7 мг, для детей в возрасте от 7 месяцев до 6 лет — 10 мг, у школьников препубертатного возраста – 12 мг, у юношей – 15 мг, у девушек – 18 мг. Обеспеченность организма железом связана как с его содержанием в пищевом рационе, так и с биодоступностью. К продуктам, богатым железом, относятся красное мясо, печень, икра осетровых рыб, некоторые крупы (греча, пшено, овес), фрукты (черника, голубика, персики, яблоки, хурма и др.). В женском молоке концентрация железа не превышает 2 — 4 мг/л, в коровьем – 1 мг/л. Содержание железа в рационе питания является одним из важнейших, но не единственным фактором, определяющим нормальную обеспеченность организма человека этим нутриентом. Гемовое железо, поступающее из продуктов животного происхождения (мяса, рыбы, домашней птицы) в виде комплексных форм, связанных с порфириновым кольцом (гемоглобин, миоглобин) и другими белками (ферритин, гемосидерин), хорошо всасывается в кишечнике и усваивается до 15 — 35% от общего объёма, содержащегося в пищевых продуктах. Железо, входящее в состав ряда специфических белков (лактоферрин молока, овотрансферрин и фосфовитин яйца), всасывается хуже, за исключением грудного молока, биодоступность нутриента в котором составляет 50%. Из растительных пищевых продуктов человек получает железо в виде солей, фитоферритина, в комплексах с органическими кислотами. Усвояемость негемового железа не превышает 2 — 5%. Уровень всасывания железа зависит от индивидуальных потребностей в нем, обеспеченности им организма, его источника и содержания в пище, а также от наличия в этом продукте лиганд, усиливающих или ингибирующих процессы утилизации. Гемовое железо обладает высокой абсорбционной способностью вследствие того, что его усвояемость, как правило, не связана с действием других веществ, содержащихся в рационе. Негемовое железо всасывается намного хуже, поскольку на его усвояемость влияет ряд соединений, входящих в состав пищевых продуктов.
Большое значение в процессе абсорбции железа принадлежит количественному и качественному составу белка. Лица с низкой обеспеченностью белком имеют дефицит железа, что объясняется достаточно большим содержанием хорошо усвояемого гемового железа в белковых продуктах, образованием с нутриентом легко абсорбируемых комплексов некоторыми аминокислотами. Добавление в рацион продуктов животного происхождения способно увеличивать всасывание железа из овощей в 2 — 3 раза. При белковой недостаточности резко уменьшается утилизация железа эритроцитами, что приводит к снижению концентрации гемоглобина.
Органические кислоты (лимонная, яблочная, винная) соединяются с негемовым железом в хорошо растворимые комплексы. В то же время целый ряд соединений, содержащихся в соевых продуктах, чае, кофе, шпинате, молоке (фитаты, танин, фосфопротеины, оксалаты), образуют с железом плохо растворимые комплексы и тем самым тормозят его всасывание.
Хорошо изучена роль гиповитаминозов в развитии ЖДА. Аскорбиновая кислота активно участвует в процессах всасывания негемового железа в кишечнике, восстанавливая трехвалентное железо в биодоступную двухвалентную форму. Образуя хелатные комплексы в кислой среде желудка и поддерживая в растворимой форме негемовое железо, поступающее в щелочную среду тонкой кишки, витамин С устраняет ингибирующий эффект фитатов и танина, которые создают эти комплексы в щелочной среде. Утилизация железа повышается как при добавлении чистой аскорбиновой кислоты, так и продуктов с высоким ее содержанием. Предполагается, что аскорбиновая кислота необходима для модулирования синтеза ферритина. Аскорбиновая кислота увеличивает освобождение железа из макрофагов, и тем самым способствует эритропоэзу.
К развитию анемии может приводить недостаток рибофлавина. В условиях нарушения метаболизма рибофлавина, с нарастанием его тканевого дефицита формируется синдром избыточной потери железа с мочой, снижается накопление в печени, что, возможно, обусловлено блокадой поступления железа из кишечника. Дефицит пиридоксина отражается на состоянии аминокислотного обмена (лизина, гистидина, метионина), специфически участвующих в процессах всасывания железа в кишечнике и синтезе гемоглобина.
Значение в развитии анемии имеет нарушение метаболизма многих микроэлементов: меди, марганца, никеля, цинка, селена и др. Медь является кофактором различных ферментов, участвующих, в том числе, в метаболизме железа. Исследования на животных показали, что церуллоплазмин необходим для транспорта железа трансферрином. Кроме того, ионы меди участвуют в синтезе гема в митохондриях, поэтому дефицит меди в организме приводит к устойчивой к лечению ферропрепаратами анемии и нейтропении.
Экзогенный дефицит цинка, описанный впервые A.S. Prasad в 1963 году и названый болезнью Прасада, характеризуется наличием карликовости, гипогонадизма и ЖДА.
Одним из важных патогенетических звеньев анемических состояний является дисбаланс в системе “перекисное окисление липидов (ПОЛ) – антиоксиданты”. Установлено, что активация процессов липопероксидации на фоне угнетения антиоксидантных ресурсов организма сопровождает практически все анемии. Это, в свою очередь, приводит к усилению мембранодеструкции, накоплению в крови токсических продуктов ПОЛ. Лечение ферропрепаратами инициирует гиперпродукцию свободных радикалов, вызывая оксидативный стресс. Наиболее биологически значимым ферментом антиоксидантного звена (АОЗ) является супероксиддисмутаза – фермент содержащий цинк. Кроме того, обладая постоянной валентностью, цинк предотвращает окисление SH-групп ионами железа и меди.
Особую значимость проблема ЖДС приобретает в эндемичных по дефициту некоторых микроэлементов (например, селена) регионах. Известна роль селена в обеспечении адекватного ответа со стороны ферментативного АОЗ за счет включения в структуру глутатионпероксидазы (ГПО). Установлено, что при ЖДА у детей раннего возраста в условиях селенодефицита имеется нарушение фосфолипидного состава мембран и снижение активности антиоксидантных ферментов эритроцитов, приводящее к усилению их перекисного гемолиза (Баранова Т.А., 2004).
Таким образом, одной из ведущих причин развития ЖДА является нерациональное питание. Предрасполагают к сидеропении раннее искусственное вскармливание младенцев, особенно неадаптированными молочными смесями, несвоевременное введение прикормов; дефицит в рационе мясных продуктов, свежих овощей и фруктов на фоне преобладание злаков, бобовых и молока в рационе детей старше года, отсутствие коррекции питания в эндемичных по дефициту отдельных микроэлементов регионах.
3. Заболевания желудочно-кишечного тракта (гастриты, энтериты, врожденные и приобретенные энтеропатии с синдромом нарушенного всасывания) приводят к нарушению утилизации железа
4. Хронические кровопотери, возможно обусловленные эрозивным гастроэнтероколитом, диафрагмальной грыжей, варикозом вен пищевода, полипозом или телеангиэктазиями кишечника, дивертикулом, геморрагическими диатезами, гематурией, менометроррагиями, идиопатическим гемосидерозом легких, некоторыми паразитарными инвазиями. У детей первого года жизни, вскармливаемых нативным коровьим молоком, часто возникают диапедезные кровотечения в кишечнике.
ЖДА предшествует латентный дефицит железа, протекающий бессимптомно и характеризующийся уменьшением количества резервного железа. Поскольку микроэлемента поступает в организм недостаточно, то потребляется резервное железо, поступающее в циркулирующую кровь. Первоначально используется ферритин макрофагов, как более мобильная фракция, а затем – гемосидерин, компартмент железа. Отрицательный баланс железа приводит к усилению абсорбции микроэлемента в кишечнике и увеличению синтеза трансферрина. Освобождаемое железо из резервного компартмента позволяет поддерживать сывороточное железо на физиологическом уровне, но сывороточный ферритин при этом снижается. Если дефицит железа не восполняется, то развивается ЖДА. По данным российский педиатров, частота латентного дефицита железа среди детей первых двух лет жизни достигает 73% (Румянцев А.Г., Чернов В.М., 2001) и вероятность его перехода в анемию высока.
Клиническая картина ЖДА состоит из двух ведущих синдромов: анемического и сидеропенического. Анемический синдром проявляется бледностью кожных покровов и слизистых оболочек, физической и умственной утомляемостью, снижением работоспособности, тахикардией, головокружением, приглушенностью тонов и систолическим шумом при аускультации сердца. Для сидеропенического синдрома характерны дистрофические изменения кожи и ее придатков в виде выпадения волос, ломкости, исчерченности ногтей, койлонихий (ложкообразных ногтей) а также атрофические поражения слизистых оболочек пищевода, желудка, кишечника, рецепторов носа и языка, сопровождающиеся извращением вкуса и обоняния, гингивитом, ангулярным стоматитом, дисфагией, диспепсией, вторичным синдромом мальабсорбции. Часто отмечаются мышечные гипотония и боли вследствие дефицита миоглобина. Следует отметить, что клинические симптомы дегенеративных поражений кожи и слизистых оболочек желудочно-кишечного тракта выражены у взрослых и детей старшего возраста, что связано, по-видимому, с длительным дефицитом железа. В раннем возрасте преобладают диспепсические расстройства, метеоризм, снижение аппетита, затруднения при глотании твердой пищи, мышечная гипотония, в том числе диафрагмы, приводящая к опущению печени и селезенки, определяемой пальпаторно. У детей старшего возраста нередко появляется снижение тонуса мышц мочевого пузыря, что ведет к неудержанию мочи при смехе и кашле.
Лабораторная диагностика. 1. Гемограмма характеризуется гипохромной, микроцитарной, регенераторной анемией, с нормальным или повышенным числом эритроцитов в начале болезни. При прогрессировании железодефицита и снижении эффективности эритропоэза количество эритроцитов и ретикулоцитов падает и повышается на фоне ферротерапии. При оценке гемограммы, выполненной с помощью гематологического анализатора, выявляются снижение MCV, MCH, MCHC и типичное для ЖДА значительное увеличение RDW, показывающую анизоцитоз клеток. Осмотическая резистентность эритроцитов (ОРЭ) в норме или повышена.
2. При биохимическом исследовании крови определяются основные диагностические критерии ЖДС: уменьшается содержания сывороточного ферритина (СФ) – ниже 30 нг/л; повышается уровень общей железосвязывающей способности сыворотки (ОЖСС) – выше 60 мкмоль/л; понижается количество сывороточного железа (СЖ) – менее 12,5 мкмоль/л и насыщение трансферрина железом (НТЖ) – ниже 25%. При падении коэффициента НТЖ ниже 16% эффективный эритропоэз невозможен, что сопровождается эритропенией и ретикулоцитопенией. Латентный дефицит железа диагностируется на основании снижения концентрации СФ и повышения ОЖСС.
3. Необходимости проведения миелограммы для диагностики ЖДА нет. Морфология клеток костного мозга при дефиците железа характеризуется нормобластной гиперплазией с преобладанием полихроматофильных или оксифильных нормобластов с уменьшением объема цитоплазмы, со снижением процента сидеробластов и гемосидерина в клетках до полного его отсутствия.
Диагностический алгоритм ЖДА включает: 1) тщательный сбор анамнеза (выяснение предрасполагающих факторов к дефициту железа);
2) клиническое исследование пациента (отсутствие желтухи, лимфо-пролиферативного синдрома, гепатоспленомегалии, наличие признаков сидеропении);
3) оценку гемограммы (гипохромная, микроцитарная, регенераторная анемия при отсутствии изменений со стороны лейкограммы, содержания тромбоцитов, сдвигов СОЭ).
4) оценку эффекта от терапии препаратами железа через 2 – 3 недели (ретикулоцитоз, тенденция к нарастанию гемоглобина).
Во всех остальных случаях проводится диагностика в большем объеме, направленная на исключение других причин анемических состояний.
В таблице 7 отражены дифференциально-диагностические лабораторные критерии анемий при алиментарном дефиците железа, нарушениях его утилизации и реутилизации.
источник
Периферическая кровь при железодефицитной анемии. Свойственные крови морфологические изменения заключаются в микроцитозе и гипохромии. Однако эти признаки отражают длительную недостаточность железа, сочетающуюся с тяжелой анемией. Исходно, когда в процессе гемоглобиногенеза отмечается отрицательное влияние недостаточного подвоза железа в костный мозг, кроветворение начинает приспосабливаться к новым условиям. По началу сокращается объем эритроцитов.
Микроцитоз и нормохромия обычное явление у женщин при показателе гемоглобина от 9 до 10 г на 100 мл. Гипохромия развивается, когда показатель уровня гемоглобина падает до меньших значений, причем вначале она умеренная, а затем становится все более выраженной. При тяжелой форме анемии эритроциты имеют кольчатый аспект (аннулоциты) или обретают вид клеток-мишень. Пойкилоцитоз наблюдается лишь при тяжелых формах анемии (Дачие и сотр.).
Показатели эритроцитов свидетельствуют о небольшом объеме (менее 80 мкг3), о количестве гемоглобина менее 27 пг и о средней концентрации гемоглобина на каждый эритроцит (менее 30 г/100/мл.). В принципе число ретикулоцитов в норме или немного больше; лишь е редких случаях их число занижено. Число эритроцитов обычно нормальное или немного меньшее нормы. Вот почему определение не дает точную справку о тяжести анемии. В отдельных случаях, особенно у детей, число эритроцитов превышает 5 млн/мм3. Следует отметить, что, при железодефицитной анемии увеличивается устойчивость эритроцитов к гипотонии.
Наиболее часто число лейкоцитов укладывается в норму. При длительной недостаточности железа развивается умеренная гранулоцитопения. В некоторых случаях выявляются гиперсегментированные нейтрофилы. Их появление при недостатке железа можно объяснить развитием вторичной недостаточности фолиевокислых солей или витамина В12 (Брукнер и сотр.).
В большинстве случаев показатель численности тромбоцитов высокий, однако еше не разработано четкое объяснение этому явлению. Высказана мысль о возможности появления тромбоцитоза в результате активной кровоточивости. В случаях тяжелой или длительной анемии отмечена умеренная тромбоцитопения, обратимая после проведения железотерапии.
У страдающих железодефицитной анемией количество клеточной массы в костном мозге выше нормы. Рост показателя костномозговых клеток объясняется увеличением числа эритробластов. Последние, в частности полихроматофильные и оксифильные меньших размеров, чем нормальные эритробласты в связи с сокращением количества цитоплазмы. Исследование мазка в условиях железодефицитной анемии выявляет не только малые размеры эритробластов, но также их нерегулярный, «изорванный» контур. В таких клетках были описаны аспекты дисэритропоэза и кариорексиса, почкования ядер, в некоторых случаях многоядерность и ядерные фрагменты.
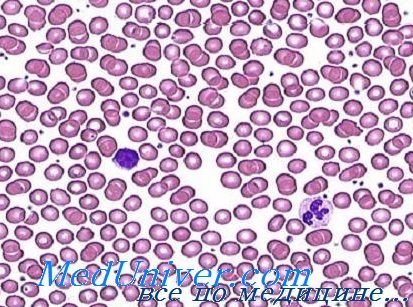
Непосредственное исследование, без окраски, размозженных на стекле зерен костного мозга не выявляет наличие аггрегатов мелких, нерегулярных, золотистых, характерных гемосидерину частиц. Окраска по Перлсу выявляет отсутствие запасного железа в макрофагах и наличие менее 10% сидеробластов (Дачие и сотр.). В целях определения заболевания железодефицитной анемией этот тест представляет наибольшее диагностическое значение.
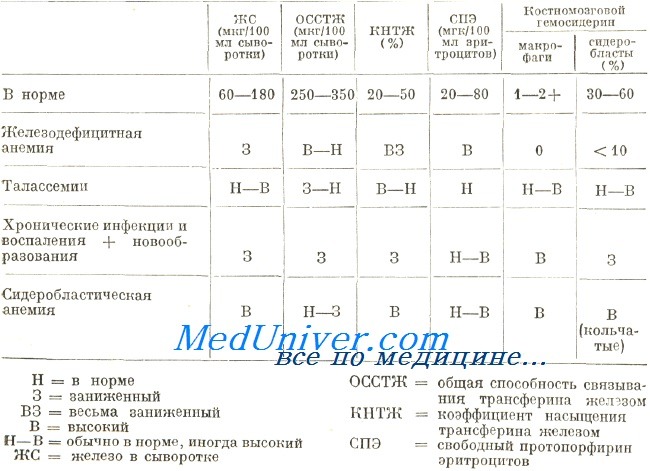
Сывороточное железо при железодефицитной анемии. Концентрация железа в сыворотке всегда меньше 50 мкг/100 мл., причем в отдельных случаях она не больше 10 мкг/100 мл. Общая связывающая способность железа (ОССЖ), отражающая количество находящегося в кровотоке трансферина, чаще завышена и лишь в редких случаях укладывается в норму или занижена. У больных с заниженной ОССЖ возможно вмешательство и других факторов, например гипопротеинемии (McGibbon и Mollin5). Насыщение трансферином (железо сыворотки/ОССЖ х 100) в любом случае меньше 16%, однако встречаются и случаи 1%-ой насыщенности.
Следует обратить особое внимание на интерпретацию насыщения трансферином у женщин на последнем квартале беременности. У последних насыщение трансферином менее 16% не всегда указывает на наличие недостатка железа. Объяснение такому явлению следует искать в повышении количества трансферина, что характерно беременным независимо от возможного дефицита железа.
Показатель свободного протопорфирина эритроцитов (СПЭ) в принципе характеризуется высокими значениями — более 70 мкг/100 мл. а в отдельных случаях даже больше 300 мкг/мл. При этом следует обратить внимание на тот факт, что на повышение уровня СПЭ влияет больше продолжительность железо дефицита, чем его интенсивность (Dameshek).
Показатель феритина в сыворотке — растворимой формы находящегося в запасе железа—составляет менее 12 мкг/л. у женщин и детей раннего возраста и менее 35 мкг/л. у мужчин. Существует четкая взаимосвясь сывороточного феритина и количеством железа выявляемого в костном мозге и печени путем окраски по Перлсу.
Кинетика железа. В процессе выявления недостатка железа кинетика последнего не применяется как текущий метод. При использовании этого метода обнаруживается весьма быстрый клиренс железа плазмы, перенос железа в костный мозг и его расход нормальными или увеличенными эритроцитами, при этом интенсивность и скорость метаболизма железа эритроцитов больше нормы. Эти данные свидетельствуют о наличии неэффективного кроветворения в условиях недостатка железа:
Диагностирование тяжелой железодефицитной анемии по клиническим и лабораторным данным дело несложное, при этом сделанное определение подтверждается терапевтическим испытанием. Осложнения появляются при мало выраженной форме анемии и нечетких клинических и лабораторных признаках. Ниже в таблице приведены морфологические, биохимические и цитохимические данные, на основе которых дифференцируются этапы недостатка железа.
Элементы лабораторного диагноза стадий железной недостаточности
Железодефицитную анемию следует отличать от остальных видов гипохромной анемии. Среди последних, на втором месте по частоте после железодефицитной анемии, находится бета-талассемия (по данным приема для страдающих болезнями крови при Центре гематологии). Учитывая тяжесть заболевания, ранный возраст страдающего и характерную клиническую картину тяжелая бета-талассемия (анемия Кули) распознается без затруднений.
В противоположность этому легкая форма бета-талассемии в отдельных случаях не различима от железодефицитной анемии по клиническим признакам и результатам морфологического исследования крови. Возможные кровоточивость в анамнезе, наблюдаемые в слизистых оболочках и роговых образованиях изменения, равно как и бледность сыворотки подсказывают диагноз железодефицитной анемии. Гипохромия и микроцитоз общее, для обеих групп явление, однако при талассемии они выделяются более ярко.
Отмечаем, что, при талассемии, более характерной чертой микроцитоза это не сокращенный диаметр эритроцитов, а их значительно уменьшенная толщина (микроплатициты). Вот почему выраженная гипохромия с показателем гемоглобина примерно 10 г/100 мл или более подсказывает диагноз талассемии. Также, при железодефицитной анемии с более 8 г/100 мл гемоглобина пойкилоцитоз единичное явление, в то время как при талассемии наблюдается часто. В условиях талассемии выраженный микроцитоз отражается ростом численности эритроцитов, по сравнению с железодефицитной анемией.
Что касается остальных лабораторных данных следует не забывать, что при талассемии чаще наблюдаются такие признаки, как повышенное число ретикулоцитов, полихроматофильных эритроцитов и наличие точечно-базофильных красных кровяных клеток, к тому же осмотическая устойчивость последних больше.
В связи со сказанным для различения этих двух заболеваний наибольшую ценность представляют тесты метаболизма железа. В принципе, при талассемии показатель железа в крови характеризуется нормальными или завышенными значениями. Редко, у больных с хронической кровоточивостью развивается гипосидеремия. В таких случаях ОССТЖ, показатель которой при талассемии отличается низкими значениями (обычно менее 250 мкг/100 мл), увеличивается до нормы и даже более.
За исключением случаев, осложненных недостатком железа, костномозговые запасы железа при талассемии укладываются в норму или несколько больше. В отдельных случаях количество железа в митохондриях нормобластов очень велико, что создает аспект кольчатых сидеробластов.
Анемия с многонедельным течением, развивающаяся при инфекциях и хронических воспалениях, в принципе носит нормоцитный и нормохромный характер, причем эта характеристика действительна и в отношение анемий, наблюдаемых при свежих новообразованиях. Но после длительного течения в условиях этих заболеваний анемия становится микроцитной и гииохромной. В подобном случае различение этой анемии от железодефицитной возможна путем выявления первичного заболевания, в частности посредством лабораторных исследований. Морфологическое исследование крови не представляет данные, способствующие дифференциальному диагнозу.
Элементы дифференциальной диагностики при гипохромной анемии
Концентрация железа в сыворотке невелика в обеих группах заболеваний, в то время как показатель ОССТЖ в принципе высокий при железодефицитной анемии и низкий при хронических воспалениях и новообразованиях. По этой причине коэффициент насыщенности трансферина меньше у страдающих железодефицитной анемией. Обследование дополняется определением гемосидерина на костномозговом мазке. В костном мозге страдающих хроническим воспалением и новообразованием содержатся макрофаги, загруженные гемосидерином, который всегда отсутствует в условиях железодефицитной анемии. При обоих заболеваниях сидеробласты обнаруживаются в малом количестве или совсем отсутствуют.
В процессе, диагностирования возникают затруднения и в случае сидеробластической анемии. Тем не менее, в условиях сидеробластической анемии, эритроциты отличаются частным видом. На мазге различаются две популяции эритроцитов, из них одна микроцитная и гипохромная) другая — макроцитная и нормохромная («частичная гипохромия»). Дифференциальная диагностика основывается на определении метаболизма железа, который, при сидеробластической анемии, отражает нормальную или завышенную сидеремию, нормальную или низкую ОССТЖ и высокий показатель гемосидерина в костном мозге с наличием кольчатых сидеробластов.
Из гемолитических анемий наличие гипохромии отмечается при гемоглобинопатиях К, КС, Е, Кёлн. В отдельных случаях наблюдаются клетки мишень. Высокие показатели сидеремии и гемосидерина в костном мозге исключают возможность наличия железодефицитной анемии. Гемолитическая анемия с хроническим внутрисосудистым гемолизом, в частности ночной пароксизмальной гемоглобинурией сочетается с характерной для железодефицитной анемии картиной. Дифференциация возможна по признакам гемолиза и данным лабораторных анализов специфических ночной пароксизмальной гемоглобинурии.
После проведения курса лечения витамином В12 или фолиевой кислотой сидеремия и запасы железа быстро сокращаются под влиянием ускоренного эритропоэза. Это сокращение четко выражено у женщины с небольшим запасом железа. Дифференциальная диагностика представляет трудности, поскольку признаки мегалобластоза в костном мозге исчезают после проведения специфической терапии. В таком случае наиболее важным представляется исследование мазка крови, выявляющее наличие макроцитоза с нормохромией и гиперсегментирование нейтрофилов.
Нередко исследование мазка крови страдающего недостатком железа указывает на наличие нормохромии. Вот почему представляется важной постановка дифференциального диагноза по сравнению с группой нормохромных анемий. Отсутствие костномозгового гемосидерина характеризует железодефицитную анемию, даже при ее умеренной форме.
Необходимо отметить, что в условиях истинной полицитемии, эритроциты нередко гипохромные уже при первом обследовании врача, до вскрытия вен. К тому же обнаруживается невысокая сидеремия и отсутствие костномозгового запаса железа. Тем не менее истинная полицитемия отличается характерной клинической и лабораторной симптоматологией.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В соответствии с рекомендациями ВОЗ, стандартизованы следующие критерии диагностики железодефицитных анемий у детей:
- снижение уровня СЖ менее 12 мкмоль/л;
- повышение ОЖСС более 69 мкмоль/л;
- насыщение трансферрина железом менее 17%;
- содержание гемоглобина ниже 110 г/л в возрасте до 6 лет и ниже 120 г/л — в возрасте старше 6 лет.
Таким образом, ВОЗ рекомендует достаточно точные критерии для диагностики железодефицитной анемии, однако методы диагностики требуют забора крови из вены и проведения достаточно дорогих биохимических исследований, что не всегда возможно в украинских лечебных учреждениях. Имеются попытки минимизации критериев диагностики железо-дефицитной анемии.
Федеральная служба по заболеваемости, эпидемиологии и образованию (United States Federal Government Centers for Disease Control — CDC) со штаб-квартирой в Атланте (Джорджия, США) рекомендует использовать для диагностики железо-дефицитной анемии 2 доступных критерия: снижение концентрации гемоглобина и гематокрита (Ht) при отсутствии у больного других заболеваний. Устанавливают предположительный диагноз железодефицитной анемии и назначают лечение препаратами железа на 4 нед из расчёта 3 мг элементарного железа на 1 кг массы тела больного в сутки. Достоинство данных рекомендаций — регистрация ответа на терапию препаратами железа по строго фиксированным критериям. К концу 4-й нед лечения концентрация гемоглобина должна повыситься на 10 г/л по отношению к исходной, a Ht — на 3%. Такой ответ подтверждает диагноз «железодефицитная анемия», и лечение продолжают в течение нескольких месяцев. Если ответ не получен, рекомендуют остановить лечение препаратами железа и пересмотреть данный случай с точки зрения диагностики процесса. Перегрузка железом организма за 4 нед при приёме препаратов железа внутрь маловероятна.

Лабораторную диагностику железодефицитной анемии осуществляют с помощью:
- общего анализа крови, выполненного «ручным» методом;
- анализа крови, выполненного на автоматическом анализаторе крови;
- биохимических исследований.
При диагностике любой анемии обязательно выполнение общего анализа крови с определением количества ретикулоцитов. Врач ориентируется на гипохромный и микроцитарный характер анемии. В общем анализе крови, выполненном «ручным» методом, выявляют:
- снижение концентрации гемоглобина ( 12 /л) количество эритроцитов;
- снижение цветового показателя ( 12-16 мм/ч);
- анизоцитоз (характерны микроциты) и пойкилоцитоз эритроцитов.
Ошибка определения параметров может достигать 5% и более. Стоимость одного общего анализа крови составляет около 5 долларов США.
Точным и удобным методом диагностики и дифференциальной диагностики служит метод определения эритроцитарных показателей на автоматических анализаторах крови. Исследование проводят как в венозной, так и в капиллярной крови. Ошибка в определении параметров значительно ниже, чем при «ручном» методе, и составляет менее 1%. При развитии дефицита железараньше всего повышается показатель выраженности анизоцитоза эритроцитов — RDW (норма
Портал iLive не предоставляет медицинские консультации, диагностику или лечение.
Информация, опубликованная на портале, предназначена только для ознакомления и не должна использоваться без консультации со специалистом.
Внимательно ознакомьтесь с правилами и политикой сайта. Вы также можете связаться с нами!
Copyright © 2011 — 2019 iLive. Все права защищены.
источник

Железодефицитная анемия является самой распространенной патологией системы крови и самой часто встречаемой анемией. По данным ВОЗ (всемирной организации здравоохранения), более 2 миллиардов людей на планете имеют дефицит железа в организме. Несколько чаще данным недугом страдают женщины, что связано с беременностью, кормлением грудью, а также периодической кровопотерей во время менструаций.
Интересные факты
- Первое задокументированное упоминание о железодефицитной анемии датируется 1554 годом. В те времена данным недугом страдали преимущественно девушки 14 – 17 лет, в связи с чем заболевание называлось «de morbo virgineo», что в переводе означает «болезнь девственниц».
- Первые попытки лечения заболевания препаратами железа были предприняты в 1700 году.
- Латентный (скрытый) дефицит железа может отмечаться у детей в период интенсивного роста.
- Потребность в железе у беременной женщины в два раза больше, чем у двух здоровых взрослых мужчин.
- За время беременности и родов женщина теряет более 1 грамма железа. При обычном питании данные потери восстановятся лишь через 3 – 4 года.
Размер зрелого эритроцита колеблется в пределах от 7,5 до 8,3 микрометров (мкм). Он имеет форму двояковогнутого диска, которая поддерживается благодаря наличию в клеточной мембране эритроцита особого структурного белка – спектрина. Такая форма обеспечивает максимально эффективный процесс газообмена в организме, а наличие спектрина позволяет эритроцитам видоизменяться при прохождении через мельчайшие кровеносные сосуды (капилляры) и после этого восстанавливать свою первоначальную форму.
Более 95% внутриклеточного пространства эритроцита заполнено гемоглобином – веществом, состоящим из белка глобина и небелкового компонента – гема. Молекула гемоглобина состоит из четырех глобиновых цепей, в центре каждой из которых находится гем. Каждый эритроцит содержит более 300 миллионов молекул гемоглобина.
За транспортировку кислорода в организме отвечает небелковая часть гемоглобина, а именно атом железа, входящего в состав гема. Обогащение крови кислородом (оксигенация) происходит в легочных капиллярах, при прохождении через которые каждый атом железа присоединяет к себе 4 молекулы кислорода (формируется оксигемоглобин). Оксигенированная кровь разносится по артериям ко всем тканям организма, где происходит переход кислорода к клеткам органов. Взамен из клеток выделяется углекислый газ (побочный продукт клеточного дыхания), который присоединяется к гемоглобину (формируется карбгемоглобин) и по венам транспортируется к легким, где выделяется в окружающую среду вместе с выдыхаемым воздухом.
Помимо переноса дыхательных газов, дополнительными функциями эритроцитов являются:
- Антигенная функция. Эритроциты обладают собственными антигенами, которые определяют принадлежность к одной из четырех основных групп крови (по системе АВ0).
- Транспортная функция. К наружной поверхности мембраны эритроцитов могут прикрепляться антигены микроорганизмов, различные антитела и некоторые медикаменты, которые разносятся с током крови по всему организму.
- Буферная функция. Гемоглобин принимает участие в поддержании кислотно-щелочного равновесия в организме.
- Остановка кровотечений. Эритроциты включаются в состав тромба, формирующегося при повреждении сосудов.
В организме человека эритроциты формируются из так называемых стволовых клеток. Эти уникальные клетки образуются на стадии эмбрионального развития. Они содержат ядро, в котором находится генетический аппарат (ДНК – дезоксирибонуклеиновая кислота), а также множество других органелл, обеспечивающий процессы их жизнедеятельности и размножения. Стволовые клетки дают начало всем клеточным элементам крови.
Для нормального процесса эритропоэза необходимы:
- Железо. Данный микроэлемент входит в состав гема (небелковой части молекулы гемоглобина) и обладает способностью обратимо связывать кислород и углекислый газ, что и определяет транспортную функцию эритроцитов.
- Витамины (В2, В6, В9 и B12). Регулируют образование ДНК в кроветворных клетках красного костного мозга, а также процессы дифференцировки (созревания) эритроцитов.
- Эритропоэтин. Гормональное вещество, вырабатываемое почками, которое стимулирует процесс образования эритроцитов в красном костном мозге. При уменьшении концентрации красных кровяных телец в крови развивается гипоксия (недостаток кислорода), что является основным стимулятором выработки эритропоэтина.
Образование эритроцитов (эритропоэз) начинается в конце 3 недели эмбрионального развития. На ранних этапах внутриутробного развития красные клетки крови образуются, в основном, в печени и селезенке. Примерно на 4 месяце беременности происходит миграция стволовых клеток из печени в полости костей таза, черепа, позвонков, ребер и других, в результате чего в них формируется красный костный мозг, который также принимает активное участие в процессе кроветворения. После рождения ребенка кроветворная функция печени и селезенки угнетается, и костный мозг остается единственным органом, обеспечивающим поддержание клеточного состава крови.
В процессе превращения в эритроцит, стволовая клетка претерпевает целый ряд изменений. Она уменьшается в размерах, постепенно теряет ядро и практически все органеллы (в результате чего дальнейшее ее деление становится невозможным), а также накапливает гемоглобин. Конечным этапом эритропоэза в красном костном мозге является ретикулоцит (незрелый эритроцит). Он вымывается из костей в периферический кровоток, и в течение суток происходит его созревание до стадии нормального эритроцита, способного в полной мере выполнять свои функции.
Средняя продолжительность жизни красных клеток крови составляет 90 – 120 дней. По истечении этого периода их клеточная мембрана становится менее пластичной, в результате чего теряет способность обратимо деформироваться при прохождении через капилляры. «Старые» эритроциты захватываются и разрушаются особыми клетками иммунной системы – макрофагами. Данный процесс происходит, в основном, в селезенке, а также (в значительно меньшей степени) в печени и красном костном мозге. Незначительно малая доля эритроцитов разрушается непосредственно в сосудистом русле.
При разрушении эритроцита из него выделяется гемоглобин, который быстро распадается на белковую и небелковую части. Глобин подвергается ряду превращений, в результате чего формируется пигментный комплекс желтого цвета – билирубин (несвязанная форма). Он нерастворим в воде и весьма токсичен (способен проникать в клетки организма, нарушая процессы их жизнедеятельности). Билирубин быстро транспортируется в печень, где связывается с глюкуроновой кислотой и выводится вместе с желчью.
Небелковая часть гемоглобина (гем) также подвергается разрушению, в результате чего происходит выделение свободного железа. Оно токсично для организма, поэтому быстро связывается с трансферрином (транспортным белком крови). Большая часть железа, выделяющегося при разрушении эритроцитов, транспортируется в красный костный мозг, где повторно используется для синтеза эритроцитов.
В организме взрослого человека содержится около 4 грамм железа. Эта цифра варьирует в зависимости от пола и возраста.
Концентрация железа в организме составляет:
- у новорожденных – 75 мг на 1 килограмм массы тела (мг/кг);
- у мужчин – более 50 мг/кг;
- у женщин – 35 мг/кг (что связано с ежемесячной потерей крови).
Основными местами содержания железа в организме являются:
- гемоглобин эритроцитов – 57%;
- мышцы – 27%;
- печень – 7 – 8%.
Кроме того, железо входит в состав целого ряда других белковых ферментов (цитохромов, каталазы, редуктазы). Они участвуют в окислительно-восстановительных процессах в организме, в процессах клеточного деления и регуляции многих других реакций. Дефицит железа может привести к недостатку данных ферментов и появлению соответствующих нарушений в организме.
Всасывание железа в организме человека происходит преимущественно в двенадцатиперстной кишке, при этом все железо, поступающее в организм, принято разделять на гемовое (двухвалентное, Fe +2 ), содержащееся в мясе животных и птиц, в рыбе, и негемовое (трехвалентное, Fe +3 ), основным источником которого являются молочные продукты и овощи. Важным условием, необходимым для нормального всасывания железа, является достаточное количество соляной кислоты, входящей в состав желудочного сока. При уменьшении ее количества всасывание железа значительно замедляется.
Всосавшееся железо связывается с трансферрином и транспортируется в красный костный мозг, где используется для синтеза эритроцитов, а также к органам-депо. Запасы железа в организме представлены, в основном, ферритином – комплексом, состоящим из белка апоферритина и атомов железа. Каждая молекула ферритина содержит в среднем 3 – 4 тысячи атомов железа. При снижении концентрации данного микроэлемента в крови, происходит выделение его из ферритина и использование для нужд организма.
Скорость всасывания железа в кишечнике строго ограничена и не может превышать 2,5 мг в сутки. Этого количества достаточно лишь для того, чтобы восстанавливать ежедневные потери данного микроэлемента, которые в норме составляют около 1 мг у мужчин и 2 мг у женщин. Следовательно, при различных патологических состояниях, сопровождающихся нарушением всасывания железа либо повышенными его потерями, может развиться дефицит данного микроэлемента. При снижении концентрации железа в плазме уменьшается количество синтезируемого гемоглобина, в результате чего образующиеся эритроциты будут иметь меньшие размеры. Кроме того, нарушаются процессы роста эритроцитов, что приводит к уменьшению их количества.
Причиной дефицита железа в организме может быть:
- недостаточное поступление железа с пищей;
- повышение потребности организма в железе;
- врожденный недостаток железа в организме;
- нарушение всасывания железа;
- нарушение синтеза трансферрина;
- повышенная кровопотеря;
- алкоголизм;
- применение лекарственных препаратов.
Нарушение питания может привести к развитию железодефицитной анемии как у детей, так и у взрослых.
Основными причинами недостаточного поступления железа в организм являются:
- длительное голодание;
- вегетарианство;
- однообразная диета с малым содержанием животных продуктов.
У новорожденных и детей грудного возраста потребности в железе полностью покрываются при кормлении грудным молоком (при условии, что мать не страдает железодефицитным состоянием). Если же слишком рано переводить ребенка на искусственное вскармливание, у него также могут появиться симптомы дефицита железа в организме.
В нормальных, физиологических условиях может возникать повышенная потребность в железе. Это характерно для женщин во время беременности и в период кормления грудью.
Несмотря на то, что определенная часть железа в период беременности сохраняется (ввиду отсутствия менструальных кровотечений), потребность в нем увеличивается в несколько раз.
| Причина | Примерное количество расходуемого железа |
| Увеличение объема циркулирующей крови и количества эритроцитов | 500 мг |
| Железо, передаваемое плоду | 300 мг |
| Железо, входящее в состав плаценты | 200 мг |
| Кровопотеря во время родов и в послеродовом периоде | 50 – 150 мг |
| Железо, теряемое с грудным молоком за весь период кормления | 400 – 500 мг |
Организм ребенка получает от матери все необходимые питательные вещества, в том числе и железо. Однако при наличии определенных заболеваний у матери или плода, возможно рождение ребенка с дефицитом железа.
Причиной врожденного дефицита железа в организме может быть:
- тяжелая железодефицитная анемия у матери;
- многоплодная беременность;
- недоношенность.
В любом из вышеперечисленных случаев концентрация железа в крови новорожденного значительно ниже нормы, и симптомы железодефицитной анемии могут проявляться уже с первых недель жизни.
Всасывание железа в двенадцатиперстной кишке возможно лишь при нормальном функциональном состоянии слизистой оболочки данного отдела кишечника. Различные заболевания желудочно-кишечного тракта могу повреждать слизистую оболочку и значительно снижать скорость поступления железа в организм.
К уменьшению всасывания железа в двенадцатиперстной кишке может привести:
- Энтерит – воспаление слизистой оболочки тонкого кишечника.
- Целиакия – наследственное заболевание, характеризующееся непереносимостью белка глютена и связанным с этим нарушением всасывания в тонком кишечнике.
- Helicobacter Pylori – инфекционный агент, поражающий слизистую оболочку желудка, что, в конечном итоге, приводит к уменьшению секреции соляной кислоты и нарушению всасывания железа.
- Атрофический гастрит – заболевание, связанное с атрофией (уменьшением размеров и функции) слизистой оболочки желудка.
- Аутоиммунный гастрит – заболевание, вызванное нарушением работы иммунной системы и выработкой антител к собственным клеткам слизистой оболочки желудка с последующим их разрушением.
- Удаление желудка и/или тонкой кишки – при этом уменьшается как количество образуемой соляной кислоты, так и функциональная площадь двенадцатиперстной кишки, где происходит всасывание железа.
- Болезнь Крона – аутоиммунное заболевание, проявляющееся воспалительным поражением слизистой оболочки всех отделов кишечника и, возможно, желудка.
- Муковисцидоз – наследственное заболевание, проявляющееся нарушением секреции всех желез организма, в том числе слизистой оболочки желудка.
- Рак желудка или двенадцатиперстной кишки.
Нарушение образования данного транспортного белка может быть связано с различными наследственными заболеваниями. Симптомов дефицита железа у новорожденного не будет, так как он получал данный микроэлемент из организма матери. После рождения основным способом поступления железа в организм ребенка является всасывание в кишечнике, однако из-за недостатка трансферрина всосавшееся железо не может быть доставлено к органам-депо и к красному костному мозгу и не может использоваться в синтезе эритроцитов.
Так как трансферрин синтезируется только в клетках печени, различные ее поражения (цирроз, гепатиты и другие) также могут привести к уменьшению концентрации данного белка в плазме и развитию симптомов железодефицитной анемии.
Одноразовая потеря большого количества крови обычно не приводит к развитию железодефицитной анемии, так как запасов железа в организме достаточно, чтобы возместить потери. В то же время при хронических, длительных, часто незаметных внутренних кровотечениях организм человека может терять по несколько миллиграмм железа ежедневно, на протяжении нескольких недель или даже месяцев.
Причиной хронической кровопотери может быть:
- язва желудка или двенадцатиперстной кишки;
- геморрой;
- неспецифический язвенный колит (воспаление слизистой толстого кишечника);
- болезнь Крона;
- полипоз кишечника;
- распадающиеся опухоли желудочно-кишечного тракта (и другой локализации);
- грыжа пищеводного отверстия диафрагмы;
- эндометриоз (разрастание клеток внутреннего слоя стенки матки);
- системная красная волчанка;
- системный васкулит (воспаление кровеносных сосудов различной локализации);
- сдача крови донорами более 4 раз в год (300 мл донорской крови содержат около 150 мг железа).
Если причина кровопотери не будет своевременно выявлена и устранена, высока вероятность развития железодефицитной анемии у больного, так как всасывающееся в кишечнике железо способно лишь покрывать физиологические потребности в данном микроэлементе.
Прием некоторых лекарственных препаратов может нарушать процессы всасывания и утилизации железа в организме. Обычно это происходит при длительном приеме больших доз медикаментов.
Препаратами, которые могут вызвать дефицит железа в организме, являются:
- Нестероидные противовоспалительные средства (аспирин и другие). Механизм действия данных препаратов связан с улучшением текучести крови, что может привести к появлению хронических внутренних кровотечений. Кроме того, они способствуют развитию язвы желудка.
- Антациды (Ренни, Алмагель). Данная группа препаратов нейтрализует или уменьшает скорость выделения желудочного сока, содержащего соляную кислоту, необходимую для нормального всасывания железа.
- Железосвязывающие препараты (Десферал, Эксиджад). Данные препараты обладают способностью связывать и выводить из организма железо, причем как свободное, так и входящее в состав трансферрина и ферритина. В случае передозировки возможно развитие железодефицитного состояния.
Во избежание развития железодефицитной анемии принимать данные препараты следует только по назначению врача, строго соблюдая дозировку и длительность использования.
Проявлениями железодефицитной анемии являются:
- мышечная слабость;
- повышенная утомляемость;
- одышка;
- учащенное сердцебиение;
- изменения кожи и ее придатков (волос, ногтей);
- поражение слизистых оболочек;
- поражение языка;
- нарушение вкуса и обоняния;
- склонность к инфекционным заболеваниям;
- нарушения интеллектуального развития.
Как говорилось ранее, железо входит в состав множества ферментов, участвующих в процессах клеточного дыхания и деления. Дефицит данного микроэлемента приводит к повреждению кожи — она становится сухой, менее эластичной, шелушится и трескается. Кроме того, привычный красный или розоватый оттенок слизистым оболочками и коже придают эритроциты, которые находятся в капиллярах данных органов и содержат оксигенированный гемоглобин. При снижении его концентрации в крови, а также в результате уменьшения образования эритроцитов, может отмечаться бледность кожных покровов.
Волосы истончаются, теряют привычный блеск, становятся менее прочными, легко ломаются и выпадают. Рано появляется седина.
Поражение ногтей является весьма специфичным проявлением железодефицитной анемии. Они истончаются, приобретают матовый оттенок, расслаиваются и легко ломаются. Характерной является поперечная исчерченность ногтей. При выраженном дефиците железа может развиться койлонихия – края ногтей приподымаются и изгибаются в обратную сторону, приобретая ложкообразную форму.
Слизистые оболочки относятся к тканям, в которых процессы клеточного деления происходят максимально интенсивно. Вот почему их поражение является одним из первых проявлений дефицита железа в организме.
При железодефицитной анемии поражается:
- Слизистая оболочка полости рта. Она становится сухой, бледной, появляются участки атрофии. Затрудняется процесс пережевывания и проглатывания пищи. Также характерно наличие трещин на губах, образование заед в углах рта (хейлоз). В тяжелых случаях изменяется цвет и снижается прочность зубной эмали.
- Слизистая оболочка желудка и кишечника. В нормальных условиях слизистая оболочка данных органов играет важную роль в процессе всасывания пищи, а также содержит в себе множество желез, вырабатывающих желудочный сок, слизь и другие вещества. При ее атрофии (вызванной дефицитом железа) нарушается пищеварение, что может проявляться диареей или запорами, болями в животе, а также нарушением всасывания различных питательных веществ.
- Слизистая оболочка дыхательных путей. Поражение гортани и трахеи может проявляться першением, чувством наличия инородного тела в горле, что будет сопровождаться непродуктивным (сухим, без мокроты) кашлем. Кроме того, слизистая оболочка дыхательных путей в норме выполняет защитную функцию, предотвращая попадание чужеродных микроорганизмов и химических веществ в легкие. При ее атрофии повышается риск развития бронхита, пневмонии и других инфекционных заболеваний органов дыхания.
- Слизистая оболочка мочеполовой системы. Нарушение ее функции может проявляться болями при мочеиспускании и во время полового акта, недержанием мочи (чаще у детей), а также частыми инфекционными заболеваниями в пораженной области.
Как уже говорилось, слизистая оболочка языка богата вкусовыми рецепторами, расположенными преимущественно в сосочках. При их атрофии могут появляться различные вкусовые нарушения, начиная со снижения аппетита и непереносимости некоторых видов продуктов (обычно кислой и соленой пищи), и заканчивая извращением вкуса, пристрастием к поеданию земли, глины, сырого мяса и других несъедобных вещей.
Нарушения обоняния могут проявляться обонятельными галлюцинациями (ощущением запахов, которых на самом деле нет) либо пристрастием к непривычным запахам (лака, краски, бензина и другим).
Склонность к инфекционным заболеваниям
При дефиците железа нарушается образование не только эритроцитов, но и лейкоцитов – клеточных элементов крови, обеспечивающих защиту организма от чужеродных микроорганизмов. Недостаток данных клеток в периферической крови повышает риск развития различных бактериальных и вирусных инфекций, который еще больше возрастает при развитии анемии и нарушении микроциркуляции крови в коже и других органах.
Важно отметить, что лечение железодефицитной анемии будет неэффективным, если не выявить и не устранить причину ее возникновения.
В диагностике железодефицитной анемии применяется:
- опрос и осмотр пациента;
- общий анализ крови;
- биохимический анализ крови;
- пункция костного мозга.
Первое, что должен сделать врач при подозрении на железодефицитную анемию – это тщательно опросить и обследовать пациента.
Врач может задать следующий вопросы:
- Когда и в какой последовательности начали появляться симптомы заболевания?
- Как быстро они развивались?
- Имеются ли схожие симптомы у членов семьи или ближайших родственников?
- Как питается пациент?
- Страдает ли пациент какими-либо хроническими заболеваниями?
- Каково отношение к алкоголю?
- Принимал ли пациент какие-либо медикаменты в течение последних месяцев?
- Если больна беременная женщина – уточняется срок беременности, наличие и исход предыдущих беременностей, принимает ли она препараты железа.
- Если болен ребенок – уточняется его масса при рождении, родился ли он доношенным, принимала ли мать препараты железа во время беременности.
Во время обследования врач оценивает:
- Характер питания – по степени выраженности подкожно-жировой клетчатки.
- Цвет кожи и видимых слизистых оболочек – особое внимание уделяется слизистой полости рта и языку.
- Придатки кожи – волосы, ногти.
- Мышечную силу – врач просит пациента сжать свою руку или использует специальный прибор (динамометр).
- Артериальное давление – оно может быть снижено.
- Вкус и обоняние.
Это первый анализ, назначаемый всем пациентам при подозрении на анемию. Он позволяет подтвердить или опровергнуть наличие анемии, а также дает косвенную информацию о состоянии кроветворения в красном костном мозге.
Кровь для общего анализа может браться из пальца или из вены. Первый вариант более подходит в том случае, если общий анализ является единственным лабораторным исследованием, назначенным пациенту (когда достаточно небольшого количества крови). Перед взятием крови кожу пальца всегда обрабатывают ватой, смоченной в 70% спирте, чтобы избежать занесения инфекции. Прокол производится специальной одноразовой иглой (скарификатором) на глубину 2 – 3 мм. Кровотечение в данном случае несильное и полностью останавливается практически сразу после взятия крови.
В том случае, если планируется выполнять сразу несколько исследований (например, общий и биохимический анализ) – берут венозную кровь, так как ее легче получить в больших количествах. Перед забором крови на среднюю треть плеча накладывается резиновый жгут, что приводит к наполнению вен кровью и облегчает определение их местоположения под кожей. Место прокола также должно быть обработано спиртовым раствором, после чего медсестра одноразовым шприцем прокалывает вену и набирает кровь для анализа.
Полученную одним из описанных методов кровь направляют в лабораторию, где она исследуется в гематологическом анализаторе – современном высокоточном приборе, имеющемся в большинстве лабораторий мира. Часть полученной крови окрашивают специальными красителями и исследуют в световом микроскопе, что позволяет визуально оценить форму эритроцитов, их строение, а при отсутствии или неисправности гематологического анализатора – произвести подсчет всех клеточных элементов крови.
При железодефицитной анемии мазок периферической крови характеризуется:
- Пойкилоцитозом – наличием в мазке эритроцитов различных форм.
- Микроцитозом – преобладанием эритроцитов, размер которых меньше нормы (могут встречаться и нормальные эритроциты).
- Гипохромией – цвет эритроцитов изменяется с ярко-красного на бледно-розовый.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при железодефицитной анемии |
| Концентрация эритроцитов (RBC) | При истощении запасов железа в организме нарушается эритропоэз в красном костном мозге, ввиду чего общая концентрация эритроцитов в крови будет снижена. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Средний объем эритроцита (MCV) | При дефиците железа нарушаются процессы образования гемоглобина, в результате чего уменьшается размер самих эритроцитов. Гематологический анализатор позволяет максимально точно определить данный показатель. | 75 – 100 кубических микрометров (мкм 3 ). | Менее 70 мкм 3 . |
| Концентрация тромбоцитов (PLT) | Тромбоциты – клеточные элементы крови, отвечающие за остановку кровотечений. Изменение их концентрации может наблюдаться в том случае, если дефицит железа вызван хронической кровопотерей, что приведет к компенсаторному увеличению их образования в костном мозге. | 180 – 320 х 10 9 /л. | В норме или увеличена. |
| Концентрация лейкоцитов (WBC) | При развитии инфекционных осложнений концентрация лейкоцитов может значительно повышаться. | 4,0 – 9,0 х 10 9 /л. | В норме или увеличена. |
| Концентрация ретикулоцитов (RET) | В нормальных условиях естественным ответом организма на анемию является увеличение скорости образования эритроцитов в красном костном мозге. Однако при дефиците железа развитие данной компенсаторной реакции невозможно, ввиду чего снижается количество ретикулоцитов в крови. | М: 0,24 – 1,7%. | Уменьшена либо находится на нижней границе нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | Как уже говорилось, дефицит железа приводит к нарушению образования гемоглобина. Чем дольше длится заболевание, тем ниже будет данный показатель. | М: 130 – 170 г/л. | Менее 120 г/л. |
| Ж: 120 – 150 г/л. | Менее 110 г/л. | ||
| Среднее содержание гемоглобина в одном эритроците (MCH) | Данный показатель более точно характеризует нарушение образования гемоглобина. | 27 – 33 пикограмм (пг). | Менее 24 пг. |
| Гематокрит (Hct) | Данный показатель отображает количество клеточных элементов по отношению к объему плазмы. Так как основное большинство клеток крови представлено эритроцитами, уменьшение их количества приведет к снижению гематокрита. | М: 42 – 50%. | Менее 40%. |
| Ж: 38 – 47%. | Менее 35%. | ||
| Цветовой показатель (ЦП) | Цветовой показатель определяется путем пропускания через взвесь эритроцитов световой волны определенной длины, которая поглощается исключительно гемоглобином. Чем меньше будет концентрация данного комплекса в крови, тем ниже будет значение цветового показателя. | 0,85 – 1,05. | Менее 0,8. |
| Скорость оседания эритроцитов (СОЭ) | Все клетки крови, а также эндотелий (внутренняя поверхность) сосудов, имеют отрицательный заряд. Они отталкиваются друг от друга, что способствует поддержанию эритроцитов во взвешенном состоянии. При уменьшении концентрации эритроцитов расстояние между ними увеличивается, и сила отталкивания уменьшается, в результате чего они будут оседать на дно пробирки быстрее, чем в нормальных условиях. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
В ходе данного исследования удается установить концентрацию различных химических веществ, находящихся в крови. Это дает информацию о состоянии внутренних органов (печени, почек, костного мозга и других), а также позволяет выявить множество заболеваний.
Существует несколько десятков биохимических показателей, определяемых в крови. В данном разделе будут описаны только те из них, которые имеют значение в диагностике железодефицитной анемии.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при железодефицитной анемии |
| Концентрация сывороточного железа | Вначале данный показатель может быть в норме, так как дефицит железа будет компенсироваться выделением его из депо. Только при длительном течении заболевания концентрация железа в крови начнет снижаться. | М: 17,9 – 22,5 мкмоль/л. | В норме или снижена. |
| Ж: 14,3 – 17,9 мкмоль/л. | |||
| Уровень ферритина в крови | Как говорилось ранее, ферритин является одним из основных видов депонирования железа. При недостатке данного элемента начинается мобилизация его из органов-депо, ввиду чего уменьшение концентрации ферритина в плазме является одним из первых признаков железодефицитного состояния. | Дети: 7 – 140 нанограмм в 1 миллилитре крови (нг/мл). | Чем дольше длится дефицит железа, тем меньше уровень ферритина. |
| М: 15 – 200 нг/мл. | |||
| Ж: 12 – 150 нг/мл. | |||
| Общая железосвязывающая способность сыворотки | Данный анализ основан на способности трансферрина, находящегося в крови, связывать железо. В нормальных условиях, каждая молекула трансферрина только на 1/3 связана с железом. При дефиците данного микроэлемента печень начинает синтезировать больше трансферрина. Концентрация его в крови повышается, однако количество железа, приходящегося на каждую молекулу, снижается. Определив, какая доля молекул трансферрина находится в несвязанном с железом состоянии, можно сделать выводы о выраженности дефицита железа в организме. | 45 – 77 мкмоль/л. | Значительно выше нормы. |
| Концентрация эритропоэтина | Как было упомянуто ранее, эритропоэтин выделяется почками, если ткани организма испытывают недостаток в кислороде. В норме данный гормон стимулирует эритропоэз в костном мозге, однако при дефиците железа данная компенсаторная реакция малоэффективна. | 10 – 30 международных миллиединиц в 1 миллилитре (мМЕ/мл). | Значительно выше нормы. |
Данное исследование заключается в прокалывании одной из костей организма (обычно грудины) специальной полой иглой и заборе нескольких миллилитров вещества костного мозга, которое потом исследуется под микроскопом. Это позволяет напрямую оценить выраженность изменения структуры и функции органа.
В начале заболевания никаких изменений в пунктате костного мозга не будет. При развитии анемии может отмечаться разрастание эритроидного ростка кроветворения (увеличения количества клеток-предшественниц эритроцитов).
Для выявления причины железодефицитной анемии применяется:
- анализ кала на наличие скрытой крови;
- рентгенологическое исследование;
- компьютерная томография;
- эндоскопические исследования;
- консультация других специалистов.
Причиной появления крови в кале (мелены) может стать кровотечение из язвы, распад опухоли, болезнь Крона, неспецифический язвенный колит и другие заболевания. Обильные кровотечения легко определяются визуально по изменению цвета каловых масс на ярко-красный (при кровотечении из нижних отелов кишечника) или черный (при кровотечении из сосудов пищевода, желудка и верхнего отдела кишечника).
Массивные однократные кровотечения практически не приводит к развитию железодефицитной анемии, так как быстро диагностируются и устраняются. Опасность в этом плане представляют длительные, небольшие по объему кровопотери, возникающие при повреждении (или изъязвлении) мелких сосудов желудочно-кишечного трата. В таком случае выявить кровь в кале возможно только с помощью специального исследования, которое назначается во всех случаях анемии неясного генеза.
С целью выявления опухолей или язв желудка и кишечника, которые могли стать причиной хронического кровотечения, применяется рентген с контрастом. В роли контраста используется вещество, которое не поглощает рентгеновские лучи. Обычно это взвесь бария в воде, которую пациент должен выпить непосредственно перед началом исследования. Барий покрывает слизистые оболочки пищевода, желудка и кишечника, в результате чего на рентгеновском снимке становится четко различима их форма, контур и различные деформации.
Перед проведением исследования необходимо исключить прием пищи в течение последних 8 часов, а при исследовании нижних отделов кишечника назначаются очистительные клизмы.
В данную группу включен ряд исследований, суть которых заключается во введении в полости организма специального аппарата с видеокамерой на одном конце, подсоединенной к монитору. Этот метод позволяет визуально исследовать слизистые оболочки внутренних органов, оценить их строение и функцию, а также выявить опухоль или кровотечение.
С целью установления причины железодефицитной анемии используется:
- Фиброэзофагогастродуоденоскопия (ФЭГДС) – введение эндоскопа через рот и исследование слизистой оболочки пищевода, желудка и верхних отделов кишечника.
- Ректороманоскопия – исследование прямой и нижнего отдела сигмовидной кишки.
- Колоноскопия – исследование слизистой оболочки толстого кишечника.
- Лапароскопия – прокалывание кожи передней стенки живота и введение эндоскопа в брюшную полость.
- Кольпоскопия – исследование влагалищной части шейки матки.
При выявлении заболевания различных систем и органов гематолог может привлекать специалистов из других областей медицины с целью постановки более точного диагноза и назначения адекватного лечения.
Для выявления причины железодефицитной анемии может понадобиться консультация:
- Диетолога – при выявлении нарушения питания.
- Гастролога – при подозрении на наличие язвы или других заболеваний желудочно-кишечного тракта.
- Хирурга – при наличии кровотечения из желудочно-кишечного тракта или другой локализации.
- Онколога – при подозрении на опухоль желудка или кишечника.
- Акушера-гинеколога – при наличии признаков беременности.
| Название продукта | Содержание железа в 100 г продукта |
| Продукты животного происхождения | |
| Печень свиная | 20 мг |
| Печень куриная | 15 мг |
| Печень говяжья | 11 мг |
| Яичный желток | 7 мг |
| Мясо кролика | 4,5 – 5 мг |
| Баранина, говядина | 3 мг |
| Куриное мясо | 2,5 мг |
| Творог | 0,5 мг |
| Коровье молоко | 0,1 – 0,2 мг |
| Продукты растительного происхождения | |
| Плоды шиповника | 20 мг |
| Морская капуста | 16 мг |
| Чернослив | 13 мг |
| Гречка | 8 мг |
| Семена подсолнечника | 6 мг |
| Смородина черная | 5,2 мг |
| Миндаль | 4,5 мг |
| Персик | 4 мг |
| Яблоки | 2,5 мг |
Основным направлением в терапии данного заболевания является использование препаратов железа. Диетотерапия, хотя и является важным этапом лечения, не в состоянии самостоятельно восполнить дефицит железа в организме.
Методом выбора являются таблетированные формы препаратов. Парентеральное (внутривенное или внутримышечное) введение железа назначается в случае, если невозможно полноценное всасывание данного микроэлемента в кишечнике (например, после удаления части двенадцатиперстной кишки), необходимо быстро восполнить запасы железа (при массивной кровопотере) либо при развитии побочных реакций от применения пероральных форм препарата.
| Название препарата | Механизм лечебного действия | Способ применения и дозы | Контроль эффективности лечения |
| Гемофер пролонгатум | Препарат сульфата железа, восполняющий запасы данного микроэлемента в организме. | Принимать внутрь, за 60 минут до или через 2 часа после еды, запивая стаканом воды. |
Рекомендуемые дозы:
- детям – 3 миллиграмма на килограмм массы тела в сутки (мг/кг/сут);
- взрослым – 100 – 200 мг/сут.
Перерыв между двумя последующими приемами железа должен составлять не менее 6 часов, так как в этот период клетки кишечника невосприимчивы к новым дозам препарата.
Длительность лечения – 4 – 6 месяцев. После нормализации уровня гемоглобина переходят на поддерживающую дозу (30 – 50 мг/сутки) еще на 2 – 3 месяца.
- Повышение количества ретикулоцитов в анализе периферической крови на 5 – 10 день после начала приема препаратов железа.
- Повышение уровня гемоглобина (обычно отмечается через 3 – 4 недели лечения).
- Нормализация уровня гемоглобина и количества эритроцитов на 9 – 10 неделе лечения.
- Нормализация лабораторных показателей – уровня сывороточного железа, ферритина крови, общей железосвязывающей способности сыворотки.
- Постепенное исчезновение симптомов дефицита железа отмечается на протяжении нескольких недель или месяцев.
Данные критерии используются для контроля эффективности лечения всеми препаратами железа.
Рекомендуемые дозы:
- взрослым для лечения анемии – 2 таблетки 2 раза в день;
- женщинам при анемии во время беременности – 1 – 2 таблетки 1 раз в сутки.
После нормализации уровня гемоглобина переходят на поддерживающую терапию (20 – 50 мг 1 раз в сутки).
- сульфат железа;
- фолиевую кислоту;
- витамин В12.
Данный препарат назначается женщинам во время беременности (когда повышается риск развития дефицита железа, фолиевой кислоты и витаминов), а также при различных заболеваниях желудочно-кишечного тракта, когда нарушается всасывание не только железа, но и многих других веществ.
При внутривенном введении железа высок риск передозировки, поэтому данная процедура должна выполняться только в условиях стационара под контролем специалиста.
Важно помнить, что некоторые лекарственные средства (и другие вещества) могут в значительной степени ускорять либо замедлять скорость всасывания железа в кишечнике. Применять их совместно с препаратами железа стоит осторожно, так как это может привести к передозировке последних, или, наоборот, к отсутствию лечебного эффекта.
| Медикаменты, способствующие всасыванию железа | Вещества, препятствующие всасыванию железа |
|
|
При неосложненном течении и правильно проводимом лечении необходимости в данной процедуре нет.
Показаниями к переливанию эритроцитов являются:
- массивная кровопотеря;
- снижение концентрации гемоглобина менее 70 г/л;
- стойкое снижение систолического артериального давления (ниже 70 миллиметров ртутного столба);
- предстоящее хирургическое вмешательство;
- предстоящие роды.
Эритроциты следует переливать максимально короткий промежуток времени, пока не будет устранена угроза жизни пациента. Данная процедура может осложниться различными аллергическими реакциями, поэтому перед ее началом необходимо провести целый ряд тестов на определение совместимости крови донора и реципиента.

Причиной затруднений в лечении железодефицитной анемии может быть:
- неправильно выставленный диагноз;
- неустановленная причина дефицита железа;
- поздно начатое лечение;
- прием недостаточных доз препаратов железа;
- нарушение режима приема медикаментов или диеты.
При нарушениях в диагностике и лечении заболевания возможно развитие различных осложнений, некоторые из которых могут представлять опасность для здоровья и жизни человека.
Осложнениями железодефицитной анемии могут быть:
- Отставание в росте и развитии. Данное осложнение характерно для детей. Оно обусловлено ишемией и связанными с ней изменениями в различных органах, в том числе в ткани головного мозга. Отмечается как задержка физического развития, так и нарушение интеллектуальных способностей ребенка, которые при длительном течении заболевания могут оказаться необратимыми.
- Анемическая кома. Развитие комы обусловлено критическим снижением доставки кислорода к головному мозгу. Внешне это проявляется потерей сознания, отсутствием реакции на речь и болевые раздражители. Кома является опасным для жизни состоянием, требующим срочной медицинской помощи.
- Развитие недостаточности внутренних органов. При длительном дефиците железа и наличии анемии могут поражаться практически все органы человека. Наиболее характерным является развитие сердечной недостаточности, почечной недостаточности и печеночной недостаточности.
- Инфекционные осложнения. Часто рецидивирующие инфекции могут сопровождаться поражением внутренних органов и развитием сепсиса (попадания гноеродных бактерий в кровоток и ткани организма), что особенно опасно у детей и людей пожилого возраста.
источник