РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2018
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «25» апреля 2019 года
Протокол №64
Железодефицитная анемия – приобретенное заболевание из группы дефицитных анемий, возникает при дефиците железа, сопровождающееся микроцитарной, гипохромной, норморегенераторной анемией, клиническими проявлениями которой являются сочетание сидеропенического и анемического синдромов.
| МКБ-10 | |
| Код | Название |
| D50 | Железодефицитная анемия |
| D50.0 | Хроническая постгеморрагическая анемия |
Дата разработки/пересмотра протокола: 2013 год (пересмотр в 2018 г.)
Сокращения, используемые в протоколе:
| АХБ | – | анемия при хронических болезнях |
| ВОЗ | – | Всемирная организация здравоохранения |
| ГПК | – | гидросидполимальтозный комплекс |
| ЖДА | – | железодефицитная анемия |
| ЖКТ | – | желудочно-кишечный тракт |
| ЛДЖ | – | латентный дефицит железа |
| МСНС | – | средняя концентрация гемоглобина в эритроците |
| НТЖ | – | коэффициент насыщения трансферрина железом |
| ОЖСС | – | общая железосвязывающая способность |
| СЖ | — | сывороточное железо |
| СФ | – | сывороточный ферритин |
| ЦП | – | цветовой показатель |
| ЭГДС | – | эзофагогастродуоденоскопия |
| Hb | – | гемоглобин |
| МСН | – | содержание гемоглобина в эритроците |
| MCV | – | средний объем эритроцитов |
| RDW | – | степень анизоциотоза эритроцитов |
Пользователи протокола: врачи общей практики, педиатры, гематологи
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез:
Для анемического синдрома характерны следующие симптомы:
· снижение аппетита;
· шум в ушах;
· мелькание мушек перед глазами;
· плохая переносимость физических нагрузок;
· слабость, вялость, головокружение, раздражительность;
· обмороки;
· одышка;
· снижение работоспособности;
· снижение когнитивных функций;
· снижение качества жизни;
Физикальное обследование
Клинические проявления ЖДА представляют совокупность двух синдромов: сидеропенического и анемического.
Для сидеропенического синдрома характерны следующие симптомы:
· изменения кожи: сухость, появление маленьких пигментных пятен цвета «кофе с молоком», бледность кожи;
· изменения слизистых оболочек: «заеды» в углу рта, глоссит, атрофический гастрит и эзофагит; видимых слизистых оболочек;
· диспептические явления со стороны ЖКТ;
· изменения волос – раздваивание кончика, ломкость и выпадение вплоть до гнездной алопеции;
· изменения ногтей – поперечная исчерченность ногтей больших пальцев рук (в тяжелых случаях и ног), ломкость, расслаивание на пластинки;
· изменение обоняния – пристрастие больного к резким запахам лака, краски ацетона, выхлопных газов автомобиля, концентрированных духов;
· изменения вкуса – пристрастие больного к глине, мелу, сырому мясу, тесту, пельменям и др.;
· боли в икроножных мышцах, изменение тонуса мышц в виде тенденции к гипотонии, гипотония мышц мочевого пузыря с развитием недержания мочи;
· расширение границ сердца, приглушенность сердечных тонов, тахикардия, систолический шум на верхушке сердца.
· Считается, что наличие 4-х симптомов и более из перечисленных выше патогномонично для латентного дефицита железа (ЛДЖ) и ЖДА.
Лабораторные исследования:
Имеется 3 возможности лабораторной диагностики ЖДА:
· ОАК, выполненный «ручным» методом — снижение концентрации Hb (менее 110 г/л), небольшое снижение количества эритроцитов (менее 3,8 х 1012/л), снижение ЦП (менее 0,85), увеличение СОЭ (более 10-12 мм/час), нормальное содержание ретикулоцитов (10-20‰). Дополнительно врач-лаборант описывает анизоцитоз и пойкилоцитоз эритроцитов. ЖДА это микроцитарная, гипохромная, норморегенераторная анемия.
· ОАК, выполненный на автоматическом анализаторе клеток крови — снижаются средний объем эритроцита – MCV (менее 80 фл), среднее содержание Hb в эритроците – MCН (менее 26 пг), средняя концентрация Hb в эритроците – МСНС (менее 320 г/л), повышается степень анизоцитоза эритроцитов – RDW (более 14%).
· Биохимический анализ крови — снижение концентрации сывороточного железа (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки (более 69 мкмоль/л), снижение коэффициента насыщения трансферрина железом (менее 17%), снижение сывороточного ферритина (менее 30 нг/мл). В последние годы появилась возможность определения растворимых трансферриновых рецепторов (рТФР), количество которых в условиях дефицита железа увеличивается (более 2,9 мкг/мл).
Инструментальные исследования: нет
Диагностический алгоритм: (схема)
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Мегалобластные анемии | снижается количество эритроцитов и гемоглобина, наблюдаются лейкопения и тромбоцитопения. Кроме того, при обоих типах анемий может развиваться гемолитический синдром | Исследование периферической и венозной крови; миелограмма | При ЖДА не бывает гиперхромной анемии с макроцитозом эритроцитов. Длительность жизни эритроцитов при мегалобластной анемии снижается. Возможное понижение лейкоцитов и тромбоцитов при мегалобластной анемии, когда как при ЖДА данные показатели в норме. Особенности миелограммы (наличие редукции красного кроветворного ростка, а не гиперплазия мегалобластов). |
| Апластическая анемия | Анемический синром, геморрагический синдром на фоне тромбоцитопении, симптомы интоксикации. | Исследование периферической и венозной крови, миелограммы, общего анализа мочи, имунофенотипирова ние периферической крови на ПНГ клон. | При ЖДА в миелограмме не отмечается сокращение всех трех ростков кроветворения, нет жирового перерождение костного мозга. Отрицательный ПНГклон. |
| Талассемия | гипохромная анемия, анизоцитоз эритроцитов, наличие мишеневидных форм эритроцитов (пятно гемоглобина в центре клетки, напоминающее мишень). При этом содержание сывороточного железа нормальное или повышенное. Компенсаторная гиперплазия костного мозга ведёт к нарушениям в строении лицевого черепа. Череп может стать квадратным, башенным; нос приобретает седловидную форму; нарушается прикус и расположение зубов. Отмечается желтушность кожи и слизистых оболочек. Селезёнка и печень увеличены. Больные подвержены инфекционным заболеваниям. Рано начавшаяся анемия обуславливает физическое и умственное недоразвитие ребёнка. | Исследование периферической и венозной крови, миелограммы, генетическое исследование, УЗИ органов брюшной полости, портальной вены, проба Кумбса, определение типов гемоглобина. | Нет генетических мутаций, форма эритроцитов не изменена; сывороточное железо обычно снижено; нет костной деформации; нет желтушного синдрома; отсутствие гепатоспленомегалии; физическое и умственное развитие ребенка соответствуют возрасту. |
| Сидеробластные анемии | нарушение синтеза гема и митохондриальная дисфункция: неэффективный эритропоэз, высокое содержание железа в крови и гемосидероз внутренних органов. В костном мозге образуются эритроциты малого размера, в которых снижено содержание гемоглобина, а железо откладывается внутри клеток, затем выходит в кровь и оседает в тканях внутренних органов. | клинический анализ крови; пункция костного мозга, сывороточное железо, УЗИ Органов брюшной полости; генетическое исследование | При ЖДА снижено сывороточное железо в крови; нет гемохроматоза; отсутствие генетических мутаций |
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение:
- Устранение этиологических факторов;
- Рациональное лечебное питание (для новорожденных – грудное естественное вскармливание, а при отсутствии молока у матери – адаптированные молочные смеси, обогащенные железом. Своевременное введение прикорма, мяса, субпродуктов, гречневой и овсяной круп, фруктовых и овощных пюре, твердых сортов сыра; уменьшение приема фосфатов, танина, кальция, которые ухудшают всасывание железа).
Медикаментозное лечение
В настоящее время в нашей стране используется терапевтический план лечения ЖДА пероральными препаратами железа, суточные дозы которых представлены в таблице.
Возрастные терапевтические дозы пероральных препаратов железа для лечения ЖДА у детей.
| Возраст ребенка | Суточная доза элементарного железа |
| Ионные железосодержащие препараты (солевые, полисахаридные соединения железа) | |
| Дети до 3-х лет | 3 мг/кг |
| Дети старше 3-х лет | 45-60 мг |
| Подростки | до 120 мг |
| Неионные соединения т.е. препараты, представленные гидроксид-полимальтозным комплексом трехвалентного железа | |
| Любой возраст | 5 мг/кг |
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности | |||||||||
| Монокомпонентные препараты железа | ||||||||||||
| Глюконат железа | Глюконат железа 300 мг | по 1–3 табл. в день | III C | |||||||||
| Сульфат железа | Сульфат железа табл. 256.3 мг (80 мг железа), Сульфат железа 325 мг (105 мг иона (II) железа (Fe 2+ )) | Детям старше 6 лет до 15 лет назначают по 1 капсуле ежедневно. Подросткам с 15 лет в начале терапии обычно назначают по 1 капсуле 1-2 раза в сутки | III C | |||||||||
| Комбинированные препараты | ||||||||||||
| Железа (II) сульфат сухой + Аскорбиновая кислота 60 мг | Сульфат железа таб.320 мг+аскорбиновая кислота 60 мг | по 1 табл. 1–2 раза в день | III C | |||||||||
| Препараты железа (III) валентные | ||||||||||||
| Железа (III) гидроксид полимальтозат | Железа (III) гидроксид полимальтозат 400 мг (100 мг эл.железа) Таб. 375 мг (100 мг эл.железа) | По 100 — 300 мг железа (1 — 3 таблетки) ежедневно | IIB | |||||||||
| Препараты железа для парентерального введения | ||||||||||||
| Железа оксида сахарат | Железо III гидроксид сахарозный комплекс 540 мг (железа 20 мг); | |||||||||||
Железа (III) гидроксида сахарозного комплекса 333,0 мг (эквивалентно элементарному железу) 20,0 мг
В/в медленно (0,2 мл/мин) в дозе 100–200 мг железа (2–4 мл), предпочтительно разведенного в 10–20 мл 0,9% раствора натрия хлорида или 5% раствора глюкозы. Начальная доза препарата составляет 25 мг железа или 0,5 мл раствора, которая вводится в/в медленно в течение 1–2 мин
в/в (внутривенно) капельно (инфузионно) 1000 мг железа 1 раз в неделю.
Дальнейшее ведение:
Диспансерное наблюдение за детьми и подростками с ЖДА проводится в течение 1-го года с момента установления диагноза, контролируются самочувствие и общее состояние больного. Перед снятием больного с диспансерного наблюдения выполняется общий анализ крови, все показатели которого должны быть в пределах нормы.
Медицинской, физической и психологической реабилитации больных после излечения от ЖДА не требуется.
Индикаторы эффективности лечения:
- улучшение аппетита, самочувствия, физической активности, настроения;
- нормализация цвета кожи и видимых слизистых;
- нормализация Hb, ретикулоцитов.
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ: см. Амбулаторный уровень
Хирургическое вмешательство: нет
Дальнейшее ведение: см. Амбулаторный уровень
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: нет
Показания для экстренной госпитализации:
- анемия III степени тяжести;
- необходимость парентерального введения препаратов железа.
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2018
- 1) Dado DN, Loesch EB, Jaganathan SP A Case of Severe Iron Deficiency Anemia Associated with Long-Term Proton Pump Inhibitor Use Curr Ther Res Clin Exp. 2017 Jan 21;84:1-3 2) Тарасова И.С. Разработка и научное обоснование скрининга железодефицитных состояний у подростков: Автореф. дис. д-ра мед. наук. — М.— 67 с. 3) Тарасова И.С., Чернов В.М., Лаврухин Д.Б., Румянцев А.Г. Становление менструальной функции как фактор риска развития анемии // Гематология и трансфузиология. — 2014. — Т. 55, № 4. — С. 3-7. 4) Baker R.D., Greer F.R. Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age) // Pediatrics. — 2014. — Vol. 126, N5. — P. 1040-1050. 5) Детская гематология. Клинические рекомендации / Под ред. А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. Авторы: Айзенберг В.Л., Балашов Д.Н., Биккулова Д.Ш., Вдовин В.В., Володин Н.Н., Демихов В.Г., Демихова Е.В., Евдокимова М.А., Жарков П.А., Журина, О.Н., Зозуля Н.И., Инякова Н.В., Карачунский А.И., Клипинина Н.В., Копылов К.Г., Кузминова Ж.А., Кумирова Э.В., Кумскова М.А., Лазарев В.В., Луговская С.А., Лукина Е.А., Лунякова Е.А., Масчан М.А., Морщакова Е.Ф., Мякова Н.В., Новичкова Г.А., Орлов А.Б., Панкратьева Л.Л., Полевиченко Е.В., Птушкин В.В., Румянцева Ю.В., Самочатова Е.В., Свирин П.В., Сигарева И.А., Скворцова Ю.В., Скобин В.Б., Сметанина Н.С., Спиридонова Е.А., Стефаненко Е.А., Тарасова И.С., Хаин А.Е., Хамин И.Г., Харькин А.В., Хачатрян Л.А., Цветаева Н.В., Цыпин Л.Е., Чернов В.М., Щербина А.Ю., Щукин В.В. — М.: ГЭОТАР-Медиа, 2015. — 656 с. 6) Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am Soc Hematol Educ Program 2016; 2016:57. 7) Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am Soc Hematol Educ Program 2016; 2016:57. 8) Krayenbuehl PA, Battegay E, Breymann C, et al. Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood 2011; 118:3222. 9) Sharma R, Stanek JR, Koch TL, et al. Intravenous iron therapy in non-anemic iron-deficient menstruating adolescent females with fatigue. Am J Hematol 2016; 91:973. 10) Vaucher P, Druais PL, Waldvogel S, Favrat B. Effect of iron supplementation on fatigue in nonanemic menstruating women with low ferritin: a randomized controlled trial. CMAJ 2012; 184:1247. 11) Pittori C, Buser A, Gasser UE, et al. A pilot iron substitution programme in female blood donors with iron deficiency without anaemia. Vox Sang 2011; 100:303. 12) Burden RJ, Morton K, Richards T, et al. Is iron treatment beneficial in, iron-deficient but non-anaemic (IDNA) endurance athletes? A systematic review and meta-analysis. Br J Sports Med 2015; 49:1389. 13) Achebe MM, Gafter-Gvili A. How I treat anemia in pregnancy: iron, cobalamin, and folate. Blood 2017; 129:940. 14) Gomollón F, Gisbert JP. Intravenous iron in inflammatory bowel diseases. Curr Opin Gastroenterol 2013; 29:201. 15) Jimenez K, Gasche C, Auerbach M. On both sides of the ocean. Blood Transfus 2016; 14:197. 16) Lee T, Clavel T, Smirnov K, et al. Oral versus intravenous iron replacement therapy distinctly alters the gut microbiota and metabolome in patients with IBD. Gut 2017; 66:863. 17) García-López S, Bocos JM, Gisbert JP, et al. High-dose intravenous treatment in iron deficiency anaemia in inflammatory bowel disease: early efficacy and impact on quality of life. Blood Transfus 2016; 14:199. 18) Reinisch W, Chowers Y, Danese S, et al. The management of iron deficiency in inflammatory bowel disease—an online tool developed by the RAND/UCLA appropriateness method. Aliment Pharmacol Ther 2013; 38:1109.Gasche C, Evstatiev R, Haas T, et al. [Diagnosis and treatment of iron deficiency and anaemia in inflammatory bowel diseases. Consensus of the Austrian IBD Working Party]. Z Gastroenterol 2011; 49:627. 19) Auerbach M, Adamson JW. How we diagnose and treat iron deficiency anemia. Am J Hematol 2016; 91:31. 20) Kim YW, Bae JM, Park YK, et al. Effect of Intravenous Ferric Carboxymaltose on Hemoglobin Response Among Patients With Acute Isovolemic Anemia Following Gastrectomy: The FAIRY Randomized Clinical Trial. JAMA 2017; 317:2097. 21) Khalafallah AA, Yan C, Al-Badri R, et al. Intravenous ferric carboxymaltose versus standard care in the management of postoperative anaemia: a prospective, open-label, randomised controlled trial. Lancet Haematol 2016; 3:e415. 22) Johansson PI, Rasmussen AS, Thomsen LL. Intravenous iron isomaltoside 1000 (Monofer®) reduces postoperative anaemia in preoperatively non-anaemic patients undergoing elective or subacute coronary artery bypass graft, valve replacement or a combination thereof: a randomized double-blind placebo-controlled clinical trial (the PROTECT trial). Vox Sang 2015; 109:257. 23) Froessler B, Palm P, Weber I, et al. The Important Role for Intravenous Iron in Perioperative Patient Blood Management in Major Abdominal Surgery: A Randomized Controlled Trial. Ann Surg 2016; 264:41. 24) Serrano-Trenas JA, Ugalde PF, Cabello LM, et al. Role of perioperative intravenous iron therapy in elderly hip fracture patients: a single-center randomized controlled trial. Transfusion 2011; 51:97.
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
- Омарова Кулян Омаровна – доктор медицинских наук, профессор, гематолог АО «Национальный центр педиатрии и детской хирургии».
- Манжуова Ляззат Нурбапаевна – кандидат медицинских наук, заведующий отделением онкологии №1 АО «Национальный центр педиатрии и детской хирургии».
- Нургалиев Даир Жванышевич – доктор медицинских наук, руководитель отдела онкогематологии и трансплантации гемопоэтических стволовых клеток КФ «UMC» «Национальный научный центр материнства и детства».
- Ашимова Разита Беймбетовна – онкогематолог, отделение онкологии №1 КФ «UMC» Национальный научный центр материнства и детства.
- Ихсанова Алина Кайратовна – онкогематолог, отделение онкологии №1 КФ «UMC» Национальный научный центр материнства и детства.
- Суров Владимир Константинович – клинический фармаколог отдела госпитальной фармации АО «Национальный Центр Нейрохирургии».
Указание на отсутствие конфликта интересов: нет.
- Абдрахманова Сагира Токсанбаевна. – доктор медицинских наук, профессор кафедры детских болезней НАО «Медицинский университет Астана».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
источник
Анемия – состояние, при котором снижается общее количество гемоглобина в организме. Снижение концентрации гемоглобина в крови является ключевым показателем, поскольку может быть измерено напрямую.
В этиологии фолиеводефицитной анемии играют роль следующие факторы:
Недостаточное поступление с питанием (вскармливание козьим молоком);
Нарушение всасывания в кишечнике (энтерит);
Повышенная потребность (недоношеность; малый вес при рождении; гемолитическая анемия, гипертиреоз, инфекционно-воспалительные заболевания);
Использование медикаментов – антагонистов фолиевой кислоты (препараты для лечения эпилепсии, метотрексат);
Повышенное выведение (гемодиализ).
Изолированный дефицит фолиевой кислоты встречается редко, как правило, он сочетается с дефицитом железа, белка, других витаминов.
Фолиевая кислота содержится в зеленых листьях растений, фруктах, печени, почках. Запасы фолатов в организме взрослого человека составляют 5-10 мг, минимальная потребность — 50 мкг в день. Мегалобластная анемия может развиться через 4 месяца полного отсутствия поступления фолатов с пищей.
После попадания в организм фолиевая кислота превращается в активный метаболит тетрагидрофолиевую кислоту, которая играет важнейшую роль в метаболизме нуклеиновых кислот и протеинов. Дефицит фолиевой кислоты приводит к нарушению клеточного деления и накоплению токсичных метаболитов, таких как гомоцистеин [1,2].
Данных о распространенности дефицита фолиевой кислоты и фолиеводефицитной анемии у детей в России нет.
Фолиеводефицитная анемия (D52):
D52.0 — Фолиеводефицитная анемия, связанная с питанием
D52.1 — Фолиеводефицитная анемия медикаментозная
D52.8 — Другие фолиеводефицитные анемии
D52.9 — Фолиеводефицитная анемия неуточненная
Клиническая картина складывается из симптомов, характерных для анемии: слабости, головокружения, одышки сердцебиения при физической нагрузке, повышенной утомляемости, нарушения успеваемости в школе. Общие признаки, являющиеся следствием гипоксии тканей: бледность, тахикардия, одышка, плохой аппетит, вялость или повышенная возбудимость. Кроме того могут наблюдаться ангулярный стоматит, глоссит. Пациенты могут жаловаться на анорексию, тошноту, рвоту, боли в животе и диарею.
Фолиеводефицитная анемия крайне редко наблюдается в чистом виде. Как правило, дефицит фолиевой кислоты сочетается с дефицитом железа, так как эти состояния развиваются вследствие действия единых этиопатогенетических факторов. При этом и клинические проявления и лабораторные характеристики анемии зависят от соотношения выраженности дефицита железа и фолата. Учитывая, что при ЖДА и при фолиеводефицитной анемии наблюдаются разнонаправленные сдвиги в показателях обмена железа и эритроцитарных индексах, лабораторные тесты при смешанной форме анемии становятся малоинформативными. В данной ситуации решающее значение имеет анамнез и клиника анемии.
Дифференциальный диагноз проводят с витамин В12 дефицитной анемией, другими формами анемии с мегалобластоидным типом кроветворения: врожденной оротатацидурией, синдром Леша-Найена (Lesch-Nyhan), тиамин-зависимой мегалобластной анемией, врожденной дизэритропоэтической анемией, эритролейкемией. Кроме того, необходимо исключить формы анемии, протекающие с макроцитозом, но без признаков мегалобластоидности – апластическую анемию, аутоиммунную гемолитическую анемию, заболевания печени, гипотиреоз, сидеробластные анемии.
Необходимо оценить размеры лимфатических узлов, печени, селезенки, исключить наличие образований в брюшной полости, забрюшинном пространстве, другие признаки злокачественных заболеваний. [1,2]
Необходимо отметить, что при сочетанном дефиците назначение фолиевой кислоты без препаратов железа приведет к неполному восстановлению гемоглобина и к проявлению клинических и лабораторных признаков дефицита железа. И наоборот, если начать лечение с препаратов железа, проявятся признаки дефицита фолиевой кислоты.
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела. Выявляется бледность кожных покровов, слизистых, при тяжелой анемии присутствует учащенное сердцебиение, одышка.
Поскольку при фолиеводефицитной анемии в костном мозге происходит неэффективный эритропоэз и за счет этого повышенное разрушение гемоглобинсодержащих клеток, в крови повышается уровень непрямого билирубина и появляется легкая желтушнось склер и кожи. При тяжелых формах может наблюдаться небольшое увеличение селезенки (реактивная гиперплазия). Таким образом, имеется некоторое сходство симптоматики фолиеводефицитной анемии и гемолитической анемии. Лабораторное обследование позволяет провести надежную дифференциальную диагностику этих форм анемии.
По лабораторным признакам фолиеводефицитная анемия почти совпадает с В12-дефицитной анемией. Различия заключаются в разном уровне витамина В12 и фолиевой кислоты в крови. Кроме того, для фолиеводефицитной анемии в отличие от В12-дефицитной анемии, не характерны признаки поражения нервной системы. Следует помнить, что изолированный дефицит витамина В12 в детском возрасте встречается редко и является обычно осложнением глистной инвазии широким лентецом или наследственных нарушений обмена, а также результатом воздействия некоторых медикаментов [1,2, 3].
- Рекомендовано проведение общего клинического анализа крови и биохимического анализа крови.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии:
Для фолиеводефицитной анемии характерны:
низкий уровень ретикулоцитов;
высокий уровень сывороточного железа;
высокий уровень ферритина;
умеренное повышение непрямого билирубина;
низкий уровень фолата в сыворотке крови (норма более 3 нг/мл);
низкий уровень фолата в эритроцитах;
нормальный уровень витамина В12 в крови;
картина мегалобластического кроветворения в костном мозге.
При сочетании дефицита железа и фолиевой кислоты могут наблюдаться сочетания лабораторных признаков, что приводит к неопределенной картине и затруднению диагностики; в этом случае надо ориентироваться на клинические симптомы и анамнез.
Высокий ретикулоцитоз может являться признаком продолжающегося кровотечения, гемолиза, а также наблюдается при фолиеводефицитной анемии через неделю после назначения фолиевой кислоты.
Наряду с анемией, как правило, отмечается умеренное снижение уровня тромбоцитов и лейкоцитов.
Необходимо исследование мочи для исключения протеинурии, характерной для синдрома Иммерслунд-Грэссбек [4]. Для исключения врожденного отсутствия внутреннего фактора проводится тест Шиллинга с радиоактивным меченным витамином В12. Учитывая недоступность меченного витамина В12 в общей лабораторной практике можно использовать модифицированный тест Шиллинга: после приема внутрь витамина В12 определяется уровень витамина в крови. При отсутствии повышения уровня витамина В12 диагностируется нарушение всасывания витамина в кишечнике.
При наличии двух- или трехростковой цитопении необходимо рассмотреть необходимость исследования костного мозга для исключения лейкемии, миелодиспластического синдрома, апластической анемии.
Характерные признаки мегалобластического кроветворения в костном мозге исчезают через несколько часов после приема фолиевой кислоты.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии: Детям первого года жизни фолиевая кислота назначается в дозе 0,25-0,5 мг/кг в сутки в течение месяца. В более старшем возрасте суточная доза составляет 1 мг/сутки. Пероральный прием эффективен даже в случае мальабсорбции, однако в этом случае дозу следует увеличить до 5-15 мг/сутки.
- Рекомендовано в процессе лечения проводить контроль показателей крови:
Общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, гематокрита — на 7 — 10 день от начала лечения. Наличие ретикулоцитарной реакции является важным признаком правильности лечения.
Контроль показателей крови 1 раз в неделю. Нормализация уровня Hb происходит через 4 — 6 недель от начала лечения и является решающим подтверждением правильности диагноза и лечения [1,2,5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2с)
Специфических реабилитационных мероприятий в отношении пациентов с фолиеводефицитной анемией нет. Диспансерное наблюдение проводится с учетом устранения причин дефицита фолиевой кислоты (основного заболевания, неправильного питания).
Правильное вскармливание грудных детей, назначение фолиевой кислоты недоношенным детям. Рациональное питание детей старшего возраста. Необходимо учитывать возможность развития дефицита фолиевой кислоты при различных заболеваниях. Фолиевая кислота в дозе 0,25 — 1 мг/сутки назначается недоношенным детям, детям с низкой массой тела при рождении, детям, страдающим хроническими воспалительными заболеваниями, заболеваниями кишечника с синдромом мальабсорбции.
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнен общий клинический анализ крови с подсчетом ретикулоцитов и тромбоцитов
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
На основании данных современной литературы и анализа собственных клинических наблюдений освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы верификации причин анемического синдрома, обусловленного недостаточностью в организме ребенка железа, фолиевой кислоты и витамина В12. Изложены ключевые положения, лежащие в основе дифференциального диагноза между железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемиями. Представлены принципы лечения указанных дефицитных анемий у детей. Выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. При этом своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка в целом. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма, ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения по дифференциальной диагностике и лечению анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Ключевые слова: анемия, витамин В12-дефицитная анемия, дети, железодефицитная анемия, фолиеводефицитная анемия.
Для цитирования: Заплатников А.Л., Османов И.М., Ефимов М.С., Дементьев А.А., Чабаидзе Ж.Л., Майкова И.Д., О.А. Кузнецова, А.С. Воробьева, Е.Р. Радченко, Гончарова Л.В., Гавеля Н.В. Диагностика и принципы лечения дефицитных анемий у детей (в таблицах и схемах) // РМЖ. Медицинское обозрение. 2019. №3. С. 2-5
Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams)
A.L. Zaplatnikov 1,2 , I.M. Osmanov 2 , M.S. Efimov 1 , A.A. Dementiev1, Zh.L. Chabaidze 1 , I.D. Maikova 2 , O.A. Kuznetsova 2 , A.S. Vorobieva 2 , E.R. Radchenko 2 , L.V. Goncharova 2 , N.V. Gavelia 2
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Z.A. Bashlyaeva Children’s City Clinical Hospital, Moscow
The article highlights the clinical, anamnestic and laboratory properties of iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia in children, based on the data of modern literature and in-house clinical observation analysis. The basic verification principles of the anemic syndrome causes associated with iron, folic acid and vitamin B12 deficiency in children are presented. The fundamental provisions underlying the differential diagnosis between iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia are also reviewed. In addition, the article describes the treatment principles in children with nutritional deficiency anemia. Anemia manifestation in a child determines the need for mandatory cause clarification of this pathological condition. At the same time, timely verification of the anemia etiology allows starting adequate therapy without delay, which determines its effectiveness and improves the child’s life quality as a whole. Late diagnosis and lack of adequate therapy, however, lead to the pathological processes progression. This has a negative impact on the child’s body growth and development and worsens his life quality in general. The authors came to the conclusion that it is necessary to present fundamental provisions for practicing pediatricians on anemia differential diagnosis and treatment associated with iron, folic acid and vitamin B12 deficiency in children, taking into account this problem urgency.
Keywords: anemia, vitamin B12-deficiency anemia, children, iron-deficiency anemia, folic acid- deficiency anemia.
For citation: Zaplatnikov A.L., Osmanov I.M., Efimov M.S. et al. Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams). RMJ. Medical Review. 2019;3:6–9.
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
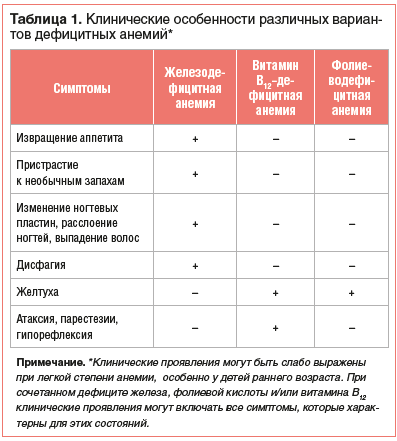
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
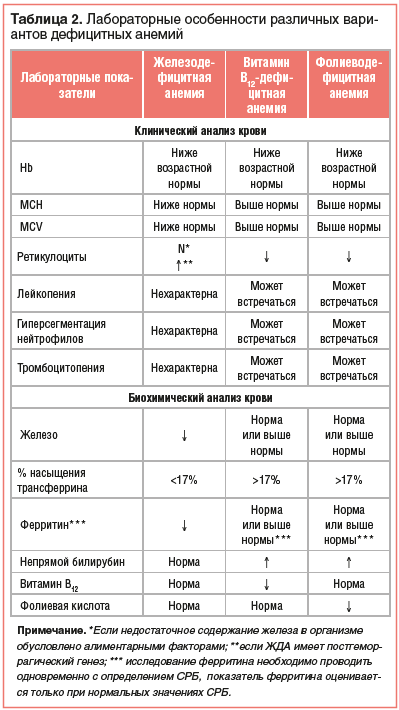
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Только для зарегистрированных пользователей
источник
Анемия – состояние, при котором снижается общее количество гемоглобина в организме. Снижение концентрации гемоглобина в крови является ключевым показателем, поскольку может быть измерено напрямую.
В этиологии фолиеводефицитной анемии играют роль следующие факторы:
Недостаточное поступление с питанием (вскармливание козьим молоком);
Нарушение всасывания в кишечнике (энтерит);
Повышенная потребность (недоношеность; малый вес при рождении; гемолитическая анемия, гипертиреоз, инфекционно-воспалительные заболевания);
Использование медикаментов – антагонистов фолиевой кислоты (препараты для лечения эпилепсии, метотрексат);
Повышенное выведение (гемодиализ).
Изолированный дефицит фолиевой кислоты встречается редко, как правило, он сочетается с дефицитом железа, белка, других витаминов.
Фолиевая кислота содержится в зеленых листьях растений, фруктах, печени, почках. Запасы фолатов в организме взрослого человека составляют 5-10 мг, минимальная потребность — 50 мкг в день. Мегалобластная анемия может развиться через 4 месяца полного отсутствия поступления фолатов с пищей.
После попадания в организм фолиевая кислота превращается в активный метаболит тетрагидрофолиевую кислоту, которая играет важнейшую роль в метаболизме нуклеиновых кислот и протеинов. Дефицит фолиевой кислоты приводит к нарушению клеточного деления и накоплению токсичных метаболитов, таких как гомоцистеин [1,2].
Данных о распространенности дефицита фолиевой кислоты и фолиеводефицитной анемии у детей в России нет.
Фолиеводефицитная анемия (D52):
D52.0 — Фолиеводефицитная анемия, связанная с питанием
D52.1 — Фолиеводефицитная анемия медикаментозная
D52.8 — Другие фолиеводефицитные анемии
D52.9 — Фолиеводефицитная анемия неуточненная
Клиническая картина складывается из симптомов, характерных для анемии: слабости, головокружения, одышки сердцебиения при физической нагрузке, повышенной утомляемости, нарушения успеваемости в школе. Общие признаки, являющиеся следствием гипоксии тканей: бледность, тахикардия, одышка, плохой аппетит, вялость или повышенная возбудимость. Кроме того могут наблюдаться ангулярный стоматит, глоссит. Пациенты могут жаловаться на анорексию, тошноту, рвоту, боли в животе и диарею.
Фолиеводефицитная анемия крайне редко наблюдается в чистом виде. Как правило, дефицит фолиевой кислоты сочетается с дефицитом железа, так как эти состояния развиваются вследствие действия единых этиопатогенетических факторов. При этом и клинические проявления и лабораторные характеристики анемии зависят от соотношения выраженности дефицита железа и фолата. Учитывая, что при ЖДА и при фолиеводефицитной анемии наблюдаются разнонаправленные сдвиги в показателях обмена железа и эритроцитарных индексах, лабораторные тесты при смешанной форме анемии становятся малоинформативными. В данной ситуации решающее значение имеет анамнез и клиника анемии.
Дифференциальный диагноз проводят с витамин В12 дефицитной анемией, другими формами анемии с мегалобластоидным типом кроветворения: врожденной оротатацидурией, синдром Леша-Найена (Lesch-Nyhan), тиамин-зависимой мегалобластной анемией, врожденной дизэритропоэтической анемией, эритролейкемией. Кроме того, необходимо исключить формы анемии, протекающие с макроцитозом, но без признаков мегалобластоидности – апластическую анемию, аутоиммунную гемолитическую анемию, заболевания печени, гипотиреоз, сидеробластные анемии.
Необходимо оценить размеры лимфатических узлов, печени, селезенки, исключить наличие образований в брюшной полости, забрюшинном пространстве, другие признаки злокачественных заболеваний. [1,2]
Необходимо отметить, что при сочетанном дефиците назначение фолиевой кислоты без препаратов железа приведет к неполному восстановлению гемоглобина и к проявлению клинических и лабораторных признаков дефицита железа. И наоборот, если начать лечение с препаратов железа, проявятся признаки дефицита фолиевой кислоты.
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела. Выявляется бледность кожных покровов, слизистых, при тяжелой анемии присутствует учащенное сердцебиение, одышка.
Поскольку при фолиеводефицитной анемии в костном мозге происходит неэффективный эритропоэз и за счет этого повышенное разрушение гемоглобинсодержащих клеток, в крови повышается уровень непрямого билирубина и появляется легкая желтушнось склер и кожи. При тяжелых формах может наблюдаться небольшое увеличение селезенки (реактивная гиперплазия). Таким образом, имеется некоторое сходство симптоматики фолиеводефицитной анемии и гемолитической анемии. Лабораторное обследование позволяет провести надежную дифференциальную диагностику этих форм анемии.
По лабораторным признакам фолиеводефицитная анемия почти совпадает с В12-дефицитной анемией. Различия заключаются в разном уровне витамина В12 и фолиевой кислоты в крови. Кроме того, для фолиеводефицитной анемии в отличие от В12-дефицитной анемии, не характерны признаки поражения нервной системы. Следует помнить, что изолированный дефицит витамина В12 в детском возрасте встречается редко и является обычно осложнением глистной инвазии широким лентецом или наследственных нарушений обмена, а также результатом воздействия некоторых медикаментов [1,2, 3].
- Рекомендовано проведение общего клинического анализа крови и биохимического анализа крови.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии:
Для фолиеводефицитной анемии характерны:
низкий уровень ретикулоцитов;
высокий уровень сывороточного железа;
высокий уровень ферритина;
умеренное повышение непрямого билирубина;
низкий уровень фолата в сыворотке крови (норма более 3 нг/мл);
низкий уровень фолата в эритроцитах;
нормальный уровень витамина В12 в крови;
картина мегалобластического кроветворения в костном мозге.
При сочетании дефицита железа и фолиевой кислоты могут наблюдаться сочетания лабораторных признаков, что приводит к неопределенной картине и затруднению диагностики; в этом случае надо ориентироваться на клинические симптомы и анамнез.
Высокий ретикулоцитоз может являться признаком продолжающегося кровотечения, гемолиза, а также наблюдается при фолиеводефицитной анемии через неделю после назначения фолиевой кислоты.
Наряду с анемией, как правило, отмечается умеренное снижение уровня тромбоцитов и лейкоцитов.
Необходимо исследование мочи для исключения протеинурии, характерной для синдрома Иммерслунд-Грэссбек [4]. Для исключения врожденного отсутствия внутреннего фактора проводится тест Шиллинга с радиоактивным меченным витамином В12. Учитывая недоступность меченного витамина В12 в общей лабораторной практике можно использовать модифицированный тест Шиллинга: после приема внутрь витамина В12 определяется уровень витамина в крови. При отсутствии повышения уровня витамина В12 диагностируется нарушение всасывания витамина в кишечнике.
При наличии двух- или трехростковой цитопении необходимо рассмотреть необходимость исследования костного мозга для исключения лейкемии, миелодиспластического синдрома, апластической анемии.
Характерные признаки мегалобластического кроветворения в костном мозге исчезают через несколько часов после приема фолиевой кислоты.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии: Детям первого года жизни фолиевая кислота назначается в дозе 0,25-0,5 мг/кг в сутки в течение месяца. В более старшем возрасте суточная доза составляет 1 мг/сутки. Пероральный прием эффективен даже в случае мальабсорбции, однако в этом случае дозу следует увеличить до 5-15 мг/сутки.
- Рекомендовано в процессе лечения проводить контроль показателей крови:
Общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, гематокрита — на 7 — 10 день от начала лечения. Наличие ретикулоцитарной реакции является важным признаком правильности лечения.
Контроль показателей крови 1 раз в неделю. Нормализация уровня Hb происходит через 4 — 6 недель от начала лечения и является решающим подтверждением правильности диагноза и лечения [1,2,5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2с)
Специфических реабилитационных мероприятий в отношении пациентов с фолиеводефицитной анемией нет. Диспансерное наблюдение проводится с учетом устранения причин дефицита фолиевой кислоты (основного заболевания, неправильного питания).
Правильное вскармливание грудных детей, назначение фолиевой кислоты недоношенным детям. Рациональное питание детей старшего возраста. Необходимо учитывать возможность развития дефицита фолиевой кислоты при различных заболеваниях. Фолиевая кислота в дозе 0,25 — 1 мг/сутки назначается недоношенным детям, детям с низкой массой тела при рождении, детям, страдающим хроническими воспалительными заболеваниями, заболеваниями кишечника с синдромом мальабсорбции.
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнен общий клинический анализ крови с подсчетом ретикулоцитов и тромбоцитов
источник
1 ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ 1
2 Ответственные исполнители: — Чернов Вениамин Михайлович д-р мед. наук, проф., зав. отделом детской гематологии и редких заболеваний ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России — Тарасова Ирина Станиславовна д-р мед. наук, зав. отделом наследственных и редких болезней ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России, доцент кафедры онкологии, гематологии и лучевой терапии педиатрического факультета ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России Рецензирование, обсуждение содержания рекомендации проводилось на сайте НОДГО, совещаниях, съездах педиатров, гематологов России Диагностика и лечение железодефицитной анемии МКБ-10: рубрикой Е61.1, D50, D50.0, D50.1, D50.8, D50.9, O99.0 2
3 ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ IRON DEFICIENCY ANEMIA (АНГЛ.) ОПРЕДЕЛЕНИЕ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ Рубрики, присвоенные различным железодефицитным состояниям в Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10), представлены в табл. 1. Таблица 1. Рубрики в Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра, присвоенные железодефицитным состояниям (цит. по [1]) Железодефицитное состояние Рубрика по МКБ-10 ЛДЖ Е61.1 ЖДА D50 ХПА D50.0 Сидеропеническая дисфагия D50.1 Другие железодефицитные анемии D50.8 ЖДА неуточненная D50.9 Анемия, осложняющая беременность, деторождение и послеродовый период O99.0 Железодефицитная анемия (ЖДА) полиэтиологичное заболевание, возникновение которого связано с дефицитом железа в организме из-за нарушения его поступления, усвоения или повышенных потерь, характеризующееся микроцитозом и гипохромной анемией. Возникновению ЖДА, как правило, предшествует развитие латентного дефицита железа (ЛДЖ), который рассматривается как приобретенное функциональное состояние и характеризуется латентным (скрытым) дефицитом железа, снижением запасов железа в организме и недостаточным его содержанием в тканях (сидеропения, гипосидероз), отсутствием анемии. ЖДА характеризуется сочетанием сидеропенического и анемического синдромов. ПРИЧИНЫ РАЗВИТИЯ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ Основная причина развития ЖДА, по мнению экспертов Всемирной организации здравоохранения (ВОЗ), это неправильное (несбалансированное) питание. Гораздо реже ЖДА развивается вследствие кровотечений различных локализаций, что приводит к хронической постгеморрагической анемии (ХПА), или глистных инвазий в странах с низкой санитарной культурой. Основными причинами развития ЖДА в детской практике являются: дефицит железа при рождении ребенка; алиментарный дефицит железа вследствие несбалансированного питания; 3
4 повышенные потребности организма в железе вследствие бурного роста ребенка; потери железа из организма, превышающие физиологические. Алиментарно-зависимыми факторами в развитии дефицита железа у детей являются: недостаточное поступление железа с пищей; сниженное всасывание железа; увеличенные потери железа из-за микрокровотечений из кишечника, обусловленных ранним введением кефира и коровьего молока. Причинами развития ХПА у лиц мужского пола являются различные заболевания желудочно-кишечного трак та (ЖКТ): язвенные кровотечения, полипы толстой кишки, неспецифический язвенный колит, ангио-матоз кишечника, дивертикул Меккеля, кровотечения из геморроидальных образований, опухоли желудка и кишечника. Среди причин ХПА у девушек и женщин репродуктивного возраста на первом месте находятся аномальные или обильные маточные кровотечения, а заболевания ЖКТ занимают второе место. Гендерные различия необходимо учитывать при выявлении причин развития ЖДА КРИТЕРИИ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ В общем анализе кропи, выполненном «ручным» методом, ориентируются на снижение концентрации гемоглобина НЬ (менее 110 г/л), небольшое снижение количества эритроцитов (менее 3,8 х И)12/л), снижение цветового показателя (менее 0,85), увеличение СОЭ (более мм/ч), сниженное или нормальное количество ретикулоцитов (норма 10 20%с). Дополнительно врач-лаборант описывает морфологические изменения эритроцитов анизоцитоз и пойкилоцитоз. ЖДА это микроцптарная, гипохромная, нормо- или реже гипорегенераторная анемия. В общем анализе кропи, выполненном на автоматическом гематологическом анализаторе, изменяются указанные выше показатели и ряд эритроцитных индексов. Снижаются средний объем эритроцита (mean corpuscular volume MCV) (менее 80 фл), среднее содержание НЬ в эритроците (mean corpuscular hemoglobin МСН) (менее 26 пг), средняя концентрация НЬ в эритроците (mean corpuscular hemoglobin concentration MCHC) (менее 320 г/л), повышается степень анизоцито-за эритроцитов (red blood cell distribution width RDW) (более 14%). В биохимическом анализе крови ориентируются на снижение концентрации сывороточного железа СЖ (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки ОЖСС (более 69 мкмоль/л), снижение коэффициента насыщения трансферри-на железом НТЖ (менее 17%), снижение концентрации сывороточного ферритина СФ (менее 30 нг/мл или мкг/л). В последние годы появилась возможность определения растворимых трансферриновых рецепторов (ртфр), концентрация которых в условиях дефицита железа увеличивается (более 2,9 мкг/мл). ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ Дифференциальный диагноз ЖДА следует проводить с: другими анемиями из группы дефицитных анемий: В12-дефицитной анемией (D51) и фолиево-дефицитной анемией (D52), т.е. мегало-бластными анемиями; 4
5 анемией хронических заболеваний АХБ (D63.8). Для мегалобластных анемий характерны следующие лабораторные признаки: макроцитарная анемия (MCV более 100 фл); вовлечение в процесс 2 3 ростков кроветворения и, как следствие, наличие, кроме анемии, лейкопении, нейтропении и тромбоцитопении; гиперсегментация ядер нейтрофилов (пяти- и шестидольчатые, много-лопастные ядра); мегалобластный тип кроветворения, наличие в костном мозге крупных эритроидных клеток; снижение концентрации в сыворотке крови витамина В12 (норма пг/мл) при В12-дефицитной анемии; снижение концентрации в сыворотке крови (норма 3 20 нг/мл) или содержания в эритроцитах (норма нг/мл) фолиевой кислоты при фолиеводефицитной анемии. АХБ имеет определенные причины развития и довольно сложный патогенез. Для дифференциальной диагностики ЖДА и АХБ, кроме наличия основного заболевания, необходимо проведение обследования. Наиболее информативными лабораторными показателями являются НТЖ, СФ и ртфр (табл. 2). Основными причинами развития АХБ являются: инфекции, протекающие хронически (туберкулез, сепсис, остеомиелит, абсцесс легких, бактериальные эндокардиты и др.); системные заболевания соединительной ткани (системная красная волчанка, ревматоидный артрит); хронические заболевания печени (гепатит, цирроз); хронические воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона)* злокачественные новообразования (солидные опухоли, множественная миелома, лимфомы). Таблица 2. Дифференциальная диагностика железодефицитной анемии и анемии хронических болезней Показатель Норма ЖДА АХБ Наличие хронического заболевания Нет Есть СЖ 6 В патогенезе развития АХБ имеется несколько механизмов: нарушения метаболизма железа (реутилизации железа из макрофагов), супрессия эритропоэза (ингибиторы эритропоэза, цитокины, подавляющие действие эритропоэтина ЭПО), неадекватная продукция ЭПО (выработка ЭПО повышена, но не соответствуют степени тяжести анемии), гемолиз эритроцитов (из-за повреждения мембраны микрогромпами или продуктами перекисного окисления липидов). ЛЕЧЕНИЕ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ Целями лечения ЖДА являются устранение причины, лежащей в основе развития заболевания (коррекция питания, выявление и устранение источника кровопотери), и возмещение дефицита железа в организме. В связи с этим основными принципами лечения ЖДА являются: назначение лекарственных железосодержащих препаратов, поскольку возместив дефицит железа в организме иными способами невозможно; использование преимущественно препаратов железа для перорального приема; назначение препаратов железа в адекватных дозах, которые рассчитываются для каждого конкретного больного с учетом массы его тела и терапевтического плана лечения; достаточная длительность курса лечения препаратами железа, составляющая при анемии легкой степени 3 мес, при анемии средней степени 4,5 мес и при тяжелой анемии 6 мес; преодоление тканевой сидеропении и пополнение запасов железа в депо, что определяется по нормализации концентрации СФ; необходимость контроля эффективности терапии препаратами железа. Расчет дозы препарата железа В России лечение ЖДА определяется Протоколом ведения больных «Железодефицитная анемия» [2], утвержденным Минздравсоцразвития России 22 октября 2004 г. Создание этого Протокола группой ведущих специалистов нашей страны явилось значительным движением вперед. поскольку вооружило врачей единым пониманием проблемы дефицита железа, критериями его диагностики, принципами лечения и наблюдения больных ЖДА, оценки качества их жизни. С точки зрения врача-педиатра, лечение ЖДА у детей имеет некоторые особенности, которые следует учитывать в лечебном протоколе. Прежде всего, применение у детей в возрасте до 3 лет солевых препаратов двухвалентного железа в дозе 5 8 мг/кг массы тела в сутки, как это рекомендовано в Протоколе, вызывает проявления токсичности у многих больных и не оправдано с терапевтической точки зрения. При расчете доз солевых препаратов железа следует использовать рекомендации ВОЗ [3. 4] (табл. 3). Аналогичная доза солевых препаратов железа (3 мг/кг массы тела в сутки) для детей в возрасте до 3 лет указана и в пособии для врачей, утвержденном Департаментом здравоохранения Москвы в 2004 г. [5]. 6
7 Таблица 3. Возрастные дозы пероральных солевых препаратов железа для лечения железодефицитной анемии (рекомендации Всемирной организации здравоохранения, 1998; цит. по [3]). Возраст До 3 лет Старше 3 лет Подростки Суточная доза элементарного железа 3 мг/кг мг До 120 мг Различный возраст детей (от периода новорожденности до старшего подросткового возраста) и, соответственно, различная масса тела (3,2 70 кг и более) делают необходимым индивидуальный расчет дозы препарата железа для каждого ребенка. В Протоколе дозу препарата на основе гидроксид полимальтозного комплекса (ГПК) трехвалентного железа рекомендуют рассчитывать, ориентируясь на возраст детей, а не на массу их тела. Мы считаем, что в детской прак тике доза препаратов железа (III) на основе ГПК должна составлять 5 мг/кг массы тела в сутки независимо от возраста, именно эта доза рекомендована в упомянутом выше пособии для врачей [5]. Терапевтический план лечения железодефицитной анемии у детей В российской педиатрической практике многие годы был принят так называемый трапециевидный терапевтический план лечения ЖДА у детей. В соответствии с этим планом в первые 3 5 дней дозу солевых препаратов железа постепенно повышали, чтобы не вызвать у больного раздражения слизистой оболочки ЖКТ. Полную (100%) дозу солевого препарата железа применяли в течение 1,5 3 мес. в зависимости от степени тяжести анемии с последующим ее снижением до 50% к моменту окончания лечения. Этот план, как и большинство других, был разработан эмпирическим путем, и его эффективность никогда не была подтверждена рандомизированными исследованиями. Появление препаратов железа (III) на основе ГПК заставило пересмотреть план лечения ЖДА. Под руководством сотрудников Федерального научно-клинического центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (ФНКЦ ДГОИ) Минздрава России (Москва) было проведено рандомизированное исследование по сравнению эффективности двух планов лечения ЖДА различной степени т я жест и у детей и подростков: традиционного трапециевидного и нового, предусматривающего прием 100% дозы препарата железа (III) на основе ГПК в течение всего периода лечения. Во время исследования оценивали переносимость препарата на основе ГПК и эффективность терапии в ранние (ретикулоцитарная реакция, прирост концентрации НЬ) и поздние сроки (нормализация концентрации НЬ, СЖ и СФ). Была доказана эффективность терапии у детей и подростков с ЖДА препаратом железа (III) на основе ГПК. После завершения курса лечения нормализация концентрации НЬ была достигнута у 96,9% пациентов, СЖ у 73,4%, СФ у 60,9% пациентов. Незначительное количество (6,3%) нежелательных явлений (запор в течение 1-го 7
8 месяца лечения) и 100% приверженность пациентов к лечению позволили заключить, что препарат железа (III) на основе ГПК является оптимальным препаратом для терапии ЖДА у детей и подростков. Также было доказано преимущество использования 100% дозы препарата железа (III) на основе ГПК в течение всего курса лечения: нормализация концентрации СЖ была зафиксирована у 90,6%, СФ у 75% детей и подростков. При использовании традиционного трапециевидного плана лечения аналогичные показатели составили 56,3 и 46,9% соответственно [6 8]. Препараты для лечения железодефицитной анемии Препараты железа для лечения ЖДА могут быть условно разделены на ионные солевые (преимущественно двухвалентные) и препараты железа (III) на основе ГПК. Рандомизированные исследования последних лет доказали, что эффективность солевых препаратов железа и препаратов железа (III) на основе ГПК в лечении ЖДА одинакова [ 9 ]. В процессе лечения ЖДА солевыми препаратами железа могут возникать следующие проблемы: передозировка и даже отравление вследствие неконтролируемого организмом всасывания; взаимодействие с другими лекарственными препаратами и пищей; выраженный металлический привкус; окрашивание эмали зубов и десен, иногда стойкое; частый отказ пациентов от лечения (до 30 35% приступивших к лечению), т.е. низкая комплаентность. Большинства перечисленных проблем можно избежать при использовании препаратов железа (III) на основе ГПК, имеющих следующие свойства и преимущества: высокую безопасность, отсутствие риска передозировки, интоксикации и отравлений; отсутствие потемнения десен и зубов; приятный вкус; отличную переносимость; высокую комплаентность лечения; отсутствие взаимодействия с другими лекарственными средствами и продуктами питания; наличие антиоксидантных свойств. Применение солевых препаратов железа может сопровождаться токсичностью и развитием таких нежелательных явлений, как боли в эпигастральной области, запор, понос, тошнота, рвота. Это приводит к низкой комплаентности лечения ЖДА солевыми препаратами железа. Возможны передозировка и даже отравления солевыми препаратами железа из-за пассивного неконтролируемого всасывания. Современные препараты железа (III) на основе ГПК не вызывают таких осложнений и прекрасно переносятся. Основные пероральные препараты железа, применяемые в лечении ЖДА, и содержание в них элементарного железа приведены в табл. 4. 8
9 Таблица 4. Основные пероральные препараты, применяемые для лечения ЖДА, и содержание в них элементарного железа Препарат Состав препарата (в 1 драже, 1 таблетке, в 1 мл капель или Форма выпуска Актиферри н Актиферри н Актиферри н сиропа) Сульфат железа 113,85 мг, D, L- серин 129 мг в 1 капсуле Сульфат железа 47,2 мг, D, L- серин 35,6 мг, глюкоза и фруктоза 151,8 мг, калия сорбат 1 мг в 1 мл капель Сульфат железа 171 мг, D,Lсерин 129 мг, глюкоза, фруктоза в 5 мл сиропа Сульфат железа 320 мг, аскорбиновая кислота 60 мг Капсулы, в блистере 10 капсул, по 2 и 5 блистеров упаковке Капли для приема внутрь, 30 мл во флаконе Сироп, 100 мл во флаконе Сорбифер Таблетки, покрытые Дурулес оболочкой, по 30 и 50 таблеток во флаконе Мальтофер ГПК Раствор для приема внутрь, 30 мл во флаконе с капельницей Мальтофер -Фол ГПК, фолиевая кислота 0,35 мг в 1 таблетке Жевательные таблетки, 10 таблеток в блистере, по 3 блистера в упаковке Мальтофер ГПК Жевательные таблетки, в блистере 10 таблеток, по 3 и 50 блистеров в упаковке Капсулы, во флаконе 30 шт. 9 Содержание элементарного железа Fe 2+ : 34,5 мг в 1 капсуле Fe 2+ : 9,48 мг в 1 мл Fe 2+ : 34 мг в 5 мл Fe 2+ : 100 мг в 1 таблетке Fe 3+ : 50 мг в 1 мл раствора (20 капель) Fe 3+ : 100 мг в 1 таблетке Fe 3+ : 100 мг в 1 таблетке Мальтофер ГПК Сироп, 150 мл во флаконе Fe 3+ : 10 мг в 1 мл Тардиферо н Таблетки, покрытые Fe 2+ : 80 мг Сульфат железа 256,3 мг, мукопротеоза 80 мг, аскорбиновая кислота 30 мг Тотема В 10 мл раствора содержится: 50 мг глюконата железа, 1,33 мг глюконата марганца, 0,7 мг глюконата меди, глицерол, глюкоза, сахароза, лимонная кислота, цитрат натрия и др. Ферретаб комп. Фумарат железа 154 мг, фолиевая кислота 0,5 мг Ферроплек Сульфат железа 50 мг, с аскорбиновая кислота 30 мг Ферронал Глюконат железа 300 мг в 1 таблетке Ферлатум Протеин сукцинилат железа 800 мг в 15 мл Фенюльс Сульфат железа 150 мг, аскорбиновая кислота 50 мг, рибофлавин 2 мг, тиамин 2 мг, никотинамид 15 мг, пиридоксин гидрохлорид 1 мг, пантотеновая кислота 2,5 мг Феррум Лек оболочкой, 10 таблеток в блистере, 3 блистера в упаковке Раствор для приема внутрь, ампулы по 10 мл, по 20 шт. в упаковке Капсулы, 10 капсул в блистере, 3 блистера в упаковке Драже, в упаковке 100 шт. Таблетки, покрытые оболочкой, в блистере 10 таблеток, 1 блистер в упаковке Раствор для приема внутрь, 15 мл во флаконе, 10 флаконов в упаковке Капсулы, 10 капсул в блистере, 1 блистер в упаковке ГПК Жевательные таблетки, 10 таблеток в стрипе, 3 стрипа в упаковке Феррум Лек Хеферол Фумарат железа 350 мг в 1 капсуле Fe 2+ : 5 мг в 1 мл Fe 2+ : 50 мг в 1 капсуле Fe 2+ : 10 мг в 1 драже Fe 2+ : 30 мг в таблетке Fe 2+ : 40 мг в 15 мл Fe 2+ : 45 мг в 1 капсуле Fe 3+ : 100 мг в 1 таблетке ГПК Сироп, 100 мл во флаконе Fe 3+ : 10 мг в 1 мл Fe 2+ : 115 мг в капсуле
10 Парентеральные (внутривенные и внутримышечные) препараты железа (табл. 5) показаны в тех случаях, когда есть противопоказания к применению пероральных препаратов или они неэффективны. Парентеральные препараты железа в лечении ЖДА показаны при; тяжелой форме ЖДА (в настоящее время встречается довольно редко, менее чем в 3% случаев); непереносимости пероральных препаратов железа; резистентности к лечению пероральными препаратами железа; наличие язвенной болезни желудка или двенадцатиперстной кишки или операций на ЖКТ, даже в анамнезе; анемии, ассоциированной с хроническими болезнями кишечника (язвенный колит, болезнь Крона); хронической болезни почек для лечения и профилактики анемии в преддиализный и диализный периоды; наличии противопоказаний к переливанию эритроцитной массы, в том числе по религиозным убеждениям (например, свидетели Иеговы); необходимости быстрого насыщения организма железом. Внутримышечные или внутривенные инъекции препарата железа обычно проводят 1 3 раза в неделю. При использовании парентеральных препаратов железа не рекомендуется превышать общий дефицит железа, который предварительно рассчитывают по формуле: Общий дефицит железа (мг) = Масса тела больного (кг) х (НЬ норма (г/л) — НЬ больного (г/л)) х 0,24 + Депо железа (мг) Коэффициент 0,24 = 0,0034 0, : содержание железа в Hb приблизительно 0,34%; объем крови 7% массы тела; 1000 перевод граммов в миллиграммы. Депо железа у пациентов с массой тела: менее 35 кг 15 мг/кг, целевая концентрация Hb 130 г/л; более 35 кг 500 мг, целевая концентрация Hb 150 г/л. Особенностью данной формулы является учет железа в депо, составляющего значимую (более 30%) часть общего количества железа. Снижение запасов железа в депо может быть доказано по снижению концентрации СФ. Зная общий дефицит железа в организме (в мг) и количество железа в 1 ампуле препарата (например, 100 мг), можно рассчитать необходимое количество ампул на курс лечения по формуле: Общий дефицит железа Количество ампул длявведения = (2) 100 мг Возможны нежелательные явления при использовании парентеральных препаратов железа. Оба способа введения (внутривенный и внутримышечный) могут вызвать различные нежелательные явления местные (покраснение, жжение, зуд) и общие (аллергические, анафилактоидные). Последние характерны для парентеральных препаратов железа, содержащих декстран. Это требует наблюдения больного, применения тест-дозы перед началом лечения, точного расчета количества железа, которое следует ввести во избежание повреждающего действия его повышенной концентрации в циркуляции. Необходимо иметь в виду возможность возникновения нежелательных явлений, обусловленных гиперчувствительностью пациента к препаратам железа, вводимым даже в очень низких дозах. 10
11 Для того чтобы терапия парентеральными препаратами железа была эффективной и безопасной для пациента необходимо строгое выполнение следующих принципов лечения: применение современных парентеральных препаратов железа с меньшей токсичностью, без анафилактоидных реакций, опасных для жизни больного; определение общего дефицита железа в организме больного по формуле 1; прекращение терапии после восполнения общего дефицита железа во избежание опасного перенасыщения организма железом. По этим же соображениям желательно проводить терапию парентеральными препаратами железа под контролем НТЖ; соблюдение техники проведения внутримышечной инъекции и внутривенной инфузии препаратов железа; обязательное выполнение требования инструкции по применению парентерального препарата железа, если предусмотрено введение пробной дозы перед началом лечения; лечение рекомендуется проводить в диапазоне безопасных доз, так как нежелательные явления парентеральных препаратов железа являются дозозависимыми. Таблица 5. Некоторые современные препараты железа для парентерального введения Название препарата Состав препарата Количество препарата в ампуле Для внутримышечного введения Жектофер Железо (III)-сорбитол-цитрат 100 мг в 2 мл КосмоФер Железо (III)-гидроксид декстран 100 мг в 2 мл (низкомолекулярный) Мальтофер раствор для Гидроксид железа (III) с 100 мг в 2 мл инъекций полимальтозой Спейсферрон Водный раствор 100 мг в 5 мл низкомолекулярного декстрана с микроэлементами железом и кобальтом Фербитол Железо (III)-сорбитол 100 мг в 2 мл Феркайл Железо (III)-декстран 100 мг в 2 мл Ферростат Железо (III)-гидроксид 100 мг в 2 мл сорбитоловый комплекс Феррум Лек раствор для инъекций Гидроксид железа (III) с полиизомальтозой в водном изотоническом растворе 100 мг в 2 мл Для внутривенного введения Венофер Железо (III)-гидроксид сахарозный комплекс 100 мг в 5 мл 40 мг в 2 мл КосмоФер Железо (III)-гидроксид декстран 100 мг в 2 мл (низкомолекулярный) Ликферр 100 Железо (III)-гидроксид 100 мг в 5 мл сахарозный комплекс Феринжект Железо (III)-карбоксимальтозат 500 мг в 10 мл 100 мг в 2 мл Контроль эффективности лечения ЖДА препаратами железа Критериями эффективности лечения ЖДА препаратами железа являются: 11
12 ретикулоцитарная реакция: на 7 10-й день от начала лечения препаратами железа количество ретикулоцитов повышается (обычно на 2 3% или ) по сравнению с их количеством до начала лечения; повышение концентрации Hb к концу 4 нед. лечения препаратами железа на 10 г/л и гематокрита на 3% по отношению к изначальным значениям до лечения [10]; исчезновение клинических проявлений заболевания через 1 1,5 мес. от начала лечения препаратами железа; преодоление тканевой сидеропении и восполнение железа в депо через 3 6 мес. от начала лечения (в зависимости от степени тяжести анемии), что контролируется по нормализации концентрации СФ (более 30 мкг/л). Причины неэффективности лечения ЖДА препаратами железа Если критерии эффективности лечения не выполняются и лечение оказывается не успешным, следует рассмотреть следующие позиции: правильность постановки диагноза ЖДА; адекватность дозировки препаратов железа; необходимую длительность лечения ЖДА; выполняемость курса лечения ЖДА родителями пациента; наличие у больного проблем со всасываемостью; переносимость больным назначенного препарата железа. Если диагноз ЖДА установлен правильно, то ответ на применение солевых препаратов железа или препаратов железа (III) на основе ГПК, будет обязательно. Если отсутствует ретикулоцитарная реакция, являющаяся самым ранним ответом на лечение, и отсутствуют повышение концентрации Hb на 10 г/л и гематокрита на 3% к концу 4 нед. лечения, то следует остановить лечение и пересмотреть диагноз, так как, скорее всего, у больного имеется не ЖДА [11]. Так называемая «рефрактерность» ЖДА к лечению препаратами железа чаще всего обусловлена неадекватностью назначенной терапии или анемией, не связанной с дефицитом железа. Наконец, если все указанные позиции учтены и выяснены, то следует подумать о недавно описанной в литературе железорефрактерной железодефицитной анемии (ironrefractory iron deficiency anemia IRIDA) [12, 13]. IRIDA это наследуемое по аутосомно-рецессивному типу заболевание, описаны семейные случаи. Известно, что лечение этой разновидности ЖДА пероральными препаратами железа неэффективно, частичный эффект можно получить при использовании парентеральных препаратов железа. Причиной IRIDA является мутация в гене ТМРRSS6. В результате повышается концентрация гепцидина, который ингибирует всасывание железа в кишечнике и высвобождение железа из макрофагов. Частотные характеристики IRIDA пока не известны, методы эффективной терапии не разработаны. Отношение к переливанию эритроцитной массы При ЖДА, как правило, нет показаний для переливания эритроцитной массы. Даже тяжелые случаи ЖДА можно успешно лечить с помощью пероральных, внутримышечных или внутривенных препаратов железа. Риск применения трансфузий эритроцитной массы в лечении ЖДА явно превышает пользу от них. Меры общественной и индивидуальной профилактики ЖДА Меры общественной профилактики Если распространенность ЖДА в стране или регионе превышает 40%, эксперты ВОЗ рекомендуют проведение фортификации, которая предусматривает обогащение железом наиболее употребляемых населением продуктов. Обычно в качестве таких 12
13 продуктов выбирают хлеб или макаронные изделия. Важно, чтобы доля населения, употребляющего этот продукт, составляла не менее 65 95%. Фортификация затруднена из-за отсутствия идеального пищевого продукта, хорошо переносимого соединения железа, а также проблем с его всасываемостью. Эффективность фортификации составляет около 50% среди охваченного населения. Более эффективной считается профилактика ЖДА у населения, представляющего группы риска развития анемии. Этот вид профилактики получил название саплиментации и подразумевает добавку веществ (железа, йода и др.) извне [14]. Наиболее показательным примером саплиментации является применение препаратов железа у беременных женщин для профилактики ЖДА. Согласно рекомендациям ВОЗ, препарат железа в дозе 60 мг/кг в сутки применяют во II и III триместрах беременности и в течение 3 мес. лактации. Национальные рекомендации США предусматривают применение препарата железа в дозе 30 мг/кг в сутки в течение всего периода беременности. Однако даже при охвате саплиментацией 50, 80 и 95% беременных женщин эффективную дозу железа получают только 67% женщин. Первичная профилактика дефицита железа Проблема дефицита железа это прежде всего проблема питания, поэтому первичная профилактика ЖДА это адекватное, сбалансированное питание человека в любом возрасте. Ежедневная потребность взрослого человека в железе составляет около 1 2 мг, ребенка 0,5 1,2 мг. Обычная диета обеспечивает поступление от 5 до 15 мг элементарного железа в день. В ЖКТ (двенадцатиперстной кишке и верхнем отделе тощей кишки) всасывается лишь 10 15% железа, содержащегося в пище. Основным пищевым источником железа являются продукты животного происхождения, содержащие гемовое железо. Наибольшее количество железа содержится в говядине, баранине, печени, в меньшей степени рыбе, курином мясе, твороге. Важным является не то, сколько железа содержится в продукте, а какова его биодоступность. По сравнению с животными продуктами негемовое железо, содержащееся в растительной пище (овощи, фрукты, злаки), имеет сниженную биодоступность, что означает его более низкую всасываемость. Кроме того, для всасывания железа необходимы определенные условия: витамин С усиливает всасывание железа, а такие вещества, как таниновая кислота, входящая в состав чая, или фитаты, встречающиеся в некоторых продуктах, могут существенно угнетать всасывание железа. При ЖДА всасывание железа в двенадцатиперстной кишке резко возрастает, что связано с подавлением синтеза гепцидина. В настоящее время для профилактики дефицита железа в большинстве стран мира приняты соответствующие рекомендации. В основном они касаются детей раннего возраста, беременных и кормящих женщин, а также женщин репродуктивного возраста. Американская академия педиатрии (American Academy of Pediatrics) в 2010 г. пересмотрела рекомендации по профилактике ЖДА у детей первого года жизни и детей раннего возраста (1 3 года). Основные положения этих рекомендаций сводятся к следующему [13]: доношенные здоровые дети имеют достаточные запасы железа в первые 4 мес. жизни. В связи с небольшим содержанием железа в грудном молоке детям, находящимся на грудном вскармливании, показано дополнительное назначение железа (1 мг железа на 1 кг массы тела в сутки), начиная с 4-месячного возраста и до введения прикорма (например, каши, обогащенной железом); доношенные дети, находящиеся на смешанном вскармливании (грудное молоко составляет более половины рациона), должны дополнительно получать 1 мг железа на 1 кг массы тела в сутки, начиная с 4-месячного возраста и до ведения прикорма; 13
14 дети, находящиеся на искусственном вскармливании и получающие молочные смеси, обогащенные железом, получают достаточное количество железа из молочных смесей или прикорма. Цельное коровье молоко не следует назначать детям до 12 мес.; дети в возрасте 6 12 мес. должны получать 11 мг железа в сутки. В качестве блюд прикорма следует назначать красное мясо и овощи с высоким содержанием железа. В случае недостаточного поступления железа с молочными смесями или прикормом следует дополнительно назначить железо в виде капель или сиропа; дети в возрасте 1 3 лет должны получать 7 мг железа в сутки, лучше в виде пищи, содержащей достаточное количество красного мяса, овощей с высоким содержанием железа и фруктов с большим содержанием витамина С, который усиливает всасывание железа. Также возможно дополнительное назначение жидких форм препаратов железа или поливитаминов; все дети, родившиеся недоношенными, должны получать по крайней мере 2 мг железа на 1 кг массы тела в сутки до 12-месячного возраста, что соответствует содержанию железа в обогащенных им молочных смесях. Дети, родившиеся недоношенными, при грудном вскармливании должны получать 2 мг железа на 1 кг массы тела в сутки, начиная с 1-го месяца жизни и до перехода на искусственное вскармливание молочными смесями, обогащенными железом, или до введения прикорма, обеспечивающего поступление 2 мг железа на 1 кг массы тела в сутки. Вторичная профилактика дефицита железа Вторичную профилактику дефицита железа (ранняя диагностика ЖДА) рекомендуется проводить при каждом обращении пациента к врачу, проведении диспансеризации, медицинских осмотров и т.д. При этом врачи должны опираться на жалобы больного, данные анамнеза, клинические проявления и изменения лабораторных показателей. В США в качестве меры вторичной профилактики ЖДА у детей грудного и дошкольного возраста предусмотрен универсальный и селективный скрининг. Универсальный (всеобщий) скрининг проводится среди детей в возрасте 12 мес. и включает определение концентрации Hb и оценку факторов риска развития ЖДА. К таким факторам риска относят [10, 13]: низкий социально-экономический статус семьи (социально неблагополучные семьи, беженцы или эмигранты); недоношенность или низкая масса тела при рождении; отравление свинцом; исключительно грудное вскармливание после 4-месячного возраста без дополнительного назначения железа; употребление цельного коровьего молока или диета с низким содержанием железа. К дополнительным факторам риска относят: недостаточное питание, отставание в развитии; особые потребности, обусловленные состоянием здоровья. В случае выявления факторов риска развития ЖДА у детей раннего возраста рекомендуют проводить селективный (избирательный) скрининг в любое время [10]. У детей в возрасте 2 5 лет, не имеющих факторов риска, обследование на предмет выявления ЖДА проводится ежегодно. Среди детей школьного возраста и мальчиков подросткового возраста скрининговому обследованию для выявления анемии подлежат дети, имеющие ЖДА в анамнезе или особые потребности, обусловленные состоянием здоровья или низким поступлением железа с пищей. 14
15 Начиная с подросткового возраста, скрининг для выявления анемии проводят у всех небеременных женщин каждые 5 10 лет в течение всего детородного возраста. Ежегодному скринингу подлежат женщины с факторами риска развития ЖДА (обильная кровопотеря при менструации или иной природы, недостаточное потребление железа и предшествующий диагноз ЖДА). Проведенное у девушек Вологды исследование показало, что обильная менструальная кровопотеря является дополнительным фактором риска развития анемии у девушек-подростков [14]. При проведении скрининга в популяции с низкой распространенностью ЖДА и отсутствием тяжелых форм заболевания следует ориентироваться не на данные анамнеза и клинические проявления (признаки анемии и сидеропении), а на изменения лабораторных показателей. Как показали проведенные в ФНКЦ ДГОИ им. Дмитрия Рогачева Минздрава России (Москва) исследования, наибольшей общей точностью/эффективностью в выявлении дефицита железа и ЖДА при проведении скрининга у подростков обладают Hb, гематокрит, цветовой показатель, MCV и MCH. Биохимические показатели (СЖ, ОЖСС, СФ, НТЖ), как обладающие высокой специфичностью в выявлении дефицита железа, рекомендуется использовать только для подтверждения диагноза, установленного на основании других тестов (например, гематологических) [15]. Прием препаратов железа с профилактической целью предназначен для лиц из групп риска, которые не имеют возможности получать продукты, обогащенные железом. Следует помнить, что железо из обогащенных продуктов питания включается в эритропоэз в меньшей степени, чем при назначении препаратов железа. Диспансерное наблюдение больных ЖДА Диспансерное наблюдение за детьми и подростками с ЖДА проводится в нашей стране в течение одного года с момента установления диагноза. Контролируются самочувствие и общее состояние больного. Перед снятием больного с диспансерного наблюдения выполняется общий анализ крови, все показатели которого должны быть в пределах нормы. Вакцинация. Проведение профилактических прививок детям с ЖДА не противопоказано, не требует нормализации концентрации НЬ и должно проводиться у больных с нетяжелой анемией в обычные сроки, поскольку количество иммунокомпетентных клеток у больных достаточно. В нашей стране издан официальный документ, подтверждающий это положение: «Вакцинопрофилактика. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок. Методические указания» [16]. Согласно этому документу анемии, в том числе и ЖДА, относятся к «ложным противопоказаниям к проведению вакцинации», а непроведение педиатрами прививок при анемиях «должно рассматриваться как свидетельство его некомпетентности в вопросах иммунопрофилактики». В разделе 13.4 этого документа написано: «Анемия нетяжелая, алиментарного генеза не должна быть причиной отвода от прививки, после которой ребенку назначают соответствующее лечение. Тяжелая анемия требует выяснения причины с последующим решением вопроса о времени вакцинации». Меры реабилитации. Медицинской, физической и психологической реабилитации больных после излечения от ЖДА не требуется. 15
источник