1 ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ АНЕМИИ ХРОНИЧЕСКИХ БОЛЕЗНЕЙ 1
2 Ответственные исполнители: — Демихов Валерий Григорьевич д-р мед. наук, проф., директор Научноклинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России — Морщакова Елена Федоровна д-р мед. наук, заместитель директора по науке Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России — Лунякова Мария Анатольевна канд. мед. наук., зав. отделом гематологии и онкологии Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России — Инякова Наталья Викторовна канд. мед. наук, научный сотрудник Научноклинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России Рецензирование, обсуждение содержания рекомендации проводилось на сайте НОДГО, совещаниях, съездах педиатров, гематологов России Диагностика и лечение анемии хронических болезней МКБ-10: рубрикой D63.8 2
3 АНЕМИЯ ХРОНИЧЕСКИХ БОЛЕЗНЕЙ Син.: анемия воспаления Код по МКБ-1 D63.8 Анемия хронических болезней (АХБ) является второй по распространенности после ЖДА и наблюдается у пациентов с острой или хронической активацией иммунной системы вследствие различных как инфекционных, так и неинфекционных заболеваний (рис. 1). Рис. 1. Наиболее частые причины анемий в клинической практике. Наиболее частые состояния, которые могут приводить к развитию АХБ, представлены в таблице 1. В настоящее время считается, что образование гепцидина ключевой механизм развития АХБ. Являясь гормоном, секретируемым гепатоцитами в условиях воспаления, гепцидин блокирует всасывания железа в кишечнике и реутилизацию железа из депо (депонирование железа в клетках моноцитарно-макрофагальной системы), тем самым снижая концентрацию железа в плазме крови, что способствует развитию железодефицитного эритропоэза. Другим важным фактором развития АХБ является неадекватно низкая продукция ЭПО вследствие избыточной продукции провоспалительных цитокинов. Таким образом, ведущую роль в развитии АХБ играет комплекс факторов, основными из которых являются нарушение гомеостаза железа вследствие повышенной продукции гепцидина и нарушение эритропоэза в виде неадекватно низкой продукции ЭПО степени анемии, что является патогенетическим обоснованием терапевтического применения при них эритропоэзстимулирующих препаратов (ЭСП). 3
4 АХБ развивается не только при хронических, но и острых воспалительных заболеваниях. Снижение уровня Hb можно обнаружить уже менее, чем через 2 недели от начала заболевания. Обычно это умеренная, микроцитарная анемия с уровнем Hb г/л и гематокритом 30-40%. Лишь у 20% пациентов гематокрит может снижаться меньше 25%. При хроническом течении анемии, она становится более гипохромной с более выраженным воспалительным компонентом в ее этиологии. При острой инфекции, когда анемия развивается быстро, она часто нормохромная. Таблица 1. Основные заболевания, сопровождающиеся развитием анемии хронических болезней. Заболевания, ассоциируемые с анемией хронических болезней Инфекции (острые и хронические) вирусные (в том числе ВИЧ) бактериальные паразитарные грибковые Предположительная распространенность анемии при данном заболевании (%) Рак гемобластозы солидные опухоли Аутоиммунные реакции ревматоидный артрит системная красная волчанка диффузные заболевания 8 71 соединительной ткани васкулиты саркоидоз заболевания кишечника Хроническая реакция трансплантат против хозяина после органной трансплантации 8 70 Хронические заболевания почек ОСОБЕННОСТИ ДИАГНОСТИКИ АНЕМИИ ХРОНИЧЕСКИХ БОЛЕЗНЕЙ Принципиальное различие между ЖДА и АХБ заключается в том, что ЖДА имеет отношение к абсолютному дефициту железа, тогда как патофизиология АХБ является мультифакторной. С высокой долей вероятности об АХБ следует думать, если анемия развилась на фоне тяжелых заболеваний. АХБ необходимо также исключить в случаях, когда перо-ральная ферротерапия в течение 4 нед не привела к повышению НЬ >10 г/л. С этой целью проводится определение биохимических показателей обмена железа с 4
5 расчетом коэффициента НТЖ и концентрации сывороточного ферритина СФ (см. клинические рекомендации по ЖДА, дифференциальная диагностика). Следует учитывать, что уровень СФ повышается в условиях воспаления (острые и хронические инфекции, болезни печени, аутоиммунные и онкологические заболевания), что может маскировать наличие дефицита железа (ДЖ). Поэтому при повышенном уровне СРБ (>10 мкг/л) ДЖ констатируется при СФ 6 зрения более целесообразна при АХБ, однако если она используется в виде монотерапии (только в случаях доказанного при АХБ ДЖ по низкому уровню НТЖ или ФС) следует ожидать высокого уровня резистентности (около 50%) к терапии. Это связано с неадекватно низкой продукцией ЭПО степени тяжести анемии, характерной для АХБ. Поэтому наиболее эффективной схемой лечения АХБ является комбинированное использование ЭСП и внутривенных препаратов железа. Использование пероральных препаратов железа вместо внутривенной ферротерапии допустимо, но может снижать ответ на рчэпо терапию. В настоящее время самый большой опыт применения рч ЭПО у детей и подростков имеется у пациентов с хронической почечной недостаточностью (см. соответствующие клинические рекомендации). В литературе доступны немногочисленные публикации о эффективности рч ЭПО в сочетании с препаратами железа при АХБ у детей. С практической точки зрения уровень сывороточного ЭПО (с-эпо), определяемый у пациента с анемией, не может просто сравниваться с нормальным значением ЭПО. Продукция ЭПО почками увеличивается обратно пропорционально степени гипоксии (снижения концентрации Hb). Поэтому уровень с-эпо следует оценивать относительно степени тяжести анемии. В каждой лаборатории рекомендуется на основании анализа данных обследования популяции пациентов с анемией (чаще с ЖДА) рассчитать уравнение регрессии Hb-ЭПО, которое будет моделью адекватности продукции ЭПО степени тяжести анемии. Для врача-клинициста важно все анемии разделить на две большие группы: I анемии с адекватной продукцией ЭПО и II анемии с неадекватно низкой продукцией ЭПО степени тяжести анемии. Оценку адекватности продукции ЭПО проводят на основании определения отношения логарифма, определяемого (О) уровня ЭПО (в исследуемой сыворотке) к логарифму предполагаемого (П) уровня ЭПО (в контрольной сыворотке пациента с ЖДА с тем же уровнем Hb) коэффициент О/П (log ЭПО). Продукцию ЭПО считают неадекватно низкой степени анемии при О/П (log ЭПО) 7 концентрации ЭПО низкая (нижняя прямая на рисунке 2). Уровень эндогенного ЭПО при этом виде анемии, если и повышается, то незначительно, и не соответствует степени снижения уровня Hb (неадекватно низкая степени анемии продукция ЭПО). В группу ЭДА относятся: анемия при хронической почечной недостаточности, АХБ, ранняя анемия недоношенных, анемия при злокачественных новообразованиях, анемия при хронической сердечной недостаточности, анемия беременных. Рис. 2. Зависимость между уровнем Hb и концентрацией сывороточного эритропоэтина (ЭПО) (Log шкала) при анемии с адекватной (верхняя прямая) и неадекватно низкой (нижняя прямая) продукцией ЭПО. В клинической практике уровень с-эпо 8 пациентов с различными ЭДА. Выявление неадекватно низкой продукции ЭПО у пациента с анемией. Протокол применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков Показания к применению: Hb 9 повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация превышает 120 г/л, следует прекратить введение препарата. Применение ЭСП при АХБ у детей патогенетически обосновано, однако имеет недостаточную доказательную базу. Необходимы многоцентровые рандомизированные исследования для того, чтобы высказаться за или против применения ЭСП при АХБ в педиатрической практике. До этих пор применение ЭСП возможно в рамках исследовательских протоколов, а также в некоторых исключительных случаях, например, по религиозным убеждениям, как альтернатива гемотрансфузиям. Диспансерное наблюдение Учитывая симптоматический характер анемического синдрома, продолжительность наблюдения определяется клиникой основного заболевания. 9
источник
Для цитирования: Дворецкий Л.И. Клинические рекомендации по лечению больных железодефицитной анемией // РМЖ. 2004. №14. С. 893
Железодефицитная анемия (ЖДА) представляет собой клинико–гематологический синдром, возникающий при развитии дефицита железа вследствие различных патологических (физиологических) процессов и характеризующийся снижением уровня гемоглобина (в меньшей степени эритроцитов) наряду с клиническими признаками анемии и сидеропении.
Клинические рекомендации ведения больных ЖДА включают: – выявление причины ЖДА и при необходимости – ее коррекция; – обучение больных ЖДА; – принятие решения о назначении лекарственных препаратов железа (ПЖ); – выбор лекарственного ПЖ; – путь введения ПЖ (внутрь или парентерально); – длительность лечения и необходимость поддерживающей терапии; – контроль переносимости ПЖ и коррекция при плохой переносимости; – оценку эффективности и выявление причин отсутствия или недостаточного эффекта; – коррекцию выявленных причин неэффективности.
Выявление причины ЖДА и возможности ее коррекции
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и вместе с тем наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ–10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует особо подчеркнуть роль врача–интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА (независимо от конкретной причины) обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к гематологу или другому специалисту. При выявлении причины ЖДА лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений – лечение эрозивно–язвенных процессов в желудке, оперативные лечения при опухолях ЖКТ, миоме матки, лечение энтеритов, коррекция алиментарной недостаточностии т.д.
Существенным компонентом ведения больных ЖДА является повышение их образовательного уровня в отношении данной патологии, создание мотивации к лечению, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Необходимо разъяснение сущности ЖДА, причин ее возникновения, реальных возможностей коррекции дефицита железа и нормализации уровня гемоглобина. Особое значение имеют обучающие программы у беременных женщин с наличием ЖДА и пациенток, страдающих меноррагиями. У беременных должна создаваться мотивация необходимости коррекции дефицита железа с целью предотвращения недостатка железа у плода. Больные должны быть осведомлены о возможных побочных эффектах при лечении лекарственными препаратами железа, необходимости соблюдения врачебных назначений, в том числе и регулярности приема ПЖ. Следует обязательно указать на недопустимость попыток коррекции дефицита железа с помощью различных пищевых продуктов, а также на строгие показания к назначению инъекционных форм ПЖ.
Принятие решения о назначении лекарственных препаратов железа
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так например, железо, содержащееся в мясе в виде гема, всасывается на 40–50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3–5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа. На фармацевтическом рынке России в настоящее время имеется большой арсенал ПЖ в различных лекарственных формах, с неодинаковым содержанием в них железа, наличием дополнительных компонентов, влияющих на биодоступность железа, различной стоимостью (рис. 1). Из ПСЖ железо всасывается в двухвалентной форме, в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В ПЖК железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе, связано как в физиологическом состоянии в молекуле ферритина. Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Всасывание железа из ПЖК и нарастание его концентрации в сыворотке происходит медленно, но оно быстро поступает в запасы. При применении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПЖК в отличие от ПСЖ не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания (табл. 1). Для лучшей абсорбции ПСЖ рекомендуется принимать за час до еды т.е. на пустой желудок, что может вызывать нарушения со стороны желудка, кишечника и другие побочные эффекты. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучший комплайенс больных ЖДА. ПСЖ взаимодействуют с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), снижающими биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК. Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ.
Основными показаниями для парентерального введения ПЖ являются: – патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания); – резекция тонкой кишки; – резекция желудка по Бильрот II с формированием «слепой петли»; – эрозивно–язвенные процессы в желудке (обострение язвенной болезни и др.); – непереносимость ПЖ для приема внутрь. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой. Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах при необходимости более быстрой нормализации содержания гемоглобина (например, при подготовке к оперативному вмешательству) следует считать неоправданным. ПЖ для парентерального введения могут назначаться при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена ПЖ для приема внутрь и т.д.).
Выбор лекарственного препарата железа
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа . Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединения железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1–2 таблеток в сутки. Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицин сульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианкобаламин). Среди ПЖК на отечественно рынке имеются гидроксиполимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахарозный комплекс. К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксиполимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т.е. прооксидантные реакции. Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. Для лучшей переносимости ПСЖ следует принимать во время еды, хотя следует иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Всасываниежелеза может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ – фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПЖ в виде солей недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли магния). С учетом этого следует рекомендовать прием препаратов солей железа в различное время с другими вышеуказанными медикаментами. Препараты ПЖК, в частности, гидроксиполимальтозный комплекс лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияние на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов. В таблице 2 представлены основные зарегистрированные в России лекарственные ПСЖ и ПЖК для приема внутрь.
Оценка эффективности лечения
В случаях назначения ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3–4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4–9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой – эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
Длительность лечения и поддерживающая терапия
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 4–6 недель. Поддерживающая терапия показана в тех ситуациях, когда причина дефицита железа сохраняется (меноррагии, беременность) или в силу различных ситуаций является трудноустранимой (патология кишечника, носовые и другие кровотечения при геморрагических диатезах). Женщинам, страдающим ЖДА на фоне меноррагий, после нормализации показателей гемоглобина рекомендуется поддерживающая терапия ПЖ в течение 5–7 дней после очередной менструации. Больным надо разъяснять необходимость поддерживающего лечения в связи с продолжающимися избыточными потерями железа. Беременные с ЖДА должны получать ПЖ до конца беременности в целях обеспечения адекватной потребности плода в железе.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Диспептические расстройства могут уменьшаться при приеме препаратов после еды или уменьшения суточной дозы препарата. Чаще побочные эффекты регистрируютсяпри приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества. В случаях сохраняющейся плохой переносимости пероральных ПЖ показано назначение ПЖ парентерально (внутримышечно или внутривенно). На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
Причины неэффективности лечения препаратами железа
В случае отсутствия или недостаточного эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Возможные причины неэффективности лечения ПЖ и способы их коррекции представлены в таблице 3. Необходима убежденность в правильной трактовке всех клинико–лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно связано с назначением ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, чем и объясняется, вероятнее всего, невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике. Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ. В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате показатели гемоглобина не достигают нормальных значений и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга. Ряд больных не всегда выполняют назначение врача (регулярность приема ПЖ, достаточная продолжительность и т.д.). В некоторых случаях это может быть обусловлено развитиемпобочных эффектов от ПЖ и самостоятельным прекращением лечения. Поэтому необходим контроль за лечением, эффективностью, переносимостью ПЖ со стороны врача, среднего медперсонала, родственников больных. Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, среди которых клинически наиболее значимыми являются скрытые кровопотери из желудочно–кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное эндоскопическое исследование кишечника (в ряде случаев – повторное). Таким образом, у больных ЖДА наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Своевременная верификация синдрома ЖДА и выявление ее причины, адекватная патогенетическая терапия с назначением ПЖ с оптимальными фармакокинетическими свойствами, клинической эффективностью, переносимостью позволяет корригировать анемический синдром и обеспечивать достаточный уровень качества жизни у данной категории пациентов.
источник
Н.И. Стуклов, Е.Н. Семенова
ФГБОУ ВПО Российский университет дружбы народов, Москва
Рассмотрен современный взгляд на проблему железодефицитной анемии (ЖДА) с точки зрения эпидемиологии, этиологии, патогенеза. Описаны известные в настоящее время механизмы регуляции обмена железа, приведены наиболее важные данные литературы и результаты собственных исследований. Основываясь на рекомендациях по лечению больных ЖДА, авторы представляют описанный в литературе и собственный клинический опыт использования железосодержащих препаратов и рассматривают полученные результаты. В рамках статьи авторы объясняют механизмы низкой эффективности лечения при ЖДА и предлагают способы решения проблемы с учетом опубликованных в литературе последних научных исследований.
Ключевые слова: анемия; обмен железа; сидеропенический синдром; лечение железодефицитной анемии.
N.I. Stuklov, E.N. Semenova
Russian University of People’s Friendship, Moscow, Russia
Modern views of epidemiology, etiology and pathogenesis of iron deficiency anemia are considered. Mechanisms of iron metabolism regulation are described based on the most important literature data and the results of the authors ’ research. The authors present their own and literature clinical experience of using iron-containing drugs with reference to the existing recommendations on the treatment of iron deficiency anemia. Causes of low treatment efficiency are discussed and the ways to address this problem are proposed based on the published results of clinical research.
Key words: anemia; iron metabolism; sideropenic syndrome; treatment of iron deficiency anemia.
Анемии (греч. αναιμια — бескровие) определяются как ряд клинических состояний, связанных со снижением уровня гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин; (ВОЗ, 2001) и (или) гематокрита ( менее 36,4% соответственно), что обусловлено уменьшением количества эритроцитов или содержания гемоглобина в них [1]. В настоящее время железодефицитная анемия (ЖДА) является самым распространенным состоянием, связанным со снижением уровня гемоглобина, поэтому ее признают государственной проблемой более чем в 100 странах мира, где разрабатываются программы, направленные на профилактику и снижение заболеваемости. ЖДА чаще выявляется у представителей наиболее социально значимых и незащищенных слоев населения — у женщин детородного возраста и детей. Количество больных анемией в указанных группах, по данным ВОЗ (2001), превышает 1 млрд [2]. В итоге ЖДА является причиной роста материнской и детской смертности [3].
Регуляция обмена железа.
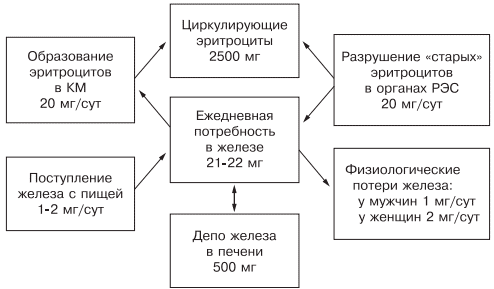
Ежедневно организму для нормальной жизнедеятельности требуется 20—25 мг железа, причем экзогенного железа необходимо только 1— 2 мг: женщинам — 2 мг (из-за физиологической кровопотери), а мужчинам — 1—1,5 мг. Около 20 мг железа поступает из «старых» разрушенных эритроцитов, столько же расходуется на синтез нового гемоглобина.
Железо накапливается в органах ретикулоэндотелиальной системы (до 500 мг), остальные запасы железа на 70% сосредоточены в гемоглобине, что и обусловливает развитие ЖДА при хронической кровопотере (рис. 1).
Рис. 1. Схема обмена железа.
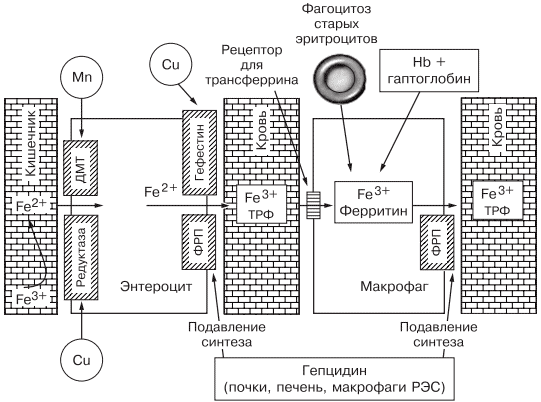
Всасывание железа происходит в верхних отделах тонкой кишки, причем этот процесс требует участия множества белков. В основном до 70—80% железа усваивается в двухвалентном состоянии (гемовое железо, содержащееся в основном в мясе, меньше — в печени и рыбе). При поступлении в кишечник растительного трехвалентного железа с помощью медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С оно восстанавливается до двухвалентного. Двухвалентное железо через марганецзависимые белки — транспортеры двухвалентных металлов (ДМТ — двухвалентный металлотранспортер) поступает в энтероцит, а затем через белок ферропортин на базальной мембране — в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином (рис. 2). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [4, 5].
Рис. 2. Схема регуляции обмена железа.
Универсальным регулятором метаболизма железа является гепцидин [6—9], который блокирует транспорт железа, причем этот механизм реализуется с помощью регуляции активности белка ферропортина, т.е. путем воздействия на высвобождение железа из клеток кишечника и макрофагов ретикулоэндотелиальной системы [10—13]. Увеличение количества железа в организме ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи — к восстановлению захвата железа из пищи и кишечника (см. рис. 2) [14—18]. Помимо железорегуляторной функции, гепцидин оказывает выраженное бактерицидное действие, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [6]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. В работе, проведенной в 2011 г. [19], доказана роль гепцидина как основного фактора развития ЖДА у женщин с гинекологическими заболеваниями без патологической кровопотери. Показатели гепцидина в указанной группе составили 108,75 ± 40,08 нг/л (референсные значения 60— 85 нг/л), что обусловило резкое уменьшение содержания ферропортина — 0,43 ± 0,21 нг/л (референсные значения 3,1 ± 0,2 нг/л) и привело к нарушению поступления железа из кишечника в кровь [19].
Железо, которое остается внутри клеток, депонируется в виде ферритина, количество которого в крови прямо пропорционально содержанию железа в депо [20].
Клиническая картина и диагностические критерии.
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [21—23].
В настоящее время выделяют несколько этапов развития дефицита железа [5, 24].
1. Предрасположенность к развитию дефицита железа (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических болезней желудочно-кишечного тракта — ЖКТ, заболеваний женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции трехвалентного железа в ЖКТ, которое может превышать 50% (в норме 10—15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме (по данным лабораторных исследований).
4. ЖДА. Диагноз устанавливается при уровне гомоглобина менее 120 г/л у женщин и 130 г/л у мужчин. Выделяют следующие стадии ЖДА:
В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого уменьшается количество гемоглобина в эритрокариоцитах костного мозга, что проявляется на первом этапе гипохромией эритроцитов, а в дальнейшем — развитием гипохромной микроцитарной анемии.
Клинические проявления ЖДА связаны с развитием как сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета, так и непосредственно симптомов анемии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности).
Наиболее характерным лабораторным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг, средняя концентрация гемоглобина в эритроците менее 290 г/л. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита — менее 80 фл [21, 22, 24].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных их применение не всегда оправдано. Так, показатель ферритина сыворотки (ФС) как единственный маркер, отражающий запасы железа в организме и используемый для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [5, 20], варьирует от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени. В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [25]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [26]. Тем более изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, так как они рассчитываются исходя из содержания трансферрина и сывороточного железа, а последний показатель вообще не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [21]. Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20%. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [26].
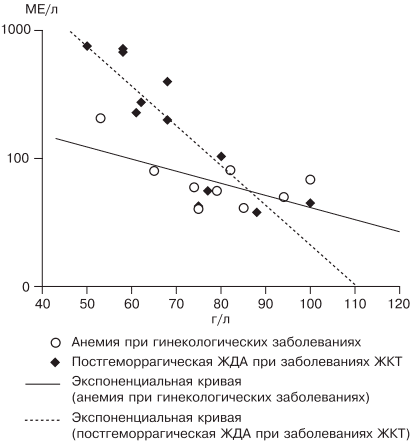
Наиболее частыми причинами ЖДА являются как физиологические, так и патологические состояния. В группу риска развития ЖДА входят недоношенные дети, так как у них не успевает сформироваться депо железа, и подростки, которым требуется больше железа в связи с быстрым ростом организма [27]. Наиболее часто ЖДА развивается при беременности. В период беременности, родов и лактации в среднем расходуется до 1000 мг железа, что в 2 раза больше его запасов в депо [28]. Репродуктивный возраст у женщин связан с повышенной потерей железа при менструациях; этот недостаток компенсируется увеличением всасывания железа в ЖКТ, что в настоящее время объясняется изменением влияния гепцидина. При наличии гиперполименореи, однако, такой баланс нарушается в связи с увеличением кровопотери [29, 30], при сопутствующих заболеваниях ЖКТ нарушается всасывание железа и развивается ЖДА [6, 19]. Часто у женщин меноррагии имеют органические причины: полипы, эндометрит, миома матки, аденомиоз, открывающийся в полость матки; мало того, такие заболевания, как миома матки и дисплазия шейки матки, оказывают влияние на развитие анемии и без патологической кровопотери [5, 19, 30]. Указанный механизм связан с увеличением содержания гепцидина в крови и снижением активности эритропоэза, доказанным синдромом неадекватной выработки эритропоэтина. В настоящее время продукцию эритропоэтина принято считать неадекватной при отношении определяемого эритропоэтина к предполагаемому (О/П log эритропоэтина менее 0,9) [28, 31]. Так, В.А. Бурлевым и Е.Н. Коноводовой [32] при обследовании женщин с миомой матки выявлено отношение О/П log эритропоэтина менее 0,8, а при обследовании гинекологических больных с анемией без нарушения менструальной функции в 2011 г. отношение О/П log эритропоэтина составило 0,89 (рис. 3). Для всех женщин с диагностированной ЖДА необходимо обязательное обследование у гинеколога. В случае обнаружении ЖДА у мужчин, наоборот, показано исключение заболеваний ЖКТ.
Рис. 3. Зависимость между уровнем гемоглобина и сывороточного эритропоэтина (логарифмическая шкала и экспоненциальные кривые) у больных с постгеморрагической ЖДА при заболеваниях ЖКТ (предполагаемый эритропоэтин) и анемии при гинекологических заболеваниях (определяемый эритропоэтин) [5].
Помимо повышенной потребности в железе и хронической кровопотери, патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в том числе и обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [21].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [5].
Лечение.
Современная тактика лечения при ЖДА в настоящее время направлена на устранение этиологического фактора и восполнение запасов железа в организме [4, 5]. Наиболее оправдано более физиологическое пероральное применение препаратов железа; парентерально препараты можно использовать только при доказанном дефиците железа. Перорально следует назначать препараты железа в высоких дозах (от 200 до 300 мг/сут), что, однако, может приводить к возникновению диспепсических явлений, поэтому (особенно в детской и акушерской практике) рекомендуется постепенное повышение дозы до терапевтической, а при достижении нормальных значений уровня гемоглобина — ее снижение [20].
Степень абсорбции двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они пассивно диффундируют через каналы ДМТ-белков [33], поэтому препараты, содержащие двухвалентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1—2 мес, а нормализация депо железа происходит уже через 3—4 мес от начала лечения в зависимости от степени тяжести анемии и дозы препарата. Препараты, содержащие железо в трехвалентном состоянии, требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом трехвалентного железа наступит только через 2—4 мес, а нормализация показателей депо железа — через 5—7 мес от начала терапии [5, 19, 33]. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние таблетированных препаратов железа на ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа. Лучше (но также с потерей эффективности) использовать формы с замедленным высвобождением, так как часть препарата будет высвобождаться в нижних отделах ЖКТ, где железо практически не всасывается [34]. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа активно применяются благодаря их лучшей переносимости.
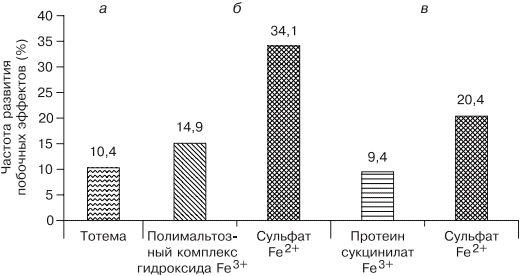
В современной клинической практике используются различные варианты сочетаний двухвалентного железа с витаминами С, В9, В12, что позволяет минимизировать побочные эффекты и одновременно повысить эффективность терапии, однако переносимость такого лечения до настоящего времени была основным лимитирующим фактором [20, 33]. Анализ переносимости различных препаратов железа более чем у тысячи пациентов показал, что современная жидкая форма двухвалентного железа (препарат тотема, лаборатория Иннотек Интернасиональ, Франция) по количеству побочных эффектов не превышает таковые у трехвалентного (рис. 4) [4]. Такой эффект достигается равномерным распределением препарата по слизистой оболочке желудка и его высокой биодоступностью. Двухвалентное железо равномерно и максимально эффективно проникает в энтероциты и, не накапливаясь в них, поступает в кровь. Это обусловлено наличием в составе препарата меди и марганца, которые входят в состав ДМТ-белков и гефестина, окисляющего железо, что способствует наилучшему его метаболизму (см. рис. 2) [33]. Помимо этого, указанные металлы участвуют в работе системы антиоксидантов, наиболее важными составляющими которой являются Cu, Zn-супероксиддисмутаза, Mn-супероксиддисмутаза (в митохондриях), каталаза, глутатионпероксидаза и глутатион. При уменьшении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов, что обусловливает их повреждающее действие на клетки. Следует понимать, что процесс активации перекисного окисления липидов запускается ионами двухвалентного железа, что проявляется частым развитием побочных эффектов при лечении препаратами железа. Наличие меди и марганца в составе тотемы уменьшает образование свободных радикалов, что улучшает переносимость препаратов железа [37].
Пациентам с заболеваниями ЖКТ назначать препараты железа перорально следует с осторожностью, причем острые заболевания, такие как язва желудка и двенадцатиперстной кишки, эрозивный гастрит, являются противопоказаниями; также не следует использовать указанный метод лечения у больных с заболеваниями тонкой кишки (болезнь Крона, целиакия, мальабсорбция) или отсутствием ее части.
Рис. 4. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов.
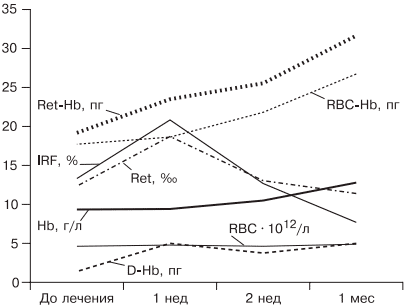
При лечении больных ЖДА остро стоит вопрос оценки эффективности терапии, так как часто ЖДА диагностируется у соматически тяжелых больных с крайне низким уровнем гемоглобина. Попытки ранней диагностики, как правило, связаны с исследованием количества ретикулоцитов [38], однако в настоящее время такой подход не является доказательным, так как часто ретикулоцитоз возникает компенсаторно при наличии кровотечения. В работе [5, 9] показано, что наиболее достоверными показателями, указывающими на хороший эффект препаратов железа, служат появление молодых форм ретикулоцитов и увеличение дельты гемоглобина (разницы между средним содержанием гемоглобина в ретикулоците и эритроците) уже через 1 нед после начала лечения (рис. 5).
Рис. 5. Динамика гемоглобина эритроцитов (RBC), количества ретикулоцитов (Ret), фракции незрелых ретикулоцитов (IRF-) среднего содержания гемоглобина в эритроците (RBC-Hb), среднего содержания гемоглобина в ретикулоците (Ret-Hb), дельты гемоглобина (D-Hb) при лечении ЖДА в течение 1 мес.
Основным критерием положительного ответа на терапию ЖДА является прирост уровня гемоглобина через 1 мес после начала применения препаратов железа, однако рекомендации разных организаций по этому вопросу не согласуются друг с другом. Минимальным приростом уровня гемоглобина в периферической крови для признания терапии эффективной является его увеличение более чем на 10 г/л за 1 мес (Центр по контролю и профилактике заболеваний в США) [39]. В нашем исследовании, проведенном при лечении 61 пациентки с гинекологической патологией и заболеваниями ЖКТ, у которых лечение привело к полному восстановлению показателей гемоглобина и обмена железа, прирост уровня гемоглобина в течение первого месяца составил от 10 до 50 г/л с медианой прироста 30 г/л [19]. Поэтому с учетом большого количества сопутствующих заболеваний у больных ЖДА и доказанной роли гепцидина в нарушении метаболизма железа за оптимальный критерий оценки эффективности терапии лучше принять прирост уровня гемоглобина более 10 г/л за 1 мес [5].
При отсутствии прироста уровня гемоглобина, согласно указанным критериям, необходимо обязательно исследовать обмен железа, провести диагностический поиск, исключить другой механизм развития анемии. При подтверждении абсолютного дефицита железа и отсутствии злокачественной опухоли следует перейти на парентеральное применение препаратов железа со строго рассчитанной терапевтической дозой. При назначении препаратов парентерально предпочтение следует отдавать внутривенному пути введения. Наиболее часто в настоящее время используются венофер (100 мг в 5 мл), космофер, феринъект (50 мг в 1 мл). За один раз, как правило, вводят 100—200 мг, но, используя феринъект, это количество можно увеличить до 1000 мг. Эти препараты должны применяться только при наличии показаний, доказанном абсолютном дефиците железа и невозможности перорального применения. Существенным недостатком парентерального применения является то, что необходимо использовать строго рассчитанное количество препарата, врач может назначать препараты только в условиях стационара, применение препаратов ограничено из-за наличия большого количества тяжелых побочных реакций (анафилактический шок, аллергические реакции, передозировка железа, системный гемосидероз, локальный гемосидероз тканей). Кроме того, как правило, есть ограничения парентерального применения препаратов при беременности, особенно в ранние сроки.
В случае отсутствия гипоферритинемии есть основания проводить лечение анемии с использованием препаратов рекомбинантного человеческого эритропоэтина, эффективность которого доказана при терапии ЖДА в поздние сроки беременности [28] и у больных с миомой матки [40, 41]. Такую тактику необходимо выбирать у больных с доказанными хроническими воспалительными или инфекционными заболеваниями, доброкачественными опухолями при наличии синдрома неадекватной степени тяжести анемии выработки эритропоэтина [5, 19, 28].
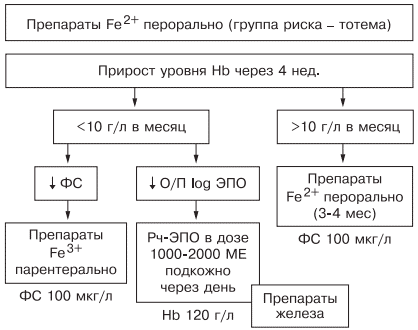
Таким образом, оптимальным у больных с наличием гипохромной микроцитарной анемии является выявление причины развития дефицита железа, после чего следует начинать лечение. Если есть сомнения в железодефицитном характере анемии, лучше проверить обмен железа, подтвердив диагноз ЖДА низкими показателями ФС и насыщения трансферрина железом. Далее следует устранить хроническое заболевание, остановить кровотечение, убрать погрешности в диете и начать пероральный прием препаратов железа (с обязательным учетом противопоказаний). Лечение следует начинать с двухвалентных препаратов железа. При наличии хронических воспалительных, пролиферативных, инфекционных заболеваний лучше использовать жидкую лекарственную форму (препарат тотема), содержащую в своем составе глюконат двухвалентного железа, медь и марганец. Через 1 мес следует определить прирост уровня гемоглобина и если он выше 10 г/л в месяц — продолжить лечение, если нет — пересмотреть диагноз (рис. 6).
Рис. 6. Схема лечения ЖДА.
При использовании препаратов железа необходимо ориентироваться на показатель ФС, целевое значение которого должно составлять около 100 мкг/л, после чего можно остановить лечение (поздние критерии эффективности терапии [39]). При пероральном приеме препаратов достаточно подтвердить нормализацию содержания ФС через 3 мес терапии, при назначении препаратов железа внутривенно этот показатель необходимо проверять каждую неделю. Лечение препаратами рекомбинантного человеческого эритропоэтина опасно из-за возможности развития эритроцитоза и тромботических осложнений, поэтому ориентироваться прежде всего необходимо на уровень гемоглобина, целевая концентрация которого не должна превышать 120 г/л [42].
Таким образом, ЖДА представляет собой важную социально значимую проблему, а ее диагностика и лечение до сих пор являются трудной задачей. Только выполнение современных рекомендаций позволит существенно повысить качество и эффективность оказания медицинской помощи больным ЖДА.
Сведения об авторах:
Российский университет дружбы народов, Москва
Кафедра госпитальной терапии с курсом клинической лабораторной диагностики Стуклов Николай Игоревич — д-р мед. наук, проф. кафедры; руководитель курса гематологии;
Семенова Елена Николаевна — учебный мастер кафедры.
источник
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2017
| МКБ-10 | |
| Код | Название |
| D50 | Железодефицитная анемия |
| D50.0 | Постгеморрагическая (хроническая) анемия |
| D50.8 | Другие железодефицитные анемии |
| D50.9 | Железодефицитная анемия неуточненная |
Дата разработки/пересмотра протокола: 2013 год (пересмотрен в 2017 г.)
Сокращения, используемые в протоколе:
(англ. Iron-refractory iron-deficiency anemia) железорефрактерная железодефицитная анемия
(англ. Mean corpuscular hemoglobin) – среднее содержание гемоглобина в эритроците в пг
(англ. Mean corpuscular volume) средний объем эритроцита в фл
сатурация трансферрина (англ. Transferrin Saturation) или коэффициент насыщение трансферрина железом
общая железосвязывающая способность сыворотки
растворимые рецепторы трансферрина
Пользователи протокола: врач общей практики, терапевт, гематолог, гинеколог, хирург, ревматолог, нефролог, пульмонолог, гастроэнтеролог, эндокринолог.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Классификация[1,3]:
Общепризнанной классификации ЖДА не существует.
Латентный дефицит железа, функциональный дефицит железа, анемия хронических заболеваний являются самостоятельными нозологическими формами в классификацию ЖДА не включены.
Наиболее часто используется классификация по степени тяжести и этиологическая классификация [1].
Классификация ЖДА по степени тяжести [3]:
Этиологическая классификация ЖДА (по Camaschella C., 2015 в модификации)[1]:
| Причина | Примеры |
| Повышенное потребление железа | Быстрый рост в подростковом периоде, менструальные кровопотери, беременность во втором и третьем триместрах, донорство крови |
| Недостаточное алиментарное поступление железа | Недостаточное алиментарное поступление железа вследствие недоедания, обусловленного социальными причинами, вегетарианства и др. |
| Нарушение абсорбции железа | Гастроэктомия, дуоденальный шунт, бариатрическая хирургия, целиакия, воспалительные заболевания кишечника, атрофический гастрит, глистная инвазия |
| Хронические кровопотери | Из желудочно-кишечного тракта: эзофагит, гастрит, язва желудка, язва двенадцатиперстной кишки, дивертикулез, опухоли желудочно-кишечного тракта, воспалительные заболевания кишечника, ангиодисплазия, геморрой, паразитоз, оккультные кровотечения Из половых и мочевыводящих путей: обильные и/или продолжительные менструации, внутрисосудистый гемолиз (в т.ч. при пароксизмальной ночной гемоглобинурии, аутоиммунной гемолитической анемии с холодовыми антителами, маршевая гемоглобинурия, микроангиопатический гемолиз, повреждение эритроцитов протезом клапанов) Системные кровотечения, включая геморрагическую телеангиоэктазию, хронический шистосомоз, синдром Мюнхгаузена |
| Связанные с лекарственными препаратами | Глюкокортикостероиды, салицилаты, нестероидные противовоспалительные, ингибиторы протонной помпы [4, 5] |
| Наследственные | IRIDA (мутация в гене TMPRSS6) и более редкие причины |
| Эритропоэз, ограниченный железом | Лечение с использованием эритропоэтинов анемии хронических заболеваний, хронической болезни почек |
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1-3]
Диагностические критерии
Жалобы и физикальное обследование:
Общеанемический синдром: слабость, повышенная утомляемость, головокружение, головные боли (чаще в вечернее время), одышка при физической нагрузке, ощущение сердцебиения, синкопальные состояния, мелькание «мушек» перед глазами при невысоком уровне артериального давления, часто наблюдается умеренное повышение температуры, нередко сонливость днем и плохое засыпание ночью, раздражительность, нервность, конфликтность, плаксивость, снижение памяти и внимания, ухудшение аппетита. Выраженность жалоб зависит от адаптации к анемии. Лучшей адаптации способствует медленный темп анемизации.
Сидеропенический синдром:
· изменение кожи и ее придатков (сухость, шелушение, легкое образование трещин, бледность). Волосы тусклые, ломкие, «секутся», рано седеют, усиленно выпадают, изменения ногтей: истончение, ломкость, поперечная исчерченность, иногда ложкообразная вогнутость (койлонихии).
· изменения слизистых оболочек (глоссит с атрофией сосочков, трещины в углах рта, ангулярный стоматит).
· изменения со стороны желудочно-кишечного тракта (атрофический гастрит, атрофия слизистой пищевода, дисфагия). Затруднение глотания сухой и твердой пищи.
· мышечная система. Миастения (вследствие ослабления сфинктеров появляются императивные позывы на мочеиспускание, невозможность удерживать мочу при смехе, кашле, иногда ночное недержание мочи у девочек). Следствием миастении могут быть и невынашивание беременности, осложнения в процессе беременности и родов (снижение сократительной способности миометрия).
· пристрастие к необычным запахам.
· извращение вкуса. Выражается в стремлении есть что-либо малосъедобное.
· склонность к тахикардии, гипотонии.
Лабораторные исследования:
Лабораторные исследования при подозрении на ЖДА могут включать помимо ОАК с ретикулоцитами и показателей обмена железа также исследование уровня витамина В12, фолиевой кислоты, биохимические показатели (общий белок, креатинин, мочевина, глюкоза крови, общий билирубин, прямой билирубин, трансаминазы) и другие исследования в зависимости от особенностей клинической картины и широты дифференциально-диагностического поиска. План исследований также может расширяться для уточнения причин железодефицита и исключения скрытых кровопотерь и проведения онкопоиска.
| № п/п | Лабораторный показатель | Референсный интервал (может меняться в зависимости от лаборатории) | Изменения при ЖДА |
| 1 | Морфологические изменения эритроцитов | нормоциты – 68% микроциты – 15,2% макроциты – 16,8% | Микроцитоз сочетается с анизоцитозом, пойкилоцитозом, в наличии анулоциты, плантоциты |
| 2 | Цветовой показатель | 0,86 -1,05 | Гипохромия показатель менее 0,86 |
| 3 | Содержание гемоглобина | Женщины – не менее 120 г/л Мужчины – не менее 130 г/л | Уменьшено |
| 4 | МСН | 27-31 пг | Менее 27 пг |
| 5 | МСНС | 33-37% | Менее 33 % |
| 6 | МСV | 80-100 фл | Снижен |
| 9 | Количество ретикулоцитов | 2-10:1000 | Не изменено |
| 11 | Железо сыворотки | Женщины – 12-25 мкмль/л Мужчины –13-30 мкмоль/л | Снижено |
| 12 | Общая железосвязывающая способность сыворотки крови | 30-85 мкмоль/л | Повышена |
| 13 | Латентная железосвязывающая способность сыворотки | Менее 47 мкмоль/л | Выше 47 мкмоль/л |
| 14 | Коэффициент насыщения трансферрина железом (TSat) | ≥16% | Уменьшено |
| 15 | Уровень ферритина * | 15-150 мкг/л | Уменьшение |
* — показатель информативен только при отсутствии признаков системного воспалительного ответа (например — при нормальном уровне СРБ)
Инструментальные исследования:
С целью выявления источников кровопотери, патологии других органов и систем, в том числе солидных опухолей:
· фиброгастродуоденоскопия по показаниям;
· рентгенологическое исследование органов ЖКТ по показаниям;
· рентгенологическое исследование органов грудной клетки по показаниям;
· фиброколоноскопия по показаниям;
· ректороманоскопия по показаниям;
· УЗИ органов малого таза по показаниям;
· УЗИ органов брюшной полости по показаниям;
Показания для консультации специалистов:
· консультация хирурга – для исключения кровотечения из желудочно-кишечного тракта;
· консультация гастроэнтеролога – при подозрении на мальабсорбцию или хронические кровопотери при патологии органов желудочно-кишечного тракта;
· консультация стоматолога – стоматологические проблемы, приводящие к анемии;
· консультация оториноларинголога – носовые кровотечения;
· консультация онколога – злокачественное поражение, которое является причиной кровотечения;
· консультация нефролога – исключение заболеваний почек при дифференциальной диагностике с анемией хронических заболеваний;
· консультация фтизиатра – кровотечение или вторичная анемия на фоне туберкулеза;
· консультация пульмонолога – кровопотери или вторичная анемия на фоне заболеваний бронхолегочной системы;
· консультация гинеколога – кровотечение из половых путей (ювенильные кровотечения, дисменореи и т.д.);
· консультация эндокринолога – снижение функции щитовидной железы, наличие диабетической нефропатии;
· консультация гематолога – для исключения заболеваний системы крови и при неэффективности ферротерапии у пациентов с верифицированным дефицитом железа;
· консультация проктолога – ректальные кровотечения;
· консультация инфекциониста – при наличии признаков гельминтоза или другого паразитоза, приводящего к анемии.
Диагностический алгоритм: см. Приложение 1
Дифференциальный диагноз и обоснование дополнительных исследований:
Железодефицитная анемия до получения результатов исследования обмена железа на основании ОАК требует проведения дифференциальной диагностики с другими гипохромными анемиями, вызванными нарушением синтеза гемоглобина. К ним относятся анемии, связанные с нарушением синтеза порфиринов (анемия при свинцовом отравлении, при врожденных нарушениях синтеза порфиринов), а также талассемии. Гипохромные анемии в отличие от железодефицитных анемий протекают с высоким содержанием железа в крови и депо, которое не используется для образования гема (сидероахрезия), при этих заболеваниях отсутствуют признаки тканевого дефицита железа. Дифференциальным признаком анемии, обусловленной нарушением синтеза порфиринов, является гипохромная анемия с базофильной пунктацией эритроцитов, ретикулоцитов, усиленным эритропоэзом в костном мозге с большим количеством сидеробластов. Для талассемии характерны мишеневидная форма и базофильная пунктация эритроцитов, ретикулоцитоз и наличие признаков повышенного гемолиза.
Верификация дефицита железа и ЖДА проводится только на основании лабораторных данных – снижения уровня гемоглобина, ферритина, сывороточного железа, TSat и др. в связи с чем дифференциальная диагностика с нозологиями, при которых не характерен дефицит железа (миелодиспластический синдром, апластическая анемия, витамин В12 дефицитная анемия, фолиеводефицитная анемия, гемолитические анемии) не вызывает затруднений.
В случаях, когда у пациента с анемией и лабораторно подтвержденным дефицитом железа со стороны системы крови выявляются симптомы или лабораторные изменения, которые не характерны для ЖДА, требуется дообследование у гематолога.
Дифференциальная диагностика при лабораторно подтвержденной ЖДА требуется с другими заболеваниями и состояниями при которых возможно развитие сидеропении [1].
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Основные критерии диагноза |
| Латентный дефицит железа | Характерно снижение уровня сывороточного железа | Сывороточное железо, мкмоль/л | ê |
| TSat, % | ≥16% | ||
| Ферритин, мкг/л | |||
| Гемоглобин, г/л | Норма | ||
| MCV [2] | ê или в норме | ||
| MCH [3] | ê или в норме | ||
| Дополнительно: | |||
| sTFR, мг/л | é | ||
| Содержание гемоглобина в ретикулоцитах, пг | |||
| Функциональный дефицит железа | Возможно снижение уровня сывороточного железа | Сывороточное железо, мкмоль/л | ê или в норме |
| TSat, % | ê или в норме | ||
| Ферритин, мкг/л | Норма | ||
| Гемоглобин, г/л | Норма | ||
| MCV | Норма | ||
| MCH | Норма | ||
| Дополнительно: | |||
| sTFR, мг/л | é | ||
| Содержание гемоглобина в ретикулоцитах, пг | |||
| Функциональный дефицит железа | Возможно снижение уровня сывороточного железа | Сывороточное железо, мкмоль/л | ê или в норме |
| TSat, % | ê или в норме | ||
| Ферритин, мкг/л | Норма | ||
| Гемоглобин, г/л | Норма | ||
| MCV | Норма | ||
| MCH | Норма | ||
| Дополнительно: | |||
| sTFR, мг/л | é | ||
| Содержание гемоглобина в ретикулоцитах, пг | |||
| IRIDA (ведущий признак – неэффективность ферротерапии) | Характерно снижение уровня сывороточного железа и TSat | Сывороточное железо, мкмоль/л | ê |
| TSat, % | |||
| Ферритин, мкг/л | вариабельно | ||
| Гемоглобин, г/л | ê | ||
| MCV | êê | ||
| MCH | êê | ||
| Дополнительно: | |||
| sTFR, мг/л | é | ||
| Содержание гемоглобина в ретикулоцитах, пг | ê | ||
| Анемия хронических заболеваний | Характерно снижение сывороточного железа | Сывороточное железо, мкмоль/л | ê |
| TSat, % | ê или в норме | ||
| Ферритин, мкг/л | >100 | ||
| Гемоглобин, г/л | ê | ||
| MCV | ê или в норме | ||
| MCH | ê или в норме | ||
| Дополнительно: | |||
| sTFR, мг/л | ê или в норме | ||
| Содержание гемоглобина в ретикулоцитах, пг | ê | ||
| ЖДА и анемия хронических заблеваний | Характерно снижение сывороточного железа | Сывороточное железо, мкмоль/л | ê |
| TSat, % | ê или в норме | ||
| Ферритин, мкг/л | |||
| Гемоглобин, г/л | ê | ||
| MCV | êê | ||
| MCH | êê | ||
| Дополнительно: | |||
| sTFR, мг/л | вариабельно | ||
| Содержание гемоглобина в ретикулоцитах, пг | ê | ||
| ЖДА | Характерно снижение сывороточного железа, TSat и ферритина | Сывороточное железо, мкмоль/л | ê |
| TSat, % | |||
| Ферритин, мкг/л | |||
| Гемоглобин, г/л | ê | ||
| MCV | ê | ||
| MCH | ê | ||
| Дополнительно: | |||
| sTFR, мг/л | é | ||
| Содержание гемоглобина в ретикулоцитах, пг | ê |
Получить консультацию по медтуризму
Получить консультацию по медтуризму
| Аскорбиновая кислота (Ascorbic acid) |
| Железа (III) гидроксид декстран (Ferric (III) hydroxide destrane) |
| Железа (III) гидроксид полимальтозат (Ferric (III) hydroxide polymaltosate) |
| Железа (III) гидроксид сахарозный комплекс (Ferric (III) hydroxide sacharose complex) |
| Железа глюконат (Ferrous gluconate) |
| Железа карбоксимальтозат (Ferric carboxymaltosate) |
| Железа сульфат (Ferric sulfate) |
| Железа фумарат (Ferrous fumarate) |
| Фолиевая кислота (Folic acid) |
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [6-16]
ЖДА является хроническим заболеванием, развитие которого требует времени, за которое успевают включиться механизмы адаптации и в большинстве случаев достигается компенсация. Пациенты сохраняют неплохое самочувствие и клинические проявления ЖДА минимальны. Поэтому лечение ЖДА должно проводиться амбулаторно. При использовании парентеральных препаратов железа возможна госпитализация в дневной стационар.
Лечебная программа при ЖДА включает:
· устранение этиологических факторов (лечение основного заболевания);
· лечебное питание (диета № 11);
· лечение железосодержащими препаратами;
· восполнение запасов железа (терапию насыщения).
· противорецидивную терапию.
Немедикаментозное лечение:
· Диета. При железодефицитной анемии больному показана диета, богатая железом. Железо из продуктов животного происхождения всасывается в кишечнике в значительно больших количествах, чем из растительных продуктов.
Медикаментозное лечение:
ЖДА не может быть успешно излечена в случае, если не устранена её причина. Основой патогенетической терапии ЖДА являются препараты железа. Трансфузии не заменяют ферротерапию. Ферротерапия может проводиться препаратами железа для приема внутрь и парентеральными препаратами.
Из парентеральных препаратов предпочтительнее использование внутривенных, т.к. введение внутримышечных болезненно, имеет вариабельную абсорбцию и может приводить к формированию инфильтратов.
Конечный результат терапии препаратами железа вне зависимости от пути введения одинаков – рост уровня гемоглобина. Отличия между различными препаратами с различными путями введения заключаются в переносимости лечения и темпах прироста уровня гемоглобина.
Препараты железа для приема внутрь
Основными принципами лечения ПЖ для приема внутрь являются следующие:
· назначение ПЖ с достаточным содержанием элементарного железа;
· нецелесообразность одновременного назначения витаминов группы В (в том числе В12), фолиевой кислоты без специальных показаний в связи с отсутствием доказательств преимуществ в эффективности и безопасности перед монокомпонентными препаратами, невозможностью отследить фармакокинетику препарата при наличии 3 и более компонентов в 1 таблетке;
· избегание назначения препаратов железа внутрь при наличии признаков нарушения всасывания в кишечнике;
· достаточная продолжительность насыщающего курса терапии (не менее 3 мес., может увеличиваться до 5-6 месяцев);
· необходимость проведения поддерживающей терапии ПЖ после нормализации показателей гемоглобина в соответствующих ситуациях.
Рекомендуемая суточная доза элементарного железа у большинства взрослых составляет 150-200 мг. [9] Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Например, таблетка железа сульфата массой 325 мг содержит 65 элементарного железа, три таблетки – 195 мг железа из которых может быть адсорбированно и утилизированно только 25 мг. [10]
Терапия препаратами железа для приема внутрь должна проводиться в течение 3х месяцев для восполнения запасов в депо. [9]
При пероральной ферротерапии наиболее распространены гастроинтестинальные побочные эффекты. Они включают металлический вкус, тошноту, диарею, запор, потемнение стула.
Для уменьшения выраженности побочных эффектов возможно уменьшение дозы (перевод на однократный прием, например) или увеличение интервала приёма, переход на прием другого препарата железа с меньшим содержанием элементарного железа, переход с таблеток на жидкие лекарственные формы, которые позволяют более просто подбирать переносимую дозу, отмена пероральных препаратов и назначение внутривенных.
Причины неэффективности терапии ПЖ для приема внутрь:
· отсутствие дефицита железа (неправильная трактовка природы гипохромной анемии и ошибочное назначение ПЖ);
· недостаточная дозировка ПЖ (недоучет количества трехвалентного железа в препарате);
· недостаточная длительность лечения ПЖ;
· нарушение всасывания ПЖ, назначаемых внутрь больным с соответствующей патологией;
· одновременный прием препаратов, нарушающих всасывание железа;
· наличие хронических (оккультных) кровопотерь, чаще всего из органов ЖКТ;
· сочетание ЖДА с другими анемическими синдромами (В12-дефицитной, фолиеводефицитной).
Парентеральные препараты железа.
Показания для назначения парентеральных препаратов железа [1, 11]:
· нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по методу Бильрот II с выключением двенадцатиперстной кишки);
· выраженные гастроинтестинальные побочные эффекты пероральной терапии, не устранимые другими способами;
· постоянные потери крови, при которых потребность в железе превышает физиологические возможности для всасывания железа (например, тяжелое маточное кровотечение, наследственная геморрагическая телеангиоэктазия с поражением слизистых оболочек);
· пожелание пациента о быстром (за 1-2 визита) восполнении дефицита железа и отказ от продолжительной многомесячной ферротерапии;
Кумулятивную дозу, необходимую для восстановления уровня гемоглобина в крови и восполнения запасов железа в организме, при внутривенном введении ПЖ вычисляют по формуле Ганзони:
*депо железа у человека с массой тела >35 кг и = 35 кг = 500 мг и
| Лекарственная группа (МНН) | Лекарственные средства | Способ применения | Уровень доказательности | |
| Монокомпонентные препараты железа B03A (код АТХ) | ||||
| Глюконат железа** | Глюконат железа* 300 мг | Пероральный прием по 2 таб. х 2-3 раза в день | III C | |
| Сульфат железа** B03AA07 | Сульфат железа табл. 256.3 мг (80 мг железа), Сульфат железа 325 мг (105 мг иона (II) железа (Fe 2+ )) | Пероральный прием по 1таб. х 2 раза в день | III C | |
| Фумарат железа** B03AA02 | Фумарат железа* (суспензия 3 гр) для детей, Железа фумарат 200 – таб. 200 мг (65 мг железа), Железа фумарат капс.300 мг (100 мг эл. Железа) | Пероральный прием: железа фумарат по 1таб. х 3 раза в день, по 1 капс. х 2-4 раза в день | III C | |
| Комбинированные препараты В03АА | ||||
| В03АА Железа (II) сульфат сухой + Аскорбиновая кислота 60 мг | Сульфат железа таб.320 мг+аскорбиновая кислота 60 мг | Пероральный прием, по 1 таб. х 1-2 раза в сутки | III C | |
| Фумарат железа, фолиевая кислота B03AD02 | Железа фумарат 163,56 мг (50 мг железа) и фолиевая кислота 540 мкг | Перорально по 1 капс. х 2 раза в сутки | III C | |
| Препараты железа (III) валентные | ||||
| Железа (III) гидроксид полимальтозат** | Железа (III) гидроксид полимальтозат 400 мг (100 мг эл.железа) Таб. 375 мг (100 мг эл.железа) | Пероральный прием по 1 жеват. таб. х 2-3 р в день | IIB | |
| Препараты железа для парентерального введения. | ||||
| Лекарственная группа (МНН) | Лекарственные средства | Способ применения | Уровень доказательности | |
| B03AC02 Железа оксида сахарат | Железо III гидроксид сахарозный комплекс 540 мг (железа 20 мг); | |||
Железа (III) гидроксида сахарозного комплекса 333,0 мг (эквивалентно элементарному железу) 20,0 мг
В/в медленно (0,2 мл/мин) в дозе 100–200 мг железа (2–4 мл), предпочтительно разведенного в 10–20 мл 0,9% раствора натрия хлорида или 5% раствора глюкозы. Начальная доза препарата составляет 25 мг железа или 0,5 мл раствора, которая вводится в/в медленно в течение 1–2 мин
в/в (внутривенно) капельно (инфузионно) 1000 мг железа 1 раз в неделю.
*применение препарата после регистрации на территории РК
**нет в КНФ
Хирургическое вмешательство:
Проводятся при продолжающихся кровотечениях на стационарном уровне.
Дальнейшее ведение:
· Для пациентов, получающих пероральную ферротерапию контрольные исследования ОАК следует проводить через 1-2 недели от начала лечения.
· При терапии парентеральными препаратами, особенно с однократным введением, контрольные исследования ОАК могут проводится через 4-8 недель от введения препарата.
· Пациенты с продолжающимися кровотечениями (например, с наследственной геморрагической телеангиоэктазией) нуждаются в более частом контроле.
NB! Причинами рецидива ЖДА могут быть недостаточная длительность приема пероральных препаратов, продолжающиеся потери крови, некорректный диагноз ЖДА, наличие дополнительных причин для развития анемии.
Индикаторы эффективности лечения: см. стационарный уровень.
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [7-9]
Тактика лечения аналогична амбулаторному уровню. При гемодинамической нестабильности может проводиться трансфузия эритроцитсодержащих компонентов крови.
Эритроцитсодержащие компоненты крови при ЖДА следует переливать только в случаях гемодинамической нестабильности (УД – С; см. ниже) и подобная практика не должна быть рутинной [7].
Критерии гемодинамической нестабильности (должны присутствовать все признаки) [8]:
· Систолическое артериальное давление менее 100 мм.рт.ст.;
· Изменения сознания;
· Одышка/тахипное;
Количество трансфузий нужно максимально ограничивать. Уровень гемоглобина не является определяющим для оценки показаний к трансфузиям и выбору тактики лечения, т.к. пациенты могут иметь разную степень адаптации к анемии и клинические проявления являются более значимыми.
· Перечень основных лекарственных средств (имеющих 100% вероятность применения) – см. Амбулаторный уровень;
· Перечень дополнительных лекарственных средств (менее 100% вероятности применения) – см. Амбулаторный уровень.
Хирургическое вмешательство:
Показаниями к хирургическому лечению является продолжающееся кровотечение, нарастание анемии, вследствие причин, которые не могут быть устранены путем медикаментозной терапии.
Дальнейшее ведение: см. Амбулаторный уровень.
Индикаторы эффективности лечения [9]:
· разрешение симптомов;
· ретикулоцитарный криз на 7-10 дни от начала терапии препаратами железа, может быть не выражен при анемии легкой степени;
· повышение уровня гемоглобина происходит как правило медленно, начиная с 1-2 недель лечения с последующим приростом примерно 20 г/л в течение последующих трех недель с нормализацией к 6-8 неделям от начала лечения;
· контролировать показатели обмена железа рекомендуется не ранее, чем 4 недели после завершения терапии. Терапия препаратами железа завершается, если показатели обмена железа (TSat и ферритин) нормализуются. В случае дискордантности между TSat и ферритином рекомендуется ориентироваться на первый показатель.
Госпитализация в круглосуточный стационар может проводиться только в исключительных случаях при наличии признаков гемодинамической нестабильности, обусловленной только подтверждённой ЖДА при исключении всех других причин гемодинамической нестабильности.
Показания для плановой госпитализации: нет.
Показания для экстренной госпитализации:
Экстренная госпитализация пациента с ЖДА показана только при наличии признаков гемодинамической нестабильности при исключении других причин гемодинамической нестабильности:
· при выявленном источнике кровотечения в зависимости от источника кровопотери в отделение хирургического профиля (хирургию, гинекологию, проктологию и т.д.);
· при отсутствии установленного кровотечения – госпитализация в терапевтическое отделение.
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2017
- 1) Camaschella C. Iron-Deficiency Anemia /N Engl J Med 2015; 372:1832-1843. 2) Peyrin-Biroulet L.,Williet N., Cacoub P. Guidelines on the diagnosis and treatment of iron deficiency across indications: a systematic review /Am J Clin Nutr doi: 10.3945/ajcn.114.103366. 3) Сельчук В.Ю. Чистяков С.С. Толокнов Б.О. и соавт. Железодефицитная анемия: современное состояние проблемы /РМЖ, 2012. №1:1. 4) Sarzynski E. I., Puttarajappa C., Xie Y., Grover M., Laird-Fick H. Association between proton pump inhibitor use and anemia: a retrospective cohort study // Dig Dis Sci. 2011, Aug; 56 (8): 2349–2353. 5) Dado DN, Loesch EB, Jaganathan SP A Case of Severe Iron Deficiency Anemia Associated with Long-Term Proton Pump Inhibitor Use Curr Ther Res Clin Exp. 2017 Jan 21;84:1-3. 6) Auerbach M, Ballard H, Glaspy J. Clinical update: intravenous iron for anaemia. Lancet 2007; 369:1502. 7) Red Blood Cell Transfusion: 2016 Clinical Practice Guidelines from the AABB (Journal of the American Medical Association; October 12, 2016. 8) San Luis Obispo County EMS Agency ALS Treatment Protocols 2007 [Rev. 11/1/10] 9) Schrier S., Auerbach M. Treatment of iron deficiency anemia in adults / www.uptodate.com, aug, 2017. 10) Schrier SL. So you know how to treat iron deficiency anemia. Blood 2015; 126:1971. 11) Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am Soc Hematol Educ Program. 2016 Dec;2016(1):57-66. 12) Rodgers GM, Auerbach M, Cella D, Chertow GM, Coyne DW, Glaspy JA, Henry DH High-molecular weight iron dextran: a wolf in sheep’s clothing? J Am Soc Nephrol. 2008;19(5):833 13) Administration of intravenous iron sucrose as a 2-minute push to CKD patients: a prospective evaluation of 2,297 injections.Macdougall IC, Roche A/Am J Kidney Dis. 2005;46(2):283. 14) Safety and efficacy of rapidly administered (one hour) one gram of low molecular weight iron dextran (INFeD) for the treatment of iron deficient anemia. Auerbach M, Pappadakis JA, Bahrain H, Auerbach SA, Ballard H, Dahl NV/Am J Hematol. 2011 Oct;86(10):860-2. Epub 2011 Aug 29. 15) Intravenous iron treatment in pregnancy: comparison of high-dose ferric carboxymaltose vs. iron sucrose. Christoph P, Schuller C, Studer H, Irion O, De Tejada BM, Surbek D/J Perinat Med. 2012;40(5):469. Epub 2012 May 13. 16) Intravenous ferric carboxymaltose compared with oral iron in the treatment of postpartum anemia: a randomized controlled trial. Van Wyck DB, Martens MG, Seid MH, Baker JB, Mangione A/Obstet Gynecol. 2007;110(2 Pt 1):267.
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
1) Пивоварова Ирина Алексеевна – председатель РОО «Казахстанское Общество врачей-гематологов» Республики Казахстан, Председатель Правления ТОО «Центр гематологии».
2) Загурская Елена Юрьевна – заместитель Председателя Правления ТОО «Центр гематологии».
3) Клодзинский Антон Анатольевич – кандидат медицинских наук, гематолог ТОО «Центр гематологии», медицинский советник, заместитель председателя РОО «Казахстанское Общество врачей – гематологов» Республики Казахстан.
4) Хан Олег Ромуальдович – ассистент кафедры внутренних болезней, гематолог РГП на ПХВ «Научно- исследовательский институт кардиологии и внутренних болезней».
5) Юхневич Екатерина Александровна – и.о. доцента кафедры клинической фармакологии и доказательной медицины РГП на ПХВ «Карагандинский государственный медицинский университет», клинический фармаколог
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Тургунова Людмила Геннадиевна – доктор медицинских наук, профессор, заведующая кафедрой терапевтических дисциплин факультета непрерывного профессионального развития, врач-гематолог РГП на ПХВ «Карагандинский государственный медицинский университет».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
источник