Абсолютно любой человек может услышать диагноз «анемия». Это серьезное заболевание, которое может развиваться совершенно по разным причинам и в силу различных обстоятельств. И потому все виды анемии классифицируются по разным признакам, а также по причинам, которые стали провокаторами развития патологического процесса. Только детальное изучение классификация по различным признакам поможет лучше понять суть такого заболевания, как анемия.
Знакомство с этим заболеванием лучше всего начинать с вопроса, какие бывают виды анемии. К основным видам относится четыре анемии, для которых будут характерны общие признаки заболевания. Основные виды прогрессируют за счет обширных кровотечений или нарушениями процесса создания кровяных телец. Основной и общий признак – усталость и учащенный сердечный ритм.
В таблице виды анемий. Здесь показаны основные причины, которые вызвали развитие заболевания.
| Вид анемии | Причина анемии |
| Постгеморрагическая | Острая и хроническая кровопотеря (ранения, кровотечения) |
| Гемолитическая | Усиленное разрушение эритроцитов |
| Дефицитная | Недостаток витаминов, железа или других элементов, необходимых для процесса кроветворения |
| Гипопластическая | Наиболее тяжелый вид, который связан с нарушением процесса кроветворения в костном мозгу |
Различают разновидности анемий по типу кроветворения. К ним относятся: нормобластическая анемия и мегалобластическая анемия. Также различают наследственные, приобретенные, аутоиммунные и смешанные анемии. Врожденные дизэритропоэтические анемии относятся к особой группе наследственной патологии, которая характеризуется неэффективным процессом образования кровяных телец.
Дифференциальная диагностика определяет следующие важнейшие разновидности, которые определяются по цветовому показателю:
- Нормохромия. К ней относится острая постгеморрагическая анемия, иногда гемолитическая (чаще приобретенная). Гипопластическая и апластическая анемии также являются нормохромными. Показатель равен 0,82 – 1, 05.
- Гипохромия. Гипохромной часто является жд анемия, а также большинство гемолитических анемий. Показатель этой разновидности будет меньше 0, 82.
- Гиперхромия. Происходит повышение цветового показателя – выше 1, 05. Такое явление наблюдается в случае увеличения среднего размера диаметра кровяных телец. Анемия, которая вызвана недостатком фолиевой кислоты (витамин В12), зачастую является гиперхромной.
Классификация анемий по воз (Всемирная организация здравоохранения) основывается на следующих показателях: снижение концентрации гемоглобина у мужчин – ниже 130г/л, у женщин – ниже 120 г/л, у беременных – ниже 110 г/л.
Существует принятая классификация анемии по степени тяжести, которая включает в себя легкую, среднюю и тяжелую степень. Классификация анемии по тяжести базируется на показателях уровня содержания гемоглобина и красных кровяных телец в крови. Тяжесть анемии определяется клиницистами, которые руководствуются принятой рабочей классификацией.
- Легкая анемия, а точнее легкая степень тяжести, определяется, когда уровень гемоглобина находится в пределах от 90-120 г/л.
- Анемия средней тяжести характеризуется уровнем гемоглобина от 70 до 90 г/л.
- Тяжелая степень анемии определяется, когда уровень гемоглобина в крови падает ниже 70 г/л.
Анемия 1 степени – это наиболее легкая патология, которая объединяет комплекс заболеваний. Прогрессирование происходит практически без каких-либо признаков, только в редких случаях пациент поступает с жалобами на усталость, слабость в мышцах, отсутствие аппетита.
Анемия 2 степени проявляется более ярко: пациенты жалуются на сильные головные боли, головокружение, предобморочные состояния. Дети со второй стадией плохо учатся, устают от малейшей нагрузки. Еще одни характерные признаки – сухая кожа, ранки возле рта и проблемы с пищеварительным трактом.
Анемия последней стадии протекает с серьезными изменениями: волосы и ногти становятся ломкими, тусклыми. Пациенты жалуются на изменение вкусовых предпочтений, появляется чувство онемения конечностей. При игнорировании третьей степени могут появиться достаточно серьезные и опасные последствия.
Первая степень анемического расстройства протекает достаточно легко и зачастую пациентам не требуется специального медикаментозного лечения. В большинстве случаев подбирается сбалансированный рацион и правильный режим дня. Остальные степени заболевания требует лечебной терапии.
Анемическое заболевание, которое было вызвано критическим недостатком железа в крови, называется железодефицитной анемией. Существует общепринятая классификация железодефицитной анемии по стадиям. В зависимости от того, насколько выражен недостаток этого элемента в организме человека, различают несколько стадий.
Анемия 1 стадии характеризуется дефицитом этого микроэлемента без каких-либо клинических проявлений (скрытая анемия, прелатентная). На этой стадии только происходит истощение железа. Определить наличие этой стадии невозможно без проведения лабораторных обследований.
Развернутая клинико-лабораторная картина железодефицитной анемии происходит на второй стадии, которая следует за первой при отсутствии адекватной лечебной терапии. Эта стадия характеризуется критически недостаточным поступлением железа в ткани организма. Картина симптоматика протекает следующим образом: изменение вкусовых пристрастий, слабость в мышцах, структурные изменения волос и ногтей, бледность кожных покровов.
Лабораторные показатели намного более выражены при этой стадии прогрессирования заболевания. Если на первой стадии происходит истощение запасов необходимого микроэлемента, то на второй стадии происходит уменьшение содержания сывороточного ферритина. На этой стадии чрезвычайно важно подобрать необходимое адекватное лечение, которое направлено на купирование симптоматики и причины, которая вызвала прогрессирование заболевания.
источник
Анемия — группа клинико-гематологических синдромов, общим моментом для которых является снижение концентрации гемоглобина в крови, чаще при одновременном уменьшении числа эритроцитов (или общего объёма эритроцитов).
В зависимости от пола и возраста норма показателя содержания гемоглобина в литре крови может отличаться.
Повышение гемоглобина отмечается при:
первичной и вторичной эритремии;
обезвоживании (ложный эффект за счёт гемоконцентрации);
чрезмерном курении (образование функционально неактивного HbСО).
Снижение гемоглобина выявляется при:
гипергидратации (ложный эффект за счёт гемодилюции — «разбавления» крови, увеличения объёма плазмы относительно объёма совокупности форменных элементов).
Анемии подразделяют на группы по различным признакам. Классификация анемий в основном основывается на удобстве, возможности эффективного её применения в клинической практике.
Цветовой показатель (ЦП) показывает степень насыщения эритроцита гемоглобином. В норме он равен 0,85—1,05. В зависимости от него различают такие анемии:
витамин B12-дефицитная анемия
В зависимости от выраженности снижения уровня гемоглобина выделяют три степени тяжести анемии:
Лёгкая — уровень гемоглобина ниже нормы, но выше 90 г/л;
Средняя — гемоглобин в пределах 90—70 г/л;
Тяжёлая — уровень гемоглобина менее 70 г/л.
По способности костного мозга к регенерации
Основным признаком такой регенерации является увеличение количества ретикулоцитов (молодых эритроцитов) в периферической крови. Норма — 0,5—2 %.
Арегенераторная (к примеру, апластическая анемия) — характерно отсутствие ретикулоцитов.
Гипорегенераторная (витамин B12-дефицитная анемия, железодефицитная анемия) — характерно количество ретикулоцитов ниже 0,5 %.
Норморегенераторная или регенераторная (постгеморрагическая) — количество ретикулоцитов в норме (0,5—2 %).
Гиперрегенераторная (гемолитические анемии) — количество ретикулоцитов более 2 %.
Основана на механизмах развития анемий как патологического процесса
Железодефицитные анемии — связаны с дефицитом железа
Дисгемопоэтические анемии — анемии, связанные с нарушением кровообразования в красном костном мозге
Постгеморрагические анемии — связанные с острой или хронической кровопотерей
Гемолитические анемии — связанные с повышенным разрушением эритроцитов
В12 — и фолиеводефицитные анемии
Различают три основных механизма развития анемии:
Анемия как следствие нарушения образования нормальных эритроцитов и синтеза гемоглобина. Такой механизм развития наблюдается в случае недостатка железа, витамина B12, фолиевой кислоты, во время заболеваний красного костного мозга. Иногда анемия возникает при приёме больших доз витамина С (витамин С в больших дозах блокирует действие витамина B12).
Анемия как следствие потери эритроцитов — является, главным образом, следствием острых кровотечений (травмы, операции). Следует отметить, что при хронических кровотечениях малого объёма причиной анемии является не столько потеря эритроцитов, сколько недостаток железа, который развивается на фоне хронической потери крови.
Анемия как следствие ускоренного разрушения эритроцитов крови. В норме длительность жизни эритроцитов составляет около 120 дней. В некоторых случаях (гемолитическая анемия, гемоглобинопатии и пр.) эритроциты разрушаются быстрее, что и становится причиной анемии. Иногда разрушению эритроцитов способствует употребление значительных количеств уксуса, вызывающего ускоренный распад эритроцитов.
Общие показатели крови, связанные с эритроцитами:
RBC — абсолютное содержание эритроцитов (норма 4,3—5,15 кл/л), содержащих гемоглобин, транспортирующих кислород и углекислый газ.
HGB — концентрация гемоглобина в цельной крови (норма 132—173 г/л). Для анализа используют цианидный комплекс или бесциандидные реактивы (как замена токсичному цианиду). Измеряется в молях или граммах на литр или децилитр.
HCT — гематокрит (норма 0,39—0,49), часть (% = л/л) от общего объёма крови, приходящаяся на форменные элементы крови. Кровь на 40—45 % состоит из форменных элементов (эритроцитов, тромбоцитов, лейкоцитов) и на 60—65 % из плазмы. Гематокрит это соотношение объёма форменных элементов к плазме крови. Считается, что гематокрит отражает соотношение объёма эритроцитов к объёму плазмы крови, так как в основном эритроциты составляют объём форменных элементов крови. Гематокрит зависит от количества RBC и значения MCV и соответствует произведению RBC*MCV.
Эритроцитарные индексы (MCV, MCH, MCHC):
MCV — средний объём эритроцита в кубических микрометрах (мкм) или фемтолитрах (фл)(норма 80—95 фл). В старых анализах указывали: микроцитоз, нормоцитоз, макроцитоз.
MCH — среднее содержание гемоглобина в отдельном эритроците в абсолютных единицах (норма 27—31 пг), пропорциональное отношению «гемоглобин/количество эритроцитов». Цветной показатель крови в старых анализах. ЦП=MCH*0.03
MCHC — средняя концентрация гемоглобина в эритроцитарной массе, а не в цельной крови (норма 300—380 г/л, отражает степень насыщения эритроцита гемоглобином. Снижение MCHC наблюдается при заболеваниях с нарушением синтеза гемоглобина. Тем не менее, это наиболее стабильный гематологический показатель. Любая неточность, связанная с определением гемоглобина, гематокрита, MCV, приводит к увеличению MCHC, поэтому этот параметр используется как индикатор ошибки прибора или ошибки, допущенной при подготовке пробы к исследованию.
источник
В.Ю. Сельчук, С.С. Чистяков, Б.О. Толокнов, Л.В. Манзюк, мгмсу М.П. Никулин, Т.В. Юрьева, П.В. Кононец, Г.В. Титова
МГМСУ
Реферат: обсуждаются вопросы современного лечения железодефицитных анемий, включая препарат для внутривенного введения — карбоксимальтозат железа, который быстро восстанавливает дефицит железа, не вызывает реакции гиперчувствительности, характерные для препаратов, содержащих декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.
Ключевые слова: железодефицитная анемия, лечение, карбоксимальтозат железа
Анемия — это клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в крови. Снижение содержания гемоглобина до уровня менее 120 г/л рассматривается как анемия [Aapro, 2008]. Самые разнообразные физиологические и патологические процессы могут служить основой развития анемических состояний, в связи с чем анемии в большинстве случаев рассматриваются как симптом, а не основное заболевание. Анемии наблюдаются при многих терапевтических, хирургических, онкологических и других заболеваниях. Различают железодефицитные, сидероахрестические (с избытком железа), В12— и фолиеводефицитные, гемолитические, анемии при костномозговой недостаточности, постгеморрагические, анемии, связанные с перераспределением железа, комбинированные анемии. Однако 80% всех анемий связано с дефицитом железа. Железо в организме человека участвует в регуляции обмена веществ, в процессах переноса кислорода, в тканевом дыхании и оказывает огромное влияние на состояние иммунологической резистентности.
Почти все железо в организме человека входит в состав различных белков и ферментов. Можно выделить две его основные формы: гемовое (входящее в состав гема — составной части гемоглобина и миоглобина) и негемовое. Железо гема мясных продуктов всасывается без участия соляной кислоты. Однако ахилия может в определенной мере способствовать развитию железодефицитной анемии (ЖДА) при наличии значительных потерь железа и высокой потребности в нем.
Всасывание железа осуществляется преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки. Степень всасывания железа зависит от потребности организма в нем. При выраженном дефиците железа всасывание его может происходить и в остальных отделах тонкого кишечника. При уменьшении потребности организма в железе происходит снижение скорости поступления его в плазму крови и увеличивается отложение в энтероцитах в виде ферритина, который элиминируется при физиологическом слущивании эпителиальных клеток кишечника. В крови железо циркулирует в комплексе с плазменным трансферрином. Этот белок синтезируется преимущественно в печени. Трансферрин захватывает железо из энтероцитов, а также из депо в печени и селезенке и переносит его к рецепторам на эритрокариоцитах костного мозга. В норме трансферрин насыщен железом приблизительно на 30%. Комплекс трансферрин-железо взаимодействует со специфическими рецепторами на мембране эритрокариоцитов и ретикулоцитов костного мозга, после чего путем эндоцитоза проникает в клетки, и железо переносится в их митохондрии, где включается в протопорфирин и таким образом участвует в образовании гема. Освободившийся от железа трансферрин неоднократно участвует в переносе железа. Количество железа, которое расходуется на эритропоэз, составляет 25 мг/сут., что значительно превышает возможности всасывания железа в кишечнике. В связи с этим для гемопоэза постоянно используется железо, освобождающееся при распаде эритроцитов в селезенке. Хранение (депонирование) железа осуществляется в депо в составе белков ферритина и гемосидерина.
Наиболее распространенная форма депонирования железа в организме — ферритин. Ферритин представляет собой водорастворимый гликопротеиновый комплекс, в центре которого расположено железо, покрытое белковой оболочкой из апоферритина. Каждая молекула ферритина содержит от 1000 до 3000 атомов железа. Ферритин определяется почти во всех органах и тканях, но наибольшее его количество обнаруживается в макрофагах печени, селезенки, костного мозга, эритроцитах, сыворотке крови, слизистой оболочке тонкой кишки. При нормальном балансе железа в организме устанавливается своеобразное равновесие между содержанием ферритина в плазме и депо (прежде всего в печени и селезенке). Уровень ферритина в крови отражает количество депонированного железа. Ферритин создает запасы железа в организме, которые могут быстро мобилизоваться при повышении потребности тканей в железе.
Другая форма депонирования железа — гемосидерин. Это малорастворимое производное ферритина с более высокой концентрацией железа, состоящее из агрегатов кристаллов железа, не имеющих апоферритиновой оболочки. Гемосидерин накапливается в макрофагах костного мозга, селезенки, купферовских клетках печени.
Общепринято выделять две формы железодефицитных состояний: латентный дефицит железа и ЖДА. Латентный дефицит железа характеризуется уменьшением количества железа в его депо и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов. ЖДА — гипохромная микроцитарная анемия, развивающаяся вследствие дефицита железа в сыворотке крови, костном мозге и депо — печени и селезенке. ЖДА возникает как правило, при хронической потере крови и (или) недостаточном поступлении железа в организм.
По данным Всемирной организации здравоохранения (ВОЗ), дефицит железа в организме человека является одним из наиболее распространенных дефицитов питательных веществ в организме человека во всем мире [Benoist B. et al., 2008; WHO, 2001]. Анемия относится к числу глобальных проблем современного здравоохранения. В мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения. Частота встречаемости анемии оказалась высокой во всех группах и составила 25,4-47,4% у детей дошкольного и школьного возраста, 41,8% — у беременных женщин, 30,2% — у небеременных женщин репродуктивного возраста, 23,9% — у пожилых людей и 12,7% — у мужчин.
Хотя среди взрослого населения анемия чаще всего развивалась у женщин во время беременности, тем не менее в популяции основную долю пациентов с анемией составляли небеременные женщины репродуктивного возраста (468 млн человек). По крайней мере в половине случаев причиной анемии служит дефицит железа [WHO, 2001], который может быть следствием хронической кровопотери (менструации, оккультные кровотечения при опухолях желудочно-кишечного тракта (ЖКТ), неспецифические и специфические воспалительные заболевания тонкой и толстой кишки, другие причины), недостаточного поступления железа с пищей или нарушения его усвояемости (например, при хроническом алкоголизме), повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), нарушения всасывания.
Дефицит железа бывает не только абсолютным, но и функциональным. Последний возникает, когда адекватное или даже повышенное общее содержание железа в организме оказывается недостаточным у больных при увеличении потребности в железе костного мозга на фоне стимуляции эритропоэза. Важную роль в регуляции обмена железа играет гепсидин — гормон, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа в кишечнике, а также его высвобождение из депо и макрофагов. Повышение уровня гепсидина, отмечающееся при воспалении, считают основной причиной анемии при хронических заболеваниях. Кроме того, уровень гепсидина повышается при хронической болезни почек, что способствует развитию нефрогенной анемии и резистентности к стимуляторам эритропоэза. При усилении эритропоэза под действием эритропоэтина скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга. Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа из гемосидерина требуется определенное время. В результате количество поступающего в костный мозг железа уменьшается, что вызывает развитие его функционального и абсолютного дефицита.
В соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) учитывают следующие формы анемий, связанных с абсолютным и относительным дефицитом железа:
Классификация, клиника и диагностика ЖДА
Общепризнанной классификации ЖДА не существует. Имеются клиническая классификация ЖДА и классификация по стадиям и тяжести протекания анемии.
Клиническая классификация ЖДА:
1. ЖДА постгеморрагические. Эту группу составляют анемии, развивающиеся на почве повторных небольших кровопотерь, — метроррагии, эпистаксис, гематурия и т.д.
2. ЖДА беременных. Причины возникновения анемий данной группы различны: дисбаланс питания беременных и связанное с этим ухудшение утилизации железа, передача организмом матери значительного его количества развивающемуся плоду, потери железа в период лактации и др.
3. ЖДА, связанные с патологией ЖКТ. К ним относятся анемии, возникающие после гастрэктомии, обширных резекций тонкой кишки, при различных энтеропатиях. По своей сути это ЖДА, обусловленные грубым, тяжелым нарушением функции всасывания железа -проксимальном отделе двенадцатиперстной кишки.
4. ЖДА вторичные, возникающие при инфекционных, воспалительных или опухолевых болезнях. Анемии в этих случаях развиваются вследствие больших потерь железа при гибели клеток опухолей, распаде тканей, микро- и даже макрогеморрагиях, повышении потребности в железе в очагах воспаления.
5. Эссенциальная (идиопатическая) ЖДА, при которой самый тщательный анамнестический и лабораторный поиск не выявляет общеизвестные причины возникновения дефицита железа. У большинства больных имеет место особая форма нарушения всасывания железа.
6. Ювенильная ЖДА — анемия, развивающаяся у молодых девушек (и чрезвычайно редко — у юношей). Данная форма железодефицитного малокровия связана с генетическими или фенотипическими дисгормональными явлениями.
7. ЖДА сложного генеза. В эту группу входят анемии алиментарные.
ЖДА также классифицируют по стадиям и тяжести протекания.
I стадия — потеря железа превышает его поступление, постепенное истощение запасов, всасывание в кишечнике компенсаторно увеличивается;
II стадия — истощение запасов железа (уровень сывороточного железа — ниже 50 мкг/л, насыщение трансферрина — ниже 16%) препятствует нормальному эритропоэзу, эритропоэз начинает падать;
III стадия — развитие анемии легкой степени (100-120 г/л гемоглобина, компенсированной), с незначительным снижением цветового показателя и других индексов насыщения эритроцитов гемоглобином;
IVстадия — выраженная (менее 100 г/л гемоглобина, субкомпенсированная) анемия с явным снижением насыщения эритроцитов гемоглобином;
Vстадия — тяжелая анемия (60-80 г/л гемоглобина) с циркуляторными нарушениями и тканевой гипоксией.
Клиническая картина ЖДА
Клиническими проявлениями ЖДА являются два важнейших синдрома — анемический и сидеропенический.
Анемический синдром обусловлен снижением содержания гемоглобина и уменьшением количества эритроцитов, недостаточным обеспечением тканей кислородом и представлен неспецифическими симптомами. Больные жалуются на общую слабость, повышенную утомляемость, снижение работоспособности, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиения, одышку при физической нагрузке, появление обморочных состояний. Может появляться снижение умственной работоспособности, ухудшение памяти, сонливость. Субъективные проявления анемического синдрома вначале беспокоят больных при физической нагрузке, а затем и в покое (по мере развития анемии).
При объективном исследовании обнаруживается бледность кожи и видимых слизистых оболочек, нередко — некоторая пастозность в области голеней, стоп, лица. Характерны утренние отеки — «мешки» вокруг глаз. Анемия обусловливает развитие синдрома миокардиодистрофии, который проявляется одышкой, тахикардией, часто аритмией, умеренным расширением границ сердца влево, глухостью тонов сердца, негромким систолическим шумом во всех аускультативных точках. При тяжелой и длительной анемии миокардиодистрофия может привести к выраженной недостаточности кровообращения. ЖДА развивается постепенно, поэтому организм больного адаптируется к низкому уровню гемоглобина, и субъективные проявления анемического синдрома не всегда бывают ярко выражены.
Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат-дегидрогеназа и др.). Сидеропенический синдром проявляется многочисленными симптомами, такими как:
Лабораторные данные
Диагностика латентного дефицита железа
Латентный дефицит железа диагностируется на основании следующих признаков:
Диагностика ЖДА
При снижении содержания гемоглобинового железа появляются характерные для ЖДА изменения общего анализа крови:
Наиболее часто используемыми в практике критериями ЖДА являются:
— низкий цветовой показатель;
— гипохромия эритроцитов, микроцитоз;
— снижение уровня сывороточного железа;
— повышение ОЖСС;
— снижение содержания ферритина в сыворотке.
При биохимическом исследовании крови, кроме снижения уровня сывороточного железа и ферритина, выявляются также изменения, обусловленные основным онкологическим или другим заболеванием.
Лечение
В настоящее время существует следующие этапы лечения ЖДА:
Не так давно гемотрансфузия являлась одним из самых распространенных способов коррекции анемии даже легкой степени у больных после операционной кровопотери и кровопотери при других клинических ситуациях (роды, маточные кровотечения, геморрой, опухоли ЖКТ и др.). Считалось, что надо остановить кровотечение и перелить донорскую кровь или эритроцитную массу. Необходимое для переливания количество эритроцитов определяли исходя из объема кровопотери и уровня гемоглобина. Однако ориентация на достижение нормального уровня гемоглобина иногда приводила к переливанию значительных количеств (до 5-6 л) донорской крови, что сопровождалось развитием синдрома массивной трансфузии, рецидивом кровотечения, появлением признаков полиорганной недостаточности с высокой смертностью.
В последнее время получила распространение новая трансфузионная тактика — компонентная гемотерапия, в связи с чем переливание эритроцитной массы заняло доминирующее место в лечении не только хронической, но и острой кровопотери. Однако отсутствие детально разработанных и сформулированных показаний к гемотерапии с учетом индивидуальных особенностей пациентов нередко приводит к необоснованным, неоправданным трансфузиям, которых, к сожалению, еще много. В современных условиях оправдана тенденция к ограничению переливания препаратов крови в связи с ростом числа таких осложнений, как перенос инфекций, формирование ложных групповых антител, подавление эндогенного эритропоэза.
Лечебная программа при ЖДА включает:
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев радикальное устранение причины ЖДА не представляется возможным, например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных и в некоторых других ситуациях. В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Путь введения препарата больному ЖДА определяется конкретной клинической ситуацией. При проведении купирующей терапии применяются пероральное и парентеральное введение препаратов железа (ПЖ) больному.
Первый путь — пероральный — является наиболее распространенным, хотя и дающим более отсроченные результаты.
Основными принципами лечения ПЖ для приема внутрь являются следующие:
— назначение ПЖ с достаточным содержанием трехвалентного железа;
— нецелесообразность одновременного назначения витаминов группы В (в том числе В12), фолиевой кислоты без специальных показаний;
— избегание назначения ПЖ внутрь при наличии признаков нарушения всасывания в кишечнике;
— достаточная продолжительность насыщающего курса терапии (не менее 3-5 мес.);
— необходимость проведения поддерживающей терапии ПЖ после нормализации показателей гемоглобина в соответствующих ситуациях.
Для адекватного прироста показателей гемоглобина у больных необходимо назначать от 100 до 300 мг трехвалентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Индивидуальные колебания в количестве необходимого железа обусловлены степенью его дефицита в организме, истощения запасов, скоростью эритропоэза, всасываемостью, переносимостью и некоторыми другими факторами. С учетом этого при выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но и, главным образом, на количество трехвалентного железа, которое только и всасывается в кишечнике.
Причины неэффективности терапии ПЖ для приема внутрь:
— отсутствие дефицита железа (неправильная трактовка природы гипохромной анемии и ошибочное назначение ПЖ);
— недостаточная дозировка ПЖ (недоучет количества трехвалентного железа в препарате);
— недостаточная длительность лечения ПЖ;
— нарушение всасывания ПЖ, назначаемых внутрь больным с соответствующей патологией;
— одновременный прием препаратов, нарушающих всасывание железа;
— наличие хронических (оккультных) кровопотерь, чаще всего из органов ЖКТ;
— сочетание ЖДА с другими анемическими синдромами (В12-дефицитной, фолиеводефицитной).
Второй путь введения ПЖ — парентеральное введение, которое может быть внутримышечным и внутривенным. Показаниями для применения ПЖ парентерально могут быть следующие клинические ситуации:
— нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по методу Бильрот II с выключением двенадцатиперстной кишки);
— обострение язвенной болезни желудка или двенадцатиперстной кишки;
— непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
— необходимость более быстрого насыщения организма железом, например, у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме. Лечение больных с ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, пожилые люди), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Общая ориентировочная доза ПЖ для внутримышечного введения, необходимая для коррекции дефицита железа и анемии, может быть рассчитана по формуле:
А = KxF (100 — 6 Х Hb) F = 0,0066,
где А — число ампул, К — масса больного в кг, НЬ — содержание гемоглобина в г %.
При парентеральном введении ПЖ возможны развитие флебитов, инфильтратов, потемнение кожи в местах инъекций, аллергических реакций, в том числе тяжелых (анафилактический шок). Внутримышечные инъекции болезненны, в некоторых случаях они ассоциировались с развитием саркомы ягодичной мышцы [Grasso P, 1973; Greenberg G., 1976]. По мнению некоторых авторов [Auerbach M. et al., 2007], от внутримышечного введения ПЖ следует отказаться.
В последнее время особенно большой интерес вызывают ПЖ для внутривенного введения с целью терапии постгеморрагических анемий. В нескольких работах показано, что внутривенное введение ПЖ более эффективно при сравнении с приемом железа внутрь при тех же показаниях. Помимо этого, внутривенная терапия позволяет избежать возникновения как побочных эффектов со стороны ЖКТ, наблюдающихся при приеме ПЖ внутрь, так и некоторых осложнений, вызываемых при внутримышечном введении ПЖ, однако требует определенного уровня реанимационной службы учреждения, в котором вводятся препараты.
ПЖ для внутривенного введения
Для внутривенного введения в России применяют карбоксимальтозат железа (Феринжект®), сахарат железа (Венофер), глюконат железа и декстран железа, которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии.
Внутривенное введение декстрана железа вызывает большое число анафилактических реакций, сопровождающихся летальностью в 13,5% случаев [Faich G. еt Strobos J., 1999], и в настоящее время применяется ограниченно. Применение натриевого комплекса глюконата железа в сукрозе вызывает значительно меньше осложнений и, как правило, не сопровождается смертельными исходами. Однако токсические эффекты, связанные с поступлением свободного железа в организм, существенно ограничивают применение препарата в ежедневной практике терапии ЖДА.
Сахарат железа (III) (Венофер®) является популярным препаратом для лечения синдрома ЖДА. Это связано с безопасностью и высокой переносимостью комплекса трехвалентного железа с сахаратом в отличие от декстрана железа и глюконата железа. Данный препарат одобрен для применения, в том числе и в период беременности. Венофер следует вводить только в учреждениях, располагающих оборудованием для сердечно-легочной реанимации, так как часто могут отмечаться сердечно-сосудистые осложнения в виде гипотонии. Максимальная разовая парентеральная доза сахарата железа (III) составляет 500 мг, предпочтительно развести препарат в 100 мл 0,9% раствора NaCl для введения в форме инфузии. Продолжительность инфузии составляет приблизительно 4,5 ч с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском развития гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 1-3 раза/нед. до повышения уровня гемоглобина >105 г/л. Затем пациента можно перевести на прием пероральных ПЖ для поддерживающей терапии. Оснований ожидать возможной передозировки железом не имеется.
Комплекс железа с карбоксимальтозой (Феринжект®) — новый недекстрановый комплекс железа, преимуществом которого является возможность введения высоких доз (до 1000 мг за 1 введение) в короткий промежуток времени (на 1 инфузию требуется 15 мин.). Благодаря этому отсутствует необходимость в дорогостоящих повторных инфузиях небольших доз железа, при этом Феринжект® характеризуется хорошей переносимостью. Феринжект® также одобрен для применения, в том числе и в период беременности. На сегодняшний день (как и в случае сахарата железа) не проводилось масштабных рандомизированных исследований для оценки безопасности применения данного препарата для плода. По этой причине перед назначением любых ПЖ внутривенно необходимо тщательно оценить соотношение пользы и рисков.
Эффективность и безопасность внутривенного введения ПЖ зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 ч после приема и не используется для эритропоэза. Хотя декстран железа обладает высокими молекулярной массой и стабильностью, его недостатком является повышенный риск развития аллергических реакций. Карбоксимальтозат железа сочетает в себе положительные свойства высокомолекулярных комплексов железа, но не вызывает реакции гиперчувствительности, наблюдающиеся при применении препаратов, содержащих декстран, и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе [Geisser P., 2009]. Схема оценки риска токсических эффектов и анафилактических реакций препаратов свободного железа для внутривенного введения представлена на рисунке 1 [С.В. Моисеев, 2012].
Рис. 1. Риск токсических эффектов и анафилактических реакций при применении внутривенных препаратов железа
Из рисунка 1 видно, что глюконат железа может вызывать анафилактические реакции и одновременно обладает выраженным токсическим эффектом. Декстран железа, не являясь препаратом с выраженными токсическими эффектами, способен вызывать анафилаксию. Сахарат железа не приводит к развитию анафилактических реакций у больных с ЖДА, но обладает токсическими свойствами. Карбоксимальтозат железа — Феринжект® характеризуется сниженным риском возникновения как токсических эффектов свободного железа, так и анафилактических реакций.
Применение карбоксимальтозата железа позволяет вводить за 1 инфузию до 1000 мг железа (внутривенно капельно в течение 15 мин.), в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 4,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Карбоксимальтозат железа отличается не только удобством применения, но и низкой токсичностью, а также отсутствием оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином.
Также, Феринжект® вводят внутривенно в виде болюса (максимальная доза — 4 мл, или 200 мг железа, не более 3 раз/нед.) или капельно (максимальная доза -20 мл, или 1000 мг железа, не чаще 1 раза/нед.). Перед началом лечения необходимо рассчитать оптимальную кумулятивную дозу препарата, которую не следует превышать. Кумулятивную дозу, необходимую для восстановления уровня гемоглобина в крови и восполнения запасов железа в организме, вычисляют по формуле Ганзони:
Кумулятивный дефицит железа (мг) = масса тела (кг) х (целевой НЬ — фактический НЬ) (г/дл) х 2,4 + содержание депонированного железа (мг), где целевой уровень гемоглобина (НЬ) у человека с массой тела или = 35 кг 15 г/дл (9,3 ммоль/л), соответственно, депо железа у человека с массой тела >35 кг и = 35 кг = 500 мг и ЛИТЕРАТУРА
1. Worldwide prevalence of anaemia 1993-2005. WHO global database of anaemia. Edited by de Benoist В. et al. World Health Organisation. 2008.
2. Iron deficiency anaemia: assessment, prevention, and control. A guide for programme managers. Geneva, WHO, 2001 (WH0/NHD/01.3).
3. Grasso P. Sarcoma after intramuscular iron injection // Br. Med. J. 1973. Vol. 2. Р. 667.
4. Greenberg G. Sarcoma after intramuscular iron injection // Br. Med. J. 1976. Vol. 1. Р. 1550-1550.
5. Auerbach M, Ballard H., Glaspy J. et al. Clinical update: intravenous iron for anaemia // Lancet. 2007. Vol. 369. Р. 1502-1504.
6. Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinjecf): structure/reactivity relationships of iron preparations // Port.. J. Nephrol. Hypert. 2009. Vol. 23 (1). Р. 11-16.
7. Моисеев С.В. Железа карбоксимальтозат (Феринжект) — новый внутривенный препарат для лечения железодефицитной анемии // Клиническая фармакология и терапия. 2012. № 21 (2). С. 2-7.
8. Faich G., Strobos J. //Am. J. Kidney Dis. 1999. Vol. 33. No. 3. P. 464-470.
9. Beshara S., Sorensen J., Lubberink M. et al. Pharmacokinetics and red cell utilization of 52Fe/59Fe-labelled iron polymaltose in anaemic patients using positron emission tomography// Br. J. Haematol. 2003. Vol. 120. Р. 853-859.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
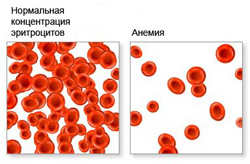
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
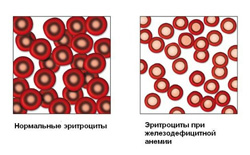
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
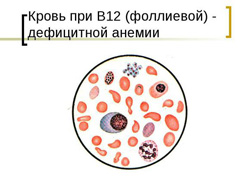
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
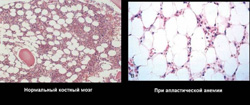
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник


