«КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ»; № 22(1); 2013; стр. 1-6.
В.Г.Авдеев, 1 С.В.Моисеев 1,2
Кафедра внутренних болезней факультета фундаментальной медицины МГУ им. М.В.Ломоносова
Кафедра терапии и профболезней Первого МГМУ им. И.М.Сеченова
Обсуждаются методы лечения анемии при болезни Крона. Для коррекции железодефицита у таких пациентов предпочтительно применение внутривенных препаратов железа, которые по эффективности и переносимости имеют преимущества перед пероральными железосодержащими средствами.
Ключевые слова. Болезнь Крона, анемия, железодефицит, внутривенные препараты железа, карбоксимальтозат железа.
The authors discuss etiology, mechanisms and treatment of anemia in patients with inflammatory bowel diseases (Crohn’s disease and ulcerative colitis). Because of extensive gastrointestinal adverse effects, and data showing that the use of oral iron in inflammatory bowel diseases may be associated with disease exacerbation, current guidelines suggest that iron supplementation in IBD should be administered intravenously.
Key words. Inflammatory boew disease, anemia, iron deficiency, intravenous iron, ferric carboxymaltose.
Анемия — это самое распространенное внекишечное проявление болезни Крона. Частота ее у больных воспалительными заболеваниями кишечника (ВЗК) варьируется от 16% у амбулаторных пациентов до 68% у госпитализированных больных [1]. По данным систематизированного обзора 19 исследований [2] в 70-80-х гг. прошлого века анемия встречалась примерно у 2/3 больных болезнью Крона, однако в последующем ее частота ее снизилась, вероятно, за счет улучшения результатов лечения основного заболевания и более частого применения препаратов железа. В самом крупном исследовании, опубликованном в 2005 году, частота анемии у 7200 пациентов с ВЗК составила 13% [3], однако в других недавно завершенных исследованиях она была существенно выше и достигала 29-60% [2]. Вариабельность этого показателя может отражать различия критериев диагностики анемии и особенности выборок пациентов. В отличие от других внекишечных проявлений болезни Крона исследователи не уделяют должного внимания изучению анемии, хотя она сопровождается различными симптомами, в том числе одышкой, утомляемостью, головной болью, тахикардией, головокружением, которые ухудшают трудоспособность пациентов и их качество жизни и могут быть причиной госпитализаций.
Механизмы развития анемии при болезни Крона
Основная причина анемии у больных болезнью Крона — дефицит железа, который может быть следствием скрытой кровопотери, нарушения всасывания и/или низкого потребления железа [4]. На втором месте среди причин снижения уровня гемоглобина находится анемия хронических заболеваний. Значительно реже встречаются другие формы анемии (В12- и фолиеводефицитная, гемолитическая, анемия, вызванная некоторыми лекарственными средствами, такими как месалазин, сульфасалазин и пуриновые аналоги).
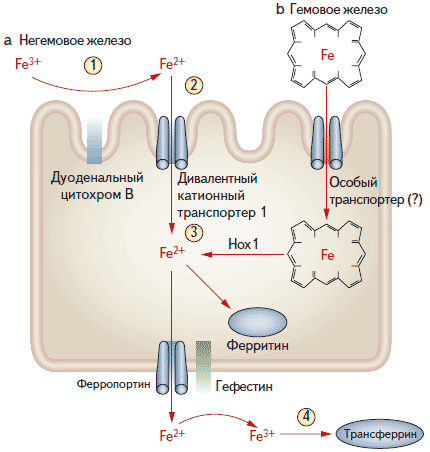
В норме запасы железа в организме человека (в основном в эритроцитах) составляют 3,5 г. В среднем ежедневно теряется 1-2 мг железа за счет десквамации эпителиальных клеток и кровопотери при менструации. Соответственно, у женщин потери железа выше и чаще развивается железодефицитная анемия. Запасы железа восполняются за счет его всасывания в тонкой кишке. С пищей железо поступает в виде гема (мясные продукты) и других белков и органических кислот (овощи). Всасывание железа, не входящего в состав гема, происходит в 4 этапа [4]. На первом этапе в кислом содержимом желудка из пищевых продуктов высвобождаются ионы Fe 3+ , которые превращаются в ионы Fe 2+ под действием соляной кислоты или дуоденального цитохрома В на апикальной мембране (соответственно, изменения слизистой оболочки двенадцатиперстной кишки приводят к ухудшению всасывания железа). Затем ионы Fe 2+ поступают в клетки слизистой оболочки с помощью дивалентного катионного транспортера, экспрессия которого увеличивается при дефиците железа. На третьем этапе внутри клетки часть железа связывается с ферритином и образует депо, в то время как другая часть поступает в кровь через ферропортин 1 на базолатеральной оболочке. При этом ионы Fe 2+ окисляются до Fe 3+ под действием гефестина, а также других оксидаз, таких как церулоплазмин. В плазме ионы Fe 3+ связываются с основным транспортным белком — трансферрином. Всасывание железа, входящего в состав гема, недостаточно изучено. Предполагается, что оно происходит с помощью специального транспортера. Внутри клетки железо высвобождается из порфирина под действием гемоксигеназы, а дальнейшие этапы его всасывания соответствуют описанным выше.
Рис. 1. Этапы связывания железа в кишечнике (объяснения см. в тексте)
Важную роль в регуляции обмена железа играет гепсидин — гормон, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа через мембрану) и подавляет всасывание железа в кишечнике и его освобождение из депо и макрофагов [5]. Экспрессия гепсидина увеличивается при инфекциях и воспалительных состояниях под действием провоспалительных цитокинов, прежде всего интерлейкина-6 [6]. Увеличение уровня гепсидина при воспалении, в том числе болезни Крона, — это один из основных механизмов развития анемии хронических заболеваний. Экспрессия гепсидина регулируется различными факторами, в частности костным морфогенетическим протеином 6 (BMP6) [7]. Поступление железа в энтероциты вызывает активацию экспрессии BMP6, которые поступает в печень и взаимодействует с рецепторами. Транслокация образующегося комплекса в ядро сопровождается активацией промотера гена HAMP и увеличением синтеза гепсидина.
Диагностика железодефицитной анемии
В соответствии с рекомендациями ВОЗ анемию диагностируют при снижении уровня гемоглобина ЛИТЕРАТУРА
1. Gisbert J., Gomollon F. Common misconceptions in the diagnosis and management of anemia in inflammatory bowel disease. Am. J. Gastroenterol., 2008, 103, 1299-1307.
2. Kullnigg S., Gasche C. Systemic review: managing anaemia in Crohn’s disease. Aliment. Pharmacol. Ther., 2006, 24, 1507-1523.
3. Ershler W., Chen K., Reyes E., Dubois R. Economic burden of patients with anemia in selected diseases. Value Health, 2005, 8, 629-638.
4. Stein J., Hartmann F., Dignas A. Diagnosis and management of iron deficiency anemia in patients with IBD. Nat. Rev. Gastroenterol. Hepatol., 2010, 7 (11), 599-610.
5. Collins, J., Wessling-Resnick M., Knutson M. Hepcidin regulation of iron transport. J. Nutr., 2008, 138, 2284-2288.
6. Wrighting D., Andrews N. Interleukin-6 induces hepcidin expression through STAT3. Blood, 2006, 108, 3204-3209.
7. Knutson M. Iron-sensing proteins that regulate hepcidin and enteric iron absorption. Annu. Rev. Nutr., 2010, 30, 149-171.
8. Gasche C., Berstad A., Befrits R. et al. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm. Bowel Dis., 2007, 13 (12), 1545-1553.
9. Козловская Л.В., Рамеев В.В., Саркисова И.А. Патогенез и клиническое значение анемии хронических заболеваний. Анемия, 2005, 4, 4-10.
10. Thomas C., Thomas L. Biochemical markers and hematologic indices in the diagnosis of functional iron deficiency. Clin. Chem., 2002, 48, 1066-1076.
11. Mast A., Blinder M., Dietzen D. Reticulocyte hemoglobin content. Am. J. Hematol., 2008, 83, 307-310.
12. Auerbach M., Ballard H., Glaspy J. et al. Clinical update: intravenous iron for anaemia. Lancet, 2007, 369, 1502-1504.
13. Zhu A., Kaneshiro M., Kaunitz J. Evaluation and treatment of iron deficiency anemia: a gastroenterological perspective. Dig. Dis. Sci., 2010, 55, 548-559.
14. Rimon E. et al. Are we giving too much iron? Low-dose iron therapy is effective in octogenarians. Am. J. Med., 2005, 118, 1142-1147.
15. Ganzoni A. Intravenous iron-dextran: therapeutic and experimental possibilities [German]. Schweiz. Med. Wochenschr., 1970, 100, 301-303.
16. Semrin G., Fishman D., Bousvaros A. et al. Impaired intestinal iron absorption in Crohn’s disease correlates with disease activity and markers of inflammation. Inflamm. Bowel Dis., 2006, 12, 1101-1106.
17. Aghdassi E., Carrier J., Cullen J. et al. Effect of iron supplementation on oxidative stress and intestinal inflammation in rats with acute colitis. Dig. Dis. Sci., 2001, 46, 1088-1094.
18. Erichsen K., Ulvik R., Nysaeter G. et al. Oral ferrous fumarate or intravenous iron sucrose for patients with inflammatory bowel disease. Scand. J. Gastroenterol., 2005, 40 (9), 1058-1065.
19. Моисеев С.В. Железа карбоксимальтозат (Феринжект) — новый внутривенный препарат для лечения. Клин. фармакол. тер., 2012, 21 (2), 48-53.
20. Geisser Р. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations. Port. J. Nephrol. Hypert., 2009, 23 (1), 11-16.
21. Kulnigg S., Stoinov S., Simanenkov V. et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT®) randomized controlled trial. Am. J. Gastroenterol., 2007, 103 (5), 1182-1192.
22. Evstatiev R., Marteau P., Iqbal T. et al.; FERGI Study Group. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology, 2011, 141 (3), 846-853.
23. Evstatiev R., Alexeeva O., Bokemeyer B. et al.; FERGI Study Group. Ferric carboxymaltose prevents recurrence of anemia in patients with inflammatory bowel disease. Clin. Gastroenterol. Hepatol., 2012, Oct 16. pii: S1542-3565( 12)01212-8. [Epub ahead of print].
24. Gasche C, Dejaco C, Waldhoer T, Tillinger W, Reinisch W, Fueger GF, Gangl A., Lochs H. Intravenous iron and erythropoietin for anemia associated with Crohn disease. A randomized, controlled trial. Ann. Intern. Med., 1997, 126 (10), 782-787.
25. Koutroubakis I., Karmiris K., Makreas S. et al. Effectiveness of darbepoetin-alfa in combination with intravenous iron sucrose in patients with inflammatory bowel disease and refractory anaemia: a pilot study. Eur. J. Gastroenterol. Hepatol., 2006, 18 (4), 421-425.
источник
Анемии являются довольно частым вторичным синдромом при гастроэнтерологических заболеваниях. Основными видами анемий, выявляемых у гастроэнтерологических больных, являются: железодефицитная анемия (ЖДА), анемия хронических заболеваний (АХЗ), гемолитическа
Анемии являются довольно частым вторичным синдромом при гастроэнтерологических заболеваниях. Основными видами анемий, выявляемых у гастроэнтерологических больных, являются: железодефицитная анемия (ЖДА), анемия хронических заболеваний (АХЗ), гемолитическая анемия, В12— и фолиеводефицитная анемия, гипо-, апластические анемии.
ЖДА — наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Второй по распространенности после ЖДА в детской гастроэнтерологии является АХЗ, которая отличается достаточными запасами железа в организме, но снижением насыщения им трансферрина, сниженным или нормальным уровнем сывороточного железа. Причина развития АХЗ заключается в действии провоспалительных цитокинов (интерлейкина 1-альфа и интерлейкина 1-бета, фактора некроза опухоли альфа, гамма-интерферона и др.).
Воспалительные заболевания кишечника
Воспалительные заболевания кишечника (ВЗК), прежде всего, неспецифический язвенный колит (НЯК) и болезнь Крона (БК), часто сопровождаются развитием анемии. Частота анемии при ВЗК, по данным литературы, достаточно вариабельна и колеблется от 6% до 74% [17]. В большинстве исследований это значение составляет 35–50% [9, 12, 13, 19, 25, 27]. С несколько большей частотой анемия выявляется у больных НЯК. Так, S.?Schreiber и соавт. [26] сообщили о наличии анемии у 25% больных с БК и 37% больных с НЯК.
В развитии анемии при ВЗК всегда играют роль несколько механизмов. Условно можно выделить следующие группы причин возникновения анемии при ВЗК [2, 4, 7, 13, 17, 18, 20]:
Наиболее часто у больных ВЗК комбинируются АХЗ и железодефицитная анемия [1, 4, 17, 18], однако роль других факторов тоже велика и выраженность анемии может усиливаться вследствие повторных эпизодов кровотечения, дефицита витаминов и нутриентов, влияния лекарственных препаратов.
Анемия хронических заболеваний была впервые описана Maxwell Wintrobe и George Cartwright в 1949 году. Основными критериями ее диагностики являются снижение уровня сывороточного железа и насыщения трансферрина железом при сохранных запасах железа в ретикулоэндотелиальной ткани (нормальный уровень ферритина).
Успехи в расшифровке основных механизмов АХЗ привели к повышенному вниманию к этому виду анемии, в том числе и в педиатрии. Установлено, что на долю АХЗ приходится около 10–20% всех анемий.
На сегодняшний день главным звеном в патогенезе АХЗ считается гиперпродукция провоспалительных цитокинов. Они приводят к угнетению синтеза эритропоэтина и значительно снижают его эффекты, направленные на усиление пролиферации и созревания эритроидных предшественников [1–4, 13].
Нарушение метаболизма железа при АХЗ во многом опосредовано экспрессией гепсидина. Гепсидин — это белок острой фазы воспаления, который синтезируется печенью в ответ на воздействие липополисахаридов бактерий и интерлейкина 6. Гепсидин снижает всасывание железа в двенадцатиперстной кишке, блокирует высвобождение железа из макрофагов и снижает способность красного костного мозга его усваивать. Недостаточное поступление железа в эритроидные клетки приводит к нарушению их созревания и снижению синтеза гема [3, 14].
Участие провоспалительных цитокинов в генезе АХЗ при ВЗК обусловлено как прямым их ингибирующим действием (в первую очередь, гамма-интерферона) на созревание эритроидных клеток и усилением процессов апоптоза, так и опосредованными эффектами: подавлением синтеза эритропоэтина, снижением чувствительности к нему эритроидных клеток, активацией синтеза гепсидина и нарушением утилизации железа, а также усилением свободно-радикальных реакций [5, 10, 14].
В течение последних двадцати лет в отделении гастроэнтерологии Российской детской клинической больницы (РДКБ) наблюдалось 155 пациентов с НЯК и 61 пациент с БК. Анемия выявлялась у 35% детей с НЯК и имела железодефицитный характер, обусловленный преимущественно хронической кровопотерей. В 69% случаев анемия была легкой степени, в 27% — среднетяжелой, а в 4% — тяжелой. Тяжесть анемии в значительной степени зависела от обширности поражения толстой кишки и выраженности язвенного процесса.
Снижение уровня гемоглобина (110 г/л ≤ Hb
А. В. Малкоч*, кандидат медицинских наук
С. В. Бельмер*, доктор медицинских наук, профессор
Н. А. Анастасевич*
Е. В. Семенова*
Л. М. Карпина**
Н. Е. Щиголева**
И. А. Матина**
А. П. Пономарева**
*РГМУ, **Российская детская клиническая больница, Москва
источник
Железодефицитная анемия – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности, опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни пациентов.
Выделяют три глобальные причины развития дефицита железа в организме:
- Недостаточное поступление с пищей или повышенная потребность.
- Нарушение всасывания железа в кишечнике.
- Хронические потери крови.
Заболевания желудочно-кишечного тракта являются одной из основных причин развития железодефицитной анемии, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний часто выступают болезни верхних отделов желудочно-кишечного тракта и толстой кишки.
Одной из важных причин развития железодефицитной анемии является нарушение процессов всасывания железа в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Различные заболевания тонкой кишки, сопровождающиеся синдромом мальабсорбции (энтерит, амилоидоз, целиакея, идеопатическая стеаторея), а также оперативные вмешательства на желудке и тонкой кишке (состояние после тотальной гастроэктомии, субтотальной резекции желудка, ваготомии с гастроэктомией, резекция тонкой кишки) приводят к развитию дефицита железа.
Накапливаются данные о потенциальной связи инфекции H. pylory с железодефицитной анемией, которая может быть следствием скрытых кровотечений при эрозивном гастрите и язвенной болезни, нарушение всасывания железа при хеликобактерном атрофическом пангастрите, а также снижения содержания аскорбиновой кислоты в желудке и конкурентного захвата и утилизации железа самой бактерией. Таким образом, эрадикация H. pylory может стать еще одним подходом к лечению железодефицитной анемии в отсутствии других явных ее причин.
Этиологическим фактором анемии может стать прием нестероидных противовоспалительных препаратов (НПВП). Врачам хорошо известна возможность как массивных, так и скрытых кровотечений из эрозий и язв желудка и двенадцатиперстной кишки при НПВП-гастропатии. Однако, железодефицитная анемия может быть следствием НПВП-энтеропатии, другими клиническими проявлениями которой могут служить гипоальбуминемия, мальабсорбция и наличие измененной крови в кале.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией железодефицитной анемии, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энетропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз).
Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит и болезнь Крона, часто сопровождаются развитием анемии. Ведущими механизмами при этом выступают кровопотеря у пациентов с язвенным колитом и болезнью Крона, а также мальабсорбция при вовлечении в процесс тощей и подвздошной кишки при болезни Крона.
Ведущей причиной анемии при патологии нижних отделов желудочно-кишечного тракта, особенно у пациентов старше 50 лет, служит колоректальный рак. Хроническая кровопотеря наблюдается при полипах толстой кишки, дивертикулезе, ишемическом колите, геморрое и анальных трещинах.
Анемический синдром часто делает необходимым тщательное обследование желудочно-кишечного тракта. Для уточнения вида анемии проводят исследования общего и биохимического анализа крови.
Среди причин железодефицитной анемии (почти 30-50% всех случаев) прежде всего рассматривают острые или хронические кровопотери из желудочно-кишечного тракта.
Причины железодефицитной анемии
Как показали результаты открытого мультицентрового исследования, проведенного в Украине в 2008 году и базировавшиеся на анализе 1299 историй болезней больных железодефицитной анемией, основной причиной развития были эрозивно-язвенные поражения пищевого канала (44,58%) и заболевания, сопровождающиеся синдромом мальабсорбции. Циррозы печени являлись причиной железодефицитной анемии в 10,39% случаев, воспалительные заболевания кишечника – 4,54% больных.
Диагностируется железодефицитная анемия у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т.д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей.
Диагностика анемии основывается, главным образом, на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина.
| Причина | Примерное количество расходуемого железа |
| Увеличение объема циркулирующей крови и количества эритроцитов | 500 мг |
| Железо, передаваемое плоду | 300 мг |
| Железо, входящее в состав плаценты | 200 мг |
| Кровопотеря во время родов и в послеродовом периоде | 50 – 150 мг |
| Железо, теряемое с грудным молоком за весь период кормления | 400 – 500 мг |
Организм ребенка получает от матери все необходимые питательные вещества, в том числе и железо. Однако при наличии определенных заболеваний у матери или плода, возможно рождение ребенка с дефицитом железа.
Причиной врожденного дефицита железа в организме может быть:
- тяжелая железодефицитная анемия у матери;
- многоплодная беременность;
- недоношенность.
В любом из вышеперечисленных случаев концентрация железа в крови новорожденного значительно ниже нормы, и симптомы железодефицитной анемии могут проявляться уже с первых недель жизни.
Всасывание железа в двенадцатиперстной кишке возможно лишь при нормальном функциональном состоянии слизистой оболочки данного отдела кишечника. Различные заболевания желудочно-кишечного тракта могу повреждать слизистую оболочку и значительно снижать скорость поступления железа в организм.
К уменьшению всасывания железа в двенадцатиперстной кишке может привести:
- Энтерит – воспаление слизистой оболочки тонкого кишечника.
- Целиакия – наследственное заболевание, характеризующееся непереносимостью белка глютена и связанным с этим нарушением всасывания в тонком кишечнике.
- Helicobacter Pylori – инфекционный агент, поражающий слизистую оболочку желудка, что, в конечном итоге, приводит к уменьшению секреции соляной кислоты и нарушению всасывания железа.
- Атрофический гастрит – заболевание, связанное с атрофией (уменьшением размеров и функции) слизистой оболочки желудка.
- Аутоиммунный гастрит – заболевание, вызванное нарушением работы иммунной системы и выработкой антител к собственным клеткам слизистой оболочки желудка с последующим их разрушением.
- Удаление желудка и/или тонкой кишки – при этом уменьшается как количество образуемой соляной кислоты, так и функциональная площадь двенадцатиперстной кишки, где происходит всасывание железа.
- Болезнь Крона –аутоиммунное заболевание, проявляющееся воспалительным поражением слизистой оболочки всех отделов кишечника и, возможно, желудка.
- Муковисцидоз – наследственное заболевание, проявляющееся нарушением секреции всех желез организма, в том числе слизистой оболочки желудка.
- Рак желудка или двенадцатиперстной кишки.
Нарушение образования данного транспортного белка может быть связано с различными наследственными заболеваниями. Симптомов дефицита железа у новорожденного не будет, так как он получал данный микроэлемент из организма матери. После рождения основным способом поступления железа в организм ребенка является всасывание в кишечнике, однако из-за недостатка трансферрина всосавшееся железо не может быть доставлено к органам-депо и к красному костному мозгу и не может использоваться в синтезе эритроцитов.
Так как трансферрин синтезируется только в клетках печени, различные ее поражения (цирроз, гепатиты и другие) также могут привести к уменьшению концентрации данного белка в плазме и развитию симптомов железодефицитной анемии.
Одноразовая потеря большого количества крови обычно не приводит к развитию железодефицитной анемии, так как запасов железа в организме достаточно, чтобы возместить потери. В то же время при хронических, длительных, часто незаметных внутренних кровотечениях организм человека может терять по несколько миллиграмм железа ежедневно, на протяжении нескольких недель или даже месяцев.
Причиной хронической кровопотери может быть:
- язва желудка или двенадцатиперстной кишки;
- геморрой;
- неспецифический язвенный колит (воспаление слизистой толстого кишечника);
- болезнь Крона;
- полипоз кишечника;
- распадающиеся опухоли желудочно-кишечного тракта (и другой локализации);
- грыжа пищеводного отверстия диафрагмы;
- эндометриоз (разрастание клеток внутреннего слоя стенки матки);
- системная красная волчанка;
- системный васкулит (воспаление кровеносных сосудов различной локализации);
- сдача крови донорами более 4 раз в год (300 мл донорской крови содержат около 150 мг железа).
Если причина кровопотери не будет своевременно выявлена и устранена, высока вероятность развития железодефицитной анемии у больного, так как всасывающееся в кишечнике железо способно лишь покрывать физиологические потребности в данном микроэлементе.
Длительное и частое употребление алкоголя приводит к повреждению слизистой оболочки желудка, что связано, в первую очередь, с агрессивным воздействием этилового спирта, входящего в состав всех алкогольных напитков. Кроме того, этиловый спирт непосредственно угнетает кроветворение в красном костном мозге, что также может усиливать проявления анемии.
Прием некоторых лекарственных препаратов может нарушать процессы всасывания и утилизации железа в организме. Обычно это происходит при длительном приеме больших доз медикаментов.
Препаратами, которые могут вызвать дефицит железа в организме, являются:
- Нестероидные противовоспалительные средства (аспирин и другие). Механизм действия данных препаратов связан с улучшением текучести крови, что может привести к появлению хронических внутренних кровотечений. Кроме того, они способствуют развитию язвы желудка.
- Антациды (Ренни, Алмагель). Данная группа препаратов нейтрализует или уменьшает скорость выделения желудочного сока, содержащего соляную кислоту, необходимую для нормального всасывания железа.
- Железосвязывающие препараты (Десферал, Эксиджад). Данные препараты обладают способностью связывать и выводить из организма железо, причем как свободное, так и входящее в состав трансферрина и ферритина. В случае передозировки возможно развитие железодефицитного состояния.
Во избежание развития железодефицитной анемии принимать данные препараты следует только по назначению врача, строго соблюдая дозировку и длительность использования.
Симптомы данного заболевания обусловлены, недостатком железа в организме и нарушением кроветворения в красном костном мозге. Стоит отметить, что дефицит железа развивается постепенно, поэтому в начале заболевания симптоматика может быть довольно скудной. Латентный (скрытый) дефицит железа в организме может привести к появлению симптомов сидеропенического (железодефицитного) синдрома. Несколько позже развивается анемический синдром, тяжесть которого обусловлена уровнем гемоглобина и эритроцитов в организме, а также скоростью развития анемии (чем быстрее она развивается, тем выраженнее будут клинические проявления), компенсаторными возможностями организма (у детей и пожилых людей они менее развиты) и наличием сопутствующих заболеваний.
Проявлениями железодефицитной анемии являются:
- мышечная слабость;
- повышенная утомляемость;
- одышка;
- учащенное сердцебиение;
- изменения кожи и ее придатков (волос, ногтей);
- поражение слизистых оболочек;
- поражение языка;
- нарушение вкуса и обоняния;
- склонность к инфекционным заболеваниям;
- нарушения интеллектуального развития.
Железо входит в состав миоглобина – основного белка мышечных волокон. При его недостатке нарушаются процессы мышечного сокращения, что будет проявляться мышечной слабостью и постепенным уменьшением мышц в объеме (атрофией). Кроме того, для работы мышц постоянно необходимо большое количество энергии, которая может образовываться только при адекватной доставке кислорода. Данный процесс нарушается при уменьшении концентрации гемоглобина и эритроцитов в крови, что проявляется общей слабостью и непереносимостью физических нагрузок. Люди быстро утомляются при выполнении повседневной работы (подъема по лестнице, походе на работу и так далее), и это может существенно снижать качество их жизни. Дети с железодефицитной анемией характеризуются малоподвижным образом жизни, предпочитают «сидячие» игры.
Увеличение частоты дыхания и сердечных сокращений возникает при развитии гипоксии и является компенсаторной реакцией организма, направленной на улучшение кровоснабжения и доставки кислорода к различным органам и тканям. Это может сопровождаться чувством нехватки воздуха, болями за грудиной, (возникающими при недостаточном поступлении кислорода к сердечной мышце), а в тяжелых случаях — головокружениями и потерей сознания (из-за нарушения кровоснабжения головного мозга).
Как говорилось ранее, железо входит в состав множества ферментов, участвующих в процессах клеточного дыхания и деления. Дефицит данного микроэлемента приводит к повреждению кожи — она становится сухой, менее эластичной, шелушится и трескается. Кроме того, привычный красный или розоватый оттенок слизистым оболочками и коже придают эритроциты, которые находятся в капиллярах данных органов и содержат оксигенированный гемоглобин. При снижении его концентрации в крови, а также в результате уменьшения образования эритроцитов, может отмечаться бледность кожных покровов.
Волосы истончаются, теряют привычный блеск, становятся менее прочными, легко ломаются и выпадают. Рано появляется седина.
Поражение ногтей является весьма специфичным проявлением железодефицитной анемии. Они истончаются, приобретают матовый оттенок, расслаиваются и легко ломаются. Характерной является поперечная исчерченность ногтей. При выраженном дефиците железа может развиться койлонихия – края ногтей приподымаются и изгибаются в обратную сторону, приобретая ложкообразную форму.
Слизистые оболочки относятся к тканям, в которых процессы клеточного деления происходят максимально интенсивно. Вот почему их поражение является одним из первых проявлений дефицита железа в организме.
При железодефицитной анемии поражается:
- Слизистая оболочка полости рта. Она становится сухой, бледной, появляются участки атрофии. Затрудняется процесс пережевывания и проглатывания пищи. Также характерно наличие трещин на губах, образование заед в углах рта (хейлоз). В тяжелых случаях изменяется цвет и снижается прочность зубной эмали.
- Слизистая оболочка желудка и кишечника. В нормальных условиях слизистая оболочка данных органов играет важную роль в процессе всасывания пищи, а также содержит в себе множество желез, вырабатывающих желудочный сок, слизь и другие вещества. При ее атрофии (вызванной дефицитом железа) нарушается пищеварение, что может проявляться диареей или запорами, болями в животе, а также нарушением всасывания различных питательных веществ.
- Слизистая оболочка дыхательных путей. Поражение гортани и трахеи может проявляться першением, чувством наличия инородного тела в горле, что будет сопровождаться непродуктивным (сухим, без мокроты) кашлем. Кроме того, слизистая оболочка дыхательных путей в норме выполняет защитную функцию, предотвращая попадание чужеродных микроорганизмов и химических веществ в легкие. При ее атрофии повышается риск развития бронхита, пневмонии и других инфекционных заболеваний органов дыхания.
- Слизистая оболочка мочеполовой системы.Нарушение ее функции может проявляться болями при мочеиспускании и во время полового акта, недержанием мочи (чаще у детей), а также частыми инфекционными заболеваниями в пораженной области.
Изменения языка являются характерным проявлением дефицита железа. В результате атрофических изменений в его слизистой оболочке больной может ощущать боль, чувство жжения и распирания. Изменяется и внешний вид языка — исчезают видимые в норме сосочки (которые содержат большое количество вкусовых рецепторов), язык становится гладким, покрывается трещинами, могут появляться зоны покраснения неправильной формы («географический язык»).
Как уже говорилось, слизистая оболочка языка богата вкусовыми рецепторами, расположенными преимущественно в сосочках. При их атрофии могут появляться различные вкусовые нарушения, начиная со снижения аппетита и непереносимости некоторых видов продуктов (обычно кислой и соленой пищи), и заканчивая извращением вкуса, пристрастием к поеданию земли, глины, сырого мяса и других несъедобных вещей.
Нарушения обоняния могут проявляться обонятельными галлюцинациями (ощущением запахов, которых на самом деле нет) либо пристрастием к непривычным запахам (лака, краски, бензина и другим).
Склонность к инфекционным заболеваниям
Железо входит в состав ряда ферментов головного мозга (тирозингидроксилазы, моноаминоксидазы и других). Нарушение их образования приводит к нарушению памяти, концентрации внимания и интеллектуального развития. На поздних стадиях при развитии анемии интеллектуальные нарушения усугубляются ввиду недостаточного снабжения головного мозга кислородом.
Врач любой специальности может заподозрить наличие анемии у человека, основываясь на внешних проявлениях данного заболевания. Однако установлением вида анемии, выявлением ее причины и назначением соответствующего лечения должен заниматься врач-гематолог. В процессе диагностики он может назначить целый ряд дополнительных лабораторных и инструментальных исследований, а при необходимости привлечь специалистов из других областей медицины.
Важно отметить, что лечение железодефицитной анемии будет неэффективным, если не выявить и не устранить причину ее возникновения.
В диагностике железодефицитной анемии применяется:
Первое, что должен сделать врач при подозрении на железодефицитную анемию – это тщательно опросить и обследовать пациента.
Врач может задать следующий вопросы:
- Когда и в какой последовательности начали появляться симптомы заболевания?
- Как быстро они развивались?
- Имеются ли схожие симптомы у членов семьи или ближайших родственников?
- Как питается пациент?
- Страдает ли пациент какими-либо хроническими заболеваниями?
- Каково отношение к алкоголю?
- Принимал ли пациент какие-либо медикаменты в течение последних месяцев?
- Если больна беременная женщина – уточняется срок беременности, наличие и исход предыдущих беременностей, принимает ли она препараты железа.
- Если болен ребенок – уточняется его масса при рождении, родился ли он доношенным, принимала ли мать препараты железа во время беременности.
Во время обследования врач оценивает:
- Характер питания – по степени выраженности подкожно-жировой клетчатки.
- Цвет кожи и видимых слизистых оболочек – особое внимание уделяется слизистой полости рта и языку.
- Придатки кожи – волосы, ногти.
- Мышечную силу – врач просит пациента сжать свою руку или использует специальный прибор (динамометр).
- Артериальное давление – оно может быть снижено.
- Вкус и обоняние.
Это первый анализ, назначаемый всем пациентам при подозрении на анемию. Он позволяет подтвердить или опровергнуть наличие анемии, а также дает косвенную информацию о состоянии кроветворения в красном костном мозге.
Кровь для общего анализа может браться из пальца или из вены. Первый вариант более подходит в том случае, если общий анализ является единственным лабораторным исследованием, назначенным пациенту (когда достаточно небольшого количества крови). Перед взятием крови кожу пальца всегда обрабатывают ватой, смоченной в 70% спирте, чтобы избежать занесения инфекции. Прокол производится специальной одноразовой иглой (скарификатором) на глубину 2 – 3 мм. Кровотечение в данном случае несильное и полностью останавливается практически сразу после взятия крови.
В том случае, если планируется выполнять сразу несколько исследований (например, общий и биохимический анализ) – берут венозную кровь, так как ее легче получить в больших количествах. Перед забором крови на среднюю треть плеча накладывается резиновый жгут, что приводит к наполнению вен кровью и облегчает определение их местоположения под кожей. Место прокола также должно быть обработано спиртовым раствором, после чего медсестра одноразовым шприцем прокалывает вену и набирает кровь для анализа.
Полученную одним из описанных методов кровь направляют в лабораторию, где она исследуется в гематологическом анализаторе – современном высокоточном приборе, имеющемся в большинстве лабораторий мира. Часть полученной крови окрашивают специальными красителями и исследуют в световом микроскопе, что позволяет визуально оценить форму эритроцитов, их строение, а при отсутствии или неисправности гематологического анализатора – произвести подсчет всех клеточных элементов крови.
При железодефицитной анемии мазок периферической крови характеризуется:
- Пойкилоцитозом – наличием в мазке эритроцитов различных форм.
- Микроцитозом – преобладанием эритроцитов, размер которых меньше нормы (могут встречаться и нормальные эритроциты).
- Гипохромией – цвет эритроцитов изменяется с ярко-красного на бледно-розовый.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при железодефицитной анемии |
| Концентрация эритроцитов (RBC) | При истощении запасов железа в организме нарушается эритропоэз в красном костном мозге, ввиду чего общая концентрация эритроцитов в крови будет снижена. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Средний объем эритроцита (MCV) | При дефиците железа нарушаются процессы образования гемоглобина, в результате чего уменьшается размер самих эритроцитов. Гематологический анализатор позволяет максимально точно определить данный показатель. | 75 – 100 кубических микрометров (мкм 3 ). | Менее 70 мкм 3 . |
| Концентрация тромбоцитов (PLT) | Тромбоциты – клеточные элементы крови, отвечающие за остановку кровотечений. Изменение их концентрации может наблюдаться в том случае, если дефицит железа вызван хронической кровопотерей, что приведет к компенсаторному увеличению их образования в костном мозге. | 180 – 320 х 10 9 /л. | В норме или увеличена. |
| Концентрация лейкоцитов (WBC) | При развитии инфекционных осложнений концентрация лейкоцитов может значительно повышаться. | 4,0 – 9,0 х 10 9 /л. | В норме или увеличена. |
| Концентрация ретикулоцитов (RET) | В нормальных условиях естественным ответом организма на анемию является увеличение скорости образования эритроцитов в красном костном мозге. Однако при дефиците железа развитие данной компенсаторной реакции невозможно, ввиду чего снижается количество ретикулоцитов в крови. | М: 0,24 – 1,7%. | Уменьшена либо находится на нижней границе нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | Как уже говорилось, дефицит железа приводит к нарушению образования гемоглобина. Чем дольше длится заболевание, тем ниже будет данный показатель. | М: 130 – 170 г/л. | Менее 120 г/л. |
| Ж: 120 – 150 г/л. | Менее 110 г/л. | ||
| Среднее содержание гемоглобина в одном эритроците (MCH) | Данный показатель более точно характеризует нарушение образования гемоглобина. | 27 – 33 пикограмм (пг). | Менее 24 пг. |
| Гематокрит (Hct) | Данный показатель отображает количество клеточных элементов по отношению к объему плазмы. Так как основное большинство клеток крови представлено эритроцитами, уменьшение их количества приведет к снижению гематокрита. | М: 42 – 50%. | Менее 40%. |
| Ж: 38 – 47%. | Менее 35%. | ||
| Цветовой показатель (ЦП) | Цветовой показатель определяется путем пропускания через взвесь эритроцитов световой волны определенной длины, которая поглощается исключительно гемоглобином. Чем меньше будет концентрация данного комплекса в крови, тем ниже будет значение цветового показателя. | 0,85 – 1,05. | Менее 0,8. |
| Скорость оседания эритроцитов (СОЭ) | Все клетки крови, а также эндотелий (внутренняя поверхность) сосудов, имеют отрицательный заряд. Они отталкиваются друг от друга, что способствует поддержанию эритроцитов во взвешенном состоянии. При уменьшении концентрации эритроцитов расстояние между ними увеличивается, и сила отталкивания уменьшается, в результате чего они будут оседать на дно пробирки быстрее, чем в нормальных условиях. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
В ходе данного исследования удается установить концентрацию различных химических веществ, находящихся в крови. Это дает информацию о состоянии внутренних органов (печени, почек, костного мозга и других), а также позволяет выявить множество заболеваний.
Существует несколько десятков биохимических показателей, определяемых в крови. В данном разделе будут описаны только те из них, которые имеют значение в диагностике железодефицитной анемии.
источник