Анемия – обширное заболевание с недостаточностью железа. Апластическая анемия – малокровие, которое развивается вследствие заболевания костного мозга. А именно – прекращения функционирования костного мозга.
Причина кроется в поражении систем организма различного происхождения. Сюда входит:
Какова же симптоматика апластической анемии? Симптомы разнообразны. В основном клиника напоминает любую другую анемию. К симптомам можно отнести:
— бледность слизистых оболочек;
В конечной стадии наблюдаются некрозы и сепсис.
Для более подробной информации зайдите на сайт: bolit.info
В любом случае проконсультируйтесь с врачом!
Апластическую анемию можно предупредить. Профилактика будет заключаться в постоянном медицинском наблюдении. Если вас беспокоят симптомы, напоминающие анемию. Срочно обратитесь к специалисту!
Проходите чаще лабораторные методы исследования крови! Анализ крови наиболее подробно покажет присутствующую патологию. Это поможет вовремя сменить профессию. Если условия труда неблагоприятны для работы.
Неспецифическая профилактика будет заключаться в изоляции с очага облучения. Как известно данный очаг неблагоприятно сказывается на здоровье организма. Особенно, если это касается костного мозга.
Прежде всего, врач должен обратить внимание на жалобы пациента. Диагностика будет заключаться на основе субъективных и объективных данных. Осмотр специалиста включает в себя образования на коже. А именно – кровоизлияния.
Затем собирается анамнез. То есть наследственные данные. Были ли случаи заболевания среди родственников. Также как давно пациента беспокоят данные симптомы. Есть ли вредные привычки.
Важным компонентом диагностики будет исследование крови. Лабораторные анализы покажут нам пониженное количество эритроцитов и снижение уровня гемоглобина.
Анализ мочи будет свидетельствовать о воспалительном процессе и кровоточивости. Можно отнести еще исследование костного мозга. В данном случае проводится пункция кости.
Апластическая анемия – явление достаточно редкое. У взрослых данное заболевание развивается остро с рецидивами и осложнениями. Апластической анемии подвержены одинаково, и женщины, и мужчины. Чаще молодого возраста.
Если своевременно начать лечение, то шансы есть. В чем же заключается лечение данного заболевания? Лечение будет заключаться в гемотрансфузии. То есть переливание крови и ее компонентов. А именно – эритроцитарная масса.
Хлористый кальций тоже используется в лечении. Витамин А, фолиевая кислота. Антибиотики – пенициллин и стрептомицин. Длительный курс лечения гормонами. К ним относят преднизалон и кортикозон.
Апластическая анемия у детей протекает не так тяжело, как у взрослых. С чем это может быть связано. Чаще у детей данное заболевание возникает как следствие вируса. А именно – дети, перенесшие вирусную инфекцию. Наследственные факторы тоже имеют место при заболевании. По статистике, вирусная инфекция – гепатит становится причиной апластической анемии. У детей осложнения наблюдаются реже. Диагностика будет заключаться в исследовании мочи и крови. А также анамнез и осмотр.
Лечение данного заболевания будет заключаться в приеме антибиотиков по возрастным показаниям. Симптоматическое лечение показано в любом возрасте. Конечной точкой будет пересадка костного мозга, но при условии необратимых осложнений.
Прогноз будет зависеть от своевременности лечения. Чем раньше начали лечение, тем лучше прогноз! Известно, что почти 90% больных погибают от апластической анемии. Данный факт опирается на своевременность лечения.
Если проведено трансплантация костного мозга, то шансов выжить гораздо больше. Все зависит от конкретного человека. Ну и, конечно же, от грамотного специалиста. Правильной диагностики данного заболевания.
Если прогноз неблагоприятный, то рассчитывать на хороший исход не придется. Все чаще не леченные вовремя болезни приводят к летальному исходу. Апластическая анемия – не исключение!
Если вы хотите сохранить жизнь себе и близким, то обращайтесь к врачу. Осложнения, которые вызваны данным заболеваниям все чаще приводят к смерти.
Инсульт, кома, хронические заболевания – неблагоприятный исход апластической анемии. Известно, что эти болезни не приведут к счастливой и долгой жизни!
У людей вовремя не вылеченных от данной болезни продолжительность жизни резко сокращается! По статистике в течение одно года погибает большее количество больных.
При трансплантации костного мозга выживаемость значительно возрастает. На четыре года больше. Примерно у 10 из 11 больных.
Если человеку вовремя провели лечебный курс, то выживаемость повышается. Больной может прожить и семь, и восемь лет. Поэтому не откладывайте визит к врачу! Будьте более внимательными к своему здоровью!
источник

Можно даже сказать, что это целая группа патологических состояний, которые представляют собой самостоятельную форму заболевания. При апластической анемии костный мозг перестает производить клетки крови в необходимом количестве: лейкоциты, тромбоциты и эритроциты. Различные виды болезни протекают по-разному, некоторые из них дают о себе знать сразу, а остальные проявляются только через время.
Тяжелая апластическая анемия требует обязательной госпитализации, так как она угрожает жизни больного. Критерии тяжелой формы заболевания заключаются в резком понижении уровня тромбоцитов в крови (менее 500/мкл), при этом также отмечается снижение нейтрофилов. Сверхтяжелая форма апластической анемии характеризуется критическим понижением нейтрофилов до 200/мкл.
Апластическая анемия у детей развивается в нескольких формах, которые характеризуются развитием определенных признаков. Самой тяжелой из них считается анемия Фанкони, при которой присутствуют врожденные дефекты развития костей, пороки сердца и почек.
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины.
Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения.
В настоящее время заболевание с названием «апластическая анемия» выделяют как самостоятельную нозологическую единицу — и чётко разграничивают его от синдрома гипоплазии кроветворения, являющегося проявлением ряда известных самостоятельных заболеваний костного мозга.
Многих интересует вопрос, что такое апластическая анемия и почему она появляется? К сожалению, современная медицина не может назвать очевидные причины развития апластической анемии у человека. Но известно, что болезнь бывает приобретённая и наследственная.
Существует теория, что развитие патологии связано с особенностями функционирования организма каждого индивида. Тем не менее отмечаются некоторые факторы, которые могут спровоцировать появление болезни. В частности, самым ясным из факторов является воздействие на человека ионизирующей радиации, которая подавляет функции костного мозга и приводит к снижению выработки им эритроцитов, тромбоцитов и лейкоцитов. Также к предрасполагающим факторам можно отнести следующие:
- плохая экологическая ситуация в регионе;
- регулярные контакты человека с вредными химическими веществами;
- некоторые инфекционные патологии, в частности, гепатит, цитомегаловирусная инфекция;
- проблемы с костным мозгом;
- приём некоторых медикаментов, в том числе обычных жаропонижающих и обезболивающих средств типа аспирина;
- частый приём антибиотиков, особенно левомицетина.
Обнаружено, что болезнь наблюдают у пациентов с чрезмерной тягой к алкоголю. Не последнюю роль в развитии болезни играет и генетическая предрасположенность. Апластическая анемия у детей часто развивается вследствие наследственных патологий, в том числе этом может быть анемия Фанкони. Необходимо отметить, что зачастую у детей диагностируется идиопатическая апластическая анемия – то есть патология с неясной этиологией.
Что касается такой патологии, как гипопластическая апластическая анемия – то это ещё более тяжёлая патология, вызывающая серьёзные нарушения в работе всех внутренних органов и приводящая к нарушению работоспособности систем организма.
Также следует сказать, что апластическая анемия бывает трёх форм тяжести:
- очень тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренная (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
Все симптомы апластической анемии объединяются в 3 основных группы синдромов: анемический синдром, геморрагический синдром, синдром инфекционных осложнений.
Анемический синдром характеризуется:
- выраженной общей слабостью;
- быстрой утомляемостью;
- непереносимостью привычных физических нагрузок;
- одышкой и тахикардией при умеренных нагрузках, в тяжелых случаях – в покое, при перемене положения тела;
- головными болями, головокружением, эпизодами обморока;
- шумом, звоном в ушах;
- чувством «несвежей головы»;
- мельканием «мушек», пятен, цветных полос перед глазами;
- болями колющего характера в области сердца;
- снижением концентрации;
- нарушением режима «сон – бодрствование» (сонливость днем, бессонница ночью).
Объективно при обследовании пациентов устанавливаются бледность кожных покровов и видимых слизистых оболочек, приглушенность тонов сердца, учащение пульса, снижение артериального давления.
Выделяют два пика заболеваемости: в 10–25 лет и после 60 лет. Чаще болеют женщины.
Геморрагический синдром проявляется:
- гематомами (синяками) разного размера и точечными кровоизлияниями, возникающими на коже и слизистых оболочках после незначительного воздействия или спонтанно, без причин;
- кровоточивостью десен;
- кровотечением из носа;
- у женщин – маточными межменструальными кровотечениями, длительными обильными менструациями;
- розовым окрашиванием мочи;
- определением следов крови в испражнениях;
- возможными массивными желудочно-кишечными кровотечениями;
- кровоизлияниями в склеру и глазное дно;
- кровоизлияниями в головной мозг и его оболочки;
- легочными кровотечениями.
Объективное подтверждение геморрагического синдрома – точечные кровоизлияния и кровоподтеки на коже и слизистых, множественные гематомы на разных стадиях (от пурпурно-фиолетовых до желтых).
Инфекционные осложнения представлены развивающимися пневмониями, пиелонефритами, фурункулезами, постинъекционными абсцессами или инфильтратами, в тяжелых случаях – сепсисом.
В детском возрасте чаще наблюдается врожденная патология, передаваемая от родителей либо приобретенная в период внутриутробного развития. Некоторые признаки такой патологии можно определить даже у новорожденного, другие могут проявиться только через несколько лет. К числу тяжелых симптомов анемии у новорожденных относятся:
- аномалии строения лица (треугольное лицо, маленькие глаза, курносый нос и др.);
- аномалии конечностей (отсутствие большого пальца на руках, отсутствие лучевой кости, шестипалость и др.);
- низкорослость;
- особенности пигментации кожи – это скопления множественных пятен светло-коричневого цвета;
- аномалии внутренних органов, чаще мочеполовой системы;
- деформация и разрушение ногтей;
- отставание в умственном развитии;
Апластическая анемия у детей старше 1 года первоначально определяется по внешнему виду, поведению. Больные дети отличаются от сверстников бледностью кожных покровов и слизистых оболочек, у них наблюдается увеличение размеров лимфатических узлов, случаются частые кровотечения из носа, десен, по утрам появляется кровь в моче. Их поведение характеризуется частой сменой настроения, раздражительностью, они быстро утомляются, теряют аппетит.
Гематологическое обследование включает внимательный клинический осмотр и проведение специальных диагностических исследований: общего и биохимического анализа крови, стернальной пункции, трепанобиопсии. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия.
Для гемограммы при апластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Исследование пунктата костного мозга показывает уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности; в трепанобиоптате обнаруживается замещение красного костного мозга жировым (желтым). В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Апластическая анемия может осложняться:
- тяжелыми жизнеугрожающими кровотечениями;
- бактериальным эндокардитом;
- сепсисом;
- сердечной недостаточностью;
- почечной недостаточностью;
- реакцией отторжения при трансплантации костного мозга.
При диагнозе апластическая анемия, лечение подбирается с учетом потенциальной причины, которая могла спровоцировать болезнь. Как только патология выявлена, больного нужно госпитализировать, только в больнице можно провести диагностику, подобрать и провести комплексное лечение, определить дозировку препаратов и курс терапии. Есть три способа лечения болезни:
- трансплантация;
- трансфузия;
- лечение с помощью медикаментов.
Трансплантацию считают одним из успешных способов помощи пациентам при апластической анемии. Суть процедуры заключается в пересадке костного мозга от донора. Прогноз после проведенной в больнице операции зависит от возраста пациента – чем он моложе, тем больше шансы на успех. В качестве донора может выступать близкий родственник пациента, у которого такая же группа крови.
До назначения пересадки, необходимо провести исследование, которое покажет, насколько совместимы будут клетки донора и реципиента. Перед трансплантацией проводится серьезная подготовка пациента, риск отторжения чужеродных тканей высокий. Перед трансплантацией костного мозга переливание крови не делают, проводят облучение, затем назначают химиотерапию.
Такая подготовка нужна, чтобы снизить иммунитет больного, чтобы он не атаковал чужеродные клетки на первых порах. Нужно учесть, что трансплантация мозга – затратная процедура, которая проводится в специализированных медицинских учреждениях.
Трансфузия – процедура, при которой больному переливают кровь. Для переливания используют препараты крови, подготовленные из крови доноров на станциях переливания. Методика дает лишь временный эффект, переливание частично восполняет дефицит клеток крови больного, но патология не лечится, костный мозг также остается неспособным производить собственные кровяные тельца. Недостатком трансфузионной терапии является невозможность проведения у пациентов с аутоиммунной формой патологии. Если трансфузия будет проводится часто, в печени и селезенке скапливается железо, врачи назначают пациентам медикаменты, способствующие его выведению из организма.
Лечение с помощью медикаментов проводится комплексно, пациенту назначают препараты из разных групп:
- иммунодепрессанты (специфические антиглобулины, Циклоспорин и пр.). Такие медикаменты нужны, если нет возможности пересадить костный мозг. Назначают иммуносупрессоры параллельно с гормонами, чтобы исключить анафилактическую реакцию;
- лекарства для стимуляции кроветворения (Филгастрим, Лейкомакс). Медикаменты этой группы активизируют в организме продуцирование лейкоцитов, поэтому целесообразно их назначать только при диагностировании лейкопении;
- андрогеносодержащие медикаменты (Тестостерона пропионат, Сустанон) назначаются мужчинам для подавления апластической анемии;
- гемостатики (аминокапроновая кислота и пр.) назначаются при выраженном геморрагическом синдроме;
- Десферал и его аналоги назначаются в случае необходимости избавиться от излишков железа в организме.
Другим методом лечения апластической анемии является спленэктомия (операция по удалению селезенки). Цель оперативного вмешательства – остановить происходящие в организме аутоиммунные процессы, из-за которых вырабатываются антитела к клеткам собственного костного мозга. У такой методики есть противопоказание – наличие инфекционных осложнений.
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых.
Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов.
В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
источник
О халатности врачей, о влиянии связей на выздоровление и о стрессе, который помог справиться с болезнью без операции
Апластическая анемия — крайне редкое заболевание кровеносной системы. В Европе на миллион человек приходится двое больных. В Азии же апластическая анемия встречается в три раза чаще. Каждый год погибает не менее 2/3 заболевших. Примерно половина больных может прожить более пяти лет без трансплантации костного мозга, но с полноценным современным медикаментозным лечением. В 50% случаев причина недуга неизвестна.
Февраль 2014 года. Все началось с того, что в десятом классе меня ударила своим тяжелым сапожищем одноклассница. До сих пор не понимаю, что на нее нашло. Было невероятно больно. На ноге размером с кулак появился синяк, который долгое время не проходил.
Через неделю возле синяка появились красные точки на ноге. Я стал жаловаться на плохое самочувствие, и мама дала мазь, которая «должна помочь». Результата не было. Тогда мы пошли в поликлинику.
Стоит сказать, что из себя представляют казахстанские медицинские заведения. Наши поликлиники – та еще параша. Там сидел самый ******** (непрофессиональный) хирург. Он взглянул на мои ноги и смог определить плоскостопие, когда я был в зимних сапогах. Огромные зимние сапоги на широкой подошве. Во время приема он не мог оторваться от планшета. Наконец, когда врач решил сделать осмотр ноги, он выдал: «Видишь, у тебя синяк. Пространство загноилось. Нужно резать и чистить. Красные точки пройдут, когда вы все прочистите».
После мы направились в другую поликлинику, где меня должны были прооперировать. Врачи той больницы посмотрели мою ногу и уверили, что красные точки — не последствие синяка. Если быть точнее, назвали точки «системным сбоем» в кровоснабжении. Однако мама не поверила и настояла на том, чтобы мне сделали рентген ноги. Они очень долго спорили, но все же пришли к компромиссу: я пошел и на рентген, и на сдачу крови.
На снимке ноги ничего страшного не было: ни воспалений, ни явных нарушений. Самое интересное было в анализе крови, потому что спустя 15 минут после сдачи к нам подошли врачи и предупредили: «Наш аппарат сломался. Он показывает совершенно невероятные цифры». Когда прибор починили, я сдал кровь заново. Оказалось, что проблема не в устройстве. Результаты анализа очень печальные. Мама без лишних слов сказала: «Все, сынок, мы уходим».
Мама звонила всем знакомым, родственникам в поиске правильных врачей; она отказывалась верить результатам. Я же еще не до конца понимал, что происходит. Когда она предложила поехать в суперкрутую частную клинику для важных людей, все, что я сказал — «завтра же школа».
В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала
В той клинике договорились о полном обследовании: провели анализ крови и осмотрели не только ногу, но и брюшную полость, сердце, голову. Взяли кровь — их аппарат тоже «дал сбой». Я чувствовал неладное. Врачи сделали повторный забор. Нам принесли анализы, и это был первый раз, когда я успел выхватить листочек с анализами и просмотреть его до мамы. Стало понятно, в какой ситуации я оказался. В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала.
Наши поиски хороших врачей этим не закончились. Мы поехали в Центр детской хирургии. Я к тому времени просто запарился ездить и ждать; я устал. Мама разговаривала с бесконечным количеством врачей центра. Однако позиция заместителя главного врача была довольно ясна: не могут принять меня. Затянулось бы надолго, если бы мама не позвонила человеку, которому можно было позвонить. Только тогда больница согласилась меня принять, и врач уверил мою маму, что мной займутся профессионалы.
Именно в этом центре и поставили предварительный диагноз — апластическая анемия. Костный мозг перестал производить достаточные количества всех основных видов клеток крови. Никто так и не понял, почему недуг у меня появился. Я не подходил ни по одной из причин развития болезни. Опять-таки диагноз был пока только догадкой. Для того чтобы поставить точное заключение, нужно было меня оперировать, но этого они сделать не могли. Анализы выявили 3 тысячи тромбоцитов из нужных 180 тысяч. Это означало: кровь практически не свертывается. Поэтому мне начали переливать кровь, чтобы подготовить к операционному столу, но вены не выдерживали тех объемов, что вливали. Нужно было ставить катетер, а для этого нужна операция. Получался замкнутый круг. В итоге мои руки стали похожи на руки отпетого наркомана из-за синяков, появлявшихся каждое переливание.
Походы на процедуры, бесконечные кабинеты — всё это надоело. Я делал на автомате то, что мне говорили, и перестал следить за действиями врачей. Контролировала мама. Дошло до того, что она проверяла каждую ампулу. Иммунитет начал стремительно лететь к чертям. Организм стал воспринимать костный мозг как враждебный и чужеродный орган, поэтому включил все ресурсы для его ликвидации. Вся ирония в том, что иммунные клетки вырабатывает именно костный мозг. Мой организм боролся сам с собой. Отказывать стала печень. Началась поддерживающая терапия. Так долго продолжаться не могло, еще немного и организм бы просто не выдержал. Родственники морально готовили маму к моей смерти. Врачи же решили разорвать этот круг. Влили мне большее, чем обычно, количество крови. Провели операцию, чтобы поставить катетер в вену и узнать процент оставшегося костного мозга.
После операции выяснилось, что в организме всего десять процентов незараженного участка костного мозга. Местные и даже республиканские врачи отказывались меня лечить. Все ссылались на то, что не потянут. Предупредили: «Если хотите, чтобы сын выжил, нужно искать врача за пределами страны». Мы решили обратиться в другие клиники. Когда я выписывался из больницы в Алматы, мне дали пройтись без катетера целые сутки. То был блаженный день: не нужно было таскаться с огромным штативом, на котором висела куча препаратов. Наконец, я принял ванну как нормальный человек.
Вообще, у нас был выбор: Россия, Литва или Беларусь. Мы решили поехать в Россию.
В Москве есть клиника, которая строилась под надзором Путина. Национальный научно-практический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва. Невероятно элитарная больница в Москве, куда мы и отправились. Изначально они нас не приняли. Тогда мы через знакомых вышли на директора этой клиники. Как оказалось, что в Казахстане, что в России, всё решают связи.
В этом центре врач решил заново подтвердить диагноз и поставить катетер. Это значит — новая операция. Когда диагноз подтвердился, на удивление, врачи не стали пугать меня. Прогнозировали 70 % полного выздоровления. Не было разговоров о том, что я останусь инвалидом или умру. Они сказали забыть о всяческих терминах и специальных словах, потому что в процессе выздоровления я и мое стремление будут играть огромную роль.
На дворе был апрель. Лечение долго не могли начать. Показатели кровяных клеток оставались на минимальном уровне, иммунитет крайне ослаб. Количество лейкоцитов стало меньше допустимого в четыре раза. Если рядом со мной кто-то чихал, я мог слечь с температурой под 40. Мне давали жаропонижающее, но препарат помогал только в течение получаса. А потом температура вновь поднималась и меня лихорадило. Именно из-за такого состояния химиотерапию начали только через полторы недели после приезда в Москву.
Химиотерапия — процесс, когда я в принципе не чувствовал ничего. Мне было стабильно нормально. Вот после терапии стало намного хуже: если раньше хватало пол-литра крови на три дня, то после мне стали вводить это количество в день, затем — 750 мл, 850 мл и так далее. Я практически потреблял по литру крови в сутки. Параллельно с этим печень стала сильно сдавать от этого количества крови и от препаратов. Чтобы хоть как-то помочь организму, мне выписали строжайшую диету: нельзя жареное из-за нагрузки на печень, нельзя мучное или кисломолочное. За две недели я похудел практически на 15 килограмм.
Через месяц после химиотерапии показатели крови стали расти. Конечно, они не доходили даже до 50 % нужной цифры, но жить уже было можно. Прогресс был. Поэтому процесс переливания завершился. Меня переселили в корпус для тех, у кого была ремиссия, и я смог выбираться гулять по Москве. В июне было состояние, когда я мог передвигаться сам. Правда, всего 20 метров, но и это была маленькая победа. Я попросил врачей выписать меня, и мы улетели в Алматы.
Два месяца я довольно хорошо себя чувствовал, пока в августе на очередном обследовании мои показатели крови опять не упали. Две недели подряд после этого вновь началось: врачи, анализы, бесконечные звонки. За это время на фоне стресса показатели крови повысились, но местные врачи опасались таких скачков. Они предложили полететь в Турцию, чтобы сделать пересадку костного мозга. Опять стресс — количество кровяных клеток поднялось почти до нормы. Можно было остаться здесь, но в Турцию мы все же поехали. Правда, там операцию проводить отказались, бессмысленно было делать трансплантацию при нормальных результатах. Мы вернулись уверенные в том, что теперь все нормально. Такое чудесное выздоровление не редкость: одному знакомому не помогали таблетки, но сильный стресс нормализовывал результаты.
Мы платили за процесс лечения сами, потратили за три месяца 5 миллионов рублей по старому курсу. Государство никак не участвовало в этом, хотя просьбы были. Финансово помогали друзья и знакомые. Они перечисляли деньги на наш счет.
Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь
В Казахстане болеть вообще зашкварно. Если у вас нет денег лечиться за границей, то мне вас искренне жаль. Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь.
Сейчас мне 20 лет, и вот уже три года чувствую себя нормально. По сей день рецидивов не было. Я постоянно на дорогостоящих таблетках; это и поддерживает мою жизнь. Кратчайшее прекращение курса лечения может привести к скачку в анализе крови. Прогнозы говорят, что скоро заболевание может проявиться вновь, но я не живу в ожидании очередного черного периода и стараюсь радоваться каждому благополучно прожитому дню.
источник
Новые медикаменты и пересадка костного мозга помогут людям с апластической анемией жить полноценной жизнью гораздо дольше.
Кровь — это жизнь. Но редкая болезнь под названием апластическая анемия лишает организм жизни, лишая организм крови. (23.03.2008 — HealthDay Новости). Кровь пациентов с апластической анемией становится обедненной клетками крови, так как костный мозг замедляет их производство. Симптомы заболевания могут варьироваться в зависимости от того, какого типа клеток крови больше всего не хватает. Это может быть хроническая усталость, болезни сердца, бесконечные инфекций, понижение свертываемости крови.
Но есть надежда. Не смотря на то, что как два десятилетия назад, так и как в последнее время, болезнь часто оканчивается смертельным исходом, в настоящее время апластическая анемия становится гораздо более управляемым заболеванием. Достижения в области медикаментозной терапии и успехи в области трансплантации позволили сократить число летальных исходов, что позволяет пациентам жить полноценной жизнью гораздо дольше.
«Мы совершенствуем методы лечение апластической анемии — либо полностью вылечиваем заболевание, либо лечим ее симптомы», говорит д-р Ярослав П. Мациежевский (Dr. Jaroslaw P. Maciejewski, Cleveland Clinic’s Department of Hematologic Oncology and Blood Disorders). И эти успехи помогают врачам лучше понять другие, имеющие более широкое распространение заболевания, такие как болезни сердца и лейкемия.
По данным Национальных институтов здравоохранения ежегодно в США регистрируется 50 тысяч случаев апластической анемии и 20-30 тысяч случаев миелодиспластического синдрома (миелодиспластический синдром или МДС — это подобное апластической анемии заболевание крови, которое возникает тогда, когда костный мозг начинает производить плохо функционирующие или незрелые клетки крови).
Важно отметить, что многие симптомы апластической анемии, такие как усталость и инфекции, также могут быть вызваны другими заболеваниями, говорит д-р Роналд Пакетт (Dr. Ronald Paquette, a blood disease researcher with the University of California, Los Angeles’ Jonsson Comprehensive Cancer Center) специалист по заболеваниям крови в Калифорнийском университете.
Костный мозг — это губчатый материал внутри кости, который производит стволовые клетки, которые в свою очередь превращаются в три типа клеток крови — эритроциты, лейкоциты и тромбоциты. «По существу, костный мозг – это завод крови», — говорит Мациежевский. У больных с апластической анемией, стволовые клетки повреждаются, вследствие чего происходит замедление или остановка производства всех клеток крови.
Причина повреждения стволовых клеток остается неизвестной в более чем половине случаев заболеваний апластической анемией. Согласно научным исследованиям Национального института здоровья есть предположение, что стволовые клетки повреждаются, когда иммунная система человека атакует свои собственные клетки организма по ошибке.
Некоторые случаи апластической анемии были связаны с воздействием токсинов, таких как пестициды, мышьяк и бензол. Инфекционные заболевания также могут привести к нарушениям приводящим к апластической анемии. Это инфекционные заболевания как гепатит, вирус Эпштейна-Барра, цитомегаловирус, парвовирус B19, ВИЧ, а также аутоиммунные заболевания, такие как системная красная волчанка и ревматоидный артрит. Наконец, некоторые генетические нарушения могут привести к апластической анемии.
Симптомы апластической анемии зависят от типа клеток крови, которых больше всего не хватает в организме:
— Недостаток эритроцитов может привести к нехватке кислорода в организме. Люди, у которых низкий уровень эритроцитов нередко чувствуют себя усталыми. Из-за того, что сердце должно работать быстрее и напряженнее, чтобы снабдить органы и ткани кислородом, со временем могут развиться сердечно-сосудистые заболевания.
— Недостаток лейкоцитов может ослабить иммунитет человека. Человек может чаще болеть инфекционными заболеваниями, и обычные болезни могут проходить в тяжелой форме.
— Недостаток тромбоцитов, снижает способность крови свертываться. Пациенты с низким уровнем тромбоцитов могут иметь большое количество синяков и гематом. Возможны кровотечения, которые трудно остановить.
«После того, как человеку поставлен диагноз апластическая анемия необходимо сразу начать лечение», — говорит д-р Пакетт. «Очень важно, чтобы лечение было в специализированном центре, так как это очень редкое заболевание» — сказал он. «Самое главное заключается в том, чтобы вас наблюдал специалист с большим опытом лечения заболеваний на ранней стадии».
Для пациентов моложе 30 лет трансплантация стволовых клеток является предпочтительным методом лечения. Для тех, у кого есть родственный донор (подходящие брат или сестра), проводят трансплантацию стволовых клеток, здоровые стволовые клетки донора заменяет дефектные клетки костного мозга больного человека. По данным Международного фонда апластической анемии и МДС более 80% процентов пациентов полностью выздоравливают (Aplastic Anemia & MDS International Foundation Inc.)
По мнению д-ра Пакетта достижения в области исследования стволовых клеток и препаратов против отторжения донорских клеток привели к тому, что трансплантации от неродственных доноров также становятся все более успешными.
Одним из перспективных направлений лечения является трансплантация стволовых клеток пуповинной крови. «Стволовые клетки пуповинной крови новорожденных младенцев можно замораживать и сохранять в банке клеток, чтобы позже использовать как донорские клетки, как для новорожденного (в случае возникновения у него тяжелых заболеваний), так и для неродственной трансплантации», говорит д-р Пакетт. — «Это очень обнадеживает».
Для пациентов с апластической анемией важно начать лечение как можно скорее. «Как показывают исследования, чем раньше была сделана пересадка костного мозга с момента постановки диагноза, тем лучше результат» — считает Пакетт.
Больные, у которых нет донора, или те, для которых трансплантация невозможна по медицинским показаниям, часто получают иммуносупрессивную терапию такими препаратами как антитимоцитарный глобулин и циклоспорин. По данным Международного фонда апластической анемии и МДС положительная динамика в результате иммуносупрессивной терапии наблюдается в 70-80% случаев.
Переливание крови от подходящего донора также помогает поддержать показатели крови на высоком уровне. Это помогает облегчить симптомы заболевания, хотя этот метод не является эффективными при длительном лечении.
«Так или иначе, вылечиваем ли мы болезнь или нет, в любом случае состояние пациента можно улучшить «, говорит д-р Ярослав П. Мациежевский. — «Теперь мы можем сохранить жизнь людям с апластической анемией или продлить им жизнь на долгие годы».
источник
Апластическая анемия – заболевание системы крови, заключающееся в аплазии (отсутствии формирования) клеток костного мозга, в результате чего развивается дефицит форменных элементов крови – панцитопения. Сходным с этим являются процессы гипоплазии, когда процессы кроветворения происходят в меньшем объёме, чем необходимо и развивается гипопластическая анемия. Обычно эти два понятия объединяют общим понятием апластической анемии.
Когда не известны причины, вызвавшие развитие заболевания, оно носит название идиопатическое. Такое встречается в большинстве случаев. Но иногда всё-таки удаётся установить причину. Ей может быть:
- действие ионизирующего излучения;
- токсины – бензол, инсектициды;
- лекарственные препараты – хлорамфеникол, нестероидные противовоспалительные средства, цитостатики;
- вирусы гепатита, Эбштейна — Барра;
- заболевания иммунной системы;
- генетические нарушения при созревании клеток костного мозга.
Наличие дефекта в стволовых клетках или снижение количества приводит к их низкой пролиферативной активности. Другим механизмом развития апластической анемии является нарушение регуляции иммунокомпетентными клетками процессов созревания ростков крови (гемопоэз). Патология микроокружения – один из возможных путей, приводящих к угнетению синтеза клеток крови или их полному отсутствию.
Возможно сочетание нескольких механизмов в развитии апластической анемии.
Анемия Фанкони – наследственное заболевание с аутосомно-рецессивным типом наследования. В результате мутации образуются белки, нарушающие процессы репарации (восстановление структуры) ДНК. Это приводит к высокой чувствительности и к повреждениям нуклеиновой кислоты, сопровождается прогрессированием нарушений костномозгового кроветворения и повышенной вероятностью развития опухолей.
Все основные симптомы апластической анемии возникают из-за дефицита клеток крови и нарушения их функции. Дефицит тромбоцитов приводит к развитию геморрагического синдрома, лейкоцитов (агранулоцитоз) – пониженному иммунитету, эритроцитов – анемическому синдрому.
Как уже было отмечено ранее, возможны острое и хроническое течение апластической анемии. У 15% больных заболевание протекает остро и сопровождается повышенной температурой тела, множественными кровоизлияниями. При врождённой форме (анемия Фанкони) возможны отставание в росте и развитии, «кофейные» пятна на кожном покрове.
Анемический синдром проявляется головокружением, мельканием «мушек» перед глазами, слабостью.
Лейкоцитопения – низкий уровень лейкоцитов сопровождается присоединением бактериальной инфекции.
Геморрагический синдром – проявляется кровотечениями (носовыми, десневыми, маточными), высыпаниями на коже. При кровоизлиянии в глазное дно это может проявляться снижением остроты зрения. Чаще всего это характерно для лиц молодого возраста с тяжёлой степенью апластической анемии.
Диагноз подтверждается на основании клинических симптомов, лабораторных и инструментальных методов исследования. Характерные симптомы апластической анемии указаны выше.
В первую очередь из лабораторных анализов назначается общий анализ крови, в котором отражается уровень всех форменных элементов. Как уже упоминалось не раз, будет наблюдаться панцитопения – низкие уровни клеток крови.
Обнаруженная анемия характеризуется по цветному показателю. При апластической анемии она нормохромная или возможна незначительная гиперхромность. Ретикулоциты снижены или отсутствуют. Показатели СОЭ (скорость оседания эритроцитов) будут повышены. Низкий уровень лейкоцитов возникает за счёт дефицита гранулоцитов, отмечается относительный лимфоцитоз. Нарушается структура тромбоцитов и их функциональные способности.
Проводят пункцию костного мозга. Характеристика полученного пунктата будет зависеть от того попала ли игла в угнетённый очаг или в остатки нормально функционирующего костного мозга. В первом случае пунктат будет обеднён клеточными элементами, снижено количество молодых форм гранулоцитов, повышено процентное количество лимфоцитов, также нарушены процессы дифференцировки и пролиферации.
Обнаружение бластных клеток в пунктате не имеет отношения к апластической анемии, значит, следует искать другой патологический процесс, сходный с этим по клиническим проявлениям и нарушениям созревания кроветворных клеток.
Отмечается отложение избытка железа в виде пигмента в печени, селезёнке, костном мозге. Для правильной диагностики необходимо выяснить, что могло привести к сниженному уровню лейкоцитов (токсические вещества, лекарственные средства, инфекционные агенты, аутоиммунные поражения, хронические воспалительные процессы, гипотиреоз).
Анемия, похожая на апластическую, может возникать при парциальной красноклеточной аплазии. При таком состоянии изолированно нарушаются процессы синтеза и дифференцировки клеток эритроидного ряда, возможна выработка антител к клеткам костного мозга.
Диагноз апластической анемии ставится при наличии любых 2 критериев из перечисленных ниже:
- уровень гемоглобина менее 100 г/л;
- уровень лейкоцитов менее 3,5 * 109 /л (содержание гранулоцитов менее 1,5 * 109/л);
- гипоклеточный костный мозг и уровень тромбоцитов менее 50 * 109/л.
Характеристика степеней тяжести апластической анемии представлена в таблице 1.
Таблица 1. Критерии степени тяжести апластической анемии.
| Степень тяжести | Критерии |
| Умеренная |
|
| Тяжёлая |
|
| Очень тяжёлая |
|
Основным методом лечения апластической анемии является восстановление количества кроветворных клеток, а также назначение иммуносупрессивной терапии для подавления иммунных реакций. Самым действенным методом считается пересадка стволовых кроветворных клеток.
При трансплантации костного мозга необходимо тщательно проводить оценку на совместимость донора и реципиента во избежание патологии «трансплантат против хозяина».
Отмечается тот факт, что при апластической анемии, вызванной химиотерапией и врождённых формах, терапия иммуносупрессорами не является эффективной.
К иммуносупрессивной терапии относятся:
- антилимфоцитарный иммуноглобулин;
- циклоспорин;
- глюкокортикоиды;
- цитостатики.
Обратите внимание, что самолечением не стоит заниматься, так как у каждого лекарственного средства есть свои показания, противопоказания, побочные эффекты.
Не разрешается употреблять иммуносупрессивные препараты при наличии инфекционно-воспалительного процесса, тяжёлых нарушении сердечно-сосудистой системы, печени, почек, не купируемом геморрагическом синдроме.
При любой терапии необходим контроль за пациентом со стороны медицинского персонала для оценки возможных аллергических реакций, которые могут возникнуть на компоненты лекарственного средства. Может быть отсроченная аллергическая реакция, проявляющаяся спустя 2 – 3 дня.
Использование ростовых факторов обеспечивает поддержание гранулоцитов на уровне 1 – 1,5 * 109/л. В качестве дополнительного метода лечения может быть назначен лимфоцитоплазмаферез. Он оправдан при наличии аллергической реакции или формировании антител к форменным элементам крови. Ещё одним направлением лечения апластической анемии является терапия, проводимая против основных осложнений: инфекционных, геморрагических, аллергических. В некоторых случаях проводится переливание тромбоцитарной и эритроцитарной масс.
Таблица 2. Показания к назначению трансфузии эритроцитарной массы и тромбоконцентрата.
| Комноненты крови для гемотрансфузии | Показания |
| Эритроцитарная масса | Гемоглобин менее 90 г/л Гематокрит менее 30% |
| Тромбоцитарная масса | Кровотечения на фоне низкого уровня тромбоцитов (10 – 20 * 109/л) |
Для оценки терапии используют понятие ремиссии. Улучшение костномозгового кроветворения – неполная (частичная) ремиссия, позволяет пациенту избегать зависимости от переливания крови. Число гранулоцитов в крови составляет более 0,5 * 109/л, что снижает риск тяжёлых инфекционных осложнений. Полная ремиссия сопровождается отсутствием клинических проявлений, уровень гемоглобина приходит в норму, количество тромбоцитов больше 100 * 109/л, гранулоцитарных лейкоцитов – 1 * 109/л.
Исход заболевания зависит от глубины и тяжести поражения костномозгового кроветворения. Прогноз может быть неблагоприятным при неожиданном резком развитии апластической анемии.
Профилактика развития апластической анемии заключается в ограничении влияния на организм неблагоприятных внешних факторов. Необходимо соблюдать правила техники безопасности при работе с ионизирующими излучениями, бензолом, избегать бесконтрольного приёма лекарственных средств, лечить заболевания органов и систем, приводящих к снижению гемопоэза, например, патология почек, цирроз печени.
При подтверждённой апластической анемии необходимо наблюдение за состоянием пациентов, постоянный контроль за уровнями форменных элементов, чтобы не пропустить рецидив и возможные осложнения.
Подводя итог всему вышесказанному, следует обратить внимание на то, что апластическая анемия может развиться неожиданно без какого-либо провоцирующего действия, приводить к геморрагическому, анемическому синдрому, вызывать инфекционно-воспалительные осложнения. Однако своевременно назначенная терапия грамотного специалиста позволит избежать неблагоприятного исхода.
Мы приложили много усилий, чтобы Вы смогли прочитать эту статью, и будем рады Вашему отзыву в виде оценки. Автору будет приятно видеть, что Вам был интересен этот материал. Спасибо!
источник
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри — физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом — выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, — резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов — причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда — аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
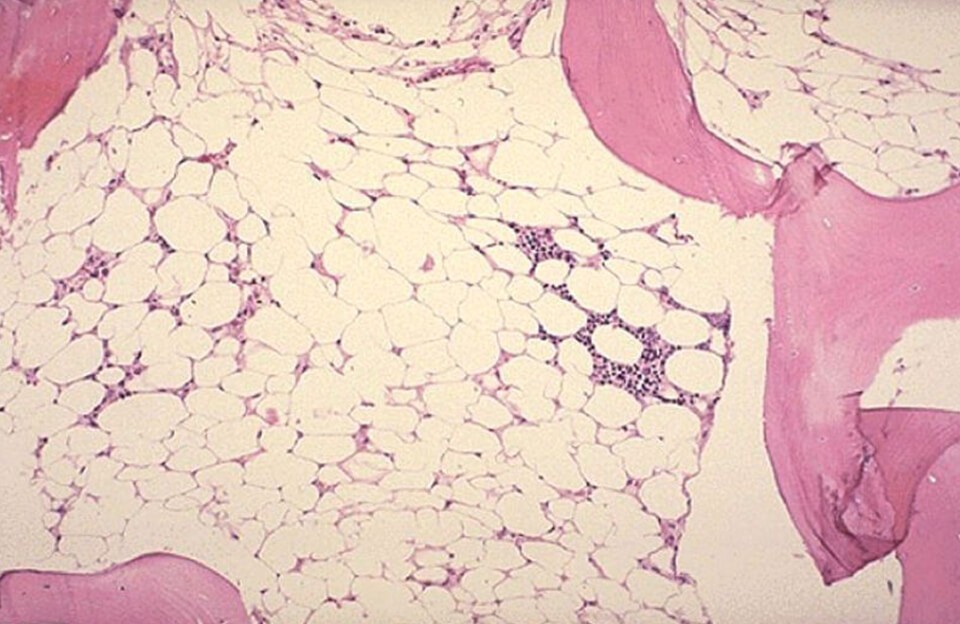
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение — это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности — избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет — 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
источник