
Можно даже сказать, что это целая группа патологических состояний, которые представляют собой самостоятельную форму заболевания. При апластической анемии костный мозг перестает производить клетки крови в необходимом количестве: лейкоциты, тромбоциты и эритроциты. Различные виды болезни протекают по-разному, некоторые из них дают о себе знать сразу, а остальные проявляются только через время.
Тяжелая апластическая анемия требует обязательной госпитализации, так как она угрожает жизни больного. Критерии тяжелой формы заболевания заключаются в резком понижении уровня тромбоцитов в крови (менее 500/мкл), при этом также отмечается снижение нейтрофилов. Сверхтяжелая форма апластической анемии характеризуется критическим понижением нейтрофилов до 200/мкл.
Апластическая анемия у детей развивается в нескольких формах, которые характеризуются развитием определенных признаков. Самой тяжелой из них считается анемия Фанкони, при которой присутствуют врожденные дефекты развития костей, пороки сердца и почек.
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины.
Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения.
В настоящее время заболевание с названием «апластическая анемия» выделяют как самостоятельную нозологическую единицу — и чётко разграничивают его от синдрома гипоплазии кроветворения, являющегося проявлением ряда известных самостоятельных заболеваний костного мозга.
Многих интересует вопрос, что такое апластическая анемия и почему она появляется? К сожалению, современная медицина не может назвать очевидные причины развития апластической анемии у человека. Но известно, что болезнь бывает приобретённая и наследственная.
Существует теория, что развитие патологии связано с особенностями функционирования организма каждого индивида. Тем не менее отмечаются некоторые факторы, которые могут спровоцировать появление болезни. В частности, самым ясным из факторов является воздействие на человека ионизирующей радиации, которая подавляет функции костного мозга и приводит к снижению выработки им эритроцитов, тромбоцитов и лейкоцитов. Также к предрасполагающим факторам можно отнести следующие:
- плохая экологическая ситуация в регионе;
- регулярные контакты человека с вредными химическими веществами;
- некоторые инфекционные патологии, в частности, гепатит, цитомегаловирусная инфекция;
- проблемы с костным мозгом;
- приём некоторых медикаментов, в том числе обычных жаропонижающих и обезболивающих средств типа аспирина;
- частый приём антибиотиков, особенно левомицетина.
Обнаружено, что болезнь наблюдают у пациентов с чрезмерной тягой к алкоголю. Не последнюю роль в развитии болезни играет и генетическая предрасположенность. Апластическая анемия у детей часто развивается вследствие наследственных патологий, в том числе этом может быть анемия Фанкони. Необходимо отметить, что зачастую у детей диагностируется идиопатическая апластическая анемия – то есть патология с неясной этиологией.
Что касается такой патологии, как гипопластическая апластическая анемия – то это ещё более тяжёлая патология, вызывающая серьёзные нарушения в работе всех внутренних органов и приводящая к нарушению работоспособности систем организма.
Также следует сказать, что апластическая анемия бывает трёх форм тяжести:
- очень тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренная (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
Все симптомы апластической анемии объединяются в 3 основных группы синдромов: анемический синдром, геморрагический синдром, синдром инфекционных осложнений.
Анемический синдром характеризуется:
- выраженной общей слабостью;
- быстрой утомляемостью;
- непереносимостью привычных физических нагрузок;
- одышкой и тахикардией при умеренных нагрузках, в тяжелых случаях – в покое, при перемене положения тела;
- головными болями, головокружением, эпизодами обморока;
- шумом, звоном в ушах;
- чувством «несвежей головы»;
- мельканием «мушек», пятен, цветных полос перед глазами;
- болями колющего характера в области сердца;
- снижением концентрации;
- нарушением режима «сон – бодрствование» (сонливость днем, бессонница ночью).
Объективно при обследовании пациентов устанавливаются бледность кожных покровов и видимых слизистых оболочек, приглушенность тонов сердца, учащение пульса, снижение артериального давления.
Выделяют два пика заболеваемости: в 10–25 лет и после 60 лет. Чаще болеют женщины.
Геморрагический синдром проявляется:
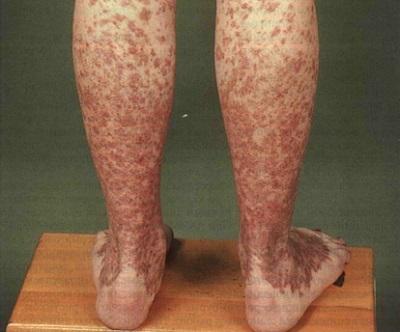
- гематомами (синяками) разного размера и точечными кровоизлияниями, возникающими на коже и слизистых оболочках после незначительного воздействия или спонтанно, без причин;
- кровоточивостью десен;
- кровотечением из носа;
- у женщин – маточными межменструальными кровотечениями, длительными обильными менструациями;
- розовым окрашиванием мочи;
- определением следов крови в испражнениях;
- возможными массивными желудочно-кишечными кровотечениями;
- кровоизлияниями в склеру и глазное дно;
- кровоизлияниями в головной мозг и его оболочки;
- легочными кровотечениями.
Объективное подтверждение геморрагического синдрома – точечные кровоизлияния и кровоподтеки на коже и слизистых, множественные гематомы на разных стадиях (от пурпурно-фиолетовых до желтых).
Инфекционные осложнения представлены развивающимися пневмониями, пиелонефритами, фурункулезами, постинъекционными абсцессами или инфильтратами, в тяжелых случаях – сепсисом.
В детском возрасте чаще наблюдается врожденная патология, передаваемая от родителей либо приобретенная в период внутриутробного развития. Некоторые признаки такой патологии можно определить даже у новорожденного, другие могут проявиться только через несколько лет. К числу тяжелых симптомов анемии у новорожденных относятся:
- аномалии строения лица (треугольное лицо, маленькие глаза, курносый нос и др.);
- аномалии конечностей (отсутствие большого пальца на руках, отсутствие лучевой кости, шестипалость и др.);
- низкорослость;
- особенности пигментации кожи – это скопления множественных пятен светло-коричневого цвета;
- аномалии внутренних органов, чаще мочеполовой системы;
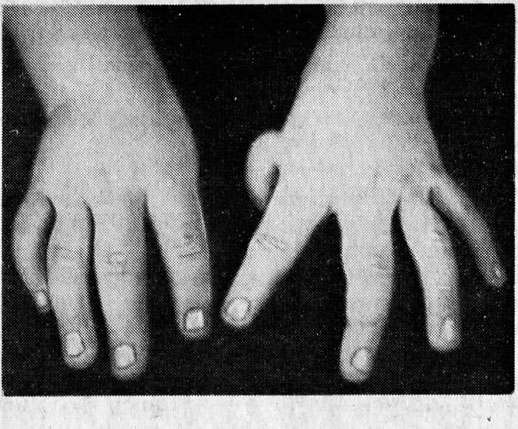
- деформация и разрушение ногтей;
- отставание в умственном развитии;
Апластическая анемия у детей старше 1 года первоначально определяется по внешнему виду, поведению. Больные дети отличаются от сверстников бледностью кожных покровов и слизистых оболочек, у них наблюдается увеличение размеров лимфатических узлов, случаются частые кровотечения из носа, десен, по утрам появляется кровь в моче. Их поведение характеризуется частой сменой настроения, раздражительностью, они быстро утомляются, теряют аппетит.
Гематологическое обследование включает внимательный клинический осмотр и проведение специальных диагностических исследований: общего и биохимического анализа крови, стернальной пункции, трепанобиопсии. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия.
Для гемограммы при апластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Исследование пунктата костного мозга показывает уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности; в трепанобиоптате обнаруживается замещение красного костного мозга жировым (желтым). В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Апластическая анемия может осложняться:
- тяжелыми жизнеугрожающими кровотечениями;
- бактериальным эндокардитом;
- сепсисом;
- сердечной недостаточностью;
- почечной недостаточностью;
- реакцией отторжения при трансплантации костного мозга.
При диагнозе апластическая анемия, лечение подбирается с учетом потенциальной причины, которая могла спровоцировать болезнь. Как только патология выявлена, больного нужно госпитализировать, только в больнице можно провести диагностику, подобрать и провести комплексное лечение, определить дозировку препаратов и курс терапии. Есть три способа лечения болезни:
- трансплантация;
- трансфузия;
- лечение с помощью медикаментов.
Трансплантацию считают одним из успешных способов помощи пациентам при апластической анемии. Суть процедуры заключается в пересадке костного мозга от донора. Прогноз после проведенной в больнице операции зависит от возраста пациента – чем он моложе, тем больше шансы на успех. В качестве донора может выступать близкий родственник пациента, у которого такая же группа крови.
До назначения пересадки, необходимо провести исследование, которое покажет, насколько совместимы будут клетки донора и реципиента. Перед трансплантацией проводится серьезная подготовка пациента, риск отторжения чужеродных тканей высокий. Перед трансплантацией костного мозга переливание крови не делают, проводят облучение, затем назначают химиотерапию.
Такая подготовка нужна, чтобы снизить иммунитет больного, чтобы он не атаковал чужеродные клетки на первых порах. Нужно учесть, что трансплантация мозга – затратная процедура, которая проводится в специализированных медицинских учреждениях.
Трансфузия – процедура, при которой больному переливают кровь. Для переливания используют препараты крови, подготовленные из крови доноров на станциях переливания. Методика дает лишь временный эффект, переливание частично восполняет дефицит клеток крови больного, но патология не лечится, костный мозг также остается неспособным производить собственные кровяные тельца. Недостатком трансфузионной терапии является невозможность проведения у пациентов с аутоиммунной формой патологии. Если трансфузия будет проводится часто, в печени и селезенке скапливается железо, врачи назначают пациентам медикаменты, способствующие его выведению из организма.
Лечение с помощью медикаментов проводится комплексно, пациенту назначают препараты из разных групп:
- иммунодепрессанты (специфические антиглобулины, Циклоспорин и пр.). Такие медикаменты нужны, если нет возможности пересадить костный мозг. Назначают иммуносупрессоры параллельно с гормонами, чтобы исключить анафилактическую реакцию;
- лекарства для стимуляции кроветворения (Филгастрим, Лейкомакс). Медикаменты этой группы активизируют в организме продуцирование лейкоцитов, поэтому целесообразно их назначать только при диагностировании лейкопении;
- андрогеносодержащие медикаменты (Тестостерона пропионат, Сустанон) назначаются мужчинам для подавления апластической анемии;
- гемостатики (аминокапроновая кислота и пр.) назначаются при выраженном геморрагическом синдроме;
- Десферал и его аналоги назначаются в случае необходимости избавиться от излишков железа в организме.
Другим методом лечения апластической анемии является спленэктомия (операция по удалению селезенки). Цель оперативного вмешательства – остановить происходящие в организме аутоиммунные процессы, из-за которых вырабатываются антитела к клеткам собственного костного мозга. У такой методики есть противопоказание – наличие инфекционных осложнений.
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых.
Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов.
В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
источник
О халатности врачей, о влиянии связей на выздоровление и о стрессе, который помог справиться с болезнью без операции
Апластическая анемия — крайне редкое заболевание кровеносной системы. В Европе на миллион человек приходится двое больных. В Азии же апластическая анемия встречается в три раза чаще. Каждый год погибает не менее 2/3 заболевших. Примерно половина больных может прожить более пяти лет без трансплантации костного мозга, но с полноценным современным медикаментозным лечением. В 50% случаев причина недуга неизвестна.
Февраль 2014 года. Все началось с того, что в десятом классе меня ударила своим тяжелым сапожищем одноклассница. До сих пор не понимаю, что на нее нашло. Было невероятно больно. На ноге размером с кулак появился синяк, который долгое время не проходил.
Через неделю возле синяка появились красные точки на ноге. Я стал жаловаться на плохое самочувствие, и мама дала мазь, которая «должна помочь». Результата не было. Тогда мы пошли в поликлинику.
Стоит сказать, что из себя представляют казахстанские медицинские заведения. Наши поликлиники – та еще параша. Там сидел самый ******** (непрофессиональный) хирург. Он взглянул на мои ноги и смог определить плоскостопие, когда я был в зимних сапогах. Огромные зимние сапоги на широкой подошве. Во время приема он не мог оторваться от планшета. Наконец, когда врач решил сделать осмотр ноги, он выдал: «Видишь, у тебя синяк. Пространство загноилось. Нужно резать и чистить. Красные точки пройдут, когда вы все прочистите».
После мы направились в другую поликлинику, где меня должны были прооперировать. Врачи той больницы посмотрели мою ногу и уверили, что красные точки — не последствие синяка. Если быть точнее, назвали точки «системным сбоем» в кровоснабжении. Однако мама не поверила и настояла на том, чтобы мне сделали рентген ноги. Они очень долго спорили, но все же пришли к компромиссу: я пошел и на рентген, и на сдачу крови.
На снимке ноги ничего страшного не было: ни воспалений, ни явных нарушений. Самое интересное было в анализе крови, потому что спустя 15 минут после сдачи к нам подошли врачи и предупредили: «Наш аппарат сломался. Он показывает совершенно невероятные цифры». Когда прибор починили, я сдал кровь заново. Оказалось, что проблема не в устройстве. Результаты анализа очень печальные. Мама без лишних слов сказала: «Все, сынок, мы уходим».
Мама звонила всем знакомым, родственникам в поиске правильных врачей; она отказывалась верить результатам. Я же еще не до конца понимал, что происходит. Когда она предложила поехать в суперкрутую частную клинику для важных людей, все, что я сказал — «завтра же школа».
В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала
В той клинике договорились о полном обследовании: провели анализ крови и осмотрели не только ногу, но и брюшную полость, сердце, голову. Взяли кровь — их аппарат тоже «дал сбой». Я чувствовал неладное. Врачи сделали повторный забор. Нам принесли анализы, и это был первый раз, когда я успел выхватить листочек с анализами и просмотреть его до мамы. Стало понятно, в какой ситуации я оказался. В графе с элементами крови есть показатели нормы: у меня же в некоторых ячейках были нули. Практически половина нужных для жизни клеток отсутствовала.
Наши поиски хороших врачей этим не закончились. Мы поехали в Центр детской хирургии. Я к тому времени просто запарился ездить и ждать; я устал. Мама разговаривала с бесконечным количеством врачей центра. Однако позиция заместителя главного врача была довольно ясна: не могут принять меня. Затянулось бы надолго, если бы мама не позвонила человеку, которому можно было позвонить. Только тогда больница согласилась меня принять, и врач уверил мою маму, что мной займутся профессионалы.
Именно в этом центре и поставили предварительный диагноз — апластическая анемия. Костный мозг перестал производить достаточные количества всех основных видов клеток крови. Никто так и не понял, почему недуг у меня появился. Я не подходил ни по одной из причин развития болезни. Опять-таки диагноз был пока только догадкой. Для того чтобы поставить точное заключение, нужно было меня оперировать, но этого они сделать не могли. Анализы выявили 3 тысячи тромбоцитов из нужных 180 тысяч. Это означало: кровь практически не свертывается. Поэтому мне начали переливать кровь, чтобы подготовить к операционному столу, но вены не выдерживали тех объемов, что вливали. Нужно было ставить катетер, а для этого нужна операция. Получался замкнутый круг. В итоге мои руки стали похожи на руки отпетого наркомана из-за синяков, появлявшихся каждое переливание.
Походы на процедуры, бесконечные кабинеты — всё это надоело. Я делал на автомате то, что мне говорили, и перестал следить за действиями врачей. Контролировала мама. Дошло до того, что она проверяла каждую ампулу. Иммунитет начал стремительно лететь к чертям. Организм стал воспринимать костный мозг как враждебный и чужеродный орган, поэтому включил все ресурсы для его ликвидации. Вся ирония в том, что иммунные клетки вырабатывает именно костный мозг. Мой организм боролся сам с собой. Отказывать стала печень. Началась поддерживающая терапия. Так долго продолжаться не могло, еще немного и организм бы просто не выдержал. Родственники морально готовили маму к моей смерти. Врачи же решили разорвать этот круг. Влили мне большее, чем обычно, количество крови. Провели операцию, чтобы поставить катетер в вену и узнать процент оставшегося костного мозга.
После операции выяснилось, что в организме всего десять процентов незараженного участка костного мозга. Местные и даже республиканские врачи отказывались меня лечить. Все ссылались на то, что не потянут. Предупредили: «Если хотите, чтобы сын выжил, нужно искать врача за пределами страны». Мы решили обратиться в другие клиники. Когда я выписывался из больницы в Алматы, мне дали пройтись без катетера целые сутки. То был блаженный день: не нужно было таскаться с огромным штативом, на котором висела куча препаратов. Наконец, я принял ванну как нормальный человек.
Вообще, у нас был выбор: Россия, Литва или Беларусь. Мы решили поехать в Россию.
В Москве есть клиника, которая строилась под надзором Путина. Национальный научно-практический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва. Невероятно элитарная больница в Москве, куда мы и отправились. Изначально они нас не приняли. Тогда мы через знакомых вышли на директора этой клиники. Как оказалось, что в Казахстане, что в России, всё решают связи.
В этом центре врач решил заново подтвердить диагноз и поставить катетер. Это значит — новая операция. Когда диагноз подтвердился, на удивление, врачи не стали пугать меня. Прогнозировали 70 % полного выздоровления. Не было разговоров о том, что я останусь инвалидом или умру. Они сказали забыть о всяческих терминах и специальных словах, потому что в процессе выздоровления я и мое стремление будут играть огромную роль.
На дворе был апрель. Лечение долго не могли начать. Показатели кровяных клеток оставались на минимальном уровне, иммунитет крайне ослаб. Количество лейкоцитов стало меньше допустимого в четыре раза. Если рядом со мной кто-то чихал, я мог слечь с температурой под 40. Мне давали жаропонижающее, но препарат помогал только в течение получаса. А потом температура вновь поднималась и меня лихорадило. Именно из-за такого состояния химиотерапию начали только через полторы недели после приезда в Москву.
Химиотерапия — процесс, когда я в принципе не чувствовал ничего. Мне было стабильно нормально. Вот после терапии стало намного хуже: если раньше хватало пол-литра крови на три дня, то после мне стали вводить это количество в день, затем — 750 мл, 850 мл и так далее. Я практически потреблял по литру крови в сутки. Параллельно с этим печень стала сильно сдавать от этого количества крови и от препаратов. Чтобы хоть как-то помочь организму, мне выписали строжайшую диету: нельзя жареное из-за нагрузки на печень, нельзя мучное или кисломолочное. За две недели я похудел практически на 15 килограмм.
Через месяц после химиотерапии показатели крови стали расти. Конечно, они не доходили даже до 50 % нужной цифры, но жить уже было можно. Прогресс был. Поэтому процесс переливания завершился. Меня переселили в корпус для тех, у кого была ремиссия, и я смог выбираться гулять по Москве. В июне было состояние, когда я мог передвигаться сам. Правда, всего 20 метров, но и это была маленькая победа. Я попросил врачей выписать меня, и мы улетели в Алматы.
Два месяца я довольно хорошо себя чувствовал, пока в августе на очередном обследовании мои показатели крови опять не упали. Две недели подряд после этого вновь началось: врачи, анализы, бесконечные звонки. За это время на фоне стресса показатели крови повысились, но местные врачи опасались таких скачков. Они предложили полететь в Турцию, чтобы сделать пересадку костного мозга. Опять стресс — количество кровяных клеток поднялось почти до нормы. Можно было остаться здесь, но в Турцию мы все же поехали. Правда, там операцию проводить отказались, бессмысленно было делать трансплантацию при нормальных результатах. Мы вернулись уверенные в том, что теперь все нормально. Такое чудесное выздоровление не редкость: одному знакомому не помогали таблетки, но сильный стресс нормализовывал результаты.
Мы платили за процесс лечения сами, потратили за три месяца 5 миллионов рублей по старому курсу. Государство никак не участвовало в этом, хотя просьбы были. Финансово помогали друзья и знакомые. Они перечисляли деньги на наш счет.
Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь
В Казахстане болеть вообще зашкварно. Если у вас нет денег лечиться за границей, то мне вас искренне жаль. Трусость казахстанских врачей и их нежелание браться за трудные кейсы могут привести к быстрой смерти. Связи — главный показатель, по которому они оценивают болезнь.
Сейчас мне 20 лет, и вот уже три года чувствую себя нормально. По сей день рецидивов не было. Я постоянно на дорогостоящих таблетках; это и поддерживает мою жизнь. Кратчайшее прекращение курса лечения может привести к скачку в анализе крови. Прогнозы говорят, что скоро заболевание может проявиться вновь, но я не живу в ожидании очередного черного периода и стараюсь радоваться каждому благополучно прожитому дню.
источник
На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
источник
Апластическая анемия – заболевание системы крови, заключающееся в аплазии (отсутствии формирования) клеток костного мозга, в результате чего развивается дефицит форменных элементов крови – панцитопения. Сходным с этим являются процессы гипоплазии, когда процессы кроветворения происходят в меньшем объёме, чем необходимо и развивается гипопластическая анемия. Обычно эти два понятия объединяют общим понятием апластической анемии.
Когда не известны причины, вызвавшие развитие заболевания, оно носит название идиопатическое. Такое встречается в большинстве случаев. Но иногда всё-таки удаётся установить причину. Ей может быть:
- действие ионизирующего излучения;
- токсины – бензол, инсектициды;
- лекарственные препараты – хлорамфеникол, нестероидные противовоспалительные средства, цитостатики;
- вирусы гепатита, Эбштейна — Барра;
- заболевания иммунной системы;
- генетические нарушения при созревании клеток костного мозга.
Наличие дефекта в стволовых клетках или снижение количества приводит к их низкой пролиферативной активности. Другим механизмом развития апластической анемии является нарушение регуляции иммунокомпетентными клетками процессов созревания ростков крови (гемопоэз). Патология микроокружения – один из возможных путей, приводящих к угнетению синтеза клеток крови или их полному отсутствию.
Возможно сочетание нескольких механизмов в развитии апластической анемии.
Анемия Фанкони – наследственное заболевание с аутосомно-рецессивным типом наследования. В результате мутации образуются белки, нарушающие процессы репарации (восстановление структуры) ДНК. Это приводит к высокой чувствительности и к повреждениям нуклеиновой кислоты, сопровождается прогрессированием нарушений костномозгового кроветворения и повышенной вероятностью развития опухолей.
Все основные симптомы апластической анемии возникают из-за дефицита клеток крови и нарушения их функции. Дефицит тромбоцитов приводит к развитию геморрагического синдрома, лейкоцитов (агранулоцитоз) – пониженному иммунитету, эритроцитов – анемическому синдрому.
Как уже было отмечено ранее, возможны острое и хроническое течение апластической анемии. У 15% больных заболевание протекает остро и сопровождается повышенной температурой тела, множественными кровоизлияниями. При врождённой форме (анемия Фанкони) возможны отставание в росте и развитии, «кофейные» пятна на кожном покрове.
Анемический синдром проявляется головокружением, мельканием «мушек» перед глазами, слабостью.
Лейкоцитопения – низкий уровень лейкоцитов сопровождается присоединением бактериальной инфекции.
Геморрагический синдром – проявляется кровотечениями (носовыми, десневыми, маточными), высыпаниями на коже. При кровоизлиянии в глазное дно это может проявляться снижением остроты зрения. Чаще всего это характерно для лиц молодого возраста с тяжёлой степенью апластической анемии.
Диагноз подтверждается на основании клинических симптомов, лабораторных и инструментальных методов исследования. Характерные симптомы апластической анемии указаны выше.
В первую очередь из лабораторных анализов назначается общий анализ крови, в котором отражается уровень всех форменных элементов. Как уже упоминалось не раз, будет наблюдаться панцитопения – низкие уровни клеток крови.
Обнаруженная анемия характеризуется по цветному показателю. При апластической анемии она нормохромная или возможна незначительная гиперхромность. Ретикулоциты снижены или отсутствуют. Показатели СОЭ (скорость оседания эритроцитов) будут повышены. Низкий уровень лейкоцитов возникает за счёт дефицита гранулоцитов, отмечается относительный лимфоцитоз. Нарушается структура тромбоцитов и их функциональные способности.
Проводят пункцию костного мозга. Характеристика полученного пунктата будет зависеть от того попала ли игла в угнетённый очаг или в остатки нормально функционирующего костного мозга. В первом случае пунктат будет обеднён клеточными элементами, снижено количество молодых форм гранулоцитов, повышено процентное количество лимфоцитов, также нарушены процессы дифференцировки и пролиферации.
Обнаружение бластных клеток в пунктате не имеет отношения к апластической анемии, значит, следует искать другой патологический процесс, сходный с этим по клиническим проявлениям и нарушениям созревания кроветворных клеток.
Отмечается отложение избытка железа в виде пигмента в печени, селезёнке, костном мозге. Для правильной диагностики необходимо выяснить, что могло привести к сниженному уровню лейкоцитов (токсические вещества, лекарственные средства, инфекционные агенты, аутоиммунные поражения, хронические воспалительные процессы, гипотиреоз).
Анемия, похожая на апластическую, может возникать при парциальной красноклеточной аплазии. При таком состоянии изолированно нарушаются процессы синтеза и дифференцировки клеток эритроидного ряда, возможна выработка антител к клеткам костного мозга.
Диагноз апластической анемии ставится при наличии любых 2 критериев из перечисленных ниже:
- уровень гемоглобина менее 100 г/л;
- уровень лейкоцитов менее 3,5 * 109 /л (содержание гранулоцитов менее 1,5 * 109/л);
- гипоклеточный костный мозг и уровень тромбоцитов менее 50 * 109/л.
Характеристика степеней тяжести апластической анемии представлена в таблице 1.
Таблица 1. Критерии степени тяжести апластической анемии.
| Степень тяжести | Критерии |
| Умеренная |
|
| Тяжёлая |
|
| Очень тяжёлая |
|
Основным методом лечения апластической анемии является восстановление количества кроветворных клеток, а также назначение иммуносупрессивной терапии для подавления иммунных реакций. Самым действенным методом считается пересадка стволовых кроветворных клеток.
При трансплантации костного мозга необходимо тщательно проводить оценку на совместимость донора и реципиента во избежание патологии «трансплантат против хозяина».
Отмечается тот факт, что при апластической анемии, вызванной химиотерапией и врождённых формах, терапия иммуносупрессорами не является эффективной.
К иммуносупрессивной терапии относятся:
- антилимфоцитарный иммуноглобулин;
- циклоспорин;
- глюкокортикоиды;
- цитостатики.
Обратите внимание, что самолечением не стоит заниматься, так как у каждого лекарственного средства есть свои показания, противопоказания, побочные эффекты.
Не разрешается употреблять иммуносупрессивные препараты при наличии инфекционно-воспалительного процесса, тяжёлых нарушении сердечно-сосудистой системы, печени, почек, не купируемом геморрагическом синдроме.
При любой терапии необходим контроль за пациентом со стороны медицинского персонала для оценки возможных аллергических реакций, которые могут возникнуть на компоненты лекарственного средства. Может быть отсроченная аллергическая реакция, проявляющаяся спустя 2 – 3 дня.
Использование ростовых факторов обеспечивает поддержание гранулоцитов на уровне 1 – 1,5 * 109/л. В качестве дополнительного метода лечения может быть назначен лимфоцитоплазмаферез. Он оправдан при наличии аллергической реакции или формировании антител к форменным элементам крови. Ещё одним направлением лечения апластической анемии является терапия, проводимая против основных осложнений: инфекционных, геморрагических, аллергических. В некоторых случаях проводится переливание тромбоцитарной и эритроцитарной масс.
Таблица 2. Показания к назначению трансфузии эритроцитарной массы и тромбоконцентрата.
| Комноненты крови для гемотрансфузии | Показания |
| Эритроцитарная масса | Гемоглобин менее 90 г/л Гематокрит менее 30% |
| Тромбоцитарная масса | Кровотечения на фоне низкого уровня тромбоцитов (10 – 20 * 109/л) |
Для оценки терапии используют понятие ремиссии. Улучшение костномозгового кроветворения – неполная (частичная) ремиссия, позволяет пациенту избегать зависимости от переливания крови. Число гранулоцитов в крови составляет более 0,5 * 109/л, что снижает риск тяжёлых инфекционных осложнений. Полная ремиссия сопровождается отсутствием клинических проявлений, уровень гемоглобина приходит в норму, количество тромбоцитов больше 100 * 109/л, гранулоцитарных лейкоцитов – 1 * 109/л.
Исход заболевания зависит от глубины и тяжести поражения костномозгового кроветворения. Прогноз может быть неблагоприятным при неожиданном резком развитии апластической анемии.
Профилактика развития апластической анемии заключается в ограничении влияния на организм неблагоприятных внешних факторов. Необходимо соблюдать правила техники безопасности при работе с ионизирующими излучениями, бензолом, избегать бесконтрольного приёма лекарственных средств, лечить заболевания органов и систем, приводящих к снижению гемопоэза, например, патология почек, цирроз печени.
При подтверждённой апластической анемии необходимо наблюдение за состоянием пациентов, постоянный контроль за уровнями форменных элементов, чтобы не пропустить рецидив и возможные осложнения.
Подводя итог всему вышесказанному, следует обратить внимание на то, что апластическая анемия может развиться неожиданно без какого-либо провоцирующего действия, приводить к геморрагическому, анемическому синдрому, вызывать инфекционно-воспалительные осложнения. Однако своевременно назначенная терапия грамотного специалиста позволит избежать неблагоприятного исхода.
Мы приложили много усилий, чтобы Вы смогли прочитать эту статью, и будем рады Вашему отзыву в виде оценки. Автору будет приятно видеть, что Вам был интересен этот материал. Спасибо!
источник
Апластическая анемия — это гематологический синдром, обусловленный действием большого количества экзогенных и эндогенных факторов. Характерным его признаком являются качественные и количественные изменения клеток гемопоэза и их микроокружения с развитием панцитопении в периферической крови, гипоклеточности и жировой инфильтрации костного мозга.
Определяют два возрастных пика заболеваемости апластической анемией — 20 и 65 лет. В связи с этим существует мнение о возможной этиологической роли вирусов (в молодом возрасте) и химических веществ (в пожилом). Однако большинство авторов склонны считать апластическую анемию полиэтиологическим заболеванием.
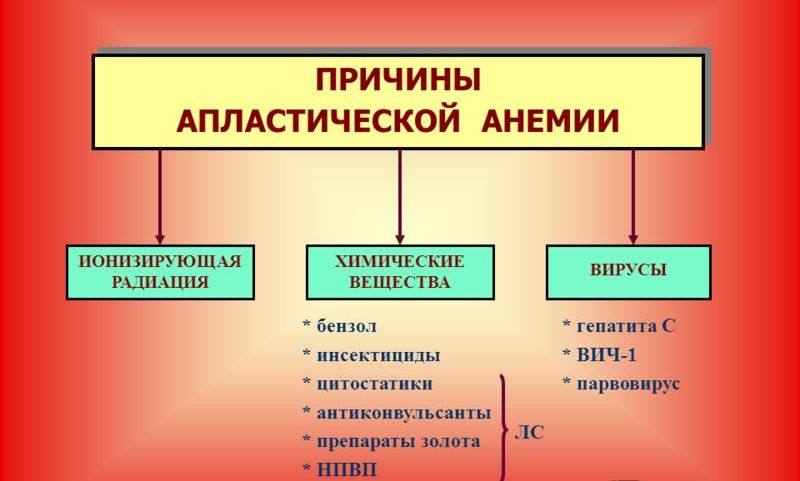
Вероятную причину возникновения апластической анемии выявляют примерно у 50% больных. К возможным этиологическим факторам относятся:
- некоторые лекарственные препараты (антибиотики, сульфаниламидные препараты, препараты золота, нестероидные противовоспалительные и успокаивающие средства, транквилизаторы, цитостатики и т.п.),
- химические вещества (пары ртути, кислот, красители, лаки, краски, средства бытовой химии, бензин, бензол, урсол и т.п.),
- физические факторы (радионуклиды),
- инфекционные агенты (вирусы гепатитов В, С, ретровирусы, микобактерия туберкулеза и т.д.),
- аутоиммунные процессы и заболевания (системная красная волчанка, синдром Шегрена, эозинофильный фасциит и т.п.).
В развитии апластической анемии имеет значение генетическая предрасположенность и индивидуальная реактивность организма. Рассматривают три главные концепции возможных механизмов возникновения нарушений костномозгового кроветворения при апластической анемии:
- поражение стволовых кроветворных клеток,
- нарушение иммунологического контроля за процессами гемопоэза (клеточного и гуморального),
- дефектность кроветворения микроокружения.
Первые клинические проявления апластической анемии бывают различными. Острое начало наблюдается в 12-15% больных. Для него характерны быстрое развитие анемии, выраженный геморрагический синдром, часто — лихорадка с ознобом. Острое начало обычно наблюдают с молодых людей. Чаще апластическая анемия развивается постепенно, проявляется анемичным и геморрагическим синдромами. Ход определяют у 85% больных апластической анемией.
Поводом для первичного обращения к врачу может быть нарастающая общая слабость, вялость, бледность, появление одышки и сердцебиения при ходьбе, боли в области сердца как признак анемической гипоксии. Иногда наблюдаются геморрагические проявления различной степени и локализации — кровотечения носовые и с десен, кожные геморрагии (от мелкоточечных до сплошных), меноррагия. Нередко возникают гематурия, кровотечения из пищеварительного тракта.
В 84% больных во время офтальмоскопии обнаруживают кровоизлияния в сетчатку. Часто наблюдают горячку, обусловленную некротическими изменениями слизистых оболочек ротовой полости, пищеварительного тракта, нагноением обширных кровоизлияний во внутренних органах и тканях. Таким образом, клинические проявления апластической анемии непосредственно связаны с изменениями в периферической крови (анемия, лейкопения, тромбоцитопения) и охватывают соответственно тощий, геморрагический синдромы и синдром инфекционных осложнений.
Для апластической анемии не характерны спленомегалия, гепатомегалия, увеличение лимфатических узлов. Увеличение размеров печени можно наблюдать разве что у лиц, переболевших гепатитом, а селезенки — у пациентов, которым неоднократно проводили гемотрансфузии. Апластическая анемия чаще развивается в течение длительного времени (месяцы и годы), может сопровождаться сначала редукцией одного из ростков кроветворения с постепенными изменениями со стороны всех ростков.
Лечение апластической анемии остается нерешенной проблемой, поскольку нет фундаментальных знаний о ее патогенезе, существует высокий риск фатальных осложнений лечения при тяжелых формах течения. Большинство современных методов лечения разработаны преимущественно на основании эмпирических результатов исследования.
Двумя ведущими направлениями в лечении апластической анемии являются мероприятия, направленные на восстановление костномозгового кроветворения и профилактики геморрагических и инфекционных осложнений и проявлений анемии. Лечение следует начинать немедленно после установления диагноза.
Использование циклоспорина А позволяет получить ответ почти у трети больных, рефрактерных к терапии антилимфоцитарным глобулином. Предполагают, что механизм действия циклоспорина А связан с необратимым и специфическим действием на геном стволовой клетки, с торможением апоптоза, угнетением продукции интерлейкина-2. Препарат не влияет на макрофагальное звено иммунитета и, как следствие, не уменьшает резистентность организма к инфекциям.
В течение первых 8-10 суток параллельно назначают антилимфоцитарный и антитромбоцитарный глобулин в виде длительной инфузии.
Из побочных эффектов применения указанных препаратов — высокая частота аллергических реакций немедленного (анафилактический шок) и замедленного (сывороточная болезнь, крапивница, миалгии, артралгии, гипертермия) типа.
Кортикоиды длительное время рассматривали как один из эффективных методов лечения апластической анемии. Однако доказано, что ремиссия после терапии кортикоидами наблюдается лишь у 12% пациентов, а комбинация кортикоидов с андрогенами не улучшает результатов лечения. Высокие дозы метилпреднизолона могут быть рекомендованы как альтернативная форма иммуносупрессивной терапии больных с тяжелым течением. Высокая частота осложнений не всегда позволяет его применять.
Сегодня трансплантация костного мозга — единственный радикальный метод лечения апластической анемии, поскольку в отдельных случаях может обеспечить восстановление нормального гемопоэза. Заместительную терапию компонентами крови проводят согласно обоснованным показаниями к ее назначению. Показания к трансфузии отмытых эритроцитов:
- уровень гемоглобина ниже 80 г/л;
- показатель гематокрита меньше 30%.
Угрозу системной или локальной инфекции определяют по уровню гранулоцитов. Фактором высокого риска возникновения инфекции следует считать уровень гранулоцитов ниже 0,2*10 9 /л, умеренного риска — уровень гранулоцитов 0,2-0,5*10 9 /л и низкого риска — более 0,5*10 9 /л. Для уменьшения риска кровоизлияний и местных воспалительных процессов внутримышечные и подкожные инъекции не проводят.
В случае возникновения лихорадки больным назначают эмпирическую антибактериальную терапию антибиотиками, прежде всего подавляют грамотрицательную микрофлору.
Использование андрогенов как самостоятельного метода лечения апластической анемии может быть оправданным при ее хроническом неагрессивном течении. Чаще всего применяют тестостерона пропионат, метилтестостерон, оксиметолон в начальной дозе 1-2 мг / кг массы те па в сутки. Лечение длится в среднем 1-3 мес. Спленэктомию как метод лечения апластической анемии последние годы почти не применяют.
Дифференциальную диагностику проводят с заболеваниями, которые сопровождаются панцитопенией. В клинической практике чаще всего приходится дифференцировать апластическую анемию с острыми лейкемиями, миелодиспластическим синдромом и волосатоклеточной лейкемией. Клиническая картина острой лейкемии, которая дебютирует панцитопенией, иногда не отличается от таковой при апластической анемии. Аспирационная биопсия костного мозга и трепанобиопсия позволяют верифицировать диагноз апластической анемии. При острых лейкемия может увеличиваться селезенка и появляться цитогенетические аномалии. Волосатоклеточная лейкемия может сопровождаться аплазией костного мозга, но чаще спленомегалией.
Наибольшие трудности возникают при дифференциальной диагностики, когда нет спленомегалии. При трепанобиопсии обнаруживают увеличение количества ретикулиновых волокон и замещение миелоидной ткани аморфным эозинофильным материалом. Применения метода проточной цитофотометрии позволяет выявить экспрессию рецепторов.
Миелодиспластический синдром иногда сложно разграничить с апластической анемией. Единственным методом, который позволяет провести дифференциальную диагностику в сложных случаях, является ультразвуковое исследование. Цитогенетические аномалии свидетельствуют о миелодиспластическом синдроме.
Анемия Фанкони бывает у детей 5-12 лет. Заболевание дебютирует тромбоцитопенией и анемией. Различают два типа анемии Фанкони — первый (классический) с грубыми пороками развития скелета и внутренних органов, а второй сказывается малыми аномалиями, гиперпигментацией участков кожи, задержкой роста.
Апластическая анемия способна осложниться тяжелой формой стероидного сахарного диабета, артериальной гипертензией, инфекционными осложнениями, в частности на фоне неадекватно подобранной терапии.
Лечение апластической анемии обычно требует госпитализации, хотя бы на начальный срок. Впоследствии больной может быть переведен на амбулаторное лечение или диспансерное наблюдение. Требуется соблюдение всех врачебных предписаний, полноценное питание, отсутствие умственныхз и физических нагрузок.
Доза применяемого при лечении апластической анемии циклоспорина А колеблется в пределах 5-10 мг/кг массы тела в сутки в два употребления, ее регулируют по уровню креатинина в сыворотке крови. Продолжительность курса в среднем составляет 3-10 месяцев (но не менее 3 месяцев).
Антилимфоцитарный глобулин назначают в дозе 15 мг/кг массы тела в сутки в виде длительной, 8-12-часовой инфузии ежесуточно в течение 8-10 суток.
Антитромбоцитарный глобулин назначают в дозе 0,75 мг/кг массы тела в сутки в виде длительной, 4-5-часовой инфузии ежесуточно в течение 8-10 суток.
Метилпреднизолон назначают в высоких дозах (0,5-1 г в сутки) внутривенно в течение 5 суток.
Метилтестостерон назначают в начальной дозе 1-2 мг/кг массы тела в сутки; лечение длится в среднем 1-3 месяцев.
Оксиметолон назначают в начальной дозе 1-2 мг/кг массы тела в сутки; лечение длится в среднем 1-3 месяцев.
Апластическая анемия — одно из самых тяжелых расстройств кроветворения со смертностью, превышающей 80%. Уже одно лишь это служит противопоказаниям ко всякого рода экспериментам в лечении. Недопустимо самолечение, разновидностью которого обычно и становится народная медицина. Ухудшения самочувствия сродни тем, которые наблюдаются при апластической анемии, должны быть поводом для немедленного обращения к медикам за профессиональной помощью.
Лечение апластической анемии в период беременности — сложный и трудоемкий процесс. Современная медицина не обладает широким арсеналом средств, восстанавливающих здоровье в этом случае, а потому и беременные женщины лечатся по стандартной схеме.
Такой диагноз в период беременности требует всего спектра дифференциальной диагностики и абсолютной уверенности доктора в том, что именно эта разновидность анемии развилась у будущей матери. Не исключена постановка вопроса о сохранении беременности, ведь лечение и сама по себе агрессивная болезнь отражается на формировании плода.
Диагноз апластической анемии преимущественно верифицируют по результатам исследования периферической крови и костного мозга. В анализах периферической крови пациентов с апластической анемией обнаруживают разной степени выраженности нормохромную анемию, концентрацию гемоглобина. На фоне анемии развивается лейкопения с гранулоцитопенией и относительным лимфоцитозом. Тромбоцитопения часто глубокая, иногда — до единичных тромбоцитов в мазках крови.
Наблюдают значительное увеличение СОЭ, особенно при выраженной анемии, очагах некроза и массивных геморрагиях. Особенностью апластической анемии является уменьшение количества ретикулоцитов в периферической крови. Появление в периферической крови эритрокариоцитов (нормобласты), морфологически измененных эритроцитов и лейкоцитов не характерно для апластической анемии.
Содержимое железа в сыворотке крови больных апластической анемией нормальное или несколько повышено. С помощью аспирационной биопсии костного мозга обнаруживают уменьшение общего количества миелокариоцитов, а также угнетение всех ростков гемопоэза.
В миелограмме обнаруживают значительные нарушения со стороны костномозгового кроветворения. Привлекает внимание снижение суммарного процентного содержания клеточных элементов гранулоцитопоэза вследствие уменьшения количества как молодых форм клеток нейтрофильного ряда, так и зрелых гранулоцитов. Часто отмечают повышение относительного содержания лимфоцитов и плазматических клеток в костном мозге. Наблюдают задержку созревания клеток эритроидного ряда на стадии полихроматофильных нормобластов (эритрокариоцитов). При этом активность эритроцитоза в целом, по данным миелограмы, может быть как пониженной, так и несколько повышенной. Мегакариоциты обнаруживают в незначительном количестве, часто с дегенеративными изменениями, нарушениями отшнуровки тромбоцитов. В пунктате в значительных количествах наявны жировые клетки и элементы стромального происхождения.
В гистологических препаратах трепанобиоптатов больных апластической анемией обнаруживают аплазию костного мозга с замещением кроветворной ткани жировой. При условии эффективного лечения в костном мозге восстановление гемопоэза начинается с эритроидного ростка. Позже восстанавливаются гранулоцитопоэз и в последнюю очередь регенерирует мегакариоцитарный росток.
Больным с тяжелым течением апластической анемии трепанобиопсию выполняют в условиях стационара, а пациентам с нетяжелым течением — в амбулаторных условиях или в дневном стационаре.
Иммунологические исследования при апластической анемии проводят для определения групп крови и резус-принадлежности, а также для проведения НLА-типирования при подборе костного мозга для трансплантации.
Вирусологические исследования при апластической анемии сводятся к выявлению антител к цитомегаловирусной инфекции (СМV), поскольку «серонегативные» по СМV-инфекции больные должны получать СМV-негативные компоненты крови.
При необходимости определяют маркеры гепатитов, прежде всего гепатита В и С. УЗИ брюшной полости и забрюшинного пространства позволяет выявить аномалии почек, наряду с рентгенологическим изменениями костей предплечья и кистей рук у детей и лиц молодого возраста может свидетельствовать об анемии Фанкони — наследственной форме апластической анемии. Наличие сплено- и гепатомегалии может указывать на гемобластоз.
Цитогенетические исследования в сложных диагностических случаях помогают отбросить миелодиспластический синдром. Свойственные цитогенетические аномалии и для анемии Фанкони.
Критерии диагноза апластической анемии:
- концентрация гемоглобина менее 100 г/л или показатель гематокрита ниже 30%.
- количество лейкоцитов в периферической крови меньше 3,5*10 9 /л, количество гранулоцитов меньше 1,5*10 9 /л.
- количество тромбоцитов в периферической крови меньше 50*10 9 /л.
Диагноз апластической анемии считают достоверным при наличии двух из трех названных критериев в сочетании с гипоклеточным костным мозгом при отсутствии бластных форм в периферической крови и в костном мозге. В зависимости от изменений в периферической крови и миелограмме выделяют следующие клинические формы анемии:
- с нетяжелым течением;
- с тяжелым течением;
- со сверхтяжелым ходом.
Апластическая анемия с нетяжелым течением имеет такую лабораторно-гематологическую характеристику:
- в периферической крови количество гранулоцитов более 0,5*10 9 /л,
- тромбоцитов — 20-50*10 9 /л,
- ретикулоцитов — более 1%,
- в костном мозге (по данным аспирационной биопсии костного мозга и трепанобиопсии) рядом с участками уменьшенной клеточности определяют зоны сохраненного гемопоэза,
- содержание немиелоидных клеток составляет менее 50%,
- по данным трепанобиопсии наблюдают признаки гипоплазии костного мозга.
Для апластической анемии с тяжелым течением характерно:
- уменьшение в периферической крови количества гранулоцитов (менее 0,5*10 9 /л),
- уменьшение в периферической крови количества тромбоцитов (менее 20*10 9 /л),
- уменьшение в периферической крови количества ретикулоцитов (менее 1%),
- в костном мозге — снижение количества миелокариоцитов (менее 40*10 9 /л),
- содержание немиелоидных клеток — более 50%,
- по данным трепанобиопсии проявляют аплазию костного мозга.
Для апластической анемии со сверхтяжелым ходом характерными признаками являются:
- острое начало и тяжелые клинические проявления заболевания,
- гранулоцитопения (менее 0,2*10 9 /л),
- тромбоцитопения (ниже 20,0*10 9 /л).
Информация предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
источник


