Нарушение кровообразования зависит от ряда причин. Основные из них следующие:
недостаток факторов, необходимых для осуществления нормального эритропоэза. Сюда относятся анемии, связанные с дефицитом в организме железа, витаминов B12, B6, В2, фолиевой кислоты, белков (голодание) и микроэлементов (Си, Со, Zn, Мn);
расстройство нейрогуморальной регуляции эритропоэза. Здесь главная роль принадлежит недостаточной продукции эритропоэтина или его инактивации ингибиторами;
токсическое действие на костный мозг некоторых микробных токсинов, химических и лекарственных средств, ионизирующей радиации и пр. (гипо- и апластические анемии);
метастазы злокачественных опухолей в костный мозг, лейкозы (метапластические анемии).
Несмотря на то, что все перечисленные анемии объединяются по патогенезу как анемии вследствие нарушенного кровообразования, процесс нарушения эритропоэза в разных случаях анемий обусловлен разными частными механизмами.
Железодефицитные анемии составляют наибольший процент среди всех случаев малокровия.
Этиология. Основные причины железодефицитных анемий следующие: 1) хронические кровопотери (вместе с эритроцитами теряется железо); 2) нарушение всасывания железа (удаление желудка, отсутствие секреции соляной кислоты, заболевания кишечника — энтериты); 3) повышенное расходование запасов железа (беременность, лактация, период роста у детей); 4) нарушение включения железа в синтез гема (наследственный дефект ферментов, отравление свинцом).
Железодефицитная анемия может сочетаться с тканевым дефицитом железа в организме, признаками которого являются: ломкость ногтей, выпадение волос, атрофический процесс в слизистой оболочке желудка (атрофический гастрит) и другие симптомы. С развитием атрофи-ческого гастрита ухудшается всасывание железа и прогрессирует малокровие.
Патогенез. При дефиците железа нарушается синтез гемоглобина в эритро- и нормобластах. Недостаточная гемоглобинизация клеток красной крови приводит к задержке их созревания и выхода в кровеносное русло. Увеличивается процент неэффективного эритропоэза. Неэффективным эритропоэзом называют процесс разрушения эритроидных клеток в костном мозге, в норме он не превышает 20%. Развивается анемия гипорегенераторного типа. Железодефицитные анемии обычно гипохромные с цветовым показателем ниже единицы (0,8-0,4), так как концентрация гемоглобина падает в большей степени, чем количество эритроцитов. Характерным признаком является сидеропения — уменьшение уровня железа в плазме крови до 100 мкг/л (норма в среднем 1000 мкг/л).
Картина крови. В периферической крови наблюдается пойкило-цитоз (наличие эритроцитов разной формы) и анизоцитоз (эритроциты разной величины) с преобладанием микроцитов. Количество ретикулоцитов увеличивается незначительно, в тяжелых случаях падает ниже нормы.
В12-дефицитные и фолиеводефицитные анемии.
Этиология. Основными причинами являются нарушение всасывания или повышенное расходование витамина B12 и фолиевой кислоты, реже недостаточное поступление их с пищей.
Нарушение всасывания витамина B12 наиболее выражено при анемии Аддисона—Бирмера развитие которой обусловлено отсутствием в желудочном соке больных внутреннего фактора Касла (гастромукопротеина).
В отсутствие гастромукопротеина витамин B12 разрушается в кишечнике и не усваивается. С недостатком в организме этого витамина нарушается нормальный эритропоэз, возникает мегалобластический тип кроветворения, ведущий к развитию малокровия.
Для анемии Аддисона — Бирмера характерны и другие признаки авитаминоза B12: «полированный язык» из-за атрофии сосочков языка, шаткая походка, вызванная дегенеративными изменениями в задних и боковых столбах спинного мозга (фуникулярный миелоз).
Дефицит гастромукопротеина создается также после резекции желудка. Вначале развивается железодефицитная анемия вследствие ограниченного всасывания железа, а через 3 — 4 года — мегалобластическая анемия, так как к этому времени истощаются запасы эндогенного витамина B12.
Витамин В12 и фолиевая кислота плохо усваиваются при различных поражениях тонкого кишечника (резекция кишки, паразитирование широкого лентеца, энтериты).
Мегалобластическая анемия наблюдается иногда у беременных. Причиной служит интенсивное потребление плодом витамина B12 и фо-лиевой кислоты, когда эмбриональный тип кроветворения у плода сменяется нормобластическим (на IV —V месяце развития).
Патогенез. Витамин B12 и фолиевая кислота необходимы для нормального эритропоэза. При недостатке витамина B12 затрудняется переход фолиевой кислоты в ее метаболически активную форму — тетрагид-рофолиевую кислоту. В результате этого нарушается синтез ДНК в кроветворных клетках, в частности эритро- и нормобластах. Задерживается их деление и созревание, чем и обусловлен переход нормобластического эритропоэза в мегалобластический. В костном мозге преобладают клетки патологической регенерации. Характерной чертой мегалобластического эритропоэза является его неэффективность: резко увеличивается процент разрушающихся в костном мозге незрелых клеток (до 50%). Из-за подавления митотической активности и неэффективного эритропоэза значительно уменьшается количество поступающих в кровь эритроцитов (анемия гипорегенераторного типа).
Картина крови. В периферической крови появляются «гигантские» клетки с диаметром до 12 — 15 мкм — мегалоциты и единичные, содержащие ядро мегалобласты. Эти клетки менее устойчивы, чем нормальные эритроциты, и легко подвергаются гемолизу, что усугубляет анемию. В крови могут быть обнаружены эритроциты с патологическими включениями в виде телец Жолли (остатки ядра), колец Кебота (остатки оболочки ядра) и эритроциты с базофильной зернистостью. Отмечается выраженный пойкилоцитоз и анизоцитоз с преобладанием макроцитов, встречаются нейтрофилы с гиперсегментированным ядром. Анемия сопровождается лейкопенией и тромбоцитопенией.
Мегалобластические анемии относятся к анемиям гиперхромным с цветовым показателем выше единицы (1,3-1,5). Гиперхромия обусловлена крупным размером клеток. Общее содержание гемоглобина в крови значительно падает, еще более резко снижается количество эритроцитов (до 2х106 и ниже в 1 мкл).
Гипо- и апластические анемии возникают от токсического действия на костный мозг ионизирующей радиации, некоторых химических и лекарственных средств (бензол, цитостатические препараты, антибиотики), наблюдаются при инфекционных заболеваниях, нарушениях гормональной регуляции эритропоэза, аутоиммунных процессах. Замещение кроветворной ткани опухолевыми клетками (при лейкозах, метастазах рака в костный мозг) приводит к развитию метапластической анемии. При воздействии на костный мозг указанных выше факторов повреждаются и гибнут стволовые клетки, подавляются процессы деления и созревания кроветворных клеток, сокращается объем кроветворной ткани, что ведет к опустошению (аплазии) костного мозга. Отмечается прогрессирующее падение эритропоэза. Количество эритроцитов падает, резко снижается содержание в крови гемоглобина, цветовой показатель остается в пределах нормы. Как правило, анемия сочетается с лейкопенией и тромбоцитопенией.
источник
БОЛЕЗНИ КРОВИ.
Группа заболеваний или состояний, характеризующихся снижением содержания гемоглобина в единице объема крови, чаще при одновременном уменьшении кол-ва эритроцитов. Созревание эритроцитов происходит в костном мозге, поэтому на основании изучения пунктата можно судить о состоянии эритропоэза – гипо- или гиперрегенерация, а также можно определить тип эритропоэза- эритробластический, нормо- или мегалобластический.
При анемии происходит ряд характерных изменений эритроцитов: нарушение их формы (пойкилоцитоз, анизоцитоз), и размеров (микро-, макроцитоз), насыщение эритроцитов гемоглобином (гипо-, гиперхромия), появление включений – базофильных зерен (тельца Жолли) и базофльных колец (Кебота), а также при некоторых формах эдерных эритроцитов (эритробласты, нормобласты, мегалобласты) и незрелых форм.
Классификация. На основании этиологии и патогенеза 3 группы:
— вследствие кровопотери – постгеморрагические
— вследствие нарушенного кровообразования
— вследствие повышенного кроворазрушения – гемолитические.
По течению А. м.б. острой и хронической.
ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИЯ.
Может быть острой и хронической.
ОСТРАЯ ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИЯ.
Причины.Массивное кровотечение при язве желудка, разрыве маточной трубы, ветви легочной артерии, аневризмы аорты. При повреждении аорты потеря 1л. крови приводит к смерти вследствие резкого падения артериального давления даже без значительного малокровия внутренних органов. При повреждении более мелких сосудов и потери более половины общего объема крови смерть наступает от острой сердечной недостаточности при выраженном малокровии внутренних органов.
Патогенез. Быстрое уменьшение общего объема крови, что ведет к острой гипоксии. Наблюдаются одышка, сердцебиение, в крови повышается уровень катехоламинов, в результате гипоксии повышается содержание эритропоэтина, который стимулирует пролиферацию чувствительных к нему клеток костного мозга, в периферической крови появляются ретикулоциты.
П\а. Отмечается бледность кожных покровов и внутренних органов – острое малокровие. Костный мозг плоских костей бледно-красный.
ХРОНИЧЕСКАЯ ПОСТЕМОРРАГИЧЕСКАЯ АНЕМИЯ
Причины. Длительная кровопотеря при опухолях, расширенных геморроидальных венах, при кровотечениях из полости матки, язвы желудка, гемофилии, выраженном геморрагическом синдроме.
Патогенез. Нарастающий дефицит железа, поэтому эту анемию в настоящее время относят к железодефицитной.
П\а.бледность кожных покровов, малокровие внутренних органов, жировая дистрофия миокарда, печени, выраженный геморрагический синдром, костный мозг плоских и трубчатых костей красный, имеются очаги экстрамедуллярного кроветворения.
АНЕМИИ ВСЛЕДСТВИЕ НАРУШЕНИЯ КРОВООБРАЗОВАНИЯ.
Виды анемий:
– всл. алиментарной недостаточности железа
— всл. экзогенной недостаточности в связи с повышенными запросами организма
( ювенильный хлороз, беременность, лактация, инфекции)
— всл. резорбционной недостаточности (энтериты, резекция тонкой кишки)
2. Обусловленные нарушением синтеза или утилизации порфиринов:
— приобретенные (отравление свинцом, дефицит вит В6)
3. Обусловленные нарушением синтеза ДНК и РНК – мегалобластные анемии:
— вследствие дефицита вит В12; связанные с болезнями в тонкой кишке; с конкурентным расходом вит. В12.
— вследствие дефицита фолиевой кислоты: анемии, связанные с болезнями тонкой кишки; с конкурентным расходом фолиевой кислоты;
Редко встречаются наследственные анемии, обусловленные нарушением активности ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований.
4. Гипо- и апластические анемии, вызванные эндогенными экзогенными и
Следует отметить, что все эти анемии развиваются в течение длительного времени. Поэтому в клинических и морфологических проявлениях ведущим является состояние хронической гипоксии. В связи с этим имеются общие морфологические проявления этих анемий:
— стромально-сосудистые: отек и фиброз стромы в органах, диапедезные кровоизлияния, гемосидероз;
— изменения паренхиматозных органов: дистрофия и атрофия;
— проявления регенераторных возможностей кроветворной ткани: появление красного костного мозга в трубчатых костях, очагов экстрамедуллярного кроветворения в лимоузлах, селезенке, в строме печени, слизистых и серозных оболочках, клетчатке ворот почек;
Анемии, возникающие при недостатке железа, вит. В12, фолиевой к-ты, принято называть дефицитными,а при недостаточности усвоения этих в-в – ахрестическими.
Железодефицитные анемии.
1) Недостаточное поступление железа с пищей; у новорожденных – при недостатке у матери, при искусственном вскармливании:
2) Половое созревание – «бледная немочь» (андрогены активизируют эритропоэз, эстрогены не обладают таким действием;
3) Экзогенная недостаточность в связи с повышенными запросами у беременных и кормящих;
4) Недостаточное всасывание вследствие заболеваний жкт
П\а. Малокровие внутренних органов развивается не сразу, отмечается дистрофия паренхиматозных элементов органов. Кожа сухая, с трещинами в углах рта, вогнутые ногти, атрофия сосочков языка, атрофический гастрит. Костный мозг трубчатых костей красный, выявляются очаги экстрамедуллярного кроветворения.
Анемии, обусловленные нарушением синтеза и утилизации порфиринов.
Различают наследственные и приобретенные.
Наследственные анемии. Снижение активности ферментов, участвующих в синтезе гемма. Нарушается синтез порфирина, что мешает связывать железо, и оно накапливается в организмею железа в сыворотке много, однако эффективного эритропоэза не происходит, эритроциты становятся базофильными, в них мало Нв. В костном мозге накапливается большое кол-во сидеробластов, Во многих органах – гемосидероз, т.к. железо утилизируется мф-гами. Со временем в печени развивается цирроз и печеночная недостаточность, изменения в миокарде приводят к сердечной недостаточности, склеротические процессы в поджелудочной железе проявляются симптомами сахарного диабета.
Приобретенные анемии. При отравлении свинцом (свинец блокирует ферменты в синтезе гемма). В крови при этом появляется большое кол-во ретикулоцитов, в моче выявляется аминолипоевая кислота. Нарушается метаболизм нервной системы. Развивается двигательный полиневрит, астения, нарушения жкт.
Анемии при дефиците вит В6, который способствует синтезу порфиринов, при длительном применении противотуберкулезных препаратов, у детей при искусственном вскармливании.
Дата добавления: 2016-10-27 ; просмотров: 509 | Нарушение авторских прав
источник
1. Анемии, связанные с нарушением образования гемоглобина:
1.1. Анемии, связанные с дефицитом железа,
Анемии, связанные с нарушением синтеза ДНК и РНК (мегалобластные):
2.2. Анемия, связанная с дефицитом фолиевой кислоты.
3. Анемии, связанные с гибелью кроветворных клеток костного мозга:
5. Метапластические анемии, связанные с вытеснением (замещением) кроветворной ткани. Причины: опухоль, миелофиброз.
Разберем некоторые наиболее распространенные анемии этой группы.
В основе патогенеза – нарушение образования гемма.
Самая распространенная — составляет 80% среди всех форм малокровия. По данным ВОЗ, число людей, страдающих дефицитом железа, достигает 200 млн. человек. Чаще ЖДА страдают дети раннего возраста (около 50%), беременные и женщины детородного периода (порядка 10%, при этом скрытый дефицит железа имеется у 20% женщин).
Железо – один из основных организменных микроэлементов: его содержание у взрослого человека составляет 4-5 г.
Распределение железа в организме:
70% от общего количества – в составе гемопротеинов (соединений, в которых железо связано с порфирином). Основной представитель этой группы – Нв (58% железа). Также в эту группу входят миоглобин (8% железа), цитохромы, пероксидазы и каталазы (4% железа).
Группа митохондриальных окислительно-восстановительных негемовых ферментов (ксантиноксидаза, НАД∙Н-дегидрогеназа и т.д.), участвующих в транспорте электронов. Железа в их составе мало, однако их синтез напрямую связан с его содержанием в организме.
Транспортные формы железа – трансферрин, лактоферрин и низкомолекулярный переносчик (транспортирует железо внутри эритроцитов).
Депонированное железо – ферритин и гемосидерин.
В виде ферритина депонируется около 70% резервного железа. Молекулы ферритина имеются во всех клетках, но особенно его много в печени, селезенке, костном мозге.
Гемосидерин запасает 30% железа.
О запасах железа в тканях судят по количеству сидеробластов – клеток, содержащих негемовое железо.
Всасывание железа. Абсорбция железа происходит в 12п. кишке и начальном отделе тощей кишки (1-2 мг в сутки). Валентность, по современным данным, не влияет на всасывание, решающее значение имеет растворимость железа. Во всасывании негемового железа участвуют желудочный сок и соляная кислота. Они обеспечивают восстановление окисной формы железа (Fe 3+) в закисную (Fe 2+ ), ионизацию железа, повышая его доступность для всасывания. Гемовое железо всасывается независимо от желудочной секреции в виде порфириновой структуры, в слизистой кишечника происходит его отщепление от гема и образование ионизированного железа. В связи с этим железо лучше всасывается из мясных продуктов (прежде всего из печени, телятины), содержащих гемовое железо, нежели из растительных, включающих негемовое железо (железом богаты фасоль, бобы, петрушка, укроп, салат). Мед, сахар, масло железа не содержат.
Далее железо попадает в энтероцит и затем в плазму крови. В энтероцитах избыток железа может задерживаться в соединении с апоферритином. Энтероцит, перегруженный железом, продвигается от основания к вершине ворсинки и теряется со слущенным эпителием, предотвращая тем самым избыток металла в организме.
В плазме железо связывается с трансферрином и транспортируется в костный мозг, затем в эритрокариоциты, после чего трансферрин возвращается в плазму. В эритрокариоцитах железо переносится в митохондрии, где синтезируется гем. Количество рецепторов к трансферрину снижается по мере созревания (старения) клеток.
Железо, высвобождающееся при гемолизе (до 15-20 мг в сутки), вновь утилизируется (макрофагами) и идет на синтез гемоглобина.
Физиологическая потеря железа – 1 мг в сутки. Оно теряется с отшелушивающимся эпителием кожи, слущивающимся эпителием кишечника, потом, мочой, калом. У женщин также во время менструаций, родов, лактации (до 800-1000 мг).
В том случае, когда потери железа не компенсируется уровнем его поступления с пищей, развивается ЖДА.
Патогенез: снижение содержания железа в сыворотке крови, костном мозге, депо нарушение синтеза Нв нарушение образования эритроцитов, снижение их пролиферативной активности, активация неэффективного эритропоэза, укорочение жизни эритроцитов.
Классификация ЖДА (по патогенезу — 5 групп):
Связанные с недостаточным исходным уровнем железа (у недоношенных, новорожденных и детей первых лет жизни),
Связанные с повышенной потребностью в железе — при беременности, лактации, усиленном росте (у подростков — ювенильный хлороз),
Связанные с нарушением всасывания железа и поступлением его с пищей (при хронических энтеритах, после резекций тонкой кишки, желудка и др.),
Связанные с нарушением транспорта железа (наследственные атрансферринемии).
Клиника ЖДА обусловлена недостаточным снабжением тканей кислородом.
— Извращение обоняния (пристрастие к запахам ацетона, керосина, бензина, нафталина, лака для ногтей, резины), вкуса (склонность к употреблению в пищу мела, угля, глины, песка, льда, теста, крупы, мясного фарша) – pica chlorotica (в переводе с латинского – птица, поедающая землю). Предположительная причина подобных нарушений — дефицит железа в клетках ЦНС.
— Сухость кожи, выпадение, сечение и преждевременное поседение волос, ломкость и истончение ногтей, их уплощение — койлонихии – ложкообразные ногти с поперечной или продольной исчерченностью. Желтые подошвы и ладошки.
— За счет тканевого дефицита железа поражаются слизистая рта и ЖКТ: стоматит, глоссит, дисфагия (проявляется затруднением глотания плотной и сухой пищи), угнетение кислотообразования в желудке. Может быть кариес.
— Непроизвольное мочеиспускание при кашле и смехе вследствие мышечной слабости.
— Вегето-сосудистые расстройства: неустойчивое АД, потливость.
— Страдает также клеточный иммунитет, нарушаются процессы дифференцировки лимфоцитов, фагоцитоза.
Кровь. Нв 60-70 г/л, эритроцитов – 1,5-2,0 Т/л, средний объем эритроцитов — 80-84 фл. Гипохромные эритроциты с широким просветлением в центре (бублики или колечки), анизоцитоз с преобладанием микроцитов, пойкилоцитоз. Ретикулоцитоз в случае кровопотери, в остальных случаях – в пределах нормы.
Костный мозг. Задержка созревания эритрокариоцитов на стадии полихроматофильных нормобластов – серый КМ, реже — базофильных нормобластов – синий КМ, снижение числа сидеробластов (это нормобласты с единичными гранулами железа в цитоплазме), признаки дистрофических изменений в клетках эритроидного ряда.
Важное диагностическое значение имеют также показатели обмена железа (сывороточное железо и коэффициент насыщения трансферрина железом — ↓; железосвязывающая способность сыворотки крови — ↑).
Лечение. Препараты железа (двухвалентного) – соли, в основном сульфаты железа (150-200 мг в сутки) в сочетании с веществами, улучшающими его всасывание (аскорбиновая, лимонная и янтарная кислоты). У больных с нарушениями всасывания – парентеральное введение.
источник
Анемии – это группа заболеваний, характеризующихся снижением содержания гемоглобина в единице объема крови с одновременным уменьшением количества эритроцитов.
При исследовании мазков периферической крови пациентов, больных анемией, находят следующие изменения эритроцитов: нарушение формы (пойкилоцитоз, анизоцитоз), размеров диаметра (макроцитоз, микроцитоз), изменение степени насыщения эритроцитов гемоглобином (гиперхромия, гипохромия), появление ядерных остатков в цитоплазме эритроцита (базофильных телец Жоли, базофильных колец Кабо). При некоторых формах анемии в периферической крови появляются незрелые эритроциты, содержащие ядро (эритробласты, нормобласты, мегалобласты) и полихроматофильные эритроциты.
Анемии характеризуются уменьшением числа эритроцитов и количества гемоглобина в единице крови. Но при некоторых заболеваниях число эритроцитов не уменьшается, хотя наблюдается значительное уменьшение гемоглобина. Такая ситуация наблюдается при железодефицитной анемии.
При анемиях изменяется морфология эритроцитов в периферической крови: появляется:
- Пойкилоцитоз – эритроциты разной формы;
- Анизоцитоз – эритроциты различной величины;
- Гиперхромные, гипохромные (в зависимости от интенсивности окраски).
- В эритроцитах могут быть остатки ядер (тельца Жоли – базофильные зерна, и кольца Кабо – базофильные кольца). (Рис. 1, 2)
В крови могут появляться незрелые формы эритроцитов: эритробласты, оксифильные, полихроматофильные, базофильные нормоциты, мегалобласты, мегалоциты и др. В периферической крови изучают гемограмму, включающую количество гемоглобина, клетки крови, в т.ч. эритроциты, тромбоциты, лейкоциты и лейкоцитарную формулу, которая представляет процентное соотношение лейкоцитов. Ретикулоциты периферической крови подсчитывают на 1 тысячу эритроцитов. Норма ретикулоцитов – до 2%.
Так как созревание эритроцитов происходит в красном костном мозге, для уточнения гематологического диагноза производят пункцию грудины с целью получить пунктат красного костного мозга или трепанобиопсию крыла подвздошной кости для получения биоптата. При исследовании пунктата и биоптата оценивают эритропоэз (нормальная регенерация, гипорегенерация, гиперрегенерация) и выявляют тип эритропоэза (эритробластический, мегалобластический, нормобластический). Также рассчитывают соотношение лейкоцитарных и эритроидных клеток костномозгового пунктата (Л:Э). Процентное выражение клеточного состава костного мозга называется миелограммой (Рис.3, 4).
Классификация анемий.
На основании этиологии и патогенеза различают три основные группы анемий: постгеморрагические (вследствие кровопотери), анемии вследствие нарушенного кровообразования, гемолитические (вследствие повышенного кроверазрушения).
Острая постгеморрагическая анемия возникает в результате массивного кровотечения при травмах, ранениях, а также при осложнениях язв желудка, разрывах маточной трубы и других повреждениях сосудов. Чем крупнее поврежденный сосуд, тем более опасным является кровотечение. При повреждении аорты происходит резкое падение артериального давления после потери более одного литра крови, что приводит к смерти. При этом внутренние органы мало изменены. При кровотечении из более мелких сосудов и при потере больше половины общего объема крови смерть наступает от острой сердечной недостаточности, а во внутренних органах отмечается выраженное малокровие.
В патогенезе острой постгеморрагической анемии основную роль играет одновременное уменьшение плазмы крови и эритроцитов, что ведет к острой гипоксии. Это проявляется у пациентов в виде одышки и сердцебиения.
При вскрытии отмечается бледность кожных покровов и внутренних органов. Красный костный мозг плоских костей розовый. Морфология внутренних органов без особенностей.
Хронические постгеморрагические анемии. Основными причинами их возникновения являются осложненные кровотечениями язвы желудка, опухоли, варикозные расширения геморроидальных вен, гемофилии, выраженный геморрагический синдром. В начале хронического кровотечения регенераторная функция костного мозга компенсирует потерю эритроцитов. В результате гипоксии повышается содержание эритропоэтина, который стимулирует пролиферацию клеток красного костного мозга, в периферической крови увеличивается количество ретикулоцитов. Но одновременно с эритроцитами пациент теряет железо, содержащееся в гемоглобине. Поэтому постгеморрагическая анемия переходит в железодефицитную.
В периферической крови наблюдается гипохромная анемия с низким цветовым показателем (до 0,5-0,6 при норме 0,86–1,05), с наличием микроцитоза, пойкилоцитоза, анизоцитоза. Одновременно часто отмечают лейкопению с относительным лимфоцитозом. Количество ретикулоцитов увеличивается (2-4%).
В красном костном мозге, также как при острой кровопотере есть гиперплазия эритроидного ростка с увеличением общего количества нормоцитов до 30-40%, за счет, главным образом, базофильных или полихроматофильных эритроидных клеток.
Макроскопически отмечается бледность кожных покровов, бледность внутренних органов, возникающая гипоксия органов и тканей приводит к жировой дистрофии миокарда печени, почек. Часто выражен геморрагический синдром вследствие потери тромбоцитов при кровотечении, который проявляется в виде кровоизлияний на слизистых и серозных оболочках. Наблюдаются очаговые превращения желтого костного мозга в красный, появляются очаги экстрамедуллярного кроветворения в печени и селезенке.
2. Сидероахрестические (сидеробластные).
3. Анемии, при недостатке В12 и (или) фолиевой кислоты, связанные с нарушением синтеза ДНК и РНК.
4. Гипопластические и апластические.
Железодефицитные анемии (ЖДА) самые частые (700000 человек в мире страдают этим заболеванием). Причинами возникновения ЖДА являются недостаток поступления с пищей железа (алиментарная), что бывает у недоношенных детей, т.к. основной запас железа новорожденные получают от матери в последние дни нормальной беременности. ЖДА возникают также у беременных и кормящих женщин в связи с повышенными запросами организма, у девушек при ювенильном хлорозе (заболевание, связанное с недостатком железа в организме и развившееся на фоне дисфункции половых желез и расстройства менструального цикла). Поздний хлороз появляется во время климакса. ЖДА возникают также из-за недостатка всасывания железа при заболеваниях ЖКТ и после резекции желудка или кишечника.
Картина крови: Гипохромная анемия с низким цветовым показателем (Рис.5). Количество эритроцитов снижено, но может быть и в норме. В костном мозге отмечается увеличение числа эритроидных клеток до 40-50% с преобладанием базофильных и полихроматофильных нормоцитов, отмечается много микроэритробластов. Уровень плазменного железа снижен.
Сидероахрестические (сидеробластные) анемии связаны с нарушением синтеза и утилизации порфиринов, вследствие чего железо плохо используется для синтеза гемоглобина. При этих анемиях также наблюдается низкий уровень гемоглобина. Среди них есть наследственные – сцепленные с Х-хромосомой, и приобретенные, например, при свинцовой интоксикации (сопровождается невритами). Для сидероахрестических анемий характерны:
– гипохромия эритроцитов периферической крови,
– расширенный эритроидный росток красного костного мозга,
– преобладание базофильных эритробластов в пунктате (т.к. они не могут превратиться в полихроматофильные из-за недостатка гемоглобина),
– повышенное количество сидероцитов и сидеробластов в костном мозге, которое обнаруживается при специальной окраске для выявления железа в цитоплазме эритроидных клеток,
– высокое содержание сывороточного железа.
Анемии вследствие недостатка витамина В12 и фолиевой кислоты. Для нормального эритропоэза в красный косный мозг должны поступать витамин В12 и фолиевая кислота, которые участвуют в синтезе ДНК при делении клеток. Всасывание витамина В12 происходит в тонком кишечнике после предварительного связывания с гастромукопротеином желудка. Развитие пернициозной (В12-дефицитной) анемии может быть обусловлено недостатком гастромукопротеина в связи с наследственной неполноценностью добавочных клеток фундальных желез. Но чаще встречается приобретенная В12-дефицитная анемия, развившаяся при участии аутоиммунного механизма.
При этом в организме появляются антитела одного из трех типов:
- Антитела могут блокировать витамин В12, не давая ему возможности соединиться с гастромукопротеином;
- Блокируют гастромукопротеин или комплекс гастромукопротеин – витамин В12;
- Против париетальных клеток.
В результате нарушается пролиферация клеток всех быстро обновляющихся тканей, к которым, в первую очередь, относится кроветворный костный мозг. Основным проявлением нарушения кроветворения становится анемия с уменьшением числа эритроцитов и увеличением их размеров, так как синтез гемоглобина не нарушен, что получило наименование кроветворения по мегалобластическому типу. Неустойчивость мембраны мегалобластов и мегалоцитов ведет к тому, что они частично разрушаются еще в костном мозге, а затем и в периферической крови. Процессы кроверазрушения преобладают над процессами кроветворения. С разрушением элементов крови связан общий гемосидероз, а с нарастающей гипоксией – жировая дистрофия органов. В крови наблюдается гиперхромная анемия с цветовым показателем выше 1 и наличием мегалоцитов, редко мегалобластов. Число ретикулоцитов уменьшено. Отмечается пойкилоцитоз, анизоцитоз, лейкопения, в лейкоцитарной формуле – сдвиг вправо с наличием гигантских нейтрофилов. Количество тромбоцитов снижено с увеличением их размера. СОЭ увеличена.
Патологическая анатомия. Кожа бледная, с желтым оттенком. Подкожный жировой слой развит. Гипостазов нет. Кровь водянистая. Во внутренних органах: селезенке, печени, почках – гемосидероз. Наиболее выражены изменения в ЖКТ, в костном мозге и спинном мозге. В ротовой полости – гунтеровский глоссит – изменения языка. В начале заболевания края и кончик языка ярко-красного цвета, а затем воспалительные явления исчезают, сосочки языка атрофируются, и он становится лакированным. Одновременно с атрофией слизистой языка развивается атрофия слизистой оболочки глотки, пищевода. Наиболее типичным симптомом является атрофия слизистой желудка, а затем и кишечника.
Очень характерны изменения со стороны нервной системы. В спинном мозге, в задних и боковых столбах, выражен распад миелина и осевых цилиндров, что получило название – фуникулярный миелоз. У больных проявляется понижением чувствительности, снижением двигательной функции и т.д. Могут быть очаги ишемии и размягчения головного и спинного мозга.
В периферической крови видны мегалоциты и гиперсегментированные нейтрофилы (Рис.6). Исследование костного мозга дает возможность поставить точный диагноз. Общее количество миелокариоцитов увеличено. Имеется гиперплазия эритроидного ростка, преимущественно за счет появления базофильных форм мегалобластов (их может быть до 30% от общего числа ядерных элементов костного мозга).
В костном мозге виден распад мегалобластов и мегалоцитов и последующий эритрофагоцитоз. Значительная часть гемоглобиновых пигментов (порфирин, гематин) не используются, циркулируют в крови и выводятся из организма преимущественно почками, в которых постепенно развивается гемоглобинурийный нефроз. В селезенке и лимфатических узлах видны очаги экстрамедуллярного кроветворения.
С дефицитом гастромукопротеина связано развитие пернициозно-подобных состояний при раке желудка, лимфогранулематозе желудка, сифилисе желудка, полипозе, коррозивном гастрите (с повреждением половины слизистой желудка и более при отравлениях). При всех этих заболеваниях в желудке возникают дистрофические изменения, приводящие к гибели добавочных и париетальных клеток с развитием недостаточности витамина В12. Такой же генез имеет пострезекционная В12-дефицитная агастрическая анемия.
При нарушении всасывания витамина В12 в кишечнике также возникает В12–фолиево-дефицитная анемия. Это может быть при глистной инвазии (дифиллоботриозная), спру (заболевание, связанное с поражением кишечника, изменениями в нервной и эндокринной системах). Нарушается всасывание витаминов и после удаления тонкой кишки.
В12–фолиево-дефицитная анемия развивается также при использовании некоторых лекарственных препаратов, аналогов фолиевой кислоты (аметоптерин, метотрексат и др.).
В последние годы летальность от пернициозной анемии резко снизилась, в связи с хорошей диагностикой и лечением витаминами В12 и фолиевой кислотой.
Гипо- и апластические анемии. Характеризуются прогрессирующим падением эритропоэза, гранулопоэза, тромбопоэза, вплоть до полного истощения костного мозга. Причины могут быть эндо- и экзогенные. Среди эндогенных причин преобладают наследственные. К ним относятся семейная апластическая анемия Фанкони, при которой аплазия костного мозга сочетается с пороками развития. Впервые выявляется в детском возрасте и гипопластическая анемия Эрлиха, при которой гипоплазия костного мозга сочетается с выраженной кровоточивостью.
Для гипо- и апластических анемий характерно поражение эритроидного и миелоидного ростков кроветворения. В пунктате из грудины нет молодых форм эритроцитов. Красный костный мозг замещается желтым (жировым). В случаях полного опустошения костного мозга говорят о «чахотке» костного мозга – панмиелофтизе. В периферической крови – выраженная анемия с небольшим снижением цветового показателя. Количество гемоглобина может падать до 20 г/л. Число эритроцитов снижается до 1·10 12 /л. Резко падает число лейкоцитов и тромбоцитов.
Причиной возникновения экзогенных апластических анемий могут быть радиактивное облучение, лекарственные препараты (цитостатики, барбитураты, амидопирин, хлорамфеникол) и другие токсические вещества – бензол, фенол и др.
При экзогенных гипопластических анемиях, в отличие от эндогенных, гемопоэз вначале подавляется не полностью. В пунктате из грудины можно найти молодые формы эритро- и миелопоэтических рядов. Однако при длительном воздействии патогенного фактора наступает опустошение красного костного мозга – панмиелофтиз. Для точной диагностики этого состояния применяют трепанобиопсию. Из крыла подвздошной кости берут маленький участок костной ткани, где можно увидеть соотношение красного и желтого костного мозга и выявить процессы склерозирования.
Из-за неустойчивости эритроцитов и поражения тромбоцитарного ростка присоединяются гемолиз, множественные кровотечения, развивается общий гемосидероз, жировая дистрофия паренхиматозных органов, язвенные и некротические процессы.
Гипо и апластические анемии могут возникать при лейкозах, в результате замещения нормального кроветворения опухолевым клоном, и при метастазировании в костный мозг клеток злокачественных опухолей, таких как рак предстательной, молочной, щитовидной желез и желудка (Рис.7).
К этой группе относится также анемия при мраморной болезни (врожденный остеосклероз), при которой наблюдается избыточное костеобразование, ведущее к сужению просвета костей. На месте губчатого вещества появляется плотное вещество, на срезе напоминающее шлифованный мрамор.
К ним относятся заболевания, при которых кроверазрушение преобладает над кровообразованием. Разрушение эритроцитов при гемолизе приводит к общему гемосидерозу и надпочечной желтухе. Иногда развивается гемоглобинурийный нефроз – заболевание почек, при котором продукты распада гемоглобина поражают проксимальные канальцы почек. Появляется гемосидерин в почечном эпителии, вызывая некроз эпителия и разрывы базальных мембран.
В костном мозге наблюдается гиперплазия. Костный мозг разрастается в плоских и трубчатых костях, становится сочным, розово красным, ярко красным. Костномозговое кроветворение происходит усиленно, и незрелые клетки эритроидного ряда ускоренно вымываются в периферическую кровь. В крови значительно растет количество ретикулоцитов. В селезенке, лимфатических узлах, рыхлой соединительной ткани появляются очаги экстрамедуллярного кроветворения.
Гемолитические анемии подразделяют на анемии, обусловленные внутрисосудистым и внесосудистым гемолизом. Гемолитические анемии, обусловленные внутрисосудистым гемолизом по причинам возникновения подразделяют на:
- Токсические (возникают под действием ядов, токсинов).
- Инфекционные (малярия).
- Посттрансфузионные.
- Иммунные гемолитические анемии (гемолитическая болезнь новорожденных).
- Аутоиммунные гемолитические анемии (при аутоиммунных заболеваниях, таких как системная красная волчанка, при хроническом лимфолейкозе, при вирусных инфекциях, при лечении некоторыми лекарственными препаратами и других).
Гемолитические анемии, обусловленные преимущественно внесосудистым (внутриклеточным) гемолизом, часто носят наследственный характер. Для анемий этой группы характерна триада признаков: анемия, спленомегалия и желтуха.
К гемолитическим анемиям этой группы относят мембранопатии, в основе которых лежат дефекты клеточной мембраны эритроцитов, что обуславливает их нестойкость, захват и разрушение макрофагами ретикулоэндотелиальной системы селезенки, костного мозга, лимфоузлов, печени. К основным эритромембранопатиям относят микросфероцитарную гемолитическую анемию и овалоцитарную гемолитическую анемию.
Эритроцитоферментопатии обусловлены отсутствием какого-то фермента в эритроцитах или изменением его активности. Дефицит в эритроцитах глюкозо-6-фосфатдегидрогеназы проявляется у больного (при вирусных инфекциях, приеме некоторых лекарств и т.д.) в виде острых гемолитических кризов, но может дать и хроническую гемолитическую болезнь (Рис.8).
Гемоглобинопатии (гемоглобинозы) связаны с нарушением синтеза глобина и его цепей. Молекула глобина состоит из 4 цепей. В гемоглобине А (α2 β2), который у взрослого человека составляет 97 %, глобин состоит из 2 α-цепей и 2 β-цепей. При гемоглобинопатиях може быть нарушена скорость синтеза одной из цепей (талассемии), либо изменен аминокислотный состав одной или обеих цепей. При некоторых гемоглобинопатиях (серповидноклеточная анемия) человек в повседневной жизни может чувствовать себя достаточно хорошо. Но при повышенной нагрузке, сопровождающейся повышенной потребностью в кислороде (физическая нагрузка, подъем в горы) развивается ацидоз, растворимость гемоглобина нарушается, и он выпадает в осадок, часто с разрывом мембраны эритроцитов, их распадом и развитием гемолитической анемии. Серповидноклеточная анемия и талассемии распространены в средиземноморском регионе. Отмечено, что такие люди легче переносят малярию, которая, видимо, и явилась фактором их выживания (отбора) в условиях частых эпидемий.
источник
Факторы, способствующие возникновению лейкозов. Основные клинико-морфологические синдромы при лейкозах. Образование анемии вследствие нарушения кровообразования. Дефицит внутреннего фактора Касла при астерофическом гастрите, раке и резекции желудка.
Нажав на кнопку «Скачать архив», вы скачаете нужный вам файл совершенно бесплатно.
Перед скачиванием данного файла вспомните о тех хороших рефератах, контрольных, курсовых, дипломных работах, статьях и других документах, которые лежат невостребованными в вашем компьютере. Это ваш труд, он должен участвовать в развитии общества и приносить пользу людям. Найдите эти работы и отправьте в базу знаний.
Мы и все студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будем вам очень благодарны.
Чтобы скачать архив с документом, в поле, расположенное ниже, впишите пятизначное число и нажмите кнопку «Скачать архив»
Лейкозы – заболевания с первичным поражением костного мозга. Этиология и патогенез гемобластозов. Общие положения опухолевой прогрессии. Отличие лейкозов от других опухолей. Изучение классификации неходжкинских лимфом. Причины смерти больных лейкозами.
презентация [5,0 M], добавлен 18.07.2017
Патологические процессы как основа развития анемических состояний. Причины железодефицитной анемии. Потери железа организмом. Анемии вследствие кровопотери, вследствие нарушения кровообразования и связанные с нарушением синтеза и утилизации порфиринов.
презентация [495,2 K], добавлен 30.03.2016
Этиология, патогенез, клинические проявления, диагностика и методы лечения анемии Аддисона-Бирмера. Условия развития мегаобластной анемии при раке желудка. Особенности протекания гипо- и апластической анемии, определение способов ее профилактики.
реферат [842,7 K], добавлен 15.09.2010
Основные факторы риска, способствующие возникновению рака желудка. Характеристика гистологического строения опухоли. Исследование имплантационного и лимфогенного метастазирования. Анализ психических изменений у больных онкологическими заболеваниями.
дипломная работа [635,9 K], добавлен 25.05.2017
Лейкоз (лейкемия, белокровие) — клональное злокачественное заболевание кроветворной системы. Классификация лейкозов, этиологические факторы, течение болезни. Клиника и группы риска острых лейкозов, морфологические особенности, диагностика и лечение.
презентация [4,0 M], добавлен 14.02.2014
Классификация анемий на основании особенностей этиологии и патогенеза. Острая и хроническая постгеморрагическая анемия. Виды болезни вследствие нарушения кровообразования. Клинико-морфологическая картины тромбоцитопатии. Сущность и причины тромбоцитоза.
реферат [31,3 K], добавлен 08.02.2009
Лейкозы — многочисленные опухоли, возникающие из кроветворных клеток и поражающие костный мозг. Продолжительность заболевания, этиология и патогенез. Причины острых и хронических лейкозов, клиническая картина, лечение и применение антибиотиков.
реферат [25,2 K], добавлен 17.09.2009
Гипопластические анемии — это нарушения гемопоэза, характеризующиеся редукцией эритроидного, миелоидного и мегакариоцитарного кроветворных ростков костного мозга и панцитопенией в крови. Этиология, патогенез, диагностика и методы лечения заболевания.
презентация [465,5 K], добавлен 03.04.2012
Понятие и классификация лейкозов, основные причины и предпосылки их возникновения, клиническая картина и симптомы, Этиология и порядок диагностирования данной группы заболеваний, принципы составления схемы лечения. Сестринский процесс при лейкозах.
реферат [16,0 K], добавлен 28.04.2011
Инфекционно-воспалительное поражение костного мозга при заболевании остеомиелитом. Классификация заболевания, характеристика стадий его развития. Факторы, способствующие возникновению острого посттравматического остеомиелита при открытых переломах костей.
презентация [3,3 M], добавлен 27.04.2013
источник
Виды анемий вследствие нарушения кровообразования:
1. Вследствие алиментарной недостаточности железа;
2. Вследствие экзогенной недостаточности железа в связи с повышенными запросами организма (ювенильный хлороз) у беременных, кормящих женщин, при инфекциях;
3. Вследствие резорбционной недостаточности железа (энтериты, резекция тонкой кишки);
Обусловленные нарушением синтеза или утилизации порфиринов:
2. Приобретенные (отравление свинцом; дефицит витамина В6).
Обусловленные нарушением синтеза ДНК и РНК—мегалобластные анемии:
1. Вследствие дефицита витамина В12: злокачественная, или пернициозная, анемия; анемии, связанные с болезнями тонкой кишки; анемии, связанные с конкурентным расходом витамина В12;
2. Вследствие дефицита фолиевой кислоты: анемии, связанные с болезнями тонкой кишки, связанные с конкурентным расходом фолиевой кислоты.
Гипопластическая и апластическая анемия, вызванная эндогенными, экзогенными или наследственными факторами.
Следует отметить, что все эти анемии развиваются в течение длительного времени, поэтому в клинических и морфологических проявлениях ведущим является состояние хронической гипоксии. В связи с этим имеются общие морфологические проявления этих анемий:
Ш Стромально-сосудистые: отек и фиброз стромы в органах, диапедезные кровоизлияния, гемосидероз;
Ш Изменения паренхиматозных элементов: дистрофия и атрофия;
Ш Проявление регенераторных возможностей кроветворной ткани: появление красного костного мозга в трубчатых костях, очагов экстрамедуллярного кроветворения в лимфатических узлах, селезенке, в строме печени, клетчатке ворот почек, слизистых и серозных оболочках.
Анемии, возникающие при недостатке железа, витамина BJ2, фолиевой кислоты, принято называть дефицитными, а при недостаточном усвоении этих веществ в костном мозге — ахрестическими.
1. Недостаточное поступление железа с пищей; у новорожденных детей — при недостатке железа у матери, при искусственном вскармливании;
2. Половое созревание, особенно у девушек. В литературе эта болезнь описана как «бледная немочь». Причина этого заболевания в том, что андрогены активируют эритропоэз, усиливая всасывание железа, в то время как эстрогены не обладают таким действием;
3. Экзогенная недостаточность железа в связи с повышенными запросами у беременных и кормящих;
4. Недостаточное всасывание железа вследствие заболеваний желудочно-кишечного тракта (операции на ЖКТ, резекция желудка и 12 перстной кишки).
По данным разных авторов, железодефицитная анемия существует у 27 % детей белой расы и у 40 % черной расы, а также у 20 % женщин детородного возраста.
Клинические проявления. Слабость, головокружение, одышка, обмороки. Сидеропенические проявления: трещины в углах рта, выраженные изменения кожи, ногтей и волос, извращение вкуса, боль и покраснение языка, дисфагия, ложные позывы на мочеиспускание, мышечная слабость, что обусловлено недостаточностью фермента глицерофосфатоксидазы, который содержит железо; ахилия — снижение секреции в желудочно-кишечном тракте.
Патологическая анатомия. Малокровие внутренних органов развивается не сразу, отмечается дистрофия паренхиматозных элементов органов. Кожа сухая с трещинами в углах рта, вогнутые ногти, атрофия сосочков языка, атрофический гастрит. Костный мозг трубчатых костей красный, выявляются очаги экстрамедуллярного кроветворения.
источник
B12-дефицитная и фолиеводефицитная анемия — это анемии связанные с нарушением синтеза нуклеиновых кислот и заменой нормобластического типа кроветворения мегалобластическим из-за недостатка в организме витамина B12 и фолиевой кислоты.
1. Недостаток витамина в пище.
2. Неусвоение витамина B12 в желудке, что может быть связано с нарушением функции фундального отдела желудка, который вырабатывает гастромукопротеин (витамин B12 усваивается в комплексе с гастромукопртеином). Нарушение функции обкладочных клеток вызывается воздействием на них аутоантител (пернициозная или Аддисона-Бирмера или злокачественная анемия). Кроме того, подобное состояние может возникнуть после резекции желудка.
3. Неусвоение витамина B12 в кишечнике (при резекции тонкой кишки, опухоли, спру, дифиллоботриозе, алкоголизме).
4. Повышенное расходование витаминов при беременности.
5. Нарушение депонирования витаминов в печени при ее диффузном поражении.
Патогенез. Дефицит витамина B12 и фолиевой кислоты, участвующих в образовании тимина, входящего в состав ДНК, снижает скорость ее образования. Замедление репликации ДНК в тканях, где в норме деление клеток происходит наиболее интенсивно ( в кроветворной ткани) приводит к формированию крупных клеток крови: мегалоцитов, мегалобластов, гигантских мегакариоцитов. Созревание мегалобластов до мегалоцитов сопровождается нарушением энуклеации (об этом свидетельствуют появление в мегалоцитах телец Жолли (остатки ядра) и колец Кебота (остатки ядерной облочки)). Наличие большого количества мегалобластов и мегалоцитов, насыщенных гемоглобином, обуславливает гиперхромию (ЦП>1.0). В крови встречается много дегенеративно измененных эритроцитов(:пойкилоцитоз, анизоцитоз с микроцитозом, гиперхромия, мегалоциты с патологическими включениями). Уменьшается количество клеток физиологической регенерации (ретикулоциты, полихроматофилы), т.к. в костном мозге наблюдается раздражение эритроцитарного ростка с преобладанием мегалобластического типа кроветворения над нормобластическим. Наблюдается тромбо — и лейкоцитопения с атипическими клетками.
В результате недостатка витамина B12 в организме накапливается метилмалоновая кислота, которая токсична для нервных клеток. Кроме того, при дефиците витамина B12 в нервных волокнах синтезируются жирные кислоты с измененной структурой, что отражается на образовании миелина и приводит к повреждению аксона. Развивается дегенерация задних и боковых столбов спинного мозга (фуникулярный миелоз), поражаются черепно-мозговые и периферические нервы.
Дефицит витамина B12 (цианкоболамина) приводит к:
1. Нарушению перехода: фолиевая кислота → тетрагидрофолиевая кислота → тимин → ДНК,. при котором страдают активно размножающиеся клетки кроветворной ткани (анемия);ЖКТ (воспалительно-атрофические процессы в слизистой).
2. Нарушение перехода метилмалоновой кислоты в янтарную (накопление метилмалоновой кислоты) оказывает токсическое действие на нервную систему.
3. Нарушение образования миелинав результате синтез жирных кислот с измененной структурой.
Железодефицитная анемия вызванна недостатком железа в организме в результате нарушения баланса между его поступлением, потреблением и потерей. Это самый распространненый вид анемии (80% всей заболевемости анемией).
1. Хронические кровопотери, приводящие к потере железа вместе с эритроцитами.
2. Повышенная потребность в железе (в период роста, созревания, беременности, лактации).
3. Алиментарная недостаточность железа.
а) при ахлоргидрии (соляная кислота ионизирует железо, что необходимо для его усвоения);
б) при авитаминозе витамина C (витамин C стабилизирует железо в двухвалентной форме, а трехвалетное железо организмом не усваевается);
в) при энтеритах и резекции тонкой кишки.
5. Нарушение транспорта железа (наследственная атрансферринемия, гипотрансферринемия при поражениях печени).
6. Недостаточная утилизация железа из его резерва (при инфекции, интоксикации).
7. Нарушение депонирования железа (при гепатитах, циррозах).
Недостаток железа в организме проявляется исчезновением гемосидерина в клетках печени и селезенки, снижением количества сидеробластов и сидероцитов в костном мозге. В крови уменьшается содержание сывороточного железа и степень насыщения им трансферрина (белка-переносчика железа), что ведет к снижению транспорта железа в костный мозг. Нарушается включение железа в эритроцитарные клетки, при этом снижается синтез гема и глобина, уменьшается активность некоторых ферментов в эритроцитах,что вызывает повышение их чувствительности к окислителям (т.к. неполноценность ферментативных процессов ведет к неустойчивости клеточных мембран), и эритроциты подвергаются гемолизу под действием окислителей. Продолжительность жизни эритроцитов сокращается.
Дефицит железа в организме приводит к уменьшению миоглобина и активности железосодержащих факторов тканевого дыхания. Развивается гемическая гипоксия, с атрофическими и дистрофическими процессами в тканях и органах (особенно в ЖКТ и миокарде).
Железодефицитная анемия — нормобластическая, гипохромная (из-за недостаточной гемоглобинизации). В мазке крови наблюдается анизоцитоз (микроцитоз), пойкилоцитоз. Количество ретикулоцитов зависит от регенерирующей способности костного мозга (анемия может быть в начале регенераторной, а затем гипорегенераторной).
источник
Группа анемий, объединенных одним общим механизмом развития, который заключается в нарушении или полном прекращении эритропоэза в результате дефицита веществ, необходимых для осуществления нормального кроветворения, носит название дефицитных анемий.Сюда относят дефицит микроэлементов (железо, медь, кобальт), витаминов (В12, B6, В2, фолиевая кислота) и белков.
При замещении костномозговой полости жировой, костной или опухолевой тканью (метастазы опухолей в костный мозг, лейкоз), а также при действии физических (ионизирующая радиация) и химических факторов, некоторых микробных токсинов и лекарственных препаратов развиваются анемии в результате сокращения площади кроветворения.
Железодефицитные анемии.Анемии, обусловленные дефицитом железа в организме, относятся к числу наиболее распространенных заболеваний в мире и составляют 80-95% всех форм малокровия. Наиболее часто они встречаются у детей младшего возраста, девушек-подростков и женщин детородного возраста.
Этиология. Железодефицитная анемия может быть обусловлена самыми разнообразными причинами: недостаточным поступлением железа с пищей, нарушением всасывания его в тонком кишеч-
нике, повышенной потребностью в период роста, беременностью, лактацией, кровотечениями из различных органов и др. Однако наиболее частой причиной железодефицитной анемии являются кровопотери и в первую очередь длительные постоянные кровотечения даже с небольшими потерями крови. В этих случаях количество теряемого железа превышает его поступление с пищей. Дефицит железа в организме развивается при суточной потере его в количестве, превышающем 2 мг. Схема метаболизма железа представлена на рис. 14-5.
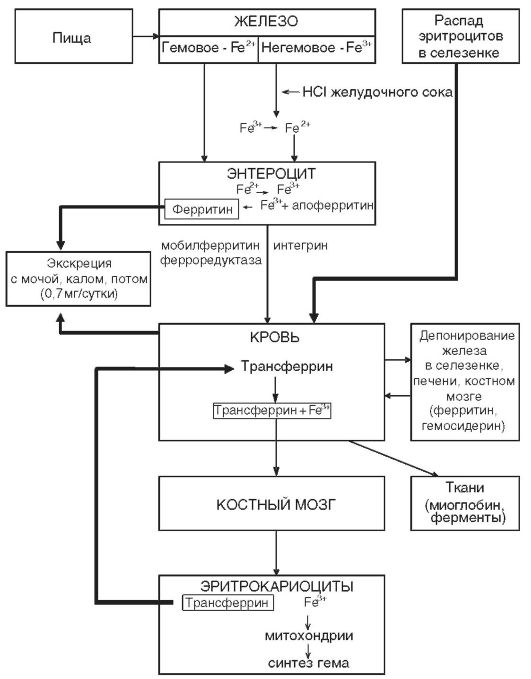
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л.И. Идельсон): 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа (табл. 14-4).
Таблица 14-4.Причины и механизмы развития железодефицитных состояний
| Этиологические факторы | Патогенез | |
| группы факторов | характеристика | |
| Особенные периоды жизни | Дети недоношенные и новорожденные Дети первых лет жизни | Недостаточный исходный уровень железа |
| Интенсивный рост (пубертатный период) Беременность Лактация | Повышенное расходование железа | |
| Патологические состояния | Хроническая кровопотеря: при частых лечебных кровопусканиях, донорстве; при заболеваниях сердечнососудистой системы (гипертоническая болезнь, геморрагическая телеангиэктазия и др.); при патологии желудочнокишечного тракта (варикозное расширение вен пищевода, диафрагмальная грыжа, язва желудка и двенадцатиперстной кишки, язвенный колит, дивертикулез, геморрой и др.); из органов мочеполовой системы (алкогольная нефропатия, туберкулез почек, почечнокаменная болезнь, полипы и рак мочевого пузыря, обильные меноррагии, эндометриоз, миома матки и др.); из органов дыхательной системы (рак легкого, туберкулез, бронхоэктазия и др.); | Повышенная потеря железа |
| при заболеваниях системы крови (лейкозы, апластическая анемия и др.); при патологии системы гемостаза (аутоиммунная тромбоцитопения, гемофилии, ДВС-синдром и др.) | ||
| Патологические состояния и болезни | Патология желудочно-кишечного тракта: резекция желудка и кишечника; гипосекреция желудочного сока; хронический энтерит; дисбактериозы; глистные инвазии и др. | Нарушение всасывания железа |
| Наследственная атрансферринемия Приобретенная гипотрансферринемия (при нарушении белоксинтезирующей функции печени) | Нарушение транспорта железа | |
| Алкоголизм | Комбинация факторов: недостаточное поступление железа; нарушение транспорта железа; нарушение всасывания железа; потеря железа | |
| Неблагоприятные воздействия | Нерациональное питание: голодание; вегетарианская диета; искусственное вскармливание грудных детей | Недостаточное поступление железа |
| Избыточные физические нагрузки | Повышенное расходование железа |
Патогенез. Основным звеном патогенеза заболевания является снижение содержания железа в сыворотке крови, костном мозгу и депо. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мы-
шечная слабость и др. (сидеропенический синдром Вальденстрема). В патогенезе клинических проявлений болезни в еще большей степени, чем недостаточное снабжение тканей кислородом, имеет значение нарушение активности железосодержащих ферментов в тканях организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, α-глицерофосфатоксидаза). Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до (2,0-1,5)-10 12 /л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозгу и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозгу не превышает 10-15%). Содержание ретикулоцитов колеблется в пределах нормы, но при значительной кровопотере бывает несколько повышенным. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов.
В костном мозгу отмечаются нарушение процессов гемоглобинизации эритрокариоцитов, сопровождающееся увеличением количества базофильных и полихроматофильных нормобластов при параллельном снижении числа их оксифильных форм, а также резкое уменьшение количества сидеробластов — нормобластов, содержащих единичные гранулы железа в цитоплазме (в норме до 20-40%).
В диагностике железодефицитной анемии решающее значение имеют показатели обмена железа (сывороточное железо, железосвязывающая способность сыворотки, общий запас железа в организме и др.). Количество железа в сыворотке крови при выраженной железодефицитной анемии падает до 5,4-1,8 мкМ/л при норме 12,5-30,4 мкМ/л (мужчины; у женщин этот показатель на 10-15% ниже). Увеличивается железосвязывающая способность сыворотки. В норме одна треть трансферрина насыщена железом, а две трети — свободны. Под общей железосвязывающей способностью сыворотки понимается не абсолютное количество трансферрина, а коли-
чество железа, которое может связаться с трансферрином (в норме 54,0-72,0 мкМ/л). Содержание ферритина в сыворотке крови, по результатам радиоиммунологических методов исследования, при железодефицитных анемиях снижается до 9,0-1,5 мкг/л (в норме — 12-300 мкг/л). Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6-1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
В12-дефицитные и фолиеводефицитные анемии.Витамин В12 и фолиевая кислота — кофакторы синтеза ДНК. Их дефицит сопровождается нарушением процессов пролиферации клеток с высоким кругооборотом — клеток крови, клеток кишечного эпителия и как следствие развитием анемии, характеризующейся наличием в костном мозгу мегалобластов, расстройствами пищеварения. Сочетанный дефицит витамина В12 и фолиевой кислоты встречается редко, чаще наблюдается изолированный дефицит витаминов.
Этиология. Дефицит витамина В12 чаще развивается в результате нарушения его всасывания при снижении секреции внутреннего фактора Касла (рис. 14-6) вследствие атрофии слизистой желудка либо после резекции желудка (агастрические анемии). У большинства больных с дефицитом витамина В12 обнаруживаются антитела, направленные против обкладочных клеток желудка и внутреннего фактора Касла. В12— и фолиеводефицитные состояния могут развиваться также при инвазии широким лентецом, поглощающим большое количество витамина В12, при беременности, нарушении всасывания витамина В12 в кишечнике, реже — при недостатке поступления с пищей (табл. 14-5).
Таблица 14-5.Причины развития мегалобластных анемий
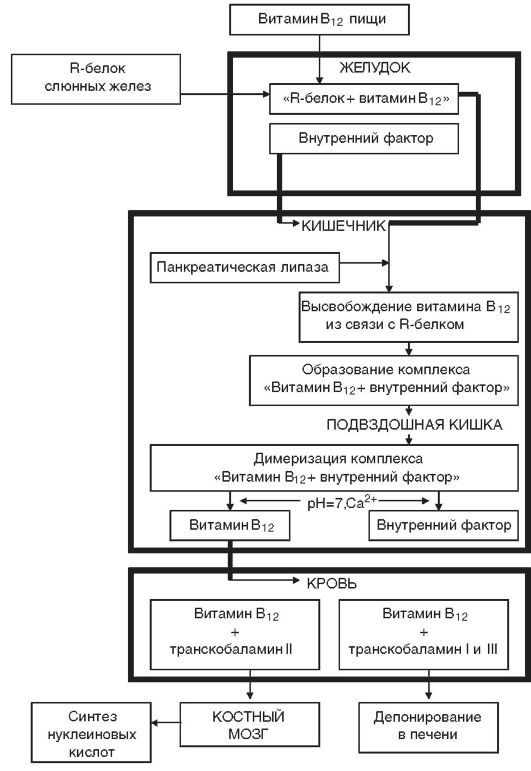
Пернициозная анемия (болезнь Аддисона-Бирмера). Представляет собой одну из форм заболевания, связанного с дефицитом фактора Касла и связанной с ним недостаточностью витамина В12. Различают наследственную и приобретенную формы болезни (см. табл. 14-5). Приобретенная форма анемии чаще развивается у лиц пожилого возраста (в среднем в возрасте 60 лет), редко встречается у детей в возрасте до 10 лет (ювенильная форма). Заболевание характеризуется поражением трех систем: пищеварительной (воспаление и атрофия сосочков языка, гистаминрезистентная ахилия, связанная с глубокой атрофией слизистой желудка, в peзультате чего железы дна и тела желудка прекращают выработку внутреннего фактора Касла — гастромукопротеина), нервной (фуникулярный миелоз — дегенерация задних и боковых столбов спинного мозга, нарушение кожной и вибрационной чувствительности, мышечно-суставного чувства, изменение ахилловых, коленных и др. рефлексов) и кроветворной (гиперхромная макроцитарная мегалобластическая анемия).
Патогенез. Расстройства пищеварения и переход на мегалобластический тип кроветворения обусловливаются резким снижением активности В12-зависимых энзимов, участвующих в метаболизме фолатов (соли фолиевой кислоты), необходимых для синтеза ДНК. При этом обнаруживается yменьшение активности метилтрансферазы, сопровождающееся кумуляцией в клетках неактивного метилтетрагидрофолата и нарушением синтеза ДНК (синтез РНК не страдает) (рис. 14-7), что приводит к удлинению S-фазы клеточного цикла и патологии деления и созревания эпителиальных клеток желудочно-кишечного тракта и миелокариоцитов. В костном мозгу развивается мегалобластоз.
Нарушение кроветворения связано с замедлением темпа мегалобластического эритропоэза в результате удлинения времени митотического цикла и сокращения числа митозов: вместо трех митозов, свойственных нормобластическому эритропоэзу, регистрируется только один. Срок жизни эритроцитов сокращается до 30-40 дней (в норме — 90 дней). Часть клеток погибает на ранних стадиях развития. Распад мегалобластов в костном мозгу, наряду с их замедленной дифференциацией, и мегалоцитов в крови приводит к тому, что процессы кроветворения не компенсируют процессы кроверазрушения. Развивается мегалобластическая анемия.
В основе неврологических расстройств (фуникулярный миелоз) лежит нарушение превращения метилмалонил-КоА в сукцинил-
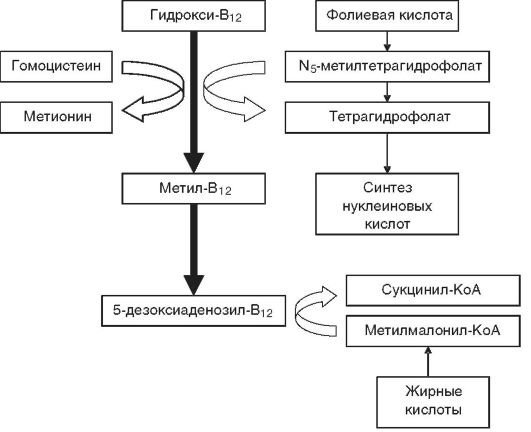
КоА при недостатке 5-дезоксиаденозил-В12 (см. рис. 14-7) и накопление в нервной ткани токсичных метилмалоновой и пропионовой кислот, вызывающих жировую дистрофию нервных клеток и демиелинизацию нервных волокон спинного мозга и периферических нервов.
При монодефиците фолиевой кислоты нарушения метаболизма жирных кислот в нервной ткани, а следовательно, признаки неврологических расстройств отсутствуют.
Картина крови. В периферической крови обнаруживаются гиперхромная анемия (цветовой показатель 1,2-1,5), явления пойкилоцитоза с тенденцией к овалоцитозу, анизоцитоза с выраженным макроцитозом и мегалоцитозом. Характерны явления анизохромии и гиперхромии эритроцитов; могут обнаруживаться полихроматофильные и оксифильные мегалобласты, эритроциты с тельцами Жолли, кольцами Кабо, азурофильной зернистостью. Средний диаметр эритроцитов увеличивается до 8,2-9,5 мкм, их средний объем превышает 100 фл (110-160 фл). Регистрируется умеренная лей-
копения с нейтропенией при полном отсутствии малочисленных форм гранулоцитов — эозинофилов и базофилов (анэозинофилия, абазофилия). Встречаются гиперсегментно-ядерные нейтрофилы (дегенеративный ядерный сдвиг вправо), редко — гигантские формы нейтрофилов. Количество тромбоцитов уменьшается, часть их имеет крупные размеры (6-10 мкм и более).
Костный мозг гиперклеточный за счет накопления незрелых (негемоглобинизированных) ядросодержащих форм клеток красного ряда. На препаратах костного мозга обнаруживаются мегалоциты и мегалобласты, гигантские формы метамиелоцитов.
Гипо- и апластические анемии.Гипопластические анемии относятся к числу анемий, обусловленных депрессией костно-мозгового кроветворения без признаков гемобластоза и метаплазии.
Апластические анемии могут быть наследственными и приобретенными. Последние развиваются при действии на организм некоторых химических и лекарственных веществ (бензол, бензин, пары ртути и различных кислот, красители, сульфаниламиды, антибиотики, цитостатические препараты, препараты золота, висмута, мышьяка и др.), ионизирующей радиации, при ряде инфекций (герпесвирусные инфекции, туберкулез), аутоиммунных заболеваниях (системная красная волчанка, ревматоидный артрит), эндокринопатиях (дисфункция щитовидной железы, яичников, тимуса), а также при стрессе, голодании, расстройствах пищеварения. Описаны случаи апластической анемии у жителей Хиросимы и Нагасаки, перенесших острое лучевое поражение после взрыва атомной бомбы.
Патогенез анемии до конца неизвестен. Считается, что при апластических анемиях имеет место дефицит частично детерминированных (плюрипотентных) стволовых клеток (КОЕ-ГЭММ) в результате их некроза или апоптоза при действии повреждающих факторов, потери способности к пролиферации, патологии гемопоэзиндуцирующего микроокружения (с нарушением процессов не только образования, но и созревания СКК), образования аутоантител.
Апластические анемии могут быть тотальными, протекающими с редукцией одновременно красного и белого ростков кроветворения (анемия Фанкони, анемия Эстрена-Дамешека), и парциальными, с избирательным угнетением красного ростка кроветворения (анемия Блекфена-Даймонда, парциальная красно-клеточная аплазия). Для тотальной апластической анемии характерна панцитопения (низкое содержание всех форм клеток в крови), сочетаю-
щаяся с панмиелопатией (низкое содержание всех форм клеток в костном мозгу), для парциальной — дефицит эритроидных клеток в крови и костном мозгу.
Заболевание чаще начинается постепенно, в крови отмечается снижение содержания гемоглобина (до 30-20 г/л), эритроцитов, ретикулоцитов. Анемия, как правило, нормохромная, макроцитарная. Характерно ускорение СОЭ до 30-50 мм/ч. При тотальной форме аплазии лейкопения сопровождается абсолютной нейтропенией, относительным лимфоцитозом. Содержание тромбоцитов уменьшается до (60-30)-10 9 /л и ниже, удлиняется время кровотечения, развивается геморрагический синдром.
В костном мозгу выявляются резкое снижение количества ядросодержащих элементов, торможение созревания клеток, почти полное исчезновение мегакариоцитов. При парциальной апластической анемии гранулоцитарный и мегакариоцитарный ростки сохраняются без существенных изменений.
Среди анемий, связанных с нарушенным кровообразованием, выделяют также анемии хронических заболеваний(гипохромные) и анемии, ассоциированные с заболеваниями внутренних органов(нормохромные). При этом выраженность анемического синдрома прямо пропорциональна продолжительности и тяжести основного заболевания, признаки которого чаще превалируют над гипоксическими проявлениями анемии.
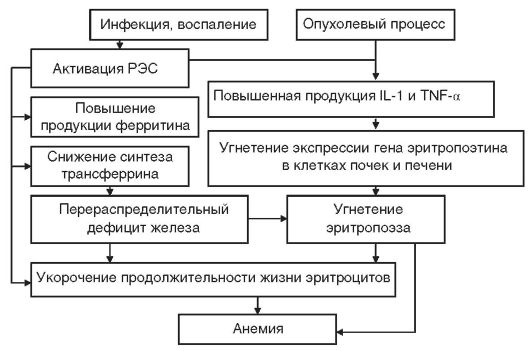
Анемия хронических заболеваний (АХЗ) развивается при инфекционно-воспалительных заболеваниях (менингит, пневмония, туберкулез, инфекционный эндокардит, остеомиелит, сифилис, ВИЧ-инфекция, грибковые инфекции и др.), системных заболеваниях соединительной ткани (ревматизм, ревматоидный артрит, системная красная волчанка, дерматомиозит и др.) и опухолях (множественная миелома, неходжкинские лимфомы, лимфогранулематоз, рак легкого, рак молочной железы, рак яичников и др.). К АХЗ не относятся анемии, возникающие при заболеваниях эндокринной системы, печени и почек (даже если они являются хроническими). В патогенезе АХЗ (рис. 14-8) основное значение имеют: нарушение метаболизма железа, недостаточная продукция эритропоэтина, угнетение эритропоэза, укорочение продолжительности жизни эритроцитов (в среднем до 80 дней). Развитие АХЗ у больных со злокачественными новообразованиями, наряду с цитокинопосредованным угнетением эритропоэза, связано также с метастатическим поражением костного мозга и миелофиброзом.
Анемии, ассоциированные с заболеваниями внутренних органов, включают анемии при эндокринных заболеваниях, заболеваниях печени и почек.
К числу анемий при эндокринных заболеванияхотносятся анемии при заболеваниях щитовидной и паращитовидных желез, надпочечников, половых желез, гипопитуитаризме и др., в основе патогенеза которых лежит депрессия эритропоэза при дефиците или, напротив, гиперсекреции ряда гормонов. В частности, такие гормоны, как тироксин, кортизол, тестостерон в очень высоких концентрациях вызывают угнетение пролиферативной активности эритроидных прекурсоров. В случае сгущения крови в результате дегидратации (при надпочечниковой недостаточности, гипотиреозе) диагностика анемии может быть затруднена.
К анемиям при заболеваниях печениотносятся анемии, возникающие при диффузных поражениях органа (циррозе, хроническом гепатите, гемохроматозе и др.). Патогенез анемии при заболеваниях печени отличается многообразием патогенетических факторов, что определяется особенностями патогенеза основного заболевания. Выделяют следующие механизмы развития анемии:
• угнетение процессов кроветворения в костном мозгу вследствие прямого токсического влияния на клетки-предшест-
венницы гемопоэза алкоголя (при алкогольном поражении печени) и эндогенных токсинов (при нарушениях обезвреживающей и клиренсной функции печени), при нарушениях метаболизма железа и депонирования витамина В12 и фолиевой кислоты в пораженной печени;
• укорочение продолжительности жизни эритроцитов в результате прямого повреждающего действия токсических продуктов экзогенного (алкоголь) и эндогенного (при эндотоксемии) происхождения, гиперспленизма, при нарушениях внутриклеточного метаболизма эритроцитов (например, в связи с дефицитом в клетках НАДФ+) и их способности к деформации (вследствие патологии клеточной мембраны при изменениях фракционного состава фосфолипидов, снижении содержания сиаловых кислот);
• кровотечения из расширенных вен желудочно-кишечного тракта (при циррозе печени), носовые, геморроидальные и иной локализации (при формирующейся недостаточности синтеза факторов свертывания крови вследствие нарушений белкового обмена).
В подавляющем большинстве случаев при заболеваниях печени регистрируется нормохромная нормоцитарная анемия, при присоединяющемся дефиците железа — микроцитарная нормоили гипохромная, при недостаточности витамина В12 и фолиевой кислоты, метастазах рака желудка в печень — макроцитарная анемия нормоили гиперхромного типа.
Анемия при заболеваниях почекможет выявляться у больных острым гломерулонефритом, интерстициальным нефритом, хронической почечной недостаточностью. Патогенез анемии при заболеваниях почек определяется снижением продукции эритропоэтина клетками юкстагломерулярного аппарата, депрессией кроветворения в костном мозгу (в результате нарушения пролиферативной активности эритроидных клеток, торможения процессов синтеза гема) и сокращением срока жизни эритроцитов (до 40-50 дней) при действии токсических продуктов азотистого обмена.
Дата добавления: 2016-07-11 ; просмотров: 2838 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник

