Самое частое заболевание системы крови – это, безусловно, анемия. Она представляет собой синдром, состоящий из клинических признаков анемии и лабораторных данных, основой которых выступает снижение уровня гемоглобина. Большинство случаев ее возникновения не несет непосредственной угрозы жизни человека, но значительно нарушает общее состояние и уровень здоровья. Исключение составляют только случаи тяжелой острой анемии, возникшей на фоне сильного кровотечения.
Хронические анемии, сопровождающиеся даже критическим снижением гемоглобина, не несут таких больших угроз, так как организм частично адаптируется к таким патологическим условиям. В любом случае, это болезнь, требующая соответствующего лечения. Чем раньше симптомы анемии будут распознаны, тем легче и быстрее будет восстановительный процесс.
Кожные покровы человеческого организма содержат больше всего капиллярных сетей, обеспечивающих микроциркуляторные и обменные процессы в этих тканях. Несмотря на то, что в дерме нет крупных сосудов, депонирующих кровь, которые имеются во внутренних органах, нормальная кожа имеет бледно-розовы оттенок. Это обусловлено просвечиванием крови, содержащейся в сети капилляров. Поэтому цвет кожи напрямую зависит от состава крови и оттенка, который отсвечивается под действием солнечного света.
Основные признаки анемии в виде изменений кожи выглядят так:
- Бледность разной степени выраженности. Чем тяжелее анемия, тем более выражена бледность. В некоторых случаях на фоне восковидной бледности может определяться легкая желтушность;
- Румянец щек исчезает даже при первой степени анемии;
- Бледность слизистых оболочек, доступных визуальному осмотру (ротоглотка);
- Кожа становится сухой, шелушащейся, дряблой;
- Появляются трещины по типу заед в уголках рта;
- Возникает легкая отечность лица и нижних конечностей;
- Нарушается рост волос. Они становятся тусклыми, ломкими, сильно секутся;
- Нарушение структуры и роста ногтей (слоистость, мягкость, деформации, присоединение грибкового поражения).
Головной мозг относится к группе органов, чувствительных к ишемии. Анемия, как болезнь, сопровождающаяся нарушением транспортных функций крови по доставке кислорода в ткани, вызывает ишемию нервных клеток. Как результат – специфические симптомы при анемии со стороны функционирования нервной системы:
- Головокружение при физических нагрузках, а при тяжелой анемии – и в покое;
- Шаткость при ходьбе и нарушение координации при выполнении точных движений;
- Зрительные расстройства в виде мелькания мушек или появление различных пятен перед глазами;
- Ноющая головная боль без четкой локализации;
- Вялость и сонливость на фоне общего недомогания и слабости;
- Различные виды шума в ушах;
- Внезапные обморочные состояния на фоне любых нагрузок;
- Заметное ухудшение возможностей интеллектуальной деятельности и памяти.
Сердечная мышца (миокард), как и нейроны головного мозга, очень чувствительна к ишемии, которая сопровождает любую анемию. В зависимости от скорости ее развития и степени выраженности формируются характерные признаки анемии. При постгеморрагических видах на первый план выступают симптомы, связанные с нарушением регуляции артериального давления. Хроническая анемия вызывает трофические расстройства миокарда. При этом возникают такие изменения:
- Немотивированная тахикардия (учащенное сердцебиение и пульс) в покое или ее выраженное усиление при минимальных физических нагрузках;
- Появление одышки при выполнении привычной для человека работы;
- Снижение цифр артериального давления ниже привычных показателей;
- Боли в грудной клетке. Чаще всего, это загрудинная или боль в проекции сердца, сопровождающаяся чувством нехватки воздуха и сердцебиением;
- Нарушение сердечного ритма в виде его нестабильности или экстрасистолии. Имеющиеся в анамнезе аритмии, как правило, усугубляются.
Любая анемия с течением времени приводит к нарушению функциональных способностей не только жизненно важных органов, но и всех тканей организма. Это вызывает такие дополнительные признаки анемии:
- Снижение мышечной силы и массы;
- Изменения со стороны полости рта: распространенный кариозный процесс на зубах, воспалительные изменения десен, сглаженность или разрастание сосочков языка;
- Снижение либидо и потенции у мужчин;
- Вторичный иммунодефицит, при котором часто возникают простудные заболевания и грибковые инфекции (стоматит, молочница, онихомикоз);
- Нарушения со стороны органов чувств: патологические вкусовые и обонятельные пристрастия или неправильное восприятие запахов и вкусовых качеств пищи;
- Нарушение функционирования пищеварительной системы и снижение аппетита;
- Склонность к нагноению ран и их плохое заживление;
- У детей длительная анемия приводит к нарушению роста и развития.
Поскольку диагноз анемии предполагает сочетанные клинические и лабораторные симптомы, ее подтверждение обязательно строится на основании этих признаков. Более того, единственным достоверным критерием диагноза может стать определение уровня гемоглобина крови. При анемии изменения в анализах крови могут быть представлены:
- Сниженным содержанием гемоглобина (у ребенка и взрослого критерии идентичны): при первой степени гемоглобин снижен до 90 г/л, при второй степени – 90-70 г/л, при третьей степени – менее 70 г/л;
- Падением уровня эритроцитов: менее 4,0 т/л у мужчин и менее 3,5 т/л у женщин;
- Гипохромией эритроцитов, проявляющейся снижением цветового показателя ниже 0,85, что говорит о низком насыщении эритроцитарных клеток гемоглобином;
- Наличие эритроцитов неполноценного типа: клетки разных размеров (анизоцитоз), формы (пойкилоцитоз), мегалобластов, серповидных клеток, сфероцитов и микроцитов (сферические и мелкие эритроциты);
- Изменение количества ретикулоцитов (предшественников эритроцитов), норма которых составляет 0,2%, как в строну повышения, так и понижения. В первом случае это свидетельствует и том, что у больного имеет место железодефицитная анемия, во втором – гипопластическая;
- Нарушение обмена железа в организме в виде изменений уровня сывороточного железа (менее 12 ммоль/л) и других показателей, характеризующих способность к синтезу гемоглобина и его включения в состав эритроцитов (железосвязывающая способность сыворотки, насыщение трансферина железом). Эти показатели определяются для детализации и определения характеристик железодефицитной анемии у детей и взрослых;
- Ускорение СОЭ.
Элементарные клинико-лабораторные данные позволяют провести дифференциальную диагностику между разными видами анемий, что даст возможность определиться, какие именно ее виды могут иметь место в конкретном случае. Наиболее типичные признаки основных видов анемий приведены в таблице.
| Вид анемии | Типичные симптомы |
| Железодефицитная (чаще возникает у взрослых женщин и детей) | Преобладают признаки поражения кожи и ее придатков (бледность, сухость, заеды в уголках рта, нарушение структуры и роста ногтей и волос). Часто снижается аппетит, общая слабость выражена умеренно. Резко атрофируются сосочки языка, что делает его поверхность гладкой. Выражена бледность слизистых оболочек. Отмечается пристрастие к несъедобным веществам (глина, мел и прочие). |
| Мегалобластная (недостаток фолиевой кислоты и цианокобаламина в организме) | Преобладают симптомы поражения нервной и пищеварительной систем. При этом отмечаются онемение конечностей, дискоординационные нарушения и головокружения, страдает интеллектуальная деятельность мозга и память. Практически всегда увеличивается печень и селезенка, гипертрофируются сосочки, и воспаляется язык. |
| Постгеморрагическая | Определяется по анамнестическим данным: кровавая рвота, понос и другие признаки кровотечений. |
| Гемолитическая (разрушения эритроцитов крови) | Характеризуется желтушностью кожи, повышением температуры, увеличением печени и селезенки. При этом моча и каловые массы не изменяют свой оттенок, что отличает желтуху при гемолитической анемии от других желтух. |
| Гипопластическая (нарушение выработки эритроцитов в костном мозге) | Очень редко такая анемия бывает изолированной и поэтому практически всегда сочетается с низким количеством эритроцитов и тромбоцитов. Сопровождается увеличением селезенки и лимфатических узлов, общей гипертермической реакцией, повышенной кровоточивостью и снижением иммунитета. Чаще бывает у детей. |
От того, насколько правильно и своевременно будут распознаны признаки анемии, зависит адекватность лечебных мероприятий и их эффективность!
источник
Как уже было указано, связь между злокачественной анемией и поражением спинного мозга была впервые доказана в конце XIX века. Страдание было названо фуникулярным миелитом соответственно общим представлениям того времени, когда всякое заболевание спинного мозга, независимо от его природы, называлось миелитом. В дальнейшем, когда было доказано, что воспалительные изменения при этой болезни являются вторичными реактивными, то названию «миелит» стали предпочитать «миелоз». В литературе существует и ряд синонимов для определения этого страдания. Французские авторы пользуются термином «невроанемический синдром», в англоамериканской литературе широкое распространение приобрело название «подострая дегенерация спинного мозга». Наименее удачным является встречающийся иногда термин «антеролатеральный склероз». Это название не отражает сущности болезни, при которой склероз совершенно не наблюдается, а передние столбы спинного мозга могут быть поражены так же, как боковые и задние.
По статистическим данным современных авторов, миелоз наблюдается в большинстве случаев пернициозной анемии. Процент поражений спинного мозга при пернициозной анемии резко расходится у старых и новых авторов. Паппенгейм обнаружил изменения в нервной системе только у 6% больных, Тюрк — у 3 из 80 больных, Дейна — у 10%, Тейлор — у 12%. Исследования последнего времени дают совершенно другие цифры: Вольтман 80%, Герст 70%, Вильсон и Эван 74%, Мейленграхт, Скуг и Арене до 90—97%, А. Я. Ловцкая 93%, по нашим данным 91%. Цифры, несомненно, колеблются в зависимости от тщательности неврологического исследования и в большей мере зависят от того, представлена ли статистика невропатологом или терапевтом. Брейн указывает, что число смертных случаев от фуникулярного миелоза в 1933 г. было вдвое больше, чем в 1927 г., т. е. до введения печеночной терапии. Одни авторы считают, что учащение фуникулярных миелозов объясняется фиксацией на них внимания и умением их лучше диагностировать. Другие думают, что это учащение обусловлено введением печеночной терапии, удлинившей жизнь больных. Если ранее общие симптомы господствовали в картине болезни и маскировали неврологическую симптоматику, то в дальнейшем при улучшении общего состояния под влиянием печеночной терапии у больных стала чаще выявляться картина фуникулярного миелоза.
Патогенез. В настоящее время все исследователи согласны с тем, что анемия сама по себе не является причиной фуникулярного миелоза. В пользу этого утверждения прежде всего говорит отсутствие параллелизма между изменениями крови и явлениями со стороны нервной системы. Фуникулярный миелоз, так же как ахилия и глоссит, может предшествовать анемии. Со времени введения в терапию злокачественной анемии препаратов печени приходится постоянно убеждаться, что нарушения со стороны нервной системы могут прогрессировать, несмотря на нормальную картину крови. Наконец, при экспериментальных анемиях, вызываемых повторными кровопусканиями или введением различных анемизирующих веществ, не удается получить фуникулярный миелоз. Приведенные факты позволяют сделать заключение, что анемия не является причиной фуникулярного миелоза и что оба они вызываются каким-то другим общим этиологическим фактором.
Значительно сложнее вопрос об отношениях между анемией, миелозом и ахилией. Данные многих авторов, в том числе и наши, позволяют утверждать, что во всех случаях фуникулярного миелоза, независимо от того, сопровождались они явлениями анемии или нет, наблюдалась ахилия. Это обстоятельство направило внимание исследователей на желудочно-кишечный тракт. Успешное применение печеночной терапии выдвинуло на первое место среди других теорий происхождения злокачественной анемии теорию о роли алиментарной недостаточности. Эта точка зрения становится понятной в свете исследований Касла.
Ряд экспериментов Касла и его сотрудников позволил им прийти к заключению, что не отсутствие соляной кислоты само по себе, а прекращение секреции и выделения специфического фермента ведет к развитию анемии.
Касл выдвинул теорию, что нормальный желудочный сок содержит «внутренний» антианемический фактор, взаимодействие которого с «внешним» фактором, находящимся в пище, необходимо для созревания эритроцитов, нормального кровотворения и целости нервной системы. В настоящее время доказано, что внешним фактором является витамин В12. Исследования Гласса обнаружили, что внутренний фактор относится к гастромукопротеинам. Внутренний фактор вступает в нестойкое соединение с витамином В12, извлекая его из пищи и способствуя его усвоению организмом. Отсутствие внутреннего фактора в организме ведет к недостаточности усвоения В12 из пищи.
Нередко наблюдающееся отсутствие параллелизма между течением анемии и фуникулярного миелоза побуждало предполагать отсутствие полной идентичности между патогенезом анемии и фуникулярного миелоза. Исследования последнего времени обнаружили, что назначение внутрь фолиевой кислоты при пернициозной анемии ведет к быстрой ремиссии, но не предотвращает появление фуникулярного миелоза и не задерживает дальнейшее его развитие. 3. Нивег и сотрудники объясняют неспособность фюлиевой кислоты улучшить явления со стороны нервной системы тем, что она синтезирует дезоксирибонуклеиновую кислоту и не участвует в образовании рибо- и нуклеиновой кислоты, как витамин В12. Обмен последней особенно интенсивен в центральной нервной системе.
Экспериментальные исследования С. И. Яковлева, В. Н. Черниговского, Д. И. Гольдберга обнаружили, что нарушение иннервации желудка ведет у собак к резкому снижению или исчезновению внутреннего фантора из желудочного сока. Эти исследования указывают на значение трофических функций нервной системы в патогенезе пернициозной анемии.
Симптоматология. Признаки поражения нервной системы в большинстве случаев возникают после того, как появились типичные изменения крови, а также после того, как становятся очевидными соматические симптомы в виде общей слабости, изменения цвета кожи, глоссита. Однако, как уже было указано, иногда клиническая картина фуникулярного миелоза появляется до того, как наступают изменения со стороны крови.
Первыми признаками поражения нервной системы являются парестезии в конечностях в виде чувства онемения, жара, покалывания, ползания мурашек, иногда ломящих болей.
Нередко больные долго не придают значения своим субъективным ощущениям, и только при расспросе обнаруживается, что они уже много месяцев испытывают парестезии. В самом начале болезни при наличии только парестезий объективное исследование нервной системы может и обнаружить патологических явлений. В дальнейшем по мере развития заболевания появляются признаки поражения задних и боковых столбов. Значительно реже болезнь начинается с двигательных расстройств, чувств усталости в ногах, изменения походки, выпадения сухожильных рефлексов.
В типичных случаях фуникулярного миелоза наблюдаются различные сочетания поражения задних и боковых столбов. Одним из ранних признаков поражения задних столбов является нарушение вибрационной чувствительности. Оно более выражено в руках, чем в ногах. Иногда оно распространяется и на туловище, не оставляя сомнении, что поражение локализуется в задних столбах спинного мозга, а не в периферических нервах. Далее появляется расстройство глубокой мышечной чувствительности, также чаще и больше выраженное в ногах.
Значительно реже встречаются поражения поверхностной чувствительности по типу «чулок» и «перчаток». Коленные и ахилловы рефлексы выпадают. Симптом Ромберга положительный. Характер расстройств походки определяется относительной интенсивностью поражения задних или боковых столбов. Она может быть преимущественно атактической или спастической, иногда той и другой одновременно.
Поражение боковых столбов вызывает слабость конечностей с повышением сухожильных рефлексов, выпадением брюшных и кремастерного рефлексов, патологические пирамидные рефлексы, повышение мышечного тонуса. В дальнейшем парезы достигают степени, лишающей больных возможности передвигаться. Спастический парапарез очень часто сменяется вялым, сухожильные рефлексы понижаются или совершенно выпадают.
Расстройства чувствительности становятся более интенсивными, носят проводниковый характер и захватывают все виды чувствительности. При вялом параличе долго сохраняются патологические рефлексы. Это своеобразное сочетание пирамидных симптомов и вялых парапарезов характерно для фуникулярного миелоза.
Верхние конечности поражаются в значительно меньшей степени. Выпадения здесь обычно ограничиваются расстройствами чувствительности и повышением сухожильных рефлексов. Поражения только верхних конечностей мы ни разу не наблюдали.
Расстройства поверхностной чувствительности обычно появляются в более поздней стадии болезни. Запоры, императивный позыв, задержка в начале акта мочеиспускания указывают на поражение боковых столбов, в то время как растяжение пузыря, остаточная моча и парадоксальная ишурия являются следствием вовлечения в процесс задних столбов.
Описанную выше «типичную» картину фуникулярного миелоза мы наблюдали менее чем в половине случаев. Часто встречается картина поражения только задних столбов: понижение или выпадение сухожильных рефлексов, парестезии, расстройства вибрационной и глубокой мышечной чувствительности. Реже имеет место синдром только боковых столбов: спастические парезы, патологические рефлексы. Наряду со случаями, стабилизировавшимися на начальных симптомах в виде парестезий и легких расстройств глубокой чувствительности, наблюдаются случаи, в которых в течение 2—3 недель устанавливается картина поперечного поражения спинного мозга. Клиническая картина при фуникулярном миелозе исключительно разнообразна и число атипичных случаев не меньше, чем типичных.
При своеобразном течении каждого отдельного случая выделение отдельных форм или стадий болезни является в значительной мере условным. В общем можно различать абортивную форму, синдром поражения задних столбов, синдром поражения боковых столбов, синдром сочетанного поражения задних и боковых столбов.
Синдром полиневрита при пернициозной анемии описали А. Я. Ловцкая, С. Н. Шаравский и др. В пользу полиневрита может говорить атрофия мышц стоп и кистей, периферический тип расстройств чувствительности, отсутствие расстройств вибрационной чувствительности и нарушений со стороны сфинктеров.
Следует, однако, иметь в виду, что дифференцировать полиневрит от заднестолбовых форм фуникулярного миелоза исключительно трудно. Расстройства чувствительности могут носить сходный характер, а нарушения со стороны сфинктеров появляются при фуникулярном миелозе уже в далеко зашедшей фазе болезни.
На дне глаза очень редко находят признаки атрофии зрительных нервов. Спинномозговая жидкость остается нормальной. В большинстве случаев при исследовании крови обнаруживаются изменения, характерные для пернициозной анемии.
Изменения психики наблюдаются нередко. Они могут появиться до обнаружения других признаков заболевания нервной системы. Обычно встречается повышенная раздражительность, плохое настроение, депрессивное состояние. Часто наблюдается психическая астения, больные апатичны, молчаливы, быстро устают при малейшем умственном усилии. Реже наблюдаются выраженные психозы в виде психомоторного возбуждения, бреда, преследования, делириозного состояния. М. П. Невский обнаружил астенический синдром в 80—90% случаев пернициозной анемии, психозы — в 8—10%. Автор различает три формы психозов:
- депрессивное состояние с тревогой и страхом;
- галлюцинаторно-бредовую форму;
- бред и галлюцинации с периодически возникающим помрачением сознания.
В основе психических нарушений, по-видимому, лежат разные причины. Наряду с хронической гипоксией существенную роль играют органические изменения в мозгу, сходные с дегенеративными изменениями в спинном мозгу.
Течение болезни исключительно разнообразно. У одних больных болезнь медленно прогрессирует, у других она стационарна в течение длительного времени. Иногда же болезнь быстро прогрессирует и больной погибает от сепсиса вследствие восходящей урогенной инфекции или пролежней. При отсутствии лечения больные чаще умирают от самой анемии или случайных инфекций, чем от поражений нервной системы и связанных с ними осложнений.
Дифференциальный диагноз. Диагноз не представляет затруднений в случаях, когда у больного пернициозной анемией появляются признаки поражения нервной системы. Наоборот, значительные трудности диагноз может представить тогда, когда больной впервые обращается к врачу по поводу нервных симптомов или когда нервные симптомы предшествуют изменениям крови. Страдание может быть смешано с различными заболеваниями в зависимости от стадии, в которой больной поступает под наше наблюдение. Вначале истинная причина болей и парестезий в конечностях может быть просмотрена и приписана атеросклерозу головного мозга, полиневриту, эндартерииту сосудов конечностей. При недостаточно выраженных изменениях крови приходится проводить дифференциальный диагноз со спинной сухоткой, множественным склерозом, спинальным сифилисом, инфекционным миелорадикулитом, реже опухолью спинного мозга и амиотрофическим боковым склерозом.
Парестезии при фуникулярном миелозе отличаются от таковых при атеросклерозе большим постоянством и интенсивностью, наличием объективных расстройств чувствительности. Вообще в случае упорных парестезий у лиц старше 40 лет следует произвести тщательное исследование крови, иногда при этом неожиданно удается обнаружить подлинную причину болезни. Большое значение имеет тщательное соматическое исследование больного и выявление атрофии слизистой языка и ахлоргидрии. Некоторые из наших больных указывали, что они за несколько лет до развития болезни испытывали неприятные ощущения (жжение, покалывание в языке).
В отличие от полиневрита боли при давлении испытываются больными не только по ходу нервов, но и при давлении на мышцы, суставы, надкостницу. При пробе по Ласегу боль также ощущается не по ходу седалищного нерва, а по всей ноге, причем больные нередко указывают на большую интенсивность болей в области суставов.
При эндартериите обнаруживается ослабление или выпадение пульса на a . dorsalis pedis , изменение окраски кожи пальцев ноги, в то время как при анемии наблюдается пастозность или отечность стоп.
Наличие пирамидных симптомов, указывающих на вовлечение в процесс не только задних и боковых столбов, имеет большое дифференциально- диагностическое значение для отличия миелоза от спинной сухотки. При наличии же симптомов только со стороны задних столбов против спинной сухотки говорит отсутствие изменений зрачков, нормальная спинномозговая жидкость, отрицательная вассермановская реакция.
В отличие от множественного склероза при фуникулярном миелозе нет атрофии височных половин сосков зрительных нервов, скандированной речи, нистагма. Дрожание при миелозе встречается, но не носит интенционного характера. Против множественного склероза свидетельствует также развитие болезни в более пожилом возрасте, отсутствие ремиссий, сочетание выпадений сухожильных рефлексов с патологическими рефлексами, начало страдания с парестезий. Заслуживает внимания, что при миелозе из-за общей слабости парезы выражены значительно больше, чем пирамидные симптомы, и больные перестают самостоятельно передвигаться гораздо раньше, чем при множественном склерозе. Встречаются случаи, особенно при наличии симптомов только со стороны боковых столбов, когда дифференциальный диагноз на основании одной неврологической картины представляет большие трудности, тем более что иногда типичные симптомы сочетаются с нистагмом, расстройством речи, атрофией зрительных нервов. В таких случаях решающее значение имеет исследование крови, желудочного сока и пункция костного мозга.
В дифференциальном диагнозе со спинальным сифилисом, помимо сказанного по поводу спинной сухотки, имеет значение также раннее появление при сифилисе расстройств мочеиспускания, проводниковый характер расстройств всех видов чувствительности, наличие признаков поражения черепных нервов и очаговых симптомов со стороны головного мозга.
Амиотрофический боковой склероз различается на основании наличия мышечных атрофий, бульбарных симптомов и отсутствия парестезий и расстройств чувствительности.
При опухоли спинного мозга выпадения не ограничиваются задними столбами и пирамидными проводниками, обнаружение же блока и белково-клеточной, диссоциации в спинномозговой жидкости говорит против фуникулярного миелоза.
Необходимо иметь в виду, что при миелозе атипичные формы встречаются очень часто, поэтому для невыраженных форм страдания обнаружение ахилии, исследование крови и пункция костного мозга имеют решающее значение. Это в особенности относится к синдрому полиневрита и психическим изменениям, при которых в клинической картине нет ничего патогномонического для данного страдания.
Злокачественная анемия и рак обычно поражают лиц одного и того же возраста. Кахексия и вторичная анемия при раке могут сделать затруднительным дифференциальный диагноз, в особенности при наличии костных метастазов. У пожилых людей может наблюдаться понижение глубокой и вибрационной чувствительности, а также сухожильных рефлексов. Поэтому при наличии ахилии у пожилых людей следует произвести все исследования, необходимые для исключения рака.
Следует заметить, что в последние годы клиническая картина пернициозной анемии значительно изменилась, что, по-видимому, объясняется изменением характера питания, а также более ранним и эффективным лечением. Соответственно этому вместо классических тяжелых форм фуникулярного миелоза чаще встречаются легкие, маловыраженные формы.
Если в этих случаях исследование крови и пункция костного мозга не дают достаточных оснований для диагноза, рекомендуется исследование содержания витамина В12 в сыворотке крови.
Лечение. Результаты лечения печенью фуникулярного миелоза не столь эффективны, как при лечении соматических признаков злокачественной анемии. Это расхождение объясняется тем фактом, что кровь постоянно восстанавливается, в то время как при поражении проводников в центральной нервной системе нельзя ожидать полного восстановления функций. Тем не менее, если процесс не прогрессирует, можно надеяться на улучшение отдельных симптомов.
Интересным в этом отношении является сравнительное патогистологическое исследование спинного мозга, произведенное Девисоном у больных, леченных печенью, и у 10 нелеченых. Картина изменений миелина и осевых цилиндров в тех и других случаях оставалась неизменной. У всех леченных печенью обнаружено образование глиозных рубцов, не отмеченных у нелеченых больных. По мнению Девисона, эти исследования доказывают, что лечение печенью задерживает дальнейшее развитие процесса вследствие быстрого образования глиозного рубца. Девисон считает, что печень ослабляет токсическое действие патогенного фактора и тем самым усиливает способность глии к реактивной пролиферации.
В одном из наших анатомических случаев, когда проводилось лечение печенью, была выражена наклонность к образованию глиозных рубцов. В 2 других случаях этого обнаружить не удалось. Успешность лечения печенью определяется рядом факторов. Прежде всего необходимо применение ее в ранних стадиях фуникулярного миелоза. Следует назначить дозу более высокую, чем при злокачественной анемии. Наконец, необходимо длительное и систематическое применение печени или ее эффективных препаратов — камполона или антианемина. Наряду с печенью рекомендуется применение витамина В12.
Общую схему лечения фуникулярного миелоза можно представить следующим образом: инъекция 4 мл антианемина или камполона в течение недели, затем 2 мл, пока число эритроцитов не достигнет 4 000 000. В дальнейшем 2 мл каждые 2 недели в течение 1—2 лет. Повторение основного курса зависит от течения нервных симптомов. Кроме того, пивные дрожжи 30—60 г ежедневно. Инъекции 5% раствора витамина Вх в течение 2—3 месяцев по 1 мл. Внутрь желудочной сок. Диета, богатая животным белком
Опыт показал, что при фуникулярном миелозе лечебный эффект витамина В12 лучше, чем при лечении печенью. Ощущение слабости, головокружения, парестезии и боли в конечностях проходят в течение 5—7 дней Успешные результаты наблюдаются также у больных, у которых недавно развилась острая параплегия. Особенно хороший эффект получается в том случае, если лечение начинают не позже чем через 3 месяца после появления симптомов фуникулярного миелоза. Своевременное длительное и повторное лечение витамином В12 предупреждает появление нервных симптомов вызывает улучшение имеющейся объективной картины и задерживает дальнейшее развитие фуникулярного миелоза.
Терапия витамином В12 является заменяющей и поэтому должна при меняться длительное время. Вначале ежедневно в течение 2 недель внутримышечно вводится 100—200 у витамина, затем 50 у 2 раза в неделю в течение 6 месяцев, в дальнейшем 50 у один раз в 2 недели. Доза должна быть индивидуализирована и, если нужно, увеличена.
источник
Первые описания поражений спинного мозга при пернициозной анемии относятся к концу XIX века. Болезнь была названа фуникулярным миелитом соответственно общим представлениям того времени, когда всякое заболевание спинного мозга независимо от его природы называлось миелитом. В дальнейшем было доказано, что воспалительные изменения в спинном мозгу при пернициозной анемии являются вторичными, реактивными, и названию миелит стали предпочитать миелоз. В литературе существует ряд синонимов для определения этого страдания. Французские авторы пользуются термином «невроанемический синдром». В англо-американской литературе широкое распространение получило название «подострая дегенерация спинного мозга».
По статистическим данным современных авторов, миелоз сопровождает большинство случаев пернициозной анемии. Следует отметить, что процент поражений спинного мозга при пернициозной анемии резко расходится у старых и новых авторов. Паппенгейм обнаружил изменения нервной системы только в 6% случаев, Тейлор — в 12%. В последнее время получены значительно большие цифры: по Вильсону и Эвансу -74%, по Мейленграхту — 90-97%, по А. Я. Ловцкой -93%, по нашим наблюдениям — 91%. Цифры, несомненно, колеблются в зависимости от тщательности неврологического исследования. Брейн указывает, что число умерших от фуникулярного миелоза в 1933 г. было вдвое больше, чем в 1927 г., т. е. до введения печеночной терапии. Одни авторы считают, что увеличение числа случаев фуникулярного миелоза объясняется фиксацией на них внимания и умением лучше диагностировать их. Другие полагают, что это учащение обусловлено применением печеночной терапии, удлиняющей жизнь больных. Если ранее в картине болезни господствовали общие симптомы, которые маскировали неврологическую симптоматику, то в настоящее время при улучшении общего состояния под влиянием печеночной терапии у больных чаще выявляется картина фуникулярного миелоза.
Клинические признаки поражения нервной системы в большинстве случаев возникают только после появления типичных изменений крови и после того, как становятся очевидными соматические симптомы в виде общей слабости, изменения цвета кожи, глоссита. Клиническая картина фуникулярного миелоза редко появляется до того, как наступают изменения со стороны крови.
Первыми признаками поражения нервной системы являются парестезии в конечностях в виде чувства онемения, жара, покалывания, ползания мурашек, редко ломящих болей.
Иногда больные долго не придают значения субъективным ощущениям и только при расспросе становится известно, что они уже много месяцев испытывают парестезии. Значительно реже болезнь начинается с двигательных расстройств в виде чувства усталости в ногах, парезов, расстройств походки.
В типичных случаях фуникулярного миелоза наблюдаются различные сочетания симптомов поражения задних и боковых столбов спинного мозга. К признакам поражения задних столбов относятся расстройства глубокой чувствительности, атаксия, исчезновение сухожильных рефлексов. Поражение боковых столбов вызывает слабость конечностей с повышением сухожильных рефлексов, выпадением брюшных и кремастерного рефлексов, патологические пирамидные знаки, повышение мышечного тонуса.
В дальнейшем парезы конечностей достигают степени, лишающей больных возможности самостоятельно передвигаться. Спастический парапарез ног очень часто сменяется вялым: сухожильные рефлексы понижаются или совершенно исчезают. Расстройства чувствительности становятся более интенсивными, носят проводниковый характер и захватывают уже все виды чувствительности.
При вялом параличе с отсутствием сухожильных рефлексов долго сохраняются патологические пирамидные рефлексы. Это своеобразное сочетание пирамидных симптомов и вялых парезов характерно для фуникулярного миелоза.
Верхние конечности поражаются в значительно меньшей степени. Нарушения здесь чаще всего ограничиваются расстройствами чувствительности и повышением или выпадением сухожильных рефлексов.
Запоры, императивный позыв к мочеиспусканию, задержка в начале акта мочеиспускания указывают на поражение боковых столбов, в то время как растяжение мочевого пузыря, наличие остаточной мочи и парадоксальная ишурия являются следствием поражения задних столбов.
Описанная типичная картина болезни наблюдается менее чем в половине всех случаев. Частым является вариант, характеризующийся симптомами поражения только задних столбов: понижением или исчезновением сухожильных рефлексов, парестезиями, расстройствами глубокой чувствительности. Реже встречается синдром поражения только боковых столбов в виде спастического парапареза нижних конечностей с патологическими пирамидными рефлексами.
Наряду со случаями, когда отмечаются только начальные симптомы в виде парестезии и легких нарушений глубокой чувствительности, наблюдаются случаи, в которых в течение 2-3 недель устанавливается картина поперечного миелита.
При своеобразном течении каждого случая выделить те или иные формы или стадии болезни довольно трудно. В общем можно различать абортивную форму, синдром поражения задних столбов, синдром поражения боковых столбов, комбинированную форму поражения задних и боковых столбов.
Изменения психики наблюдаются нередко. Они могут появиться до обнаружения других признаков поражения нервной системы. Обычно отмечается повышенная раздражительность, плохое настроение, депрессивное состояние. Часто встречается психическая астения: больные апатичны, молчаливы, быстро устают при малейшем умственном усилии. Реже наблюдаются выраженные психозы в виде психомоторного возбуждения, бреда преследования, делириозного состояния. По-видимому, в этих случаях изменения психики обусловлены не интоксикацией, а анатомическим поражением головного мозга. В пользу этого говорит обнаружение в полушариях головного мозга патогистологических изменений, аналогичных дегенеративным изменениям в спинном мозгу.
Синдром полиневрита при пернициозной анемии описали А. Я. Ловцкая, А, С. Черников, С. Н. Шаравский. В пользу наличия полиневрита могут говорить атрофия мышц кистей и стоп, периферический тип расстройства чувствительности, тенденция к ослаблению тяжести симптомов.
На дне глаза очень редко находят признаки атрофии зрительных нервов. Спинномозговая жидкость нормальна. В огромном большинстве случаев в крови обнаруживаются изменения, характерные для анемии.
Течение болезни исключительно разнообразно. У одних больных она медленно прогрессирует, у других остается стационарной в течение длительного времени. Иногда же болезнь быстро прогрессирует, и больной погибает от сепсиса вследствие восходящей урогенной инфекции или пролежней. При отсутствии лечения больные чаще умирают от самой анемии или случайных инфекций, чем от поражений нервной системы.
Патологоанатомическая картина фуникулярного миелоза характеризуется распадом миелиновых оболочек и осевых цилиндров в волокнах белого вещества спинного мозга с образованием пустот вследствие недостаточного реактивного разрастания глии. В самом начале болезни в задних столбах и задних отделах боковых столбов спинного мозга появляются небольшие вакуоли. Постепенно разрушение белого вещества с образованием разной величины пустот распространяется по всему спинному мозгу, оставляя в исходных стадиях свободной от поражения лишь узкую зону вокруг серого вещества. К этому могут присоединиться явления вторичного перерождения, преимущественно в шейном отделе спинного мозга. Этими вторичными дегенерациями обусловлены слабо выраженные явления склероза в грудном и шейном отделе спинного мозга.
Процесс локализуется внутри отдельных проводниковых систем, но не захватывает целиком их поперечник, а распространяется по соседству на ближайшие пучки, что говорит против системного характера болезни. По периферии пустот можно видеть, что миелиновые оболочки и осевые цилиндры находятся в различных стадиях распада: от простого набухания до полного исчезновения. Патологический процесс поражает преимущественно длинные пути спинного мозга и щадит короткие пути вокруг серого вещества. В поздних стадиях болезни бывают поражены и короткие пути, но в значительно меньшей степени.
Характерной является диссоциация между распадом нервной ткани и реакцией глии. Вакуоли в белом веществе очень слабо изолируются образованием глиозных тяжей. Пролиферирующие в небольшом числе астроциты вскоре претерпевают регрессивные изменения. Как уже было указано, за исключением области вторичных дегенерации в шейном и частично грудном отделе, в спинном мозгу не обнаруживается признаков склероза, образования глиозного рубца.
Сосуды в области дегенерации увеличены в числе, стенки их утолщены, иногда отмечается гиалиновое перерождение их. Вокруг сосудов можно увидеть скопление макрофагов, содержащих жир и продукты распада липоидов.
Серое вещество спинного мозга не поражается. Вопрос о наличии изменений в периферической нервной системе изучен недостаточно. Нонне, Бодехтель и др. настаивают на интактности периферических нервов. В наших случаях мы также не обнаружили их изменения. Другие авторы описывают дегенеративные изменения нервов и корешков.
Патологические изменения в головном мозгу встречаются значительно реже, чем в спинном. В белом веществе головного мозга можно обнаружить типичные очажки с распадом миелиновых оболочек и осевых цилиндров. В головном мозгу видны также микроскопические кольцевидные кровоизлияния, ничем не отличающиеся от таковых при интоксикациях и других болезнях, вызывающих геморрагический диатез. Наконец, в полушариях головного мозга иногда находят диффузные изменения клеток, выражающиеся в гидролизе, пигментной дегенерации и даже гибели клеток (псориаз, витилиго и др.).
Ряд авторов утверждает, что характерные для фуникулярного миелоза изменения встречаются и при других болезнях. Они описаны при различных анемиях, лейкемиях, карциноматозе, сифилисе, авитаминозе, базедовой болезни, бруцеллезе.
Таким образом, роль этиологического фактора при фуникулярном миелозе приписывается самым различным болезням. По мнению М. Б. Кроля, М. А. Хазанова и И. Л. Сосновика, различные вредности, длительно действующие на организм и ведущие к истощению, предрасполагают к фуникулярному миелозу. Однако в последние годы эта точка зрения встречает все больше возражений.
По данным современных авторов и нашим наблюдениям, фуникулярный миелоз встречается в огромном большинстве случаев пернициозной анемии, тогда как при других истощающих болезнях крайне редко. Что касается описанных в старой литературе случаев миелоза без анемии, то надо учитывать, что из-за недостатков прежних методик исследования и незнакомства с латентными формами анемии этиологический фактор фуникулярного миелоза оценивался неправильно. Примеры такого рода подробно разобраны А. Я. Ловцкой. Известно также, что изменения со стороны крови могут наступить значительно позднее, чем явления фуникулярного миелоза.
Страница 1 — 1 из 2
Начало | Пред. | 1 2 | След. | Конец
источник
1.4 Поражение нервной системы при ЖДА
Анемические симптомы связаны с недостаточным обеспечением тканей кислородом: слабость, головокружение, отдышка, бледность кожи и слизистых оболочек, тахикардия, функциональный систолический шум. Так же отмечаются нарушения в центральной нервной системе.
Наибольшую озабоченность из всех последствий недостаточности железа для грудных детей и детей раннего возраста до 2 лет вызывает возможное нарушение умственного и психомоторного развития. Особенно чувствительны к недостаточности железа дети в период введения прикорма (с 6 до 24 месяцев), когда они растут быстрыми темпами. На этот период приходится пик распространенности железодефицитной анемии у детей, который совпадает по времени с последней фазой рывка в развитии головного мозга, когда происходит развитие познавательных способностей и моторики.
Данные, полученные в результате исследований в широких совокупностях населения, показали положительную связь между недостаточностью железа и пониженными показателями ряда умственных и физических функций у детей различных возрастных групп, особенно у грудных детей. Также было высказано мнение о том, что недостаточность железа изменяет эмоциональное состояние грудных детей настолько, что они становятся более углубленными в себя, осторожными и неуверенными и в результате этого могут быть менее способными взаимодействовать с окружающим миром и учиться у него, что мешает их интеллектуальному развитию. У детей дошкольного возраста (36–72 месяца) установлена связь недостаточности железа с низкими результатами в учении, особенно при выполнении заданий, требующих повышенного внимания и распознавания подсказок и намеков, имеющих ключевое значение для решения наглядных задач.
Общеизвестно единство соматических и нервно-психических процессов, нарушение которого приводит к ряду патологических изменений в организме: болезни нервной системы вызывают соматические расстройства и, наоборот, первичное поражение других органов является причиной органических и функциональных неврологических нарушений.
Возникающая при анемии гипоксия мозговой ткани вызывает развитие симптомов общего характера. Вначале появляются слабость, повышенная утомляемость, рассеянность, головная боль, сонливость или наоборот, возбуждение. При некоторых формах анемии в связи с повышенной агглютинацией эритроцитов наступает тромбоз сосудов головного мозга, и появляются симптомы размягчения мозговой ткани — параличи. Парезы, нарушение чувствительности и т.п.
К очень неожиданному выводу пришла группа зарубежных авторов, которые сделали попытку выяснить, могут ли последствия дефицита железа уйти бесследно после восполнения запасов железа в организме.
Главными задачами их исследования стали:
— определить умственное и психомоторное поведение детей в возрасте 1 года в зависимости от уровня железа в организме ребёнка.
— оценить влияние кратковременной и долговременной терапии на умственное и психомоторное поведение.
В исследование были включены 196 здоровых детей из городской клиники, из благополучных семей. Младенцев включали в исследование в возрасте 3-х месяцев. В дальнейшем в случае необходимости проводилось лечение.
В возрасте 9-ти и 12-ти месяцев у детей оценивался гематологический статус, а в возрасте 12-ти и 15-ти месяцев проводился тест развития ребёнка.
Индекс умственного развития (ИУР) — оценивает познавательную способность (язык, абстрактное мышление, память и т. д.)
Индекс психомоторного развития (ИПР) оценивает функцию грубых движений (координацию, равновесие, ходьбу и т. д.)
Только показатели ИУР и ИПР полностью возвращались к нормальным значениям до 100% (соответствовали нормальному развитию) и, поэтому, были включены в количественный анализ.
В зависимости от уровня содержания гемоглобина 196 детей были поделены на группы:
Hb > 110 г / % 30 человек — контроль
Hb = 105-109 г / % 127 человек — дефицит Fе
источник
Данное заболевание крови встречается у 0,1% всего населения, однако среди пожилых людей данный показатель повышается до 1%. Чаще болеют женщины, причем развитие дефицита витамина В12 обычно связано с беременностью и может самостоятельно исчезать после рождения ребенка.
Интересные факты
- Дефицит витамина В12 отмечается у 10% людей в возрасте старше 70 лет, однако не у всех из них развиваются клинические проявления В12 дефицитной анемии.
- Ни одно животное или растение на земле не способно синтезировать витамин В12.
- Витамин В12 вырабатывается исключительно микроорганизмами (бактериями), обитающими в конечном отделе пищеварительного тракта животных и человека, однако он неспособен попасть в кровоток, так как его всасывание происходит в тощей кишке, которая расположена в начальных отделах кишечника.
Образование эритроцитов начинается еще на ранних стадиях эмбрионального развития. Первые клетки крови у эмбриона образуются из мезенхимы (особой эмбриональной ткани) в конце 3 недели беременности. По мере роста и развития выделяются основные органы, которые обеспечивают кроветворение.
Основными кроветворными органами являются:
- Печень – выполняет кроветворную функцию с 6 недели внутриутробного развития и до рождения ребенка.
- Селезенка – участвует в процессе кроветворения с 12 недели внутриутробного развития и до рождения ребенка.
- Красный костный мозг – начинает выполнять кроветворную функцию с 12 недели внутриутробного развития и является единственным кроветворным органом после рождения ребенка.
Образование эритроцитов происходит из так называемых полипотентных стволовых клеток (ПСК). В организме человека имеется около 40 тысяч ПСК, которые образуются в периоде внутриутробного развития. Они содержат ядро, в котором располагается ДНК (дезоксирибонуклеиновая кислота), регулирующая процессы клеточного деления и дифференцировки (приобретения клеткой специфической функции). Кроме ядра в стволовых клетках имеется множество других структур (органелл), которые нужны для обеспечения процессов их жизнедеятельности и размножения.
Молекула ДНК человека имеет форму двух нитей, спирально перекрученных между собой. Каждая нить состоит из множества особых химических соединений – нуклеозидов. Нуклеозиды могут соединяться друг с другом в различных комбинациях, от чего в конечном итоге и зависит вид клетки, ее форма, состав и выполняемые ею функции. Другими словами, любые проявления живой клетки зависят от того, какие нуклеозиды и в какой последовательности будут взаимодействовать в каждой определенной молекуле ДНК.
Уникальной особенностью ПСК является то, что под действием различных регуляторных факторов они могут превращаться в любую клетку крови — эритроцит (обеспечивающий транспорт газов), тромбоцит (отвечающий за остановку кровотечений), лейкоцит или лимфоцит (выполняющие защитные функции).
Процесс роста и развития эритроцитов регулируется эритропоэтином – особым веществом, которое вырабатывается почками, если ткани организма испытывают недостаток в кислороде (кислородное голодание). Эритропоэтин активирует образование эритроцитов в красном костном мозге, в результате чего увеличивается их количество в периферической крови, что улучшает доставку кислорода к органам и тканям организма. Устранение кислородного голодания на тканевом уровне уменьшает продукцию эритропоэтина, что приводит к уменьшению синтеза эритроцитов.
Процесс дифференцировки (образования эритроцита из стволовой клетки) можно представить следующим образом:
- Полипотентная стволовая клетка через несколько промежуточных делений превращается в клетку-предшественницу эритропоэза, которая также содержит ядро и органеллы.
- Под воздействием эритропоэтина клетка-предшественница эритропоэза начинает активно делиться, при этом в ней происходит ряд структурных и функциональных изменений — она в несколько раз уменьшается в размерах, теряется ядро и большинство органелл (следовательно, и способность к дальнейшему размножению) и накапливает гемоглобин.
- Все описанные выше процессы происходят в красном костном мозге, а их результатом является образование ретикулоцитов (незрелых форм эритроцитов). За сутки в костном мозге образуется около 3 х 10 9 ретикулоцитов, которые выделяются в периферический кровоток. Они содержат некоторые органеллы и способны в небольших количествах образовывать гемоглобин.
- В течение 24 часов происходит полная утрата всех оставшихся органелл, в результате чего формируется зрелый эритроцит.
Для образования эритроцитов необходимы:
- Железо – включается в состав гемоглобина, являясь основным микроэлементом, обеспечивающим транспорт кислорода в организме.
- Витамин В12 (кобаламин) – принимает участие в образовании ДНК.
- Витамин В9 (фолиевая кислота) – также участвует в процессе образования ДНК.
- Витамин В6 (пиридоксин) – участвует в процессе образования гемоглобина.
- Витамин В2 (рибофлавин) – участвует в процессе дифференцировки эритроцитов.
Конечным этапом эритропоэза является зрелый эритроцит. Он не содержит ядра, практически полностью лишен органелл и не способен делиться. Его красный цвет обусловлен наличием железа, входящего в состав гемоглобина, который заполняет почти все внутреннее пространство клетки (в каждом эритроците содержится от 250 до 400 миллионов молекул гемоглобина, что равняется 25 – 40 пикограммам).
Эритроцит имеет форму уплощенного двояковогнутого диска с более толстыми краями и углублением в центре. Внутренняя поверхность его клеточной мембраны выстлана специальным белком – спектрином, который отвечает за поддержание формы клетки. Диаметр клетки равен в среднем 7,5 – 8,3 мкм.
Перечисленные особенности строения позволяют эритроциту видоизменяться и проходить через мельчайшие кровеносные сосуды организма, диаметр которых в 2 – 3 раза меньше диаметра самих эритроцитов, возвращаясь после этого к первоначальной форме (благодаря наличию спектрина).
Эритроциты не способны передвигаться самостоятельно и транспортируются в организме с током крови. Наружные поверхности их мембран обладают определенным отрицательным зарядом, в результате чего отталкиваются друг от друга, от остальных клеток крови и от стенок сосудов (которые также заряжены отрицательно). Это обеспечивает поддержание всех клеток крови во взвешенном состоянии, предотвращая их слипание и образование сгустков.
Средний срок жизни эритроцитов составляет 120 дней, в течение которых они циркулируют в крови, выполняя свои функции. Так как данные клетки практически лишены органелл, их способности к устранению повреждений (неизменно возникающих в процессе циркуляции в организме) довольно ограничены.
С течением времени эритроциты несколько уменьшаются в объеме (однако количество гемоглобина в них остается прежним), клеточная мембрана утрачивает эластичность и способность видоизменяться. Кроме того, наружная поверхность мембран старых эритроцитов теряет свой отрицательный заряд. Результатом этих процессов является уменьшение прочности и изменение формы красных клеток крови, что способствует их разрушению.
Разрушение эритроцитов (гемолиз) происходит:
- в селезенке;
- в сосудистом русле.
Разрушение эритроцитов в селезенке (внутриклеточный гемолиз)
Селезенка является основным органом, в котором разрушается до 90% эритроцитов, а также других клеток крови. Этому процессу способствует наличие большого количества так называемых синусоидных капилляров, имеющих в своей стенке небольшие отверстия. Эритроциты при прохождении через такие капилляры выходят из них и проходят через узкие щели в ткани селезенки (диаметр которых составляет 0,5 – 0,7 мкм). Старые или деформированные клетки не способны пройти через эти щели, поэтому задерживаются в них и разрушаются специальными клетками – макрофагами, которые находятся в данном органе в большом количестве.
При разрушении эритроцита железо, входящее в состав гемоглобина, высвобождается в кровоток, связывается с особым транспортным белком трансферрином и переносится в костный мозг, где вновь используется для образования эритроцитов. Оставшийся гемоглобин в результате нескольких химических реакций превращается в билирубин (несвязанную фракцию) – вещество желтого цвета, которое выделяется в кровоток при разрушении эритроцитов. Билирубин транспортируется в печень, где связывается с глюкуроновой кислотой, образуя связанную фракцию билирубина, которая включается в состав желчи и выводится из организма с калом.
Разрушение эритроцитов в сосудистом русле (внеклеточный гемолиз)
Данный термин подразумевает разрушение эритроцитов (и других клеток крови) непосредственно в просвете кровеносных сосудов. Примерно 10% эритроцитов разрушается путем внеклеточного гемолиза. Гемоглобин, попадающий при этом в кровоток, связывается с особым белком плазмы – гаптоглобином. Образующийся комплекс переносится в селезенку и разрушается ее макрофагами.
Организм человека не в состоянии синтезировать витамин В12, поэтому его количество полностью зависит от поступления с пищей (преимущественно животного происхождения).
Всасывание кобаламина происходит в кишечнике и только в присутствии особого фермента – внутреннего фактора Касла, который вырабатывается париетальными клетками слизистой оболочкой желудка. Поступающий с пищей витамин В12 связывается с данным ферментом в желудке. Образовавшийся комплекс взаимодействует (в присутствии ионов кальция) со специфическими рецепторами клеток слизистой оболочки тощей кишки (являющейся частью тонкого кишечника), в результате чего кобаламин переносится в кровоток, а внутренний фактор Касла остается в просвете кишечника.
Попавший в кровоток витамин В12 связывается со специальным транспортным белком – транскобаламином I или II и в таком виде доставляется в костный мозг, где принимает участие в процессе кроветворения, и в печень, являющуюся местом его депонирования. Важно отметить, что в клетки организма витамин В12 может попасть, только находясь в комплексе с транскобаламином II.
При сбалансированном питании и прочих нормальных условиях в кишечнике ежедневно всасывается 30 – 50 мкг витамина В12. Он депонируется в печени, которая у взрослого человека может содержать до 3 – 5 миллиграмм витамина. Если учесть, что суточная потребность организма в нем составляет 3 – 5 мкг, то становится понятным, почему первые признаки В12 дефицитной анемии начинают появляться не ранее чем через 2 – 3 года после нарушения процессов поступления кобаламина в организм.
Недостаток витамина В12 приводит к нарушению синтеза ДНК во всех клетках организма. В первую очередь это проявляется в тканях, в которых процессы клеточного деления происходят наиболее интенсивно — в кроветворной ткани и в слизистых оболочках.
Попавший в клетку кобаламин превращается в одну из двух активных форм:
- Дезоксиаденозилкобаламин (ДА-В12). Участвует в образовании жирных кислот. При их недостатке в организме поражается нервная система.
- Метил-кобаламин (метил-В12). Принимает активное участие в процессе образования компонентов ДНК, а именно в синтезе тимидина – одного из пиримидиновых нуклеозидов. Недостаток витамина В12 в организме приводит к остановке синтеза данного нуклеозида, в результате чего образуется структурно неполноценная молекула ДНК. Она быстро разрушается, что делает невозможным дальнейшее деление и дифференцировку клеток. Кроме того, метил-В12 также необходим для образования миелина, из которого состоят оболочки нервных волокон. При недостатке данного вещества нарушается проведение нервного импульса по нервам, что может проявляться разнообразными неврологическими симптомами.
Нарушение синтеза ДНК в процессе кроветворения происходит в начальных стадиях эритропоэза, в результате чего дальнейшее развитие эритроцитов становится невозможным. Образующиеся при этом кроветворные клетки (называемые мегалобластами) имеют большие размеры (10 – 20 мкм), содержат остатки разрушенного ядра и множество органелл, а также большое количество гемоглобина. Большинство из них разрушается прямо в костном мозге – развивается так называемый неэффективный эритропоэз. Те мегалобласты, которые все-таки выделяются в кровоток, неспособны выполнять транспортную функцию и при первом же прохождении через селезенку задерживаются и разрушаются в ней.
Важно отметить, что при недостатке витамина В12 в костном мозге нарушается образование не только эритроцитов, но и других клеток – лейкоцитов и тромбоцитов. Обычно эти изменения выражены менее значительно, чем дефицит эритроцитов, однако при длительном течении заболевания и отсутствии адекватного лечения может развиться панцитопения – клинический синдром, характеризующийся недостатком всех клеточных элементов в крови.

Причинами развития дефицита витамина В12 являются:
- недостаточное поступление с пищей;
- нарушение всасывания в кишечнике;
- повышенное использование витамина В12 в организме;
- наследственные заболевания, нарушающие обмен витамина В12.
Как было сказано ранее, организм человека неспособен самостоятельно синтезировать кобаламин, поэтому он должен присутствовать в потребляемой пище. Растения не содержат витамин В12, поэтому единственным его источником являются продукты животного происхождения — мясо, рыба, кисломолочные продукты и так далее. В нормальных условиях данные продукты включены в рацион почти каждого человека, поэтому дефицита витамина В12 не развивается.
Причинами недостаточного поступления витамина В12 с пищей могут быть:
- нарушение питания;
- хронический алкоголизм.
Нарушение питания
Одной из частых причин дефицита кобаламина в организме может быть вегетарианство. Вегетарианцами называется определенная группа людей, которые полностью отказались не только от мяса, но и от всех продуктов животного происхождения (яиц, рыбы, молока, сливочного масла и других). Так как данные продукты являются единственным источником кобаламина, вполне логично, что в скором времени у таких людей может развиться дефицит витамина В12 в организме.
Кроме вегетарианцев риск развития В12 дефицитной анемии повышен у бедных слоев населения, которые из-за недостатка средств не могут позволить себе употребление достаточного количества продуктов животного происхождения.
Хронический алкоголизм
Употребление больших доз алкоголя препятствует взаимодействию кобаламина с внутренним фактором Касла, а также повреждает слизистую оболочку желудка, нарушая выработку данного фактора париетальными клетками. Результатом этого становится резкое уменьшение количества кобаламина, поступающего в кровь.
Кроме того, длительное злоупотребление алкогольными напитками может привести к развитию таких заболеваний как алкогольный гепатит и цирроз. Результатом этого является уменьшение запасов кобаламина в печени, что снижает компенсаторные возможности организма при нарушении поступления данного витамина с пищей.
В данном случае с пищей поступает достаточное количество кобаламина, однако нарушены процессы его транспортировки из просвета кишечника в кровь.
Причинами нарушения всасывания витамина В12 могут быть:
- нарушение образования внутреннего фактора Касла;
- поражение тонкого кишечника;
- паразитарные инфекции.
Нарушение образования внутреннего фактора Касла
Как уже говорилось, наличие данного фактора является необходимым условием для всасывания витамина В12. При его недостатке поступающий с пищей кобаламин не способен пройти через слизистую оболочку кишечника и полностью выделяется с калом.
Причинами недостатка внутреннего фактора Касла могут быть:
- Атрофический гастрит. Данное заболевание характеризуется атрофией (уменьшением размеров и снижением функциональной активности) всех клеток слизистой оболочки желудка, что приводит к снижению или полному прекращению синтеза внутреннего фактора Касла париетальными клетками.
- Аутоиммунный гастрит. Характеризуется нарушением деятельности иммунной (защитной) функции организма, в результате чего собственные клетки начинают восприниматься как чужеродные, к ним образуются специфические антитела, которые их разрушают. При аутоиммунном гастрите антитела могут образовываться как к париетальным клеткам слизистой оболочки желудка, так и к самому фактору Касла.
- Рак желудка. Это опухолевое заболевание, в процессе которого происходит неконтролируемый рост и размножение опухолевых клеток, что приводит к постепенному разрушению и вытеснению париетальных клеток слизистой оболочки.
- Удаление желудка. Лечение некоторых заболеваний (прободной язвы, рака) заключается в частичном или полном удалении желудка, что приводит к уменьшению либо полному исчезновению париетальных клеток и, следовательно, к уменьшению количества образующегося внутреннего фактора Касла.
- Врожденный дефицит внутреннего фактора Касла. Данное заболевание передается по наследству и характеризуется дефектом гена, ответственного за образование этого фактора, что приводит к нарушению его секреции железами желудка.
Поражение тонкого кишечника
Всасывание витамина В12 происходит в тощей кишке. Различные повреждения данного отдела тонкого кишечника могут привести к нарушению процессов всасывания в нем.
Причинами поражения тощей кишки могут быть:
- Воспалительные заболевания (энтериты). Воспалению тонкого кишечника могут способствовать инфекции желудочно-кишечной системы, пищевые отравления, различные аллергии. При длительном течении воспалительных процессов происходит атрофия клеток слизистой оболочки кишечника, что делает невозможным всасывание кобаламина.
- Опухоли. Опухоли кишечника, по описанному ранее механизму, могут приводить к разрушению его слизистой оболочки.
- Удаление тонкой кишки (из-за опухоли или по другой причине).
Паразитарные инфекции
Исследованиями последних лет установлено, что более чем у 90% населения в кишечнике обитают различные паразиты (глисты). Им, как любым живым организмам, для роста и развития требуются определенные питательные вещества, в том числе и витамины. Некоторые глисты (например, широкий ланцет, вызывающий развитие дифиллоботриоза) могут достигать огромных размеров, в результате чего практически весь витамин В12, поступающий с пищей, не всасывается, а потребляется паразитом.
Как упоминалось ранее, взрослому человеку необходимо всего лишь 3 – 5 мкг кобаламина в сутки. Однако при определенных условиях и заболеваниях потребность в данном витамине может значительно увеличиваться.
Причинами усиленного использования витамина В12 в организме могут быть:
- Беременность. В развивающемся плоде процессы роста и деления клеток происходят максимально интенсивно, что увеличивает потребность матери в витамине В12 в несколько раз.
- Гипертиреоз. Данное заболевание характеризуется увеличенным образованием и поступлением в кровоток гормонов щитовидной железы (трийодтиронина и тироксина). Это приводит к повышению обмена веществ в организме, что характеризуется усилением процессов клеточного деления во многих органах и требует больших количеств кобаламина.
- Злокачественные опухоли. Злокачественный процесс характеризуется неконтролируемым и непрерывным размножением опухолевой клетки, в результате чего образуется множество ее копий. При массивных опухолях большая часть кобаламина может потребляться опухолевой тканью, в результате чего другие органы будут испытывать недостаток в данном витамине.
Это довольно большая группа патологических состояний, характеризующаяся нарушением образования определенных веществ, которые в норме обеспечивают всасывание и утилизацию кобаламина в организме.
Нарушение обмена витамина В12 может быть обусловлено:
- Наследственным дефицитом транскобаламина II. Заболевание наследуется по аутосомно-рецессивному типу, то есть ребенок будет болеть только в том случае, если оба родителя страдали данным заболеванием (либо являлись его бессимптомными носителями). Характеризуется уменьшением образования или полным отсутствием транскобаламина II в организме. В этом случае количество витамина В12 в крови нормальное или даже увеличенное, однако он не может попасть в клетки организма, в результате чего развивается клиническая картина В12 дефицитной анемии.
- Синдромом Имерслунд-Гресбека. Данное заболевание также передается по аутосомно-рецессивному типу и характеризуется нарушением всасывания витамина В12 в кишечнике. Механизм этого процесса окончательно не установлен, так как секреция и взаимодействие внутреннего фактора Касла с кобаламином происходят нормально, и никаких органических поражений тонкого кишечника не наблюдается. Предполагается нарушение транспортных систем в клетках слизистой оболочки тощей кишки.
- Нарушением использования витамина В12 в клетках. Как говорилось ранее, в клетках организма кобаламин превращается в метил-кобаламин и дезоксиаденозилкобаламин. Эти процессы требуют наличия определенных веществ (ферментов), при отсутствии которых использование витамина В12 клетками становится невозможным.

Заболевание развивается медленно и в начальных стадиях характеризуется неспецифическими симптомами – слабостью, повышенной утомляемостью. С течением времени состояние пациента ухудшается, а проявления дефицита витамина В12 становятся более явными.
Основные клинические проявления В12 дефицитной анемии обусловлены:
- нарушением образования клеток крови;
- поражением пищеварительной системы;
- поражением нервной системы.
В результате нарушения процесса кроветворения в циркулирующей крови снижается количество эритроцитов. Это ухудшает транспорт газов в организме и приводит к кислородному голоданию всех тканей и органов.
Нарушение кроветворения проявляется:
- Бледностью и желтушностью кожи и слизистых оболочек. Розоватый цвет кожи и слизистых оболочек обусловлен белково-пигментным комплексом – гемоглобином, входящим в состав эритроцитов. При В12 дефицитной анемии бледность развивается постепенно, усиливаясь в течение нескольких месяцев. Кроме того, из-за усиленного разрушения эритроцитов (происходящего в костном мозге и в селезенке), в кровь выделяется большое количество пигмента билирубина, который придает коже и слизистым оболочкам желтоватый оттенок.
- Учащенным сердцебиением. Если организм испытывает недостаток в кислороде – активируются определенные защитные реакции, одной из которых является увеличение частоты сердечных сокращений (ЧСС). Это приводит к увеличению объема крови, проходящей через каждый орган за единицу времени, что улучшает доставку кислорода.
- Болями в сердце. Увеличение частоты сердечных сокращений улучшает доставку кислорода ко всем органам. Однако само сердце при этом выполняет большую работу и получает меньше кислорода, что может привести к появлению колющих болей в груди, которые могут распространяться в область левого плеча и живота.
- Непереносимостью физических нагрузок. При физических нагрузках увеличивается потребность мышц в энергии, которая образуется только при достаточном количестве поступающего кислорода. В нормальных условиях эти потребность восполняются за счет увеличения частоты сердечных сокращений. Однако при В12 дефицитной анемии ЧСС и так увеличена, что усугубляется нарушенной транспортной функцией эритроцитов, в результате чего физические нагрузки различной интенсивности приводят к быстрой утомляемости, появлению чувства нехватки воздуха, головокружениям или потере сознания.
- Головокружениями и частыми обмороками. Данные симптомы являются признаками выраженного дефицита эритроцитов в крови, когда головной мозг начинает испытывать недостаток в кислороде.
- Появлением «мушек» перед глазами. Это обусловлено недостаточным кровоснабжением сетчатки глаза (которая весьма чувствительна к кислородному голоданию) и стекловидного тела, что приводит к нарушению в них обмена веществ, ухудшению остроты зрения и появлению перед глазами маленьких темных пятен в форме колец, молний, ниточек и др.
- Увеличением селезенки. Большие эритроциты, попадающие в кровоток, задерживаются в капиллярах селезенки, закупоривая их. Это приводит к скоплению большого количества клеток крови в органе и увеличению его в размерах.
Поражение желудочно-кишечной системы является наиболее ранним признаком дефицита витамина В12 в организме, что обусловлено интенсивным клеточным делением в слизистых оболочках полости рта, желудка, кишечника. При нарушении данных процессов быстро развиваются атрофические изменения и нарушение функции органов.
Поражение пищеварительной системы может проявляться:
- Нарушением пищеварения. Процесс пищеварения полностью зависит от нормального функционирования слизистых оболочек полости рта, желудка и кишечника. В них располагается множество желез, выделяющих особые пищеварительные соки, которые способствуют переработке пищевых продуктов. При недостаточности данных соков пища не проходит должной обработки, в результате чего нарушаются процессы всасывания питательных веществ, витаминов, микроэлементов.
- Неустойчивым стулом. В результате нарушения процессов пищеварения пища может дольше задерживаться в желудке или в кишечнике, приводя к вздутию живота, изжоге, запорам, которые могут чередоваться с диареей (поносом).
- Снижением аппетита. Появляется в результате снижения секреции желудочного сока атрофированной слизистой оболочкой желудка.
- Снижением массы тела. Является результатом снижения аппетита и нарушения пищеварения.
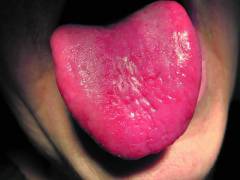
- Изменением цвета и формы языка. Поверхность языка образована огромным множеством мелких ворсинок, называемых сосочками. При В12 дефицитной анемии происходит атрофия слизистой оболочки языка, то есть постепенное уменьшение и исчезновение всех сосочков. В результате язык становится гладким, ярко-малинового цвета.
- Нарушением вкуса. Человек чувствует вкус различных продуктов благодаря наличию множества вкусовых рецепторов, расположенных в слизистой оболочке языка (преимущественно в сосочках). Следствием ее поражения является снижение или полная утрата вкусовых ощущений. Кроме того, у человека может появляться различные вкусовые отклонения – он может испытывать отвращение к различным продуктам питания (например, к мясу, рыбным изделиям и т. д.).
- Частыми инфекциями ротовой полости. Слизистая оболочка ротовой полости играет важную защитную роль, предотвращая рост и развитие патогенной микрофлоры. При ее атрофии увеличивается частота инфекционных заболеваний полости рта, может развиваться глоссит (воспаление языка), гингивит (воспаление десен).
- Болью и жжением в полости рта. Возникает в результате атрофических изменений слизистой оболочки и поражения нервных окончаний ротовой полости.
- Болью в животе после еды. Нормальная слизистая оболочка желудка выполняет защитную функцию, предохраняя желудок от агрессивного воздействия пищевых продуктов. При нарушении процессов клеточного деления повышается риск ее воспаления (развития гастрита) и образования язв, что может проявляться режущими болями в животе, усиливающимися после приема пищи (особенно острой, грубой, плохо обработанной).
Поражения нервной системы при дефиците витамина В12 обусловлены участием кобаламина в образовании миелиновых оболочек, которые являются составной частью большинства нервных волокон организма и обеспечивают передачу нервного импульса по ним. При нарушении образования миелина происходит повреждение и склероз (замещение рубцовой тканью) нервных клеток и нервных волокон, что может проявляться всевозможными неврологическими нарушениями (в зависимости от того, какие нервы были поражены).
Наиболее опасным считается поражение головного мозга, являющегося центром всей нервной системы, и спинного мозга, который представляет собой совокупность нервных волокон, идущих от головного мозга ко всем органам и тканям организма и в обратном направлении.
Симптомами поражения нервной системы при В12 дефицитной анемии могут быть:
- Нарушение чувствительности. Одно из первых проявлений поражения нервной системы. Чувствительность может нарушаться в любых участках тела, однако это наиболее заметно, когда поражаются пальцы рук, запястья. Больной человек может не ощущать прикосновение, тепло, холод и даже боль. Чаще поражение носит двусторонний характер и без соответствующего лечения постоянно прогрессирует.
- Парестезии. Один из видов нарушения чувствительности, характеризующийся онемением, покалыванием, «ползанием мурашек» в определенной области кожи.
- Атаксия. Данный термин подразумевает нарушение согласованной работы мышц. Это может проявляться нарушением равновесия, неуклюжестью и несогласованностью движений рук и ног, туловища.
- Снижение мышечной силы. Чтобы мышца сокращалась, необходимо поступление достаточного количества нервных импульсов из головного мозга. Кроме того, даже в покое головной мозг постоянно посылает к мышцам небольшое количество импульсов, что обеспечивает поддержание мышечного тонуса. При поражении спинного мозга импульсы не могут достичь мышц, в результате чего происходит их атрофия (уменьшение массы и размеров). При отсутствии своевременного лечения данное состояние может прогрессировать и привести к параличу – полной утрате способности выполнять произвольные движения.
- Нарушение процессов дефекации и мочеиспускания. Развиваются при длительном недостатке витамина В12 в организме и могут проявляться задержкой или, наоборот, недержанием кала и/или мочи (в зависимости от того, какие участки спинного мозга поражены).
- Нарушения психики. Является одним из наиболее неблагоприятных (в прогностическом плане) симптомов заболевания и характеризуется поражением коры головного мозга. Выраженность психических расстройств варьирует в зависимости от пораженного участка и выраженности склеротических изменений и может проявляться как бессонницей, незначительным ухудшением памяти или легкой депрессией, так и тяжелыми психозами, судорогами, галлюцинациями.
При В12 дефицитной анемии неврологические симптомы появляются в определенной последовательности — вначале происходит симметричное поражение ног, затем живота и туловища. В более поздних стадиях в процесс вовлекаются пальцы рук, плечевой пояс, шея, может поражаться область лица и головы. В последнюю очередь появляются психические расстройства.
Диагностикой и лечением В12 дефицитной анемии занимается врач-гематолог, который, при необходимости, может привлекать других специалистов (гастролога, невролога).
Процесс диагностики В12 дефицитной анемии включает:
- общий анализ крови;
- биохимический анализ крови;
- пункцию костного мозга;
- установление причины В12 дефицитной анемии.
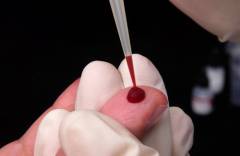
Целью данного исследования является определение клеточного состава периферической крови, а также детальное исследование полученного материала под микроскопом, что позволяет выявить отклонения в размерах, форме или составе клеток в крови.
Забор крови для анализа
Процедуру производит медсестра в специальном процедурном кабинете. Кровь берется утром, натощак. За 2 – 3 часа до сдачи анализа рекомендуется исключить курение и тяжелые физические нагрузки.
Для клинического анализа кровь могут брать:
- Из пальца (капиллярную). Капиллярную кровь берут из кончика пальца руки. Вначале с целью дезинфекции медсестра обрабатывает палец пациента ватой, смоченной в 70% спирте. После этого скарификатором (тонкой одноразовой стерильной пластинкой, которая заточена с обеих сторон) делается прокол кожи на глубину 2 – 4 мм. Первая появившаяся капля крови удаляется ватным тампоном, после чего в специальную промаркированную стеклянную трубку набирается несколько миллилитров крови. По окончании процедуры к месту прокола на 2 – 3 минуты прикладывается ватный тампон, пропитанный спиртом.
- Из вены. Кровь обычно берут из вен локтевой области, которые наиболее хорошо определяются под кожей. Если определить расположение вены в данной области не удается, кровь можно взять из любой другой вены. Пациент садится на стул и кладет руку на его спинку таким образом, чтобы локтевой сустав оказался в разогнутом состоянии. Медсестра накладывает тугой жгут на область плеча и определяет местоположение вены. Локтевая область дважды обрабатывается ватой, смоченной в спирте, после чего одноразовой стерильной иглой, присоединенной к шприцу, производится прокол вены и забор нескольких миллилитров крови. Потом игла извлекается, а к месту прокола на 5 – 7 минут прикладывается пропитанный спиртом ватный тампон.
Микроскопическое исследование
Для определения формы и размеров различных клеток в исследуемой крови, одну или несколько капель переносят на специально стекло, окрашивают специальными красителями и исследуют в световом микроскопе. Таким же способом можно подсчитать примерное содержание клеток в исследуемом образце.
Нормальный размер эритроцитов – 7,5 – 8,3 мкм. При микроскопическом исследовании они определяются как клетки красного цвета, одинаковых размеров, кольцевидной формы, не содержащие ядра или других включений.
При дефиците витамина В12 в костном мозге образуются мегалобласты. Часть из них сразу разрушается, а остальные поступают в кровоток.
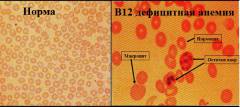
При В12 дефицитной анемии микроскопическая картина периферической крови характеризуется:
- Пойкилоцитозом – наличием эритроцитов различной формы.
- Анизоцитозом – наличием эритроцитов различных размеров.
- Макроцитозом – наличием эритроцитов, увеличенных в диаметре (более 8,5мкм).
- Внутриклеточными включениями – в эритроцитах определяются остатки разрушенного ядра и некоторые органеллы.
- Гиперхромией – эритроциты имеют более выраженную окраску, чем в норме (что обусловлено большой концентрацией гемоглобина и отсутствием сужения в центре клетки).
Исследование в гематологическом анализаторе
В большинстве современных лаборатории имеются специальные гематологические анализаторы, которые позволяют в довольно короткие сроки получить точную информацию о количестве клеточных элементов в исследуемой крови, а также некоторые другие показатели.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Данный показатель более точно отображает средние размеры эритроцитов в исследуемой крови, так как оценивает большее количество клеток, чем то, которое исследует врач при обычной микроскопии. | 75 – 100 кубических микрометров (мкм 3 ). | 100 – 110 мкм 3 и более. | |
| Концентрация эритроцитов (RBC) | В результате усиленного разрушения эритроцитов в костном мозге и в селезенке количество их в периферической крови будет снижено. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Концентрация тромбоцитов (PLT) | При в12 дефицитной анемии нарушается образование не только эритроцитов, но и остальных клеток крови. | 180 – 320 х 10 9 /л. | Менее 180 х 10 9 /л. |
| Концентрация лейкоцитов (WBC) | Лейкоциты выполняют защитную функцию. В норме их концентрация увеличивается при различных инфекциях. При дефиците витамина В12 образование лейкоцитов нарушается, и их количество в крови может быть уменьшено даже при тяжелых инфекционных заболеваниях. | 4,0 – 9,0 х 10 9 /л. | Менее 4,0 х 10 9 /л. |
| Концентрация ретикулоцитов (RET) | При дефиците витамина В12 кроветворение в костном мозге неэффективно, клетки не созревают до стадии ретикулоцитов, в результате чего их количество в крови будет снижено. | М: 0,24 – 1,7%. | Может быть в несколько раз ниже нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | При В12 дефицитной анемии количество эритроцитов снижено, однако концентрация гемоглобина в каждом из них увеличена, что может поддерживать общий уровень гемоглобина в крови на нормальном уровне. | М: 130 – 170 г/л. | Может быть нормальным или слегка сниженным. |
| Ж: 120 – 150 г/л. | |||
| Средняя концентрация гемоглобина в эритроцитах (MCHC) | Дает более точную информацию о насыщении эритроцитов гемоглобином, так как не учитывается объем плазмы, в которой находятся клетки крови. | 320 – 360 г/л. | Более 400 г/л. |
| Среднее содержание гемоглобина в одном эритроците (MCH) | Определяется посредством деления уровня гемоглобина на количество эритроцитов (вычисления производятся гематологическим анализатором автоматически). | 27 – 33 пикограмм (пг). | Более 35 пг. |
| Гематокрит (Hct) | Данный показатель выражается в процентах и определяет долю клеточных элементов в общем объеме крови. | М: 42 – 50%. | Снижен из-за значительного уменьшения количества эритроцитов в крови. |
| Ж: 38 – 47%. | |||
| Цветовой показатель (ЦП) | Характеризует степень насыщения эритроцитов гемоглобином — чем его больше, тем выше будет цветовой показатель. | 0,85 – 1,05. | Более 1,1. |
| Скорость оседания эритроцитов (СОЭ) | Так как наружные поверхности эритроцитов заряжены отрицательно, они отталкиваются друг от друга, что препятствует их склеиванию. Суть определения СОЭ заключается в склеивании эритроцитов в крови и оседании их на дно пробирки под действием силы тяжести. Скорость данного процесса зависит от концентрации клеток в крови — чем их меньше, тем слабее они отталкиваются друг от друга, и тем быстрее будет СОЭ. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
Данное исследование позволяет определить наличие растворенных в крови веществ (белков, ферментов, витаминов и других). Практически любое заболевание (в том числе и В12 дефицитная анемия) характеризуется увеличением или снижением концентрации различных веществ в крови, что позволяет судить о выраженности патологического процесса и степени повреждения внутренних органов, а также контролировать эффективность проводимого лечения.
Кровь для биохимического исследования берется из вены (подготовка пациента и методика забора материала были описаны выше), после чего в специальной пробирке направляется в лабораторию.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Содержание кобаламина в крови | Обычно заболевание характеризуется снижением уровня витамина В12. Однако в некоторых случаях (при нарушениях обмена кобаламина в организме) концентрация данного витамина в крови будет увеличена, несмотря на клинические проявления В12 дефицитной анемии, поэтому данный показатель необходимо оценивать, учитывая данные других анализов. | 200 – 900 пг/мл. |
|
| Уровень метилмалоновой кислоты в крови | Данное вещество участвует в процессах жизнедеятельности клеток. Для его использования необходимо наличие активной формы кобаламина (ДА-В12), в отсутствии которой метилмалоновая кислота не может использоваться клетками организма, в результате чего ее концентрация в крови повышается. | 73 – 270 нмоль/мл. | Значительно выше нормы. |
| Уровень гомоцистеина в крови | Гомоцистеин – аминокислота, которая участвует в образовании вещества метионина, входящего в состав миелиновых оболочек нервных клеток. Этот процесс также требует присутствия активной формы кобаламина (метил-В12). При его недостатке количество свободного гомоцистеина в плазме крови повышается. | 5 – 16 мкмоль/л. | Значительно выше нормы. |
| Концентрация билирубина (несвязанной фракции). | Уровень несвязанного билирубина может повышаться при массивном разрушении мегалобластов в красном костном мозге и в селезенке. | 4,5 – 17,1 мкмоль/л. | Может быть увеличен в несколько раз, особенно при длительном течении заболевания. |
| Концентрация сывороточного железа | При интенсивном разрушении эритроцитов и их предшественников из них выделяется большое количество железа. В нормальных условиях оно используется для синтеза новых эритроцитов, однако при В12 дефицитной анемии данный процесс нарушен, в результате чего концентрация железа в крови может повышаться. | М: 17,9 – 22,5 мкмоль/л. | Может повышаться при длительном течении заболевания. |
| Ж: 14,3 – 17,9 мкмоль/л. |
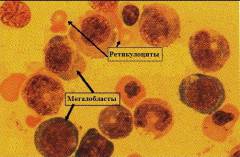
Обычно костный мозг берут из грудины. Процедура выполняется только специально обученным врачом в условиях стерильной операционной. Место пункции дважды обрабатывается 70% спиртовым или йодным раствором. После этого специальным шприцем с полой иглой, установленной под прямым углом к грудине, прокалывают кожу и надкостницу и продвигают иглу на 1 – 2 см в вещество кости. Убедившись, что игла находится в полости кости, производится забор нескольких миллилитров костного мозга, который имеет вид густого, желтовато-красно вещества. Полученный материал направляется в лабораторию для микроскопического исследования.
При В12 дефицитной анемии в костном мозге определяется увеличение клеточных элементов (преимущественно за счет предшественников эритроцитов). Клетки увеличены в размерах, содержат слишком большое количество гемоглобина (по сравнению с нормой). Также отмечается нарушение созревания мегакариоцитов (предшественников тромбоцитов) и промиелоцитов (предшественников лейкоцитов).
При подтверждении диагноза не менее важным моментом является выявление его причины, так как ее устранение (если оно возможно) может привести к излечению пациента.
Для выявления причины В12 дефицитной анемии используется:
- Оценка рациона пациента. Уточняется, как питается пациент, потребляет ли достаточное количество животных продуктов, как часто употребляет алкогольные напитки.
- Фиброгастродуоденоскопия (ФГДС). Метод исследования внутренней поверхности желудка и начального отдела кишечника посредством введения специальной трубки с видеокамерой на конце. Позволяет выявить атрофию слизистой, наличие рака или язвы.
- Биопсия слизистой оболочки желудка и/или кишечника. Подразумевает прижизненное взятие кусочка ткани слизистой оболочки и исследование его клеточного строения. Позволяет выявить атрофические процессы, а также различить доброкачественные и злокачественные опухоли.
- Анализ кала на яйца гельминтов (глистов). С помощью данного метода можно установить само наличие паразитов, а также определить их чувствительность к различным противопаразитарным препаратам, что позволит назначить максимально эффективное лечение.
- Определение специфических антител. В крови могут определяться антитела к внутреннему фактору Касла либо к париетальным клеткам слизистой оболочки, которые его продуцируют.
- Оценка функции печени. Определяется уровень печеночных ферментов в крови, проводится ультразвуковое исследование (УЗИ) органа.
- Определение уровня гормонов щитовидной железы в крови. При их увеличении потребление кобаламина организмом возрастает, что со временем может привести к развитию В12 дефицитной анемии.
Суть медикаментозной терапии данного недуга заключается в ведении витамина В12 извне. Поступив в организм, кобаламин быстро включается в процессы кроветворения, что приводит к устранению симптомов анемии в довольно короткие сроки.
Показаниями к началу лечения витамином В12 являются:
- подтвержденный (лабораторно) диагноз В12 дефицитной анемии;
- концентрация кобаламина в плазме крови менее 220 пг/мл;
- выраженная клиническая картина анемии (даже при более высокой концентрации кобаламина в крови).
Способ применения и дозировка
В большинстве случаев препарат витамина В12 (цианокобаламин) вводится внутримышечно. Прием внутрь (в виде таблеток) допускается, если достоверно установлено, что причиной дефицита витамина является недостаточное его количество в пище, а общее состояние организма не критично (легкое снижение показателей крови, отсутствие неврологических проявлений).
Лечение начинают с внутримышечного введения 500 – 1000 мкг цианокобаламина 1 раз в сутки. Минимальный курс лечения – 6 недель, после чего переходят на поддерживающую терапию. Дозировка препарата на данном этапе лечения зависит от причины и выраженности дефицита витамина В12 в организме. Обычно назначается внутримышечное введение 200 – 400 мкг цианокобаламина 2 – 4 раза в месяц. Поддерживающая терапия может проводиться пожизненно.
Контроль эффективности лечения
В период лечения рекомендуется сдавать общий анализ крови 2 – 3 раза в неделю.
Первым признаком эффективности терапии, а также достоверным подтверждением диагноза является «ретикулоцитарный криз», возникающий на 3 – 5 день после начала введения витамина В12 в организм. Данное состояние характеризующийся резким увеличением количества ретикулоцитов в крови (в 10 – 20 раз), что свидетельствует о начале нормального кроветворения в косном мозге.
В течение 1 – 1,5 месяцев происходит постепенная нормализация состава периферической крови, ослабление неврологических проявлений, нормализация работы пищеварительной системы, что свидетельствует об эффективности проводимого лечения. На этапе поддерживающей терапии рекомендуется ежемесячное проведение общего анализа крови и определение уровня кобаламина в крови.
Суть метода заключается в переливании пациенту крови или, чаще, отдельной эритроцитарной массы. Переливание крови является опасной процедурой, поэтому данный метод используется только при угрожающих жизни состояниях.
Показаниями к переливанию эритроцитов при В12 дефицитной анемии являются:
- Тяжелая анемия – уровень гемоглобина менее 70 г/л;
- Анемическая кома – потеря сознания, обусловленная выраженным нарушением доставки кислорода к мозгу.
Перед началом процедуры проводятся тесты на совместимость крови донора и реципиента (того, кому переливается кровь), после чего в одну из больших вен организма вводится катетер, через который переливается эритроцитарная масса. Так как данная процедура сопряжена с риском развития множества побочных реакций, в течение всего периода переливания крови в палате должен присутствовать врач.
При подтвержденном диагнозе В12 дефицитной анемии одновременно с переливанием донорских эритроцитов начинают внутримышечное введение витамина В12. Переливание крови следует прекратить как можно раньше, как только устранено угрожающее жизни состояние.
Как говорилось ранее, суточная потребность в витамине В12 составляет 3 – 5 мкг, а запасы данного витамина в печени настолько велики, что даже при прекращении поступления кобаламина в организм признаки его дефицита появятся не ранее, чем через 2 – 3 года. Тем не менее, диета играет определенную роль в процессе лечения заболевания, особенно когда запасы витаминов В12 в организме снижаются.
Причинами снижения запасов витамина В12 в организме могут быть:
- Заболевания печени. Такие заболевания как цирроз и рак печени, приводят к уменьшению количества нормальных клеток органа, и замещению их соединительно тканью, которая неспособна депонировать витамин В12. В результате запасы данного витамина в организме снижаются, а при нарушении его поступления признаки заболевания могут появляться в более ранние сроки.
- Беременность. В данном случае матери необходимо обеспечивать витамином В12 не только свой, но и быстро развивающийся организм ребенка, поэтому суточная потребность в витамине В12 может увеличиваться на 50%, а в случае многоплодной беременности – еще больше. В нормальных условиях (при отсутствии заболеваний печени) запасов кобаламина в организме достаточно, чтобы покрыть потребности матери и плода в данном веществе. Однако при частых беременностях запасы кобаламина могут истощаться, особенно если у матери имеются какие-либо заболевания печени, поэтому беременным женщинам особенно важно потреблять достаточное количество этого витамина с пищей.
| Наименование продукта | Содержание витамина В12 в 100г продукта |
| Печень говяжья | 60 мкг |
| Печень свиная | 30 мкг |
| Печень куриная | 16 мкг |
| Скумбрия | 12 мкг |
| Мясо кролика | 4,3 мкг |
| Говядина | 2,6 мкг |
| Морской окунь | 2,4 мкг |
| Свинина | 2 мкг |
| Треска | 1,6 мкг |
| Карп | 1,5 мкг |
| Куриное яйцо | 0,5 мкг |
| Сметана | до 0,4 мкг |

С тех пор как в лечении В12 дефицитной анемии начали применять внутримышечное введение цианокобаламина прогноз для жизни и здоровья пациентов значительно улучшился. При соблюдении режима приема препарата люди могут доживать до глубокой старости без каких-либо проявлений заболевания.
источник