Различают острую и хроническую постгеморрагическую анемии.
Возникает в результате острой массивной потери крови в объеме от 5 мл/кг массы тела и выше (травма, хирургическое вмешательство, желудочные, маточные, кишечные кровотечения, разрыв фаллопиевых труб, нарушение гемостаза и др.). Сразу после потери крови вследствие уменьшения ее массы появляется общеанемические признаки — тахикардия, одышка, бледность кожных покровов и слизистых оболочек, падение АД. Содержание эритроцитов и гемоглобина снижается равномерно (нормоцитемическая гиповолемия), развивается нормохромная анемия. Изменения периферической крови носят стадийный характер. На 2–3-е сутки после кровотечения в кровь поступает тканевая жидкость, масса ее восстанавливается (гидремическая фаза), а количество эритроцитов и гемоглобина снижается, падает гематокрит, но в связи с выходом эритроцитов из депо цветовой показатель сохраняется в норме (нормохромная анемия), развивается лейкопения (утрата лейкоцитов во время кровотечения, гемодиллюция), тромбоцитопения (утрата тромбоцитов при потере крови, потребление при образовании тромба). Наблюдается умеренный анизоцитоз и пойкилоцитоз эритроцитов. Возникшая гипоксия ведет к повышению уровня эритропоэтина и на 4–5-е сутки после кровотечения активируется функция костного мозга (костномозговая фаза компенсации) появляются регенеративные формы эритроцитов — полихроматофилы, единичные нормобласты (полихроматофильные, оксифильные), ретикулоцитоз. Анемия приобретает гипохромный характер, т. к. ускоренная регенерация опережает созревание эритроцитов из-за возникшего дефицита железа. Развивается нейтрофильный лейкоцитоз со сдвигом влево по регенеративному типу.
Данные нарушения обусловлены уменьшением объема циркулирующей крови и гипоксией. В ответ на кровопотерю включаются механизмы компенсации, направленные на восстановление утерянного объема крови и на борьбу с анемическим состоянием (гипоксией).
Развивается в результате длительно повторяющихся небольших кровотечений. Является вариантом железодефицитных анемий, патогенез и проявления обусловлены нарастающим дефицитом железа.
Железо — один из важнейших микроэлементов, входящих в состав организма человека. Взрослому человеку требуется 15–18 мг/сут железа, из которых всасывается 2–2,5 мг. При этом биодоступность содержащегося в пище гемового железа существенно выше, чем негемового. Основные депо железа: печень (гепатоциты и макрофаги), костный мозг, селезёнка, мышцы. Если метаболизм железа нормален, 30–40 % нормобластов костного мозга содержат гранулы ферритина (сидеробласты). Отсутствие сидеробластов характерно для железодефицита. Избыток гранул в сидеробласте служит признаком переполнения организма железом (гемосидероз) или неспособности утилизировать его (сидеробластная анемия). На рис. 2 представлена схема метаболизма железа.
Дефицит железа в организме существует в двух формах, представляющих собой две последовательные стадии одного процесса: латентный (тканевый) дефицит железа (ЛДЖ) и собственно железодефицитная анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев анемий и является одной из самых распространенных ее форм. Женщины страдают данным заболеванием чаще, чем мужчины, поскольку запасы железа у последних значительно превышают (на 100–200 %) таковые у женщин. Явный и скрытый дефицит железа отмечается почти у 60 % женщин земного шара. Железодефицитные анемии встречаются во всех возрастных группах. Различают «истинные» ЖДА — при абсолютном дефиците железа и «ложные» — при нарушении включения железа в гемм, в отсутствие первичного истинного железодефицита.
Рисунок 2 – Схема метаболизма железа в организме
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л.И. Идельсон): 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа.
Таблица 3.Причины и механизмы развития железодефицитных состояний
Группы этиологических факторов
Дети недоношенные и новорожденные
Недостаточный исходный уровень железа
Интенсивный рост (пубертатный период)
Повышенное расходование железа
Хроническая кровопотеря: при частых лечебных кровопусканиях, донорстве;
При заболеваниях ССС (гипертоническая болезнь, геморрагическая телеангиэктазия и др.);
При патологии ЖКТ (варикозное расширение вен пищевода, диафрагмальная грыжа, язва желудка и 12-перстной кишки, язвенный колит, дивертикулёз, геморрой и др.);
Из органов мочеполовой системы (алкогольная нефропатия, туберкулёз почек, почечнокаменная болезнь, полипы и рак мочевого пузыря, обильные меноррагии, эндометриоз, миома матки и др.);
Из органов дыхательной системы (рак лёгкого, туберкулёз, бронхоэктазия и др.);
При заболеваниях системы крови (лейкозы, апластическая анемия и др.);
Припатологии системы гемостаза (аутоиммунная тромбоцитопения, гемофилии, ДВС-синдром и др.)
Патологические состояния и болезни
Резекция желудка и кишечника;
Гипосекреция желудочного сока;
Нарушение всасывания железа
Приобретённая гипотрансферринемия (при нарушении белоксинтезирующей функции печени)
Нарушение транспорта железа
Недостаточное поступление железа; нарушение транспорта железа; нарушение всасывания железа; потеря железа
Нарушение всасывания железа
Искусственное вскармливание грудных детей
Недостаточное поступление железа
Избыточные физические нагрузки
Повышенное расходование железа
Нередко действуют комбинации указанных факторов, вызывающих отрицательный баланс железа. Примером ЖДА, развивающейся вследствие комплексного влияния нескольких факторов, является хлороз (от греч. «хлорос» — бледно-зеленый, или «бледная немочь»). Название связано со специфическим цветом лица таких больных. При ЖДА уменьшается содержание железа в плазме крови, костном мозге и в тканевых депо.
Основным звеном патогенеза заболевания является снижение содержания железа в депо, сыворотке крови и костном мозгу. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мышечная слабость и др.. В патогенезе клинических проявлений болезни имеет значение: нарушение активности железосодержащих ферментов в тканях организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, α-глицерофосфатоксидаза) и недостаточное снабжение тканей кислородом. Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Клиническая картина складывается из двух основных синдромов: общеанемического и сидеропенического.
Общеанемический синдром проявляется симптомами, характерными для всех видов анемии: бледность, общая слабость, быстрая утомляемость, обмороки, одышка, тахикардия, систолический шум.
Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) — ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, слабость физиологических сфинктеров. Может возникнуть извращение вкуса (поедание несъедобных продуктов — мела, бумаги и др.), пристрастие к необычным запахам (ацетон, бензин, краска). Нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет».
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до 2,0-1,5×10 12 /л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозгу и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозгу не превышает 10-15%). Ретикулоциты в норме или незначительно увеличены, при прогрессировании ЖДА их количество снижается. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов.
Нередко развивается нейтропения (в результате уменьшения содержания железосодержащих ферментов в лейкоцитах). СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть незначительно повышен (на фоне кровотечений).
Исследование костного мозга.В КМ определяется нормобластическая гиперплазия с нарушением гемоглобинизации (преобладание базофильных и полихроматофильных нормобластов при снижении оксифильных), снижение индекса созревания нормобластов, снижение количества сидеробластов вплоть до полного их отсутствия. Миелоидный и мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной диагностический критерий при ЖДА, включающий набор тестов, при помощи которых подтверждается факт дефицита железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина железом,
увеличение содержания трансферрина в сыворотке,
повышение общей и латентной железосвязывающей способности сыворотки,
увеличение содержания растворимых рецепторов к трансферритину в сыворотке,
повышение свободного протопорфирина IX в эритроцитах.
Количество железа в сыворотке крови при выраженной ЖДА падает до 5,4–1,8 мкмоль/л при норме 12,5–30,4 мкмоль/л (мужчины; у женщин этот показатель на 10–15% ниже. Под общей железосвязывающей способностью сыворотки понимается количество железа, которое может связаться с трансферрином (в норме 54,0–72,0 мкмоль/л). В норме одна треть трансферрина насыщена железом, а две трети — свободны. Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6–1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный индикатор резервных запасов железа. Он содержит примерно 15-20% общего запаса железа в организме взрослого человека. Определяется почти во всех тканях, особенно высока его концентрация и синтетическая способность в печени, селезенке и костном мозге. Белок в свободном от железа виде называется апоферритином. Ферритин состоит из белковой оболочки, которая окружает ядро трехвалентного железа в виде комплексов окиси и фосфата железа. Каждая молекула апоферритина может сорбировать до 5000 атомов железа, однако большинство молекул ферритина содержат от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями внутренних органов, включают анемии при эндокринных заболеваниях, заболеваниях печени и почек.
К числу анемий при эндокринных заболеванияхотносятся анемии при заболеваниях щитовидной и паращитовидных желез, надпочечников, половых желез, гипопитуитаризме и др., в основе патогенеза которых лежит депрессия эритропоэза при дефиците или, напротив, гиперсекреции ряда гормонов. В частности, такие гормоны, как тироксин, кортизол, тестостерон в очень высоких концентрациях вызывают угнетение пролиферативной активности эритроидных прекурсоров. В случае сгущения крови в результате дегидратации (при надпочечниковой недостаточности, гипотиреозе) диагностика анемии может быть затруднена.
К анемиям при заболеваниях печени относятся анемии, возникающие при диффузных поражениях органа (циррозе, хроническом гепатите, гемохроматозе и др.).
Патогенез анемии при заболеваниях печени отличается многообразием патогенетических факторов, что определяется особенностями патогенеза основного заболевания. Выделяют следующие механизмы развития анемии:
угнетение процессов кроветворения в костном мозгу вследствие прямого токсического влияния на клетки-предшественницы гемопоэза алкоголя (при алкогольном поражении печени) и эндогенных токсинов (при нарушениях обезвреживающей и клиренсной функции печени), при нарушениях метаболизма железа и депонирования витамина В12и фолиевой кислоты в пораженной печени;
укорочение продолжительности жизни эритроцитов в результате прямого повреждающего действия токсических продуктов экзогенного (алкоголь) и эндогенного (при эндотоксемии) происхождения, гиперспленизма, при нарушениях внутриклеточного метаболизма эритроцитов (например, в связи с дефицитом в клетках НАДФ + ) и их способности к деформации (вследствие патологии клеточной мембраны при изменениях фракционного состава фосфолипидов, снижении содержания сиаловых кислот);
кровотечения из расширенных вен желудочно-кишечного тракта (при циррозе печени), носовые, геморроидальные и иной локализации (при формирующейся недостаточности синтеза факторов свертывания крови вследствие нарушений белкового обмена).
В подавляющем большинстве случаев при заболеваниях печени регистрируется нормохромная нормоцитарная анемия, при присоединяющемся дефиците железа — микроцитарная нормоили гипохромная, при недостаточности витамина В12и фолиевой кислоты, метастазах рака желудка в печень — макроцитарная анемия нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут выявляться у больных острым гломерулонефритом, интерстициальным нефритом, хронической почечной недостаточностью. Патогенез анемии при заболеваниях почек определяется снижением продукции эритропоэтина клетками юкстагломерулярного аппарата, депрессией кроветворения в костном мозгу (в результате нарушения пролиферативной активности эритроидных клеток, торможения процессов синтеза гема) и сокращением срока жизни эритроцитов (до 40-50 дней) при действии токсических продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений общего объема циркулирующей крови.
Какова этиология олигоцитемических и полицитемических гиповолемий?
Какова этиология олигоцитемических и полицитемических гиперволемий?
Укажите общие механизмы формирования компенсаторно-приспособительных механизмов при кровопотере.
Каков механизм формирования экстренных защитно-приспособительных реакций организма при кровопотерях?
Каков механизм формирования долговременных защитно-приспособительных реакций организма при кровопотерях?
Дайте определение понятию анемия, каковы принципы классификации?
Назовите основные фонды железа в организме?
Перечислите лабораторные показатели, характеризующие состояние красной крови при острой кровопотере?
Перечислите лабораторные показатели, характеризующие состояние красной крови при хронической кровопотере?
Какие Вы знаете анемии, ассоциированные с заболеваниями внутренних органов, какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного хлороза (у девочек в пубертатный период) при ЖДА
источник
Заболевания крови. Основные синдромы
— алебастровый, зеленоватый оттенок кожи;
— расширение границ сердца (относительной сердечной тупости);
— пастозность нижних конечностей.
— лейкозная инфильтрация слизистой рта (набухание десен, увеличение миндалин);
— кровотечения из носа, десен, легочные и т.д.;
— геморрагии на коже, слизистых.
Обследование: пальпаторно, биопсия.
Происходит сглаживание, выбухание, обезображивание участков, где расположены лимфоузлы.
Лимфоузлы: плотные, безболезненные, неуклонно увеличиваются, имеют вид «пакетов» и вызывают компрессионные синдромы:
— сдавливания средостения: «воротник Стокса» (одышка цианоз, отек лица, отек шеи);
— сдавление общего желчного протока → желтуха;
— сдавление забрюшинных, мезентериальных лимфоузлов дает асцит;
— увеличение лимфоузлов вдоль позвоночника → корешковый синдром.
5/ Гепатомегалия, спленомегалия.
7/ Лихорадка – м.б. небольшой, значительной.
— ревматоидоподобные артриты крупных периферических суставов;
— ногти в виде «часовых стекол»; заболевания
— фиброзные контрактуры (на поздней стадии заболевания).
10/ Гнойно-септические осложнения.
11/ Трофические изменения кожи, волос, ногтей, костей: истончение и сухость кожи, выпадение волос, ломкость ногтей.
Классификация анемий.
По этиопатогенетическому признаку:
1. Анемии вследствие кровопотерь:
2. Анемии вследствие нарушенного кровообразования:
— железонасыщенные (сидероахрестические или сидеробластные);
3. Анемии вследствие усиленного кроверазрушения (гемолитические):
— приобретенные (связаны с воздействием антител, прямых гемолизинов, других повреждающих факторов).
По способности костного мозга к кроветворению:
— регенераторные (ЦП=1) с повышенным эритропоэзом;
Анемии вследствие кровопотерь
Острая постгеморрагическая анемия
Этиология: массивная кровопотеря.
Патогенез: нарушения связаны с уменьшением объема циркулирующей крови и гипоксией.
Компенсаторные механизмы направлены на восстановление объема крови, на борьбу с гипоксией.
Картина крови: через 1-2 суток развивается нормохромная анемия. На 4-5 день – ретикулоцитоз, появляются полихроматофилы, нормобласты (нормоциты). Вследствие недостаточного насыщения эритроцитов гемоглобином анемия становится гипохромной, сопровождается лейкоцитозом со сдвигом влево.
Клиника: симптомы коллапса: резкая слабость, головокружение, бледность, сухость во рту, холодный пот, рвота, ↓ АД, ↑ Рs + слабого наполнения.
Лечение: остановка кровотечения, противошоковые мероприятия, трансфузионная терапия при АД ударов в 1 минуту.
Кровопотеря 1 л: донорская цитратная кровь (хранение не > 5 дней).
Профилактика: лечение основного заболевания.
Хроническая постгеморрагическая анемия
80% анемий – железодефицитные. Чаще болеют женщины.
Явный и скрытый дефицит железа отмечается у 60% жителей земного шара. В Европе частота железодефицитной анемии – 7-11%, скрытого дефицита железа – 20-25%.
В детском возрасте до 50% детей до 1 года имеют дефицит железа.
— хронические, необильные, скрытые кровопотери (маточные, желудочно-кишечные, легочные, носовые, десневые и т.д.);
— недостаток поступления железа с пищей (чаще в слаборазвитых странах, у детей на искусственном вскармливании, у новорожденных при дефиците железа у беременной);
— усиленный расход железа в период роста, созревания, беременности, лактации;
— пониженное усвоение железа после резекции желудка, тонкого кишечника;
— нарушение утилизации железа при инфекциях, интоксикациях, глистных инвазиях (часто в жарких странах);
— у девочек в период полового созревания в связи с повышенным расходом железа и угнетающим действием эстрогенов на эритропоэз (ювенильный хлороз → «бледная немочь»).
Патогенез: нарушение синтеза гема и насыщения эритроцитов гемоглобином вследствие истинного перераспределительного дефицита железа в организме. Снижается концентрация сывороточного железа, повышается общая и, особенно, латентная железосвязывающая способность сыворотки крови с уменьшением % насыщения железом его переносчика – трансферина (сидерофилин).
Транспорт железа в костный мозг снижается, уменьшается его включение в клетки эритроцитарного ряда.
— гипохромная анемия – ЦП=0,6 и ниже;
— число эритроцитов м.б. нормальным или снижается, но меньше, чем гемоглобин;
— нейтропения (т.к. уменьшается содержание железосодержащих ферментов в лейкоцитах);
— железо в сыворотке снижено до 2-2,5 мкмоль/л (N = 14-32 мкмоль/л).
Клиника (железодефицитной анемии):
В клинике ведущими являются 2 синдрома:
— количество эритроцитов падает в большей степени, чем гемоглобин;
— лейкопения с нейтропенией;
— эритроциты с тельцами Жолли, кольцами Кебота, базофильной зернистостью;
Клиника: жалобы связаны с поражением кроветворной, пищеварительной, нервной систем.
Общие жалобы: слабость, утомляемость, одышка, сердцебиение, диспептические расстройства.
Внешне: полнота; одутловатость лица; бледно-желтушная кожа; субиктеричность склер; афты на языке, слизистой щек; «лакированный» язык; печень, селезенка увеличены.
Нервная система: парестезии; чувство «холода», «ползания мурашек», онемение конечностей»; «ватные ноги»; мышечная слабость; атрофия мышц; характерно сегментарное поражение конечностей; потеря вкусовых ощущений, обоняния, слуха; нарушение ФТО; психические расстройства(галлюцинации, бред, Ерт-приступы; кахексия в тяжелых случаях; параличи нижних конечностей; распространенный кариес.
При правильном лечении прогноз благоприятный.
Витамин В12 парентерально 400-500 γ ежедневно N 30-40 до нормализации показателей крови.
Поддерживающая терапия: 400-500 γ 1 раз/неделю – 2-3 месяца; затем 2 раза/месяц – 2-3 месяца; затем 250 γ ежемесячно пожизненно.
В нелеченных случаях после 2-3 рецидивов – летальный исход.
Дефицит фолиевой кислоты наблюдается при голодании, особенно у детей; при алкоголизме; при беременности; при энтеритах, энтеропатиях.
Клиника: как при В12-дефицитной анемии.
Дифференцировать очень трудно. Поэтому вместе с витамином В12 назначают фолиевую кислоту (10-15 мг/сутки – 6 недель).
Течение – циклическое; прогноз – благоприятный.
Профилактика: новорожденных кормить донорским молоком, смесями, но не козьим молоком.
Дата добавления: 2016-10-23 ; просмотров: 364 | Нарушение авторских прав
источник
НА ТЕМУ: Анемия. Острая, железодефицитная, хроническая анемии
Анемия в переводе с греческого означает бескровие (an — без, haiта— кровь), что, однако, не соответствует смысловому значению названия. Анемия — это патологическое состояние, характеризующееся уменьшением содержания гемоглобина или количества эритроцитов в единице объема крови и вследствие этого ведущее к развитию гипоксии. Анемия расценивается: как патологический процесс, протекающий с нарушением деятельности различных органов и систем.
Общепринятая классификация анемии (несколько видоизмененная с учетом современных данных), в основу которой положен патогенетический принцип, представлена в табл. 22.
Приведенная классификация в известной мере условна, так как за основу ее принимается лишь один патогенетический фактор: потеря крови, дефицит железа или цианокобаламина, органическое поражение костного мозга, гемолиз. Фактически же патогенез анемии в большинстве случаев более сложен. Например, при беременности, злокачественных новообразованиях, хроническом энтероколите и т. д. в развитии анемии участвует одновременно несколько патогенетических факторов.
Наряду с этим в клинической практике наблюдаются формы анемии неизвестного пока происхождения. Однако несмотря на некоторую условность, патогенетическая классификация анемии (с учетом различных этиологических факторов и клинико-морфологических проявлений) нашла широкое применение в клинической практике.
Причинами острой кровопотери являются различные внешние травмы, сопровождающиеся повреждением крупных сосудов, или кровотечение из внутренних органов (желудочно-кишечное, легочное, носовое, маточное, геморроидальное и др.).
Клиника острой постгеморрагической анемии связана с гипоксией и развитием коллапса. Отмечаются головокружение, сердцебиение, одышка, резкая общая слабость, тахикардия, систолический шум над верхушкой сердца и над сосудами (что обусловлено значительной гидремией), снижение артериального давления.
Непосредственно после кровопотери и в течение первых часов показатели красной крови существенно не снижаются («скрытая анемия») в связи с рефлекторным уменьшением объема сосудистого русла и компенсаторным поступлением в кровоток депонированной крови (рефлекторная фаза компенсации). Через 1—2 дня развивается гидремическая фаза компенсации, выражающаяся в обильном поступлении в русло крови тканевой жидкости и восстановлении первоначального объема сосудистого русла. В этой фазе уже констатируется анемизация. Спустя 4—5 дней после кровопотери развивается костномозговая фаза компенсации (ретикулоцитоз, нейтрофильный лейкоцитоз с ядерным сдвигом до метамиелоцитов и даже миелоцигов и умеренный тромбоцитоз) в результате усиленной регенерации костного мозга и выхода костномозговых элементов в периферическую кровь.
На фоне острой кровопотери в организме нарушается капиллярное кровообращение, что вызывается уменьшением объема циркулирующей крови, спазмом периферических сосудов, повышением свертывающей способ- ности и динамической вязкости крови, внутрисосудистой агрегацией клеток крови. Уменьшение интенсивности капиллярного кровообращения приводит к гипоксии тканей, накоплению недоокисленных продуктов обмена веществ, интоксикации.
Диагноз острой постгеморрагической анемии в большинстве случаев несложен. Затруднения возникают при внезапном внутреннем кровотечении (например, разрыв маточной трубы при внематочной беременности).
Прогноз зависит от величины кровопотери и скорости кровотечения. Быстрая кровопотеря 25 % общего объема крови может привести к развитию шока, а потеря 50 % объема несовместима с жизнью. В то же время исход медленной кровопотери даже в пределах 75 % объема крови при современных методах лечения нередко благополучный. У здоровых лиц даже при значительной кровопотере состав крови восстанавливается в среднем через 4—5 недель.
Лечение при острой постгеморрагической анемии сводится к немедленному устранению причины кровотечения, борьбе с гипоксией и острой сосудистой недостаточностью. Трансфузии цельной крови восполняют дефицит эритроцитов, однако не улучшают процессов микроциркуляции, а переливание эритроцитной массы может иногда привести даже к их ухудшению.
Поскольку в развитии гипоксии нарушение капиллярного кровообращения играет большую роль, чем уменьшение количества эритроцитов, то восстановление массы последних без нормализации микроциркуляции не уменьшает кислородного голодания тканей. Поэтому терапия при остром кровотечении должна начинаться с переливания плазмозамещающих растворов реологического действия, обладающих способностью улучшать микродинамику (реополиглюкина, желатиноля, полиглюкина).
При кровопотере до 15 мл/кг массы тела рекомендуется ограничиться инфузией реополиглюкина или желатиноля в дозе 12—15 мл/кг в сочетании с солевыми растворами (изотоническим раствором натрия хлорида, раствором Рингера) в дозе 8— 10 мл/кг. Если кровопотеря достигает уровня 16—25 мл/кг, следует переливать плазмозамещаюшие растворы в сочетании с донорской кровью наименьших сроков хранения (до 5— 10 суток с момента ее заготовки) в соотношении 2:1. Доза солевых растворов увеличивается до 15 мл/кг. При кровопотере 25—35 мл/кг соотношение растворов и крови составляет 1:1, при более значительной кровопотере — 1:2.
Общая доза трансфузионных сред должна превышать кровопотерю в среднем на 20—30, а в некоторых случаях — на 50—75 % ·
Больным с исходной анемией (гемоглобин ниже 5—6,2 ммоль/л) донорскую кровь и плазмозамещающие растворы необходимо переливать даже при небольшой кровопотере (7— 10 мл/кг).
Различают многообразные клинические формы железодефицитной анемии, этиология которых различна, но патогенез единый — недостаток в организме железа.
Железо является жизненно необходимым элементом для организма, принимающим участие в транспорте кислорода, окислительно-восстановительных процессах, иммунных реакциях. Особенно велико его значение з гемопоэзе.
Патогенез. Суточная потребность в железе для нужд кроветворения обеспечивается процессами физиологического распада эритроцитов. Основная масса освобождающегося железа в виде гемосидерина поглощается системой мононуклеарных фагоцитов и в дальнейшем используется в кроветворении, только незначительная часть его (не более 10 %) выводится из организма. Недостающее количество железа вводится с пищей.
В желудке в условиях кислой среды происходит ионизация железа, превращение трехвалентного железа в двухвалентное (реакция восстановления), образование комплексных низкомолекулярных соединений его с компонентами пищи и желудочного сока. Соляная (хлористоводородная) кислота принимает участие в этих процессах, но не играет решающую роль. Комплексообразование способствует всасыванию железа в тонкой кишке, преимущественно в двенадцатиперстной и тошей, где оно, соединяясь с белком апоферритином, образует железопротеиновый комплекс ферритин. Последний всасывается в кровь, вступает в связь с β-глобулином и в виде белкового соединения трансферрина транспортируется к депо — костному мозгу и другим органам (селезенке, печени). Следовательно, недостаточное содержание в организме железа, столь необходимого для синтеза гемоглобина, может быть обусловлено рядом причин: недостаточным его усвоением (при ахилии, резекции тонкой кишки, желудка, хроническом энтероколите), повышенным расходованием железа (беременность, лактация, усиленный рост ребенка). Но основной причиной железодефицитной анемии у взрослых является хроническая кровопотеря (длительные обильные менструации, кровотечения при геморрое, грыже пищеводного отверстия диафрагмы, язве желудка или двенадцатиперегной кишки, опухолях и дивертикулах пищевого канала, а также носовые, почечные и др.).
Причины развития железодефицитной анемии у детей раннего возраста различны: недоношенность, раннее искусственное вскармливание, одностороннее питание, частые инфекции и т. д. В результате недостаточного поступления железа с пищей или перераспределения его в зоне инфекционно-воспалительного очага постепенно резервы железа в организме истощаются, что приводит к нарушению синтеза гемоглобина.
Часто дефицит железа имеет смешанный генез. Это особенно характерно для таких клинических вариантов железодефицитной анемии, как ранний и поздний хлороз.
Ранний хлороз наблюдается у девушек в период полового созревания. Этиология его изучена недостаточно. Дефицит железа, по-видимому, связан с повышенными потребностями организма в нем в этом периоде, а также с потерей железа при первых менструальных кровотечениях. Определенное значение имеет нарушение функции яичников, на фоне которого протекает хлороз. Не случайно одним из клинических проявлений раннего хлороза является нарушение менструального цикла.
Поздний хлороз появляется у женщин в возрасте 35—45 лет, иногда непосредственно перед климаксом. Патогенез позднего хлороза сложный, включающий сочетание ряда факторов: нарушений менструального цикла, значительных затрат железа в связи с повторными беременностями и лактацией, обильных менструальных кровопотерь (особенно в преклимактерическом периоде).
Клиника. Наряду с обычными признаками анемии (повышенной утомляемостью, сердцебиением, шумом в ушах, головокружением, постоянной сонливостью и т. д.) характерным симптомом железодефицитной анемии является извращение вкуса (pica chlorotica), выражающееся в наклонности к употреблению мела, глины, яичной скорлупы, зубного порошка, сырых круп (при наличии других жалоб диспепсического характера). Часто наблюдаются трофические изменения кожи и слизистых оболочек, связанные с недостатком ферментов, содержащих железо. На почве атрофии слизистой оболочки пищевода появляется дисфагия (сидеропеническая). Последняя иногда развивается при нормальном составе крови (предшествуя симптомам анемии) и, как правило, исчезает при назначении железа и восстановлении его уровня в плазме крови. У таких больных нередко наблюдаются атрофические изменения языка, хейлоз («заеды»), выпадение волос, ломкость и деформация ногтей; при позднем хлорозе — симптомы климактерического невроза: головная боль, внезапное ощущение жара, повышенная потливость, онемение пальцев рук.
При длительном дефиците железа могут наступить дистрофические изменения в сердечной мышце с соответствующей клинической симптоматикой, а также атрофия слизистой оболочки желудка и ахилия.
При исследовании крови выявляется гипохромная анемия (цветовой показатель 0,6—0,5 и ниже), микроанизоцитоз, пойкилоцитоз. Количество лейкоцитов и тромбоцитов обычно в пределах нормы, в тяжелых случаях может быть понижено. СОЭ незначительно увеличена. Для анемии, вызванной кровопотерей, характерен ретикулоцитоз.
При исследовании костного мозга отмечается увеличение количества эритробластов с преобладанием базофильных форм, а число сидеробластов (эритрокариоцитов, содержащих гранулы железа) уменьшено.
Уровень железа в сыворотке крови и процент насыщения трансферрина снижен, общая, и особенно латентная, железосвязывающая способность повышена. Содержание железа в депо уменьшено.
Для выявления запасов железа используют десфераловый тест: определяют содержание железа в суточном количестве мочи после введения 500 мг десферала (дефероксамина) (в норме 0,6—1,3 мг). При истощении запасов железа в депо его количество в моче значительно ниже нормы.
Течение железодефицитной анемии и ее прогноз зависят от характера основного заболевания, вызвавшего кровопотерю или нарушение всасывания железа. Прогноз при раннем хлорозе благоприятный. Поздний хлороз развивается медленно и протекает с периодическими обострениями, особенно в весенне-осенний период. Течение заболевания значительно ухудшается при поносе, усугубляющем нарушение всасывания железа, а также при различных интеркуррентных заболеваниях.
Диагноз основывается на наличии симптомов гипосидероза (извращение вкуса, обоняния, дисфагия, ломкость и деформация ногтей, выпадение волос и другие трофические расстройства), анемии гипохромного характера, снижении уровня железа в сыворотке крови.
Установление диагноза железодефицитной анемии требует срочного уточнения ее генеза (кровопотери, болезни органов пищеварительной системы, опухолевый процесс и т. д.).
Дифференциальный диагноз необходимо проводить с другими формами гипохромной анемии, в частности с талассемией. Последняя от железодефицитной анемии отличается признаками повышенного гемолиза, увеличением селезенки, изменениями скелета, наличием гипербилирубинемии (за счет непрямого билирубина), мишеневидных эритроцитов в крови и ретикулоцитоза. Содержание железа в сыворотке крови нормальное или повышенное.
Следует также иметь в виду, что железодефицитная анемия может быть обусловлена не только дефицитом железа в организме, но и недо статочным его использованием эритробластами костного мозга (нарушением синтеза гема) вследствие изменения функций ферментов, участвующих в данном процессе. При этом развивается сидероахрестическая анемия (от греч. ахрезия — неиспользование). В отличие от истинной железодефицитной анемии она харастеризуется сочетанием гипохромии с повышенным уровнем сывороточного железа, выраженной эритробластической реакцией костного мозга и рефрактерностью к препаратам железа. В пунктате костного мозга встречаются сидеробласты.
Лечение. Патогенетическими средствами лечения при железодефицитной анемии являются препараты железа: железа лактат (1 г 3—4 раза з день), конферон (по 1—2 капсулы 3 раза в день), ферроплекс (по 2 драже 3 раза в день). Последний препарат отличается от железа лактата лучшей усвояемостью и большей активностью, чему способствует наличие в нем аскорбиновой кислоты. Усвоение железа улучшают также препараты, содержащие микроэлементы (кобальт, медь и др.). К комплексным средствам относятся гемостимулин, в состав которого входят железа лактат, меди сульфат и сухая пищевая кровь (по 1 таблетке 3 раза в день), феррокаль (железа сульфат, кальция фруктозодифосфат, церебролецитин)—по 2—6 таблеток 3 раза в день, ферамид (комплексное соединение железа с никотинамидом) — по 0,1 г 3 раза в день и др.
Препараты железа принимают после еды (что способствует лучшей их переносимости) с небольшими дозами аскорбиновой кислоты (0,1—0,2 г). Последняя улучшает резорбцию железа, участвуя в комплексообразовании. Длительность курсового лечения составляет 1,5—2 месяца (в зависимости от тяжести анемии).
Прием железа внутрь противопоказан при язвенной болезни, острых воспалительных процессах в желудке и кишках. В таких случаях, а также при непереносимости препаратов железа, принимаемых внутрь, рекомендуются препараты для парентерального введения (фербитол, феррум Лек и др.).
Фербитол — комплекс трехвалентного железа с сорбитом. Вводится внутримышечно ежедневно по 2 мл, на курс 20—30 инъекций. Выраженных побочных реакций не вызывает.
Феррум Лек для внутримышечного введения представляет собой комплексное соединение трехвалентного железа с мальтозой. Вводится ежедневно по 2 мл. Феррум Лек для внутривенного введения — стандартизованный коллоидный раствор железа сахарата. Вводится ежедневно по 5 мл или через день по 10 мл медленно. Противопоказания — склонность к ангиоспастическим реакциям и заболевания печени.
При гипорегенераторном характере анемии препараты железа целесообразно сочетать со стимуляторами кроветворения — коамидом (1 мл 1 % раствора подкожно), пиридоксином (2 мл 5 % раствора внутримышечно). В некоторых случаях для лучшего усвоения железа рекомендуется назначать кортикостероиды (преднизолон— 15—20 мг в сутки).
Гемотрансфузионная терапия при обычном течении железодефицитной анемии не проводится. Она показана только при тяжелой степени анемии и гипоксии, необходимости срочного оперативного вмешательства, а также при рефрактерности больных к препаратам железа или непереносимости их. При этом назначают эритроцитную массу по 150—300 мл с промежутками в 4—5 дней (в зависимости от показаний).
При анемии назначают диету, богатую белками (до 120 г в день), витаминами и солями железа (зеленые овощи, фрукты, яйца, мясо, творог). Показано лечение на морских курортах (но не в жаркие месяцы года), пребывание в лесной местности, обогащенной озонированным воздухом (хвойный лес), в горах (снижение парциального давления кислорода в атмосферном воздухе является фактором, стимулирующем кроветворение). Длительное пребывание на солнце противопоказано. При железодефицитной анемии, учитывая рецидивирующий характер ее течения, рекомендуют профилактические курсы железотерапии в течение 1 — 1,5 месяца в весенний и осенний периоды.
Хроническая постгеморрагическая анемия развивается чаще всего в результате повторной кровопотери. Наибольшее практическое значение имеют желудочно-кишечные, геморроидальные и маточные кровотечения, а также кровотечения, связанные с анкилостомидозом, распространенным в южных районах страны. В развитии хронической постгеморрагической анемии имеет значение даже незначительная скрытая кровопотеря, которая с течением времени приводит к истощению в организме запасов железа, особенно при способствующих этому условиях (ахилия, понос, хронический гепатит и др.).
Клиника. Жалобы на общую слабость, головокружение, одышку, шум в ушах. Отмечается резкая бледность кожи и видимых слизистых оболочек, одутловатость лица, пастозность голеней. Аускультативно — систолический шум над верхушкой сердца, над легочным стволом и «шум волчка» над яремными венами. Однако при легкой степени малокровия клинических проявлений (в основном, связанных с гипоксией) часто не бывает, так как в действие вступают защитно-приспособительные механизмы, обеспечивающие потребность тканей в кислороде.
Картина крови характеризуется анемией с низким цветовым показателем (0,5—0,7), микроанизоцитозом, пойкилоцитозом и часто ретикулоиитозом. Наблюдается умеренная лейкопения с относительным лимфоцитозом. Количество тромбоцитов нормальное или несколько пониженное. В пунктате костного мозга на фоне гиперплазии эритроидного ростка отмечается замедление созревания эритробластов с преобладанием среди них базофильных и полихром атофильных форм. При длительной кровопотере, продолжающейся годами, возможно постепенное угнетение эритроцитопоэза, что выражается в уменьшении количества ретикулоцитов в периферической крови и эритробластов в пунктате костного мозга, т. е. с течением времени хроническая постгеморрагическая анемия приобретает гипорегенераторный характер.
Диагноз хронической постгеморрагической анемии не вызывает сомнений при наличии заболевания, сопровождающегося повторными кровотечениями. Затруднения возникают в тех случаях, когда источник кровотечения не распознан. Это особенно касается злокачественных новообразований пищевого канала.
Дифференциальный диагноз с различными видами железодефицитной анемии проводится с учетом наличия скрытых очагов кровопотери, а также на основании подробной характеристики картины крови.
Лечение при хронической постгеморрагической анемии прежде всего сводится к устранению источника кровотечения. Показаны препараты железа, а также при необходимости переливание эритроцитной массы, как при железодефицитной анемии.
1. Внутренние болезни / Под. ред. проф. Г. И. Бурчинского. ― 4-е изд., перераб. и доп. ― К.: Вища шк. Головное изд-во, 2000. ― 656 с.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
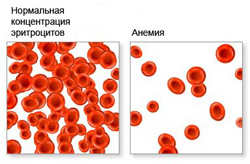
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
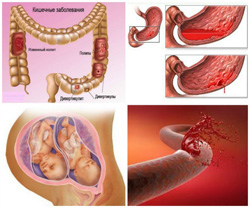
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
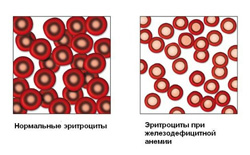
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
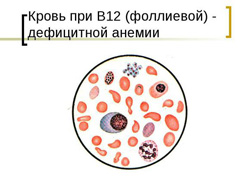
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
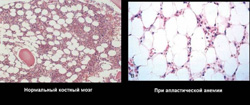
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник