Мегалобластическая анемия за счет заниженного подвоза с пищей витамина В12 и его завышенного расхода:
а) Мегалобластическая анемия за счет недостаточного подвоза с пищей витамина В12 наблюдается лишь у лиц, строго соблюдающих вегетарианский режим (отдельные религиозные секты и пр.). В принципе развивающаяся в таких случаях анемия легкой формы но, обычно, сопровождается невропатией, при том часто отмечается наличие сидеропении.
б) Повышенный расход витамина В12 наблюдается при беременности, гемолитической анемии, гипертиреозе, возможно неопластпческих заболеваниях. Тем не менее весьма редко достигается истощение запаса В12 и мегалобластическая анемия, развивающаяся в подобных условиях, в большинстве случаев связана с фолиевым дефицитом.
Мегалобластическая анемия за счет нарушения расхода витамина В12:
а) При циррозе печени часто встречается анемия, патогенетические механизмы которой бывают весьма разнообразны и взаимозависимы (разжижение крови, кровоточивость, гиперсеквестрация в селезенке, костномозговое угнетение, неполноценность поглощения и расхода факторов кроветворения и пр.).
Причина часто выявляемого макроцитоза не выяснена, при этом мегалобластическое преобразование костного мозга отмечается чрезвычайно редко. Хотя большинство случаев мегалобластической анемии при циррозе относится за счет фолиевого недостатка, имеется также значительное сокращение включения печенью вводимого внутрь 60СоВ12 (которое не исправляется применением внутреннего фактора Касла).
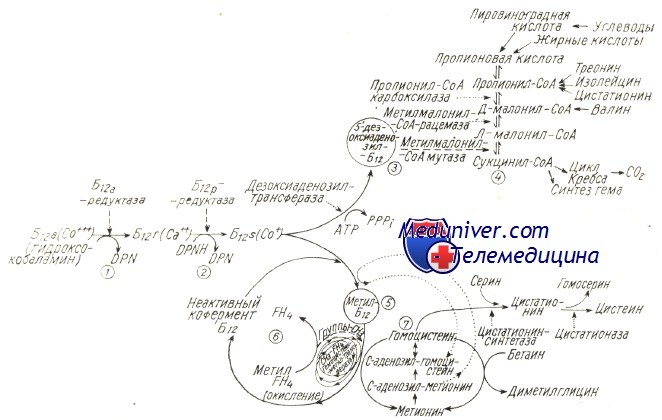
Приводятся два последовательных восстановительных процесса гидроксокобаламина (1), (2), образование 5′-дезоксиаденозил-В12 (3) и его участие в метаболизме пропионовой кислоты (4); образование метип-В12 (5), его «каталитическая» функция в переносе группы — СН3 от метил-FH4 к гомоцистеину (пусковая роль s-аденозилметионина в реакции и «регенерации’» кофермента), также взаимосвязь с метаболизмом фолатов (6) и серных аминокислот (7).
б) Нарушение расхода витамина В12 угнетением отдельных ферментов можно предположить (между прочим) с учетом роли инфекции в возвратном течении бирмеровской болезни.
в) К специальной категории нарушения расхода относятся врожденные недостатки ферментов, влияющие на реакции, в которых участвуют коферменты В12. Теоретически блокирование может произойти:
1) при прохождении витамина через клеточную оболочку;
2) во время реакции восстановления предшественника в форму Со+ и его преобразование в коферменты 5′-дезоксиаденозил- и метил-В12; 3) в ферментах (с коферментом В12), участвующих в метаболизме пропионовой кислоты или аминокислот с содержанием серы (Mahoney). Симптоматология находится в зависимости от уровня (и степени) блокирования; сообщенные случаи весьма немногочисленны.
При дефиците метилмалонил-СоА-мутазы обнаруживаются тяжелый метаболический ацидоз и выделение с мочой значительного количества АММ, отсутствие мегалобластических изменений; в отдельных случаях больные реагируют на крупные дозы В12. При дефиците метилтрансферазы отмечены повышенное выделение гомоцистеина + цистатионина, низкий показатель метионина и наличие мегалобластической анемии с повышенным количеством фолиевокислой соли в крови (в связи с метаболическим блокированием) (Arakawa).
Подобные признаки наблюдаются и при недостатке иных ферментов (независимых от В12), находящихся в обоих метаболических путях.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
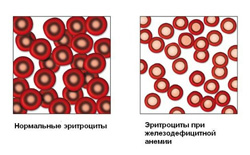
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
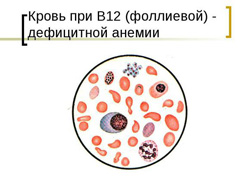
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
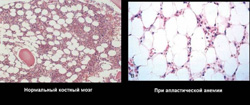
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник
А.В. Новик
ФГУ НИИ онкологии им. Н.Н.Петрова, г.Санкт-Петербург
К синдромам эндогенной интоксикации у онкологических больных относятся анемия, синдром анорексии — кахексии, синдром распада опухоли, гиперурикемия, гемолитико-уремический синдром, гиперкальциемия, гипонатриемия, лактацидоз, синдром повышенной вязкости крови и паранеопластические синдромы
В онкологической практике встречается несколько синдромов, патогенез которых тесно связан с развитием эндогенной интоксикации. К ним относятся анемия, синдром анорексии — кахексии, синдром распада опухоли, гиперурикемия, гемолитико-уремический синдром, гиперкальциемия, гипонатриемия, лактацидоз, синдром повышенной вязкости крови и паранеопластические синдромы. Все указанные состояния являются следствием одного заболевания — злокачественного опухолевого процесса. Соответственно, каждое из них может быть успешно контролируемо при использовании эффективного противоопухолевого лечения. Для указанных синдромов это лечение будет этиотропным. Однако, как известно, выраженный эффект терапии не только является пока достаточно редким явлением, но и сам по себе способен усугубить течение некоторых из них, таких как синдром распада опухоли. Поэтому патогенетическая терапия данных заболеваний является абсолютно необходимой.
В предыдущих лекциях в рамках Российской школы онкологов уже достаточно подробно разбирались некоторые из указанных синдромов [7, 9, 10]. В этой лекции мы остановимся на синдроме анемии и гипонатриемии.
Синдром анемии
Под анемией понимают снижение уровня гемоглобина ниже 120 г/л [13]. Такое состояние встречается у половины онкологических больных, особенно при распространенном процессе [14]. Злокачественные опухоли легкого и гинекологические раки чаще всего сопровождаются анемией (71 и 63% соответственно).
На основание преобладающего механизма развития синдрома возможно выделение следующих групп анемий [12]: железодефицитные, сидероахрестические (железонасыщенные), железоперераспределительные, В12-дефицитные и фолиеводефицитные, гемолитические, анемии при костно-мозговой недостаточности, анемии при уменьшении объема циркулирующей крови и анемии со смешанным механизмом развития.
Потенциальные механизмы развития анемии у онкологического больного [6] включают в себя значительное увеличение потерь эритроцитов вследствие острой или хронической кровопотери. Абсорбция на мембране различных веществ (продукты метаболизма, цитостатики, опухолевые антигены), играющих в данном случае роль токсинов, приводит к снижению устойчивости мембраны эритроцитов и более быстрой утилизации. Это, в свою очередь, значительно увеличивает потребность в их образовании. Процесс эритропоэза также подвергается значительным изменениям у онкологического больного. Это прежде всего касается синтеза эритропоэтина и снижению реакции на него гемопоэтических клеток, а также нарушения высвобождения железа из ретикулоэндотелиальной системы и перераспределение его в иммунокомпетентные клетки. По данным В.Н. Блиндарь с соавторами [1], железодефицитная анемия наблюдалась у 48%, а дефицит продукции эритропоэтинов — у 71% онкологических больных. Таким нарушениям во многом способствуют провоспалительные цитокины, такие как фактор некроза опухолей, интерфероны и интерлейкин-1. Исследования показали, что, например, фактор некроза опухолей способен не только сокращать срок жизни эритроцитов, но и опосредованно влиять на продукцию эритропоэтинов и метаболизм железа и витаминов. Немаловажным аспектом воздействия злокачественного процесса на костный мозг является его метастатическое поражение или опухоль-индуцированный фиброз и некроз. Это ведет к вытеснению костномозговых предшественников и к развитию апластической анемии. Нарушение поступления питательных веществ, обусловленные синдромом анорексии — кахексии, также вносят вклад в развитие описываемого патологического процесса. Кроме этого, важную роль играют нежелательные явления, связанные с проведением химиотерапии, которые способствуют повреждению эритроидных предшественников и снижению их реакции на эритропоэтины. Использование цитостатических агентов в терапии злокачественных опухолей может не только приводить к угнетению гемопоэза, но и вызывать гемолитические анемии (например, аналоги нуклеотидов) [22].
Последствия развития анемии для организма заключаются в развитии гемической гипоксии органов и тканей. Описание механизмов её развития и цепи патологических процессов, с ними связанных, выходит за рамки данного обзора. Хотелось бы, однако, кратко отметить роль гипоксии в развитии опухоли. Снижение содержания кислорода менее 1% стимулирует выработку факторов транскирипции, таких как HIF1-α, NFk-b и АР-1[29]. Индуцируемые ими изменения активности генома приводят к адаптации клеток к этому состоянию, стимулируют ангиогенез, блокируют апоптоз и тем самым способствуют стимуляции опухолевого роста, инвазии и метастазированию. Ещё более низкие концентрации кислорода способны оказывать мутагенное действие, усиливать нестабильность генома и, соответственно, вариабельность опухолевых клеток, что является основой для дальнейшей клональной селекции наиболее устойчивых линий. Низкое содержание кислорода в клетке является фактором химио- и радиорезистентности опухоли. Гипоксическое состояние способствует развитию агрессивного фенотипа и является универсальным фактором неблагоприятного прогноза. Таким образом, анемия является независимым прогностическим фактором для целого ряда опухолей, что было подтверждено соответствующими исследованиями [17]. В связи с этим, лечение анемии должно приводить к повышению оксигенации опухоли и таким образом повышать эффект противоопухолевой терапии.
Клиническая картина
Клиническая картина анемии складывается из нескольких синдромов. У всех больных отмечаются проявления гипоксии: нарастающая слабость, быстрая утомляемость, шум в ушах, потемнение перед глазами при изменении положения тела, головные боли, головокружение, обморочные состояния и сердцебиение при незначительных физических нагрузках, психические явления, бледность кожи и слизистых оболочек, одутловатость лица, трофические нарушения, выпадение волос, усиленное разрушение зубов, сухость кожи, сглаженность сосочков языка; в отдельных случаях — затруднения при глотании (симптом Россолимо — Бехтерева) сухой и твердой пищи; малиновая окраска языка, атрофические изменения слизистой оболочки глотки и пищевода, спастическое сужение верхней части пищевода, ломкость, образование продольной или поперечной исчерченности ногтей, койлонихия. При дефиците железа к указанной выше картине присоединяются симптомы тканевого дефицита данного элемента: извращение вкуса — pica clorotica, свидетельствующее о нарушении периферической вкусовой чувствительности. Нередко больные жалуются на мышечную слабость, отмечают ложные позывы на мочеиспускание, неспособность удержать мочу (у детей бывает ночное недержание). Гипоксия и тканевый дефицит железа приводит к расстройствам сердечно-сосудистой и нервной системы, желудочно-кишечного тракта, печени. Для дефицита витамина B12 характерны желтоватый цвет кожных покровов, диффузная пятнистая коричневая пигментация, анорексия, при выраженном дефиците возможно повышение температуры тела. У половины больных отмечаются явления глоссита — «лакированный язык» — язык лишается сосочков, становится гладким, блестящим. Иногда поражаются слизистые оболочки щек. Возможно развитие диареи. Характерно развитие фуникулярного миелоза -поражения проводящих путей задних канатиков спинного мозга. Возможно также развитие церебральных нарушений, симптомов полинейропатии.
Диагностика анемий
Диагностический алгоритм для гипохромных анемий представлен на рис.1 (по Л.И. Дворецкому, с изменениями) [4].
При выявлении гиперхромных анемий следует прежде всего думать о В12-фолиеводефицитной анемии. Их диагностическими критериями являются высокий цветовой показатель, макроцитоз, мегалоцитоз, эритроциты с остатками ядер (тельца Жолли, кольца Кэбота), ретикулоцитопения, гиперсегментация нейтрофилов, лейкопения (нейтропения), тромбоцитопения, повышение содержания железа в сыворотке, мегалобластическое кроветворение в костном мозге, пониженный уровень данных витаминов в крови. Возможны неврологические нарушения и психические расстройства.
Нормохромные анемии — наиболее частые у онкологических больных — представлены двумя основными типами: гемолитической анемией и анемией при костномозговой недостаточности. Первая характеризуется прежде всего признаками гемолиза: повышением содержания непрямого билирубина в сыворотке с наличием желтухи или без таковой, повышением содержания железа в сыворотке, наличием в моче гемосидерина и свободного гемоглобина в плазме (при некоторых формах с внутрисосудистым гемолизом). Также отмечаются ретикулоцитоз, наличие в крови ядросодержащих эритроидных клеток (эритрокариоцитов), увеличение числа эритрокариоцитов в костном мозге (свыше 23%), увеличение селезенки (при некоторых формах). Анемии при костномозговой недостаточности характеризуются нормохромией (реже гиперхромией), ретикулоцитопенией, депрессией других ростков кроветворения (лейкоцитарного, мегакариоцитарного) с соответствующими клиническими проявлениями (инфекции, кровотечения, поражения слизистых) и характерными изменениями состояния костного мозга. Последние могут быть представлены дисплазией или умеренным увеличением бластов (миелодиспластический синдром), фиброзом, замещением жировой тканью, элементами опухоли при метастатическом поражении или при поражении лейкозом.
| Рис. 1. Алгоритм диагностики гипохромных анемий. ЦП – цветовой показатель; ЖС – железо сыворотки; ЖСС – железосвязывающая способность сыворотки, YUY – нижняя граница нормы, ВГН – верхняя граница нормы, МСН – среднее содержание гемоглобина в эритроците, МСНС – средняя концентрация гемоглобина в эритроците. |
 |
Лечение анемий
Основой лечения любой анемии, связанной с опухолевым процессом, является лечение самой опухоли. При значительном снижении гемоглобина (менее 80 г/л) пациентам показано проведение гемотрансфузий. Последние позволяют быстро поднять уровень гемоглобина, однако обладают кратковременным эффектом. Переливание эритроцитарной массы сопровождается риском развития целого ряда нежелательных явлений [11]. Выделяют следующие посттрансфузионные реакции и осложнения: острые иммунные (гемолитические, фебрильные негемолитические, аллергические и гемотрансфузионное острое поражение легких); острые неиммунные (бактериальные и вирусные инфекции, циркуляторная перегрузка, физический и/или химический гемолиз, эмболия, цитратная интоксикация, гиперкальциемия); отсроченные иммунные (гемолитические, болезнь «трансплантат против хозяина», посттрансфузионная пурпура) и неимунные (гемосидероз). Уже сам список возможных нежелательных явлений свидетельствует о необходимости ограничения гемотрансфузий и использования их лишь в крайней необходимости. Кроме того, исследования E.C.Vamvakas и H.F. Taswell, в которых изучалось влияние переливания крови на продолжительность жизни больных, выявили увеличение риска смерти в течение 10 лет на 4,1% после переливания 1 дозы эритроцитарной массы [28]. Альтернативные средства лечения анемий зависят от их патогенетического типа. Для анемий, связанных с дефицитом витаминов или железа патогенетической терапией является восполнение такого дефицита. Для В12-дефицитной анемии достаточной терапией в нетяжелых случаях является введение препаратов этого витамина в дозе 100-200 мкг ежедневно в течение 1 недели с последующим переходом на введение через день до достижения полной гематологической ремиссии (нормализация кроветворения и купирование анемии). В тяжелых случаях (снижение эритроцитов менее 1*10 12 /л, неврологическая симптоматика) используется от 300 до 1000 мкг цианкобаламина в течение 2 недель с дальнейшим переходом на поддерживающий режим до достижения стойкой ремиссии. При дефиците фолиевой кислоты последнюю назначают по 3 мг ежедневно на 1 мес.
При развитии железодефицитной анемии необходимо применение препаратов железа. Коррекция диеты с учетом повышенного содержания в продуктах железа необходима, но недостаточна для лечения развившейся анемии. Для коррекции данного синдрома достаточно поступления в организм от 30 до 100 мг двухвалентного железа в сутки [2]. На сегодняшний день существует масса препаратов железа. По их составу выделяют препараты солей железа (сульфат, глюконатом, хлорид, фумарат, глицин сульфат), которые содержат двухвалентное железо, и комплексные соединения (полимальтозные и белково-сукцинатные комплексы), содержащие трехвалентное железо. Некоторые из этих препаратов выпускаются в сочетании с витаминами (С, В12, фолиевой кислотой), что усиливает всасывание из ЖКТ. В целом, при пероральном приеме, с учетом усиления всасывания железа в кишечнике при его дефиците, лишь 23-30% препарата попадает в системный кровоток. На всасывание солей железа влияют пищевые продукты и некоторые препараты. Так, фитины (рис, соя), фосфаты (рыба, морепродукты), танин (чай, кофе) способны значительно уменьшить биодоступность указанных препаратов и соответственно эффективность лечения. Применение тетрациклина, альмагеля, солей магния одновременно с препаратами железа способно уменьшить всасывание последнего. Все это необходимо учитывать при назначении лечения и разделять прием солей железа с продуктами, способными повлиять на всасывание. Препараты комплексных соединений железа таких недостатков лишены. Суточная доза препаратов железа при приеме через рот должна составлять 100-300 мг. Парентеральное введение (возможно только для комплексных препаратов) не обладает преимуществами по эффективности или скорости достижения эффекта по сравнению с энтеральным приемом [2]. В связи с этим показания к применению парентеральных препаратов ограничиваются ситуациями нарушения всасывания в кишечнике или невозможностью приема пищи и непереносимостью различных энтеральных форм [2]. Длительность лечения препаратами железа должна составлять не менее 1-1,3 мес. для восстановления тканевых запасов этого микроэлемента. Из побочных эффектов терапии стоит отметить тошноту, анорексию, металлический привкус во рту, запоры, реже — поносы [4].
При развитии сидероахрестической или железоперераспределительной анемии применение препаратов железа противопоказано. Кроме лечения основного патологического процесса, в случаях перегрузки железом рекомендуется назначение дефероксамина — препарата, образующего стабильный комплекс с трёхвалентным железом.
Для гемолитических анемий, с учетом иммунного механизма их развития, показано применение глюкокортикоидов. При неэффективности такого подхода используют иммунодепрессанты или спленэктомию. Для лечения данного состояния также используют антигормоны (даназол), моноклональные антитела к лимфоцитам (ритуксимаб, алемптузумаб), иммуноглобулины [22]. Описано также применение методов эфферентной терапии [3].
Более подробно хотелось бы остановиться на лечении анемий, связанных с костномозговой недостаточностью. Для лечения этого типа анемий были созданы рекомбинантные эритропоэтины — аналоги человеческого цитокина, обеспечивающего созревание клеток эритроидного ряда от этапа бурст-образующей единицы до эритроцита [6]. Применение названных препаратов, как показали многочисленные исследования, приводит к достоверному повышению качества жизни больных [14] и уменьшает вероятность гемотрансфузий (относительный риск 0,64, 93%ДИ 0,36-0,73) [27]. Вместе с тем, за последнее десятилетие применение эритропоэтинов сопровождается значительными побочными эффектами. Большой метаанализ, проведенный группой канадских ученых и опубликованный в 2009 г. [27] обобщил результаты 32 исследований, включавших в себя 12 006 больных. Наряду с очевидным эффектом терапии эритропоэтинами на качество жизни и частоту гемотрансфузий, о чем говорилось выше, были подтверждены риски нежелательных явлений и смерти больных от прогрессирования опухолей. Относительный риск развития тромбоэмболий во время лечения эритропоэтинами (как альфа, так и бета) по сравнению с контролем (без лечения или гемотрансфузии), составил в данном исследовании 1,69 (93% ДИ 1,27-2,24). Увеличен был также и общий риск серьезных нежелательных явлений — 1,16 (93% ДИ 1,08-1,23). Еще в 2003 году M.Henke с соавторами впервые продемонстрировали снижение выживаемости больных плоскоклеточными раком головы и шеи при использовании эритропоэтинов в сочетании с лучевой терапией [21]. Различные исследования, впоследствии проводимые как по показаниям (анемия у больных, получающих химиотерапию), так и вне их, показали сходные результаты. По данным уже упоминавшегося выше метаанализа, применение эритропоэтинов повышает риск смерти до 1,13 (93% ДИ 1,03-1,29) [27]. Исследования, проводимые вне показаний, характеризовались ещё более выраженным повышением риска смерти [20]. Выдвигаются как минимум 2 причины, объясняющие такой, казалось бы, парадоксальный эффект. Теоретически можно предположить, что, поскольку анемия вызывает гипоксию, а последняя в свою очередь способствует повышенной химио- и радиорезистентности опухолей, то повышение уровня гемоглобина должно увеличивать оксигенацию и, соответственно, чувствительность опухоли к лечению. На практике, однако, оказалось, что при повышении уровня гемоглобина более 120 г/л оксигенация опухолевой ткани падает [29]. Этим можно отчасти объяснить причину значительно большего риска прогрессирования заболевания и смерти в исследованиях, проведенных вне показаний. Ведь в этих исследованиях целевой уровень гемоглобина составлял 140 г/л или производились попытки профилактического их назначения. С другой стороны, в ряде исследований была продемонстрирована экспрессия рецепторов эритропоэтинов на опухолевых клетках. В исследовании M. Hank с соавторами, о котором уже говорилось выше, выживаемость больных, чьи опухоли экспрессировали рецепторы к эритропоэтину, была значительно ниже при использовании эритропоэтинов, тогда как применение этих препаратов при отсутствии указанных рецепторов на опухолевых клетках приводило к статистически значимому повышению выживаемости больных (рис.2).
Вместе с тем, проведенные доклинические исследования и изучение роли рецепторов эритропоэтинов на цитоплазматический характер. При культивировании 23 клеточных линий, экспрессирующих на поверхности рецепторы эритропоэтина, стимуляции опухолевого роста выявлено не было. В 23 исследованиях на животных было выявлено 3 вида воздействия эритропоэтинов: 1) торможение опухолевого роста, 2) усиление воздействия стандартной терапии и 3) отсутствие влияния на стандартную терапию. Стимуляции опухолевого роста не было выявлено ни в одном исследовании [19]. Интересно отметить, что при окраске тканей мышей, нокаутных по рецепторам эритропоэтина коммерчески доступными антителами было выявлено позитивное окрашивание. Изучение этого феномена выявило перекрестную реакцию у этих антител с белком теплового шока 70.
| Рис. 2. Выживаемость больных, получавших терапию рекомбинантным эритропоэтином, в зависимости от экспрессии рецепторов эритропоэтина [19]. |
 |
Таким образом, роль рецепторов эритропоэтинов на негемопоэтических клетках, в том числе на опухолевых, требует дальнейшего выяснения. Тем не менее, клинические данные свидетельствуют о наличии отдельных групп больных, использование эритропоэтинов у которых может существенно ухудшить результаты лечения. В связи с этим, согласно рекомендациям ESMO [26], эритропоэтины могут применяться только у больных с анемией, являющейся осложнением химиотерапии. Начало терапии возможно при гемоглобине ниже 100 г/л (анемия >1 ст.) или при анемии 1 ст., сопровождающейся выраженной клинической симптоматикой. Алгоритм назначения препаратов в соответствии с данными рекомендациями представлен в табл. 1. Необходимо отметить, что у пациентов с потенциально излечимыми опухолями употребления эритропоэтинов следует избегать.
Гипонатриемия
Под гипонатриемией понимают снижение уровня натрия в крови ниже 133 ммоль/л. Это состояние встречается у 3,7-3% онкологических больных и иногда предшествует выявлению опухолевого процесса [23]. Снижение уровня натрия в крови ниже 130 ммоль/л является неотложным состоянием, а уровень ниже 123 ммоль/л опасен для жизни. В нескольких исследованиях этот синдром связывался с повышенной летальностью, при этом частота таких исходов достигала 70% [16]. В связи с этим выявление данного состояния требует выявления его причины и незамедлительного начала коррекции.
Классификация гипонатриемий и основные причины их развития приведены в табл. 2 [13, 23]. Наиболее частой причиной развития синдрома неадекватной продукции антидиуретичекгого гормона (СНПАДГ) — 1а группы нарушений — являются опухоли гипофиза, гипопитуитаризм, хирургическое лечение краниофарингиом, хирургические вмешательства с трансфеноидальным доступом. Из лекарственных средств поражение супраоптических и паравентрикулярных ядер с последующим развитием гипонатриемии описано для циклофосфана и винкоалкалоидов.
Таблица 1. Рекомендации по проведению терапии эритропоэтинами Европейского общества клинической онкологии
| Препарат | Эпоэтин α | Эпоэтин ß | Дарбэпоэтин α |
| Начало терапии | 130 МЕ/кг TIW или 430 МЕ/кг QW | 30 000 МЕ QW | 2,23 мкг/кг QW или 300 мкг (6,73 мкг/кг) Q3W |
| Повышение дозы (увеличение гемоглобина менее 10 г/л за 4 недели) | 300 МЕ/кг TIW | 60000 МЕ QW | Не рекомендуется |
| Снижение дозы* | 23-30% | 23-30% | 23-30% |
| Приостановка терапии | При уровне гемоглобина >130 г/л до достижения уровня 120 г/л | ||
* Снижение дозы производится 1) при достижении результата терапии, 2) при подъеме гемоглобина выше 120 г/л, 3) при повышении уровня гемоглобина более 20 г/л за 4 недели. TIW — 2 раза в неделю; QW — еженедельно, Q3W — 1 раз в 3 недели.
Таблица 2. Классификация гипонатриемий и основные причины их развития
| Группа | Механизм развития | Причины |
| 1 | Нормальный баланс натрия | |
| 1а | Избыток АДГ | Избыток АДГ Паранеопластические синдромы Цитостатики (винка алкалоиды, циклофосфамид, ифосфамид и др. алкилирующие агенты) Недостаточность глюкокортикоидов Гипотиреоз |
| 1б | Избыток потребления воды (псевдогипонатриемия) | Опухолевые белки Иммуноглобулины Парапротеины Избыточное введение гипотонических растворов |
| 2 | Нарушение баланса натрия | |
| 2а | Реабсорбция натрия в почках | Снижение ОЦК Нарушения со стороны ЖКТ: Сниженное потребление жидкости Тошнота, рвота Перераспределение жидкости в третьи пространств (асцит, плеврит) Уменьшение эффективного ОЦК Сердечная недостаточность Цирроз печени |
| 2б | Выведение натрия почками | Недостаточность надпочечников Избыток предсердного или мозгового натрийуретического пептида Противоопухолевые препараты (производные платины) |
Кроме того, эту группу нарушений вызывает эктопическая продукция АДГ и аргинин-вазопрессина, наблюдающаяся как компонент паранеопластического синдрома при плоскоклеточных раках головы и шеи, нейроэндокринных опухолях, мезотелиомах, опухолях мочеточников, мочевого пузыря, предстательной железы, эндометрия, цистаденокарциномах, саркоме Юинга [18].
Наиболее частой причиной 1б группы изменений являются избыточное поступление свободной воды в организм, что вызывает псевдогипонатриемию. Типичным для таких состояний является нормальная осмолярность плазмы при сниженной концентрации натрия и расхождение более чем на 10 мосмоль/л между расчетной и фактической осмолярностью плазмы. Источником свободной воды может быть полидипсия, вызываемая лекарственными средствами (например, производными фенотиазина — нейролептиками, используемыми как компонент антиэметической терапии). К таким ситуациям могут приводить использование глюкокортикоидов, парапротеинемии и прием алкоголя (как белки, так и липиды являются осмотически активными субстанциями). Другой причиной может быть использование гипотонических растворов для ирригации полостей, например, при трансуретральной резекции предстательной железы или трансцервикальной абляции эндометрия. Необходимо отметить, что внутривенное введение 1 литра 3% глюкозы приводит к снижению осмолярности плазмы на 2,3%, повышению объема плазмы на 83 мл, увеличению содержания внутриклеточной жидкости на 667 мл и внеклеточной на 333 мл. Введение же 0,9% раствора хлорида натрия в том же объеме не влияет на содержание внутриклеточной жидкости и осмолярность, но увеличивает объем плазмы на 230 мл [24].
Нарушения баланса натрия, объединенные в группу 2а, связаны, прежде всего, с уменьшением общего или эффективного объема циркулирующей крови (ОЦК). Назначение нефротоксичных препаратов, таких как производные платины, рвота и диарея, при назначении высокоэметогенных препаратов может осложняться развитием гипонатриемии. Существуют отдельные сообщения о роли цитокинов (ИЛ-2) и моноклональных антител в возникновении гипонатриемии, хотя механизм развития синдрома в таких случаях недостаточно понятен [13]. Другой причиной развития может быть соль-теряющий синдром (Cerebral salt wasting syndrome — CSW). Механизмы развития последнего связаны с поражением головного мозга опухолевым процессом или травмой при операции, приводящим к повышению уровня натрийуретических пептидов, нарушению нервной регуляции почек и надпочечниковой недостаточности [8, 23].
Уменьшение эффективного ОЦК как причина гипонатриемии редко встречается у онкологических больных. Чаще всего, к таким последствиям приводят сердечная недостаточность от использования антрациклинов или развитие нефротического синдрома. Патогенетические механизмы связаны с парадоксальным сокращением ОЦК на фоне гипергидрата и организма, что проявляется отеками, повышенной жаждой, повышенной продукцией АДГ и сниженной клубочковой фильтрацией [23].
К состояниям, для которых характерно развитие гипонатриемии по механизмам, отнесенным к группе 2б, относятся надпочечниковая недостаточность и паранеопластическая продукция натрийуретических пептидов. Первая может быть заподозрена при развитии у больного с метастатическим поражением надпочечников, необъяснимой другими причинами тошноты, рвоты, особенно, если последние сочетаются с гипонатриемией и гиперкалиемией. Второе состояние обусловлено эктопической продукцией натрийуретического пептида. Клинически оно напоминает СНПАДГ, однако при нем уровень натрия в ответ на ограничение потребления жидкости понижается (в отличие от СНПАДГ), а в крови обнаруживают необычно низкие уровни кортизола (d»230 нмоль/ л), а в моче — повышенную концентрацию натрия. Одновременно могут проявляться признаки полиорганной недостаточности, неконтролируемой артериальной гипотензии, рефрактерной к применению симпатомиметиков и инфузионной терапии, признаки системной воспалительной реакции [8].
| Рис.3. Алгоритм диагностического поиска при гипонатриемии. ОВЖ – объем внеклеточной жидкости, СНПАДГ – синдром неадекватной продукции антидиуретического гормона, ОЦК – объем циркулирующей крови. |
 |
Диагностика гипонатриемии
Натрий играет важную роль в поддержании осмолярности плазмы крови. В связи с этим на концентрацию натрия влияют 2 основных фактора: распределение жидкости между компартментами (внеклеточным и внутриклеточным) и баланс воды в организме, с одной стороны, и выведение натрия и воды почками, с другой. Сбор анамнеза и определение проводимой лекарственной терапии для выявления потенциальных причин этого нарушения, оценка функции надпочечников, щитовидной железы и сердечно-сосудистой системы чрезвычайно важны для понимания причин гипонатриемии. Из лабораторных показателей особую важность представляют осмолярность (ОсмП) плазмы крови и мочи (ОсмМ) клиренс свободной воды (КСВ). Первые два показателя могут быть определены фактически с помощью приборов осмомометров или рассчитаны по формуле [5]
ОСмП, мосмоль/кг = глюкоза/18 + мочевина/2,8 + 1,86Na
ОсмМ, мосмоль/кг =33,3 х две последние цифры плотности мочи.
Диагностический алгоритм при гипонатриемии включает в себя несколько шагов.
1. Определение острой (до 48 часов) и хронической гипонатриемии. При первой состояние развивается остро, чаще связано с хирургическими манипуляциями. В связи с быстротой развития органы и системы (прежде всего, головной мозг) не успевают достаточно адаптироваться к низкому уровню натрия, что приводит к проявлению клинической симптоматики. Последняя проявляется анорексией, тошнотой, рвотой, запорами, мышечной слабостью, миалгиями, судорогами. Возможно развитие нарушений сознания вплоть до комы, дыхательных нарушений и, вследствие этого, смерти больного [23]. Острая гипонатриемия является неотложным состоянием и требует быстрой коррекции. Хроническая гипонатриемия гораздо реже сопровождается развитием клинической симптоматики. Постепенное нарастание процесса позволяет компенсаторным механизмам приспособиться к пониженному уровню натрия. Такое состояние требует длительной и медленной коррекции, в противном случае возможна быстрая дестабилизация основных жизненных функций.
2. Исключение возможных причин гипонатриемии. Этот этап требует анализа сопутствующей терапии. Важным является определение уровня глюкозы как первичной причины гипонатриемии, поскольку повышение глюкозы на 3 ммоль/л приводит к уменьшению концентрации натрия на 1,6 ммоль/л. Также необходима оценка функции надпочечников, щитовидной железы.
Для выявления патогенетического механизма гипонатриемии предложен следующий алгоритм [23] — рис. 3.
Терапия гипонатриемии включает в себя, помимо попытки устранения её причины, инфузионную терапию с использованием нормотонических и гипертонических растворов, применение диуретиков. Наиболее эффективным считается использование комбинированного подхода, учитывающего скорость развития симптомов и патогенетический вариант процесса [23]. При острой гипонатриймии терапию начинают с введения гипертонического раствора хлорида натрия в/в в течение 13 мин. в дозе 4 мл/кг в сочетании с лазиксом 1 мл/кг [8].
Темп коррекции — не более 24 ммоль/сут. Лечение может быть продолжено до купирования симптомов или достижения концентрации 133 ммоль/л [23]. Для определения темпа коррекции возможно использование следующих расчетов
Темп инфузии, мл/час = (0ЦК-с)*300/(Nа]*с
где ОЦК — объем циркулирующей крови, [Na] — концентрация натрия в сыворотке крови, ΔNa — изменение концентрации натрия в сыворотке после инфузии 1 литра раствора, ΔV — необходимый объем раствора для повышения натрия на 1 ммоль/л. При хронической гипонатриемии быстрая коррекция уровня натрия возможна лишь для купирования тяжелых неврологических расстройств, при этом по возможности рано следует переходить к медленной коррекции. Последняя более безопасна, поскольку дает головному мозгу время для адаптации к меняющемуся уровню натрия. В случае быстрой коррекции уровня натрия возможно развитие осмотического повреждения мозга — центрального понтийного и экстрапонтийного миелоза и ухудшения состояния больного вплоть до летального исхода. Лечение этого осложнения заключается в немедленной реиндукцией гипонатриемии введением гипотонических растворов. Поэтому темп коррекции хронической гипонатриемии не должен превышать 0,3 ммоль/ч, но не более 10 ммоль/сут. Для лечения СНПАДГ (1а тип) используют ограничение потребления жидкости (2/3 от физиологической потребности), — около 1 л/сут. для взрослых и 1 л/м 2 для детей). Для внутривенных инфузий используется только 0,9% раствор хлорида натрия. Возможно использование антагонистов V2 рецептора вазопрессина — кониваптана, ликсивоптана (lixivaptan) или толваптана [8]. Демеклоциклин, который устраняет воздействие вазопрессина на собирательные трубочки, также показан в данной ситуации. Он вводится в дозах от 100 до 300 мг 3 раза в день. При 1б типе гипонатриемии лечение заключается во введении изотонического раствора хлорида натрия в сочетании с форсированием диуреза для удаления избытка свободной воды.
При 2 а типе гипонатриемии при истинном уменьшении ОЦК в первую очередь проводят его возмещение с помощью изотонического раствора хлорида натрия, при этом данный процесс может продолжаться в течение длительного времени (например, при возникновении такого состояния на фоне терапии препаратами платины) [23]. Рекомендуется повышенное потребление соли с пищей. Применение минералкортикоидов (например, флудрокортизон 0,4 мг/сут) также может быть полезно для усиления реабсорбции натрия в почках. Длительная терапия минералкортикоидами, однако, опасна развитием гипокалиемии, гипертонии и отека легких. При уменьшении эффективного ОЦК ввиду сердечной недостаточности целесообразно ограничение потребления жидкости при сохранении нормального потребления соли. Используют петлевые диуретики в сочетании с ингибиторами АПФ. Возможно также применение антагонистов V2 рецептора вазопрессина, о которых говорилось выше. При 2б типе гипонатриемии к описанным выше методам добавляют глюкокортикоиды.
Таким образом, гипонатриемия представляет собой достаточно частое осложнение течения опухолевого процесса и противоопухолевой терапии, требующее немедленной коррекции для улучшения прогноза пациента.
Список использованной литературы
источник