1. Хроническая кровопотеря:
а) у женщин – меноррагии, метроррагии, роды;
б) кровопотери из желудочно-кишечного тракта – язвенная болезнь, язвенный колит, опухоли, полипы, геморрой, дивертикулез, варикозное расширение вен пищевода, глистные инвазии (анкилостомидоз);
в) кровопотери в замкнутые полости (нарушение реутилизации железа);
2. Повышенная потребность в железе:
в) быстрый рост в пубертатном периоде.
3. Алиментарный фактор (растительно-молочная диета).
в) искусственное вскармливание;
5. Нарушение транспорта железа:
а) наследственная атрансферринемия;
б) приобретенная гипотрансферринемия (нарушение белоксинтезирующей функции печени).
6. Нарушение всасывания:
б) резекция тонкой кишки, желудка;
Механизмы (патогенез клинических проявлений). Железодефицитная анемия проявляется гипоксическим и сидеропеническим синдромами. Снижение гемоглобина сопровождается недостаточным обеспечением тканей кислородом, что проявляется слабостью, головокружением, сердцебиением, одышкой. Дефицит железа в организме приводит к нарушению клеточных механизмов иммунорезистентности, инфекциям, что является причиной частых острых респираторных и вирусных заболеваний. К обычным симптомам анемий присоединяются признаки, специфичные для недостаточности железа. При хроническом тяжелом дефиците железа у больных появляется извращенный аппетит.
Лабораторные показатели метаболизма железа характеризуются снижением количества гемоглобина, цветового показателя, концентрации ферритина, сывороточного железа в плазме, увеличением трансферрина и общей железосвязывающей способности сыворотки (ОЖСС). Насыщение трансферрина железом (НТЖ) снижается. В последние годы для характеристики железодефицитного состояния определяют в сыворотке крови концентрацию растворимых рецепторов к трансферрину (СD 71), отражающих адекватное поступление железа в клетки эритропоеза. При ЖДА отмечается усиление синтеза и экспрессии мембранных трансферриновых рецепторов и повышение концентрации их в крови.
Апластические анемии (АА) — группа патологических состояний, при которых наряду с панцитопенией обнаруживается снижение кроветворения в костном мозге и отсутствуют признаки гемобластозов. Гемопоэтическая ткань замещается жировой. Этиология апластических анемий разнообразна: химические агенты (бензол, нестероидные противовоспалительные средства, противосудорожные препараты), иммунные заболевания (тимома и карцинома тимуса). При многообразии причин в основе патогенеза АА лежит усиление апоптоза. В костном мозге находят активированные цитотоксические Т-лимфоциты (CD 8+ DR + ). Данные клетки способны производить как гамма-интерферон, так и фактор некроза опухолей (ФНО) – антипролиферативные цитокины, угнетающие гемопоэз за счет индукции апоптоза в гемопоэтических клетках-мишенях. Конституциональная апластическая анемия – анемия Фанкони наследуется как аутосомно-рецессивный признак и проявляется только у гомозигот. Для апластических анемий характерны резкое снижение количества эритроцитов и гемоглобина (до 20-30г/л), сохранение нормохромии (чаще) и микроцитоз. Выраженное уменьшение уровня ретикулоцитов. Гранулоцитопения. Тромбоцитопения. У большинства больных увеличение СОЭ до 20-30 мм/час. Абсолютный уровень лимфоцитов в большинстве случаев остается нормальным. Диагностика апластической анемии возможна только после гистологического исследования костного мозга для исключения гемобластоза и В12-дефицитной анемии.
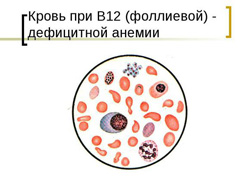
Анемии, связанные с дефицитом витамина В12 и фолиевой кислоты – мегалобластные анемии – относятся к группе анемий, связанных с нарушением синтеза ДНК и РНК. Этот синтез может быть нарушен не только в связи с дефицитом витамина В12 и фолиевой кислоты, но и при некоторых редких наследственных заболеваниях, при которых имеется недостаточность ферментов, участвующих в образовании коферментной формы фолиевой кислоты (5,10-метилентетрагидрофолиевой кислоты), либо в утилизации оротовой кислоты (оротовая ацидурия).
У млекопитающих и человека обнаружены две ферментные реакции, в которых участвуют одна из двух коферментных форм витамина В12: метилкобаламин и 5-дезоксиаденозинкобаламин. Первая из этих реакций обеспечивает нормальное эритробластическое кроветворение. В ходе ее из уридин-монофосфата образуется тимидин-монофосфат, включаемый в ДНК. Для синтеза тимидин-монофосфата необходима активная коферментная форма фолиевой кислоты: 5,10-метилентетрагидрофолиевая кислота, из которой образуется 5-метилтетрагидрофолиевая кислота, а затем – тетрагидрофолиевая кислота. Последняя вновь может превращаться в 5,10-метилентетрагидрофолиевую кислоту, пригодную для синтеза тимидин-монофосфата, после чего цикл повторяется. Без витамина В12 эта циклическая реакция нарушается, в результате чего страдает синтез тимидин-монофосфата, а следовательно – и ДНК.
Содержание витамина В12 в организме взрослого человека составляет 2-5 мг. Печень – основной орган, в котором он содержится. Потери с мочой и калом – 2-5 мкг в сутки. Из пищи всасывается не весь витамин В12, суточная потребность в нем составляет 3-7 мкг. Запасы витамина В12 настолько велики, что требуется 3-6 лет для развития его дефицита.
Запасы фолиевой кислоты составляют 5-10 мг. Суточная потребность – 100-200 мкг. Запасов фолиевой кислоты в организме при нарушении ее поступления хватает не более, чем на 3 месяца.
Главные причины дефицита витамина В12
I. Нарушение всасывания витамина В12
а) дефицит внутреннего фактора Кастла при патологии желудка (рак, атрофический гастрит и т.д.) или наследственные формы;
б) хронический энтерит (резекция тонкой кишки, тропическая спру, целиакия и т.д.)
II. Повышенный расход витамина В12
а) инвазия широким лентецом
б) множественный дивертикулез тонкой кишки (кишечная флора активно поглощает витамин В12)
III. Нарушение транспорта витамина В12 к тканям (дефицит транскобаламина).
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
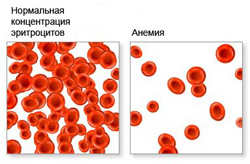
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
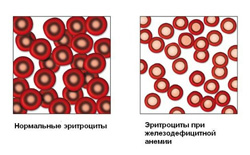
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
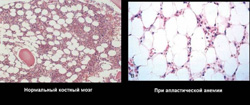
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник
Железодефицитные анемии — группа анемий, обусловленных нарушением синтеза гемоглобина в результате снижения содержания железа в организме. Это наиболее часто встречающаяся форма анемий. В европейских странах дефицит железа выявляется у 20% женщин и 2% мужчин. Особенно часто данная патология наблюдается у грудных детей. Это обусловлено тем, что при неправильном вскармливании (питание с низким содержанием железа) через 5-6 месяцев у ребенка истощается запас железа, полученный от матери во внутриутробном периоде, что приводит к развитию дефицита железа, а затем и к анемии.
В организме здоровой женщины содержится 35 мг железа на 1 кг массы тела, у мужчины — 50 мг/кг. Дефицит железа развивается при снижении его содержания в организме, возрастании потерь железа и отсутствии адекватного поступления.
Основные причины дефицита железа:
1.Хронические кровопотери. Это наиболее важная и частая причина железодефицитных анемий. Источниками кровопотери у женщин обычно являются меноррагии, у мужчин — кровотечения из желудочно-кишечного тракта. Необходимо иметь в виду, что “обычные” для женщины менструальные кровопотери могут постепенно истощать запасы запасы железа и приводить к развитию железодефицитной анемии через несколько лет. Нельзя забывать также, что если по поводу повторных носовых, десневых, гематурии, кровохарканья большинство больных обращается к врачу задолго до развития анемического синдрома, то хроническая кровопотеря из желудочно-кишечного тракта может незаметно приводить к анемии (установлено, например, что геморрой с ежедневной потерей 5 мл крови через несколько недель приводит к железодефицитной анемии). Важнейшими причинами желудочно-кишечных кровотечений являются: геморрой, язвенная болезнь, грыжа пищеводного отверстия диафрагмы, доброкачественные и злокачественные опухоли (полипы, рак желудка или толстой кишки), эзофагит, неспецифический язвенный колит, дивертикулез, прием медикаментов (нестероидные противовоспалительные препараты и др.).
2.Неадекватное поступление железа с пищей (бедность, религиозные убеждения, вегетарианство, нервная анорексия, “диета подростков” – чипсы и кола).
3.Увеличение потребности при ускоренном росте (детский и подростковый периоды) или интенсивной потере железа (во время менструаций женщины теряют более 2 мг железа в сутки, во время беременности и период лактации — 3,5 мг/сутки).
4.Нарушение всасывания железа (малабсорбция). Это состояние развивается у 50-80% больных, перенесших резекцию желудка или гастроеюностомию. Причинами малабсорбции у этих пациентов являются: а)потеря резервуарной функции желудка (его содержимое поступает в тонкую кишку, минуя проксимальный отдел двенадцатиперстной кишки, где всасывание железа максимально); б)прекращение секреции хлористоводородной кислоты.
Несмотря на нарушение всасывания пищевого железа, всасывание его растворимых солей не ухудшается.
5.Нарушение транспорта железа (атрансферринемия, дефицит меди)
Этапы развития дефицита железа:
I — истощение запасов железа или прелатентный дефицит железа. Для данного этапа характерно снижение уровня ферритина в сыворотке; уровень гемоглобина и сывороточного железа остаются нормальными.
II — железодефицитный эритропоэз. Это стадия латентного дефицита железа, которая диагностируется при снижении уровня железа в сыворотке и нормальной концентрации гемоглобина.
III — появление лабораторных и клинических признаков железодефицитной анемии.
Основным местом всасывания железа является 12-перстная кишка, в меньшей степени — тощая кишка. Возможности слизистой оболочки по абсорбции железа ограничены: из продуктов питания всасывается лишь 1,5 мг, максимум 3,5 мг железа в сутки. При дефиците железа всасываемость увеличивается до 10 мг/сутки из продуктов питания, а из лекарственных препаратов — до 20 мг/сутки. Абсорбция железа снижается при уменьшении количества гемового железа, поступающего с пищей; ограничении его биодоступности и увеличении запасов железа в организме. Пищевой дефицит может возникать у лиц, относящихся к группам риска (скудность пищевого рациона у инвалидов и одиноких, бедность, стойкое отвращение к определенным пищевым продуктам).
Железо, входящее в состав гема, всасывается в виде интактного порфиринового кольца и обладает высокой биодоступностью практически во всех мясных продуктах. Пищевое железо во всех остальных продуктах (негемовое железо) растворяется, не успев всосаться, и становится компонентом общего пищевого пула желудочно-кишечного тракта. Состав пищи оказывает существенное влияние на всасывание железа. Более полному всасыванию способствуют животная пища, аскорбиновая кислота (окисляет трехвалентное железо в более растворимое двухвалентное), низкий молекулярный вес растворимых хелатов, двухвалентное железо, дефицит железа, интенсификация эритропоэза (например, после кровопотери). Способствует активному всасыванию железа и состояние слизистой оболочки кишечника. Клетки слизистой оболочки кишечника имеют специфические рецепторы, способствующие активному транспорту железа через клеточную мембрану в плазму. Гем поступает в клетки в неизмененном виде, разрушается внутриклеточно под действием оксигеназы, после чего железо становится компонентом общего внутриклеточного транзитного пула железа. При этом часть железа (1 мг) находится в циркуляции в комплексе с трансферрином, часть остается в клетках эпителия кишечника (около 3 мг) и поступает в плазму при дефиците железа. При слущивании эпителия кишечника это железо выводится с калом.
Снижают абсорбцию железа уменьшение количества гемового железа и животной пищи (вегетарианство), увеличение количества трехвалентного железа, чай, кофе, щелочные растворы (молоко, сок поджелудочной железы), фосфаты, десферал, увеличение запасов железа в организме, гемохроматоз, редукция эритропоэза, острые или хронические инфекции. Установлено, что с возрастом всасывание неорганического железа снижается, что обусловлено уменьшением продукции хлористоводородной кислоты и атрофией слизистой оболочки желудка; всасывание гемового железа и растворимых солей двухвалентного железа по мере старения не изменяется.
Выделяют три степени тяжести железодефицитной анемии:
I (легкая) — уровень выше 90 г/л;
II (средней степени тяжести) — гемоглобин в пределах 70-90 г/л;
III (тяжелая) — уровень гемоглобина менее 70 г/л.
Для больных железодефицитными анемиями характерно наличие двух синдромов: а)анемического, который характерен для любой анемии и зависит от выраженности и скорости ее развития; б)сидеропенического, обусловленного снижением уровня железа в сыворотке крови.
Сидеропенический синдром проявляется изменениями эпителиальных тканей (сухость кожи и слизистых оболочек, трещины на руках и ногах, ломкость ногтей, уплощение ногтей — койлонихия, выпадение волос, двусторонний ангулит), извращениями вкуса и обоняния (pica chlorotica). Развитие pica chlorotica характерно прежде всего для женщин и подростков и может проявляться употреблением в пищу мела, зубного порошка, глины, песка, льда, сырого мясного фарша; нередко отмечается пристрастие к запаху бензина, керосина, ацетона, мочи, выхлопных газов автомобиля.
В ряде случаев больные жалуются на дисфагию (синдром Патерсона-Келли, или Пламмера-Винсона). Морфологическим эквивалентом этого синдрома являются дистрофические изменения в пищеводе на уровне ниже перстневидного хряща. Сидеропеническая дисфагия чаще встречается у женщин и симулирует рак пищевода (с которым необходимо проводить дифференциальную диагностику!). Частым симптомом является уменьшение мышечной силы, не соответствующее степени тяжести анемии, что обусловлено низким уровнем альфа-глицерофосфатдегидрогеназы. При тяжелом дефиците железа могут наблюдаться неврологические нарушения (парестезии, головные боли, воспаление соска зрительного нерва), а у детей — изменения поведения (плаксивость, раздражительность), замедление умственного и физического развития в связи с нарушением обмена аминокислот в тканях головного мозга.
Наиболее характерные клинические особенности железодефицитной анемии: 1)преимущественно страдают женщины; 2)развитию анемии обычно предшествует сидеропенический синдром с характерной клинической картиной; 3)заболевание чаще всего впервые манифестирует во время первых месячных, первой беременности, при лактации, в климактерическом периоде, после перенесенной инфекции; 4)длительностьзаболевания исчисляется годами; 5)в анамнезе обычно отмечается эффективность лечения препаратами железа.
При объективном обследовании отмечается характерная алебастровая (жемчужная, мраморная) бледность кожи, бледность склер и слизистых оболочек, проявления сидеропенического синдрома. При исследовании сердечно-сосудистой системы обычно выявляются тахикардия, ослабление I тона на верхушке сердца, систолический шум на верхушке и в проекции клапана легочной артерии, шум “волчка” на яремных венах. У некоторых больных выявляются периферические отеки, атрофический глоссит, одышка. Периферические лимфатические узлы, печень и селезенка не увеличены.
Необходимо иметь в виду, что при хронических железодефицитных анемиях легкой или средней степени тяжести клиническая симптоматика может отсутствовать либо ограничивается умеренными проявлениями сидеропении.
Лабораторные и инструментальные данные.
Клинический анализ крови. Для железодефицитной анемии характерно прежде всего снижение уровня гемоглобина и гематокрита, в меньшей степени — эритроцитов. Снижены также цветовой показатель, MCH и MCHС (гипохромная анемия). Микроцитоз проявляется уменьшением MCV эритроцитов менее 80 фл. Морфологическое исследование эритроцитов позволяет выявить гипохромию, анизо- и пойкилоцитоз (степень анизоцитоза более 15%), в небольшом количестве могут встречаться мишеневидные эритроциты и эллипсоциты. Содержание ретикулоцитов в пределах нормы или несколько повышено (через несколько дней после меноррагий или кровотечения иной локализации). При адекватной терапии препаратами железа на 4-8-й день количество ретикулоцитов в большинстве случаев повышается до 30-40%о. Количество лейкоцитов и лейкоцитарная формула обычно не изменяются. В некоторых случаях отмечаются умеренная лейко- и нейтропения, исчезающие на фоне лечения препаратами железа. Число тромбоцитов в норме, реже наблюдается умеренный тромбоцитоз (после кровопотери).
Биохимическое исследование сыворотки крови позволяет выявить снижение сывороточного железа, ферритина и насыщенных трансферринов (менее 16%), увеличение общей железосвязывающей способности сыворотки (общие трансферрины) и уровня ненасыщенных трансферринов.
Концентрация сывороточного ферритина коррелирует с величиной запасов железа в организме: 1 мкг/л ферритина плазмы соответствует приблизительно 10 мг железа запасов. Снижение уровня сывороточного ферритина ниже 12 мкг/л является диагностическим признаком железодефицитного состояния (когда анемия еще отсутствует).
В подавляющем большинстве случаев диагностика железодефицитной анемии не вызывает затруднений. Для этого достаточно клинических данных, исследований периферической крови и уровня сывороточного железа.
Исследование миелограммы при железодефицитных анемиях не относится к обязательным методам исследования. Показаниями для стернальной пункции являются резистентность к проводимой терапии препаратами железа, а также наличие лейко- и/или тромбоцитопении. В миелограмме при железодефицитной анемии выявляется нормальное количество миелокариоцитов, умеренная гиперплазия эритроидного ростка, нормобластический тип кроветворения с признаками нарушения гемоглобинизации клеток эритроидного ряда (увеличение количества базофильных и полихроматофильных нормоцитов и уменьшение — оксифильных форм. Кроме того, отмечается снижение количества сидероцитов и сидеробластов вплоть до полного их отсутствия (истощение запасов железа).
Инструментальные исследования необходимы для выяснения генеза анемии. С этой целью по показаниям проводятся исследование кала на скрытую кровь, ультразвуковое исследование органов брюшной полости и малого таза, рентгенография органов грудной полости, фиброгастроскопия, ректороманоскопия, ирригоскопия, при необходимости — колоноскопия, внутривенная урография.
Для уточнения генеза железодефицитной анемии показаны также консультации специалистов ( прежде всего гинеколога,и уролога).
Дифференциальный диагноз. При обследовании больного железодефицитной анемией сложностей в дифференциальной диагностике с нормохромными (нормоцитарными) и гиперхромными (макроцитарными) анемиями обычно не возникает. Сложнее проводить дифференциальный диагноз железодефицитной анемии с другими микроцитарными гипохромными анемиями , к которым относятся анемии при хронических воспалительных заболеваниях, сидеробластные анемии и гетерозиготные талассемии.
1.Анемии при хронических воспалительных заболеваниях.
Чаще всего это анемии легкой степени (гемоглобина выше 90 г/л), нормохромные и нормоцитарные, но иногда имеются умеренный микроцитоз и гипохромия. При анемии хронического воспаления ведущими в клинической картине являются проявления основного заболевания (например, ревматоидного артрита), отсутствует сидеропенический синдром, уровень сывороточного железа незначительно снижен.
Дифференциальный диагноз между железодефицитными анемиями (ЖДА) и анемиями при хронических воспалениях (АХВ)
(Williams W.J., 1988, с изменениями).
Запасы железа в костном мозге
В отличие от железодефицитных анемий, при анемии хронического воспаления железосвязывающая способность сыворотки снижена, а ферритин сыворотки в пределах нормы (таблица 7.1.)
2.Сидеробластная анемия характеризуется отсутствием сидеропенического синдрома, качественными нарушениями эритро-, лейко- и мегакариоцитопоэза, повышением количества сидеробластов в костном мозге и появлением их кольцевидных форм, увеличением содержания железа и ферритина в сыворотке крови. Железосвязывающая способность сыворотки не изменена, протопорфирин эритроцитов повышен или в норме. Сидеробластная анемия бывает врожденной и приобретенной. В последнем случае она может быть самостоятельной нозологической формой (вариант миелодиспластического синдрома), ассоциироваться с другими заболеваниями (острые и хронические лейкозы, множественная миелома, рак,) либо с лечением некоторыми медикаментами (левомицетин, противотуберкулезные средства).
3.Гетерозиготная бета-талассемия относится к наследственным гемолитическим анемиям. В России это заболевание встречается редко. Основными критериями диагностики данной патологии является повышение уровня гемоглобина А2 и F при электрофорезе гемоглобина. В периферической крови отмечаются выраженный микроцитоз, увеличение количества мишеневидных эритроцитов, сывороточного железа, общих и ненасыщенных трансферринов и ферритина.
Лечение. Прежде всего необходимо устранение причины, вызвавшей дефицит железа и развитие анемии (уменьшение объема меноррагий, удаление кровоточащих геморроидальных узлов и др.). Диета должна содержать достаточное количество железа и включать белки животного происхождения (мясо, печень), поскольку даже из растительных продуктов с высоким содержанием железа его всасывается не более 3%. Необходимо иметь в виду, что такая диета препятствует дальнейшему прогрессированию дефицита железа, но не может устранить уже имеющуюся анемию. Для лечения железодефицитной анемии необходимо назначение медикаментозных препаратов. При определенных показаниях препараты железа могут использоваться и профилактически, при признаках дефицита железа (у беременных, недоношенных детей, при продолжающихся кровопотерях).
Основным методом лечения является длительный (не менее 4-6 мес) прием пероральных препаратов железа. Методом выбора является назначение per os комплексных препаратов железа в виде сульфата, глюконата, лактата, фумарата или карбоната железа в суммарной дозе 400-600 мг в день (за 2-3 приема). Препараты железа назначаются натощак, так как продукты питания снижают абсорбцию железа на 20-70%. Дозу для детей назначают из расчета 3 мг железа на 1 кг веса ребенка в день. После достижения лечебного эффекта (нормализация уровня гемоглобина и сывороточного железа), наступающего в среднем через 4 недели, вплоть до окончания лечения переходят на поддерживающие дозы препаратов железа, которые в 2-3 раза меньше начальных.
Существует большое количество комплексных препаратов солей железа для приема внутрь. К наиболее распространенным относятся: а) ферромед (Ferromed) — капсулированный комбинированный препарат сульфата железа и фолиевой кислоты; б). ферроплекс (Ferroplex) — 1 драже содержит 0,05 г сульфат железа и 0,03 г аскорбиновой кислоты; в)фесовит (Fesovit) — комбинированный препарат сульфата железа (0,15 г в капсуле) и комплекса витаминов; г)ферро-градумент (Ferro-gradument) — сульфат железа (0,525 г) – используется для поддерживающего лечения.
В ряде случаев лечение пероральными препаратами железа оказывается безрезультатным, что может быть связано со следующими причинами: а)продолжающаяся кровопотеря; б)неправильный прием и неадекватная доза препарата; в)использование неэффективного препарата (ретардированные формы, в частности, ферроградумент, не всасываются в 12-перстной кишке и поступают более проксимальные отделы, где всасывание железа значительно снижено); г)неправильный диагноз (анемия хронических заболеваний, талассемия, сидеробластная анемия); д)комбинированный дефицит (дефицит железа и фолиевой кислоты или витамина В12 ); е)нарушение всасывания железа (редко).
У 15-20% больных лечение пероральными препаратами железа приходится отменять в связи с развитием побочных эффектов со стороны желудочно-кишечного тракта (тошнота, рвота, отсутствие аппетита, боли в животе, дискомфорт в эпигастральной области, вздутие живота, нарушения стула).
Показания к терапии парентеральными препаратами железа: а)необходимость быстрого восполнения запасов железа (тяжелая железодефицитная анемия, операция, последние недели беременности); б)нарушение всасывания железа; в)непереносимость пероральных препаратов железа; г)желудочно-кишечные заболевания (неспецифический язвенный колит, болезнь Крона); д)врожденная телеангиоэктазия, сопровождающаяся значительными повторными кровотечениями.
При назначении парентеральных препаратов железа предпочтительнее использовать медикаменты, вводимые внутривенно, так как внутримышечное введение менее эффективно (часть железа откладывается в мышцах в виде гемосидерина) и может осложняться развитием постинъекционных инфильтратов. Начинают лечение с пробной дозы препарата (1/2 ампулы), которую вводят очень медленно.
К наиболее распространенным препаратам железа для парентерального применения относятся феррум лек и феррлецит.
Феррум Лек (Ferrum Lek) — 1 ампула содержит 0,1 г трехвалентного железа с мальтозой для внутримышечного введения или железа сахарат для внутривенного введения. Общая доза (количество ампул) рассчитывается по формуле: масса тела больного (кг) х (100 — концентрация гемоглобина в г/%) х 0,0066.
Феррлецит (Ferrlecit) — 1 ампула содержит 0,0625 г натрий-железоглюконатный комплекс. Курсовая доза препарата вычисляется по формуле: масса тела больного (кг) х концентрация гемоглобина в крови (г/100мл) х 2,5.
Возможные побочные эффекты парентеральных препаратов железа: а)тошнота; б)лихорадка; в)артралгии; г)локальные боли и инфильтраты в местах инъекций (при внутримышечном введении);д)флебиты (при внутривенном введении); е)аллергические реакции (вплоть до анафилактического шока). ж) гемохроматоз (при передозировке).
Трансфузии эритроцитарной массы не относятся к обязательным методам лечения и должны проводиться лишь при тяжелой анемии, сопровождающейся изменениями в сердечно-сосудистой и дыхательной системах или предстоящем оперативном вмешательстве.
Оценка эффективности проводимой терапии:
1) улучшение общего состояния больного с 4-5-го дня терапии;
2) увеличение количества ретикулоцитов до 30-50%о на 4-8-й день;
3) повышение гемоглобина обычно начинается через 2-3 недели и еженедельно возрастает на 5г/л (возможно и скачкообразное повышение к концу 4-й недели лечения);
4) улучшение качественного состава эритроцитов (исчезает микроцитоз и гипохромия);
5) постепенная регрессия эпителиальных изменений.
Железодефицитные анемии — группа анемий, обусловленных нарушением синтеза гемоглобина в результате снижения содержания железа в организме.
Основные диагностические критерии .
2.Мраморная бледность кожи.
3.Снижение MCH, MCHС, цветового показателя, MCV менее 80 фл, RDW более 15%.
4.Снижение сывороточного железа, ферритина и насыщенных трансферринов (менее 16%), увеличение общей железосвязывающей способности и ненасыщенных трансферринов.
5.В миелограмме — умеренная гиперплазия эритроидного ростка, нормобластический тип кроветворения, снижение количества сидероцитов и сидеробластов.
Основные принципы профилактики и лечения.
1.Ликвидация причины, вызвавшей дефицит железа.
2.Диета с высоким содержанием железа (мясо, печень).
3.Профилактический прием препаратов железа в группах риска.
4.Длительный прием пероральных препаратов железа (4-6 мес).
5.Парентеральные препараты железа (по показаниям).
6.Трансфузии эритроцитарной массы при тяжелой анемии, сопровождающейся нарушениями сердечно-сосудистой и дыхательной систем, либо перед операцией.
источник