Наследственные гемолитические анемии — результат врожденного дефекта гемоглобина, ферментов или мембран эритроцитов. Соответственно выделяют три группы наследственных гемолитических анемий:
- Гемоглобинопатии (серповидноклеточная анемия, гемоглобинопатия HbSC).
- Ферментопатии (анемии при недостаточности глюкозо-6-фосфат дегидрогеназы).
- Мембранопатии (наследственный микросфероцитоз, овалоцитоз и пойкилоцитоз).
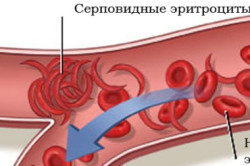
Серповидноклеточная анемия — наследственное заболевание системы крови, характеризующееся генетическим дефектом, в результате которого происходит нарушение строения белка гемоглобина (гемоглобинопатия). Образующийся при этом аномальный гемоглобин S (HbS) отличается по своим электрофизиологическим свойствам от нормального гемоглобина (HbA) здорового человека, в результате чего изменяются и сами эритроциты, приобретая характерную удлиненную форму, под микроскопом напоминающую серп (отсюда и название заболевания).
Серповидноклеточная анемия — заболевание, развивающееся у гомозигот по аллелю, кодирующему гемоглобин S, имеющий структурные аномалии молекулы гемоглобина и способный к полимеризации при отдаче кислорода или снижении его парциального давления. В эритроцитах образуются волокна (тактоиды), формирующие студенистую сеть, изменяющие форму эритроцитов на серповидную и повышающие их жесткость, что затрудняет прохождение эритроцитов по мелким сосудам. Как следствие возникает закупорка этих сосудов, и развиваются многочисленные инфаркты в селезенке, легких, почках и головном мозге.
Заболевание проявляется обычно в детском возрасте. Характерны бледность, утомляемость, задержка роста, повышенная чувствительность к инфекциям. В результате хронического гемолиза развиваются желтуха и желчнокаменная болезнь.
Характерными симптомами анемии являются трофические язвы голеней, приапизм, повторные инфаркты легких, хроническое легочное сердце, некроз почечных сосочков, обусловленные ухудшением реологических свойств крови. Возможно развитие кровоизлияний в сетчатку с последующими рубцеванием и отслойкой сетчатки.
Заболевание является хроническим. Течение заболевания нередко осложняется инфекцией, в частности сальмонеллезом, приводящим к остеомиелиту. Иногда возникает асептический некроз головки бедренной кости. Тяжелым осложнением и у детей, и у взрослых является инсульт.
Нередко развиваются угрожающие жизни больных острые кризы. Самый частый из них — болевой криз. Боль локализуется в спине, конечностях и ребрах, длится несколько дней или недель, сопровождается лихорадкой, но концентрация гемоглобина в крови нормальная. Возможно развитие острого синдрома грудной клетки, проявляющегося болью в грудной клетке, легочными инфильтратами и гипоксией.
У детей, а иногда и у взрослых, со спленомегалией развиваются секвестрационные кризы, характеризующиеся депонированием крови в селезенке и сопровождающиеся артериальной гипотонией и шоком, падением концентрации гемоглобина в крови.
Редко развиваются гемолитические кризы, характеризующиеся вторичной желтухой и снижением концентрации гемоглобина в крови.
При вирусной инфекции (обычно парвавирусе В19) развиваются апластические кризы, сопровождающиеся резким снижением гемоглобина и уменьшением количества ретикулоцитов в периферической крови.
Сходные клинические проявления имеет гемоглобинопатия HbSC. Она протекает менее тяжело, но с выраженной спленомегалией.
Гемоглобин S при серповидноклеточной анемии выявляют после обработки эритроцитов метабисульфатом натрия, что приводит к отдаче кислорода. С помощью электрофореза (более точный метод) можно количественно определить гемоглобин S и отличить гомозиготную от гетерозиготной анемии или от других аномалий строения гемоглобина.
Гемоглобин при серповидноклеточной анемии снижен до 50–100 г/л, при гетерозиготности по HbS его уровень нормальный. Средний эритроцитарный объем может быть увеличенным, наблюдается непрямая гипербилирубинемия и нейтрофильный лейкоцитоз, количество тромбоцитов повышено.
В мазках периферической крови выявляют серповидные эритроциты, иногда тельца Говела–Жолли и мишеневидные эритроциты.
Специфическим методом лечения является лечение гидроксимочевиной, повышающей уровень фетального гемоглобина и снижающей уровень гемолиза. Эффективность препарата усиливается назначением эритропоэтина. Этот метод лечения применяют только больным с тяжелой анемией.
Основное лечение направлено на предупреждение острых и хронических осложнений. Не следует допускать обезвоживания, длительного пребывания на большой высоте.
Детям от 3-х месяцев до 5 лет показано введение менингококковой вакцины и вакцины против Haemophilus influenza типа В. Детям старше 5 лет назначают профилактическую терапию пенициллином по 125–250 мг внутрь ежедневно. В случае лихорадки срочно проводят интенсивную противомикробную терапию.
Всем больным с хронической гемолитической анемией назначают фолиевую кислоту 1 мг внутрь 1 раз в сутки.
При болевом кризе в/в вводят жидкость и проводят обезболивающую терапию анальгетиками. Наиболее эффективны длительные инфузии морфина. Но следует помнить о склонности больных с рецидивирующим болевым синдромом к наркотической зависимости. Переливание крови не устраняет боль, повторные же переливания могут привести к гемосидерозу.
При остром синдроме грудной клетки проводят ингаляции кислорода и инфузионную терапию и назначают антибиотики широкого спектра действия (цефтриаксон и эритромицин). При снижении РаО2 в крови ниже 60 мм рт. ст. проводят обменное переливание крови.
Лечение секвестрационного криза направлено на восстановление гемодинамики. Основным лечением апластического криза является трансфузионная терапия.
Лечение остеомиелита проводят с учетом результата бактериологического исследования биопсийного материала. Трофические язвы голени лечат возвышенным положением нижних конечностей, интенсивными местными воздействиями и при отсутствии эффекта проводят трансфузионную терапию и пересадки полнослойных лоскутов кожи. Приапизм устраняется регидратационной терапией или хирургической декомпрессией.
Излечение от серповидноклеточной анемии у некоторых больных возможно с помощью аллотрансплантации костного мозга. Но отбор для этого лечения сложен и широко не применяется. В настоящее время интенсивно развиваются методы генотерапии.
Ферментопатические гемолитические анемии — группа заболеваний, обусловленных дефицитом активности эритроцитарных ферментов. Врожденный дефицит ферментов (пируваткиназы, глюкозо-6-фосфатизомеразы, гексокиназы, глюкозо-6-фосфатдегидрогеназы) приводит к развитию анемии. Чаще всего встречается дефицит глюкозо-6-фосфатдегидрогеназы.
Нормальные эритроциты защищены от действия окислителей за счет метаболизма глюкозы по пентозофосфатному пути, являющемуся источником восстановленного глутатиона, препятствующего окислению сульфгидрильных групп гемоглобина и мембраны эритроцитов. Образующиеся свободные радикалы кислорода при контакте с токсинами или лекарствами в эритроцитах резко увеличивают метаболизм глюкозы по этому пути.
При недостаточности глюкозо-6-фосфатдегидрогеназы в эритроцитах не образуется необходимое количество восстановленного глутатиона, что приводит к окислению сульфгидрильнх групп гемоглобина с образованием телец Гейнца и мембран эритроцитов и развитию хронического или эпизодического гемолиза.
Гем глюкозо-6-фосфатдегидрогеназы расположен на Х-хромосоме. Поэтому недостаточность глюкозо-6-фосфатдегидрогеназы наследуется сцеплено с Х-хромосомой главным образом у мужчин — выходцев из Африки, Средиземноморья и Китая. У женщин заболевание наблюдается редко.
Гемолитические кризы — основное клиническое проявление этой ферментопатической анемии — развиваются обычно быстро, в течение нескольких часов и только под действием провоцирующих факторов. К ним относятся лекарственные средства (сульфаниламиды, хинин, нитрофурантоин, аспирин, феназопиридин), инфекции и бобы, принимаемые с пищей.
Содержание глюкозо-6-фосфатдегидрогеназы снижено главным образом в стареющих эритроцитах, и они более подвержены гемолизу. В момент криза в мазках периферической крови выявляются тельца Гейнца. Характерно быстрое снижение гематокрита, повышение в плазме концентрации свободного гемоглобина и непрямого билирубина и снижение уровня гаптоглобина. Гемолитический криз проходит быстро, обычно самостоятельно после разрушения старых эритроцитов.
К концу первых суток тельца Гейнца удаляются селезенкой. После их удаления в крови появляются эритроциты с полукруглыми краевыми дефектами («укусы» эритроцитов), фрагменты эритроцитов и небольшое количество микросфероцитов. После криза уровень глюкозо-6-фосфатдегидрогеназы может нормализоваться за счет преобладания в крови популяции молодых эритроцитов. Активность фермента следует определить через 1,5–2 мес после криза.
Основное внимание следует уделить профилактике гемолитических кризов: лечению инфекции, исключению приема некоторых лекарственных средств и употребления в пищу бобов. Гемотрансфузии проводят по строгим показателям. Во время кризов с гемоглобинурией проводят адекватную гидратацию для поддержания нормальной функции почек.
Мембранопатии — наследственные заболевания, характеризующиеся структурными аномалиями белков эритроцитов, приводящими к нарушениям структуры их мембран и внесосудистому гемолизу. Различают три формы наследственных мембранопатий: микросфероцитоз, овалоцитоз и стоматоцитоз.
Заболевание наследуется в большинстве случаев по аутосомно-доминантному типу и характеризуется дефектом одного из белков цитоскелета эритроцитов, приводящим к потере части их мембраны с уменьшением отношения площади к объему. Эритроциты превращаются в микросфероциты, имеющие средний диаметр меньше 6,3 мкм и среднюю толщину больше 2,1 мкм.
Наследственный микросфероцитоз может выявиться как у детей, так и у взрослых. У больных находят синдром анемии, желтуху и спленомегалию. Желтуха сопровождается образованием пигментных камней в желчном пузыре и желчевыводящих путях даже у детей. В костном мозге развивается гиперплазия эритроидного ростка.
Анемия нормохромная, умеренная (гемоглобин 90–100 г/л). В мазке крови выявляют микросфероциты — мелкие клетки без центрального просветления. Характерна способность микросфероцитов к гемолизу в гипотонических растворах меньшей концентрации в отличие от нормальных эритроцитов. Секвестрация микросфероцитов происходит в селезенке.
Диагностическое значение имеет спонтанный гемолиз — число эритроцитов, разрушившихся после инкубации крови в течение 48 ч. У здоровых людей он не превышает 4%, у больных с наследственным микросфероцитозом достигает 15–50%. Спонтанный гемолиз при добавлении в кровь глюкозы резко снижается. Прямая проба Кумбса отрицательная в отличие от аутоиммунной гемолитической анемии, при которой она положительна.
Клиническое выздоровление наступает после спленэктомии, хотя микроцитоз остается, но гемолиз значительно уменьшается. С профилактической целью назначают длительно фолиевую кислоту (1 мг/сут внутрь). При наличии желчнокаменной болезни после спленэктомии решается вопрос о холецистэктомии.
Наследственный овалоцитоз — заболевание, сопровождающееся появлением в крови большого количества овалоцитов. В периферической крови здоровых лиц количество их составляет 5–10%, а у больных колеблется от 25 до 90%. Овалоцитоз наследуется по аутосомно-доминантному типу.
Ведущее значение в патогенезе заболевания имеет структурная аномалия спектрина, приводящая к образованию измененного цитоскелета эритроцитов. Возможна недостаточность белка 4,1 цитоскелета, связывающего спектрин и актин. В результате имеющие двояковогнутую форму диски эритроцитов после прохождения микроциркуляторного русла становятся овальными и не восстанавливают свою прежнюю форму. Овалоциты разрушаются главным образом в селезенке.
У большинства больных овалоцитоз обнаруживается случайно при исследовании периферической крови или проявляется легким гемолизом с нормальной концентрацией гемоглобина (больше 120 г/л). Концентрация гемоглобина может быть сниженной. У 10–15% больных выявляется тяжелое течение заболевания, характеризующееся интенсивным гемолизом. Концентрация гемоглобина снижается до 90–100 г/л и ниже, продолжительность жизни половины эритроцитов составляет 5 сут. В периферической крови обнаруживают микроовалоциты, пойкилоциты и шизоциты.
Лечение наследственного овалоцитоза аналогично лечению наследственного микросфероцитоза. Основное значение имеет спленэктомия, устраняющая гемолиз.
Наследственный стомацитоз — заболевание, при котором эритроциты имеют специфическую форму — выпуклые с одной стороны и вогнутые с другой и имеют щелевидное пространство в окрашенном мазке крови.
Существует две формы эритроцитов:
- гипергидратированные стоматоциты (гидроциты) с высоким содержанием ионов натрия и воды и низкой средней концентрацией гемоглобина;
- дегидратированные стоматоциты (ксероциты) с низким содержанием ионов натрия и воды, и высокой средней концентрацией гемоглобина.
Гидроциты выглядят в окрашенных мазках крови как типичные стоматоциты, а ксероциты сморщенные и имеют вид мишеней. Стоматоциты имеют укороченную продолжительность жизни.
Клиника наследственного стоматоцитоза проявляется спленомегалией и легким гемолизом. Спленэктомия полностью гемолиз не устраняет.
источник
Гемолитическая анемия – это группа патологий, при которых сокращается жизненный цикл красных кровяных клеток (эритроцитов) по причине их повышенного разрушения, которое происходит быстрее, чем успевают появляться новые клетки. Среди всех болезней крови доля гемолитической анемии составляет чуть более 5%.
Условно гемолитическая анемия разделяется на два вида:
Врожденная анемия возникает из-за системных нарушений – повышенный уровень распада эритроцитов связан с их генетическим дефектом. Врожденная форма тяжело лечится и обладает неблагоприятным прогнозом. К ней относят:
- Мембранопатию эритроцитов – эритроциты формируются неправильной формы и полностью распадаются из-за генетического дефекта оболочки. Сильное влияние на разрушение клеток оказывает селезенка. Делится болезнь на:
- овалоцитарную;
- акантоцитарную;
- микросфероцитарную.
- Ферментопатию – тельца не в состоянии поддерживать свою целостность из-за дефицита определенных ферментов типа глюкозо-6-фосфатдегидрогеназы или пируваткиназы.
- Гемоглобинопатию – анемия, которая образовывается при изменении или нарушении структуры гемоглобина – белка, который обеспечивает клеткам функцию дыхания.
При приобретенной форме гемолитической анемии у человека изначально созревают здоровые эритроциты, но под воздействием определенных факторов они преждевременно разрушаются. Тяжесть течения этой формы зависит от того, получится ли убрать провоцирующий анемию фактор. Иногда дефицит гемоглобина – это лишь временное явление, но случается, что изменения несут уже необратимый характер и требуют серьезного радикального лечения.
Приобретенные гемолитические анемии делятся на:
- Пароксизмальную ночную гемоглобинурию – редкая форма болезни, когда распад кровяных телец происходит во время сна.
- Внеэритроцитарную патологию. К факторам, которые способны разрушить здоровые кровяные клетки, относят:
- токсические поражения – например, при воздействии яда;
- инфекционные поражения – возбудители малярии и токсоплазмоза используют эритроциты для размножения, что в определенный момент становится причиной разрыва мембраны эритроцитов (также болезнь может вызвать вирусный гепатит В);
- механические поражения вызываются механическим повреждением структуры эритроцитов (например, при протезах сердечных клапанов);
- анемии, связанные с дефицитом витамина Е;
- иммуногемолитические – организм вырабатывает антитела против своих же тканей, что впоследствии становится причиной появления злокачественных образований;
- анемии, вызванные повышенным разрушением эритроцитов в селезенке.
По международной классификации болезней десятого пересмотра гемолитическая анемия входит в класс болезней крови и содержит в себе следующие блоки:
- D55 – анемия вследствие ферментных нарушений;
- D56 – талассемия;
- D57 – серповидно-клеточные нарушения;
- D58 – другие наследственные гемолитические анемии;
- D59 – приобретенная гемолитическая анемия.
При врождённых гемолитических анемиях основными причинами развития болезни становятся такие:
- дефектный ген передается от родителей по наследству;
- мутация генов происходит спонтанно во время внутриутробного развития.
Если дефектный ген располагается в обоих локусах хромосомы, то говорят о гомозиготной форме наследственной анемии. При таком типе заболевания больные крайне редко доживают до взрослого возраста.
К причинам приобретенных гемолитических анемий относятся следующие:
- воздействие ядов;
- ожоги;
- чрезмерное воздействие химических веществ;
- гемолиз при воздействии холодовых агглютининов;
- бактериальные и паразитарные инфекции;
- некоторые лекарственные средства (Хинин, Фенацетин, антималярийные препараты, Фенилгидразин, Ацетанилид);
- иммунные причины, как выработка защитных антител к своим же кровяным тельцам (реакция на сбой иммунитета) или групповая несовместимость при переливании крови.
Гемоглобин отвечает за поступление кислорода к клеткам и если его количество резко уменьшилось, то организм страдает от гипоксии разной степени. Симптомы анемии любого вида включают в себя:
- слабость;
- бледность кожных покровов, слизистых оболочек;
- желтуху;
- тахикардию;
- спленомегалию;
- гепатомегалию;
- повышение температуры тела;
- повышенную вязкость крови, из-за чего образовываются тромбы, и нарушается кровообращение организма;
- расстройства сознания;
- головокружение;
- судороги;
- покалывание в конечностях;
- одышку;
- темную мочу.
Такие симптомы, как желтуха, увеличение печени, появляются из-за того, что при распаде эритроцитов в крови повышается уровень непрямого билирубина. Желтый цвет коже придает как раз таки билирубин.
Симптомы анемии в случаях врожденной формы могут проявиться не сразу, иногда это происходит уже в период подросткового возраста.
Гемолитическая анемия может привести к ряду осложнений и последствий, среди которых отмечают следующие:
- Синдром диссеминированного внутрисосудистого свертывания, который характеризуется образованием тромбов в сосудах вместе с несвертываемостью крови, что приводит к массивным и множественным кровоизлияниям.
- Анемический шок – один из видов гипоксической комы, которая наступает при анемии тяжелой степени. Клеточное дыхание резко ухудшается из-за недостатка кислорода или блокировки дыхательных ферментов.
- Арегенераторный криз – резкое ухудшение функций костного мозга с преимущественным поражением эритроидного листка кроветворения.
- Острая почечная недостаточность.
- Гемосидероз внутренних органов – нарушение обменных процессов в организме из-за чрезмерного содержания пигмента гемосидерина в клетках ткани. Образование этого пигмента зависит от распада гемоглобина.
- Разрыв и инфаркт селезенки.
- Развитие сердечно-сосудистой недостаточности.
Протекание и исход заболевания зависят от вида анемии, тяжести протекания кризов и полноты патогенетической терапии. В большинстве случаев приобретенная анемия при устранении причин и полноценном лечении заканчивается полным выздоровлением.
С врожденной гемолитической анемией немного сложнее – её полного излечения добиться нельзя, но можно прийти к длительной ремиссии. В случае развития почечной недостаточности и других осложнений прогноз неблагоприятен.
Врачи рекомендуют в обязательном порядке, даже при отсутствии симптомов, сдавать общий анализ крови, который помогает выявить ряд заболеваний и анемию в том числе. А уже дальше при помощи дополнительных анализов определить тип и причину болезни.
Гемолиз эритроцитов делится на внутриклеточный и внутрисосудистый. Крайне важно определить, какой именно вид болезни прогрессирует, чтобы доктор понимал, в каком направлении искать причину разрушения эритроцитов.
Внутриклеточную гемолитическую анемию исследуют при помощи таких лабораторных анализов:
- гемоглобинемия – помогает определить уровень свободного гемоглобина в крови;
- гемоглобинурия – определяет уровень наличия в моче неизменённого гемоглобина;
- гемосидеринурия – показывает наличие в почках продукта окисления – гемосидерина.
Внутрисосудистую анемию выявляют такими лабораторными анализами:
- общий анализ крови – определяет снижение количества эритроцитов или гемоглобина;
- мазок периферической крови – показывает аномалии строения эритроцитов;
- биохимический анализ – помогает отслеживать увеличение общего билирубина.
Определение причины появления болезни может занять огромное количество времени, поэтому врачу следует собрать анамнез – выяснить места, в которых бывал больной, в каких условиях он живёт, где работает и какие симптомы у себя наблюдал. Если данная информация отсутствует, то назначается ряд анализов:
- Циркулирующие иммунные комплексы.
- Электрофорез гемоглобина – проводят для исключения качественных и количественных гемоглобинопатий.
- Прямой и непрямой тест Кумбса – реакция на определение антител к эритроцитам.
- Осмотическая резистентность эритроцитов – при врожденной форме анемии можно наблюдать снижение осмотической резистентности. При талассемии, наоборот, можно увидеть увеличение показателя.
- Исследование активности ферментов эритроцитов – помогает найти искомые ферменты. Количественное определение ферментов помогает отследить их снижение по отношению к нормальным значениям.
- Проба Хема и проба Хартмана – определяют продолжительность существования эритроцитов. Проба Хартмана считается положительной, если разрушается более 4% эритроцитов, а Хема – более 5%.
- Исследование «толстой капли» крови – выявляет возбудителей малярии, жизненный цикл которых связан с разрушениями эритроцитов.
- Проба на тельца Гейнца – помогает обнаружить в мазке крови нерастворимый гемоглобин. Анализ осуществляется для подтверждения дефицита Г-6-ФДГ.
- Проба на серповидность эритроцитов – определяет изменение формы эритроцитов по мере снижения парциального давления кислорода в крови. Если тельца принимают форму серпа, то диагноз считается подтвержденным.
- Бактериологический посев крови – определяет виды циркулирующих в крови инфекционных агентов, которые связываются с тельцами и вызывают их разрушение.
- Миелограмма – результат пункции головного мозга. Позволяет обнаружить злокачественные заболевания. Также определяет разрастание эритроидного ростка, что свидетельствует о высоких темпах компенсаторной продукции эритроцитов.
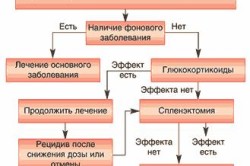
Лечение гемолитической анемии делится на два способа – при помощи медикаментов и оперативного вмешательства:
- Серповидноклеточная анемия лечится при помощи переливаний эритроцитарной массы и кровезаменителей. Важно, чтобы пациент не спровоцировал гемолитический криз.
- Аутоиммунная гемолитическая анемия – в первую очередь, следует определить фактор, который привел к этой форме болезни. Сделать это удается нечасто, поэтому назначают препараты, которые смогут притормозить выработку антител и предупредить разрушение красных кровяных телец.
- Гемолитическая анемия новорожденного – отслеживают наличие у матери ребёнка антител в качестве мер профилактики. Женщины, у которых резус-фактор отрицательный, должны на постоянной основе делать анализ крови, чтобы своевременно выявлять появление антител и вводить антирезусные иммуноглобулины.
Для лечения гемолитической анемии назначают препараты из следующих групп:
- Глюкокортикостероиды снимают воспаление. Обладают побочными эффектами, поэтому для профилактики назначают также витамины группы В и препараты, которые понижают кислотность желудочного сока.
- Иммунодепрессанты подавляют аутоиммунные реакции. Назначают на последней линии лечения.
Рассмотрим, какие препараты назначаются:
- Преднизолон – глюкокортикоидный гормон. Принимают внутривенно или через капельницу по 1-2 мг/кг/сутки. В зависимости от того, как показатели будут приходить в норму, дозу медленно понижают до 20-30 мг в сутки. Такое лечение длится месяца 3-4, после чего дозу понижают до 5 мг каждые 2-3 дня, пока полностью не отменят.
- Надропарин – коагулянт длительного действия. Назначают больным в стабильном состоянии для профилактики тромбоэмболических осложнений. Вводят препарата 0,3 мл/сутки подкожно под контролем коагулограммы.
- Фолиевая кислота – витамин, который назначают для восполнения его запасов в организме. Для начала назначают по 1 мг/сутки, а потом увеличивают до появления стойкого клинического эффекта (максимум – 5 мг).
- Гепарин – прямой коагулянт короткого действия (4-6 часов). Его назначают в качестве профилактики ДВС или при нестабильном состоянии пациента для контроля свертываемости. Вводят по 2 500-5 000 МЕ подкожно каждые 6 часов.
- Пентоксифиллин – периферический вазодилататор, который помогает увеличить доступ кислорода к периферическим тканям. Способ применения – по 400-600 мг/сутки по 2-3 раза внутрь на протяжении 2-х недель. Сроки лечения – 1-3 месяца.
- Витамин В12 назначают для восполнения этого витамина в организме из-за хронического гемолиза, который истощает его запасы. Вводят 100-200 мкг/сутки внутримышечно.
- Хлористый калий восполняет ионы калия, которые из организма выводятся из-за лечения глюкокортикоидами. Применяют 2-3 г в сутки под контролем ионограммы.
- Азатиоприн – иммунодепрессант. Применяют по 100-200 мг/сутки на протяжении 2-3 недель.
- Ранитидин снижает воздействие Преднизолона на слизистую желудка. Принимают по 300 мг в сутки в 1-2 приема внутрь.
- Циклоспорин А – иммунодепрессант, который назначают в качестве последней линии лечения, когда прием глюкокортикоидов и спленэктомия являются неэффективными. Применяют по 3 мг/кг/сутки внутривенно капельно. При наличии побочных эффектов переходят на другой препарат.
- Циклофосфамид – иммунодепрессант. Применяют по 100-200 мг/сутки на протяжении 2-3 недель.
- Винкристин – иммунодепрессант. Используют 1-2 мг/неделю в течение 3-4 недель.
В случае отсутствия эффекта от лечения медицинскими препаратами назначают хирургическое вмешательство – операцию по частичному или полному удалению селезенки (спленэктомию).
Показаниями к данной операции являются:
- гемолитическая анемия;
- эритроцитопатия;
- идиопатическая тромбоцитопеническая пурпура;
- лимфома;
- миелолейкоз;
- миелофиброз;
- апластическая анемия.
Селезенка помогает формировать иммунную систему человека, бороться с микробами и инфекциями, фильтровать кровь и регулировать её поступление к печени. В случае повреждения органа или поражения её болезнью может появиться надобность в операции.
Проводят спленэктомию под общим наркозом и используют для этого инструмент с камерой и лампочкой на конце (лапароскоп). На брюшной полости делается надрез, через который хирург и вводит лапароскоп, а через другие надрезы вводятся иные инструменты. После спленэктомии, которая была проведена при помощи лапароскопа, восстановление происходит гораздо быстрее, чем после открытой, которая предполагает большой надрез в центре или слева от брюшной полости.
Селезенка удаляется через надрез, после чего пациенту накладывают швы. Самым частым осложнением, связанным со спленэктомией, является развитие внутренней бактериальной инфекции, которая способна поразить весь организм.
После удаления селезенки организм хуже справляется с функцией фильтрации крови от вирусов и бактерий. Помочь организму можно при помощи вакцинации против определенных инфекций.
Из других осложнений спленэктомии выделяют:
- тромбообразование;
- негативную реакцию на анестезию;
- значительную потерю крови;
- проблемы с дыханием.
Полное восстановление после операции занимает около 4-6 недель, в больнице пациент находится около недели.
Предупредить развитие гемолитической анемии помогают следующие профилактические мероприятия:
- ежедневные прогулки на свежем воздухе;
- правильное и сбалансирование питание;
- еще на стадии планирования беременности выяснить резус-фактор обоих партнеров;
- питание по 5-6 раз небольшими порциями;
- консультирование семей с наличием наследственных гемолитических анемий;
- употребление поливитаминов;
- не принимать бесконтрольно лекарственные препараты;
- проведение вакцинации.
Гемолитическая анемия у ребёнка может быть наследственной или приобретенной. Наследственная гемолитическая анемия у детей проявляется из-за нарушения мембраны эритроцитов, их ферментопатии или нестабильности гемоглобина. К этой группе относится микросфероцитарная анемия, которая наследуется по аутосомно-доминантному типу. Проявляется:
- гемолизом различной активности;
- сфероцитозом;
- снижением осмотической стойкости эритроцитов;
- спленомегалией.
Несфероцитарные анемии, возникающие из-за дефицита ферментов, сопровождаются:
- базофилией;
- гемолизом с неспецифическими изменениями морфологии эритроцитов;
- полихромазией;
- сфероцитозом.
Причины изоиммунных гемолитический анемий у детей следующие:
- аутоиммунная гемолитическая анемия у матери;
- гемолитическая болезнь у новорожденных;
- несовместимость эритроцитов по системе АВО и резус-фактору.
Дети легко поддаются таким заболеваниям, так как их органы кроветворения ещё не сформировались до конца. У детей, которых кормят грудью, анемия проявляется гораздо реже, чем у детей на искусственном вскармливании. Также на процесс кроветворения влияет нехватка в пище нужных микроэлементов.
У грудных детей из-за анемии может развиться ядерная желтуха, у детей в возрасте от 1-го месяца – хронический гепатит, цирроз или желчнокаменная болезнь. У детей с тяжелым протеканием болезни может также возникнуть гемосидероз.
Диагностируют анемию у детей благодаря тесту на содержание в крови эритроцитов и гемоглобина – его в артериальной крови должно быть меньше, чем в венозной. Также возможно проведение лабораторных исследований для выявления макроцитоза эритроцитов, ретикулоцитоза. Фиксируют снижение осмотической стойкости и повышенное содержание билирубина в сыворотке крови. Проводят прямую и непрямую пробу Кумбса.
К элементам комплексного лечения анемии относятся:
- правильное питание;
- продукты антиоксидантного действия;
- фитопрепараты.
Меры профилактики при гемолитической анемии у детей заключаются в следующем:
- регулярные осмотры у педиатра;
- полноценное питание;
- прогулки;
- режим сна;
- закаливание;
- массаж;
- гимнастика.
Гемолитическая анемия представляет собой разрушение циркулирующих в крови эритроцитов, что может привести к серьезным последствиям в организме больного. Если болезнь была диагностирована, следует прибегнуть к адекватному лечению. А для предупреждения гемолитической анемии соблюдайте нужные меры профилактики.
источник
Снижение концентрации гемоглобина в крови называется малокровием (анемией). Это не болезнь, а симптом. Анемию, при которой происходит разрушение эритроцитов (красных кровяных телец), называют гемолитической. Под этим названием объединена целая группа заболеваний крови.
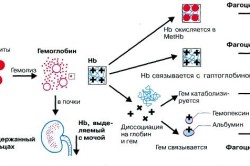
Ускоренный процесс разрушения эритроцитов называется гемолизом. Анемия гемолитическая – это общее название патологий, при которых происходит аномальный распад красных кровяных телец. Механизм развития патологического процесса связан с нарушением целостности оболочки эритроцитов. В силу разных причин (механических, токсических факторов) они разрушаются внутри сосудов или в селезенке, лимфатических узлах, костном мозге, печени.
Гемолитический синдром – это редкое заболевание. Частота встречаемости составляет 2 случая на 19000 человек. В основном диагностируется наследственная гемолитическая анемия, но болезнь может развиваться и в зрелом возрасте. Согласно статистике, мужчины болеют анемией в 2 раза чаще женщин.
Роль красных кровяных телец в организме человека разнообразна:
- Обеспечивают дыхание тканей. Кровь, проходя через легкие, обогащается кислородом за счет гемоглобина, который составляет 97% от общей массы эритроцита.
- Доставляют к клеткам тканей активные биологические компоненты и питательные вещества.
- Осуществляют функцию очищения и удаление диоксида углерода. Отходы жизнедеятельности организма эритроциты с током венозной крови переносят в почки для выведения наружу и в печень для утилизации.
- Поддерживают нормальный уровень pH. Гемоглобин выводит углекислоты, снижая кислотность в организме.
Жизненный цикл красных телец включает три периода: созревание (эритропоэз), нахождение в кровяном русле и разрушение (эритродиерез). Время жизни кровяных телец ограничено – от 100 до 120 дней. В процессе выполнения своих функций эритроциты стареют, уменьшается их активность, удельный вес, величина поверхностного заряда и кислотная стойкость.
Место разрушения эритроцитов не имеет четкой локализации. Около 90% старых кровяных телец распадаются внутри купферовских печёночных клеток, в костном мозге или селезенке (внесосудистый гемолиз). Остальные 10% погибают внутри сосудов (внутрисосудистый гемолиз). При наличии гемолитического синдрома время жизни эритроцитов составляет от 12 до 14 суток.
Самое страшное последствие гемолитической болезни – летальный исход. К числу общих осложнений заболевания относятся:
- кома;
- спутанность сознания;
- коллапс;
- желтуха;
- гемолитические кризы;
- инфаркт селезенки или разрыв органа;
- острая почечная, сердечно-сосудистая недостаточность;
- желчнокаменная болезнь;
- гангрена пальцев;
- снижение артериального давления;
- олигурия (пониженная выработка мочи).
Гемолитические заболевания делятся на две группы: наследственные (врожденные) и приобретенные. Первые классифицируются по генетическим факторам. Врожденная форма заболевания имеет хроническое течение и обусловлена особенностями организма, которые передаются по наследству. Приобретенная анемия развивается при внутрисосудистом гемолизе эритроцитов. Такая форма заболевания легче поддается лечению.
Медики выделяют несколько видов наследственного гемолитического синдрома:
- Несфероцитарный (ферментопения). Причиной распада кровяных клеток является плохая активность ферментов, которые отвечают за жизненный цикл эритроцитов.
- Мембранопатия. Ускоренное разрушение происходит из-за дефекта оболочки эритроцитов, который обусловлен генетически.
- Микросфероцитарный (Минковского-Шоффара). Недуг развивается вследствие мутации генов, которые отвечают за образование белков в стенках эритроцитов.
- Гемоглобинопатия (талассемия). Характеризуется нарушением структуры и/или продуцирования гемоглобина.
Иммунные виды заболевания подразделяются на четыре:
- Аутоиммунная гемолитическая анемия. Кровяные клетки разрушаются собственной иммунной системой.
- Изоиммунная анемия. Развивается после переливания крови, несовместимой по резус-фактору или группе. Такой конфликт может развиваться у плода (гемолитический синдром новорожденных).
- Гетероиммунная анемия. Характеризуется появлением чужеродных антигенов в мембране клетки. Развивается после вирусных инфекций или при употреблении некоторых лекарственных средств.
- Трансиммунная анемия. Появляется еще в утробе. Болезнь развивается у плода, если у беременной аутоиммунная анемия.
Представителем приобретенной мембранопатии является болезнь Маркиафавы-Микели. Патология характеризуется формированием малого процента эритроцитов, у которых нарушена мембрана. Анемии, вызванные токсоплазмой или плазмодием малярии, тоже относятся к приобретенной форме заболевания. Патогенные микроорганизмы используют кровяные клетки в качестве субстрата для размножения и роста.
К группе приобретенных анемий механического разрушения красных телец относят:
- Маршевую. Развивается при длительном хождении из-за сдавления подошв.
- Микроангиопатическую. Возникает из-за сужения просвета сосудов.
- При пересадке сердечных клапанов. Анемия развивается при столкновении медицинского пластика или металла с эритроцитами.
Клиническая картина патологии отличается разнообразием – от субклинического течения до тяжелого состояния с гемолитическими кризами. Классические симптомы заболевания проявляются при внутриклеточном гемолизе – это желтушность кожи, слизистых оболочек, склер. Желтуха сопровождается интенсивно окрашенными выделениями: темной мочой и калом. У больных увеличена селезенка, реже – печень.
Характеризуются задержкой роста у ребенка, бледностью кожи, слабостью, приступами обострения холецистита и желчной колики. Манифестация микросфероцитарной врожденной анемии возникает в любом возрасте (старости, юношестве, младенчестве). Признаки врожденной дисплазии:
- аномалия прикуса;
- седловидная деформация носа;
- готическое небо;
- башенный череп;
- брахидактилия (укорочение пальцев);
- косоглазие;
- полидактилия (увеличенное количество пальцев).
Болезнь проявляется анемическим или гемолитическим синдромом. Основные симптомы приобретенной формы заболевания:
- головокружение;
- одышка;
- частый пульс;
- болезненность в левом подреберье;
- послабление стула;
- крапивница;
- боли в животе, грудной клетке, области почек, костях.
Заболевание обусловлено множеством факторов, среди которых увеличение селезенки, механические препятствия в кровотоке, аутоиммунные реакции. Основные причины гемолитической анемии:
- попадание ядов и токсинов в кровь;
- генетические аномалии;
- воздействие химических веществ;
- переливание крови;
- тяжелые гнойные инфекции;
- беременность;
- активность паразитов;
- врожденный порок сердца;
- гепатит B;
- хронический гломерулонефрит;
- острый лейкоз;
- авитаминоз и прочие.
Постановка диагноза проводится врачом-гематологом. Первичный этап обследования – сбор анамнестических данных и осмотр пациента. Доктор оценивает степень бледности кожи и слизистых, проводит пальпацию живота для определения увеличения селезенки, печени. Второй этап диагностики – инструментальные и лабораторные исследования:
- Биохимия крови. Определяет увеличение общего билирубина.
- Анализы кала и мочи. Выявляют такие патологии, как уробилинурия, гемоглобинурия, протеинурия, гемосидеринурия.
- Миелограмма. При исследовании клеток костного мозга (полученных при стернальной пункции) выявляется/исключается гиперплазия (увеличение) его клеток.
- УЗИ брюшной полости. Проводится для определения размеров печени и селезенки.
- Биопсия костного мозга (по показаниям). Назначается для выявления характера патологических клеток.
- Пробы крови (Хема, на тельца, Гейнца, серповидность эритроцитов). Берутся для определения причины патологического процесса.
Терапевтическая тактика зависит от формы заболевания. Основа лечения аутоиммунного гемолитического синдрома – прием гормональных средств. Лечение глюкокортикоидами длительное. Гормоны купируют обострения. Их пьют и в качестве поддерживающей терапии.
Если разрушение эритроцитов происходит быстро, и на длительное лечение нет времени, то пациенту переливается донорская кровь. При наследственном микросфероцитозе применяют спленэктомию (удаление селезенки). При токсической анемии проводится гемодиализ (очищение крови).
Группы применяемых лекарственных препаратов:
- Глюкокортикоидные гормоны. Гормональная терапия сокращает или прекращает гемолиз при аутоиммунной форме заболевания (Преднизолон, Адвантан).
- Антикоагулянты. Используются для профилактики тромбообразования и усиления свертываемости крови (Гепарин, Надропатин).
- Вазодилататоры. Назначают для увеличения поступления кислорода к тканям (Пентоксифиллин, Молсидомин).
- Иммунодепрессанты. Применяются при неэффективности проведенной спленэктомии и/или гормональной терапии (Циклоспорин А, Винкристин).
- Антиагрегатрные препараты. Используются для устранения риска тромбообразования (Аспирин, Тромбопол).
- Витамины. Назначаются для восполнения их запасов (Фолиевая кислота, Витамин В12).
Удаление селезенки проводится при рецидиве аутоиммунного гемолитического синдрома, который происходит после длительной терапии глюкокортикостероидами или при признаках гиперспленизма (разрушения органа). Также этот метод лечения медики выбирают при наследственных формах анемии (овалоцитозе, акантоцитозе, сфероцитозе).
Оптимальный возраст ребенка для проведения спленэктомии – 4-5 лет. У взрослого операция проводится без возрастных ограничений по показаниям. Способы осуществления вмешательства:
- полостной через разрез брюшины;
- лапароскопический через несколько маленьких отверстий в животе.
Исход болезни зависит от тяжести ее протекания, формы анемии и состояния иммунной системы пациента. Приобретенные гемолитические синдромы при правильном лечении полностью устраняются. Врожденные патологии излечению не подлежат, но можно достигнуть длительной ремиссии. При тяжелых осложнениях болезни (почечная, сердечная недостаточность и другие) прогноз неблагоприятен.
Предупредить развитие гемолитической болезни помогут меры профилактики:
- Избегание инфекционных заболеваний.
- Отказ от вредных привычек.
- Регулярные занятия спортом.
- Сбалансированное питание.
- Адекватное использование лекарственных средств.
- Определение резус-фактора партнеров на стадии планирования зачатия.
- Генетическое консультирование носителей патологических генов.
источник
Большинство пациентов при постановке диагноза гемолитическая анемия задаются вопросом о том, гемолитическая анемия что это такое, как она проявляется и каковы способы ее лечения. Этот вид заболевания может развиваться не только у человека, но и практически у всех видов теплокровных животных, например, собак и кошек.
Среди заболеваний крови выделяется одна группа заболеваний, имеющих общее наименование гемолитическая анемия (anaemia haemolytica). Дословно «haemolytica» переводится как «распад крови» и характеризуется следующим признаками:
- разрушение эритроцитов;
- анемия (малокровие);
- увеличение содержания в крови продуктов распада эритроцитов;
- многократное усиление эритропоэза — процесса кроветворения, в результате которого образуются эритроциты — красные клетки крови.
Признаки гемолитической анемии проявляются не сразу, а после того, как становится заметной разница между разрушением клеток и их полиферацией (процесс разрастания тканей), при этом происходит истощение компенсаторной функции красного костного мозга.
Особенностью процесса образования, функционирования и распада эритроцитов является их чрезвычайная сложность. Проблемы могут возникнуть на любом уровне каждого из этих этапов. С учетом этого составлена классификация гемолитических анемий.
В зависимости от способа приобретения все виды развивающихся анемий подразделяются на две большие группы: наследственные и приобретенные.
- Гемолитическая анемия Минковского-Шоффара, или микросфероцитарная. Болезнь развивается из-за мутации в генах, отвечающих за образование белков, из которых состоят стенки эритроцитов. Такая мембрана приводит к накоплению внутри эритроцита воды и чрезмерного количества ионов натрия. В результате нарушаются структура клетки, срок ее функционирования и устойчивость к разрушению. Эритроциты превращаются в сфероциты, которые не способны проходить в узкие просветы. Это вызывает застой эритроцитов, что приводит к образованию микросфероцитов.
- Талассемия вызывает «сбои» в образовании гемоглобина. Результатом становится нарушение белковых цепей, раннее окисление, продукты которого воздействуют на мембрану эритроцитов, разрушая ее.
- Несфероцитарная характеризуется ускорением гибели эритроцитов из-за низкой активности специальных ферментов, необходимых для поддержания их жизнедеятельности. Обычно развивается, если кроме повреждения хромосомы наблюдается недостаток фермента глюкозо-6-фосфатдегидрогеназы.
- Серповидноклеточная анемия возникает при нарушении генов, отвечающих за синтез гемоглобина. В итоге клетки образуются нехарактерной серповидной формы эритроцита, они не способны изменять форму, в результате чего быстро погибают.
Второй группой недугов являются заболевания, относящиеся к приобретенным формам анемий
- Гемолитическая болезнь при резус-конфликте. Обычно возникает у новорожденных, когда резус-фактор матери и плода отличается. В организме матери с отрицательным резус-фактором образуются антитела к красным кровяным клеткам плода, имеющим на поверхности антиген. В итоге образуются комплексы, которые начинают разрушать эритроциты.
- Гемолиз под влиянием различных воздействий. Здоровые кровяные клетки могут разрушаться под действием лекарственных препаратов, ядов и токсичных веществ промышленных предприятий, интоксикаций, протекающих во время тяжелых болезней.
- Аутоиммунная — на поверхности эритроцитов оседают антитела, в результате чего клетки определяются как чужеродные и уничтожаются клетками иммунной системы человека.
- Травматически приобретенные — клетки разрушаются во время циркуляции по сосудам. Причина может заключаться в искусственных клапанах сердца, протезах, поражении сосудов и аорты и т.п.
Еще одним заболеванием является острая пароксизмальная ночная гемоглобинурия. Это заболевание встречается достаточно редко. Характеризуется приступами, возникающими в результате разрушения эритроцитов.
Причины возникновения гемолитической анемии не всегда поддаются лечению, вследствие чего проявление симптомов может усугубиться. Поэтому необходимо знать признаки, которые могут спровоцировать развитие заболевания.
- Различные виды наследственной анемии возникают из-за дефектов хромосом. Они влияют на правильность протекания процесса формирования кровяных клеток, гемоглобина, а также на структуру и активность ферментов у взрослого человека, ребенка или даже плода. Виды врожденной гемолитической анемии передаются по наследству от больных родителей, но при этом наследуют это заболевание не все дети.
- Приобретенные заболевания, то есть аутоиммунная гемолитическая анемия, возникают из-за нарушений соединительной ткани и сосудов: ревматизм, красная волчанка, артрит и т.д.
- Сложные инфекционные, вирусные заболевания, в т.ч. малярия.
- Несовпадение резус-фактора матери и плода.
- Заболевания кровеносной системы: лейкоз разных типов.
- Искусственные протезы: клапаны сердца, шунты и т.д.
- Контакт с опасными химическими веществами, например, на промышленных производствах.
- Медикаменты: противовоспалительные, антибактериальные и др. препараты.
Признаки анемии могут проявиться только при ускоренном разрушении эритроцитов. Степень проявления заболевания зависит от того, насколько быстро протекает этот процесс.
Симптомы гемолитической анемии проявляются через несколько синдромов:
- Желтуха. Кожа приобретает желтый оттенок. Цвет урины меняется на темный, может приобрести черный оттенок. Цвет кала не изменяется, что позволяет отличить «гемолитическую» желтуху от механической.
- Анемия. Характеризуется бледностью кожи и слизистой, возникают симптомы недостатка кислорода: одышка, учащенное сердцебиение, общая слабость, снижение тонуса мышц, головокружение.
- Спеленомегалия. Печень и селезенка увеличиваются в размерах. В более чем 70% случаев при осмотре фиксируется выступание печени над ребрами до 2 см.
- Гипертермия. Наблюдается повышение температуры тела до 38 градусов. В этот период уровень разрушения эритроцитов достигает максимума. Обычно таким образом гемолитическая анемия проявляется у детей.
В зависимости от вида течения заболевания различают компенсированную, выраженную анемизацию и кризисную анемию. На последнем этапе отмечается общее тяжелое состояние.
Застой и сгущение желчи провоцируют образование в желчном пузыре конкрементов. Это приводит к тому, что у больных часто фиксируются симптомы цистита, гепатита, холангита, а именно озноб, рвота, тошнота, повышение температуры на некоторый срок, в подреберье возникает острая боль.
При разрушении эритроцитов внутри кровеносных сосудов обычно чаще проявляется анемия. Желтуха, спеленомегалия обнаруживаются гораздо реже.
Общими симптомами кризиса во время гемолитической анемии считаются слабость, ощущение недостатка воздуха, частое сердцебиение, озноб, головные боли, боль в области поясницы и верхней части живота, рвота (не относящаяся к пище).

Первые проявления гемолитической анемии обычно появляются в раннем детстве. Главным признаком становится иктеричность кожи и слизистой, то есть желтушность. В сочетании с этим симптомом могут проявляться и некоторые внешние черты, вызванные аномалиями развития: нос седловидной формы, твердое небо расположено высоко, изменение формы черепа. Прогноз в подобных случаях врач может дать только после проведения спленэктомии — удаления селезенки.
Могут проявляться и другие гемолитические анемии у детей, особенно часто — талассемия. Характерные симптомы можно распознать еще у новорожденных: анемичный синдром, отклонения психического и физического развития. Наблюдаются аномалии: плоская переносица, лицо монголоидного типа, череп квадратной формы.
Одна из наиболее серьезных проблем — приобретенная анемия у новорожденных, вызванная несовпадением резус-факторов матери и плода. Важно вовремя выявить саму возможность возникновения проблемы, и первичные признаки гемолиза у плода.
- уменьшении количества красных клеток крови;
- снижении концентрации гемоглобина;
- наличии клеток неправильной формы;
- количестве ретикулоцитов — «незрелых» кровяных клеток.
Дополнительно назначаются другие способы диагностики: анализ мочи, пункция костного мозга, биохимическое исследование крови и анализ на протекание гемолиза.
В зависимости от вида заболевания, возможны различные варианты лечения. При микросфероцитарной анемии применяют спленэктомию, если есть показания к такой операции: печеночные колики, выраженность заболевания, частые обострения заболевания. После удаления селезенки во многих случаях удается добиться полной ремиссии. При этом заболевание не повторяется, даже если в крови есть микросфероциты, а сами красные клетки крови сохраняют болезнетворные свойства.
Для лечения талассемии проводят переливание крови. С его помощью корректируют общее состояние крови, чтобы уровень гемоглобина сохранялся на уровне 85 г/л. Параллельно выводится излишек железа.
Второй возможный способ лечения — пересадка костного мозга. Возможна и радикальная спленэктомия, но к такому способу прибегают крайне редко, только при сильном увеличении селезенки или тяжелой форме гемолиза. В основном, предпочтение отдается бескровным методам лечения.
Приобретенная гемолитическая анемия поддается лечению гораздо лучше. Обычно для остановки распада эритроцитов используют препараты с глюкокортикоидным гормоном. В большинстве случаев наблюдается устойчивая ремиссия. В этом случае количество гормона начинают постепенно снижать до 5-10 мг/день. Все лечение может занять до трех месяцев и позволит полностью устранить клинические проявления приобретенной анемии. В отдельных случаях дают хороший эффект препараты против малярии и иммунодепрессанты.
Если эффект от препаратов не наблюдается, либо начинается рецидив, больному назначается спленэктомия.
источник
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии— анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
источник


