Сущность Biz-дефицитной анемии (В12ДА) состоит в нарушении образования дезоксирибонуклеиновой кислоты (ДНК) в связи с нехваткой в организме витамина Bi2 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутри-костномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменению ряда органов и систем (пищеварительный тракт, ЦНС).
Этиология.В12ДА встречается значительно реже, чем ЖДА, и может быть вызвана следующими причинами:
1) нарушением секреции гастромукопротеина («внутренний фактор»)
при наследственно обусловленной атрофии желез желудка (пернициозная
анемия, или болезнь Аддисона — Бирмера), при органических заболева
ниях желудка (полипоз, рак), после гастрэктомии;
2) повышением расхода витамина Bi2 (инвазия широкого лентеца, ак
тивация кишечной микрофлоры при дивертикулезах тонкой кишки);
3) нарушением всасывания витамина Bi2 (органические заболевания
кишечника — спру, илеит, рак, состояние после резекции кишки, наслед
ственное нарушение всасывания — болезнь Имерслунд—Гресбека);
4) нарушением транспорта витамина Вп (дефицит транскобаламина);
5) образованием антител к «внутреннему фактору» или комплексу
«внутренний фактор» + витамин В12-
Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.).
Патогенез.Витамин В(2 состоит из двух коферментов — метилкоба-ламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего деление и созревание клеток красного ряда нарушаются, они избыточно растут, не утрачивая ядра. Большие клетки, содержащие ядра, называются мегалобласта-ми, они не созревают до мегалоцитов (гигантские эритроциты без ядер), легко гемолизируются, еще находясь в костном мозге. Дефицит витамина В(2 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного рядов, но это не так заметно сказывается на морфологии и количестве клеток, как нарушения эритропоэза.
При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов пропионовой и метилмалоновой кислот: развивается поражение заднебоко-вых канатиков спинного мозга — фуникулярный миелоз (схема 26).
Клиническая картина.Проявления В^ДА, как это вытекает из схемы патогенеза, складываются из следующих синдромов: 1) циркуляторно-ги-поксического (при достаточной выраженности анемии и кислородного голодания тканей); 2) гастроэнтерологического; 3) неврологического; 4) гематологического (анемия гиперхромного типа).
Кроме этих синдромов, клиническая картина будет определяться также заболеванием, на основе которого развилась В^ДА.
На I этапе диагностического поиска при достаточно выраженной анемии могут наблюдаться симптомы, обусловленные циркуляторно-ги-поксическим синдромом (слабость, повышенная утомляемость, одышка при физической нагрузке, болевые ощущения в области сердца, сердцебиения). В случае нерезкого кислородного голодания тканей эти жалобы могут отсутствовать. Снижение аппетита, отвращение к мясу, боли в кончике языка и жжение, чувство тяжести в эпигастрии после еды, чередование поносов и запоров обусловлены поражением пищеварительного тракта и, в частности, выраженной секреторной недостаточностью желудка. При поражении ЦНС больные жалуются на головную боль, неустойчивую походку, зябкость, чувство онемения в конечностях, ощущение «ползания
| Схема 26. Патогенез В12-дефицитной анемии |
мурашек». Выраженность этих жалоб не всегда соответствует степени анемии, в период ремиссии заболевания жалобы могут отсутствовать. Весьма существенно, если все перечисленные жалобы предъявляет немолодой человек, в этих случаях вероятность В12ДА повышается.
В семейном анамнезе у больных с предполагаемой В12ДА могут быть больные с данным заболеванием. Злоупотребление алкоголем может быть одной из причин развития анемии.
Данные анамнеза могут помочь в предположении патогенетического варианта анемии. Развитие анемии после пребывания больного возле больших водоемов и употребления в пищу сырой или недостаточно обработанной рыбы заставляет предположить в качестве возможной причины дифилло-ботриоз. Если заболевание возникло у пожилого человека, страдающего хроническим гастритом, и развивается медленно, то можно думать о В12ДА. В случае, если симптомы со стороны пищеварительного тракта сочетаются со снижением массы тела и быстро прогрессируют, следует предположить в качестве причины заболевания злокачественное новообразование.
Наконец, сведения об успешном лечении больного витамином Bf2 позволяют с большой уверенностью рассматривать имеющуюся симптоматику как проявление В^ДА.
На II этапе диагностического поиска симптомы могут быть обусловлены поражением пищеварительного тракта и ЦНС. Кроме того, ряд неспецифических признаков повышает вероятность предположения о наличии у больного В12ДА. Так, бледность кожных покровов в сочетании с небольшой иктеричностью склер и одутловатостью лица наблюдается при В12ДА. Масса тела таких больных, как правило, нормальная или повышенная. Однако снижение массы тела может указывать на злокачествен-
ную опухоль как возможную причину ВпДА. Аналогичное значение имеет обнаружение увеличенного плотного лимфатического узла (метастаз опухоли?). Циркуляторно-гипоксический синдром проявляется так же, как и при ЖДА (расширение границ сердца влево, тахикардия, систолический шум, шум «волчка» на яремных венах).
Несомненное диагностическое значение имеет обнаружение при исследовании пищеварительного тракта признаков глоссита: сглаженные сосочки вплоть до полной их атрофии («полированный» язык). Печень несколько увеличена, может прощупываться селезенка. Однако все эти симптомы не являются обязательными для В12ДА. Отмечаются нарушения глубокой чувствительности, нижний спастический парапарез (картина псевдотабеса). Следует заметить, что изменения нервной системы наблюдаются далеко не во всех случаях, так что их отсутствие не исключает диагноза В12ДА.
Таким образом, данные II этапа в сочетании с анамнестическими данными и жалобами больного, хотя и выявляют ряд основных симптомов В12ДА, но дают основание лишь заподозрить эту форму болезни. Окончательный диагноз ставят после проведения серии лабораторных исследований.
На III этапе диагностического поиска при исследовании периферической крови выявляют следующие признаки: снижение количества эритроцитов (менее 310 12 /л), повышение цветового показателя (более 1,1), среднего содержания гемоглобина в эритроците (более 34 пг) и среднего объема эритроцита (более 120 мкм 3 ). Эритроцитометрическая кривая сдвинута вправо — увеличено количество макроцитов, появляются мега-лоциты — эритроциты диаметром более 12 мкм. Форма эритроцитов изменена — пойкилоцитоз. Встречаются единичные мегалобласты.
Дополнительный признак — появление нейтрофилов с гиперсегмен-тированными ядрами.
Если в картине периферической крови не обнаруживают характерных признаков, то производят стерналъную пункцию. Последняя позволяет выявить в костном мозге мегалобластический тип кроветворения.
Важным является определение содержания сывороточного железа: при ВпДА оно может быть в норме или повышено в связи с усиленным гемолизом эритроцитов. В этих случаях увеличено содержание непрямого билирубина. При исследовании желудочного сока часто выявляется гиста-миноустойчивая ахилия (характерный признак анемии Аддисона — Бирме-ра), эндоскопически — атрофия слизистой оболочки желудка.
Другие инструментальные методы исследования помогают обнаружить признаки миокардиодистрофии (развивается на фоне выраженной анемии), а также уточнить этиологию заболевания.
Диагностика. В диагностике В12ДА выделяют два этапа: 1) доказательство дефицита витамина Вп как причины анемии; 2) выявление причин дефицита витамина Bi2.
Критериями ВпДА являются: 1) снижение содержания эритроцитов (менее 3,0-10 12 /л); 2) повышение цветового показателя (более 1,1); 3) повышение содержания гемоглобина в эритроцитах (более 34 пг); 4) увеличение среднего объема эритроцита (более 120 мкм 3 ); 5) сдвиг эритроцитомет-рической кривой вправо (увеличение количества макроцитов, появление ме-галоцитов — эритроцитов диаметром более 12 мкм); 6) появление в мазках пунктата костного мозга элементов мегалобластного кроветворения; 7) по-
вышение содержания сывороточного железа (более 30,4 мкмоль/л); 8) снижение радиоактивности мочи после приема витамина Bi2, меченного радиоактивным кобальтом.
Для выявления причины анемии следует проводить рентгенологическое и эндоскопическое исследование пищеварительного тракта (опухоль желудка, дивертикулез тонкой кишки), гельминтологическое исследование (инвазия широким лентецом), функциональное исследование печени с биопсией (хронический гепатит, цирроз), исследование нейтрального жира в кишечнике (спру).
В12ДА следует дифференцировать от фолиеводефицитной анемии. При дефиците фолиевой кислоты наблюдается макроцитарная гиперхром-ная анемия, а в костном мозге могут обнаруживаться мегалобласты. Следует отметить, что дефицит фолиевой кислоты встречается значительно реже. В отличие от В12ДА при фолиеводефицитной анемии содержание фолиевой кислоты в сыворотке, а также в эритроцитах снижено. Кроме того, при окраске препарата костного мозга ализарином красным окрашиваются только мегалобласты, связанные с дефицитом В^, и не окрашиваются мегалобласты, связанные с дефицитом фолиевой кислоты.
Течение. Заболевание может резко обостриться. В таких случаях развивается коматозное состояние: потеря сознания, снижение температуры тела и АД, одышка, рвота, арефлексия, непроизвольное мочеиспускание. Между развитием коматозного состояния и падением уровня гемоглобина нет четких коррелятивных отношений (у больных с резко сниженным содержанием гемоглобина не наблюдается комы). Главную роль в патогенезе комы играют быстрый темп и степень снижения гемоглобина, резкая ишемия и гипоксия ЦНС.
Формулировка развернутого клинического диагнозаучитывает: 1) этиологию В12ДА (отдельно следует выделять такую форму анемии, как болезнь Аддисона — Бирмера); 2) стадию процесса (рецидив — ремиссия); 3) выраженность отдельных синдромов (обычно при наличии неврологических расстройств, обусловленных фуникулярным миелозом).
Лечение.Комплекс лечебных мероприятий при В12ДА следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения:
• Непременным условием лечения В12ДА при глистной инвазии явля
ется дегельминтизация (для изгнания широкого лентеца назначают
фенасал по определенной схеме или экстракт мужского папоротни
ка).
• При органических заболеваниях кишечника и поносах следует при
менять ферментные препараты (панзинорм, фестал, панкреатин), а
также закрепляющие средства (карбонат кальция в сочетании с дер-
матолом).
• Нормализация кишечной флоры достигается приемом ферментных
препаратов (панзинорм, фестал, панкреатин), а также подбором
диеты, способствующей ликвидации синдромов гнилостной или
бродильной диспепсии.
• Сбалансированное питание с достаточным содержанием витаминов
белка, безусловным запрещением алкоголя — непременное условие
лечения Bir и фолиеводефицитной анемии.
• Патогенетическая терапия осуществляется с помощью парентерального введения витамина Bi2 (ликвидация его дефицита), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В^ (корти-костероидная терапия). Цианкобаламин (витамин Вп) вводят ежедневно внутримышечно в дозе 200 — 500 мкг 1 раз в день в течение 4 — 6 нед до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформации мегалобластического кроветворения в нормобласти-ческое. Появление ретикулоцитарного криза на 5 —б-й день лечения является ранним критерием эффективности его. В процессе лечения цианкобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5 — 2 мес) витамин вводят 1 раз в неделю в течение 2 — 3 мес, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса). В дальнейшем больных ставят на диспансерный учет; профилактически им вводят витамин Bi2 1 — 2 раза в год короткими курсами по 5 — 6 инъекций или ежемесячно по 200 — 500 мкг (пожизненно).
При симптомах фуникулярного миелоза витамин Вп вводят в значительных дозах — 500 — 1000 мкг ежедневно в течение 10 дней, а затем 1—3 раза в неделю до исчезновения неврологической симптоматики.
Гемотрансфузии проводят лишь при значительном снижении гемоглобина и проявлении симптомов коматозного состояния. Рекомендуется вводить эритроцитную массу по 250 — 300 мл (5 — 6 трансфузий).
Преднизолон (20 — 30 мг/сут) рекомендуется при аутоиммунной природе заболевания.
Прогноз.В настоящее время применение витамина Bt2 сделало прогноз В12ДА благоприятным. При адекватной терапии больные живут длительное время.
Профилактика.Мер первичной профилактики не существует. У лиц, имеющих перечисленные ранее этиологические факторы, следует периодически исследовать кровь для своевременного выявления анемии.
Дата добавления: 2014-11-20 ; Просмотров: 512 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Пернициозная анемия (от лат. perniciosus — гибельный, опасный) или B12-дефицитная анемия или мегалобластная анемия или болезнь Аддисона-Бирмера или (устаревшее название) злокачественное малокро́вие — заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы.
Причины B12-дефицитной анемии:
Различные этиологические факторы могут вызывать дефицит цианкобаламина или фолиевой кислоты (реже комбинированную недостаточность обоих) и развитие мегалобластной анемии. Дефицит цианкобаламина могут обусловить следующие причины: — низкое содержание в рационе; — вегетарианство; — низкая абсорбция; — дефицит внутреннего фактора; — пернициозная анемия; — гастрэктомия; — поверждение эпителия желудка химическими вещества; — инфильтративные изменения желудка; (лимфома или карцинома); — болезнь Крона; — целиакия; — резекция подвздошной кишки; — атрофические процессы в желудке и кишке; — повышенная утилизация витамина В12 бактериями при их избыточном росте; — состояние после наложения желудочно-кишечного анастомоза; — дивертикулы тощей кишки; — кишечный стаз или обструкция, обусловленная стриктурами; — глистная инвазия; — лентец широкий (Diphyllobotrium latum); — патология абсорбирующего участка; — туберкулез подвздошной кишки; — лимфома тонкой кишки; — спру; — регионарный энтерит; — другие причины. — врожденное отсутствие транскобаламина 2 (редко) — злоупотребление закисью азота (инактивирует витамин В12 окисляя кобальт); — нарушение всасывания, обусловленное применением неомицина, колхицина. Причинами дефицита фолатов могут быть: 1. Недостаточное поступление — скудный рацион; — алкоголизм; — нервно-психическая анорексия; — парентеральное питание; — несбалансированное питание у пожилых. 2. Нарушение всасывания — мальабсорбция — изменения слизистой оболочки кишечника — целиакия и спру — болезнь Крона — регионарный илеит — лимфома кишечника — уменьшение реабсорбирующей поверхности после резекции тощей кишки — прием антиконвульсантов 3. Увеличение потребности — беременность — гемолитическая анемия — эксфолиативный дерматит и псориаз 4. Нарушение утилизации — алкоголизм; — антагонисты фолатов: триметоприм и метотрексат; — врожденные нарушения метаболизма фолатов.
Патогенез (что происходит?) во время B12-дефицитной анемии:
Роль цианкобаламина и фолиевой кислоты в развитии мегалобластной анемии связана с их участием в широком спектре обменных процессов и обменных реакций в организме. Фолиевая кислота в форме 5,10 — метилентетрагидрофолата участвует в метилировании дезоксиуридина, необходимого для синтеза тимидина, при этом образуется 5-метилтетрагидрофолат. Цианокобаламин является кофактором метилтрасферазной каталитической реакции, осуществляющей ресинтез метионина и одновременно регенерацию 5-метилтетрагидрофолата в тетрагидрофолат и 5,10 метилентетрагидрофолат. При недостаточности фолатов и (или) цианкобаламина нарушается процесс включения уридина в ДНК развивающихся гемопоэтичеких клеток и образования тимидина, что обуславливает фрагментацию ДНК (блокирование ее синтеза и нарушение клеточного деления). При этом возникает мегалобластоз, происходит накопление больших форм лейкоцитов и тромбоцитов, их раннее внутрикостномозговое разрушение и укорочение жизни циркулирующих клеток крови. В результате гемопоэз оказывается неэффективным, развивается анемия, сочетающаяся с тромбоцитопенией и лейкопенией. Кроме того, цианкобаламин является коферментом в реакции превращения метилмалонил-КоА в сукцинил-КоА. Эта реакция необходима для метаболизма миелина в нервной системе, в связи с чем при дефиците цианкобаламина наряду с мегалобластной анемией отмечается поражение нервной системы, в то время как при недостаточности фолатов наблюдается только развитие мегалобластной анемии. Цианкобаламин содержится в пищевых продуктах животного происхождения — печени, почках, яйцах, молоке. Запасы его в организме взрослого человека (главным образом в печени) велики — около 5 мг, и если учесть, что суточная потеря витамина составляет 5 мкг, то полное истощение запасов при отсутствии поступления (нарушение всасывания, при вегетарианской диете) наступает только через 1000 дней. Цианкобаламин в желудке связывается (на фоне кислой реакции среды) с внутренним фактором — гликопротеином, продуцируемым париетальными клетками желудка, или другими связывающими белками — R-факторами, присуствующими в слюне и желудочном соке. Эти комплексы предохраняют цианкобаламин от разрушения при транспорте по ЖКТ. В тонкой кишке при щелочном значении рН под влиянием протеиназ панкреатического сока цианкобаламин отщепляется от R-протеинов и соединяется с внутренним фактором. В пдовздошной кишке комплекс внутреннего фактора с цианкобаламином связывается со специфическими рецепторами на поверхности эпителиальных клеток, освобождение цианкобаламина из клеток кишечного эпителия и транспорт к тканям происходит с помощью особых белков плазмы крови — транскобаламинов 1,2,3, причем транспорт цианкобаламина к гемопоэтическим клеткам осуществляется преимущественно транскобаламином 2. Фолиевая кислота содержится в зеленых листьях растений, фруктах, печени, почках. Запасы фолатов составляют 5-10 мг, минимальная потребность — 50 мкг в день. Мегалобластная анемия может развиться через 4 месяца полного отсутствия поступления фолатов с пищей.
Симптомы B12-дефицитной анемии:
В12-дефицитная анемия развивается относительно медленно и может быть малосимптомной. Клинические признаки анемии неспецифичны: слабость, быстрая утомляемость, одышка, головокружение, сердцебиение. Больные бледны, субиктеричны. Есть признаки глоссита — с участками воспаления и атрофии сосочков, лакированный язык, может быть увеличение селезенки и печени. Желудочная секреция резко снижения. При фиброгастроскопии выявляется атрофия слизистой оболочки желудка, которая подтверждается и гистологически. Наблюдаются и симптомы поражения нервной системы (фуникулярный миелоз), которые не всегда коррелируют с вырженностью анемии. В основне неврологических проявлений лежит демиелинизация нервных волокон. Отмечается дистальные парестезии, периферическая полиневропатия, расстройства чувствительности, повышение сухожильных рефлексов. Таким образом для В12-дефицитной анемии характерна триада: — поражение крови; — поражение ЖКТ; — поражение нервной системы.
Диагностика B12-дефицитной анемии:
Диагностика В12-дефицитной анемии: 1. Клинический анализ крови — снижение количества эритроцитов — снижение гемоглобина — повышение цветного показателя (выше 1.05) — макроцитоз (относится к группе макроцитарных анемий) — базофильная пунктация эритроцитов, наличие в них телец Жолл и колец Кебота — появление ортохромных мегалобластов — снижение ретикулоцитов — лейкопения — тромбоцитопения — снижение моноцитов — анэозинфилия 2. В окрашенных мазках — типичная картина: наряду с характерными овальными макроцитами встречаются эритроциты нормального размера, микроциты и шизоциты — пойкило- и анизоцитоз. 3. Уровень билирубина в сыворотке повышен за счет непрямой фракции 4. Обязательна пункция костного мозга так как такая картина на периферии может быть при лейкозе, гемолитической анемии, апластических и гипопластических состояниях (однако, необходимо отметить, что гиперхромия характерна именно для В12-дефицитной анемии). Костный мозг клеточный, число ядросодержащих эритроидных элементов увеличено в 2-3 раза противо нормы, однако эритропоэз неэффективный, о чем свидетельствует снижение числа ретикулоцитов и эритроцитов на периферии и укорочение их продолжительности жизни (в норме эритроцит живет 120-140 дней). Находят типичные мегалобласты — главный критерий постановки диагноза В12-дефицитная анемия. Это клетки с «ядерно-цитоплазматической диссоциацией» (при зрелой гемоглобинизированной цитоплазме нежное, сетчатого строения ядро с нуклеолами); также обнаруживаются клетки гранулоцитарного ряда большого размера и гигантские мегакариоциты.
Лечение B12-дефицитной анемии:
Комплекс лечебных мероприятии при В12 — дефицитной анемии следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения: — непременным условием лечения В12 — дефицитной анемии при глистной инвазии является дегельминтизация (для изгнания широкого лентеца назначают фенасал по определенной схеме или экстракт мужского папоротника). — при органических заболеваниях кишечника и поносах следует применять ферментные препараты (панзинорм, фестал, панкреатин), а также закрепляющие средства (карбонат кальция в сочетании с дерматолом). — нормализация кишечной флоры достигается приемом ферментных препаратов (панзинорм, фестал, панкреатин), а также подбором диеты, способствующей ликвидации синдромов гнилостной или бродильной диспепсии. — сбалансированное питание с достаточным содержанием витаминов, белка, безусловным запрещением алкоголя — непременное условие лечения В12 и фолиеводефицитной анемии. — патогенетическая терапия осуществляется с помощью парентерального введения витамина В12 (цианкобаламин), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В12 (кортикостероидная терапия). Гемотрансфузии проводят лишь при значительном снижении гемоглобина и проявлении симптомов коматозного состояния. Рекомендуется вводить эритроцитную массу по 250 — 300 мл (5 — 6 трансфузий). Преднизолон (20 — 30 мг/сут) рекомендуется при аутоиммунной природе заболевания. Принципы терапии: — насытить организм витамином — поддерживающая терапия — предупреждение возможного развития анемии
источник
При мегалобластной анемии в костном мозге определяются клетки с характерными морфологическими признаками: крупные, незрелые по внешнему виду ядра, окруженные относительно более зрелой цитоплазмой. С точки зрения биохимии основной причиной этого состояния является нарушение синтеза ДНК: в S-фазе клеточного цикла клетки прекращают развиваться (при частичной репликации ДНК клетка не может завершить процесс деления). При этом синтез РНК не нарушен. Происходит нарушение дифференцировки ядра. Учитывая, что синтез цитоплазматических компонентов очень интенсивный (особенно гемоглобина), площадь клеток-эритроидных предшественников очень расширена – это способствует образованию макроцитов (гиперхромных эритроцитов крупных размеров) или мегалоцитов. Такие изменения также характерны для гранулоцитарных предшественников и мегакароцитов.
Впервые мегалобласная анемия была описана английским ученым Аддисоном (Addison) в 1849 году. Аддисон обозначил ее как злокачественную (пернициозную). Врач Фенвик (Fenwick) из Лондона в 1870 году при вскрытии больного с пернициозной анемией обнаружил атрофию слизистой оболочки желудка. Немецкий врач Биермер (Biermer, Цюрих) в 1872 году в отношении этой патологии применил термин «прогрессирующая пернициозная анемия». А в 1880 ученый Эрлих (Ehrich) в костном мозге больных пернициозной анемией обнаружил крупные клетки со специфической структурой – мегалобласты. В начале XX века пернициозная анемия была одной из самых распространенных патологий крови и считалась неизлечимой.
Специалистам, которые изучали эту патологию и методы ее лечения, было присвоено пять Нобелевских премий. В 1930 году Касл (Castle) предполагал, что в мясе животных содержится «внешний фактор», который связывается с «внутренним фактором», в результате чего образуется так называемое гемопоэтическое вещество, способное усваиваться и депонироваться в печени. Ученые Минот (Minot), Марфи (Murphy) и Випл (Whipple) получили Нобелевскую премию в области медицины и физиологии за новый метод лечения пернициозной анемии сырой печенью. В 1948 году сразу две группы ученых (в США под руководством Фолкерса (Folkers) и в Великобритании под руководством Лестера-Смита (Lester-Smith)) выделили внешний фактор, витамин B12. Также Нобелевскую премию получила Дороти Кроуфут-Хоткин (Dorothy Crowfoot-Hodgkin) за изучение структуры пенициллина и витамина B12.
Витамин B12 (цианокобаламин) обладает структурой корриноида, в основе которой находится углеродная структура коррина, схожего по строению с порфирином. Цианокобаламин – сложная по структуре молекула с центральным атомом кобальта, который связан с четырьмя пиррольными кольцами и нуклеотидом. Витамин B12 имеет две коферментные формы – аденозилкобаламин и метилкобаламин. В крови человека основная форма витамина B12 – метилкобаламин.
Витамин B12 содержится только в продуктах животного происхождения (печень, почки, мясо, молоке и молочных продуктах). Небольшое количество этого витамина синтезируется в кишечнике человека. Цианокобаламин практически не содержится в продуктах растительного происхождения. У травоядных животных синтез витамина B12 происходит в желудке благодаря микроорганизмам, обитателям бобовых и корнеплодов, затем витамин попадает в паренхиматозные ткани и мышцы этих животных. Максимальная концентрация цианокобаламина в печени и почках животных (примерно 100 мкг/100 г продукта). В мясе содержание цианокобаламина гораздо ниже (примерно 0,5-2,0 мкг/100 г). Содержание витамина B12 в молоке и яйцах еще ниже, кроме этого, из-за прочной связи с протеином кобалафилином, содержащийся в этих продуктах витамин плохо усваивается. Цианокобаламин под действием протеолитических ферментов высвобождается в желудке и при кулинарной обработке продуктов.
Через стенки кишечника цианокобаламин попадает в кровь, где вступает в связь с транскобаламином II (транспортным протеином) и через воротную вену распределяется по кровеносной системе, откуда попадает в ткани-мишени.
Содержание цианокобаламина в организме взрослого человека составляет от 2 до 5 мг. Основной запас витамина B12, которого хватает на несколько лет (3-6), находится в печени. Экскреция (выведение из организма) цианокобаламина осуществляется через кишечник (с калом) и почки (с мочой), и составляет примерно 2-5 мкг в сутки. Суточная потребность организма взрослого человека в витамине B12 составляет 3-7 мкг.
Коферменты витамина B12 принимают участие в процессе синтеза ДНК, а также в регуляции функции системы гемопоэза и нервной системы. В крови содержится в большей степени активная форма витамина – метилкобаламин, который участвует в синтезе тетрагидрофолиевой кислоты, необходимой для образования тимидина.
Дефицит витамина B12 приводит к нарушению метаболизма фолатов и синтеза ДНК, в результате чего пролиферирующие кроветворные клетки не способны полностью созревать и нормально делиться. При этом в костном мозге развивается мегалобластический тип кроветворения, что приводит к появлению гигантских клеток миелопоэза и мегакариоцитопоэза. Из-за дефицита витамина B12 или B9 образуется недостаточное количество тетрагидрофолата, что вызывает развитие мегалобластной анемии по причине снижения синтеза нуклеиновых кислот.
Классическая картина B12-дефицитной анемии состоит из трех основных синдромов:
B12-дефицитная анемия, как правило, манифестирует в возрасте 50-60 лет (при этом такие пациенты часто выглядят старше своего возраста). Этот вид анемии наиболее широко распространен в Скандинавских странах, что обусловлено предрасположенностью к этой патологии голубоглазых блондинов.
B12-дефицитная анемия имеет три степени тяжести:
I степень: Легкая – концентрация гемоглобина в крови > 90 г/л
II степень: Средняя – концентрация гемоглобина в крови 70-90 г/л
III степень: Тяжелая – концентрация гемоглобина в крови 35 пг или цветового показателя > 1,1. Также увеличивается средний объем эритроцитов (> 100 фл и даже > 120 фл). В случаях, когда B12-дефицитная анемия сочетается с железодефицитной анемией или анемией хронического воспаления, средний объем эритроцитов может оставаться в пределах нормы. Выраженное повышение уровня ретикулоцитов (200-300% и выше) развивается на 5-8 день лечение витамином B12 – это повышение является подтверждением диагноза. Кроме этого, у многих пациентов наблюдается лейкопения (выраженность лейкопении часто коррелирует со степенью тяжести анемии). В некоторых случаях может наблюдаться снижение уровня тромбоцитов.
Большое диагностическое значение среди биохимических анализов крови имеет исследование уровня цианокобаламина. В миелограмме при нормальном или повышенном уровне миелокариоцитов обнаруживается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (см рис. 1-7).
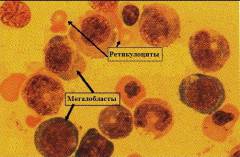
Рисунок 1. B12-дефицитная анемия. Костный мозг. Мегалобласты (окр. по Романовскому-Гимзе; ув. ×100)
Рисунок 2. B12-дефицитная анемия. Костный мозг. Мегалобласты. Гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Рисунок 3. B12-дефицитная анемия. Костный мозг. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
Рисунок 4. B12-дефицитная анемия. Препарат костного мозга. Мегалобластный тип кроветворения (окр. по Романовскому-Гимзе; ув. ×100)
Рисунок 5. B12-дефицитная анемия. Препарат костного мозга. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
Рисунок 6. B12-дефицитная анемия. Препарат костного мозга. Мегалобласты, гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Такие изменения миелограммы можно наблюдать только до начала терапии витамином B12. В аспирате костного мозга, полученного даже после однократной инъекции препарата, мегалобласты исчезают, а мегалобластический тип кроветворения сменяется нормобластическим. Отметим, что очень важным диагностическим критерием является высокий уровень лактатдегидрогеназы в крови.
Основа диагностики B12-дефицитной анемии в гематологии – анализ костного мозга на предмет наличия мегалобластов и миелоцитов с метамиелоцитами (гигантских клеток-предшественников гранулоцитопоэза). Но на практике эти клетки обнаруживаются не во всех случаях (даже если у больного явная форма анемии). Предположительно это происходит из-за того, что какое-то количество цианокобаламина больной все-таки как-то получил, что послужило причиной временного изменения гемопоэза, но не позволило полностью улучшить состояние. Но точные причины такого парадокса неизвестны. Поэтому с целью диагностики типичного случая B12-дефицитной анемии достаточно провести анализ периферической крови, с помощью которого можно определить гиперхромную макроцитарную анемию (при дифференциальной диагностике только патологий из группы миелодиспластических синдромов!). При этом могут обнаруживаться гиперсегментированные нейтрофилы (см рис. 7, 8), иногда метамиелоциты.
Рисунок 7. B12-дефицитная анемия. Препарат костного мозга. Множественные мегалобласты (окр. по Романовскому-Гимзе; ув. ×100) (а, б)
Рисунок 8. B12-дефицитная анемия. Костный мозг. (окр. по Романовскому-Гимзе; ув. ×100)
Если лабораторные исследования демонстрируют умеренную тромбоцитопению, незначительное повышение уровня непрямого билирубина и значительное повышение концентрации лактатдегидрогеназы, диагноз можно считать подтвержденным (в этом случае проведение дополнительных пункций – лишняя процедура).
При диагностике B12-дефицитной анемии важное значение играет фиброгастроскопия, с помощью которой можно подтвердить диагноз «атрофический гастрит» — главная причина дефицита цианокобаламина. Кроме этого, гастроскопия позволяет исключить злокачественную патологию желудка.
После назначения лечения витаминами B9 и B12 наблюдается следующая динамика изменения показателей лабораторных исследований:
— значительное повышение уровня эритроцитов и гемоглобина в течение 14 дней, показатель которых, в зависимости от выраженности дефицита, нормализуется через 8-12 недель с момента начала лечения; отметим, что уровень гемоглобина повышается медленнее, поэтому его показатель в периферической крови возвращается в норму через 1-2 месяца лечения;
— на 2-4-й день терапии начинает увеличиваться уровень ретикулоцитов, достигает максимума на 8-9-й день, и нормализуется к 14-му дню лечения; при этом повышается уровень тромбоцитов и лейкоцитов;
— на 10-14-й день терапии гиперсегментация ядер нейтрофилов сохраняется;
— в течение 24-48 часов после первого введения препарата в костном мозге исчезают мегалобласты; изменения морфологии ядер гранулоцитов сохраняется еще несколько суток;
— биохимический анализ крови показывает повышение уровня мочевой кислоты и холестерина (максимум достигается на пике ретикулоцитоза); концентрация лактатдегидрогеназы, щелочной фосфотазы и билирубина возвращаются в норму; может наблюдаться незначительное снижение концентрации калия в крови.
Пока врачи не могли использовать в терапии препараты цианокобаламина, B12-дефицитная анемия считалось фатальным заболеванием. В те времена ремиссию можно было получить с помощью эмпирического подбора рациона питания, трансфузионной терапии или спленэктомии, но после этого следовал очередные рецидивы, которые приводили к смерти пациента (как правило это происходило через 1-3 года с момента диагностирования патологии).
С целью профилактики развития B12-дефицитной анемии рацион питания должен содержать животный белок (печень, сердце, мясо, рыба, молочные продукты и др). Во время манифестации патологии нужно назначать цианокобаламин. Если у больного диагностированы глистные инвазии, дополнительно назначается противогельминтная терапия.
Сегодня для лечения B12-дефицитной анемии широко применяются два препарата: Цианокобаламин и Оксикобаламин. В нашей стране принято назначать Цианокобаламин: подкожно или внутримышечно 200-400 мкг 1 раз в день на протяжении 4-5 недель. В тяжелых случаях и при развитии фуникулярного миелоза суточная дозировка цианокобаламина повышают до 1000 мкг.
При условии назначения адекватного лечения явное улучшение состояния пациента и нормализацию картины костного мозга можно наблюдать уже на 3-4-е сутки лечения. Повышение уровня ретикулоцитов в периферической крови в среднем на 20-30% (ретикулоцитарный криз) развивается через 1-2 недели. Концентрация билирубина в крови возвращается в норму на протяжении 3-4 недель, лактатдегидрогеназы – через 7-14 дней.
При назначении цианокобаламина ремиссия наступает у всех больных B12-дефицитной анемией.
При отсутствии эффекта от терапии на протяжении нескольких недель, следует предполагать неверную трактовку генеза анемии. В этом случае пациенту необходимо провести дополнительную диагностику, чтобы уточнить причину анемического синдрома.
Эта патология относится к группе мегалобластных анемий. Дефицит фолиевой кислоты приводит к нарушению влияния цианокобаламина на процесс синтеза ДНК, что приводит к развитию мегалобластного типа кроветворения.
Дефицит витамина B9 может возникать из-за недостаточного поступления в организм фолиевой кислоты с пищей, патологий желудочно-кишечного тракта (нарушений усвоения фолиевой кислоты), а также при повышенной потребности организма в этом витамине.
Характерные жалобы пациентов с фолиево-дефицитной анемией – общая слабость и головокружения. Глоссит у таких больных, в отличие от больных B12-дефицитной анемией, развивается очень редко. Также при B9-дефицитной анемии не обнаруживаются признаки фуникулярного миелоза.
Как и при дефиците цианокобалавина, при дефиците фолиевой кислоты в периферической крови обнаруживается макроцитоз, повышается среднее содержание гемоглобина в эритроците и средний объем эритроцитов. В костном мозге появляются мегалобласты. Повышается уровень непрямого билирубина в крови, увеличивается активность лактатдегидрогеназы.
Дефицит фолиевой кислоты в организме приводит к повышению уровня гомоцистеина, что является фактором риска для образования венозных тромбов (из-за чрезмерного влияния гомоцистеина на эндотелий кровеносных сосудов). Гетерозиготное носительство мутации метилтетрагидрофолатредуктазы также является причиной высокого уровня гомоцистеина, однако риск образования тромбов при этом ниже.
Лечение фолиево-дефицитной анемии подразумевает применение препаратов фолиевой кислоты.
источник
Данное заболевание крови встречается у 0,1% всего населения, однако среди пожилых людей данный показатель повышается до 1%. Чаще болеют женщины, причем развитие дефицита витамина В12 обычно связано с беременностью и может самостоятельно исчезать после рождения ребенка.
Интересные факты
- Дефицит витамина В12 отмечается у 10% людей в возрасте старше 70 лет, однако не у всех из них развиваются клинические проявления В12 дефицитной анемии.
- Ни одно животное или растение на земле не способно синтезировать витамин В12.
- Витамин В12 вырабатывается исключительно микроорганизмами (бактериями), обитающими в конечном отделе пищеварительного тракта животных и человека, однако он неспособен попасть в кровоток, так как его всасывание происходит в тощей кишке, которая расположена в начальных отделах кишечника.
Образование эритроцитов начинается еще на ранних стадиях эмбрионального развития. Первые клетки крови у эмбриона образуются из мезенхимы (особой эмбриональной ткани) в конце 3 недели беременности. По мере роста и развития выделяются основные органы, которые обеспечивают кроветворение.
Основными кроветворными органами являются:
- Печень – выполняет кроветворную функцию с 6 недели внутриутробного развития и до рождения ребенка.
- Селезенка – участвует в процессе кроветворения с 12 недели внутриутробного развития и до рождения ребенка.
- Красный костный мозг – начинает выполнять кроветворную функцию с 12 недели внутриутробного развития и является единственным кроветворным органом после рождения ребенка.
Образование эритроцитов происходит из так называемых полипотентных стволовых клеток (ПСК). В организме человека имеется около 40 тысяч ПСК, которые образуются в периоде внутриутробного развития. Они содержат ядро, в котором располагается ДНК (дезоксирибонуклеиновая кислота), регулирующая процессы клеточного деления и дифференцировки (приобретения клеткой специфической функции). Кроме ядра в стволовых клетках имеется множество других структур (органелл), которые нужны для обеспечения процессов их жизнедеятельности и размножения.
Молекула ДНК человека имеет форму двух нитей, спирально перекрученных между собой. Каждая нить состоит из множества особых химических соединений – нуклеозидов. Нуклеозиды могут соединяться друг с другом в различных комбинациях, от чего в конечном итоге и зависит вид клетки, ее форма, состав и выполняемые ею функции. Другими словами, любые проявления живой клетки зависят от того, какие нуклеозиды и в какой последовательности будут взаимодействовать в каждой определенной молекуле ДНК.
Уникальной особенностью ПСК является то, что под действием различных регуляторных факторов они могут превращаться в любую клетку крови — эритроцит (обеспечивающий транспорт газов), тромбоцит (отвечающий за остановку кровотечений), лейкоцит или лимфоцит (выполняющие защитные функции).
Процесс роста и развития эритроцитов регулируется эритропоэтином – особым веществом, которое вырабатывается почками, если ткани организма испытывают недостаток в кислороде (кислородное голодание). Эритропоэтин активирует образование эритроцитов в красном костном мозге, в результате чего увеличивается их количество в периферической крови, что улучшает доставку кислорода к органам и тканям организма. Устранение кислородного голодания на тканевом уровне уменьшает продукцию эритропоэтина, что приводит к уменьшению синтеза эритроцитов.
Процесс дифференцировки (образования эритроцита из стволовой клетки) можно представить следующим образом:
- Полипотентная стволовая клетка через несколько промежуточных делений превращается в клетку-предшественницу эритропоэза, которая также содержит ядро и органеллы.
- Под воздействием эритропоэтина клетка-предшественница эритропоэза начинает активно делиться, при этом в ней происходит ряд структурных и функциональных изменений — она в несколько раз уменьшается в размерах, теряется ядро и большинство органелл (следовательно, и способность к дальнейшему размножению) и накапливает гемоглобин.
- Все описанные выше процессы происходят в красном костном мозге, а их результатом является образование ретикулоцитов (незрелых форм эритроцитов). За сутки в костном мозге образуется около 3 х 10 9 ретикулоцитов, которые выделяются в периферический кровоток. Они содержат некоторые органеллы и способны в небольших количествах образовывать гемоглобин.
- В течение 24 часов происходит полная утрата всех оставшихся органелл, в результате чего формируется зрелый эритроцит.
Для образования эритроцитов необходимы:
- Железо – включается в состав гемоглобина, являясь основным микроэлементом, обеспечивающим транспорт кислорода в организме.
- Витамин В12 (кобаламин) – принимает участие в образовании ДНК.
- Витамин В9 (фолиевая кислота) – также участвует в процессе образования ДНК.
- Витамин В6 (пиридоксин) – участвует в процессе образования гемоглобина.
- Витамин В2 (рибофлавин) – участвует в процессе дифференцировки эритроцитов.
Конечным этапом эритропоэза является зрелый эритроцит. Он не содержит ядра, практически полностью лишен органелл и не способен делиться. Его красный цвет обусловлен наличием железа, входящего в состав гемоглобина, который заполняет почти все внутреннее пространство клетки (в каждом эритроците содержится от 250 до 400 миллионов молекул гемоглобина, что равняется 25 – 40 пикограммам).
Эритроцит имеет форму уплощенного двояковогнутого диска с более толстыми краями и углублением в центре. Внутренняя поверхность его клеточной мембраны выстлана специальным белком – спектрином, который отвечает за поддержание формы клетки. Диаметр клетки равен в среднем 7,5 – 8,3 мкм.
Перечисленные особенности строения позволяют эритроциту видоизменяться и проходить через мельчайшие кровеносные сосуды организма, диаметр которых в 2 – 3 раза меньше диаметра самих эритроцитов, возвращаясь после этого к первоначальной форме (благодаря наличию спектрина).
Эритроциты не способны передвигаться самостоятельно и транспортируются в организме с током крови. Наружные поверхности их мембран обладают определенным отрицательным зарядом, в результате чего отталкиваются друг от друга, от остальных клеток крови и от стенок сосудов (которые также заряжены отрицательно). Это обеспечивает поддержание всех клеток крови во взвешенном состоянии, предотвращая их слипание и образование сгустков.
Средний срок жизни эритроцитов составляет 120 дней, в течение которых они циркулируют в крови, выполняя свои функции. Так как данные клетки практически лишены органелл, их способности к устранению повреждений (неизменно возникающих в процессе циркуляции в организме) довольно ограничены.
С течением времени эритроциты несколько уменьшаются в объеме (однако количество гемоглобина в них остается прежним), клеточная мембрана утрачивает эластичность и способность видоизменяться. Кроме того, наружная поверхность мембран старых эритроцитов теряет свой отрицательный заряд. Результатом этих процессов является уменьшение прочности и изменение формы красных клеток крови, что способствует их разрушению.
Разрушение эритроцитов (гемолиз) происходит:
- в селезенке;
- в сосудистом русле.
Разрушение эритроцитов в селезенке (внутриклеточный гемолиз)
Селезенка является основным органом, в котором разрушается до 90% эритроцитов, а также других клеток крови. Этому процессу способствует наличие большого количества так называемых синусоидных капилляров, имеющих в своей стенке небольшие отверстия. Эритроциты при прохождении через такие капилляры выходят из них и проходят через узкие щели в ткани селезенки (диаметр которых составляет 0,5 – 0,7 мкм). Старые или деформированные клетки не способны пройти через эти щели, поэтому задерживаются в них и разрушаются специальными клетками – макрофагами, которые находятся в данном органе в большом количестве.
При разрушении эритроцита железо, входящее в состав гемоглобина, высвобождается в кровоток, связывается с особым транспортным белком трансферрином и переносится в костный мозг, где вновь используется для образования эритроцитов. Оставшийся гемоглобин в результате нескольких химических реакций превращается в билирубин (несвязанную фракцию) – вещество желтого цвета, которое выделяется в кровоток при разрушении эритроцитов. Билирубин транспортируется в печень, где связывается с глюкуроновой кислотой, образуя связанную фракцию билирубина, которая включается в состав желчи и выводится из организма с калом.
Разрушение эритроцитов в сосудистом русле (внеклеточный гемолиз)
Данный термин подразумевает разрушение эритроцитов (и других клеток крови) непосредственно в просвете кровеносных сосудов. Примерно 10% эритроцитов разрушается путем внеклеточного гемолиза. Гемоглобин, попадающий при этом в кровоток, связывается с особым белком плазмы – гаптоглобином. Образующийся комплекс переносится в селезенку и разрушается ее макрофагами.
Организм человека не в состоянии синтезировать витамин В12, поэтому его количество полностью зависит от поступления с пищей (преимущественно животного происхождения).
Всасывание кобаламина происходит в кишечнике и только в присутствии особого фермента – внутреннего фактора Касла, который вырабатывается париетальными клетками слизистой оболочкой желудка. Поступающий с пищей витамин В12 связывается с данным ферментом в желудке. Образовавшийся комплекс взаимодействует (в присутствии ионов кальция) со специфическими рецепторами клеток слизистой оболочки тощей кишки (являющейся частью тонкого кишечника), в результате чего кобаламин переносится в кровоток, а внутренний фактор Касла остается в просвете кишечника.
Попавший в кровоток витамин В12 связывается со специальным транспортным белком – транскобаламином I или II и в таком виде доставляется в костный мозг, где принимает участие в процессе кроветворения, и в печень, являющуюся местом его депонирования. Важно отметить, что в клетки организма витамин В12 может попасть, только находясь в комплексе с транскобаламином II.
При сбалансированном питании и прочих нормальных условиях в кишечнике ежедневно всасывается 30 – 50 мкг витамина В12. Он депонируется в печени, которая у взрослого человека может содержать до 3 – 5 миллиграмм витамина. Если учесть, что суточная потребность организма в нем составляет 3 – 5 мкг, то становится понятным, почему первые признаки В12 дефицитной анемии начинают появляться не ранее чем через 2 – 3 года после нарушения процессов поступления кобаламина в организм.
Недостаток витамина В12 приводит к нарушению синтеза ДНК во всех клетках организма. В первую очередь это проявляется в тканях, в которых процессы клеточного деления происходят наиболее интенсивно — в кроветворной ткани и в слизистых оболочках.
Попавший в клетку кобаламин превращается в одну из двух активных форм:
- Дезоксиаденозилкобаламин (ДА-В12). Участвует в образовании жирных кислот. При их недостатке в организме поражается нервная система.
- Метил-кобаламин (метил-В12). Принимает активное участие в процессе образования компонентов ДНК, а именно в синтезе тимидина – одного из пиримидиновых нуклеозидов. Недостаток витамина В12 в организме приводит к остановке синтеза данного нуклеозида, в результате чего образуется структурно неполноценная молекула ДНК. Она быстро разрушается, что делает невозможным дальнейшее деление и дифференцировку клеток. Кроме того, метил-В12 также необходим для образования миелина, из которого состоят оболочки нервных волокон. При недостатке данного вещества нарушается проведение нервного импульса по нервам, что может проявляться разнообразными неврологическими симптомами.
Нарушение синтеза ДНК в процессе кроветворения происходит в начальных стадиях эритропоэза, в результате чего дальнейшее развитие эритроцитов становится невозможным. Образующиеся при этом кроветворные клетки (называемые мегалобластами) имеют большие размеры (10 – 20 мкм), содержат остатки разрушенного ядра и множество органелл, а также большое количество гемоглобина. Большинство из них разрушается прямо в костном мозге – развивается так называемый неэффективный эритропоэз. Те мегалобласты, которые все-таки выделяются в кровоток, неспособны выполнять транспортную функцию и при первом же прохождении через селезенку задерживаются и разрушаются в ней.
Важно отметить, что при недостатке витамина В12 в костном мозге нарушается образование не только эритроцитов, но и других клеток – лейкоцитов и тромбоцитов. Обычно эти изменения выражены менее значительно, чем дефицит эритроцитов, однако при длительном течении заболевания и отсутствии адекватного лечения может развиться панцитопения – клинический синдром, характеризующийся недостатком всех клеточных элементов в крови.

Причинами развития дефицита витамина В12 являются:
- недостаточное поступление с пищей;
- нарушение всасывания в кишечнике;
- повышенное использование витамина В12 в организме;
- наследственные заболевания, нарушающие обмен витамина В12.
Как было сказано ранее, организм человека неспособен самостоятельно синтезировать кобаламин, поэтому он должен присутствовать в потребляемой пище. Растения не содержат витамин В12, поэтому единственным его источником являются продукты животного происхождения — мясо, рыба, кисломолочные продукты и так далее. В нормальных условиях данные продукты включены в рацион почти каждого человека, поэтому дефицита витамина В12 не развивается.
Причинами недостаточного поступления витамина В12 с пищей могут быть:
- нарушение питания;
- хронический алкоголизм.
Нарушение питания
Одной из частых причин дефицита кобаламина в организме может быть вегетарианство. Вегетарианцами называется определенная группа людей, которые полностью отказались не только от мяса, но и от всех продуктов животного происхождения (яиц, рыбы, молока, сливочного масла и других). Так как данные продукты являются единственным источником кобаламина, вполне логично, что в скором времени у таких людей может развиться дефицит витамина В12 в организме.
Кроме вегетарианцев риск развития В12 дефицитной анемии повышен у бедных слоев населения, которые из-за недостатка средств не могут позволить себе употребление достаточного количества продуктов животного происхождения.
Хронический алкоголизм
Употребление больших доз алкоголя препятствует взаимодействию кобаламина с внутренним фактором Касла, а также повреждает слизистую оболочку желудка, нарушая выработку данного фактора париетальными клетками. Результатом этого становится резкое уменьшение количества кобаламина, поступающего в кровь.
Кроме того, длительное злоупотребление алкогольными напитками может привести к развитию таких заболеваний как алкогольный гепатит и цирроз. Результатом этого является уменьшение запасов кобаламина в печени, что снижает компенсаторные возможности организма при нарушении поступления данного витамина с пищей.
В данном случае с пищей поступает достаточное количество кобаламина, однако нарушены процессы его транспортировки из просвета кишечника в кровь.
Причинами нарушения всасывания витамина В12 могут быть:
- нарушение образования внутреннего фактора Касла;
- поражение тонкого кишечника;
- паразитарные инфекции.
Нарушение образования внутреннего фактора Касла
Как уже говорилось, наличие данного фактора является необходимым условием для всасывания витамина В12. При его недостатке поступающий с пищей кобаламин не способен пройти через слизистую оболочку кишечника и полностью выделяется с калом.
Причинами недостатка внутреннего фактора Касла могут быть:
- Атрофический гастрит. Данное заболевание характеризуется атрофией (уменьшением размеров и снижением функциональной активности) всех клеток слизистой оболочки желудка, что приводит к снижению или полному прекращению синтеза внутреннего фактора Касла париетальными клетками.
- Аутоиммунный гастрит. Характеризуется нарушением деятельности иммунной (защитной) функции организма, в результате чего собственные клетки начинают восприниматься как чужеродные, к ним образуются специфические антитела, которые их разрушают. При аутоиммунном гастрите антитела могут образовываться как к париетальным клеткам слизистой оболочки желудка, так и к самому фактору Касла.
- Рак желудка. Это опухолевое заболевание, в процессе которого происходит неконтролируемый рост и размножение опухолевых клеток, что приводит к постепенному разрушению и вытеснению париетальных клеток слизистой оболочки.
- Удаление желудка. Лечение некоторых заболеваний (прободной язвы, рака) заключается в частичном или полном удалении желудка, что приводит к уменьшению либо полному исчезновению париетальных клеток и, следовательно, к уменьшению количества образующегося внутреннего фактора Касла.
- Врожденный дефицит внутреннего фактора Касла. Данное заболевание передается по наследству и характеризуется дефектом гена, ответственного за образование этого фактора, что приводит к нарушению его секреции железами желудка.
Поражение тонкого кишечника
Всасывание витамина В12 происходит в тощей кишке. Различные повреждения данного отдела тонкого кишечника могут привести к нарушению процессов всасывания в нем.
Причинами поражения тощей кишки могут быть:
- Воспалительные заболевания (энтериты). Воспалению тонкого кишечника могут способствовать инфекции желудочно-кишечной системы, пищевые отравления, различные аллергии. При длительном течении воспалительных процессов происходит атрофия клеток слизистой оболочки кишечника, что делает невозможным всасывание кобаламина.
- Опухоли. Опухоли кишечника, по описанному ранее механизму, могут приводить к разрушению его слизистой оболочки.
- Удаление тонкой кишки (из-за опухоли или по другой причине).
Паразитарные инфекции
Исследованиями последних лет установлено, что более чем у 90% населения в кишечнике обитают различные паразиты (глисты). Им, как любым живым организмам, для роста и развития требуются определенные питательные вещества, в том числе и витамины. Некоторые глисты (например, широкий ланцет, вызывающий развитие дифиллоботриоза) могут достигать огромных размеров, в результате чего практически весь витамин В12, поступающий с пищей, не всасывается, а потребляется паразитом.
Как упоминалось ранее, взрослому человеку необходимо всего лишь 3 – 5 мкг кобаламина в сутки. Однако при определенных условиях и заболеваниях потребность в данном витамине может значительно увеличиваться.
Причинами усиленного использования витамина В12 в организме могут быть:
- Беременность. В развивающемся плоде процессы роста и деления клеток происходят максимально интенсивно, что увеличивает потребность матери в витамине В12 в несколько раз.
- Гипертиреоз. Данное заболевание характеризуется увеличенным образованием и поступлением в кровоток гормонов щитовидной железы (трийодтиронина и тироксина). Это приводит к повышению обмена веществ в организме, что характеризуется усилением процессов клеточного деления во многих органах и требует больших количеств кобаламина.
- Злокачественные опухоли. Злокачественный процесс характеризуется неконтролируемым и непрерывным размножением опухолевой клетки, в результате чего образуется множество ее копий. При массивных опухолях большая часть кобаламина может потребляться опухолевой тканью, в результате чего другие органы будут испытывать недостаток в данном витамине.
Это довольно большая группа патологических состояний, характеризующаяся нарушением образования определенных веществ, которые в норме обеспечивают всасывание и утилизацию кобаламина в организме.
Нарушение обмена витамина В12 может быть обусловлено:
- Наследственным дефицитом транскобаламина II. Заболевание наследуется по аутосомно-рецессивному типу, то есть ребенок будет болеть только в том случае, если оба родителя страдали данным заболеванием (либо являлись его бессимптомными носителями). Характеризуется уменьшением образования или полным отсутствием транскобаламина II в организме. В этом случае количество витамина В12 в крови нормальное или даже увеличенное, однако он не может попасть в клетки организма, в результате чего развивается клиническая картина В12 дефицитной анемии.
- Синдромом Имерслунд-Гресбека. Данное заболевание также передается по аутосомно-рецессивному типу и характеризуется нарушением всасывания витамина В12 в кишечнике. Механизм этого процесса окончательно не установлен, так как секреция и взаимодействие внутреннего фактора Касла с кобаламином происходят нормально, и никаких органических поражений тонкого кишечника не наблюдается. Предполагается нарушение транспортных систем в клетках слизистой оболочки тощей кишки.
- Нарушением использования витамина В12 в клетках. Как говорилось ранее, в клетках организма кобаламин превращается в метил-кобаламин и дезоксиаденозилкобаламин. Эти процессы требуют наличия определенных веществ (ферментов), при отсутствии которых использование витамина В12 клетками становится невозможным.

Заболевание развивается медленно и в начальных стадиях характеризуется неспецифическими симптомами – слабостью, повышенной утомляемостью. С течением времени состояние пациента ухудшается, а проявления дефицита витамина В12 становятся более явными.
Основные клинические проявления В12 дефицитной анемии обусловлены:
- нарушением образования клеток крови;
- поражением пищеварительной системы;
- поражением нервной системы.
В результате нарушения процесса кроветворения в циркулирующей крови снижается количество эритроцитов. Это ухудшает транспорт газов в организме и приводит к кислородному голоданию всех тканей и органов.
Нарушение кроветворения проявляется:
- Бледностью и желтушностью кожи и слизистых оболочек. Розоватый цвет кожи и слизистых оболочек обусловлен белково-пигментным комплексом – гемоглобином, входящим в состав эритроцитов. При В12 дефицитной анемии бледность развивается постепенно, усиливаясь в течение нескольких месяцев. Кроме того, из-за усиленного разрушения эритроцитов (происходящего в костном мозге и в селезенке), в кровь выделяется большое количество пигмента билирубина, который придает коже и слизистым оболочкам желтоватый оттенок.
- Учащенным сердцебиением. Если организм испытывает недостаток в кислороде – активируются определенные защитные реакции, одной из которых является увеличение частоты сердечных сокращений (ЧСС). Это приводит к увеличению объема крови, проходящей через каждый орган за единицу времени, что улучшает доставку кислорода.
- Болями в сердце. Увеличение частоты сердечных сокращений улучшает доставку кислорода ко всем органам. Однако само сердце при этом выполняет большую работу и получает меньше кислорода, что может привести к появлению колющих болей в груди, которые могут распространяться в область левого плеча и живота.
- Непереносимостью физических нагрузок. При физических нагрузках увеличивается потребность мышц в энергии, которая образуется только при достаточном количестве поступающего кислорода. В нормальных условиях эти потребность восполняются за счет увеличения частоты сердечных сокращений. Однако при В12 дефицитной анемии ЧСС и так увеличена, что усугубляется нарушенной транспортной функцией эритроцитов, в результате чего физические нагрузки различной интенсивности приводят к быстрой утомляемости, появлению чувства нехватки воздуха, головокружениям или потере сознания.
- Головокружениями и частыми обмороками. Данные симптомы являются признаками выраженного дефицита эритроцитов в крови, когда головной мозг начинает испытывать недостаток в кислороде.
- Появлением «мушек» перед глазами. Это обусловлено недостаточным кровоснабжением сетчатки глаза (которая весьма чувствительна к кислородному голоданию) и стекловидного тела, что приводит к нарушению в них обмена веществ, ухудшению остроты зрения и появлению перед глазами маленьких темных пятен в форме колец, молний, ниточек и др.
- Увеличением селезенки. Большие эритроциты, попадающие в кровоток, задерживаются в капиллярах селезенки, закупоривая их. Это приводит к скоплению большого количества клеток крови в органе и увеличению его в размерах.
Поражение желудочно-кишечной системы является наиболее ранним признаком дефицита витамина В12 в организме, что обусловлено интенсивным клеточным делением в слизистых оболочках полости рта, желудка, кишечника. При нарушении данных процессов быстро развиваются атрофические изменения и нарушение функции органов.
Поражение пищеварительной системы может проявляться:
- Нарушением пищеварения. Процесс пищеварения полностью зависит от нормального функционирования слизистых оболочек полости рта, желудка и кишечника. В них располагается множество желез, выделяющих особые пищеварительные соки, которые способствуют переработке пищевых продуктов. При недостаточности данных соков пища не проходит должной обработки, в результате чего нарушаются процессы всасывания питательных веществ, витаминов, микроэлементов.
- Неустойчивым стулом. В результате нарушения процессов пищеварения пища может дольше задерживаться в желудке или в кишечнике, приводя к вздутию живота, изжоге, запорам, которые могут чередоваться с диареей (поносом).
- Снижением аппетита. Появляется в результате снижения секреции желудочного сока атрофированной слизистой оболочкой желудка.
- Снижением массы тела. Является результатом снижения аппетита и нарушения пищеварения.
- Изменением цвета и формы языка. Поверхность языка образована огромным множеством мелких ворсинок, называемых сосочками. При В12 дефицитной анемии происходит атрофия слизистой оболочки языка, то есть постепенное уменьшение и исчезновение всех сосочков. В результате язык становится гладким, ярко-малинового цвета.
- Нарушением вкуса. Человек чувствует вкус различных продуктов благодаря наличию множества вкусовых рецепторов, расположенных в слизистой оболочке языка (преимущественно в сосочках). Следствием ее поражения является снижение или полная утрата вкусовых ощущений. Кроме того, у человека может появляться различные вкусовые отклонения – он может испытывать отвращение к различным продуктам питания (например, к мясу, рыбным изделиям и т. д.).
- Частыми инфекциями ротовой полости. Слизистая оболочка ротовой полости играет важную защитную роль, предотвращая рост и развитие патогенной микрофлоры. При ее атрофии увеличивается частота инфекционных заболеваний полости рта, может развиваться глоссит (воспаление языка), гингивит (воспаление десен).
- Болью и жжением в полости рта. Возникает в результате атрофических изменений слизистой оболочки и поражения нервных окончаний ротовой полости.
- Болью в животе после еды. Нормальная слизистая оболочка желудка выполняет защитную функцию, предохраняя желудок от агрессивного воздействия пищевых продуктов. При нарушении процессов клеточного деления повышается риск ее воспаления (развития гастрита) и образования язв, что может проявляться режущими болями в животе, усиливающимися после приема пищи (особенно острой, грубой, плохо обработанной).
Поражения нервной системы при дефиците витамина В12 обусловлены участием кобаламина в образовании миелиновых оболочек, которые являются составной частью большинства нервных волокон организма и обеспечивают передачу нервного импульса по ним. При нарушении образования миелина происходит повреждение и склероз (замещение рубцовой тканью) нервных клеток и нервных волокон, что может проявляться всевозможными неврологическими нарушениями (в зависимости от того, какие нервы были поражены).
Наиболее опасным считается поражение головного мозга, являющегося центром всей нервной системы, и спинного мозга, который представляет собой совокупность нервных волокон, идущих от головного мозга ко всем органам и тканям организма и в обратном направлении.
Симптомами поражения нервной системы при В12 дефицитной анемии могут быть:
- Нарушение чувствительности. Одно из первых проявлений поражения нервной системы. Чувствительность может нарушаться в любых участках тела, однако это наиболее заметно, когда поражаются пальцы рук, запястья. Больной человек может не ощущать прикосновение, тепло, холод и даже боль. Чаще поражение носит двусторонний характер и без соответствующего лечения постоянно прогрессирует.
- Парестезии. Один из видов нарушения чувствительности, характеризующийся онемением, покалыванием, «ползанием мурашек» в определенной области кожи.
- Атаксия. Данный термин подразумевает нарушение согласованной работы мышц. Это может проявляться нарушением равновесия, неуклюжестью и несогласованностью движений рук и ног, туловища.
- Снижение мышечной силы. Чтобы мышца сокращалась, необходимо поступление достаточного количества нервных импульсов из головного мозга. Кроме того, даже в покое головной мозг постоянно посылает к мышцам небольшое количество импульсов, что обеспечивает поддержание мышечного тонуса. При поражении спинного мозга импульсы не могут достичь мышц, в результате чего происходит их атрофия (уменьшение массы и размеров). При отсутствии своевременного лечения данное состояние может прогрессировать и привести к параличу – полной утрате способности выполнять произвольные движения.
- Нарушение процессов дефекации и мочеиспускания. Развиваются при длительном недостатке витамина В12 в организме и могут проявляться задержкой или, наоборот, недержанием кала и/или мочи (в зависимости от того, какие участки спинного мозга поражены).
- Нарушения психики. Является одним из наиболее неблагоприятных (в прогностическом плане) симптомов заболевания и характеризуется поражением коры головного мозга. Выраженность психических расстройств варьирует в зависимости от пораженного участка и выраженности склеротических изменений и может проявляться как бессонницей, незначительным ухудшением памяти или легкой депрессией, так и тяжелыми психозами, судорогами, галлюцинациями.
При В12 дефицитной анемии неврологические симптомы появляются в определенной последовательности — вначале происходит симметричное поражение ног, затем живота и туловища. В более поздних стадиях в процесс вовлекаются пальцы рук, плечевой пояс, шея, может поражаться область лица и головы. В последнюю очередь появляются психические расстройства.
Диагностикой и лечением В12 дефицитной анемии занимается врач-гематолог, который, при необходимости, может привлекать других специалистов (гастролога, невролога).
Процесс диагностики В12 дефицитной анемии включает:
- общий анализ крови;
- биохимический анализ крови;
- пункцию костного мозга;
- установление причины В12 дефицитной анемии.
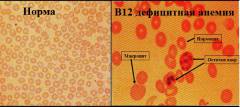
Целью данного исследования является определение клеточного состава периферической крови, а также детальное исследование полученного материала под микроскопом, что позволяет выявить отклонения в размерах, форме или составе клеток в крови.
Забор крови для анализа
Процедуру производит медсестра в специальном процедурном кабинете. Кровь берется утром, натощак. За 2 – 3 часа до сдачи анализа рекомендуется исключить курение и тяжелые физические нагрузки.
Для клинического анализа кровь могут брать:
- Из пальца (капиллярную). Капиллярную кровь берут из кончика пальца руки. Вначале с целью дезинфекции медсестра обрабатывает палец пациента ватой, смоченной в 70% спирте. После этого скарификатором (тонкой одноразовой стерильной пластинкой, которая заточена с обеих сторон) делается прокол кожи на глубину 2 – 4 мм. Первая появившаяся капля крови удаляется ватным тампоном, после чего в специальную промаркированную стеклянную трубку набирается несколько миллилитров крови. По окончании процедуры к месту прокола на 2 – 3 минуты прикладывается ватный тампон, пропитанный спиртом.
- Из вены. Кровь обычно берут из вен локтевой области, которые наиболее хорошо определяются под кожей. Если определить расположение вены в данной области не удается, кровь можно взять из любой другой вены. Пациент садится на стул и кладет руку на его спинку таким образом, чтобы локтевой сустав оказался в разогнутом состоянии. Медсестра накладывает тугой жгут на область плеча и определяет местоположение вены. Локтевая область дважды обрабатывается ватой, смоченной в спирте, после чего одноразовой стерильной иглой, присоединенной к шприцу, производится прокол вены и забор нескольких миллилитров крови. Потом игла извлекается, а к месту прокола на 5 – 7 минут прикладывается пропитанный спиртом ватный тампон.
Микроскопическое исследование
Для определения формы и размеров различных клеток в исследуемой крови, одну или несколько капель переносят на специально стекло, окрашивают специальными красителями и исследуют в световом микроскопе. Таким же способом можно подсчитать примерное содержание клеток в исследуемом образце.
Нормальный размер эритроцитов – 7,5 – 8,3 мкм. При микроскопическом исследовании они определяются как клетки красного цвета, одинаковых размеров, кольцевидной формы, не содержащие ядра или других включений.
При дефиците витамина В12 в костном мозге образуются мегалобласты. Часть из них сразу разрушается, а остальные поступают в кровоток.
При В12 дефицитной анемии микроскопическая картина периферической крови характеризуется:
- Пойкилоцитозом – наличием эритроцитов различной формы.
- Анизоцитозом – наличием эритроцитов различных размеров.
- Макроцитозом – наличием эритроцитов, увеличенных в диаметре (более 8,5мкм).
- Внутриклеточными включениями – в эритроцитах определяются остатки разрушенного ядра и некоторые органеллы.
- Гиперхромией – эритроциты имеют более выраженную окраску, чем в норме (что обусловлено большой концентрацией гемоглобина и отсутствием сужения в центре клетки).
Исследование в гематологическом анализаторе
В большинстве современных лаборатории имеются специальные гематологические анализаторы, которые позволяют в довольно короткие сроки получить точную информацию о количестве клеточных элементов в исследуемой крови, а также некоторые другие показатели.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Данный показатель более точно отображает средние размеры эритроцитов в исследуемой крови, так как оценивает большее количество клеток, чем то, которое исследует врач при обычной микроскопии. | 75 – 100 кубических микрометров (мкм 3 ). | 100 – 110 мкм 3 и более. | |
| Концентрация эритроцитов (RBC) | В результате усиленного разрушения эритроцитов в костном мозге и в селезенке количество их в периферической крови будет снижено. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Концентрация тромбоцитов (PLT) | При в12 дефицитной анемии нарушается образование не только эритроцитов, но и остальных клеток крови. | 180 – 320 х 10 9 /л. | Менее 180 х 10 9 /л. |
| Концентрация лейкоцитов (WBC) | Лейкоциты выполняют защитную функцию. В норме их концентрация увеличивается при различных инфекциях. При дефиците витамина В12 образование лейкоцитов нарушается, и их количество в крови может быть уменьшено даже при тяжелых инфекционных заболеваниях. | 4,0 – 9,0 х 10 9 /л. | Менее 4,0 х 10 9 /л. |
| Концентрация ретикулоцитов (RET) | При дефиците витамина В12 кроветворение в костном мозге неэффективно, клетки не созревают до стадии ретикулоцитов, в результате чего их количество в крови будет снижено. | М: 0,24 – 1,7%. | Может быть в несколько раз ниже нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | При В12 дефицитной анемии количество эритроцитов снижено, однако концентрация гемоглобина в каждом из них увеличена, что может поддерживать общий уровень гемоглобина в крови на нормальном уровне. | М: 130 – 170 г/л. | Может быть нормальным или слегка сниженным. |
| Ж: 120 – 150 г/л. | |||
| Средняя концентрация гемоглобина в эритроцитах (MCHC) | Дает более точную информацию о насыщении эритроцитов гемоглобином, так как не учитывается объем плазмы, в которой находятся клетки крови. | 320 – 360 г/л. | Более 400 г/л. |
| Среднее содержание гемоглобина в одном эритроците (MCH) | Определяется посредством деления уровня гемоглобина на количество эритроцитов (вычисления производятся гематологическим анализатором автоматически). | 27 – 33 пикограмм (пг). | Более 35 пг. |
| Гематокрит (Hct) | Данный показатель выражается в процентах и определяет долю клеточных элементов в общем объеме крови. | М: 42 – 50%. | Снижен из-за значительного уменьшения количества эритроцитов в крови. |
| Ж: 38 – 47%. | |||
| Цветовой показатель (ЦП) | Характеризует степень насыщения эритроцитов гемоглобином — чем его больше, тем выше будет цветовой показатель. | 0,85 – 1,05. | Более 1,1. |
| Скорость оседания эритроцитов (СОЭ) | Так как наружные поверхности эритроцитов заряжены отрицательно, они отталкиваются друг от друга, что препятствует их склеиванию. Суть определения СОЭ заключается в склеивании эритроцитов в крови и оседании их на дно пробирки под действием силы тяжести. Скорость данного процесса зависит от концентрации клеток в крови — чем их меньше, тем слабее они отталкиваются друг от друга, и тем быстрее будет СОЭ. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
Данное исследование позволяет определить наличие растворенных в крови веществ (белков, ферментов, витаминов и других). Практически любое заболевание (в том числе и В12 дефицитная анемия) характеризуется увеличением или снижением концентрации различных веществ в крови, что позволяет судить о выраженности патологического процесса и степени повреждения внутренних органов, а также контролировать эффективность проводимого лечения.
Кровь для биохимического исследования берется из вены (подготовка пациента и методика забора материала были описаны выше), после чего в специальной пробирке направляется в лабораторию.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Содержание кобаламина в крови | Обычно заболевание характеризуется снижением уровня витамина В12. Однако в некоторых случаях (при нарушениях обмена кобаламина в организме) концентрация данного витамина в крови будет увеличена, несмотря на клинические проявления В12 дефицитной анемии, поэтому данный показатель необходимо оценивать, учитывая данные других анализов. | 200 – 900 пг/мл. |
|
| Уровень метилмалоновой кислоты в крови | Данное вещество участвует в процессах жизнедеятельности клеток. Для его использования необходимо наличие активной формы кобаламина (ДА-В12), в отсутствии которой метилмалоновая кислота не может использоваться клетками организма, в результате чего ее концентрация в крови повышается. | 73 – 270 нмоль/мл. | Значительно выше нормы. |
| Уровень гомоцистеина в крови | Гомоцистеин – аминокислота, которая участвует в образовании вещества метионина, входящего в состав миелиновых оболочек нервных клеток. Этот процесс также требует присутствия активной формы кобаламина (метил-В12). При его недостатке количество свободного гомоцистеина в плазме крови повышается. | 5 – 16 мкмоль/л. | Значительно выше нормы. |
| Концентрация билирубина (несвязанной фракции). | Уровень несвязанного билирубина может повышаться при массивном разрушении мегалобластов в красном костном мозге и в селезенке. | 4,5 – 17,1 мкмоль/л. | Может быть увеличен в несколько раз, особенно при длительном течении заболевания. |
| Концентрация сывороточного железа | При интенсивном разрушении эритроцитов и их предшественников из них выделяется большое количество железа. В нормальных условиях оно используется для синтеза новых эритроцитов, однако при В12 дефицитной анемии данный процесс нарушен, в результате чего концентрация железа в крови может повышаться. | М: 17,9 – 22,5 мкмоль/л. | Может повышаться при длительном течении заболевания. |
| Ж: 14,3 – 17,9 мкмоль/л. |
Обычно костный мозг берут из грудины. Процедура выполняется только специально обученным врачом в условиях стерильной операционной. Место пункции дважды обрабатывается 70% спиртовым или йодным раствором. После этого специальным шприцем с полой иглой, установленной под прямым углом к грудине, прокалывают кожу и надкостницу и продвигают иглу на 1 – 2 см в вещество кости. Убедившись, что игла находится в полости кости, производится забор нескольких миллилитров костного мозга, который имеет вид густого, желтовато-красно вещества. Полученный материал направляется в лабораторию для микроскопического исследования.
При В12 дефицитной анемии в костном мозге определяется увеличение клеточных элементов (преимущественно за счет предшественников эритроцитов). Клетки увеличены в размерах, содержат слишком большое количество гемоглобина (по сравнению с нормой). Также отмечается нарушение созревания мегакариоцитов (предшественников тромбоцитов) и промиелоцитов (предшественников лейкоцитов).
При подтверждении диагноза не менее важным моментом является выявление его причины, так как ее устранение (если оно возможно) может привести к излечению пациента.
Для выявления причины В12 дефицитной анемии используется:
- Оценка рациона пациента. Уточняется, как питается пациент, потребляет ли достаточное количество животных продуктов, как часто употребляет алкогольные напитки.
- Фиброгастродуоденоскопия (ФГДС). Метод исследования внутренней поверхности желудка и начального отдела кишечника посредством введения специальной трубки с видеокамерой на конце. Позволяет выявить атрофию слизистой, наличие рака или язвы.
- Биопсия слизистой оболочки желудка и/или кишечника. Подразумевает прижизненное взятие кусочка ткани слизистой оболочки и исследование его клеточного строения. Позволяет выявить атрофические процессы, а также различить доброкачественные и злокачественные опухоли.
- Анализ кала на яйца гельминтов (глистов). С помощью данного метода можно установить само наличие паразитов, а также определить их чувствительность к различным противопаразитарным препаратам, что позволит назначить максимально эффективное лечение.
- Определение специфических антител. В крови могут определяться антитела к внутреннему фактору Касла либо к париетальным клеткам слизистой оболочки, которые его продуцируют.
- Оценка функции печени. Определяется уровень печеночных ферментов в крови, проводится ультразвуковое исследование (УЗИ) органа.
- Определение уровня гормонов щитовидной железы в крови. При их увеличении потребление кобаламина организмом возрастает, что со временем может привести к развитию В12 дефицитной анемии.
Суть медикаментозной терапии данного недуга заключается в ведении витамина В12 извне. Поступив в организм, кобаламин быстро включается в процессы кроветворения, что приводит к устранению симптомов анемии в довольно короткие сроки.
Показаниями к началу лечения витамином В12 являются:
- подтвержденный (лабораторно) диагноз В12 дефицитной анемии;
- концентрация кобаламина в плазме крови менее 220 пг/мл;
- выраженная клиническая картина анемии (даже при более высокой концентрации кобаламина в крови).
Способ применения и дозировка
В большинстве случаев препарат витамина В12 (цианокобаламин) вводится внутримышечно. Прием внутрь (в виде таблеток) допускается, если достоверно установлено, что причиной дефицита витамина является недостаточное его количество в пище, а общее состояние организма не критично (легкое снижение показателей крови, отсутствие неврологических проявлений).
Лечение начинают с внутримышечного введения 500 – 1000 мкг цианокобаламина 1 раз в сутки. Минимальный курс лечения – 6 недель, после чего переходят на поддерживающую терапию. Дозировка препарата на данном этапе лечения зависит от причины и выраженности дефицита витамина В12 в организме. Обычно назначается внутримышечное введение 200 – 400 мкг цианокобаламина 2 – 4 раза в месяц. Поддерживающая терапия может проводиться пожизненно.
Контроль эффективности лечения
В период лечения рекомендуется сдавать общий анализ крови 2 – 3 раза в неделю.
Первым признаком эффективности терапии, а также достоверным подтверждением диагноза является «ретикулоцитарный криз», возникающий на 3 – 5 день после начала введения витамина В12 в организм. Данное состояние характеризующийся резким увеличением количества ретикулоцитов в крови (в 10 – 20 раз), что свидетельствует о начале нормального кроветворения в косном мозге.
В течение 1 – 1,5 месяцев происходит постепенная нормализация состава периферической крови, ослабление неврологических проявлений, нормализация работы пищеварительной системы, что свидетельствует об эффективности проводимого лечения. На этапе поддерживающей терапии рекомендуется ежемесячное проведение общего анализа крови и определение уровня кобаламина в крови.
Суть метода заключается в переливании пациенту крови или, чаще, отдельной эритроцитарной массы. Переливание крови является опасной процедурой, поэтому данный метод используется только при угрожающих жизни состояниях.
Показаниями к переливанию эритроцитов при В12 дефицитной анемии являются:
- Тяжелая анемия – уровень гемоглобина менее 70 г/л;
- Анемическая кома – потеря сознания, обусловленная выраженным нарушением доставки кислорода к мозгу.
Перед началом процедуры проводятся тесты на совместимость крови донора и реципиента (того, кому переливается кровь), после чего в одну из больших вен организма вводится катетер, через который переливается эритроцитарная масса. Так как данная процедура сопряжена с риском развития множества побочных реакций, в течение всего периода переливания крови в палате должен присутствовать врач.
При подтвержденном диагнозе В12 дефицитной анемии одновременно с переливанием донорских эритроцитов начинают внутримышечное введение витамина В12. Переливание крови следует прекратить как можно раньше, как только устранено угрожающее жизни состояние.
Как говорилось ранее, суточная потребность в витамине В12 составляет 3 – 5 мкг, а запасы данного витамина в печени настолько велики, что даже при прекращении поступления кобаламина в организм признаки его дефицита появятся не ранее, чем через 2 – 3 года. Тем не менее, диета играет определенную роль в процессе лечения заболевания, особенно когда запасы витаминов В12 в организме снижаются.
Причинами снижения запасов витамина В12 в организме могут быть:
- Заболевания печени. Такие заболевания как цирроз и рак печени, приводят к уменьшению количества нормальных клеток органа, и замещению их соединительно тканью, которая неспособна депонировать витамин В12. В результате запасы данного витамина в организме снижаются, а при нарушении его поступления признаки заболевания могут появляться в более ранние сроки.
- Беременность. В данном случае матери необходимо обеспечивать витамином В12 не только свой, но и быстро развивающийся организм ребенка, поэтому суточная потребность в витамине В12 может увеличиваться на 50%, а в случае многоплодной беременности – еще больше. В нормальных условиях (при отсутствии заболеваний печени) запасов кобаламина в организме достаточно, чтобы покрыть потребности матери и плода в данном веществе. Однако при частых беременностях запасы кобаламина могут истощаться, особенно если у матери имеются какие-либо заболевания печени, поэтому беременным женщинам особенно важно потреблять достаточное количество этого витамина с пищей.
| Наименование продукта | Содержание витамина В12 в 100г продукта |
| Печень говяжья | 60 мкг |
| Печень свиная | 30 мкг |
| Печень куриная | 16 мкг |
| Скумбрия | 12 мкг |
| Мясо кролика | 4,3 мкг |
| Говядина | 2,6 мкг |
| Морской окунь | 2,4 мкг |
| Свинина | 2 мкг |
| Треска | 1,6 мкг |
| Карп | 1,5 мкг |
| Куриное яйцо | 0,5 мкг |
| Сметана | до 0,4 мкг |

С тех пор как в лечении В12 дефицитной анемии начали применять внутримышечное введение цианокобаламина прогноз для жизни и здоровья пациентов значительно улучшился. При соблюдении режима приема препарата люди могут доживать до глубокой старости без каких-либо проявлений заболевания.
источник