Апластическая анемия — это синдром хронической первичной недостаточности гемопоэза с одновременным присутствием панцитопении (анемии, нейтро-пении и тромбоцитопении). По всей видимости, у большинства пациентов развитие заболевания инициируют аутоиммунные механизмы. Способствующим фактором, по крайней мере у некоторых пациентов, вероятно, служат наследственные или приобретенные нарушения КСК.
а) Этиология. Наиболее распространенные причины апластической анемии перечислены в таблице ниже. Большинство случаев известной этиологии связано с воздействием химических веществ и лекарственных средств. Некоторые препараты и химические вещества (включая многие противоопухолевые химиотерапевтические вещества и органический растворитель бензол) вызывают дозозависимую и обратимую супрессию костного мозга.
В других случаях апластическая анемия возникает непредсказуемым образом по типу идиосинкразии в ответ на лекарственные средства (например, хлорамфеникол и соли золота), обычно не вызывающие супрессию костного мозга.
Персистирующая аплазия костного мозга может появиться после различных вирусных инфекций; чаще всего после вирусного гепатита типа не-А, не-В, не-С, не-G (5-10% случаев). Почему апластическая анемия возникает только у некоторых индивидов, до сих пор неизвестно.
Облучение всего тела может разрушать КСК в зависимости от дозы облучения. У лиц, получавших терапевтическое облучение или подвергшихся облучению в результате несчастного случая (например, как это было в Чернобыле), существует риск развития аплазии костного мозга.
В основе некоторых форм апластической анемии лежат наследственные дефекты. Анемия Фанкони представляет собой редкое аутосомно-рецессивное заболевание, вызываемое дефектами мультибелкового комплекса, необходимого для репарации ДНК. Гипофункция костного мозга становится очевидной в раннем периоде жизни и обычно сопровождается множественными врожденными аномалиями, например гипоплазией почек и селезенки, аномалиями костей, чаще всего большого пальца кисти и лучевых костей.
Наследственные дефекты теломеразы обнаруживаются в 5-10% случаев апластической анемии, возникающей у взрослых. Напомним, что теломераза необходима для клеточного «бессмертия» и неограниченной репликации, поэтому последствием частичного дефицита активности теломеразы могут быть преждевременное истощение КСК и аплазия костного мозга. Аномально короткие теломеры, которые обнаруживаются в клетках костного мозга у 50% лиц, страдающих апластической анемией, встречаются более часто, чем мутации теломеразы. Остается неясным, обусловлено ли это укорочение какими-то другими дефектами теломеразы или является следствием избыточной репликации стволовых клеток.
В большинстве случаев инициирующий фактор идентифицировать не удается; 65% случаев попадает в эту идиопатическую категорию.
б) Патогенез. Патогенез апластической анемии изучен не полностью. Маловероятно, что в основе всех случаев лежит единый механизм. Однако очевидно, что существуют два основных этиологических фактора: внешняя, иммуноопосредованная супрессия костномозговых клеток-предшественников и внутренняя аномалия стволовых клеток.
Все большее внимание привлекает экспериментальная модель, в которой активированные Т-клетки супрессируют КСК. Вначале могут произойти антигенные изменения стволовых клеток в результате действия лекарственных средств, инфекционных агентов или других, неизвестных внешних воздействий. Это вызывает клеточный иммунный ответ, в течение которого активированные Тh1 -клетки продуцируют цитокины, например IFN-y и TNF, которые супрессируют и убивают гемопоэтические клетки-предшественники. Такое представление подкрепляется рядом наблюдений.
Исследование немногих сохраняющихся при апластической анемии стволовых клеток костного мозга показало, что у них повышена экспрессия генов, участвующих в апоптозе и активирующих пути клеточной гибели. Примечательно, что экспрессия тех же генов повышена у нормальных стволовых клеток, подвергнутых действию IFN-y.
Еще более убедительные (основанные на клиническом опыте) данные получены при изучении эффектов иммуносупрессивной терапии. Антитимоцитарный глобулин и другие иммуносупрессивные агенты, например циклоспорин, вызывают реакцию в 60-70% случаев. Предполагают, что действие этих лекарственных средств основано на супрессии или гибели клонов аутореактивных Т-клеток. Природа антигенов, распознаваемых аутореактивными Т-клетками, изучена недостаточно. В некоторых случаях мишенями могут быть связанные с GPI белки. Этим можно объяснить связь апластической анемии и пароксизмальной ночной гемоглобинурии.
Альтернативное предположение о том, что апластическая анемия возникает в результате фундаментальных дефектов стволовых клеток, подтверждается присутствием кариотипических аберраций, случайной трансформацией аплазии в миелоидную неоплазию (например, в миелодиспластический синдром либо острую миелоидную лейкемию) и связью с аномально короткими теломерами. Некоторые воздействия на костный мозг (или предрасположенность к повреждению ДНК), вероятно, влекут за собой нарушения, ограничивающие способность стволовых клеток к пролиферации и дифференцировке. Если повреждение значительное, развивается апластическая анемия.
Указанные механизмы не являются взаимоисключающими, поскольку генетически измененные стволовые клетки также могут экспрессировать неоантигены и тем самым служить мишенями для Т-клеток.
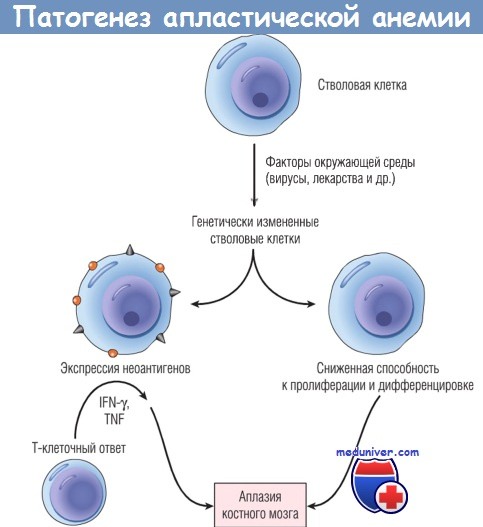
Поврежденные стволовые клетки могут продуцировать дочерние клетки, экспрессирующие неоантигены,
которые вызывают аутоиммунную реакцию, или же образуют клональную популяцию со сниженной пролиферативной активностью.
В обоих случаях возможна аплазия костного мозга.
IFN — интерферон; TNF — фактор некроза опухоли.
в) Морфология. Заметно обедненный клетками костный мозг в значительной степени лишен гемопоэтических клеток. Нередко остаются только жировые клетки, фиброзная строма, рассеянные лимфоциты и плазматические клетки. Аспирация костного мозга часто дает мало материала («сухой прокол»), поэтому для исследования лучше всего использовать биоптаты костного мозга. Другие неспецифические патологические изменения — гранулоцитопения и тромбоцитопения — обусловлены мукокутанными бактериальными инфекциями и аномальным кровотечением соответственно. Проведение множественных трансфузий при анемии индуцирует развитие системного гемосидероза.
г) Клинические признаки. Апластическая анемия наблюдается в любом возрасте и не зависит от пола. Обычно начало болезни бессимптомно. Первые проявления варьируют в зависимости от того, какая клеточная линия преимущественно поражена, однако в конечном итоге возникает панцитопения с ожидаемыми последствиями. Анемия вызывает прогрессирующую слабость, бледность и одышку. О тромбоцитопении свидетельствуют петехии и экхимозы. Нейтропения приводит к развитию частых и персистирующих минорных инфекций или внезапных озноба, лихорадки и общей слабости. Спленомегалия, как правило, отсутствует.
Если же она есть, то диагноз «апластическая анемия» должен быть подвергнут тщательной проверке. Со стороны эритроцитов обычно отмечается слабо выраженный нормохромный макроцитоз, а ретикуло-цитопения присутствует всегда.
Диагноз основывают данными исследований биоптатов костного мозга. Важно отличить апластическую анемию от других типов панцитопении, таких как алейкемическая лейкемия и МДС, которые могут иметь идентичные клинические проявления. При апластической анемии костный мозг обычно значительно обеднен клетками, тогда как миелоидные неоплазии ассоциируются с гиперклеточным костным мозгом, заполненным неопластическими клетками-предшественниками.
Прогноз вариабелен. Трансплантация костного мозга — терапия выбора, если есть подходящий донор, что обеспечивает 5-летнюю выживаемость в 75% случаев. Организм пожилых пациентов и тех больных, которым не смогли подобрать подходящего донора, часто хорошо отвечает на иммуносупрессивную терапию.
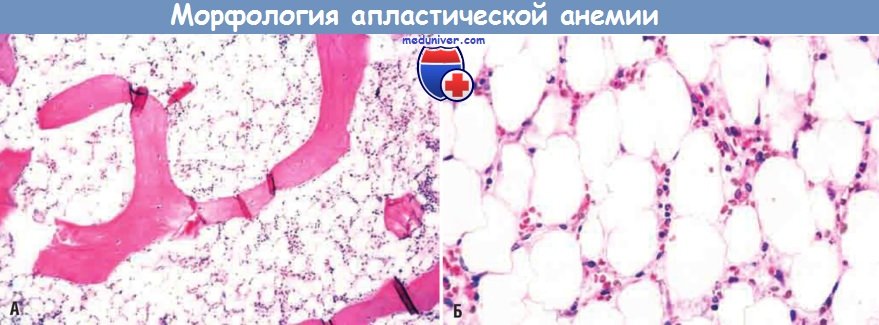
Заметное снижение количества клеток в костном мозге, содержащем в основном жировые клетки.
(А) Малое увеличение. (Б) Большое увеличение.
источник
Апластические анемии (АА) – группа патологических состояний, характеризующихся панцитопенией, уменьшением клеточности (абсолютного содержания клеток) костного мозга при содержании бластов менее 5%.
Классификация апластических анемий по этиологии:
а) врожденная (анемия Фанкони, анемия Джозефа-Дайемонда-Блекфена и др.)
б) приобретенная вследствие:
1) воздействия химических веществ (бензол, пестициды, соединения свинца)
2) воздействия лекарственных средств (хлорамфеникол, фенитоин, фенилбутазон, соединения золота и др.)
3) аутоагрессии и появления аутоантител к кроветворным клеткам
4) воздействия радиоактивного излучения
5) инфекционных заболеваний (ВГВ, ВГС, инфекционный мононуклеоз, цитомегаловирусная инфекция)
6) других заболеваний (тимомы, лимфомы и др.)
в) идиопатическая (с неустановленной причиной)
Патогенез апластических анемий: генетические нарушения, воздействие агрессивных веществ, аутоиммунные реакции ® нарушение созревания частично детерминированной стволовой клетки ® уменьшение количества стволовых клеток ® уменьшение количества эритроцитов, тромбоцитов, лейкоцитов в периферической крови.
Клиника апластических анемий:
а) приобретенная апластическая анемия: постепенное или острое начало с быстро нарастающей панцитопенией, выраженным анемическим синдромом, тяжелым геморрагическим синдромом и инфекционными осложнениями; иногда заболевание осложняется внутрисосудистым гемолизом (появляются желтушность кожи и видимых слизистых, темная моча, незначительное увеличение печени, тромбозы множественной локализации).
б) анемия Фанкони: чаще начинается в 5-10 лет; вместе с нарушениями гемопоэза характерны низкий рост, врожденные дефекты скелета (микроцефалия, аномалии фаланг пальцев), аномалии мочеполовой системы (подковообразная почка и др.), гипер- или гипопигментация кожи, умственная отсталость
Диагностика апластических анемий:
1. ОАК: панцитопения (эритро-, тромбо-, лейкоцитопения с нейтропенией и относительным лимфоцитозом)
2. Миелограмма: уменьшение количества миелокариоцитов, относительное повышение содержания лимфоцитов, абсолютное снижение количества нейтрофилов, элементов эритропоэза, резкое уменьшение мегакариоцитопоэза
3. Трепанобиопсия с иммунофенотипированием клеток (необходима для установки генеза апластической анемии): жировой костный мозг преобладает над деятельным, очаги кроветворения редки и малоклеточны
Лечение апластических анемий:
1. Госпитализация в гематологический стационар; при резкой нейтропении – изоляция больного в асептический бокс
2. Трансплантация стволовых клеток периферической крови или костного мозга – рекомендуется всем больным до 20 лет, даже при тяжелом течении апластической анемии, особенно показана зависимым от гемотрансфузий больным (у которых нужны переливания крови чаще 1 раза в мес); до трансплантации костного мозга проводят химиотерапию с тотальным облучением тела.
3. Специфическая консервативная терапия – основной метод лечения для больных старше 20 лет при легком течении заболевания или невозможности выполнить трансплантацию костного мозга: антитимоцитарный иммуноглобулин 20 мг/кг/сут в/в капельно 5 дней в асептических условиях; циклоспорин 5 мг/кг/сут внутрь; метилпреднизолон по 2 мг/кг/сут в/в с 1-ого по 14-ый день, затем по 1 мг/кг/сут с 15-ого по 21-ый день; колониестимулирующие факторы — молграмостим 5 мкг/кг/сут п/к до увеличения числа гранулоцитов > 1*10 9 /л.
4. Спленэктомия (наиболее эффективна при нетяжелой апластической анемии)
5. Профилактика и лечение осложнений (анемического синдрома, геморрагического синдрома, инфекционных осложнений, гемосидероза, сердечной и почечной недостаточности и др.)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8464 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Гипопластическая и апластическая дифдиагноз
Термины «апластическая» и «гипопластическая» анемия применяются для обозначения группы болезней и синдромов, в основе которых в большинстве случаев лежат либо изолированная гипоплазия эритроцитарного ростка, либо гипоплазия нескольких ростков костного мозга. Обе формы анемии могут быть как врожденными, так и приобретенными. В эту же группу принято включать так называемые псевдоапластические анемии, развитие которых связано с глубокими нарушениями структуры и функции эритробластов и эритроцитов. Несмотря на выраженную анемию, в костном мозге этих больных обнаруживается большое количество эритробластов.
По современным взглядам, гипопластическая анемия представляет собой болезнь костного мозга, которая проявляется его неспособностью вырабатывать эритроциты. В большинстве случаев отмечается поражение лейкоцитарного и мегакариоцитарного ростков, проявляющееся нейтропенией и тромбоцитопенией.
Этиология и патогенез
В наше время гипопластическая анемия чаще всего вызывается лекарственными средствами и химическими веществами, применяемыми в быту, промышленности и сельском хозяйстве. Особенно часто наблюдается связь гипопластической анемии с употреблением антибиотиков, сульфаниламидов, гипогликемизирующих средств, препаратов золота. Функциональная депрессия костного мозга часто развивается после контакта с растворителями (например, бензином), инсектицидами. Причина гипопластической анемии во многих случаях остается неясной. Подобные случаи классифицируются как «идиопатические».
Врожденные формы гипопластической анемии начинаются: обычно незаметно, а приобретенные часто протекают как острое заболевание с выраженной лихорадкой и геморрагическим синдромом. Указанные особенности клинической картины в прошлом послужили основанием для наименования болезни «септическая ангина», «геморрагическая алейкия».
Клиника и диагностика
При осмотре больного обращает на себя внимание резкая бледность кожи, слизистых оболочек и склер. Печень и селезенка не увеличены. В случаях, осложненных ангиной, иногда бывают незначительно увеличенными шейные и подчелюстные лимфатические узлы.
Клинические проявления болезни в значительной мере определяются характером поражения костного мозга. При изолированном поражении эритроцитарного ростка болезнь начинается как тяжелая «рефрактерная» анемия. Одновременное поражение всех ростков дает картину панмиелофтиза. Когда болезнь начинается с поражения мегакариоцитарного ростка, она в течение некоторого времени принимается обычно за тромбоцитопеническую пурпуру. Более раннее или преимущественное поражение миелоидного ростка проявляется сначала как агранулоцитоз или агранулоцитар-ная ангина. Перечисленные начальные проявления спустя некоторый срок сменяются развернутой картиной болезни с одновременным поражением всех трех ростков костного мозга. При выздоровлении в последнюю очередь исчезает тромбоцитопения.
В анализах периферической крови обычно выявляются панцитопения, анемия, анемия и нейтропения, анемия и тромбоцитопения. Содержание лимфоцитов в крови может быть увеличенным, нормальным или пониженным. По данным стернальной пункции и треданобиопсии, костный мозг содержит уменьшенное количество клеток.
Парциальная гипоплазия эритроцитарного ростка проявляется нормоцитарной или нерезко выраженной макроцитарной анемией. Количество лейкоцитов и тромбоцитов в начале болезни остается нормальным. Позднее развивается тромбоцитопения или панцитопения с характерными для них геморрагическими и инфекционными осложнениями. Примерно у половины больных обнаруживается тимома, оперативное удаление которой нередко приводит к ремиссии. Гипопластическая анемия с изолированным угнетением эритропоэза может быть первым клиническим проявлением и раковой опухоли.
Апластическая и гипопластическая анемия относятся к числу весьма трудно распознаваемых болезней.
Апластические анемии — гетерогенная группа заболеваний системы крови, основу которых составляет уменьшение продукции клеток костного мозга, чаще трех клеточных линий (эритроцито-, лейко- и тромбоцитопоэза).
Этиология и патогенез
В 50—75% случаев причина апластических анемий остается неизвестной. Развитие их может быть обусловлено различными экзогенными факторами с облигатным действием (ионизирующая радиация, бензол и его производные, противоопухолевые химиопрепараты, неорганические соединения мышьяка и др.) или факультативным миелотоксическим действием (стрептомицин, левомицетин, противосудорожные, антитиреоидные, антигистаминные, противомалярийные и другие средства). Возможны случаи апластических анемий при туберкулезе, беременности, гепатите. Из эндогенных факторов придают значение эстрогенам. Этиология конституциональной апластической анемии связана скорее всего с наследованием патологического гена от одного из родителей по рецессивному типу.
Классификация апластических анемий
Среди апластических анемий выделяют конституциональную и приобретенные. Наряду с типичной формой встречаются варианты заболевания, протекающие в виде парциальной красноклеточной аплазии или сопровождающиеся периодическим развитием внутрисосудистого гемолиза по типу пароксизмальной ночной гемоглобинурии (в начале становления болезни или на отдельных этапах процесса). У детей выделяют приобретенные, семейные и врожденные формы апластических анемий.
Примерная формулировка диагноза:
1. Апластическая анемия с панцитопенией (эритро-, тромбо-, лейкопенией с нейтропенией и относительным лимфоцитозом), миелокариоцитопенией, геморрагиями (синяки на коже, десневые и носовые кровотечения).
2. Апластическая анемия с панцитопенией, миелокариоцитопенией и геморрагическим синдромом, протекающая периодически с виутрисосудистым гемолизом (по типу пароксизмальной ночной гемоглобинурии).
3. Парциальная красноклеточная аплазия с выраженной анемией и уменьшением эритропоэза в костном мозге.
Больные апластическими анемиями бледны, с сохраненным или избыточным подкожным жировым слоем. Они жалуются на общую слабость, быструю утомляемость, пониженную работоспособность. Обычно имеются геморрагии в коже и слизистых оболочках, кровотечения из носа и десен, маточные, желудочно-кишечные и почечные кровотечения, кровоизлияния в головной мозг и любой другой орган.
К характерным признакам заболевания относятся: панцитопения (эритро-, тромбо-, лейкоцитопения с нейтропенией и относительным лимфоцитозом); в миелограмме — уменьшение количества миелокариоцитов, относительное повышение содержания лимфоцитов, абсолютное снижение количества нейтрофилов, элементов эритропоэза, резкое уменьшение мегакариоцитопоэза; в трепанобиоптате подвздошной кости жировой костный мозг преобладает над деятельным, в сохранившихся участках кроветворения встречаются преимущественно лимфоциты, эритро- и нормобласты, часто содержащие гранулы железа; более чем в 90% случаев имеет место внутриклеточный гипергемолиз с разрушением эритроцитов, главным образом в селезенке. В различные сроки заболевание иногда осложняется внутри-сосудистым гемолизом, присущим пароксизмальной ночной гемоглобинурии. В этих случаях выявляются желтушность кожных покровов и видимых слизистых оболочек, темная моча, незначительное увеличение печени, редко — селезенки и развитие тромбозов множественной локализации. Наличие внутрисосудистого гемолиза, подтверждается повышением свободной фракции билирубина сыворотки крови и свободного гемоглобина плазмы, положительные тесты Хема и Хартмана.
Среди апластических анемий у детей наряду с приобретенными формами, существенно не отличающихся от апластических анемий у взрослых, выделяют врожденный и семейный варианты.
Анемия Фанкони, носящая семейный характер, чаще встречается среди мальчиков. Первые симптомы болезни обычно проявляются в возрасте 6—8 лет. Изменения гемопоэза сочетаются с геморрагическим синдромом и разнообразными аномалиями развития скелета и внутренних органов в виде уменьшения количества костей запястья, отсутствия или гипоплазии большого пальца, клинодактилии, микроцефалии, деформации грудной клетки, пороков развития органов дыхания, почек и мочевыводящих путей, врожденных пороков сердца и других изменений. Наблюдаются также эндокринные нарушения в виде пигментации кожи и слизистых оболочек, выраженность которой обычно соответствует тяжести течения процесса.
Врожденная парциальная апластическая анемия Джозефа — Дайемонда — Блекфена развивается в раннем детском возрасте. Возможно, она связана с аутоиммунным процессом, возникающим в период внутриутробного развития или с врожденным метаболическим дефектом. Анемия различной степени сочетается с глубокой эритро- и нормобластопенией на фоне миелокариоцитопении. Лейкопээз и тромбопоэз сохранены, не наблюдается кровоточивости.
Для семейной апластической анемии Эстрена — Дамешека характерны те же изменения со стороны кроветворения, что при апластических анемиях взрослых. В отличие от апластической анемии Фанкони при этой форме не наблюдаются аномалии развития скелета и внутренних органов.
Верификация диагноза
При обнаружении клинико-гематологических данных, характерных для апластической анемии, установление диагноза не вызывает затруднений. Если заболевание протекает с синдромом внутрисосудистого гемолиза, диагноз устанавливается на основании клинической симптоматики и результатов лабораторных исследований.
Если апластическая анемия предшествует возникновению острого лейкоза, диагноз устанавливается с помощью изучения миелограммы и особенно гистологической картины костного мозга. При злокачественных новообразованиях (чаще — желудочно-кишечного тракта) вследствие токсического влияния опухоли и/или метастазирования в костный мозг может развиться депрессия кроветворения. Она встречается при остеосклерозе, остеомиелофиброзе (учитываются данные рентгенографии костей скелета, трепанобиопсии, размеры печени, селезенки и др.).
Последнее изменение этой страницы: 2016-04-26; Нарушение авторского права страницы
источник
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r) •• Группа В (тип 2, *227660, дефект гена FA2, r) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r) •• Группа D (тип 4, *227646, дефект гена FA4, r).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5´109/л, тромбоциты 100´109/л, мегакариоциты меньше 80´109/л) и тяжёлую (в периферической крови гранулоциты менее 0,5´109/л, тромбоциты менее 20´109/л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100´109/л, гранулоцитов более 1,5´109/л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100´109/л, гранулоцитов 0,5–1,5´109/л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30´109/л (без проведения трансфузий).
источник
Сущность гипопластической (и апластической) анемии состоит в резком угнетении костномозгового кроветворения, что сопровождается снижением количества эритроцитов, лейкоцитов и тромбоцитов. Известна также парциальная форма гипопластической анемии с угнетением образования только эритроцитов.
Этиология.К резкому угнетению костномозгового кроветворения приводят различные причины:
• внешние факторы, оказывающие миелотоксическое действие (иони
зирующая радиация, цитостатические препараты, различные хими
ческие вещества, лекарственные средства);
• внутренние причины (эндогенные): влияние токсичных веществ
при уремии, гипотиреозе и др.;
• идиопатические формы, когда не удается выявить никаких причин
развития анемии (у 50 % больных).
Патогенез.Механизм развития гипоплазии (аплазии) костного мозга окончательно не выяснен. Предполагают несколько механизмов развития АА: 1) поражение полипотентной стволовой клетки костного мозга; 2) подавление кроветворения, связанное с воздействием иммунных механизмов (клеточных, гуморальных); 3) нарушения в функционировании элементов «микроокружения»; 4) дефицит факторов, стимулирующих кроветворение.
Содержание веществ, непосредственно участвующих в процессе кроветворения (железо, витамин Bi2, протопорфирин), не снижено, но они не могут быть использованы кроветворной тканью.
Клиническая картинаболезни чрезвычайно разнообразна и связана в основном с цитопенией и зависит от степени ее выраженности. Соответственно этому проявления болезни чрезвычайно разнообразны: существуют переходные формы от частичного угнетения кроветворения до выраженной аплазии костного мозга.
Можно выделить три основных синдрома: цитопенический, септико-некротический и геморрагический. Их различная выраженность обусловливает пестроту данных, получаемых на различных этапах диагностического поиска.
В периферической крови определяется выраженная анемия, обычно нормохромная. Содержание гемоглобина снижается до 20 — 30 г/л. Содержание ретику-лоцитов снижено, что свидетельствует о гипорегенераторном состоянии костного мозга. Характерны выраженные лейкопения, гранулоцитопения. Содержание лимфоцитов не изменено. Число тромбоцитов снижается иногда до нуля. В большинстве случаев значительно увеличивается СОЭ (до 30-50 мм/ч).
В костном мозге уменьшено содержание миелокариоцитов, увеличено число лимфоцитов, тучных и плазматических клеток. Мегакариоциты могут полностью отсутствовать. При гистологическом исследовании костного мозга обращает внимание почти полное исчезновение костномозговых элементов и замещение их жировой тканью.
Содержание железа сыворотки у большинства больных увеличено, насыщение трансферрина железом практически 100 %.
Диагностика.Распознавание болезни основывается на данных цитологического исследования периферической крови и цитоморфологическо-го исследования костного мозга. При подозрении на АА обязательно выполнение трепанобиопсии. Необходимо провести дифференциальную диагностику с рядом заболеваний, протекающих с цитопенией: дебютом острого лейкоза, метастазами рака в костный мозг, костномозговой формой хронического лимфолейкоза. Панцитопения у пожилых людей может быть также проявлением В^-дефицитной анемии (однако при этом в костном мозге обнаруживаются мегалобласты, при патоморфологическом изучении трепаната выявляется гиперплазия костного мозга в противоположность аплазии при АА). Следует подчеркнуть, что диагноз АА является «диагнозом исключения» и устанавливается лишь в случае, если перечисленные причины развития аплазии полностью исключены.
Течение.Согласно международным критериям, принято выделять две основные формы АА. Критериями тяжелой формы являются: содержание нейтрофилов в периферической крови менее 0,510 9 /л, тромбоцитов — менее 2010 9 /л, ретикулоцитов — менее 10 %о; при исследовании костного мозга отмечается выраженное снижение клеточности или умеренная гипоплазия с количеством гемопоэтических клеток менее 30 %. Если показатели периферической крови соответствуют хотя бы двум критериям, а результаты исследования костного мозга — одному, то можно поставить диагноз тяжелой формы АА. При нетяжелой форме болезни прогноз намного лучше (все перечисленные показатели изменены существенно меньше).
ЛечениеАА — непростая задача, она должна включать:
• ликвидацию (или хотя бы ограничение) контакта больного с лица
ми, страдающими инфекционными заболеваниями (в том числе и
неспецифическими );
• устранение воздействия этиологического фактора (например, ле
карственных или химических средств, если доказана связь между
их приемом и развитием болезни);
• введение антилимфоцитарного глобулина;
• трансплантацию костного мозга.
Объем перечисленных мероприятий несколько различен при разном течении болезни, однако проведение части из них обязательно для всех больных.
Больного АА, особенно при содержании гранулоцитов менее 0,5-10 9 /л, изолируют в специально выделенную палату с боксом (где медицинский персонал меняет обувь и одежду); кожа больного обрабатывается антисептическим мылом, обязательна санация ротовой полости. Для ликвидации кишечной флоры назначают неадсорбируемые антибиотики. Для уменьшения менструальных кровопотерь на длительный срок рекомендуются препараты, уменьшающие кровопотерю или полностью прекращающие менструации (гормональные комбинированные средства).
При глубокой анемии переливают эритроцитную массу или отмытые эритроциты. При количестве тромбоцитов 20-10 9 /л или при наличии геморрагического синдрома осуществляют трансфузии тромбоцитной массы.
При нетяжелой форме эффективна спленэктомия (селезенка является органом, в котором образуются антитела, участвующие в цитотоксических реакциях). Эффект спленэктомии проявляется не сразу.
При тяжелой форме АА эффективен антилимфоцитарный (антимоно-цитарный) глобулин; препарат вводят внутривенно в течение 5 — 8 дней.
Пятилетняя выживаемость после лечения глобулином составляет 50 — 70 %. Антилимфоцитарный глобулин сочетают с циклоспорином А (сан-диммуном), представляющим собой препарат, воздействующий на функцию лимфоцитов путем подавления образования и секреции лимфокинов (возможно, иммуносупрессорный эффект циклоспорина А обусловливает подавление продукции антител против клеток костного мозга и периферической крови). Циклоспорин А назначают внутривенно, а затем внутрь.
При тяжелой форме АА показана трансплантация костного мозга от HLA-совместимого донора; показания к трансплантации ограничиваются возрастом (не старше 40 лет).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
источник
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
источник
Гипо- и апластические анемии. Этиология, патогенез. Характеристика кроветворения и основы лабораторной диагностики
Гипопластическая анемия — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, эритробластофтиз). Основа патологического процесса — нарушение пролиферации и дифференциации клеток костного мозга. Характерным признаком этого заболевания системы крови является полное истощение (аплазия) костного мозга и глубокое нарушение его функции, что сопровождается резко выраженной анемией, лейкопенией и тромбоцитопенией. Недостаточная продукция костным мозгом клеток обусловливает основные механизмы развития заболевания — анемический синдром, инфекционные осложнения в связи с гранулоцитопенией и геморрагический синдром.
Основными этиологическими факторами гипопластических анемий являются: ионизирующая радиация; инсектициды; цитостатические препараты; другие лекарственные средства; антитела против клеток костного мозга; вирусные инфекции (вирусный гепатит); наследственные факторы; идиопатическая гипо- и апластические анемии.
При исследовании периферической крови отмечаются панцитопения, резчайшая анемия с низким ретикулоцитозом, выраженным анизо-пойцилоцитозом. Содержание гемоглобина падает до 15—20 г/л. Лейкопения, тромбоцитопения разной степени. Резкое ускорение СОЭ — до 60—80 мин/ч. Исследование костномозгового кроветворения при апластической анемии обнаруживает картину почти полного опустошения костного мозга
В настоящее время основными патогенетическими факторами апластической анемии считаются:
- · поражение полипотентной стволовой гемопоэтической клетки;
- · поражение клеточного микроокружения стволовой кроветворной клетки и опосредованное нарушение ее функции;
- · иммунная депрессия кроветворения и апоптоз стволовых кроветворных клеток;
- · укорочение жизни эритроцитов;
- · нарушение метаболизма кроветворных клеток.
Поражение полипотентной стволовой гемопоэтической клетки — важнейший патогенетический фактор апластической анемии. Стволовая клетка является родоначальницей всех кроветворных клеток. При апластической анемии значительно снижается колониеобразующая способность костного мозга, нарушается пролиферация кроветворных клеток, в конечном итоге формируется синдром панцитопении — лейкопения, анемия, тромбоцитопения. Окончательно механизм угнетения активности полипотентной стволовой кроветворной клетки не выяснен.
Основная клиническая и лабораторная симптоматика приобретенной гипо- и апластической анемии с поражением всех трех кроветворных ростков костного мозга обусловлена тотальным угнетением гемопоэза, а также гипоксией органов и тканей и геморрагическим синдромом. Выраженность симптоматики зависит от степени тяжести и варианта течения анемии.
Больные предъявляют жалобы характерные для анемического синдрома. Характерны кровоточивость (десневые, носовые, желудочно-кишечные, почечные, маточные кровотечения) и частые инфекционно-воспалительные заболевания. При острой форме симптомы развиваются быстро и течение заболевания с самого начала тяжелое. Но у большинства больных заболевание развивается достаточно медленно, постепенно, в определенной мере пациенты адаптируются к анемии. Заболевание обычно распознается при выраженной симптоматике.
При осмотре больных обращает на себя внимание выраженная бледность кожи и видимых слизистых оболочек, часто с желтушным оттенком; геморрагические высыпания на коже, чаще в виде кровоподтеков различной величины. Часто на месте инъекций (внутримышечных, внутривенных, подкожных) образуются обширные гематомы. Геморрагическая сыпь локализуется преимущественно в области голеней, бедер, живота, иногда на лице. Могут наблюдаться кровоизлияния в конъюнктиву и видимые слизистые оболочки — губы, слизистую оболочку полости рта. Могут быть тяжелые носовые, желудочно-кишечные, почечные, легочные, маточные, внутрицеребральные кровотечения. Периферические лимфоузлы не увеличены.
При исследовании внутренних органов могут обнаруживаться следующие изменения:
- · Система органов дыхания — частые бронхиты, пневмонии.
- · Сердечно-сосудистая система — синдром миокардиодистрофии.
- · Система органов пищеварения — при выраженном геморрагическом синдроме могут обнаруживаться эрозии на слизистой оболочке желудка, 12-перстной кишки.
Нередко развивается гемосидероз внутренних органов вследствие повышенного разрушения неполноценных эритроцитов, снижения использования железа костным мозгом, нарушения синтеза гема, частых переливаний эритроцитарной массы.
Лабораторные данные и инструментальные исследования
Общий анализ крови — выраженное снижение количества эритроцитов и гемоглобина; анемия у большинства больных нормохромная, нормоцитарная; характерно отсутствие или резкое снижение количества ретикулоцитов (арегенераторная анемия); наблюдается лейкопения за счет гранулоцитопении с относительным лимфоцитозом; характерна тромбоцитопения. Таким образом, наиболее существенным лабораторным проявлением гипо- и апластической анемии является панцитопения. СОЭ увеличена.
Биохимический анализ крови — содержание сывороточного железа повышено, процент насыщения железом трансферина значительно увеличен.
Исследование стернального пунктата (миелограмма) — выраженное уменьшение клеток эритроцитарного и гранулоцитарного рядов, лимфоцитов и значительная редукция мегакариоцитарного ростка. В тяжелых случаях костный мозг выглядит «опустошенным», в стернальном пунктате можно обнаружить лишь единичные клетки. В костном мозге значительно увеличивается содержание железа, расположенного как внеклеточно, так и внутриклеточно.
- · Нормохромная нормоцитарная арегенераторная анемия с резким снижением или полным отсутствием ретикулоцитов, увеличением СОЭ.
- · Лейкоцитопения, абсолютная гранулоцитопения, относительный лимфоцитоз.
- · Тромбоцитопения.
- · Резко выраженный абсолютный дефицит в миелограмме клеток эритро-, лейко- и тромбоцитопоэза, задержка их созревания.
- * Увеличение содержания железа внутри эритрокариоцитов и внеклеточно.
- · Резкое уменьшение количества или полное исчезновение кроветворных клеток и замещение кроветворного костного мозга жировой тканью в трепанобиоптате подвздошной кости является основным методом верификации диагноза гипо- и апластической анемии).
- · Повышение уровня сывороточного железа.
источник
Результаты последних исследований кроветворной клетки-штамм, развитие техники костномозговой культуры в пробирке на полутвердой среде, равно как и накопление данных о пересадке костного мозга вызвали необходимость пересмотра проблемы патогенетических механизмов при апластической анемии.
Обсуждаются следующие 3 основных механизма:
1) сокращение популяции клеток-штамм;
2) неполноценность кроветворной микросреды;
3) иммунологические механизмы.
1. Сокращение численности клеток-штамм доказано при генуинных апластических анемиях и анемиях, развивающихся под воздействием токсических веществ, ионизирующего облучения и пр. Так, в костном мозге соответствующих больных отмечена небольшая концентрация CFU-c и CFU-E, что, косвенным образом, свидетельствует о сокращении численности кроветворных клеток-штамм.
Другую аномалию этих клеток составляет неспособность к репликации в связи с чем восстановление костного мозга более не осуществляется (Geary, Kern).
Статистика результатов пересадки костного мозга подтверждает эту гипотезу, поскольку у 48% из 110 больных, страдающих апластической анемией, отмечено полное восстановление, а это говорит о повторном заселении костного мозга нормальными кроветворными клеткамиштамм.
В природе эта гипотеза подтверждена существованием мышей W.WW, у которых отмечены наличие врожденной апластической анемии и неспособность к образованию селезеночных колоний (CFU-S), следовательно количественное сокращение кроветворных клеток-штамм, состояние, на которое можно положительно воздействовать пересадкой костного мозга от мышей w/w в норме.
2. Неполноценность кроветворной микросреды обнаружена Knospe и Crosby при экспериментах на облученных животных. Это явление можно проследить и в естественных условиях, у мышей Sl/Sld, в костномозговой строме которых не происходит кроветворение и которые отличаются наличием врожденной апластической анемии. На их анемию можно воздействовать селезеночной тканью мышей, с которой, в организм животного, поступает необходимая кроветворная строма; вместе с тем костномозговые клетки мышей в норме не оказывают одинаковое влияние, поскольку перевиваемые клетки-штамм лишены необходимой развитию микросреды.
Отсутствуют убедительные данные в отношении подобного механизма у человека, вопреки ряду исследований, результаты которых выявили поражение сосудисто-соединительнотканной стромы при апластической анемии.
3. Иммунологические механизмы апластической анемии. Недавно проведенные исключительно тщательные исследования установили наличие этих механизмов в отношении порождающих клеток.
Различаются следующие 2 иммуносупрессорных механизма — один опосредованный антителами против кроветворных предшественников и другой, опосредованный цитотоксическими лимфоцитами.
Так, в ряде заболеваний нейтропенией были выявлены антитела вида иммуноглобулинов Г или М, обусловливающие супрессию CFU-c (Kelton), в то время как во многих случаях эритробластопении отмечены антитела вида иммуноглобулина Г, которые угнетали образование CFU-E (тип А) или действовали как антиэритропоэтин (тип В) (Krantz).
Также описаны нейтропении и эритробластопении, обусловленные супрессорным механизмом, опосредованным чрезмерной активностью супрессорных лимфоцитов Т (Hoffmann, Kagan).
В кроветворной клетке-штамм предполагается (по материалам пересадок костного мозга болезнь «трансплантат против хозяина») наличие антител, действующих против поверхностных антигенов клеток-штамм, однако такое высказывание еще не подтверждено средствами современной техники (Silver, Geary).
источник
Апластические анемии у детей. Этиология, патогенез. Клиническая картина, диагностические критерии. Лечение.
Апластическая анемия — заболевание системы крови, характеризующееся глубокой панцитопенией, развивающейся в результате угнетения костномозгового кроветворения.
Клиническая классификация делит все виды апластической анемии на наследственные и приобретенные.
К наследственным относят анемии с полным поражением кроветворения, имеющие 2 подвида:
- Фанкони — в сочетании с врожденными пороками развития;
- Эстрена-Дамешека — без пороков.
А также анемию с частичным или избирательным поражением только эритроцитарного ростка (Даймонда-Блекфена). Макроцитарная.
Приобретенная апластическая анемия (гипопластическая) включает случаи:
- острого, подострого и хронического угнетения общего производства клеток крови;
- с поражением только эритроцитов — парциальную, красноклеточную анемию.
По разным статистическим данным, конкретные причины не удается установить в 49–78% случаев заболевания.
Наиболее изученными оказались врожденные формы: при анемии Фанкони отмечена четкая связь с изменениями в парных хромосомах №1 и №7. В случаях анемии Даймонда-Блекфена обнаружены мутации генов № 1, 16, 19 и 13. Возможными активаторами считают воздействие свободных радикалов-окислителей.
Другие причины делят на наружные и внутренние.
Экзогенные (наружные) включают:
- Химические агенты — производные бензола, ртути, нефтепродукты.
- Физическое воздействие проникающей радиации.
- Лекарственные препараты — противотуберкулезные средства (Изониазид, ПАСК), Анальгин, цитостатики, сульфаниламиды, некоторые антибиотики (Стрептомицин, Тетрациклин, Левомицетин).
- Инфекция — в ряде случаев доказана связь с перенесенными инфекционными заболеваниями (гриппом, ангиной, мононуклеозом), подавляющим действием на клетки крови обладают вирусы гепатита С, герпеса, Эпштейна-Барра, цитомегаловирус.
К внутренним причинам относятся:
- эндокринные нарушения — выявлена связь со сниженной функцией щитовидной железы, кистозными изменениями яичников у женщин;
- иммунные сдвиги — в связи с потерей в пожилом возрасте регулирующей роли тимуса (вилочковой железы).
Большинство ученых придерживается мнения, что у заболевшего человека, кроме одного или более факторов, формируется индивидуальная реакция на антигены.
О роли эндокринных изменений говорит достижение длительной ремиссии у женщин с выявленной апластической анемией во время беременности, прерыванием по медицинским показаниям.
Апластическая анемия вызвана подавлением процесса производства кровяных телец в костном мозге. Возможен повышенный уровень разрушения и уничтожения клеток собственными антигенами. Изучается механизм апоптоза (самопроизвольного уничтожающего процесса эритроцитов). Его приравнивают к «запрограммированному суициду».
Установлена повышенная активность ферментов деструктивного действия в крови, дефицит нуклеиновых кислот.
Разрушение эритроцитов наблюдается внутри костного мозга на всех уровнях созревания. Снижается продолжительность жизни красных кровяных клеток.
Поскольку утилизация железа нарушается, излишки откладываются в печени и селезенке.
Образуется повышение уровня гормона эритропоэтина, но костный мозг не реагирует на его приказы.
Со снижением гранулоцитов блокируется их функция по участию в иммунной защите организма. Соответственное проявление сниженной свертываемости происходит из-за тромбоцитопенического синдрома.
Количество лимфоцитов увеличено. Костный мозг становится «пустым» (панмиелофтиз).
Симптомы апластической анемии наследственного происхождения зависят от формы болезни.
При анемии Фанкони у ребенка обнаруживаются врожденные дефекты в костной системе (нет первого пальца на кисти руки, искривлены или отсутствуют лучевые кости). К порокам добавляются аномалии сердца и почек, маленькие глазные яблоки.
Апластическая анемия у детей начинает проявляться с четырех лет, реже в раннем возрасте. Ребенок жалуется на головные боли, усталость. Подвержен частым простудным инфекциям, носовым кровотечениям. При обследовании выявляют характерную картину крови. Болезнь принимает хроническое течение с периодами обострений.
Летальный исход возможен от присоединения инфекции или острого кровотечения.
При анемии Эстрена-Дамешека наблюдается только патология крови. Случаи очень редкие.
Анемия Даймонда-Блекфена поражает исключительно эритроцитарный росток крови. Реже наблюдались изменения костей скелета и глаз. Кровоточивость отсутствует. Кожные покровы бледные с сероватым оттенком. Рано увеличивается селезенка и печень. В анализе крови уровень тромбоцитов и лейкоцитов снижается только при значительном поражении селезенки. Обычное соотношение лейкоцитов и эритроцитов у больного 100:1 при норме до 4:1. Хроническое тяжелое течение болезни не позволяет дожить до 20-ти лет.
Симптомы апластической анемии проявляются в периоды обострения, а болезнь приобретает прогрессирующее медленное течение. Все признаки можно подразделить на основные синдромы, в зависимости от угнетения конкретного ростка клеток крови.
- Анемия — характеризуется выраженной слабостью, жалобами на головокружение, шумом в ушах, приступами сердцебиения, одышкой.
- Геморрагические проявления — на коже видны синяки, не связанные с травмированием, десны рыхлые и кровоточат. Пациентов беспокоят частые носовые кровотечения. В тяжелых случаях возможно кровоизлияние в мозг.
- Сниженный уровень гранулоцитов вызывает падение защитных иммунных механизмов. Пациенты часто заражаются инфекционными болезнями. Любые ранения у них осложняются присоединением нагноения окружающих тканей. Ангина протекает в язвенно-некротической форме. После инъекций образуются абсцессы. Стоматит приводит к язвам в полости рта. Тяжелым осложнением является общий сепсис. ИДС. Злокачественные новообразования.
При осмотре врач обращает внимание на бледность кожи, синюшность губ, кровоподтеки на теле, иногда мелкоточечную сыпь.
Артериальное давление понижено. Прослушивается характерный шум в сердце, частота сокращений выше нормы.
Увеличение печени происходит в тяжелой стадии, зависит от выраженности сердечной недостаточности.
Диагноз АА устанавливается на основании клинических проявлений и данных лабораторного обследования (А-В).
• Трехростковая цитопения: анемия (гемоглобин
На сегодняшний день так и не найдено универсальное средство лечения, поэтому прогноз для жизни пациента остается неблагоприятным.
Наиболее высокая смертность в группе больных с тяжелой формой болезни. Восстановить кроветворение не удается, а больные погибают от общего сепсиса.
При менее тяжелом течении и хорошей реакции на пересадку стволовых клеток и иммунодепрессанты положительные результаты получают от половины до 90% случаев.
источник