Можно даже сказать, что это целая группа патологических состояний, которые представляют собой самостоятельную форму заболевания. При апластической анемии костный мозг перестает производить клетки крови в необходимом количестве: лейкоциты, тромбоциты и эритроциты. Различные виды болезни протекают по-разному, некоторые из них дают о себе знать сразу, а остальные проявляются только через время.
Тяжелая апластическая анемия требует обязательной госпитализации, так как она угрожает жизни больного. Критерии тяжелой формы заболевания заключаются в резком понижении уровня тромбоцитов в крови (менее 500/мкл), при этом также отмечается снижение нейтрофилов. Сверхтяжелая форма апластической анемии характеризуется критическим понижением нейтрофилов до 200/мкл.
Апластическая анемия у детей развивается в нескольких формах, которые характеризуются развитием определенных признаков. Самой тяжелой из них считается анемия Фанкони, при которой присутствуют врожденные дефекты развития костей, пороки сердца и почек.
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины.
Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения.
В настоящее время заболевание с названием «апластическая анемия» выделяют как самостоятельную нозологическую единицу — и чётко разграничивают его от синдрома гипоплазии кроветворения, являющегося проявлением ряда известных самостоятельных заболеваний костного мозга.
Многих интересует вопрос, что такое апластическая анемия и почему она появляется? К сожалению, современная медицина не может назвать очевидные причины развития апластической анемии у человека. Но известно, что болезнь бывает приобретённая и наследственная.
Существует теория, что развитие патологии связано с особенностями функционирования организма каждого индивида. Тем не менее отмечаются некоторые факторы, которые могут спровоцировать появление болезни. В частности, самым ясным из факторов является воздействие на человека ионизирующей радиации, которая подавляет функции костного мозга и приводит к снижению выработки им эритроцитов, тромбоцитов и лейкоцитов. Также к предрасполагающим факторам можно отнести следующие:
- плохая экологическая ситуация в регионе;
- регулярные контакты человека с вредными химическими веществами;
- некоторые инфекционные патологии, в частности, гепатит, цитомегаловирусная инфекция;
- проблемы с костным мозгом;
- приём некоторых медикаментов, в том числе обычных жаропонижающих и обезболивающих средств типа аспирина;
- частый приём антибиотиков, особенно левомицетина.
Обнаружено, что болезнь наблюдают у пациентов с чрезмерной тягой к алкоголю. Не последнюю роль в развитии болезни играет и генетическая предрасположенность. Апластическая анемия у детей часто развивается вследствие наследственных патологий, в том числе этом может быть анемия Фанкони. Необходимо отметить, что зачастую у детей диагностируется идиопатическая апластическая анемия – то есть патология с неясной этиологией.
Что касается такой патологии, как гипопластическая апластическая анемия – то это ещё более тяжёлая патология, вызывающая серьёзные нарушения в работе всех внутренних органов и приводящая к нарушению работоспособности систем организма.
Также следует сказать, что апластическая анемия бывает трёх форм тяжести:
- очень тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренная (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
Все симптомы апластической анемии объединяются в 3 основных группы синдромов: анемический синдром, геморрагический синдром, синдром инфекционных осложнений.
Анемический синдром характеризуется:
- выраженной общей слабостью;
- быстрой утомляемостью;
- непереносимостью привычных физических нагрузок;
- одышкой и тахикардией при умеренных нагрузках, в тяжелых случаях – в покое, при перемене положения тела;
- головными болями, головокружением, эпизодами обморока;
- шумом, звоном в ушах;
- чувством «несвежей головы»;
- мельканием «мушек», пятен, цветных полос перед глазами;
- болями колющего характера в области сердца;
- снижением концентрации;
- нарушением режима «сон – бодрствование» (сонливость днем, бессонница ночью).
Объективно при обследовании пациентов устанавливаются бледность кожных покровов и видимых слизистых оболочек, приглушенность тонов сердца, учащение пульса, снижение артериального давления.
Выделяют два пика заболеваемости: в 10–25 лет и после 60 лет. Чаще болеют женщины.
Геморрагический синдром проявляется:
- гематомами (синяками) разного размера и точечными кровоизлияниями, возникающими на коже и слизистых оболочках после незначительного воздействия или спонтанно, без причин;
- кровоточивостью десен;
- кровотечением из носа;
- у женщин – маточными межменструальными кровотечениями, длительными обильными менструациями;
- розовым окрашиванием мочи;
- определением следов крови в испражнениях;
- возможными массивными желудочно-кишечными кровотечениями;
- кровоизлияниями в склеру и глазное дно;
- кровоизлияниями в головной мозг и его оболочки;
- легочными кровотечениями.
Объективное подтверждение геморрагического синдрома – точечные кровоизлияния и кровоподтеки на коже и слизистых, множественные гематомы на разных стадиях (от пурпурно-фиолетовых до желтых).
Инфекционные осложнения представлены развивающимися пневмониями, пиелонефритами, фурункулезами, постинъекционными абсцессами или инфильтратами, в тяжелых случаях – сепсисом.
В детском возрасте чаще наблюдается врожденная патология, передаваемая от родителей либо приобретенная в период внутриутробного развития. Некоторые признаки такой патологии можно определить даже у новорожденного, другие могут проявиться только через несколько лет. К числу тяжелых симптомов анемии у новорожденных относятся:
- аномалии строения лица (треугольное лицо, маленькие глаза, курносый нос и др.);
- аномалии конечностей (отсутствие большого пальца на руках, отсутствие лучевой кости, шестипалость и др.);
- низкорослость;
- особенности пигментации кожи – это скопления множественных пятен светло-коричневого цвета;
- аномалии внутренних органов, чаще мочеполовой системы;
- деформация и разрушение ногтей;
- отставание в умственном развитии;
Апластическая анемия у детей старше 1 года первоначально определяется по внешнему виду, поведению. Больные дети отличаются от сверстников бледностью кожных покровов и слизистых оболочек, у них наблюдается увеличение размеров лимфатических узлов, случаются частые кровотечения из носа, десен, по утрам появляется кровь в моче. Их поведение характеризуется частой сменой настроения, раздражительностью, они быстро утомляются, теряют аппетит.
Гематологическое обследование включает внимательный клинический осмотр и проведение специальных диагностических исследований: общего и биохимического анализа крови, стернальной пункции, трепанобиопсии. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия.
Для гемограммы при апластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Исследование пунктата костного мозга показывает уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности; в трепанобиоптате обнаруживается замещение красного костного мозга жировым (желтым). В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Апластическая анемия может осложняться:
- тяжелыми жизнеугрожающими кровотечениями;
- бактериальным эндокардитом;
- сепсисом;
- сердечной недостаточностью;
- почечной недостаточностью;
- реакцией отторжения при трансплантации костного мозга.
При диагнозе апластическая анемия, лечение подбирается с учетом потенциальной причины, которая могла спровоцировать болезнь. Как только патология выявлена, больного нужно госпитализировать, только в больнице можно провести диагностику, подобрать и провести комплексное лечение, определить дозировку препаратов и курс терапии. Есть три способа лечения болезни:
- трансплантация;
- трансфузия;
- лечение с помощью медикаментов.
Трансплантацию считают одним из успешных способов помощи пациентам при апластической анемии. Суть процедуры заключается в пересадке костного мозга от донора. Прогноз после проведенной в больнице операции зависит от возраста пациента – чем он моложе, тем больше шансы на успех. В качестве донора может выступать близкий родственник пациента, у которого такая же группа крови.
До назначения пересадки, необходимо провести исследование, которое покажет, насколько совместимы будут клетки донора и реципиента. Перед трансплантацией проводится серьезная подготовка пациента, риск отторжения чужеродных тканей высокий. Перед трансплантацией костного мозга переливание крови не делают, проводят облучение, затем назначают химиотерапию.
Такая подготовка нужна, чтобы снизить иммунитет больного, чтобы он не атаковал чужеродные клетки на первых порах. Нужно учесть, что трансплантация мозга – затратная процедура, которая проводится в специализированных медицинских учреждениях.
Трансфузия – процедура, при которой больному переливают кровь. Для переливания используют препараты крови, подготовленные из крови доноров на станциях переливания. Методика дает лишь временный эффект, переливание частично восполняет дефицит клеток крови больного, но патология не лечится, костный мозг также остается неспособным производить собственные кровяные тельца. Недостатком трансфузионной терапии является невозможность проведения у пациентов с аутоиммунной формой патологии. Если трансфузия будет проводится часто, в печени и селезенке скапливается железо, врачи назначают пациентам медикаменты, способствующие его выведению из организма.
Лечение с помощью медикаментов проводится комплексно, пациенту назначают препараты из разных групп:
- иммунодепрессанты (специфические антиглобулины, Циклоспорин и пр.). Такие медикаменты нужны, если нет возможности пересадить костный мозг. Назначают иммуносупрессоры параллельно с гормонами, чтобы исключить анафилактическую реакцию;
- лекарства для стимуляции кроветворения (Филгастрим, Лейкомакс). Медикаменты этой группы активизируют в организме продуцирование лейкоцитов, поэтому целесообразно их назначать только при диагностировании лейкопении;
- андрогеносодержащие медикаменты (Тестостерона пропионат, Сустанон) назначаются мужчинам для подавления апластической анемии;
- гемостатики (аминокапроновая кислота и пр.) назначаются при выраженном геморрагическом синдроме;
- Десферал и его аналоги назначаются в случае необходимости избавиться от излишков железа в организме.
Другим методом лечения апластической анемии является спленэктомия (операция по удалению селезенки). Цель оперативного вмешательства – остановить происходящие в организме аутоиммунные процессы, из-за которых вырабатываются антитела к клеткам собственного костного мозга. У такой методики есть противопоказание – наличие инфекционных осложнений.
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых.
Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов.
В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
источник
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри — физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом — выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, — резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов — причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда — аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение — это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности — избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет — 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
источник
Апластическая анемия (малокровие) – это патологическое состояние, характеризующееся угнетением ряда функций стволовых клеток костного мозга, касающихся образования форменных элементов крови — эритроцитов, тромбоцитов и клеток гранулоцитарной группы.
Классифицируется, как заболевание системы крови.
На сегодняшний день клиницистами используется несколько классификаций, учитывающих различные параметры этого заболевания.
В зависимости от причин, вызвавших заболевание, различают следующие его формы:
- Конституциональная. К этому классу относятся и наследственные формы апластической анемии;
- Медикаментозная. При классификации по МКБ -10 каждому поражающему фармацевтическому препарату присваивается отдельный код.
- Развившаяся в результате воздействия внешних причин, исключая медикаментозные.
- Идиопатическая апластическая анемия. При идиопатической анемии причины, вызвавшие недуг, остаются неизвестными.
- Другие формы апластической анемии с уточненными этиологическими факторами.
- Неуточненная форма.
Эта градация подразделяет все случаи апластической анемии на наследственные и приобретенные.
Наследственные случаи апластической анемии с полным поражением ростка гемопоэза.
- Анемия Фанкони. Угнетение гемопоэтического ростка при этом заболевании сочетается с врожденными пороками развития.
- Анемия Эстрена-Дамешека характеризуется изолированным поражением системы кроветворения. Пороки развития отсутствуют.
Наследственная анемия Даймода-Блекфена. Угнетение гемопоэза при этом заболевании характеризуется изолированным поражением эритроцитарного ростка.
Приобретенная апластическая анемия (гипопластическая анемия).
- Угнетение общего синтеза форменных элементов крови острого, подострого и хронического течения.
- Изолированное поражение только эритроцитарного ростка; в этих случаях говорят о парциальной, или красноклеточной анемии.
Согласно современным статистическим данным, в 22–51% случаев конкретные причины развития заболевания остаются неизвестными.
Наиболее точно удалось установить этиологию врожденных форм апластической анемии.
Этиологические факторы, приводящие к развитию апластической анемии, принято разделять на две группы.
- Химические вещества – нефтепродукты и продукты их переработки, ртуть, бензол.
- Физические факторы – негативное влияние проникающего радиоактивного излучения.
- Фармакологические вещества – препараты, применяемые против туберкулеза, анальгин, цитостатические средства, препараты сульфаниламидного ряда, некоторые антибиотики и средства для лечения онкологической патологии.
- Инфекционные агенты. Есть доказанные данные о взаимосвязи развития апластической (гипопластической) анемии с перенесенными ранее инфекционными заболеваниями (мононуклеоз, грипп, ангина). Кроме того, угнетающим влиянием на развитие клеток крови обладают вирусы герпеса, Эпштейна-Барра, гепатита C, цитомегаловирус.
- Нарушения со стороны эндокринной системы – такие, как гипофункция щитовидной железы или кистозная патология яичников у женщин.
- Дисфункция иммунной системы возникает по причине прекращения регуляторной функции тимуса в пожилом возрасте.
При наследственной апластической анемии симптомы зависят от заболевания, вызвавшего недуг. При этом апластическая анемия у детей – это, в большинстве случаев, дебюты врожденных форм этого заболевания.
Анемия Фанкони – это наследственная патология, для которой характерен аутосомно-рецессивный тип наследования. Дебютирует заболевание обычно в возрасте от 4 до 12 лет, однако, нарушения гематологического характера могут возникать и сразу после рождения ребенка. При анемии Фанкони имеют место врожденные дефекты опорно-двигательного аппарата:
- деформация или отсутствие лучевых костей;
- отсутствие первых пальцев кистей рук;
- головные боли;
- быстрая утомляемость;
- склонность к геморрагиям (часто они и являются причинами летального исхода);
- частые простудные заболевания;
- недоразвитие комплекса мочеполовых органов;
- выраженное угнетение всех типов гемопоэза;
- при исследовании костного мозга картина апластичная.
Патология обычно протекает стремительно. При отсутствии своевременного адекватного лечения быстро развивается анемия тяжелой степени, способная привести к летальному исходу.
Причина смерти в большинстве случаев – геморрагии (желудочно-кишечные кровотечения или кровоизлияния в мозг).
При анемии Фанкони единственным эффективным методом лечения признана трансплантация костного мозга от здорового донора, которым может стать, например, близкий родственник пациента.
Для анемии Эстрена-Дамешека характерны только нарушения в составе крови.
Анемия Даймонда-Блекфена – это заболевание из разряда наследственных спорадических патологий. Дебют происходит в течение первого года жизни. При этом заболевании наблюдаются:
- изолированное поражение эритроцитарного ростка;
- патологические изменения костей;
- характерное поражение глаз;
- кожа приобретает характерный сероватый оттенок;
- рано появляется гепатоспленомегалия;
- тромбоциты и лейкоциты содержатся в крови в нормальных количествах, снижение отмечается лишь в случае значительного поражения селезенки;
- характерный фенотип: укрупненная верхняя губа, широко расставленные глаза, бледность кожных покровов, сухость волос и отставание костного возраста от паспортного;
- это заболевание тяжелой степени приводит к летальному исходу еще до достижения 20-летнего возраста. При лабораторных исследованиях – картина нормохромной анемии при нормальной пролиферации тромбоцитарного и гранулоцитарного ростков;
- Эффективной тактикой лечения при данной форме анемии является терапия глюкокортикостероидными гормонами в сочетании с переливанием эритроцитарной массы по жизненным показаниям.
В зависимости от преимущественного поражения того или иного из ростков, все проявления, наблюдаемые при апластической анемии, целесообразно разделять на основные клинические синдромы.
- головокружение разной степени выраженности;
- физическая слабость;
- шум в ушах;
- сбои дыхания, одышка;
- ощущение усиленного сердцебиения.
- кровоточивость, рыхлость десен;
- появление гематом, не вызванных с травмами;
- носовые кровотечения;
- есть вероятность геморрагии в мозг.
- снижение защитной функции иммунной системы организма, частая заболеваемость различными инфекциями;
- гнойные воспаления мягких тканей даже при незначительных ранениях;
- возникновение абсцессов на месте инъекций;
- синюшность и кровоподтеки на коже;
- мелкоточечные высыпания на кожных покровах;
- характерный шум при аускультации сердца;
- частота сердечных сокращений повышена;
- артериальная гипотония;
- возможно осложнение в виде сепсиса;
- при тяжелой степени выявляется гепатомегалия, при этом может отмечаться иктеричность склер.
По результатам анализа крови и трепанобиопсии костного мозга выделяются различные степени тяжести апластической анемии.
Апластическая анемия средней степени тяжести:
- костный мозг при трепанобиопсии гипотрофирован;
- содержание гранулоцитов не более 2*100/л;
- тромбоцитов – до 100*100/л;
- ретикулоциты меньше 2–3%.
Апластическая анемия тяжелой степени:
- костный мозг на трепанобиопсии аплазирован;
- гранулоцитопения менее 0,5*100/л;
- тромбоцитопения меньше 20*100/л;
- ретикулоцитов – до 1%.
Крайне тяжелая степень апластической анемии:
- аплазия костного мозга;
- гранулоцитов менее 0,2*100/л;
- тромбоциты единичные или не встречаются;
- ретикулоциты – единичные или отсутствуют.
Предположить диагноз апластической анемии позволяют характерная клиническая картина заболевания и жалобы пациента.
Наиболее информативные клинические исследования:
- Общий анализ крови. Для этой патологии типична панцитопения, при этом лейкоцитопения появляется преимущественно за счет уменьшения количества гранулоцитов. Кроме того, ОАК может отражать признаки воспалительного процесса.
- Картина биохимических показателей крови. При апластической анемии характерным изменениям могут быть подвержены следующие параметры: тимоловая проба, С-реактивный белок, HBs-антиген, эритропоэтин, а также уровень сывороточного железа.
- Стернальная пункция позволяет визуализировать клетки костного мозга для оценки их количественного соотношения и степени угнетения гемопоэза. Миелограмма (так называется результат исследования) отражает клеточный состав костного мозга.
- Трепанобиопсия подразумевает взятие для анализа фрагмента костного мозга из подвздошной кости. Преимущество по отношению к стернальной пункции заключается в заборе большего количества материала и возможности сохранения его структурной целостности.
Общий анализ крови и результат трепанобиопсии позволяют оценить степень тяжести апластической анемии и определить форму заболевания.
В тех случаях, когда этиопатогенетический фактор, вызвавший недуг, известен, терапия будет начинаться с попыток устранения причин, спровоцировавших развитие заболевания. Такие меры призваны устранить вероятность дальнейшего прогрессирования патологического процесса.
Каждой форме апластической анемии соответствует определенная схема лечения, зависящая от особенностей протекания патологического процесса.
При клинически подтвержденной апластической анемии лечение может осуществляться по трем основным направлениям.
Заместительная терапия. Метод подразумевает переливание крови – цельной, форменных элементов (тромбоцитарная или эритроцитарная масса, гранулоциты) или заменителей крови. Это превентивный метод лечения, лишь на время восполняющий необходимое количество клеток крови, однако, функцию гемопоэза не восстанавливает.
Необходимо учитывать, что этот метод неприменим при аутоиммунной форме апластической анемии, так как реакцией на попадание в организм чужеродного белка будет иммунный ответ против введенных клеток.
В такой ситуации заместительная терапия будет неэффективной.
Заместительную терапию целесообразно сочетать с применением средств, способствующих выведению железа из организма, так как многократные переливания крови приводят к накоплению этого элемента в организме.
Трансплантация костного мозга. Эта методика лечения апластической анемии считается на сегодняшний день самой эффективной. Использование метода предпочтительнее в молодом возрасте. Для успеха лечения необходимо правильно подобрать донора. Им может стать близкий родственник пациента.
А также должным образом подготовить пациента (такая подготовка подразумевает химиотерапию и воздействие больших доз радиации). Операция заключается во введении отфильтрованных здоровых стволовых клеток донора в кровоток реципиента. Посредством кровотока донорский материал попадает в костный мозг больного, где, в последующем, происходит пролиферация здоровых форменных элементов крови.
Для предотвращения отторжения трансплантированного материала пациенту назначается соответствующее лечение, подавляющее иммунный ответ.
- предназначенная для стимуляции процессов гемопоэза;
- иммунодепрессивная – актуальна для аутоиммунной формы апластической анемии. Такая терапия предотвращает неадекватный иммунный ответ.
Прогноз при апластической анемии
При тяжелой степени апластической анемии до сих пор, несмотря на развитие фармацевтической промышленности, сохраняется высокий процент летальности.
Факторы, улучшающие прогноз:
- развитие трансплантологии и начало применения трансплантации;
- иммуносупрессивная терапия.
источник
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
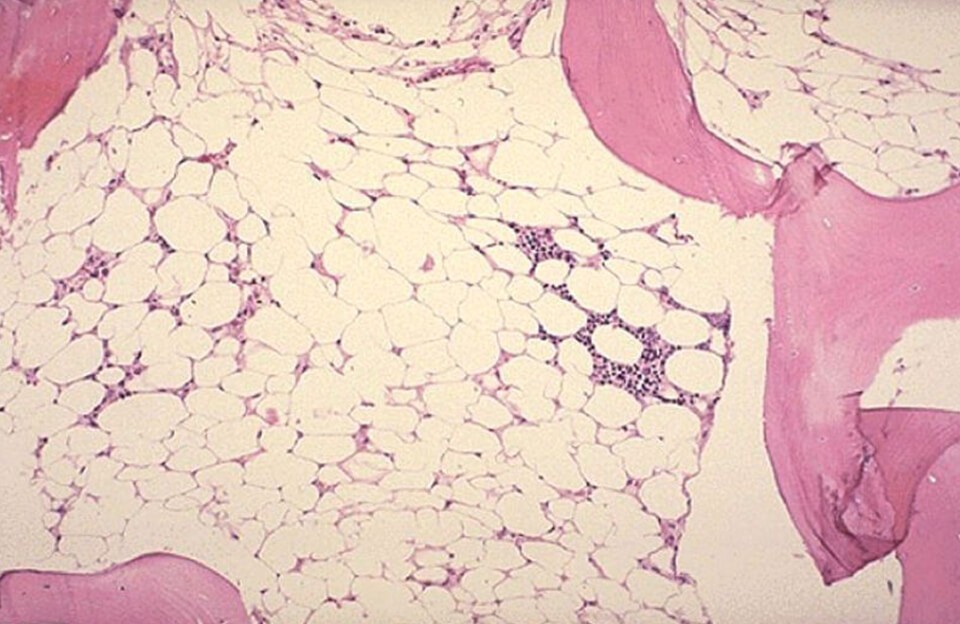
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
источник
Ретроспективными исследованиями установлено, что средний интервал от воздействия этиологического агента до возникновения панцитопении составляет 6-8 нед.
Симптомы апластических анемий напрямую связаны со степенью снижения 3 важнейших показателей периферической крови — гемоглобина, тромбоцитов и нейтрофилов. Подавляющее большинство больных апластическими анемиями обращаются к врачу по поводу кровоточивости, причём угрожающие жизни кровотечения в качестве первого клинического проявления болезни встречаются очень редко. В типичных случаях речь идёт о петехиальной сыпи, кровоточивости дёсен и легко возникающих экхимозах. Серьёзные висцеральные кровотечения — желудочно-кишечные, почечные и внутричерепные — возникают позже. Анемический синдром проявляется лёгкой утомляемостью, шумом в ушах, ощущением пульсации в голове, усталостью и другими классическими симптомами анемии. Как правило, дети хорошо переносят даже очень тяжёлую анемию. По данным литературы, тяжёлые инфекции редко выступают первыми симптомами болезни, однако, по нашим данным, это не совсем так. Нехарактерны для апластических анемий снижение массы, спленомегалия, лимфаденопатия и боли. Появление этих симптомов заставляет искать другую причину панцитопении.
Помимо внимательного клинического осмотра минимальный спектр необходимых диагностических исследований при подозрении на апластическую анемию включает:
- гемограмму с определением ретикулоцитов и ручным подсчётом лейкоцитарной формулы;
- миелограмму из 2-3 анатомически различных точек;
- трепанобиопсию костного мозга;
- пробу на ломкость хромосом с диэпоксибутаном или митомицином (митомицин С);
- биохимический анализ крови.
Для апластических анемий типично конкордатное снижение показателей производных всех 3 главных ростков костномозгового кроветворения (эритроцитов, гранулоцитов и тромбоцитов), несмотря на различную кинетику зрелых элементов крови. У большинства пациентов число лимфоцитов и моноцитов также снижено. Абсолютное число ретикулоцитов неадекватно тяжести анемии. Повышение фетального гемоглобина наряду с макроцитозом типично для апластических анемий. Повышение активности сывороточных трансаминаз, за исключением случаев гепатит-ассоциированных апластических анемий нехарактерно. Относительно высокий ретикулоцитоз, повышение билирубина и лактатдегидрогеназы говорит о сопутствующем синдроме — пароксизмальной ночной гемоглобинурии.
Состояние костного мозга при апластических анемиях должно быть оценено как по данным аспирата из нескольких точек, так и по данным трепанобиопсии. По данным исследования пунктата оценивают морфологию резидентных элементов эритро-, грануло- и мегакариоцитопоэза. Дизэритропоэз — весьма частая характеристика при апластических анемиях, типично также выявление «мегалобластоидности» эритроидных элементов, асинхронии созревания ядра и цитоплазмы эритробластов — эти признаки очень трудно дифференцировать от дисплазии эритроидного ряда, выявляемой при миелодиспластических синдромах. Зачастую в пунктате выявляется повышение количества плазматических клеток и макрофагов с явлениями фагоцитоза эритроцитов. Выявление лейкемических бластов в аспирате заставляет пересмотреть диагноз.
В 1976 и 1979 гг. Брюсом Камиттой и соавт. была выделена группа простейших показателей периферической крови и костного мозга, определяющих тяжесть течения заболевания и прогноз больных апластической анемией.
Критерии тяжёлой формы апластической анемии
Клеточность костного мозга, по данным трепанобиопсии, менее 25% (или 9 /л). Тромбоцитопения по мере прогрессирования заболевания достигает значительной степени (до единичных тромбоцитов в мазке). СОЭ, как правило, увеличена.
При анемии Фанкони имеется стресс-эритропоэз, который характеризуется макроцитозом, высоким уровнем Hb F, высоким уровнем эритропоэтина в сыворотке и наличием i-антигена.
Стернальный пунктат на ранних стадиях заболевания нормо- или гипоклеточный. Количество бластов в пределах нормы. Содержание клеток эритроидного ростка увеличено с задержкой их созревания и морфологическими нарушениями в виде анизоцитоза, базофильной пунктации в нормобластах, иногда отмечается появление мегалобластов. Гранулоцитарный росток «сужен», возможна задержка созревания на стадии неитрофильных миелоцитов и метамиелоцитов. Мегакариоцитарный росток значительно «сужен» уже на ранних стадиях заболевания. По мере прогрессирования заболевания отмечается выраженная гипоклеточность костного мозга с угнетением всех ростков и разрастанием жировой ткани. В костном мозге увеличено число ретикулярных, плазматических и тучных клеток. Гипоплазия костного мозга подтверждается результатами трепанобиопсии.
Из биохимических показателей для апластической анемии характерно повышение уровня фетального гемоглобина до 15 % (при норме 2 %) еще до развития цитопении, по мере прогрессирования аплазии фетальный гемоглобин достигает 45 %.
Установлено, что клетки больных с анемией Фанкони не способны репарировать поперечные сшивки ДНК, вызываемые так называемыми кластогенами — диэпоксибутаном, митомицином С и др. На этом феномене основана современная диагностика анемии Фанкони и у всех больных с подозрением на анемию Фанкони должен проводиться тест с диэпоксибутаном.
Течение анемии Фанкони характеризуется наличием периодов обострения и ремиссии. Без лечения через 2 года после диагностики панцитопении умирают 80 % больных, а через 4 года — около 100 %. Причиной смерти, наряду с тяжелой анемией, являются наиболее серьезные проявления геморрагического синдрома — желудочно-кишечные кровотечения, внутричерепные кровоизлияния и присоединение различных инфекций.
У больных анемией Фанкони имеется высокий риск трансформации в миелодиспластический синдром, острый лейкоз (особенно миелобластный или монобластный), злокачественные опухоли ЖКТ.
Наследственная апластическая анемия с общим поражением гемопоэза без врожденных аномалий развития (анемия Эстрена-Дамешека)
Является тотальной формой наследственной апластической анемии, наследуется аутосомно-рецессивно, протекает с панцитопенией, не сопровождается врожденными пороками развития. Заболевание встречается крайне редко, гематологические нарушения отмечаются в раннем детском возрасте. Прогноз неблагоприятный.
Врожденный дискератоз (синдром Цинссера-Коула-Энгмана)
Синдром характеризуется признаками эктодермальной дисплазии (патологическое ороговение отдельные клеток шиповатого слоя эпидермиса кожи и слизистых оболочек) в сочетании с гематологическими изменениями (примерно у 50 % больных развивается апластическая анемия). В 75 % случаев синдром наследуется рецессивно сцепленно с Х-хромосомой и, соответственно, встречается у мальчиков; у 25 % детей больных наследуется по аутосомно-доминантному типу (описано примерно одинаковое количество больных). Поражаются кожа и ее дериваты, слизистые оболочки. Наблюдаются множественный рассеянный гиперкератоз с преимущественной локализацией на лице, шее, спине, груди; атрофия кожи ладоней и ступней, ладонно-подошвенный гипергидроз; нарушение роста и дистрофия ногтей; гипотрихоз ресниц; закупорка слезных канальцев и слезотечение; лейкоплакия слизистых полости рта, в основном языка и десен; поражение эндокринных желез (нанизм, недоразвитие вторичных половых признаков). Гематологические изменения разнообразны: панцитопения, изолированная анемия, тромбоцитопения, нейтропения. Возраст дебюта апластической анемии при данном синдроме может быть весьма вариабелен, средний возраст дебюта АА составляет 15 лет.
В отличие от больных с анемией Фанкони клетки больных с врожденным дискератозом не обладают повышенной чувствительностью к антигенам, вызывающим поперечные сшивки, поэтому эти иногда фенотипически похожие синдромы могут быть дифференцированы на основании теста с диэпоксибутаном.
Характеризуется экзокринной недостаточностью поджелудочной железы, карликовостью, метафизарной хондродис-плазией, нейтропенией, иногда анемией, тромбоцитопенией. Наследуется аутосомно-доминантно.
Заболевание клинически проявляется в раннем возрасте и характеризуется признаками поражения ЖКТ и гематологическими изменениями. Отмечаются диарея, стеаторея, замедление весовых прибавок, гипотрофия. Характерны изменения костной системы в виде хондроднсплазии метафиза и формирование ортопедической патологии, задержка роста. У части больных возможна галактоземия, что приводит к гепатоспленомегалии, задержке психомоторного развития. Характерны рецидивирующие респираторные заболевания, отиты, абсцессы, остеомиелит. У некоторых детей наблюдается задержка наступления пубертатного периода.
В анализах крови с раннего возраста отмечается абсолютная нейтропения, число нейтрофилов менее 1 х 10 9 /л. Для зрелых нейтрофилов характерна гипосегментация ядер, отмечается снижение хемотаксиса нейтрофилов. Наряду с нейтропенией приблизительно у 50 % больных отмечается анемия с ретикулоцитопенией, у 60-70 % детей — тромбоцитопения, примерно у 25% больных развивается апластическая анемия. В стернальном пунктате число миелокариоцитов может быть нормальным, сниженным или повышенным; отмечается задержка созревания нейтрофилов на стадии метамиелоцита. Прогноз наиболее неблагоприятный в раннем детском возрасте, когда около 25% детей погибают от инфекционных осложнений; летальный исход возможен и от кровоизлияний в жизненно важные органы.
Наследственная апластическая анемия с избирательным поражением эритропоэза (анемия Блекфена-Даймонда)
Частота данного заболевания составляет 1 : 1 000 000 живых новорожденных; 5 — 7 : 1 000 000 во Франции, 10:1 000 000 в Скандинавии, встречается во всех этнических группах, мальчики и девочки заболевают одинаково часто. Подавляющее большинство (75 %) составляют спорадические случаи заболевания; в некоторых случаях возможно аутосомно-доминантное наследование, аутосомно-рецессивное или сцепленное с Х-хромосомой.
Первые признаки болезни выявляются в первые месяцы или на протяжении первого года жизни — у 35 % больных анемией при рождении, у 65 % в первые 6 месяцев жизни и в 90 % случаев заболевание диагностируется до года. Диагноз анемии Блекфена — Даймонда у детей старше 2 лет маловероятен. Дети, как правило, рождаются доношенными с нормальной массой тела и ростом, психомоторное развитие нормальное. Бледность кожи и слизистых отмечается с первых дней жизни, но явные клинические признаки гипоксии: вялость или возбуждение, беспокойство, сонливость, отказ от еды, диспепсические явления — появляются при снижении гемоглобина до 60-30 г/л. Врожденные пороки развития встречаются реже (в 25 % случаев), чем при анемии Фанкони. Некоторые больные имеют характерные фенотипические особенности: волосы цвета пакли, курносый нос, большая верхняя губа, гипертелоризм. По мере прогрессирования заболевания кожа приобретает восковидный, а к 5-6 годам, в связи с развитием гемосидероза, — сероватый оттенок, особенно в области шейных, подмышечных, паховых складок, половых органов. Геморрагический синдром отсутствует. Наблюдаются гепатомегалия, спленомегалия, в динамике заболевания селезенка сокращается, а печень прогрессивно увеличивается. Костный возраст отстает от паспортного на 4-5 лет, темпы окостенения изменены. Смена молочных зубов запаздывает, часто выявляется кариес.
В периферической крови нормохромная макроцитарная гипо- или арегенераторная анемия (ретикулоциты 0-0,1 %), как правило, тяжелой степени. Число лейкоцитов и тромбоцитов остается на нормальном уровне в течение первых лет жизни; иногда отмечается тенденция к тромбоцитозу. При длительном течении заболевания может развиваться умеренная тромбоцитопения. После первого десятилетия жизни может также появиться умеренная нейтропения, вероятно, из-за снижения клональной эффективности предшественников гранулоцитов.
Биохимически отмечается высокий уровень активности эритроцитарной аденозиндезаминазы; уровень фетального гемоглобина нормальный или умеренно повышен; повышено содержание i-антигена в эритроцитах; увеличено содержание эритропоэтина в сыворотке.
В стернальном пунктате костный мозг нормоклеточный, по мере прогрессирования заболевания отмечается гипоклеточность. Эритроидный росток резко сужен; диагностическим критерием является отсутствие или малое количество эритробластов (менее 5 % ядросодержащих клеток) в костном мозге. Миелоидный и мегакариоцитарный ростки не изменены. Число ретикулярных клеток и лимфоцитов увеличено, плазматических клеток не изменено.
Анемия Блекфена-Даймонда протекает хронически, у 80 % больных получают ремиссию при использовании кортикостероидов; у 20 % больных описана спонтанная ремиссия. «Постоянная гипоксия, нарушение утилизации железа, необходимость по жизненным показаниям трансфузии эритроцитарной массы неуклонно ведут к гемосидерозу, который в дальнейшем является «убийцей» больного ребенка». Возможна трансформация в миелодиспластический синдром, острый лейкоз (лимфобластный, миелобластный, промиелоцитарный, мегакариоцитарный), солидные опухоли (гепатобластому, рстеосаркому, злокачественную фиброзную гистиоцитому), лимфогранулематоз.
Дифференциальный диагноз при анемии Блекфена-Даймонда проводится с другими видами анемий, при которых в периферической крови уменьшается количество ретикулоцитов.
Анемия в период выздоровления после гемолитической болезни новорожденных.
Иногда может сочетаться со снижением интенсивности эритропоэза. Апластические кризы, характеризующиеся ретикулоцитопенией и уменьшением числа предшественников эритроцитов, могут осложнять разные типы гемолитической болезни. Подобные эпизоды являются транзиторными, кроме того, обычно выявляются признаки предшествующей гемолитической болезни. Развитие апластических кризов связывают с В19-парвовирусной инфекцией. Тактика ведения больных, как правило, выжидательная: при значительном снижении уровня гемоглобина проводятся гемотрансфузии.
Транзиторная эритробластопения детского возраста
Одна из наиболее частых форм аплазии эритроидного ростка. Этиология заболевания не известна. У здоровых ранее детей в возрасте 5 мес — 6 лет, чаще всего в возрасте 2 лет, медленно развивается тяжелая арегенераторная анемия, обусловленная резким снижением эритроцитов в костном мозге.
Развитию анемии за 1 — 2 мес может предшествовать вирусная инфекция, хотя связь заболевания с определенным возбудителем не доказана, нередко им является парвовирус В19. Анамнез и физикальное исследование неинформативны, обращает на себя внимание лишь выраженная бледность кожных покровов и слизистых. В периферической крови уровень Нb снижен до 30-80 г/л, ретикулоциты отсутствуют, количество лейкоцитов и тромбоцитов обычно нормальное, однако у 10 % больных имеется нейтропения ( 9 /л) и у 5 % — тромбоцитопения ( 9 /л). Лабораторно выявляют нормальные уровни активности эритроцитарнои аденозиндезаминазы и фетального гемоглобина; по ферментативным характеристикам эритроциты относят к стареющей популяции. Уровень железа в сыворотке повышен. В пользу транзиторной эритробластопении также свидетельствуют нормальные результаты клинического анализа крови до болезни. В стернальном пунктате отмечается резкое сужение эритроидного ростка, отсутствуют предшественники, за исключением нормоцитов, эритроцитов. Культуральными исследованиями костного мозга выявлено несколько патогенетических механизмов: присутствие в сыворотке ингибиторов стволовых клеток или аномалии последних, выражающиеся либо в их численности, либо в способности к реакции на эритропоэтин. Возможен аутоиммунный генез заболевания с поражением первичных эритроидных предшественников, а не зрелых эритроцитов. Через несколько месяцев после старта заболевания наступает спонтанная ремиссия. До наступления выздоровления могут потребоваться гемотрансфузии, кортикостероиды не используются.
Вторичные (приобретенные) аплазии эритроидного ростка
Также проявляются анемией, сопровождающейся ретикулоцитопенией и уменьшением количества предшественников эритроцитов в костном мозге. Вторичная аплазия эритроидного ростка может быть вызвана вирусными инфекциями (паротит, вирус Эпштейна-Барр, парвовирус В19), а т и — пичными пневмониями и бактериальным сепсисом; лекарственными средствами (хлорамфеникол, пенициллин, фенобарбитал, дифенилгидантоин); антиэритроцитарными антителами; иммунодефицитом; тимомой; злокачественными опухолями.
Эпизоды острой недостаточности эритропоэза могут сопровождать целый ряд вирусных инфекций. При этом значительно снижается количество циркулирующих ретикулоцитов (менее 0,1 %) и повышается уровень железа в сыворотке. В костном мозге уменьшено число предшественников эритроцитов. Эти эпизоды, как правило, купируются и не оставляют каких-либо последствий. Наиболее часто вторичная аплазия эритроидного ростка вызывается парвовирусом В19.
У всех больных грудного возраста при диагностике эритробластопении необходимы следующие исследования:
- Содержание сывороточных антител IgM и IgG (мать и ребенок).
- Вирусной ДНК в сыворотке крови.
- Вирусной ДНК в костном мозге.
Эти исследования могут помочь в дифференциации эритробластопении при инфицировании парвовирусом В19 и эритробластопении другого генеза.
В терапии вторичных эритробластопении важно устранение причины, вызвавшей заболевание — отмена препарата, лечение основного заболевания или тимэктомия. При обнаружении антиэритроидных антител показаны кортикостероиды, при их неэффективности — иммунодепрессанты (циклофосфан или азатиоприн). При иммунодефиците парвовирусная инфекция может быть хронической, тогда применяют иммуноглобулин внутривенно.
Приобретенные апластические анемии
Клиника приобретенных апластических анемий отличается в зависимости от тотального или избирательного поражения гемопоэза. У больных приобретенными апластическими анемиями в отличие от наследственных форм отсутствуют врожденные аномалии развития, физическое и психическое развитие детей не изменено, костный возраст соответствует паспортному.
Для тотальных форм апластических анемий характерно сочетание геморрагического, анемического и инфекционно-септического синдромов. Геморрагический синдром, обусловленный тромбоцитопенией, выражен резко: множественные экхимозы и петехии на коже и слизистых оболочках, конъюнктивах, рецидивирующие носовые, десневые, маточные, желудочно-кишечные и почечные кровотечения, кровоизлияния в местах инъекций. Непосредственной причиной смерти у таких больных являются чаще всего кровоизлияния в жизненно важные органы. Поражение эритроидного ростка приводит к развитию анемического синдрома, при котором у больного отмечается общая слабость, снижение аппетита, головокружение, повышенная утомляемость, бледность кожи и слизистых оболочек, ногтевых фаланг, изменения со стороны сердечно-сосудистой системы: расширение границ сердца, приглушенность тонов, тахикардия, систолический шум различной интенсивности, возможна экстрасистолия, одышка. Наличие лейкогранулоцитопении обусловливает возникновение инфекционно-септического синдрома: легкое присоединение инфекций любой локализации, язвенно-некротическое поражение кожи, слизистых оболочек. Характерно тяжелое течение инфекций, вызванных не только патогенной флорой, но и условно-патогенными и грибковыми возбудителями. Лимфатические узлы, печень, селезенка не увеличены. При избирательном поражении эритроидного ростка имеются проявления лишь анемического синдрома.
Все симптомы болезни могут проявляться и нарастать более или менее остро.
Гематологические изменения при апластической анемии складываются из нейтропении (абсолютное число нейтрофилов менее 1,5 х 10 9 /л), анемии (Нb 9 /л) и ретикулоцитопении, не соответствующей тяжести анемии. В миелограмме отмечается резкое снижение клеточности, редукция миелоидного и эритроидного ростков, вариабельный лимфоцитоз и отсутствие мегакариоцитов. У больных с медленным развитием аплазии длительно могут сохраняться участки активного кроветворения — «горячие карманы». В трепанобиоптате обнаруживается резкое снижение плацдарма кроветворения — доминирует жировой костный мозг, гемопоэтические элементы представлены резидуальными очагами эритро- и миелопоэза, мегакариоциты практически не обнаруживаются.
По тяжести приобретенные апластические анемии делятся в зависимости от глубины цитопении, ретикулоцитоза и остаточной клеточности костного мозга по данным трепанобиопсии. Используются критерии тяжести апластической анемии, разработанные международной группой изучения апластической анемии — «критерии Камитты»:
- число гранулоцитов менее 500 в 1 мкл;
- число тромбоцитов менее 20 000 в 1 мкл;
- число ретикулоцитов менее 40 000 в 1 мкл (или менее 1 % после коррекции на нормальный гематокрит).
Апластическая анемия считается тяжелой, если присутствуют любые два указанных выше показателя крови в сочетании со сниженной клеточностью. Если гематологический синдром соответствует критериям тяжелой апластической анемии, но число гранулоцитов менее 200 в 1 мкл — сверхтяжелая апластическая анемия. Все остальные случаи характеризуются как нетяжелая апластическая анемия.
Дифференциальный диагноз при приобретенных апластических анемий проводится преимущественно с острым лейкозом, мегалобластными анемиями, синдромом гиперспленизма, метастазами опухолей в костный мозг.

источник