ПАТОЛОГИЯ ЭНДОКРИННОЙ СИСТЕМЫ
Эндокринная система человека состоит из желёз внутренней секреции (эндокринных желёз) и так называемой диффузной эндокринной системы (APUD-системы). Функция эндокринной системы заключается в продукции гормонов. К железам внутренней секреции относятся эндокринный гипоталамус, аденогипофиз (питуитарная железа), эпифиз (шишковидная железа), паращитовидные железы, щитовидная железа, тимус (патология тимуса рассматривается в лекции «Иммунопатологические процессы»), островки Лангерганса поджелудочной железы, надпочечники, параганглии и половые железы (гонады; патология яичников излагается в лекции «Болезни женского организма»). Диффузная эндокринная система представлена отдельными эндокринными клетками (апудоцитами), включёнными в различные органы и ткани.
Основные цели лекции – систематизация всех наиболее часто встречающихся форм эндокринной патологии человека и определение их сущности. Детали макро- и микроскопической характеристики важнейших заболеваний и синдромов приведены в соответствующем разделе учебника А.И.Струкова, В.В.Серова «Патологическая анатомия» и в лекции не повторяются.
I. ПАТОЛОГИЯ ЭНДОКРИННОГО ГИПОТАЛАМУСА
Различают три наиболее общие формы патологических изменений эндокринной порции гипоталамуса: нарушения продукции либеринов (рилизинг-факторов) и статинов, патологию антидиуретического гормона (АДГ) и недостаточность окситоцина у женщин.
I. Нарушения продукции либеринов и статинов многообразны. Они приводят к нарушению различных функций аденогипофиза.
II. Патология антидиуретического гормона проявляется двумя типами нарушений: его недостаточностью (несахарный диабет) и гиперпродукцией (синдром Пархона, или гидропексический синдром).
1. несахарный диабет – см учебник,
2. синдром Пархона (гидропексический синдром).
Синдром Пархона – гиперпродукция АДГ. Основное проявление заболевания – задержка жидкости в организме (отёки).
III. Недостаточность окситоцина у женщин (сопровождается слабостью родовой деятельности).
II. ПАТОЛОГИЯ АДЕНОГИПОФИЗА
Многообразные патологические изменения в аденогипофизе делят на три группы: гипо-, гипер и диспитуитаризм (термины происходят от старого названия гипофиза – питуитарная железа). Гипопитуитаризм – недостаточность гипофиза, гиперпитуитаризм – гиперфункция гипофиза, развивающаяся вследствие гиперплазии его железистых клеток или опухоли (чаще аденомы, реже рака). Диспитуитаризм – недостаточность одних и гиперпродукция других гормонов аденогипофиза. Гипопитуитаризм может быть тотальным (пангипопитуитаризм) или парциальным (частичным). В случае тотального гипопитуитаризма развивается недостаточность всех гормонов аденогипофиза, частичный гипопитуитаризм характеризуется дефицитом какого-либо одного гормона. Гиперпродукцию гормонов гипофиза также можно разделить на пангиперпитуитаризм и частичный гиперпитуитаризм. Термин пангиперпитуитаризм условный, т.к. при этом имеют в виду гиперпродукцию не всех гипофизарных гормонов, а двух или трёх (формы гиперпитуитаризма с увеличением продукции всех гормонов гипофиза не описано). В основе частичного гиперпитуитаризма лежит гиперпродукция какого-либо одного гормона.
2. парциальный (частичный) гипопитуитаризм.
II. Парциальный гиперпитуитаризм
Среди форм пангипопитуитаризма различают два заболевания: гипоталамо-гипофизарная кахексия (синдром Симмондса) и послеродовый гипопитуитаризм (синдром Шиена [Шихена, Шихана]1).
1. Синдром Симмондса (гипоталамо-гипофизарная кахексия). Заболевание обусловлено некрозом или атрофией аденогипофиза. Наиболее характерные для синдрома Симмондса атрофические процессы в различных органах и тканях и преждевременное старение (вторичная прогерия) во многом связаны с недостаточностью соматотропного гормона (СТГ). В типичных случаях у больных формируется истощение (кахексия).
2. Синдром Шихена (послеродовый гипопитуитаризм) – вариант синдрома Симмондса, развивающийся после родов. Некроз ткани гипофиза при этом возникает вследствие ишемии на фоне кровопотери в родах. Часто синдромы Симмондса и Шиена рассматриваются как единое заболевание (синдром Симмондса–Шихена).
Формы парциального гипопитуитаризма
Парциальный гипопитуитаризм лежит в основе таких заболеваний как гипофизарная микросомия (гипофизарный нанизм), адипозогенитальная дистрофия (синдром Фрёлиха) и болезнь Лоуренса–Муна–Бидля.
1. Гипофизарная микросомия (гипофизарный нанизм) – недостаточность СТГ. Больные отличаются низкорослостью, что отражено в названии (термин нанизм происходит от греч. nanos – карлик).
2. Адипозогенитальная дистрофия (синдром Фрёлиха) – недостаточность гонадотропинов гипофиза [помимо гипофизарных существуют гонадотропины плаценты]. Их дефицит приводит к недостаточности половых гормонов (вторичный гипогонадизм). Заболевание обычно проявляется в пубертатном возрасте (периоде полового созревания) следующими признаками:
1. гипогенитализмом – недоразвитием половых органов и вторичных половых признаков,
3. Болезнь Лоуренса–Муна–Бидля – врождённый вариант адипозогенитальной дистрофии.
Формы парциального гиперпитуитаризма
К формам парциального гиперпитуитаризма относятся гигантизм, акромегалия, синдром Киари–Фроммеля (персистирующая лакторея) и болезнь Кушинга.
2. Акромегалия – см учебник.
3. Синдром персистирующей лактореи Киари–Фроммеля – гиперпродукция пролактина. Болеют как женщины, так и мужчины. Основное проявление – выделение молока из молочных (грудных) желёз, у женщин не связанная с беременностью и кормлением (лакторея). У женщин, кроме того, снижается продукция гонадотропинов и, следовательно, половых гормонов, вследствие чего развивается атрофия эндометрия и яичников; формируется аменорея, поэтому название синдрома у женщин дополнено термином аменорея (синдром персистирующей лактореи-аменореи).
4. Болезнь Кушинга (Иценко–Кушинга) – гиперпродукция АКТГ, вследствие чего усиливается синтез глюкокортикоидных гормонов (вторичный гиперкортицизм).
Заболевание проявляется следующими признаками:
1. вторичный иммунодефицит (избыток глюкокортикоидов обладает иммунодепрессивным эффектом);
2. вторичный сахарный диабет (глюкокортикоиды – контринсулярные гормоны);
3. вторичная артериальная гипертензия (глюкокортикоидные гормоны повышают тонус гладкомышечных клеток сосудистой стенки);
4. стероидный остеопороз – снижение степени минерализации костной ткани, вследствие чего могут возникать патологические переломы;
5. ожирение по типу Кушинга – отложение жира преимущественно на лице («лунообразное лицо») и туловище, конечности при этом остаются худыми.
Различают две основные формы патологических изменений эпифиза: гиперфункция (синдром Марбурга–Милку) и недостаточность эпифизарного мелатонина (синдром Пеллицци).
1. Синдром Марбурга–Милку – гиперпродукция эпифизарного мелатонина вследствие гиперплазии пинеоцитов или опухоли (пинеалома). Помимо эпифиза мелатонин вырабатывается в других органах, например, апудоцитами кишечника. Эпифизарный мелатонин является антагонистом ряда тропных гормонов гипофиза (липотропинов, тиреотропного гормона и гонадотропинов), поэтому при его избытке развиваются ожирение (эпифизарное ожирение), гипотиреоз и гипогенитализм.
2. Синдром Пеллицци – гипофункция эпифиза. Отсутствие тормозящего влияния мелатонина на формирование половой системы проявляется в её преждевременном созревании (к концу первого десятилетия жизни, а в ряде случаев и раньше). Болеют преимущественно мальчики (андротропизм).
IV. ПАТОЛОГИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЁЗ
Нарушения функции околощитовидных желёз проявляются в виде усиления продукции парат-гормона (гиперпаратиреоз) или его недостаточности (гипопаратиреоз).
1. Гиперпаратиреоз (болезнь Энгеля–Реклингаузена) – гиперпродукция парат-гормона с последующим развитием гиперкальциемии. Гиперпродукция гормона обусловлена гиперплазией или опухолью паращитовидных желёз и сопровождается следующими основными изменениями:
1. гиперпаратиреоидной висцеропатией (прежде всего нефропатией) в результате метастатического кальциноза. Кроме того, в почках формируются камни;
2. гиперпаратиреоидной остеопатией, проявляющейся сочетанием остеопороза и разрастания малообызвествлённой костной ткани. Кости при этом утолщены, характерны патологические переломы.
2. Гипопаратиреоз – недостаточность парат-гормона, приводящая к гипокальциемии, которая обусловливает развитие судорожного синдрома.
V. ПАТОЛОГИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Поражения щитовидной железы встречаются наиболее часто среди всех форм эндокринной патологии.
Классификация (по двум основным принципам).
I. Общие формы патологии щитовидной железы:
II. В зависимости от уровня продукции тиреоидных гормонов выделяют три формы функционального состояния щитовидной железы:
1. эутиреоз – при нормальном уровне тиреоидных гормонов,
2. гипертиреоз – при высоком уровне тиреоидных гормонов (крайняя степень выраженности гипертиреоза называется тиреотоксикоз),
3. гипотиреоз – при низком уровне тиреоидных гормонов (крайняя степень выраженности гипотиреоза называется микседема).
Определение: Струма (зоб) – макроскопически выраженная гиперплазия тиреоидной ткани. Термин зоб до середины XIX века использовался для обозначения всех объёмных процессов в передней и боковой частях шеи. Р.Вирхов первым стал применять термин зоб только по отношению к увеличению щитовидной железы. К началу ХХ века из группы зоба исключили опухоли, а к середине века – тиреоидиты. В настоящее время зобом называют только макроскопически выраженную гиперплазию тиреоидной ткани. Некоторые патологи считают, что от этого термина следует отказаться, а использовать термины узловая гиперплазия вместо узловой зоб и диффузная гиперплазия вместо диффузный зоб.
3. дисгормоногенетический зоб,
4. диффузный токсический зоб,
1. Эндемический зоб – зоб у жителей йод-дефицитных районов. Возникающий при этом дефицит тиреоидных гормонов приводит к активации тиреотропоцитов гипофиза. Повышенное образование тиреотропного гормона ведёт к гиперплазии тиреоидной ткани.
2. Спорадический зоб – приобретённая йод-независимая форма зоба, встречающаяся повсеместно. В основе болезни лежит недостаточность ферментов синтеза тиреоидных гормонов, а также первичная гиперпродукция тиреотропного гормона гипофиза. Способствуют развитию приобретённой недостаточности ферментов синтеза тиреоидных гормонов алиментарные струмогены – вещества, содержащиеся в продуктах питания (тиоцианаты сои, капусты, репы). Пища, богатая соединениями кальция и фтора, препятствует всасыванию йода, что также способствует развитию спорадического зоба.
3. Дисгормоногенетический зоб – йод-независимая форма зоба, связанная с наследственной недостаточностью ферментов синтеза тиреоидных гормонов.
Классификация (одинакова для эндемического, спорадического и дисгормоногенетического зоба):
I. Макроморфологический принцип:
1. диффузный зоб – увеличивается весь орган,
2. узловой зоб – очаговое увеличение железы в виде узла/нескольких узлов.
II. Микроморфологический принцип:
1. паренхиматозный зоб – образован мелкими фолликулами без коллоида или с незначительным количеством коллоида (начальная фаза процесса),
2. коллоидный зоб (макро- и микрофолликулярный) – образован мелкими или крупными фолликулами с коллоидом.
III. В зависимости от функционального состояния щитовидной железы:
1. эутиреоидный зоб – зоб с нормальной продукцией тиреоидных гормонов,
2. гипотиреоидный зоб – зоб с недостаточностью тиреоидных гормонов,
3. зоб с признаками кретинизма – гипотиреоидный зоб, развивающийся в детском возрасте и приводящий к физическому и психическому недоразвитию (кретинизму),
4. гипертиреоидный зоб – редкая форма зоба, сопровождающаяся повышенной продукцией тиреоидных гормонов (выделяется не всеми эндокринологами).
4. Диффузный токсический зоб (болезнь фон Базедова, болезнь Грейвза) – гипертиреоидный зоб аутоиммунной природы. В основе заболевания лежит аллергическая реакция V типа (появление стимулирующих аутоантител к фолликулярным клеткам щитовидной железы).
Диффузный токсический зоб проявляется следующими синдромами:
1. тиреотоксическая миопатия, в том числе тиреотоксическая кардиопатия (тиреотоксический миокардит),– изменения мышечной ткани; в тяжёлых случаях при явлениях сердечной недостаточности на фоне диффузного кардиосклероза или вследствие слабости дыхательной мускулатуры может наступить смерть.
2. тиреотоксический гепатит может привести к развитию цирроза.
3. вторичная артериальная гипертензия.
4. увеличение в размере щитовидной железы (вплоть до выраженного, называемого тиреомегалией).
5. характерный внешний вид больных: общая атрофия (похудание) вследствие преобладания катаболизма биополимеров над синтетическими процессами (тиреоидные гормоны – гормоны с катаболическим эффектом), что приводит к атрофии жировой ткани и скелетных мышц; внешне больные выглядят моложе своих лет;
6. тиреогенная офтальмопатия (экзофтальм и офтальмоплегия). Экзофтальм развивается вследствие разрастания фиброзной ткани в ретробульбарной клетчатке (ретробульбарный фиброз). Офтальмоплегия – неподвижность глазных яблок в результате сдавления глазодвигательных мышц и их последующей атрофии.
5. Эктопический зоб – гиперплазия нетипично расположенной тиреоидной ткани. Наиболее частые варианты эктопического зоба:
2. ретростернальный зоб (может располагаться в любом участке переднего средостения),
3. струма яичника (тератома яичника с преобладанием в ней зрелой тиреоидной ткани).
Определение. Тиреоидиты – воспалительные поражения щитовидной железы.
Наиболее часто встречаются следующие тиреоидиты: травматический (пальпируемый) тиреоидит, острый гнойный тиреоидит, подострый гранулематозный тиреоидит де Кервена–Крайля, аутоиммунный тиреоидит Хасимото и хронический фиброзный тиреоидит Риделя.
1. Травматический (пальпируемый) тиреоидит развивается в результате травмы. Макроскопически в железе в месте травмы формируется уплотнение без чётких границ. Микроскопически в просвете повреждённых фолликулов выявляется множество пенистых клеток (макрофагов, фагоцитирующих коллоид), а между фолликулами – лимфогистиоцитарный инфильтрат.
2. Острый гнойный тиреоидит характеризуется формированием абсцесса (абсцессов) или флегмоны щитовидной железы. Возникает в результате гематогенного/лимфогенного попадания гноеродной флоры в ткань щитовидной железы, а также при распространении гнойного процесса с паратиреоидных тканей при флегмонах шеи и восходящем гнойном медиастините.
3. Подострый гранулематозный тиреоидит де Кервена–Крайля. Причиной заболевания считаются вирусы, прежде всего парамиксовирусы (вирусы кори и эпидемического паротита). Подострый тиреоидит длится от нескольких недель до 2 лет (в среднем 5–6 мес) и, обычно, заканчивается выздоровлением. В некоторых случаях заболевание длится годами, периодически рецидивируя. Макроскопически отмечается увеличение щитовидной железы, развивающееся довольно быстро, что напоминает рост злокачественной опухоли. Микроморфологически выявляются очаги некроза фолликулов, наличие свободного коллоида в ткани, вокруг которого образуются гигантоклеточные гранулёмы.
4. Хронический фиброзный (фиброзирующий) тиреоидит Риделя – см учебник.
5. Аутоиммунный тиреоидит Хасимото – см учебник.
VI. ПАТОЛОГИЯ ЭНДОКРИННОЙ ТКАНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ (ОСТРОВКОВ ЛАНГЕРГАНСА)
К наиболее известным формам патологии островков Лангерганса относятся гиперинсулинизм, синдром Маллинсона, ингибиторный синдром и синдром Вернера–Моррисона. Традиционно в данной группе патологических процессов рассматривается сахарный диабет (недостаточность эффектов инсулина), который не всегда проявляется поражением островков Лангерганса.
1. Сахарный диабет – см учебник.
Основные проявления (подробнее см учебник):
1. вторичный иммунодефицит, на фоне которого формируются различные инфекционные осложнения вплоть до сепсиса,
2. диабетическая ангиопатия (макро- и микроангиопатия),
3. диабетическая нефропатия (клинически выраженная нефропатия называется синдромом Киммелстила–Уилсона),
2. Гиперинсулинизм – гиперпродукция инсулина вследствие гиперплазии бэта-клеток или опухоли из них (инсулинома). Основным проявлением болезни является гипогликемическая энцефалопатия – дистрофические изменения ткани головного мозга. Гипогликемия прежде всего отражается на жизнедеятельности головного мозга (20% всей глюкозы крови потребляется мозгом), вследствие чего вторично активируется симпато-адреналовая система и повышается продукция катехоламинов. Катехоламины расширяют сосуды мозга, но длительная гиперкатехоламинемия вызывает паралитическую дилатацию микрососудов, застой в них крови, тромбоз и отёк периваскулярной ткани, что значительно ухудшает трофику, вызывая некрозы, кровоизлияния в ткань головного мозга и её атрофические изменения.
3. Синдром Маллинсона – гиперпродукция панкреатического глюкагона вследствие гиперплазии альфа-клеток или опухоли из них (панкреоглюкагонома). Основное проявление заболевания – вторичный сахарный диабет (глюкагон – контринсулярный гормон).
Помимо панкреатического глюкагона, может произойти усиление синтеза энтероглюкагона – дуоденального глюкагона (опухоль при этом называется энтероглюкагонома). Она проявляется другими признаками: интенсивным разрастанием слизистой оболочки тонкой кишки (энтероглюкагон – фактор роста для этой ткани) и развитием тонкокишечной непроходимости.
4. Ингибиторный синдром обусловлен гиперпродукцией панкреатического соматостатина при гиперплазии дельта-клеток или опухоли из них (соматостатинома). Соматостатин – универсальный ингибитор, он является антагонистом инсулина, угнетает желудочную секрецию и секрецию желчи. Заболевание проявляется следующими признаками:
1. вторичным сахарным диабетом,
2. хроническим гипосекреторным гастритом и
3. желчнокаменной болезнью.
5. Синдром Вернера–Моррисона возникает при гиперпродукции вазоактивного интестинального пептида (ВИП) опухолями из дельта-1-клеток островков Лангерганса (випомы). Заболевание проявляется так называемой панкреатической холерой (водянистая диарея). ВИП вызывает расширение капилляров слизистой оболочки кишечника и её отёк. Отёчная жидкость поглощается покровными эпителиоцитами и секретируется ими в просвет кишки. Увеличение объёма содержимого кишечника приводит к диарее.
VII. ПАТОЛОГИЯ КЛУБОЧКОВОЙ ЗОНЫ КОРЫ НАДПОЧЕЧНИКОВ
Патология клубочковой зоны коры надпочечников проявляется усилением (гиперальдостеронизм) или снижением (гипоальдостеронизм) продукции минералокортикоидов. Гиперальдостеронизм подразделяют на первичный (синдром Конна) и вторичный.
I. гиперальдостеронизм – гиперпродукция минералокортикоидов.
1. первичный гиперальдостеронизм Конна – самостоятельное заболевание, обусловленное гиперплазией или гормонально-активной опухолью клубочковой зоны (альдостерома).
2. вторичный гиперальдостеронизм – проявление или осложнение других заболеваний и патологических состояний, прежде всего нефрогенной артериальной гипертензии.
II. гипоальдостеронизм (соль-теряющий синдром) – недостаточность минералокортикоидов.
Гиперальдостеронизм проявляется следующими основными признаками:
1. гипокалиемическая миопатия – нарушение функции скелетных мышц и миокарда на фоне дефицита калия (мышечная слабость, параличи и парезы скелетных мышц, недостаточность сократительной функции миокарда, метаболические некрозы миокарда),
2. вторичная артериальная гипертензия.
Гипоальдостеронизм сопровождается эксикозом (дегидратацией) вследствие потери с мочой натрия и воды.
VIII. ПАТОЛОГИЯ ПУЧКОВОЙ ЗОНЫ КОРЫ НАДПОЧЕЧНИКОВ
Выделяют две формы патологических изменений в пучковой зоне коры надпочечников: усиление (гиперкортицизм) и ослабление (гипокортицизм) продукции глюкокортикоидных гормонов. Гипер- и гипокортицизм подразделяются на два варианта – первичный и вторичный.
I. гиперкортицизм – гиперпродукция глюкокортикоидных гормонов (эндогенных глюкокортикоидов).
1. первичный гиперкортицизм (синдром Кушинга) – обусловлен гиперплазией или опухолью (кортикостерома) пучковой зоны, а также при длительном применении препаратов глюкокортикоидных гормонов в высоких дозах (ятрогенный первичный гиперкортицизм); первичный гиперкортицизм – гиперкортицизм без гиперпродукции АКТГ.
2. вторичный гиперкортицизм (болезнь Кушинга) – гиперкортицизм, развивающийся под влиянием гиперпродукции АКТГ.
II. гипокортицизм – недостаточность эндогенных глюкокортикоидов.
1. первичный гипокортицизм – обусловлен гипоплазией, некрозом или атрофией пучковой зоны (его острая форма, развивающаяся чаще всего при кровоизлиянии в оба надпочечника, называется синдромом Уотерхауса–Фридериксена; хроническая – болезнью Аддисона).
2. вторичный гипокортицизм – гипокортицизм, развивающийся на фоне недостаточности АКТГ, в частности, при синдром отмены длительно применявшихся препаратов глюкокортикоидных гормонов (ятрогенный вторичный гипокортицизм).
Синдром Кушинга проявляется аналогично болезни Кушинга (см выше).
Болезнь Аддисона (бронзовая болезнь) – форма хронической недостаточности коры надпочечников.
Основные проявления болезни:
1. вторичный иммунодефицит – развивается в результате недостаточности глюкокортикоидов, необходимых для созревания лимфоцитов (дисгормональная гиперплазия лимфоидной ткани), и проявляется различными инфекционными процессами вплоть до сепсиса;
2. вторичная артериальная гипотония;
3. миопатия – атрофия скелетных мышц и миокарда (наиболее характерным клиническим проявлением болезни является быстрая утомляемость),
4. генерализованный гипермеланоз – гипермеланоз кожи и слизистых оболочек в результате гиперпродукции гипофизом меланотропинов.
IX. ПАТОЛОГИЯ СЕТЧАТОЙ ЗОНЫ КОРЫ НАДПОЧЕЧНИКОВ
Наиболее частыми формами патологии сетчатой зоны коры надпочечников являются опухоли андростерома и кортикоэстрома, а также наследственное заболевание адреногенитальный синдром.
1. Андростерома – опухоль сетчатой зоны, секретирующая андрогенные гормоны. У женщин андростерома проявляется признаками вирилизации (маскулинизации): увеличивается масса скелетных мышц, рост волос по мужскому типу, происходит огрубение голоса.
2. Кортикоэстрома – опухоль сетчатой зоны, продуцирующая эстрогенные гормоны. У мужчин она сопровождается развитием признаков феминизации: гинекомастия, перераспределение жира по женскому типу, прекращение роста волос на лице, повышение тембра голоса.
3. Адреногенитальный синдром – наследственная недостаточность ферментов синтеза глюкокортикоидов. При этом вырабатывается избыточное количество надпочечниковых (эпиренальных) андрогенов. У мальчиков этот синдром проявляется преждевременным половым созреванием (надпочечниковая форма преждевременного полового созревания), у девочек – признаками вирилизации с развитием так называемого женского псевдогермафродитизма (за счёт гипертрофии клитора, симулирующего наличие полового члена).
Катехоламин-продуцирующая ткань расположена в виде островков рядом с вегетативными ганглиями. Эти островки называются параганглиями. За исключением мозгового вещества надпочечников параганглии имеют шаровидную форму, поэтому их нередко называют гломусами. Наиболее крупными параганглиями являются мозговое вещество надпочечников, каротидный гломус и поясничный аортальный параганглий (орган Цукеркандля).
Выделяют симпатические и парасимпатические параганглии. Функционально параганглии делят на хромаффинные (окрашивающиеся солями хромовой кислоты) и нехромаффинные (не окрашивающиеся этими реактивами). Хромаффинные параганглии, к которым относится мозговое вещество надпочечников, преимущественно вырабатывают адреналин, нехромаффинные – норадреналин.
Классификация форм патологии параганглиев:
I. Гиперплазия параганглиев.
II. Параганглиомы – опухоли параганглиев.
1. феохромоцитома (хромаффинная параганглиома),
2. хемодектома (нехромаффинная параганглиома).
1. Гиперплазия каротидных гломусов. Хроническая гипоксия при заболеваниях лёгких, сердца, при анемиях, а также у жителей высокогорных районов сопровождается гиперплазией сонных (каротидных) гломусов.
2. Феохромоцитома – опухоль хромаффинных параганглиев (80% феохромоцитом локализуется в мозговом веществе надпочечников), сопровождается гиперпродукцией адреналина.
Основные проявления болезни:
1. артериальная гипертензия,
2. вторичный сахарный диабет (адреналин – контринсулярный гормон).
XI. ПАТОЛОГИЯ ДИФФУЗНОЙ ЭНДОКРИННОЙ СИСТЕМЫ (АПУДОПАТИИ)
Апудопатии проявляются гипо- или гиперфункцией апудоцитов. Гиперфункция апудоцитов связана с их гиперплазией или опухолями (апудомами). Апудомы могут быть доброкачественными и злокачественными. Наиболее часто встречаются патологические изменения ЕС-, G- и S-клеток.
1. Патология ЕС-клеток (серотонина)
Основной формой патологии ЕС-клеток является карциноидный синдром. Карциноидный синдром – синдром гиперпродукции серотонина опухолями из ЕС-клеток (карциноидами), реже другими типами опухолей.
Наиболее характерные проявления карциноидного синдрома:
1. Карциноидная кардиопатия – патогномоничный для карциноидного синдрома патологический процесс. При этом формируются пороки клапанов. Обычно поражаются клапаны правого сердца в виде недостаточности трёхстворчатого клапана и стеноза устья лёгочного ствола. Створки клапанов и сухожильные хорды утолщены, молочно-белого цвета, деформированы (створки трикуспидального клапана укорочены, створки клапана устья лёгочного ствола сращены между собой). Микроскопически в створках клапанов отмечается разрастание волокнистой соединительной ткани.
2. Бронхоспазм (иногда развивается бронхиальная астма); особенно опасны астмоидные состояния, развивающиеся во время операции удаления карциноидной опухоли и нередко заканчивающиеся летальным исходом.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Развитие анемии возможно при ряде патологических состояний, казалось бы, не связанных с кроветворной системой. Диагностических трудностей, как правило, не возникает, если основное заболевание известно и анемический синдром не превалирует в клинической картине. Значение симптоматических (вторичных) анемий объясняется их относительной частотой в педиатрии и возможной резистентностью к терапии. Наиболее часто симптоматические анемии наблюдаются при хронических инфекциях, системных заболеваниях соединительной ткани, болезнях печени, эндокринной патологии, хронической почечной недостаточности, опухолях.

Наиболее часто встречаются при гнойно-воспалительных процессах, протозойных инфекциях, ВИЧ-инфекции. Установлено, что при любой хронической инфекции, продолжающейся более 1 мес, наблюдается снижение гемоглобина до 110-90 г/л.
В происхождении анемии имеют значение несколько факторов:
- Блокада перехода железа из ретикулоэндотелиальных клеток в эритробласты костного мозга;
- Увеличение расходов железа на синтез железосодержащих ферментов и, соответственно, уменьшение количества железа, идущего на синтез гемоглобина;
- Укорочение продолжительности жизни эритроцитов, обусловленное усилением активности клеток ретикулоэндотелиальной системы;
- Нарушение выделения эритропоэтина в ответ на анемию при хроническом воспалении и, как следствие этого, снижение эритропоэза;
- Снижение всасывания железа при лихорадке.
В зависимости от длительности хронического воспаления, обнаруживают нормохромную нормоцитарную анемию, реже гипохромную нормоцитарную анемию и при очень большой давности заболевания — гипохромную микроцитарную анемию. Морфологические признаки анемии неспецифичны. В мазке крови обнаруживают анизоцитоз. Биохимически выявляют снижение сывороточного железа и железосвязывающей способности сыворотки при нормальном или повышенном содержании железа в костном мозге и ретикулоэндотелиальной системе. В дифференциальной диагностике от истинных железодефицитных анемий помогает уровень ферритина: при вторичных гипохромных анемиях уровень ферритина нормальный или повышенный (ферритин — белок острой фазы воспаления), при истинном дефиците железа уровень ферритина низкий.
Лечение направлено на купирование основного заболевания. Препараты железа назначают больным с низким уровнем сывороточного железа. Для лечения используют витамины (особенно группы В). У больных СПИДом, имеющих цизкий уровень эритропоэтина, его введение в больших дозах может корригировать анемию.
Острые инфекции, особенно вирусные, могут вызывать селективную транзиторную эритробластопенню или транзиторную аплазию костного мозга. Парвовирус В19 является причиной арегенераторных кризов у больных гемолитическими анемиями.

По литературным данным, анемия наблюдается примерно у 40 % больных системной красной волчанкой и ревматоидным артритом. Основной причиной развития анемии считается недостаточная компенсаторная реакция костного мозга, обусловленная нарушенной секрецией эритропоэтина. Дополнительными факторами анемизации являются развитие дефицита железа, вызванное постоянными скрытыми кровотечениями через кишечник на фоне приема нестероидных противовоспалительных препаратов и истощение резервов фолатов (потребность в фолиевой кислоте повышена в связи с пролиферацией клеток). У больных системной красной волчанкой, кроме того, может быть аутоиммунная гемолитическая анемия и анемия вследствие почечной недостаточности.
Анемия чаще всего нормохромная нормоцитарная, иногда гипохромная микроцитарная. Имеется корреляция между концентрацией гемоглобина и СОЭ — чем выше СОЭ, тем ниже уровень гемоглобина. Уровень железа в сыворотке низкий, железосвязывающая способность также низкая.
Терапия препаратами железа в активную фазу может быть эффективна у детей в возрасте до 3 лет, так как у них часто имеется ранее возникший дефицит железа, а также у больных с крайне низким уровнем сывороточного железа и низким коэффициентом насыщения трансферрина железом. Снижение активности болезни под влиянием патогенетической терапии приводит к быстрому повышению содержания железа в сыворотке и увеличению транспорта железа в костный мозг. Больным может быть назначена терапия эритропоэтином, однако пациентам требуются большие дозы эритропоэтина и даже на высокие дозы отмечается различная степень ответа. Установлено, что чем выше уровень базального эритропоэтина, циркулирующего в плазме пациента, тем меньше эффективность терапии эритропоэтином.
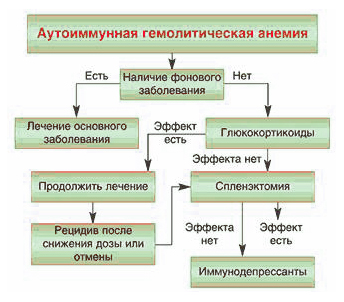
Вторичная аутоиммунная гемолитическая анемия у больных системными заболеваниями соединительной ткани нередко купируется при лечении основного заболевания. Первым этапом лечения является терапия кортикостероидами и при необходимости проведение спленэктомии. При резистентности гемолиза к указанным методам терапии добавляют цнтостатики (циклофосфан, азатиоприн), циклоспорин А, большие дозы иммуноглобулина для внутривенного введения. Для быстрого снижения титра антител можно использовать плазмаферез.

При циррозе печени у больных с синдромом портальной гипертензии развитие анемии обусловлено дефицитом железа вследствие периодических кровопотерь из варикозно расширенных вен пищевода и желудка и гиперспленизмом. Цирроз может сопровождаться «шпороклеточной анемией» с фрагментацией эритроцитов. Гипопротеинемия усугубляет анемию вследствие увеличения объема плазмы.
При болезни Вильсона-Коновалова возможна хроническая гемолитическая анемия вследствие скопления меди в эритроцитах.
При вирусном гепатите может развиться апластическая анемия.
У части больных возможен дефицит фолиевой кислоты. Уровень витамина В12 при тяжелых заболеваниях печени патологически повышен, так как витамин «выходит» из гепатоцитов.
Лечение анемии симптоматическое и зависит от основного механизма ее развития — восполнение дефицита железа, фолатов и т. д.; оперативное лечение при синдроме портальной гипертензии.

Анемия часто диагностируется при гипотиреозе (врожденном н приобретенном), обусловлена снижением выработки эритропоэтина. Чаще анемия нормохромная нормоцитарная, может быть гипохромной из-за дефицита железа, обусловленного нарушением его всасывания при гипотиреозе, или гиперхромной макроцитарной из-за дефицита витамина В12, развивающегося вследствие повреждающего действия антител, направленных против клеток не только щитовидной железы, но и париетальных клеток желудка, что ведет к дефициту витамина В12. Заместительная терапия тироксином приводит к улучшению и постепенной нормализации гематологических показателей, по показаниям назначают препараты железа и витамин В12
Развитие анемии возможно при тиреотоксикозе, хронической недостаточности коры надпочечников, гипопитуи-таризме.

Хроническая почечная недостаточность (ХПН) — синдром, обусловленный необратимой гибелью нефронов вследствие первичного или вторичного заболевания почек.
С потерей массы функционирующих нефронов происходит прогрессирующая утрата почечных функций, в том числе снижается продукция эритропоэтина. Развитие анемии у больных хронической почечной недостаточностью преимущественно обусловлено снижением синтеза эритропоэтина. Установлено, что снижение способности почек к выработке эритропоэтина совпадает, как правило, с появлением азотемии: анемия развивается при уровне креатинина 0,18-0,45 ммоль/л и ее тяжесть коррелирует с выраженностью азотемии. С прогрессированием почечной недостаточности присоединяются осложнения уремии и программного гемодиализа (кровопотери, гемолиз, нарушение баланса железа, кальция, фосфора, влияние уремических токсинов и пр.), что усложняет и индивидуализирует патогенез анемии при хронической почечной недостаточности и усугубляет ее тяжесть.
Анемия обычно нормохромная нормоцитарная; уровень гемоглобина может быть снижен до 50-80 г/л; при появлении дефицита железа — гипохромная мнкроцитарная.
Лечение проводят рекомбинантным человеческим эритропоэтнном (эпокрин, рекормон), который назначают при наличии анемии как больным, еще не нуждающимся в гемодиализе, так и на поздних стадиях хронической почечной недостаточности. При необходимости назначают препараты железа, фолиевую кислоту, аскорбиновую кислоту, витамины группы В (В1, В6, В12), анаболические стероиды. Гемотрансфузии проводят, главным образом, для экстренной коррекции прогрессирующей тяжелой анемии (снижение уровня гемоглобина ниже 60 г/л), например, при массивных кровотечениях. Эффект от гемотрансфузии лишь временный, в дальнейшем необходима консервативная терапия.

Выделяют следующие причины развития анемии при злокачественных заболеваниях:
- Геморрагический статус
- Дефицитные состояния
- Дизэритропоэтические анемии
- анемия подобная наблюдающимся при хроническом воспалении;
- сидеробластная анемия
- эритроидная гипоплазия
- Гемоднлюция
- Гемолиз
- Лейкоэритробластная анемия и инфильтрация костного мозга
- Лечение цитостатиками.
У больных лимфомой или лимфогранулематозом описана рефрактерная гипохромная анемия, характеризующаяся биохимическими и морфологическими признаками дефицита железа, но не поддающаяся лечению препаратами железа. Установлено, что из ретикулоэндотелиальной системы, вовлеченной в патологический процесс, железо не переносится в плазму.
Метастазирование опухолей в костный мозг — чаще всего в костный мозг метастазирует нейробластома, реже ретинобластома и рабдомиосаркома, лимфосаркома. У 5 % больных лимфогранулематозом выявляют инфильтрацию в костный мозг. Инфильтрацию костного мозга можно предполагать при лейкоэритробластной анемии, для которой характерно присутствие миелоцитови ядросодержащих эритроидных клеток, ретикулоцитоза, и в поздней стадии — тромбоцитопении и нейтропении, то есть панцитопения. Лейкоэритробластная картина крови объясняется тем, что при инфильтрации костного мозга происходит экстрамедуллярный эритропоэз, в результате чего в периферическую кровь выбрасываются ранние миелоидные и эритроидные клетки. Несмотря на то, что анемия обычно имеется, она может отсутствовать в ранней стадии.
Лечение анемии, помимо временного эффекта от трансфузии, мало успешно, если не удается купировать основной процесс. Возможно применение эритропоэтина.
Недоношенные дети с анемией в период выраженности клинико-гематологических изменений должны наблюдаться врачом не реже 1 раза в неделю с контролем клинического анализа крови каждые 10-14 дней на фоне лечения препаратами железа. При неэффективности терапии и в случаях тяжелой анемии показана госпитализация для выяснения рефрактерности к препаратам железа и лечения.

источник
Железодефицитная анемия (малокровие) обычно рассматривают скорее в качестве симптома другого заболевания или в виде состояния, возникающего при недостаточной концентрации в организме железа.
Причины и факторы, способствующие развитию анемического синдрома:
- Развивается болезнь у маленьких детей и взрослых, соблюдающих строгую диету, если они не получают необходимого количества железа с едой.
- На фоне нарушений в пищеварительной системе. Известно, что всасывание микроэлементов происходит в тонкой кишке (верхние отделы) и в желудке. А тем более, после удаления части желудка, способность пищеварительной системы к абсорбции нарушается.
- Анемический синдром может развиться из-за больших потерь крови. Это является основной причиной железодефицитных состояний. Часто синдром возникает у женщин из-за больших потерь крови во время обильной менструации и у тех, кто страдает от язвы пищеварительного тракта, рака желудка, геморроя, новообразований в толстой кишке.
- Сокращение времени жизни эритроцитов в крови или быстрое их разрушение. В норме срок жизни эритроцита – 4 месяца. В некоторых случаях причиной гемолиза является патология селезенки. Развивается гемолитическая или серповидно-клеточная анемия. При таком заболевании организмом вырабатывается аномальный гемоглобин.
При подозрении на анемию, важно оперативно обратится за помощью к специалисту. Врач поможет выявить причины и способы лечения болезни. Синдром приводит к снижению иммунитета, к упадку сил, ограничению работоспособности. Также анемия может стать важным сигналом о развитии других патологий и серьезных проблем в работе отдельных органов и их систем.
Диагноз ставят по анализу крови, а лечение, как правило, заключается в восстановлении количества железа с помощью лек. препаратов. Лекарства используют внутрь или вводят с помощью инъекций.
| Пол, возраст | Порог Нb (Г/Л) | Порог Нb (Г/%) |
| Дети от 3 месяцев до 5 лет | 110 | 11,0 |
| Дети от 5 до 12 лет | 115 | 11,5 |
| Дети от 12 до 15 лет | 120 | 12,0 |
| Мужчины от 15 лет | 130 — 160 | 13,0 — 16,0 |
| Женщины от 15 лет | 120 — 140 | 12,0 — 14,0 |
| Беременные женщины | 110 | 11,0 |
Можно выделить 3 основных механизма развития анемии:
- Вследствие нарушения процесса образования эритроцитов и образования гемоглобина. Такого рода механизм можно проследить при недостаточном поступлении железа, фолиевой кислоты и витамина В12, при заболеваниях костного мозга. Иногда дефицитное состояние может возникнуть из-за приема сверхбольших доз витамина С. При приеме сверх доз аскорбиновой к-ты происходит блокировка витамина В12 и нарушение процессов кроветворения.
- Острая потеря эритроцитов. Обычно – это последствия острых кровотечений, операций и травм. При хронических кровотечениях в небольших объемах причиной анемии выступает не просто потеря эритроцитов, но и недостаток железа на фоне хронической утраты крови.
- Анемический синдром — последствия от ускоренного разрушения эритроцитов крови. При нормальной работе костного мозга и иных органов кроветворения эритроциты живут порядка 4 месяцев, а затем разрушаются. При гемолитической анемии, гемоглобинопатии и так далее скорость разрушения эритроцитов выше, чем их производства. Иногда процесс протекает под влиянием внешних стимулов, химических веществ (уксус).
Рассмотрим различные виды у взрослых. Анемия является симптомом, а не отдельным заболеванием и может возникать при ряде болезней. Они, как правило, связаны с первичным поражением кроветворной системы или не зависят от нее. Невозможно провести четкую нозологическую классификацию анемий. Для этого используют принцип практической целесообразности. И в результате заболевание делят по единому классификационному признаку – по цветовому показателю.
Падение уровня гемоглобина в крови чаще всего наблюдают при одновременном снижении количества и качества эритроцитов. Любой вид анемии непременно приводит к снижению эффективности дыхательной функции крови, возникновению кислородного голодания тканей. Обычно это видно по бледности кожных покровов, слабости, высокой утомляемости, головным болям, головокружении, одышке, учащенному ритму сердца и т.д.
Врач назначает рутинное исследование мазка крови, в процессе анализа морфолог обязан указать на отклонения размера эритроцитов. Уменьшение может быть, как в меньшую (микроцитарная анемия), так и большую сторону (макроцитарная). Однако, если необходимую оценку производят без специальных микрометров, то она является весьма субъективной.
Анемии, которые могут развиться при болезнях почек, гипопластические, АХЗ и острую постгеморрагическую относят к нормоцитарным. Макроцитарные анемии бывают нормо- и гиперхромными, а микроцитарные – гипохромными.
Намного информативнее автоматический анализ крови, при котором соблюдается четкая стандартизация важных показателей. Учитывают средний корпускулярный объем (СКО), который можно измерить в фемтолитрах (fl, фл). Нормальное значение СКО составляет 80-90 фл и называется нормоцитозом. Если показатель повышен до 95 и более – то фиксируют развитие макроцитоза. При снижении менее 80 фл ставят диагноз микроцитоз. Есть у автоматического метода и свои недостатки: достаточно дорогое и чуткое оборудование, которому необходимо соответствующее обслуживание.
При замене цветового показателя на СКО не нарушается привычная классификация анемий по цветовому показателю. Анемии подразделяют на группы по различным признакам. Классификацию, как правило, основывают на удобстве и практической значимости для постановки диагноза.
Цветовой показатель покажет степень насыщения эритроцита гемоглобином. У здорового человека ЦП колеблется 0,86 до 1,1. В зависимости от него различают такие анемии:
- Гипохромная анемия, если ЦП меньше 0,86 (по некоторым классификациям ниже 0,8). При таких анализах ставят диагноз талассемия или железодефицитная анемия.
- При нормохромной анемии ЦП колеблется в пределах 0,86 — 1,1. В таком случае у пациента наблюдается постгеморрагическая анемии, гемолитические анемии, апластические анемии, неопластические заболевания костного мозга, внекостномозговые опухоли, анемия из-за снижения темпов выработки и количества эритропоэтина.
- Гиперхромная анемия – при ЦП более 1,1. Такие показатели характерны для фолиеводефицитной анемии, а также витамин B12-дефицитной анемии, для миелодиспластического синдрома.
Проводится в зависимости от выраженности снижения уровня гемоглобина в крови. Классификация по степени тяжести предполагает:
- легкую степень (когда уровень гемоглобина ниже нормы, но остается на уровне более 90 грамм на литр);
- среднюю степень тяжести (когда гемоглобин 70-90 г/л);
- тяжелую степень (когда уровень гемоглобина остается меньше 70 грамм на литр).
Разделение степени анемии по уровню гемоглобина достаточно распространено. Чаще всего именно по гемоглобину подтверждают диагноз, а потом уже проводят более детальную диагностику.
Характеризуется незначительным падением количества гемоглобина в крови. Обычно проявляются следующие симптомы:
- усталость;
- апатия;
- общее недомогание;
- часто развивается у беременных.
Как уже упоминалось выше, анемия 1 степени фиксируется, если уровень микроэлементов в крови ниже нормы, но выше 90 г на л.
Также первая степень заболевания часто поражает маленьких детей, появившихся на свет при многоплодной беременности или недоношенными. У детей постарше – это паразитические заболевания или погрешности в питании. Анемия легкой степени тяжести проще поддается лечению. Обычно рекомендуют соблюдать диету и усиленно питаться. При легкой степени анемии в рацион необходимо включать различные микроэлементы и витамины, в первую очередь – железо и витамин В12.
Анемия 2 степени или средней степени тяжести возникает не только при снижении уровня гемоглобина до 70 г/л. Возникает головокружение и головные боли, одышка, частое сердцебиение, трудности с дыханием. Дети часто болеют, у них наблюдается бледность губ и кожи. При 2 степени анемии может возникнуть кислородное голодание плода, снижается сократительная способность миокарда. Лечение медикаментозное + диета, следует больше находится и гулять по свежему воздуху.
На этой стадии острая анемия несет опасность для жизни человека. При 3 степени наблюдается ломкость ногтей и волос, острое снижение защитных сил организма, онемение конечностей, проблемы с сердцем и сосудами. Ребенок начинает часто болеть.
Особенно тяжелыми будут последствия такого симптома у беременных женщин. Это может негативно отразится на плоде, у матери развиться дистрофические изменения матки и плаценты. Анемия 3 степени лечится в стационаре, с переливанием эритроцитарной массы и другими видами медикаментозного лечения.
Основным признаком такого разделения принято считать количество молодых эритроцитов (ретикулоциты) в периферической картине крови. В норме показатель колеблется от 0,5 до 2%.
- Арегенераторную анемию (например, апластическая анемия) — ретикулоциты отсутствуют.
- Гипорегенераторная (витамин B12-дефицитная анемия или железодефицитная анемия) – ретикулоциты ниже 0,5%.
- Регенераторная или норморегенераторная (постгеморрагическая) — ретикулоциты 0,5 — 2%.
- Гиперрегенераторная (гемолитические анемии) — количество ретикулоцитов больше 2%.
Такая классификация основывается на различных механизмах развития анемии, как патологического процесса.
- Ассоциированные с дефицитом Fe — железодефицитные анемии.
- Гемолитические анемии — связанные с повышенным разрушением эритроцитов.
- Гис-гемолитические анемии — при нарушении кровообразования, протекающего в красном костном мозге.
- Постгеморрагические анемии — при острой или хронической кровопотере.
- В12- и фолиеводефицитные анемии.
Мегалобластные анемии: миокардит гемолитический и пернициозная анемия.
Гипохромия — это общее название для разных форм анемии, при которых цветовой показатель крови, вследствие недостатка гемоглобина, меньше 0,8. Не включена в список нозологических единиц. В анализе крови средний показатель для гемоглобина при таком состоянии меньше 30 пикограмм, а средняя концентрация гемоглобина в эритроците составляет менее 330 г на литр. Меняется не только цвет, но и диаметр (макро- или микроцитоз) и форма. Чаще всего при такого рода патологии красной крови кровяные тельца приобретают вид колец с бледно-красной серединой и темно-красными краями (обесцвечиваются).
Патологические формы эритроцитов могут возникать вследствие:
- Железодефицитной анемии при кровопотерях (геморрагическая), нарушении усвоения железа, при невынашивании плода и т.д.
- Хронического отравления свинцом.
- Талассемии – нарушения нормального процесса синтеза полипептидных цепей в структуре гемоглобина.
- Нарушения синтеза и утилизации порфиринов.
- Гиповитаминоза В6.
- При нарушении обмена вещества, хронических воспалительных процессах неинфекционного и инфекционного генезиса.
Дизэритропоэтическая анемия – целая группа достаточно редко встречающихся заболеваний крови, которые возникают из-за нарушения процессов эритропоэза. При этом, большая часть молодых эритроцитов погибает сразу после образования в костном мозге, а количество нормоцитов значительно снижается. Такого рода расстройство предполагает качественный, количественный, кинетический или совмещенный характер нарушения эритропоэза.
Следует упомянуть такую разновидность заболевания — гиперхромная макроцитарная анемия или малокровие. При котором также наблюдают снижение числа эритроцитов и уровня гемоглобина в единичном объеме крови. Как правило, при такого рода нарушениях параллельно дают сбой сердце и сосуды.
По коду МКБ-10 — D62 острая постгеморрагическая анемия. Такой симптом возникает после кровопотери. Подразделяют на острую постгеморрагическую анемию и хроническую постгеморрагическую анемию. Острая анемия развивается после острых и обильных кровотечений, хронические анемии возникают после длительных несильных кровотечений.
Во время быстрой кровопотери значительно снижается объем циркулирующей крови. В ответ на такое событие происходит компенсаторная реакция, которая заключается в возбуждении симпатического отдела нервной системы и рефлекторного спазма сосудов. Пульс ускоряется и ослабевает. Сосуды кожи и мышц максимально сужаются, кровь приливает к сосудам мозга, коронарным сосудам, что поддерживает снабжение кровью жизненно важных органов. При прогрессировании процесса начинает развиваться постгеморрагический шок.
Характерным клиническим симптомом постгеморрагической анемии является острая сосудистая недостаточность из-за гиповолемии (опустошение сосудистого русла). Внешне это проявляется ортостатическим коллапсом, одышкой, учащенным сердцебиением. В первые минуты кровопотери уровень гемоглобина может даже быть высоким, но после поступления тканевой жидкости в русло сосудов данный показатель снижается, даже если кровотечение уже прекратилось. Цветовой показатель остается в норме, одновременно происходит утрата эритроцитов и железа, нормохромная анемия. Ко вторым суткам увеличивается число ретикулоцитов, максимальных показателей достигает на 4-7 день (гиперрегенераторная анемия).
Диагноз ставят на основании клинических признаков и лабораторных показателей, повышения уровня остаточного азота, если кровотечение происходила в верхних отделах ЖКТ. Самое важное при такой нормохромной анемии – это устранить саму кровопотерю, восполнить устраненный объем крови эритроцитарной массой и гепарином (до 60% утраченной крови), кровезаменителями (5% р-р Альбумина, Раствор Рингера, Реополиглюкин).
При постановке диагноза постгеморрагическая анемия необходимо учитывать сведения о произошедшей острой кровопотере при наличии внешнего кровотечения. После массивного внутреннего диагноз основывают на клинических признаках и, в обязательном порядке, лабораторных пробах (Вебера, Грегерсена). Основанием для постановки диагноза также послужит рост уровня остаточного азота при кровотечении из верхнего отдела пищеварительного тракта.
После того, как кризис и острый период миновали, пациенту назначают препараты железа, витамины группы В, Е и С. Такая терапия производится в течение 6 месяцев. При утрате более 50% от объема циркулирующей крови — прогноз неблагоприятный.
Состояние может развиться в результате снижения поступления в организм фолиевой кислоты или нарушения процессов ее всасывания в пищеварительном тракте. Лечение заключается в дополнительном приеме недостающего вещества.
В отличии от патологии, ассоциированной с недостатком В12, фолиеводефицитная анемия диагностируется значительно реже.
Одной из основных причин фолиеводефицитной анемии является недостаточное содержание фолиевой к-ты в рационе. Следует помнить, что нужно включать в свое ежедневное меню больше зелени и печени. Также на здоровье значительно влияет алкогольная интоксикация, беременность, злокачественные новообразования, некоторые дерматиты, гемолиз.
Такого вида заболевания возникает при нарушении всасывания (например, при целиакии), под действием лекарственных средств, Метотрексата, Триамтерена, противосудорожных средств, барбитуратов, Метформина и др. Значительно повышается нужна организма в фолиевой кислоте после гемодиализа и при болезнях печени.
Также на здоровье оказывает влияние дефицит цианокобаламина и его кофермента – метилкобаламина. В таких условиях не происходит трансформации фолиевой кислоты в коферментную форму. В результате нарушается процесс нормального клеточного деления, начинают страдать клетки кроветворной ткани, которые ранее активно размножались. Тормозятся процессы созревания и размножения эритроцитов, сокращается их продолжительность жизни. Изменения касаются и лейкоцитов, возникает лейкопения и тромбоцитопения.
Далее в результате неправильного митоза появляются гигантские клетки эпителия пищевого канала и развиваются воспалительные процессы в слизистой оболочке, стоматиты, гастриты, эзофагиты, энтерит. Еще больше усугубляется первичное нарушения секреции и процесс всасывания внутреннего фактора, усиливается дефицит витаминов. Возникает порочный круг.
Из-за возникшего недостатка цианокобаламина, в организме начинают накапливаться продукты обмена, которые токсичны для нервных клеток. В волокнах тем временам начинают синтезироваться жирные кислоты уже с искаженной структурой. Наблюдается плавное изменение качества клеток спинного мозга и поражаются периферические и черепные нервные сплетения, развивается неврологическая симптоматика.
При таком виде анемии, как правило симптомы у пациента наблюдаются стандартные: высокая утомляемость, учащенное сердцебиение, бледность ногтей и губ, ярко-красный язык. На начальных стадиях отследить признаки поражения НС и ЖКТ практически невозможно. По результатам обследования выявляется гиперхромная макроцитарная анемия, лейкопения, тромбоцитопения. А лечение с помощью витамина В12 не вызывает улучшений лабораторных показателей. Диагноз можно подтвердить с помощью определения уровня сывороточной фолиевой к-ты и в эритроцитах. В норме ее содержание составляет от 100 до 450 нг/л. При фолиеводефицитной анемии концентрация фолиевой кислоты в эритроцитах значительно снижается.
Если проводят анализ периферической картины крови, то отмечают гиперхромную (макроцитарную) анемию при общем снижении уровня гемоглобина и эритроцитов. Непрямой билирубин меняется редко.
В качестве профилактики и для лечения фолиеводефицитной анемии должны назначить фолиевую кислоту в дозе 1 мг/сут, внутрь. Если есть необходимость врач может увеличить дозу. Улучшения должны наступать через в течение 3-4 суток, в том числе проходить должны и неврологические симптомы. В противном случае приходится говорить о недостатке именно витамина В12, а не фолиевой к-ты.
Обязательно проводить профилактику недостатка фолиевой к-ты у беременных женщин и пациентов, принимающих некоторые группы лек. препаратов. Для профилактики назначают 5 мг вещества в сутки.
Относится к виду витаминодефицитных (мегалобластных) анемий, которые возникают при недостаточном поступлении в организм витамина В12 (цианокобаламина). В результате В12-дефицитной анемии поражается кроветворная функция, нервная и пищеварительная система. В отличие от фолиеводефицитной В12-анемии, она развивается в преклонном или старческом возрасте, чаще всего у мужской половины. Проявляется заболевание постепенно.
Человек, страдающий В12-дефицитной анемией, будет испытывать общие симптомы: слабость, пониженная работоспособность, одышка, головокружение, жжение за грудиной, боли в ногах и языке, парестезии, шаткость походки. Такие симптомы будут сочетаться с желтушным цветом кожи, глосситом, незначительным увеличением печени и селезенки, негромким систолическим шумом, глухостью тонов сердца. Нередко поражается и нервная система, развивается комбинированный склероз или фуникулярный миелоз, нарушается чувствительность, полиневрит, атрофия мышц, паралич нижних конечностей.
Развивается анемия из-за недостатка витамина В12, из-за несбалансированности питания, голодания, алкоголизма и отсутствия аппетита. Также синдром может наблюдаться на фоне мальабсорбции, целиакии, изменений в слизистой оболочке кишечника, спру, лимфомы кишечника, болезни Крона, регионарного илеита, из-за длительного приема противосудорожных препаратов.
Вероятность развития В12-дефицитной анемии будет выше при беременности, гемолитической анемии, псориазе, эксфолиативном дерматите. При приеме алкоголя, препаратов–антагонистов фолатов, врождённых нарушениях метаболизма и атрофическом гастрите также может наблюдаться это заболевание.
Как правило, поставить диагноз В12-дефицитная анемия можно без особых проблем. Это может сделать гематолог, невролог, нефролог или гастроэнтеролог по результатам общего и биохимического анализа крови, наличию метилмалоновой кислоты. Также проводят УЗИ брюшной полости и исследование всасывания витамина В12 с помощью радиоизотопов. По показаниям можно провести аспирационную биопсию костного мозга.
Лечение проводят витамином В12 внутримышечно. В течение 1-1,5 месяцев используют поддерживающую дозу. Если уровень гемоглобина упал менее 60 г на л, при нарушении гемодинамики и угрозе анемической комы проводят трансфузии эритроцитов.
В качестве профилактики при заболеваниях, сопровождающихся нарушением всасывания витамина В12, а также после операций нужно под контролем содержания витамина В12 в моче и крови применять профилактические и лечебные курсы витаминотерапии.
Что это такое простыми словами? Это процесс ускоренного разрушения красных кровяных телец, он сопровождается значительным ростом уровня прямого билирубина в крови. Заболевание встречается достаточно редко.
Общим признаком можно считать ускоренное разрушение эритроцитов, сопровождающееся с одной стороны анемией и повышенным образованием продуктов распада эритроцитов, а с другой – реактивно усиленным эритропоэзом.
Аутоиммунная гемолитическая анемия, как правило вызвана генетическими дефектами мембран эритроцитов, что вызывает их повышенное разрушение. Аутоиммунное заболевание и гемолиз эритроцитов при приобретенных анемиях наступает под действием внутренних факторов или каких-либо факторов окружающей среды.
На развитие иммунных гемолитических анемий влияют посттрансфузионные реакции, вакцинации, прием некоторых препаратов (сульфаниламидов, анальгетиков, противомалярийных лекарств, производных нитрофуранового ряда). Также такой симптом может проявляться при гемобластозах, аутоиммунных патологиях (НЯК, СКВ), инфекционных болезнях (мононуклеоз, вирусная пневмония, сифилис, токсоплазмоз).
Гемолитические анемии можно поделить на два обширные группы заболеваний: приобретенные и врожденные.
Формы наследственных заболеваний:
- Эритроцитарные мембранопатии, такие как анемия Минковского-Шоффара или болезнь Минковского-Шоффара (микросфероцитоз), акантоцитоз, овалоцитоз, вызванные аномалиями в структуре мембран эритроцитов. Отметим, что сфероцитоз – самый распространенный вид среди патологий (микросфероцитоз).
- Энзимопении, вызванные дефицитом некоторых ферментов (пируваткиназа, глюкозо-6-фосфатдегидрогеназа).
- Гемоглобинопатии, возникшие из-за качественных нарушений структуры гемоглобина или изменения соотношения его нормальных форм.
Приобретенные гемолитические анемии делят на:
- Приобретенные мембранопатии (шпороклеточная анемия, болезнь Маркиафавы-Микели).
- Изо- и аутоиммунные, вызванные действием антител.
- Токсические, возникшие вследствие воздействия ядов, токсинов или других хим. агентов.
- Анемии, ассоциированные с механическими повреждениями в структуре эритроцитов.
Рост концентрации остаточных следов после распада эритроцитов в организме внешне будет проявляться желтухой лимонного оттенка. Также будет наблюдаться повышение концентрации в крови непрямого билирубина и железа. Отмечается уробилинурия и плейохромия кала и желчи. При внутрисосудистом гемолизе дополнительно развивается гипергемоглобинемия, гемоглобинурия, гемосидеринурия. Об усилении эритропоэза говорит ретикулоцитоз и полихроматофилия в составе периферической крови, либо эритронормобластоз костного мозга.
Если у пациента не микросфероцитарная анемия, обусловленная наследственным сфероцитозом или эллиптоцитозом, то необходимо, прежде всего проводить адекватную терапию заболевания, вызвавшего причину гемолитической анемии.
Для лечения обычно применяют:
- медикаменты (например, Десферал);
- спленэктомию;
- трансфузию эритроцитов при кризе;
- ГСК при аутоимунных заболеваниях в средней дозировке.
Апластическая анемия — заболевание, которое относят к категории миелодисплазий. При таком заболевании происходит резкое угнетение или прекращение роста и созревания клеток в костном мозге, еще называемое панмиелофтизом.
Типичными симптомами болезни являются: лейкопения, анемия, лимфопения и тромбоцитопения. Сам термин впервые появился в начале 20 века. Такое заболевание имеет достаточно тяжелое течение и без лечения (в том числе медикаментозного препаратом Атгам) имеет неблагоприятный прогноз.
Очень долго эту болезнь рассматривали в качестве синдрома, объединяющего различные патологические состояния в костном мозгу. В настоящее время термин «апластическая анемия» выделяется в качестве самостоятельной нозологической единицы. Его следует четко разграничивать от синдрома гипоплазии в кроветворной системе.
Апластическая анемия может быть вызвана различными причинами:
- химическими агентами, бензолом, солями тяжелых металлов и так далее;
- ионизирующим излучением;
- приемом некоторых лекарств, цитостатиков, НПВС, Анальгина, Мерказолила, Левомицетина;
- вирусами;
- наличием других аутоиммунных заболеваний.
Также существует форма апластической анемии, передающейся по наследству — анемия Фанкони. Лечение болезни заключается в приеме иммунодепрессантов и проведении пересадки костного мозга.
При серповидно-клеточной анемии человека происходит нарушение строения белка гемоглобина, он приобретает нетипичное кристаллическое строение, в виде серпа. Такую форму называют S-гемоглобином. Заболевание связывают с мутацией НВВ-гена, из-за которой в костном мозге начинает синтезироваться аномальный вид S-гемоглобина, в шестом положении в В-цепи вместо глутаминовой кислоты находится валин. Происходит полимеризация S-гемоглобина, образуются длинные тяжи, эритроциты приобретают форму серпа.
Тип наследования серповидноклеточной анемии – аутосомно-рецессивный при неполном доминировании. У гетерозиготных носителей в эритроцитах находится примерно равное количество гемоглобина А и S. Носители сами не болеют, а выявить серповидные эритроциты можно случайно при проведении лабораторного обследования. Симптомы же могут и вовсе не проявляться. Иногда такие люди начинают ощущать недомогание при гипоксии или тяжелом обезвоживании.
У гомозигот в крови есть только гемоглобин S, заболевание протекает достаточно тяжело. У таких больных высокий уровень степени разрушенных эритроцитов в селезенке, значительно короче срок жизни, часто проявляются признаки хронической недостаточности кислорода.
Такой вид анемии достаточно распространен в регионах, где высокий уровень заболеваемости малярией. У таких больных выше устойчивость к разным штаммам малярийного плазмодия. Поэтому столь вредные аллели часто проявляются у жителей Африки.
Симптомы сильно различаются и их можно наблюдать у детей уже с 3-х месячного возраста. Анемия может приводить к потере сознания, меньшей выносливости, вызвать желтуху. У младенцев наблюдается худоба, слабость, искривление конечностей, удлиненность туловища, изменения в строение черепа и зубов. Также у больных детей повышенная склонность к развитию сепсиса. У подростков наблюдают задержку развития на 2-3 года. Женщины, как правило, способны к зачатию и рождению ребенка.
Мегалобластная анемия (болезнь Аддисона-Бирмера, В12-дефицитная, пернициозная) — заболевание, вызванное недостатком фолиевой кислоты или витамина В12. Происходит это из-за недостатка веществ в пище или при заболеваниях пищеварительного тракта. Также мегалобластическая анемия может возникнуть при врожденных нарушениях процессов синтеза ДНК, приобретенных патологиях и из-за приема некоторых лекарств (антиметаболитов, противосудорожных).
При постоянном недостатке фолиевой кислоты и В12 развивается хроническая анемия, эритроциты изменяют свою форму и размеры. Более легкие стадии иногда протекают бессимптомно, далее начинают уже проявляться внешние признаки. Такое дефицитное состояние часто также называют пернициозной анемией. Заболевание получило статус анемии хронических заболеваний, так как проявляется у пациентов после 60 лет и у перенесших гепатит больных, при энтерите и раке кишечника. Подробнее о такого рода анемиях описано выше.
Развивается вследствие эндогенного В12-авитаминоза, вызванного атрофией желез фундального отдела желудка, которые в норме должны вырабатывать гастромукопротеин. В результате нарушаются процессы всасывания витамина В12 и возникает злокачественная анемия «пернициозного» типа. Чаще всего такой диагноз ставят в возрасте от 50 лет.
Болезнь сопровождается нарушениями нервной, сердечно-сосудистой, кроветворной и пищеварительной системы. Больные обычно жалуются на одышку, общую слабость, отечность ног, боли в сердце, «мурашки» по стопам и кистям, жгучие боли в языке и шаткость походки. По лабораторным показателям наблюдают анемию гиперхромного типа, лейкопению, тромбоцитопению.
Сидеробластная анемия также имеет название сидероахрестическая анемия (САА), железорефрактерная, железонасыщенная или сидеробластическая. Это патологическое состояние нарушений процесса синтеза микроэлементов и кроветворения, чаще всего – железа. Эритроциты содержат малое количество железа, из-за того, что микроэлемент активно расходуется костным мозгом и начинает накапливаться во внутренних органах. Заболевание развивается на фоне недостаточного содержания протопорфирина.
Выделяют две формы болезни:
- пиридоксин-зависимую, возникающую вследствие дефицита пиридоксальфосфата;
- пиридоксин-резистентную, развивающуюся из-за ферментного дефекта (дефицита гемсинтетазы).
Приобретенные формы сидероахрестической анемии чаще наблюдаются в пожилом возрасте, но болезнь не наследуется от родителей. Часто такого рода анемия развивается, как побочный эффект от лечения препаратами от туберкулеза или истощении пиридоксальфосфата при отравлении свинцом, при алкоголизме, миелопролиферативных болезнях крови, кожной порфирии. Встречаются и идиопатические формы САА.
Это редкое, передающееся по наследству заболевание. Анемия Фанкони встречается у 1 из 350000 детей. Наибольшее распространение заболевание получила среди евреев-ашкеназов и жителей Южной Африки.
Возникает из-за наличия дефектов в белковых кластерах, отвечающих за процесс репарации ДНК. Для заболевания характерная высокая ломкость у хромосом, наличие у пациентов старше 40 лет миелоидного лейкоза и апластической анемии.
Для новорожденных с таким недугом характерны врожденные дефекты развития, необычная пигментация, низкорослость, аномалии развития скелета и некоторые неврологические симптомы (косоглазие или недоразвитость одного из глаз, глухота, умственная отсталость), аномалии развития внутренних органов. К сожалению, в среднем такие пациенты живут не более 30 лет.
У диагноза неуточненная анемия код по МКБ-10 D64.9. Это первичный диагноз, который уточняется после проведения обследования у врача, так как он является вторичным признаком какого-либо основного заболеваний. Прежде всего следует исключить возможность кровопотери вследствие травм, хирургических вмешательств, внутренних кровотечений, далее проводится лабораторная диагностика.
По международной классификации МКБ-10 для миелодиспластического синдрома:
- D46.0 Рефрактерная анемия без сидеробластов, так обозначенная;
- D46.1 Рефрактерная анемия с сидеробластами;
- D46.2 Рефрактерная анемия с избытком бластов;
- D46.3 Рефрактерная анемия с избытком бластов с трансформацией;
- D46.4 Рефрактерная анемия неуточненная;
- D46.7 Другие миелодиспластические синдромы;
- D46.9 Миелодиспластический синдром неуточненный.
Приставка «рефрактерная» означает устойчивость заболевания к приему витаминов, препаратов железа, соблюдению диеты. Чаще всего такого вида анемия является наиболее распространенным видом миелодиспластического синдрома. Из-за нарушений процессов созревания бластов в крови значительно понижено содержание гемоглобина, проявляются признаки острого лейкоза. Примерно у 40% пациентов с миелодиспластическим синдромом проявляется рефрактерная анемия. Чаще всего гемоглобинопатия такого рода развивается у пациентов от 50 лет.
Заболевание можно считать промежуточным этапом между рефрактерной анемией и острым лейкозом. Как правило, болезнь проявляется снижением уровня гемоглобина и общей слабостью. Если у больного не нашли других причин для таких изменений картины крови, то основной задачей врачей становится дообследовать пациента и максимально затормозить наступление острого лейкоза.
Что за болезнь талассемия? Это наследуемое по рецессивному типу заболевание, развивающееся из-за снижения синтеза полипептидных цепей в структуре гемоглобина. В зависимости от того, какой мономер перестал нормально синтезироваться различают альфа-, бета-талассемию и дельта-талассемию. Также болезнь классифицируют по степени клинических проявлений, разделяют на тяжелую, легкую и среднюю.
Альфа-талассемия ассоциирована мутациями в генах HBA2 и HBA1. Альфа-цепь кодируется четырьмя локусами и, в зависимости от количества аномальных – различают разные степени тяжести заболевания. Симптомы и течение гемоглобинопатии варьируют от легкой до тяжелой степени гипохромной микроцитарной анемии.
Бета-талассемия существует в двух наиболее распространенных вариантах: малая (minor) и CD8(-AA) – большая (наиболее тяжелая форма заболевания). Анемия развивается из-за мутаций обоих аллелей бета-глобина, когда гемоглобин А начинает вытесняться гемоглобином F. Обычно малая талассемия имеет легкое течение и лечение не требуется.
Согласно Википедии, анемия Даймонда-Блекфена представляет собой наследственную форму красноклеточной аплазии с точно не выявленным типом наследования. Предполагают, что заболевание имеет аутосомно-доминантный тип наследования, который встречается у одной четвертой всех больных. У таких больных обычно проявляются проявления анемии в течение первого года жизни, слабость, бледность, повышенная утомляемость, снижение количества эритроцитов в плазме крови.
Диагноз ставят по общему анализу крови, показателям уровня эритропоэтинов, микроскопии и биопсии костного мозга. Лечению болезнь поддается плохо, назначают ГКС, гемотрансфузии.
Повышение концентрации свободного гемоглобина в плазме крови называют гемоглобинемией. Заболевание возникает вследствие приобретенных и врожденных заболеваний эритроцитов, при повышенном их разрушении. Симптом может проявиться после неправильно проведенного переливания крови, из-за воздействия паразитарных и инфекционных факторов (сепсиса, вирусной инфекции, малярии), после сильного переохлаждения, отравления ядами, бензином, уксусной кислотой, грибами. Проявляется внешне это гиперемией кожных покровов и слизистой, повышением концентрации гемоглобина и билирубина в крови.
Существуют настолько разные причины заболевания, что выявить некоторые из них можно только после проведения лабораторных исследований. Часто бывает, что показатели гемоглобина в норме, а железо низкое. Недуг может наблюдаться при недостатке витаминов группы В, фолиевой к-ты. Малокровие у человека возникает вследствие различных травм и обильных внутренних или внешних кровотечений.
Такой диагнозе женщине могут поставить, если уровень гемоглобина в крови падает ниже 120 г на литр. В целом у женщин, из-за некоторых физиологических особенностей выше склонность к данному недугу. Ежемесячные кровопотери во время менструации, когда в течение недели женщина может потерять до 100 мл крови, беременность, лактация и снижение концентрации ферритина – самые распространенные причины анемии. Часто заболевание развивается из-за психосоматики, когда у женщины депрессивное состояние, она плохо питается, редко выходят на свежий воздух, не занимается спортом или во время климакса, когда происходят глобальные изменения в физиологии женщины.
У мужской половины данный диагноз ставится, если уровень гемоглобина снизился менее 130 г на л. По статистике заболевание возникает реже. Чаще всего из-за каких-то хронических заболеваний, нарушений работы органов и их систем (язвенная болезнь, геморрой, эрозии в кишечнике, доброкачественные и злокачественные новообразования, паразиты, апластическая анемия). Существуют и генетические причины (анемия Фанкони) заболевания, которые не связаны с полом.
Малокровие проявляется по-разному, в зависимости от конкретного вида заболевания. Известно, что при малокровии у человека уменьшается количество эритроцитов, изменяется их строение, содержание железа в крови, падает гемоглобин. Ткани человека испытывают недостаток кислорода и это оказывает влияние на общее состояние и внешний вид человека.
Общие признаки анемии, следующие:
- значительно сниженная работоспособность, общая слабость;
- раздражительность, повышенная утомляемость, сильная сонливость;
- шум в ушах и головные боли, «мушки» перед глазами, головокружения;
- дизурия;
- непреодолимое желание полакомится мелом или известью;
- постоянная одышка;
- тонкие и ломкие волосы, ногти, сухая, неэластичная кожа;
- стенокардия, низкое артериальное давление;
- шум в ушах и частые обмороки;
- изменение цвета стула, желтуха, бледность;
- ломота в теле и суставах, мышечная слабость.
Также существуют специфические симптомы малокровия, характерные для той или ной разновидности:
- Железодефицитная анемия. Для данного диагноза характерная парорексия, у пациента появляется сильное желание жевать мел, землю, бумаги и прочие несъедобные материалы. Можно также выделить койлонихию, трещинки в уголках рта, заеды, воспаленный язык. Иногда может повыситься температура до субфебрильной.
- Основным симптомом В12-дефицитной анемии можно назвать покалывание в конечностях, нестойкость походки, скованность и стесненность в движениях, низкое чувство осязания. У пациента снижаются когнитивные способности, могут возникать галлюцинации. В крайне тяжелых случаях может развиться паранойя или шизофрения.
- Характерным симптомом серповидноклеточной анемии может быть слабость, приступообразные боли в брюшной полости и суставах.
- При отравлении свинцовыми отходами у пострадавшего наблюдаются характерные темно-синие линии на деснах, тошнота и болезненные ощущения в области живота.
- Хроническое разрушение эритроцитов может быть симптомом злокачественной опухоли. В таком состоянии развивается проступающая желтуха, язвы и ссадины на ногах, покраснение мочи. Часто образуются камни в желчном пузыре.
Поставить точный диагноз гемолитическая, мегалобластная или апластическая анемия можно после проведения дифференциальной диагностики. Диф. диагностика проводится по соответствующим таблицам и результатам лабораторных исследований.
источник