*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
На основании данных современной литературы и анализа собственных клинических наблюдений освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы верификации причин анемического синдрома, обусловленного недостаточностью в организме ребенка железа, фолиевой кислоты и витамина В12. Изложены ключевые положения, лежащие в основе дифференциального диагноза между железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемиями. Представлены принципы лечения указанных дефицитных анемий у детей. Выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. При этом своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка в целом. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма, ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения по дифференциальной диагностике и лечению анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Ключевые слова: анемия, витамин В12-дефицитная анемия, дети, железодефицитная анемия, фолиеводефицитная анемия.
Для цитирования: Заплатников А.Л., Османов И.М., Ефимов М.С., Дементьев А.А., Чабаидзе Ж.Л., Майкова И.Д., О.А. Кузнецова, А.С. Воробьева, Е.Р. Радченко, Гончарова Л.В., Гавеля Н.В. Диагностика и принципы лечения дефицитных анемий у детей (в таблицах и схемах) // РМЖ. Медицинское обозрение. 2019. №3. С. 2-5
Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams)
A.L. Zaplatnikov 1,2 , I.M. Osmanov 2 , M.S. Efimov 1 , A.A. Dementiev1, Zh.L. Chabaidze 1 , I.D. Maikova 2 , O.A. Kuznetsova 2 , A.S. Vorobieva 2 , E.R. Radchenko 2 , L.V. Goncharova 2 , N.V. Gavelia 2
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Z.A. Bashlyaeva Children’s City Clinical Hospital, Moscow
The article highlights the clinical, anamnestic and laboratory properties of iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia in children, based on the data of modern literature and in-house clinical observation analysis. The basic verification principles of the anemic syndrome causes associated with iron, folic acid and vitamin B12 deficiency in children are presented. The fundamental provisions underlying the differential diagnosis between iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia are also reviewed. In addition, the article describes the treatment principles in children with nutritional deficiency anemia. Anemia manifestation in a child determines the need for mandatory cause clarification of this pathological condition. At the same time, timely verification of the anemia etiology allows starting adequate therapy without delay, which determines its effectiveness and improves the child’s life quality as a whole. Late diagnosis and lack of adequate therapy, however, lead to the pathological processes progression. This has a negative impact on the child’s body growth and development and worsens his life quality in general. The authors came to the conclusion that it is necessary to present fundamental provisions for practicing pediatricians on anemia differential diagnosis and treatment associated with iron, folic acid and vitamin B12 deficiency in children, taking into account this problem urgency.
Keywords: anemia, vitamin B12-deficiency anemia, children, iron-deficiency anemia, folic acid- deficiency anemia.
For citation: Zaplatnikov A.L., Osmanov I.M., Efimov M.S. et al. Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams). RMJ. Medical Review. 2019;3:6–9.
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
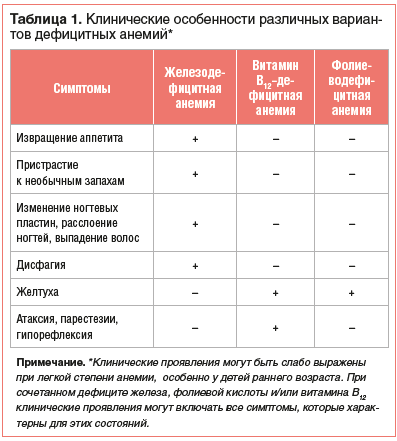
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
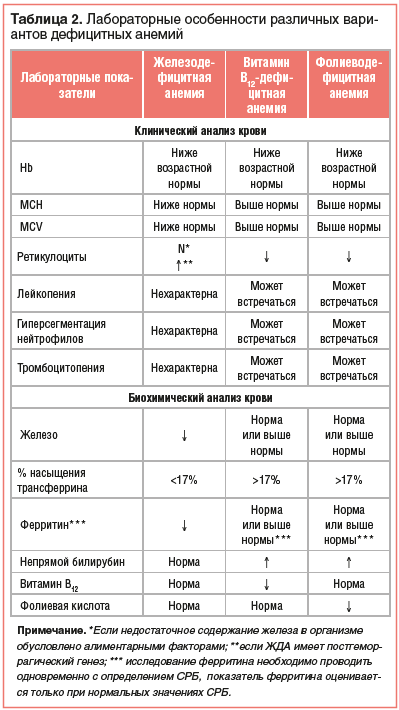
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Только для зарегистрированных пользователей
источник
Анемия – состояние, при котором снижается общее количество гемоглобина в организме. Снижение концентрации гемоглобина в крови является ключевым показателем, поскольку может быть измерено напрямую.
В этиологии фолиеводефицитной анемии играют роль следующие факторы:
Недостаточное поступление с питанием (вскармливание козьим молоком);
Нарушение всасывания в кишечнике (энтерит);
Повышенная потребность (недоношеность; малый вес при рождении; гемолитическая анемия, гипертиреоз, инфекционно-воспалительные заболевания);
Использование медикаментов – антагонистов фолиевой кислоты (препараты для лечения эпилепсии, метотрексат);
Повышенное выведение (гемодиализ).
Изолированный дефицит фолиевой кислоты встречается редко, как правило, он сочетается с дефицитом железа, белка, других витаминов.
Фолиевая кислота содержится в зеленых листьях растений, фруктах, печени, почках. Запасы фолатов в организме взрослого человека составляют 5-10 мг, минимальная потребность — 50 мкг в день. Мегалобластная анемия может развиться через 4 месяца полного отсутствия поступления фолатов с пищей.
После попадания в организм фолиевая кислота превращается в активный метаболит тетрагидрофолиевую кислоту, которая играет важнейшую роль в метаболизме нуклеиновых кислот и протеинов. Дефицит фолиевой кислоты приводит к нарушению клеточного деления и накоплению токсичных метаболитов, таких как гомоцистеин [1,2].
Данных о распространенности дефицита фолиевой кислоты и фолиеводефицитной анемии у детей в России нет.
Фолиеводефицитная анемия (D52):
D52.0 — Фолиеводефицитная анемия, связанная с питанием
D52.1 — Фолиеводефицитная анемия медикаментозная
D52.8 — Другие фолиеводефицитные анемии
D52.9 — Фолиеводефицитная анемия неуточненная
Клиническая картина складывается из симптомов, характерных для анемии: слабости, головокружения, одышки сердцебиения при физической нагрузке, повышенной утомляемости, нарушения успеваемости в школе. Общие признаки, являющиеся следствием гипоксии тканей: бледность, тахикардия, одышка, плохой аппетит, вялость или повышенная возбудимость. Кроме того могут наблюдаться ангулярный стоматит, глоссит. Пациенты могут жаловаться на анорексию, тошноту, рвоту, боли в животе и диарею.
Фолиеводефицитная анемия крайне редко наблюдается в чистом виде. Как правило, дефицит фолиевой кислоты сочетается с дефицитом железа, так как эти состояния развиваются вследствие действия единых этиопатогенетических факторов. При этом и клинические проявления и лабораторные характеристики анемии зависят от соотношения выраженности дефицита железа и фолата. Учитывая, что при ЖДА и при фолиеводефицитной анемии наблюдаются разнонаправленные сдвиги в показателях обмена железа и эритроцитарных индексах, лабораторные тесты при смешанной форме анемии становятся малоинформативными. В данной ситуации решающее значение имеет анамнез и клиника анемии.
Дифференциальный диагноз проводят с витамин В12 дефицитной анемией, другими формами анемии с мегалобластоидным типом кроветворения: врожденной оротатацидурией, синдром Леша-Найена (Lesch-Nyhan), тиамин-зависимой мегалобластной анемией, врожденной дизэритропоэтической анемией, эритролейкемией. Кроме того, необходимо исключить формы анемии, протекающие с макроцитозом, но без признаков мегалобластоидности – апластическую анемию, аутоиммунную гемолитическую анемию, заболевания печени, гипотиреоз, сидеробластные анемии.
Необходимо оценить размеры лимфатических узлов, печени, селезенки, исключить наличие образований в брюшной полости, забрюшинном пространстве, другие признаки злокачественных заболеваний. [1,2]
Необходимо отметить, что при сочетанном дефиците назначение фолиевой кислоты без препаратов железа приведет к неполному восстановлению гемоглобина и к проявлению клинических и лабораторных признаков дефицита железа. И наоборот, если начать лечение с препаратов железа, проявятся признаки дефицита фолиевой кислоты.
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела. Выявляется бледность кожных покровов, слизистых, при тяжелой анемии присутствует учащенное сердцебиение, одышка.
Поскольку при фолиеводефицитной анемии в костном мозге происходит неэффективный эритропоэз и за счет этого повышенное разрушение гемоглобинсодержащих клеток, в крови повышается уровень непрямого билирубина и появляется легкая желтушнось склер и кожи. При тяжелых формах может наблюдаться небольшое увеличение селезенки (реактивная гиперплазия). Таким образом, имеется некоторое сходство симптоматики фолиеводефицитной анемии и гемолитической анемии. Лабораторное обследование позволяет провести надежную дифференциальную диагностику этих форм анемии.
По лабораторным признакам фолиеводефицитная анемия почти совпадает с В12-дефицитной анемией. Различия заключаются в разном уровне витамина В12 и фолиевой кислоты в крови. Кроме того, для фолиеводефицитной анемии в отличие от В12-дефицитной анемии, не характерны признаки поражения нервной системы. Следует помнить, что изолированный дефицит витамина В12 в детском возрасте встречается редко и является обычно осложнением глистной инвазии широким лентецом или наследственных нарушений обмена, а также результатом воздействия некоторых медикаментов [1,2, 3].
- Рекомендовано проведение общего клинического анализа крови и биохимического анализа крови.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии:
Для фолиеводефицитной анемии характерны:
низкий уровень ретикулоцитов;
высокий уровень сывороточного железа;
высокий уровень ферритина;
умеренное повышение непрямого билирубина;
низкий уровень фолата в сыворотке крови (норма более 3 нг/мл);
низкий уровень фолата в эритроцитах;
нормальный уровень витамина В12 в крови;
картина мегалобластического кроветворения в костном мозге.
При сочетании дефицита железа и фолиевой кислоты могут наблюдаться сочетания лабораторных признаков, что приводит к неопределенной картине и затруднению диагностики; в этом случае надо ориентироваться на клинические симптомы и анамнез.
Высокий ретикулоцитоз может являться признаком продолжающегося кровотечения, гемолиза, а также наблюдается при фолиеводефицитной анемии через неделю после назначения фолиевой кислоты.
Наряду с анемией, как правило, отмечается умеренное снижение уровня тромбоцитов и лейкоцитов.
Необходимо исследование мочи для исключения протеинурии, характерной для синдрома Иммерслунд-Грэссбек [4]. Для исключения врожденного отсутствия внутреннего фактора проводится тест Шиллинга с радиоактивным меченным витамином В12. Учитывая недоступность меченного витамина В12 в общей лабораторной практике можно использовать модифицированный тест Шиллинга: после приема внутрь витамина В12 определяется уровень витамина в крови. При отсутствии повышения уровня витамина В12 диагностируется нарушение всасывания витамина в кишечнике.
При наличии двух- или трехростковой цитопении необходимо рассмотреть необходимость исследования костного мозга для исключения лейкемии, миелодиспластического синдрома, апластической анемии.
Характерные признаки мегалобластического кроветворения в костном мозге исчезают через несколько часов после приема фолиевой кислоты.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии: Детям первого года жизни фолиевая кислота назначается в дозе 0,25-0,5 мг/кг в сутки в течение месяца. В более старшем возрасте суточная доза составляет 1 мг/сутки. Пероральный прием эффективен даже в случае мальабсорбции, однако в этом случае дозу следует увеличить до 5-15 мг/сутки.
- Рекомендовано в процессе лечения проводить контроль показателей крови:
Общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, гематокрита — на 7 — 10 день от начала лечения. Наличие ретикулоцитарной реакции является важным признаком правильности лечения.
Контроль показателей крови 1 раз в неделю. Нормализация уровня Hb происходит через 4 — 6 недель от начала лечения и является решающим подтверждением правильности диагноза и лечения [1,2,5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2с)
Специфических реабилитационных мероприятий в отношении пациентов с фолиеводефицитной анемией нет. Диспансерное наблюдение проводится с учетом устранения причин дефицита фолиевой кислоты (основного заболевания, неправильного питания).
Правильное вскармливание грудных детей, назначение фолиевой кислоты недоношенным детям. Рациональное питание детей старшего возраста. Необходимо учитывать возможность развития дефицита фолиевой кислоты при различных заболеваниях. Фолиевая кислота в дозе 0,25 — 1 мг/сутки назначается недоношенным детям, детям с низкой массой тела при рождении, детям, страдающим хроническими воспалительными заболеваниями, заболеваниями кишечника с синдромом мальабсорбции.
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнен общий клинический анализ крови с подсчетом ретикулоцитов и тромбоцитов
источник
Гемолитическая анемия — это группа расстройств, при которых эритроциты разрушаются быстрее, чем костный мозг успевает их продуцировать. Термин для разрушения эритроцитов — гемолиз.
Анемия — состояние, при котором снижается общее количество гемоглобина в организме. Снижение концентрации гемоглобина в крови является ключевым показателем, поскольку может быть измерено напрямую.
| МКБ-10 | |
| Код | Название |
| D55-59 | Гемолитическая анемия |
Аутоиммунная гемолитическая анемия (АИГА) характеризуется преждевременным разрушением эритроцитов, вызванным аутоантителами, связывающими поверхностную мембрану эритроцитов, с последующим разрушением ретикулоэндотелиальной системой или механизмом, опосредованным комплементом. Это относительно редкое заболевание с предполагаемой частотой 1—3 случая на 100 000 населения в год, и нет никаких доказательств того.
Гемолитическая анемия может вызываться двумя видами причин:
| Внутренними — когда клетки крови разрушаются изнутри. Этот тип анемии часто наследуется. Он включает серповидноклеточную анемию, талассемию или эритроцитоз. Эти условия производят красные кровяные клетки, которые не живут так долго, как нормальные красные кровяные клетки. | Внешними — когда красные кровяные тельца разрушаются от внешних факторов. Это также называется аутоиммунной гемолитической анемией. |
Внешние причины гемолитической анемии
| Инфекции, бактерии или вирусы |
| Лекарства-антибиотики — пенициллин или сульфаниламиды, лекарства от малярии или ацетаминофен |
| Различные формы рака (лейкемия, лимфома или другие опухоли) |
| Аутоиммунные нарушения — системная красная волчанка (СКВ, или волчанка), ревматоидный артрит, синдром Вискотта — Олдрича или язвенный колитю |
| Гиперспленизм — состояние, при котором селезенка разрушает больше эритроцитов, чем обычно |
Некоторые виды внешней гемолитической анемии являются временными и проходят в течение нескольких месяцев. В других случаях заболевание может стать хроническим с периодами ремиссий и рецидивов.
Наиболее распространенные симптомы гемолитической анемии у детей следующие:
- бледная кожа;
- желтуха, или пожелтение кожи и глаз;
- моча темного цвета;
- лихорадка;
- слабость;
- головокружение;
- путаница;
- непереносимость физической активности;
- увеличение селезенки и печени;
- быстрое сердцебиение;
- шум в сердце.
Симптомы гемолитической анемии могут выглядеть как другие проблемы со здоровьем. Всегда консультируйтесь с доктором при диагностике состояния здоровья ребенка.
Лечащий врач вашего ребенка может заподозрить гемолитическую анемию исходя из данных в истории болезни вашего ребенка и физического осмотра.
В случае появления симптомов анемии у вашего ребенка необходимо пройти следующие тесты:
- Гемоглобин и гематокрит. Этот тест измеряет количество гемоглобина и эритроцитов в крови.
- Полный анализ крови (CBC). Этот тест проверяет эритроциты и лейкоциты, тромбоциты (тромбоциты), а иногда и молодые эритроциты (ретикулоциты). Он включает в себя гемоглобин и гематокрит и более подробную информацию об эритроцитах.
- Периферический мазок. Небольшой образец крови рассматривается под микроскопом. Клетки крови проверяют, выглядят ли они нормально или нет.
- Другие анализы крови. Эти тесты проверят на лактатдегидрогеназу, билирубин и гаптоглобин, которые могут вызывать продолжающийся гемолиз. Некоторые тесты могут найти антитела, которые вызывают гемолиз.
- Анализ мочи. Эти тесты могут проверить на гемоглобин из разрушающихся эритроцитов.
- Аспирацию костного мозга, биопсию или и то и другое. Небольшое количество жидкости костного мозга (аспирация), твердой ткани костного мозга (биопсия ядра), часто из тазобедренных костей, или оба проверяются на количество, размер и зрелость клеток крови. Этот тест может также искать аномальные клетки.
Лечение будет зависеть от симптомов вашего ребенка, его возраста и общего состояния здоровья, а также от того, насколько далеко зашла болезнь. Имеет значение и причина болезни.
Ребенка с гемолитической анемией часто лечит гематолог. Это эксперт по проблемам крови. Некоторые дети не нуждаются в лечении.
| Гемотрансфузии |
| Лекарства — кортикостероиды или стероиды |
| Внутривенный иммуноглобулин (ВВИГ) |
| Ритуксимаб — лекарство для контроля иммунной системы |
| Антибиотики для лечения инфекции, если это является основной причиной |
| Другие лекарства в зависимости от типа гемолитической анемии |
Некоторым детям могут быть также назначены:
- Спленэктомия. Это операция по удалению селезенки.
- Иммуносупрессивная терапия. Это использование других лекарств для контроля иммунной системы.
- Плазмаферез. Это удаление антител из крови, которые разрушают эритроциты.
- Трансплантация стволовых клеток. В тяжелых случаях аномальные клетки костного мозга заменяются донорским костным мозгом.
Осложнения зависят от причины гемолитической анемии и включают:
| Побочные эффекты лекарств, например повышенный риск заражения кортикостероидами |
| Желчные камни или камни в желчном пузыре |
| Тромбы и сгустки крови в легких (легочная эмболия) |
| Почечную недостаточность |
| Шок |
| Сердечную недостаточность |
Управление гемолитической анемией зависит от того, насколько серьезны симптомы. У детей с легкими симптомами регулярно берется кровь на анализ.
Лечение детей с более серьезными симптомами происходит гораздо сложнее. У них также часто берется кровь на анализ. У таких детей могут быть проблемы с повседневной деятельностью из-за их симптомов или применяемого метода лечения. Если ваш ребенок принимает лекарство, повышающее риск заражения, он должен держаться подальше от больных людей.
Обратитесь к лечащему врачу сразу, как только поведение вашего ребенка начало меняться. Например, ваш ребенок может быть не таким активным, как обычно. Также необходимо немедленно обратиться к врачу, если у вашего ребенка наблюдается изменение цвета мочи и кожи.
Ключевые моменты о гемолитической анемии у детей:
| Гемолитические анемии — это группа состояний, при которых разрушаются эритроциты |
| Гемолитическая анемия может быть наследственным заболеванием или может быть следствием аутоиммунных состояний, инфекций, рака или лекарств |
| Многие дети не нуждаются в лечении. При необходимости лечения назначают переливания крови, стероиды и др. |
Советы, которые помогут вам получить максимальную отдачу от лечащего врача вашего ребенка:
- Перед визитом запишите вопросы, на которые вы хотите получить ответы.
- При посещении запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые перечислит лечащий врач вашего ребенка.
- Узнайте, почему назначается новое лекарство или лечение и как оно поможет вашему ребенку. Также узнайте, каковы побочные эффекты.
- Выясните, можно ли лечить состояние вашего ребенка другими способами.
- Узнайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Выясните, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если необходима следующая встреча с врачом, запишите ее дату, время и цель.
В любом случае при возникновении симптомов анемии у ребенка необходимо в срочном порядке обратиться к лечащему врачу. Он поставит точный диагноз и в скорейшем времени назначит требуемое лечение, если оно будет необходимо.
Данное заболевание (другое его название — микросфероцитоз) с частотой возникновения в 2—3 случая на 10 000 новорожденных является наследственной патологией. Главным проявлением болезни выступает стремительно развивающиеся малокровие (анемия), это вызвано тем, что в селезенке преждевременно разрушается значительное количество дефектных эритроцитов.
Естественные размеры и форма эритроцитов позволяют им беспрепятственно проходить в капиллярах, которые являются самыми мелкими сосудами в организме и через стенки которых происходит газообмен в тканях.
Заболевание Минковского — Шоффара развивается вследствие наличия генного дефекта, нарушающего синтез стенок эритроцитов вследствие уменьшающегося наличия белка спектрина.
Внутрь эритроцитов начинают интенсивно поступать ионы натрия и воды, что неминуемо приводит к их расширению в размерах. В тот момент, когда эритроцит принимает сферическую форму, он теряет эластичность, из-за этого, проходя по сосудам, деформируется, а в дальнейшем очень быстро разрушается полностью.
Это приводит к дефициту количества эритроцитов, и начинает развиваться гемолитическая анемия. Чаще всего заболевание является наследственным от родителей, от одного из которых и передается дефектный ген. В более редких случаях, когда родители здоровы, болезнь Минковского — Шоффара возникает вследствие первичной мутации в процессе внутриутробного развития.
| Воздействие рентгеновского и радиационного излучения |
| Токсическое воздействие на геном попавших в организм во время беременности химических веществ (медикаменты, алкоголь, никотин, наркотические вещества и прочие) |
| Вирусная инфекция, поразившая организм плода. ДНК вируса встраивается в клеточный геном и провоцирует мутацию |
Все перечисленные факторы могут приводить, помимо микросфероцитоза, и к другим патологиям внутриутробного развития плода, поэтому следует во время беременности стараться избегать их воздействия. В физиологическом отношении своеобразным фильтром для отработанных эритроцитов является селезенка — именно она утилизирует мертвые эритроциты, продолжительность службы которых в среднем составляет 90—120 дней.
Чаще всего ярко выраженная симптоматика проявляется у детей в дошкольном и раннем школьном возрасте, а степень выраженности зависит только от количества дефектных эритроцитов. Так как течение заболевания цикличное (волнообразное), то характерны периоды гемолитического криза и межприступного периода.
Гемолитический криз — это одновременное разрушение большого количества эритроцитов. Межприступный период клинически проявляется признаками малокровия, кожа и слизистые глаз становятся бледными с небольшой желтушностью.
Гемолитический криз характеризуется такими клиническими проявлениями:
- желтухой — желтушно-зеленоватым окрашиванием кожи, слизистых вследствие увеличенного количества в крови продуктов распада гемоглобина разрушенных эритроцитов;
- повышением температуры тела до +38 °C, головной болью, головокружением, общей слабостью;
- болями в животе, которые могут иметь спастический характер;
- болью в области печени под правым подреберьем вследствие ее увеличения;
- увеличением в размерах селезенки.
Патология эритроцитов может длительно не проявлять себя абсолютно ничем, выраженность симптомов зависит от количества погибших телец. В таких случаях единственным симптомом, на который следует обратить внимание, выступит чуть заметная желтушность на коже и склерах глаз зеленоватого оттенка.
В раннем детском возрасте при серьезной форме микросфероцитоза последствием постоянного малокровия может стать отставание ребенка в психическом и соматическом развитии. Очень важно для успешного лечения этого заболевания раннее выявление деструктивных процессов, ведь перечисленные последствия в течение жизни исправить невозможно.
Диагностировать микросфероцитоз не составляет особых трудностей. Измененные эритроциты определяются анализом мазка крови при микроскопии по Романовскому — Гимзе.
Нормальные эритроциты имеют форму двояковогнутого диска, деформированные — сферическую. Подсчетом процентного соотношения числа измененных форм и общего количества эритроцитов определяется тяжесть заболевания.
Клинически значимым является течение болезни, при котором сферические эритроциты составляют 10—20 % от общего их числа. Необходимо оценить размеры лимфатических узлов, печени, селезенки, исключить наличие образований в брюшной полости, забрюшинном пространстве, другие признаки злокачественных заболеваний.
Для заблаговременной диагностики заболевания и других отклонений системы крови необходимо проводить профилактический анализ крови ребенку ежегодно.
Исходя от тяжести процесса назначается лечебная последовательность. При легком течении микросфероцитоза активные лечебные мероприятия не проводятся. Ребенок госпитализируется в стационар только при развитии приступа гемолитической анемии.
В лечебном учреждении проводится дезинтоксикационная терапия для выведения продуктов распада гемоглобина из организма, также для восстановления уровня эритроцитов в крови прописывается прием витаминов и препаратов железа.
Тяжелое течение требует проведения операции спленэктомии (удаление селезенки). При этом количество деформированных эритроцитов не уменьшается, но уже не происходит их разрушение при прохождении через селезенку. Такой исход считается методом радикальной терапии болезни Минковского — Шоффара.
Прогноз при заболевании Минковского — Шоффара весьма благоприятный при условии своевременного выявления отклонения и правильном лечении, особенно это касается предотвращения развития малокровия, которое сказывается на дальнейшем развитии.
источник
Е.С.Сахарова, Е.С.Кешишян, CONSILIUM Medicum 2002 г., Приложение: Педиатрия
Анемия является одной из наиболее частых патологий у детей раннего возраста. Около 20% доношенных детей страдают данным заболеванием, а среди недоношенных на первом году жизни анемия развивается практически у всех. При этом тяжесть анемии тем выше, чем меньше гестационный возраст ре6енка. В первые месяцы жизни у недоношенных детей с очень низкой массой тела при рождении (менее 1500 г) и гестационным возрастом менее 30 нед. тяжелая анемия, требующая переливание эритроцитарной массы, составляет до 90% .
В патогенезе ранней анемии недоношенных играет роль не только формирование железодефицита, характерное для всех детей раннего возраста, но и факторы незавершенного онтогенеза.
Кроветворение во внутриутробном периоде начинается очень рано. Уже в первые 2 нед. развития эмбриона определяются островки кроветворения — эритроциты продуцируются желточным мешком. Начиная с 12-16 нед., основным местом кроветворения становится печень и в меньшей степени селезенка. Примерно в 20 нед. внутриутробного развития плода начинается эритропоэз в костном мозге, а в печени и селезенке постепенно угасает. Таким образом, к моменту рождения у доношенных детей кроветворение в печени почти полностью прекращается, тогда как у глубоконедоношенных очаги кроветворения сохраняются практически до 40-й недели гестации (т.е. от 3 нед. до 3 мес. их фактического возраста). На ранних стадиях внутриутробного развития отмечается небольшое количество эритроцитов. До начала костномозгового кроветворения концентрация эритроцитов в крови плода растет медленно, а к моменту рождения резко возрастает и составляет уже 5-6 млн в 1 мм 3 .
Для недоношенных детей характерны морфологические изменения эритроцитов. Так, эритроциты аномальной формы составляют 27%, тогда как у доношенных новорожденных всего — 14%. Это способствует тому, что период жизни эритроцита у доношенных почти в 2 раза дольше, чем у недоношенных детей, и составляет 60-70 и 35-50 дней соответственно.
Укорочению жизни эритроцитов могут способствовать особенности строения их мембран. При изучении состава общих липидов мембран эритроцитов у детей с ранней анемией недоношенных выявлено, что со 2-й недели у них наблюдается снижение содержания фосфолипидов и повышается содержание холестерина. Эти изменения прогрессируют к 6-й неделе жизни и в разгар анемии достигают максимума, что коррелирует с клиническими и лабораторными симптомами.
В нарушении проницаемости мембран эритроцитов у недоношенных детей также играет роль низкий уровень витамина Е, который локализуется в мембранах и активно участвует в перекисном фосфорилировании. Дефицит витамина Е наблюдается у 86% недоношенных детей .
Зародышевые эритроциты на ранних этапах онтогенеза продуцируют зародышевую (эмбриональную) форму гемоглобина.
Между 7-12-й неделей внутриутробной жизни эмбриональный гемоглобин заменяется фетальным. Уровень гемоглобина также зависит от срока гестации, составляя на 10-й неделе в среднем 90 г/л, а к 38-й неделе 170±20 г/л.
Фетальный гемоглобин обладает более высоким сродством к кислороду и более медленной отдачей кислорода тканям по сравнению с гемоглобином взрослых. Переключение синтеза фетального гемоглобина на гемоглобин взрослых находится под контролем генов, находящихся в 11 и 16-й хромосомах и начинается на 30-32-й неделе внутриутробного развития. Содержание фетального гемоглобина у недоношенных детей при рождении составляет в среднем 70-80%, у доношенных новорожденных — 60-70%. Более половины объема фетального гемоглобина заменяется на гемоглобин взрослых в первые дни жизни ребенка, в дальнейшем этот процесс несколько замедляется, но к 4-5-му месяцу постнатальной жизни у большинства детей остается около 1% фетального гемоглобина. У недоношенных детей этот процесс замедлен, основной объем смены гемоглобина приходится на 40-ю неделю гестации, а полная смена растягивается практически на весь первый год жизни. Кроме того, задержка переключения синтеза с фетального гемоглобина на гемоглобин взрослых усиливается при тяжелой гипоксии и стрессе у плода.
Уровень гематокрита определяется концентрацией гемоглобина и эритроцитов в крови. В норме гематокрит у новорожденных выше, чем у взрослых, и составляет 50-55%.
Отражением состояния эритропоэза является уровень ретикулоцитов. Среднее количество ретикулоцитов у новорожденного составляет 4,2-7,2%. В конце 1-й недели постнатального возраста этот показатель снижается до уровня взрослых и составляет 1%.
При рождении доношенного ребенка определяется высокое содержание гемоглобина, что в условиях повышенного по сравнению с внутриутробным потреблением кислорода является избыточным. Это в свою очередь ведет к усилению выработки эритропоэтина и снижению эритропоэза. При угнетении функции костного мозга и усиленном разрушении эритроцитов происходит постепенное снижение и смена гемоглобина, который к 8-12-й неделе у доношенных детей достигает 110-120 г/л. Если гемоглобин снижается до этого порога — для доношенных 100-110 г/л, нарушается отдача кислорода тканям, что стимулирует продукцию эритропоэтина. В результате начинается процесс увеличения продукции эритроцитов .
У недоношенных детей процесс разрушения эритроцитов идет быстрее в связи с более коротким периодом жизни этих клеток. Уровень гемоглобина, при котором начинает увеличиваться продукция эритропоэтина у недоношенных детей, значительно ниже, чем у доношенных, и составляет 90-70 г/л (таким образом, такой уровень гемоглобина — критический для доношенных детей, является допустимым для недоношенных!).
У взрослых и детей старшего возраста в ответ даже на легкую гипоксию наблюдается быстрое увеличение продукции эритропоэтина, в то время как недоношенные не способны продуцировать адекватные количества эритропоэтина даже при критических значениях циркулирующих эритроцитов, что обусловлено, по-видимому, более низкой потребностью в кислороде.
Таким образом, анемия недоношенных характеризуется прогрессивным снижением уровня гемоглобина (до 90-70 г/л и ниже), относительно низким уровнем ретикулоцитов и угнетением костномозгового кроветворения.
Выделяют раннюю и позднюю анемию недоношенных.
Ранняя анемия развивается на 4-10-й неделе постнатальной жизни и характеризуется снижением уровня ретикулоцитов менее 1%, уровня гемоглобина до 80-70 г/л и ниже, а гематокрита до 20-30% .
Клиническая картина ранней анемии недоношенных проявляется симптомами, свойственными истинной анемии, такими как бледность кожных покровов, тахикардия или брадикардия, тахипное, апноэ.
Среди причин ранней анемии недоношенных, кроме указанных, определенное значение придается высокой скорости увеличения массы тела и объема циркулирующей крови, несоизмеримых с уровнем эритропоэза .
Кроме того, в генезе ранней анемии недоношенных играет роль дефицит фолиевой кислоты, витамина В6, микроэлементов: цинка, меди, селена, молибдена. Запасы фолиевой кислоты истощаются в течение первых недель жизни, что приводит к нарушению синтеза фолатов микрофлорой кишечника.
Известно, что ранняя анемия недоношенных может быть одним из проявлений инфекции и потенцироваться ее постнатальным развитием.
Существуют исследования, доказывающие зависимость между концентрацией гемоглобина и уровнем тиреоидных гормонов (Т3 и Т4). В условиях относительного дефицита Т3 и Т4, характерного для недоношенных детей, происходит нарушение тех этапов эритропоэза, которые требуют интенсивного синтеза специфических белков — ферментов, участвующих в образовании гемоглобина .
Кроме «условно физиологических» причин анемии, связанных с незавершенным онтогенезом, к сожалению, в потенцировании тяжести анемии определенную роль играют так называемые ятрогенные причины, такие как частые, хоть и небольшие по объему кровопотери в результате заборов крови для лабораторных исследований без восполнения ОЦК. По данным литературы, за первую неделю жизни у новорожденного недоношенного ребенка для исследований забирается около 38,9 мл крови. Относительно общего объема крови (80 мл/кг массы) это — очень большая цифра .
Суммируя все сказанное, в патогенезе анемии недоношенных играют роль сочетание нескольких факторов:
а) укороченная продолжительность жизни эритроцитов;
б) пролонгированная циркуляция и поздняя смена фетального гемоглобина;
в) особенность обмена белков, витаминов, микроэлементов;
г) инфекционные агенты, в частности грамотрицательная флора, для жизнедеятельности которой необходимо активное потребление железа;
д) ятрогенные причины.
Одним из основных методов лечения ранней анемии недоношенных до настоящего времени остаются гемотрансфузии. Наиболее часто для гемотрансфузий используется донорская эритроцитарная масса. Показаниями для переливаний эритроцитарной массы при анемии недоношенных являются: снижение гемоглобина ниже 130 г/л и гемотокрита ниже 0,4 в период ранней адаптации (первые 7 дней жизни) в сочетании с тяжелыми нарушениями дыхания и сердечной деятельности. Широкое использование гемотрансфузий у недоношенных детей сопряжено хотя и с невысоким, но существенным риском. Это прежде всего возможность передачи с трансфузиями вирусных инфекций (ВИЧ, ЦМВ), возможны также перегрузки сосудистого русла жидкостью, развития состояния «трансплантант против хозяина», электролитного дисбаланса. В настоящее время ведется поиск альтернативных путей решения этой проблемы. Одной из них является применение рекомбинантного человеческого эритропоэтина, эффективность которого сейчас интенсивно изучается .
Поздняя анемия недоношенных развивается на 3-4-м месяце жизни. Она имеет большее сходство с железодефицитной анемией детей раннего возраста. Клиническая картина поздней анемии недоношенных характеризуется снижением аппетита, уплощением весовой кривой, бледностью кожи и слизистых оболочек, сухостью кожи, увеличением печени и селезенки. Отмечается снижение сывороточного железа — гипохромия, с тенденцией к микроцитозу и гиперрегенераторной реакцией костного мозга.
Кроме всех особенностей, присущих ранней анемии недоношенных, в период развития поздней анемии начинают проявляться симптомы дефицита железа. Наиболее активное поступление железа от матери к плоду осуществляется в последние 2 мес. беременности, поэтому недоношенность в 4-8 нед. может привести к сокращению запасов железа в 1,5-3 раза по сравнению с доношенными .
У доношенных детей ретикулоэндотелиальная система имеет запас железа на 15-20 дней. Как только достигается нижний уровень гемоглобина — 100-110 г/л у доношенных и 70-90 г/л у недоношенных, начинается стимуляция эритропоэза. Если запасов железа недостаточно, происходит дальнейшее снижение гемоглобина и анемия становится железодефицитной. У недоношенного ребенка потребность в железе выше, чем у доношенного, а запасов разительно меньше. Учитывая, что железо находится в организме не только в виде гема, но также идет на построение миоглобина и ферментов — каталазы, пероксидазы, цитохромов и цитохромоксидазы, постнатальный расход его крайне велик.
После рождения источниками железа для развивающегося организма являются поступление экзогенного железа в составе пищевых продуктов и его утилизация из эндогенных запасов.
Попытки обогащения рациона питания введением адаптированных смесей, в том числе и обогащенных железом, не приводят к желаемому результату, поскольку последнее плохо всасывается. Для недоношенных детей, особенно первых месяцев жизни, единственным физиологическим продуктом питания, который обеспечивает равновесие обмена железа в организме, является материнское молоко, сбалансированное по всем ингредиентам в соответствии с физиологическим потребностям растущего организма. Хотя в женском молоке содержание железа невелико (0,2-1,5 мг/л), существуют специальные механизмы для более эффективного его усвоения (до 50%) . Вместе с тем большой проблемой является поддержание лактации у женщин, находящихся в состоянии стресса в результате досрочно прерванной беременности и больного ребенка. Просветительская работа, психологическая поддержка матери являются единственным способом обеспечения грудным вскармливанием недоношенного ребенка.
Для диетической коррекции железодефицита требуется своевременное (но не ранее 4-5-го месяца жизни) введение продуктов прикорма (фруктов, овощей, в дальнейшем, после 8 мес. — мяса). В то же время исследованиями доказано, что для лечения анемии (но не для ее профилактики) недостаточно только повышения уровня пищевого железа, а требуется медикаментозная дотация.
Чем же так опасна железодефицитная анемия?
Железодефицитная анемия способствует развитию хронической гипоксии, которая в свою очередь может приводить к замедлению умственного и психомоторного развития ребенка .
В связи с этим лечение анемии у недоношенных детей и профилактика дефицита железа у всех детей является важной и обязательной составной частью в общей схеме наблюдения за детьми на 1-м году жизни . Кроме немаловажных диетических подходов, актуально раннее назначение профилактических доз препаратов железа всем недоношенным детям. Препаратами выбора в этом случае являются современные представители гидроксид полимальтозного комплекса трехвалентного железа: Мальтофер и Феррум Лек. Гидроксид полимальтозный комплекс стабилен в физиологических условиях, что исключает образование свободных ионов железа. В отличие от распространенных ранее солевых (ионных) препаратов железа — двухвалентные соединения солей железа (например, сульфат железа), полимальтозные комплексы (Мальтофер и Феррум Лек) не оказывают раздражающего действия на слизистую оболочку кишечника, что часто проявляется в виде запора, диареи, тошноты, срыгиваний. Всасывание железа из полимальтозных комплексов приближена к абсорбции гемового железа и обеспечивается активным транспортным механизмом, наиболее физиологичным для организма. В данном случае железо непосредственно переносится через трансферриновые рецепторы в места кроветворения или доставляется в места хранения железа, где депонируется в ретикулоэндотелиальной системе (печени и селезенке) в виде ферритина.
Клинические исследования препарата “Мальтофер” показали его одинаковую эффективность по сравнению с солевыми препаратами. При этом количество побочных эффектов со стороны желудочно-кишечного тракта в 3 раза меньше при применении полимальтозного комплекса железа, а число пациентов, отказавшихся от продолжения курса лечения, более чем в 2 раза больше в группе солевых препаратов .
Химическая структура комплекса не выделяет железо в свободном виде. Совместно с активным транспортным механизмом всасывания железа это предохраняет организм от интоксикации свободными ионами железа , а также их оксидативного воздействия, присущее солевым препаратам железа .
Эти же механизмы поддерживают систему саморегуляции по принципу «обратной связи»: всасывание железа из комплекса прекращается, как только восстанавливается его необходимый уровень в организме, что исключает возможность отравления данными препаратами при их передозировке .
Недоношенным детям с первых недель жизни до 1-го года рекомендуется профилактический прием указанных препаратов железа из расчета 2 мг/кг/сут элементарного железа. Лечебная доза составляет 5 мг/кг/сут элементарного железа и не меняется до нормализации уровня гемоглобина. Контроль показателей красной крови (уровень гемоглобина, ЦП, эритроциты) недоношенным детям после выписки из отделений выхаживания необходимо проводить в обязательном порядке в 3, 6 и 12 мес, затем 2 раза в год, а при выявлении анемии — каждые 14 дней до стабилизации показателей гемограммы.
Учитывая особенности патогенеза анемии недоношенных детей, тенденцию к развитию гипорегенераторной реакции костного мозга, мегалобластозу, макроцитозу, повышенному гемолизу эритроцитов, детям с низкой массой тела при рождении необходимо раннее, с 7 дней жизни, введение фолиевой кислоты по 1 мг в сутки, витамина Е по 20 мг/кг в сутки, витаминов группы В.
Согласно Приказу Минздрава РФ № 375 от 18.12.97 г. о проведении профилактических прививок железодефицитная анемия не является противопоказанием к вакцинации. Напротив, недоношенные дети представляют особую группу риска по развитию осложненного инфекционного процесса. Поэтому даже в случае тяжелых проявлений анемии профилактические прививки могут быть проведены сразу после купирования острых проявлений. Умеренное снижение гемоглобина, проведение противоанемического лечения не является основанием для отсрочки вакцинации .
- Бисярина В.П., Казакова Л.М. Железодефицитная анемия у детей раннего возраста. М., 1979; 176.
- Nex E., Cristensen N.S., Olesen S. Volume of blood removed for analytical purposes during hospitalization of low birth weight infants. Clinical chemistry, 1981; 27: 759-61.
- Алдышева Т.В. Соединение веществ в плазме крови и активность антиокислительных ферментов эритроцитов при наличии анемии недоношенных детей. Вопросы адаптации недоношенных и детей грудного возраста. М., 1985; 127-30
- Дегтярев Д.Н., Курмашева Н.А., Володин Н.Н. Современные представления о патогенезе и лечении анемии у недоношенных детей. Лекции кафедры неонатологии ФУВ РГМУ, 1994.
- Dallmann P.R. Nutritional anemia in infancy in Tsang R.C., Nicols B.L. Nutrition during infancy, Philadelphia, 1988.
- Красницкая Л.Н. Содержание тиреоидных гормонов, тестостерона и кортизола в сыворотки крови у недоношенных детей при ранней анемии. Автореф. дисс. канд.мед.наук, Л., 1988; 22.
- Пригожина Т.А. Эффективность рекомбинантного эритропоэтина в комплексной профилактике и лечении ранней анемии недоношенных. Дисс. канд.мед.наук, М., 1988.
- Акре Д. Кормление детей первого года жизни: функциональные основы. Бюллетень ВОЗ, 1989; приложение к тому 67: 30-35.
- Walter T. Infancy: mental and motor development. American Jornal of Clinical Nutrition, 1989; 50: 655-66
- Jacobs P. et. al. Better tolerance of iron polymaltose complex compared with ferrous sulfate in the treatment of anemia. Hematology, 2000; 5: 77-83
- Geisser P. et. al. Structure / histotoxicity relationship of peroral iron preparations. Drug Research, 1992; 42: 1439-52.
- Tuomainen, T-P, et.al. Oral supplementation with ferrous sulfate but not with non-ionic iron polymaltose complex increases the susceptibility of plasma lipoproteins to oxidation, Nutrition Research, 1999; 19: 1121-32
- Geisser P., Hohl H. and Mueller A. Klinische Wirksamkeit dreier verschiedener Eisenpraeparate an Schwangeren. Schweiz. Apotheker-Zeitung, 1987; 14: 393-8
- Федоров А.М. О новом календаре профилактических прививок. Детский доктор, 1999; 1: 27-9.
Бледность всегда была синонимом красоты и аристократизма во всем мире. Тогда никто не представлял себе, что такое железодефицитная анемия. Тургеневские барышни всячески старались сохранить молочно-белую кожу, а природные смуглянки килограммами расходовали белила, чтобы никто не догадался о натуральном цвете их лица. Сейчас времена изменились: в моде здоровый, золотистый лик.
И женщины с бесцветной кожей изо всех сил стараются скрыть свою алебастровую белизну, посещая солярий, увлекаясь загаром под солнечными лучами на пляжах и т.д. Однако, чтобы достичь желаемого результата, прежде всего необходимо выяснить истинную причину этого состояния. Постоянная белизна может говорить о возникших проблемах в организме: например, о пониженном давлении — , а также — серьезном заболевании, о котором будет подробно сказано в этой статье.
Анемия (малокровие) — такое состояние, при котором в единице объема крови происходит снижение функционально полноценных красных клеток (эритроцитов) и гемоглобина, что приводит к кислородному голоданию тканей.
Некоторые ее разновидности относятся к наследственным заболеваниям. Но чаще анемия развивается у человека, страдающего множеством других болезней. Количественно она выражается степенью снижения концентрации гемоглобина — железосодержащего пигмента эритроцитов, придающего крови красный цвет.
Наиболее часто встречаются виды анемии: и В ¹² (фолиево) — дефицитная. Именно по ним возникают вопросы у наших читателей. Темы эти довольно обширные, поэтому сегодня мы поговорим о железодефицитной анемии, но вначале несколько слов о том, что может стать причиной развития этого недуга.
- Заболевания желудочно-кишечного тракта, проявляющиеся хроническими кровопотерями ( или , пищевода, кишечника; (воспаление пищевода), ; и полипоз кишечника; неспецифический ; ; .
- Болезни ЖКТ, протекающие с нарушением всасывания железа (резекция тонкого кишечника, энтерит, амилоидов кишечника, хронический панкреатит.
- Заболевания печени и ее портальных трактов с кровотечениями из расширенных вен пищевода.
- Болезни почек с микро- и макрогематурией.
- Заболевания сердечно-сосудистой системы (гипертоническая болезнь с носовыми кровотечениями; расслаивающая аневризма аорты).
- Болезни легких и бронхов, протекающие с кровотечениями (рак легкого, туберкулез, бронхоэктазы).
- Заболевания системы крови (лейкозы и гипотактические анемии, осложненные кровотечением).
- Геморрагические диатезы (тромбоцитопения, гемофилия, геморрагический васкулит).
- Гипотиреоз (снижение функции щитовидной железы).
- Группа заболеваний, сопровождающихся интоксикацией.
- Меноррагии (обильные менструации) и метроррагии (обильные маточные кровотечения).
- Беременность и период лактации (кормление младенца, питание беременных и кормящих матерей.
- Недостаточное потребление железа с пищей.
- Чрезмерное донорство. А также острые инфекции (бактериальные, вирусные, грибковые, сепсис и т.д.).
Железодефицитная анемия (ЖДА) характеризуется дефицитом железа в сыворотке крови и костном мозге, что приводит к нарушению образования гемоглобина и эритроцитов, приводящему к трофическим нарушениям в органа и тканях.
Железодефицитная анемия детского возраста может быть обусловлена недоношенностью детей, ранним искусственным вскармливанием, частыми инфекционными воспалительными заболеваниями.
Следующая форма — хлороз — бывает ранней (у молодых девушек) и поздней (у женщин 35-45 лет).
Для железодефицитной анемии характерны бледность кожных покровов, сонливость, извращение вкуса (наклонность к употреблению мела, глины, скорлупы яиц, зубного порошка). По утрам повышенное сердцебиение, шум в ушах, одышка, ломкость ногтей, выпадение волос.
Пациенты часто жалуются на стоматиты, трещинки в углах рта, покраснение и воспаление языка — глоссит, снижение артериального давления.
Диагностировать железодефицитную анемию можно не только в стационаре, но и амбулаторно.
При исследовании общего анализа крови у больных выявляются: снижение цветного показателя, незначительное снижение количества эритроцитов, повышенное содержание лейкоцитов. При биохимическом изучении крови отмечается снижение железа в крови.
Оно складывается из нескольких составляющих: лечебного питания, медикаментозной терапии и фитотерапии, санаторно-курортного лечения.
строится на принципах лечения основного заболевания — диет №№1-5, №7,№10, №15.
Лучше всего железо всасывается из продуктов животного происхождения (говяжье мясо, телятина, печень говяжья). Кроме того, порекомендую рыбу, почки, легкие, яйца, гречневую и овсяную крупы, белые грибы, какао, шоколад, зелень, овощи, горох, фасоль, яблоки, персики, киви, изюм, чернослив, мед, грецкие орехи, молочные продукты.
Не забывайте о сезонном употреблении овощей, фруктов, ягод
Питание должно быть дробным, 5-6 раз в день.
Методы приготовления пищи: на пару, отварные, запеченные в духовке, без корочки (в рукаве).
Разовая порция первого блюда должна составлять 250-300 мл + 100-150 г мяса или рыбы.
Разовая порция второго блюда — 200-250 г мяса, рыбы + 100-150 г гарнира.
Салаты — по 100-150 г, заправленные 10-15%-й сметаной (1 ст. ложка) или же растительным маслом (10-15 мл) + 5-10 мл лимонного сока.
Разовый прием хлеба грубого помола — 100-150 г.
Напитки (чай, компот, морс, цикорий) на один прием — 200-250 мл.
Свежевыжатые соки принимать курсами.
Понадобится на 4 порции: 750-800 г телятины, 200 г лука, 350 г клубня сельдерея, 5 г соли, 2 шт. лаврового листа, 5-7 горошин душистого перца, 7 сушеных плодов барбариса, 7 сушеных ягод можжевельника, 1/3 ч. ложки плодов аниса, 3 палочки гвоздики; смесь измельченных специй (куркумы, кардамона, имбиря, мускатного ореха) — 1/2 ч. ложки; 1/2 ч. ложки смеси сухих трав (базилика, розмарина, душицы, майорана, кориандра); сладкий перец — 100-150 г, свежая петрушка — 100-150 г, 200 мл сливок (10%).
Мясо промыть, просушить, измельчить, как для гуляша (шириной в 3 см), желательно поместить в чугунную посуду. Пересыпать измельченным луком, нарезанными сельдереем и сладким перцем. Сразу же добавить все вышеперечисленные приправы, перемешать.
Налить 150 мл холодной воды, закрыть крышкой и поставить на огонь. Дать закипеть, затем пламя максимально уменьшить, томить на слабом огне 45 минут. Следить, чтобы не выкипела жидкость; постоянно подливая воды. За 10 минут до полной готовности влить сливки.
Гарнир можно выбрать любой.
Медикаментозную терапию железосодержащими препаратами для каждого больного подбирает врач, основываясь на результатах различных исследований. Я лишь перечислю некоторые из этих препаратов, принимаемых внутрь: ферронат, хеферол, ферлатум, ферроград, ферроплекс, иррадиан, тардиферон, мальтофер, феррум-лек и др.
Существуют также средства, которые вводятся внутримышечно и внутривенно, — их тоже индивидуально назначает специалист.
Прием травяных сборов также хорошо было бы обсудить с врачом-фитотерапевтом.
Нам понадобятся 3 части , 5 частей , 2 части листьев . Компоненты смешать, измельчить, желательно в кофемолке. Поместить в стеклянную посуду. Хранить в сухом, темном месте.
1 дес. ложку смеси без верха поместить в стеклянную банку, залить 500 мл кипятка, настоять 7 часов, процедить, хранить в холодильнике. Принимать по 150 мл в теплом виде через 1,5 часа после еды 3 раза в день. Можно добавлять мед по вкусу.
Курс приема — неделя. После чего увеличить дозу травяной смеси до 1 ст. ложки, приготовление и прием оставив без изменения. Пить еще 5 дней, сделать перерыв 2-3 недели и лечение можно повторить.
Взять поровну лист , цветки и измельченный корень . Компоненты смешать, хранить так же, как и предыдущий сбор.
1 ст ложку сбора поместить в эмалированную кастрюлю, залить 500 мл кипятка, поставить на медленный огонь, прокипятить 5 минут, настоять 3 часа, процедить, хранить в холодильнике.
Принимать в теплом виде за 30 минут до еды по 150 мл 3 раза в день, добавляя по вкусу мед. Курс — 6-8 недель.
Прием этих сборов можно чередовать, проводя 2-3 курса в год.
После получения положительного эффекта в лечении желательно провести санаторно-курортное лечение в Кисловодске, Ессентуках, Железноводске и т.д.
Для цитирования: Дворецкий Л.И. Клинические рекомендации по лечению больных железодефицитной анемией // РМЖ. 2004. №14. С. 893
Железодефицитная анемия (ЖДА) представляет собой клинико-гематологический синдром, возникающий при развитии дефицита железа вследствие различных патологических (физиологических) процессов и характеризующийся снижением уровня гемоглобина (в меньшей степени эритроцитов) наряду с клиническими признаками анемии и сидеропении.
Клинические рекомендации ведения больных ЖДА включают: — выявление причины ЖДА и при необходимости — ее коррекция; — обучение больных ЖДА; — принятие решения о назначении лекарственных препаратов железа (ПЖ); — выбор лекарственного ПЖ; — путь введения ПЖ (внутрь или парентерально); — длительность лечения и необходимость поддерживающей терапии; — контроль переносимости ПЖ и коррекция при плохой переносимости; — оценку эффективности и выявление причин отсутствия или недостаточного эффекта; — коррекцию выявленных причин неэффективности.
Выявление причины ЖДА и возможности ее коррекции
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и вместе с тем наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ-10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует особо подчеркнуть роль врача-интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА (независимо от конкретной причины) обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к гематологу или другому специалисту. При выявлении причины ЖДА лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений — лечение эрозивно-язвенных процессов в желудке, оперативные лечения при опухолях ЖКТ, миоме матки, лечение энтеритов, коррекция алиментарной недостаточностии т.д.
Существенным компонентом ведения больных ЖДА является повышение их образовательного уровня в отношении данной патологии, создание мотивации к лечению, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Необходимо разъяснение сущности ЖДА, причин ее возникновения, реальных возможностей коррекции дефицита железа и нормализации уровня гемоглобина. Особое значение имеют обучающие программы у беременных женщин с наличием ЖДА и пациенток, страдающих меноррагиями. У беременных должна создаваться мотивация необходимости коррекции дефицита железа с целью предотвращения недостатка железа у плода. Больные должны быть осведомлены о возможных побочных эффектах при лечении лекарственными препаратами железа, необходимости соблюдения врачебных назначений, в том числе и регулярности приема ПЖ. Следует обязательно указать на недопустимость попыток коррекции дефицита железа с помощью различных пищевых продуктов, а также на строгие показания к назначению инъекционных форм ПЖ.
Принятие решения о назначении лекарственных препаратов железа
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так например, железо, содержащееся в мясе в виде гема, всасывается на 40-50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3-5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа. На фармацевтическом рынке России в настоящее время имеется большой арсенал ПЖ в различных лекарственных формах, с неодинаковым содержанием в них железа, наличием дополнительных компонентов, влияющих на биодоступность железа, различной стоимостью (рис. 1). Из ПСЖ железо всасывается в двухвалентной форме, в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В ПЖК железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе, связано как в физиологическом состоянии в молекуле ферритина. Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Всасывание железа из ПЖК и нарастание его концентрации в сыворотке происходит медленно, но оно быстро поступает в запасы. При применении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПЖК в отличие от ПСЖ не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания (табл. 1). Для лучшей абсорбции ПСЖ рекомендуется принимать за час до еды т.е. на пустой желудок, что может вызывать нарушения со стороны желудка, кишечника и другие побочные эффекты. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучший комплайенс больных ЖДА. ПСЖ взаимодействуют с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), снижающими биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК. Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ.
Основными показаниями для парентерального введения ПЖ являются: — патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания); — резекция тонкой кишки; — резекция желудка по Бильрот II с формированием «слепой петли»; — эрозивно-язвенные процессы в желудке (обострение язвенной болезни и др.); — непереносимость ПЖ для приема внутрь. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой. Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах при необходимости более быстрой нормализации содержания гемоглобина (например, при подготовке к оперативному вмешательству) следует считать неоправданным. ПЖ для парентерального введения могут назначаться при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена ПЖ для приема внутрь и т.д.).
Выбор лекарственного препарата железа
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа . Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25-30% (при нормальных запасах железа — всего 3-7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединения железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1-2 таблеток в сутки. Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей — глицин сульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианкобаламин). Среди ПЖК на отечественно рынке имеются гидроксиполимальтозный комплекс, железо-сорбитоловый комплекс, протеин сукцинилат железа, железо-сахарозный комплекс. К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксиполимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т.е. прооксидантные реакции. Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. Для лучшей переносимости ПСЖ следует принимать во время еды, хотя следует иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Всасываниежелеза может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ — фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПЖ в виде солей недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли магния). С учетом этого следует рекомендовать прием препаратов солей железа в различное время с другими вышеуказанными медикаментами. Препараты ПЖК, в частности, гидроксиполимальтозный комплекс лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияние на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов. В таблице 2 представлены основные зарегистрированные в России лекарственные ПСЖ и ПЖК для приема внутрь.
Оценка эффективности лечения
В случаях назначения ПЖ в достаточной дозе на 7-10-й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3-4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4-9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой — эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
Длительность лечения и поддерживающая терапия
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 4-6 недель. Поддерживающая терапия показана в тех ситуациях, когда причина дефицита железа сохраняется (меноррагии, беременность) или в силу различных ситуаций является трудноустранимой (патология кишечника, носовые и другие кровотечения при геморрагических диатезах). Женщинам, страдающим ЖДА на фоне меноррагий, после нормализации показателей гемоглобина рекомендуется поддерживающая терапия ПЖ в течение 5-7 дней после очередной менструации. Больным надо разъяснять необходимость поддерживающего лечения в связи с продолжающимися избыточными потерями железа. Беременные с ЖДА должны получать ПЖ до конца беременности в целях обеспечения адекватной потребности плода в железе.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже — поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Диспептические расстройства могут уменьшаться при приеме препаратов после еды или уменьшения суточной дозы препарата. Чаще побочные эффекты регистрируютсяпри приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества. В случаях сохраняющейся плохой переносимости пероральных ПЖ показано назначение ПЖ парентерально (внутримышечно или внутривенно). На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из-за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
Причины неэффективности лечения препаратами железа
В случае отсутствия или недостаточного эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Возможные причины неэффективности лечения ПЖ и способы их коррекции представлены в таблице 3. Необходима убежденность в правильной трактовке всех клинико-лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно связано с назначением ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, чем и объясняется, вероятнее всего, невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике. Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ. В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате показатели гемоглобина не достигают нормальных значений и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга. Ряд больных не всегда выполняют назначение врача (регулярность приема ПЖ, достаточная продолжительность и т.д.). В некоторых случаях это может быть обусловлено развитиемпобочных эффектов от ПЖ и самостоятельным прекращением лечения. Поэтому необходим контроль за лечением, эффективностью, переносимостью ПЖ со стороны врача, среднего медперсонала, родственников больных. Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, среди которых клинически наиболее значимыми являются скрытые кровопотери из желудочно-кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное эндоскопическое исследование кишечника (в ряде случаев — повторное). Таким образом, у больных ЖДА наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Своевременная верификация синдрома ЖДА и выявление ее причины, адекватная патогенетическая терапия с назначением ПЖ с оптимальными фармакокинетическими свойствами, клинической эффективностью, переносимостью позволяет корригировать анемический синдром и обеспечивать достаточный уровень качества жизни у данной категории пациентов.
Catad_tema Железодефицитная анемия — статьи
источник