Всасывание железа в кишечнике, его транспорт и депонирование. Истощение гемоглобинового фонда человека. Анемии, связанные с нарушением обмена железа. Клиническая картина понижения уровня гемоглобина в крови. Диагностика и лечение различных видов анемий.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http: //www. allbest. ru/
1. Анемии, связанные с нарушением обмена железа
Нормальные показатели обмена железа
Железо сывороточное, мкмоль/л
Всасывание железа в кишечнике, его транспорт и депонирование.
Железо поступает в организм человека с продуктами питания. В среднем суточный рацион человека содержит 15-20 мг железа, но всасывается всего 1,5-2 мг.
Лучше всего усваивается железо не из яблок, гречки и грецких орехов, а из мяса, особенно телятины. В субпродуктах (печень, почки) железа тоже много, но там оно содержится в виде ферритина и гемосидерина, которые усваиваются не слишком хорошо.
Кинетика железа в организме.
1. В 12-перстной кишке трехвалентное пищевое железо (Fе+++) восстанавливается до двухвалентного Fе++.
2. В эпителиальных клетках слизистой кишечника Fе соединяется с белком апоферритином. В результате образуется ферритин. Ферритин — основной белок, депонирующий железо в физиологически доступной форме.
3. При полном насыщении апоферритина железом и превращении его в ферритин наступает так называемая «блокада» слизистой оболочки, при которой дальнейшее всасывание железа прекращается.
4. Ферритин нагружается на трансферрин и доставляется к местам использования.
На трансферрине есть рецепторы к железу, если существует дефицит железа, то свободных рецепторов много они подвергаются действию протеаз и рецепторы оказываются свободно в крови, таким образом, чем больше определяется свободных рецепторов тем больше дефицит железа. Часть рецепторов свободна и в норме.
В нормальных условиях трансферрин насыщается железом на 1/3 — это железо связанное с трансферрином и есть сывороточное железо.
Максимальное количество железа, которое мог бы присоединить трансферрин — это ОЖСС.
В организме условно можно выделить такие фонды железа:
Фонд депонированного железа (ферритин, гемосидерин) в условиях дефицита истощается в первую очередь. Ферритин — содержится в макрофагах печени, селезенки, костного мозга, в эритроцитах и сыворотке крови. Лабораторным признаком истощения запасов железа в организме является снижение уровня ферритина в сыворотке крови. При этом уровень сывороточного железа сохраняется в пределах нормальных значений. Клинические признаки на этой стадии отсутствуют, диагноз может быть установлен лишь на основании определения уровня сывороточного ферритина. Это прелатентный дефицит железа в организме.
Фонд железа в составе транспортных белков (трансферрин) ослабляется после истощения запасов депо. При уменьшении железа в составе транспортных белков возникает дефицит его в тканях, вследствие чего происходит снижение активности железосодержащих тканевых ферментов. Это латентный дефицит железа в организме.
Клинически это проявляется развитием сидеропенического синдрома:
· пристрастие к острой, соленой, пряной пище
· дистрофические изменения кожи
· снижение сывороточного железа
· снижение насыщения трансферрина железом (менее 20%) — норма 30%
Истощение гемоглобинового фонда железа происходит в последнюю очередь. Уменьшение запасов этого металла в составе гемоглобина приводит к нарушению транспорта кислорода в ткани, что проявляется развитием железодефицитной анемии.
· снижение уровня гемоглобина и эритроцитов. Умеренная эритроцитопения может проявляться при Нb
© 2000 — 2018, ООО «Олбест» Все права защищены
источник
Анемии, развивающиеся при нарушении обмена железа: железодефицитные и железорефрактерные анемии: этиология, патогенез, проявления, особенности картины периферической крови.
Относят: железодефицитные и железорефрактерные анемии.
1) хронические кровопотери (вместе с эритроцитами теряется железо);
2) нарушение всасывания железа (удаление желудка, отсутствие секреции соляной кислоты, заболевания кишечника—энтериты
3) повышенное расходование запасов железа (беременность, лактация, период роста у детей);
4) нарушение включения железа в синтез гема (наследственный дефект ферментов, отравление свинцом).
Железодефицитная анемия может сочетаться с тканевым дефицитом железа в организме, признаками которого являются: ломкость ногтей, выпадение волос, атрофический процесс в слизистой оболочке желудка (атрофический гастрит) и другие симптомы. С развитием атрофического гастрита ухудшается всасывание железа и прогрессирует малокровие.
- Дефицит железа в плазме крови и клетках организма обусловливает снижение его содержания в митохондриях эритроидных клеток костного мозга. 2. Это тормозит синтез гема, соединение его с глобином и, следовательно, образование НЬ.
- Одновременно с этим нарушается синтез и других железосодержащих соединений (как в эритроидных клетках — каталазы, глутатионперок-сидазы, так и в клетках паренхиматозных органов — цитохромов, миоглобина, пероксидазы, каталазы и др.).
- Недостаток указанных ферментов в эритроцитах приводит к снижению резистентности к повреждающему действию перекисных соединений, повышенному их гемолизу и укорочению времени циркуляции в крови.
Сохраняется нормобластический тип кроветворения.
Часто наблюдается умеренная гиперплазия клеток красного ростка гемопоэза. Увеличено число базофильных и полихроматофильных эритробластов при уменьшении количества оксифильных.
Снижено количество эритроцитов и значительно уменьшено содержание НЬ (до 30-40 г/л). Это обусловливает развитие гемической гипоксии. Цветовой показатель снижен до 0,6 и более. Количество ретикулоцитов различно: от нормального до сниженного (при хроническом течении анемии) или повышенного (на начальных этапах анемии). Пойкилоцитоз, анизоцитоз (много микроцитов), наличие «теней» эритроцитов (в связи со сниженным содержанием в них НЬ). Уровень железа (Fe 2+ ) в плазме крови понижен (сидеропения) до 1,8-7,2 мкмоль/л (при норме 12-30 мкмоль/л).
Количество лейкоцитов имеет тенденцию к снижению (за счёт нейтрофилов).
Число тромбоцитов обычно в пределах нормы.
Железорефрактерные (порфиринодефицитные, сидеробластные, сидеро-ахрестические) анемии развиваются в результате нарушения включения в гем железа. В молекуле гема железо связано с одной из разновидностей порфирина — протопорфирином.
Подразделяют на первичные( наследственные) и вторичные (приобретенные):
Первичные анемии – проявления: Костный мозг: повышение числа сидеробластов, увеличение количества базофильных эритробластов, уменьшение числа гемоглобинизированныз эритробластов.
Периферическая кровь: умеренная эритропения, анизоцитоз эритроцитов; гипохромия эритроцитов; пойкилоцитоз эритроцитов, повышение уровня железа в плазме крови.
Приобретенные: Наиболее частые причины: дефицит пиридоксина (витамина В6) и хронические интоксикации (соединениями свинца, алкоголем, антимико-бактериальным средством изониазидом).
Патогенез: При дефиците витамина В6 нарушаются включение железа в молекулу тема и синтез НЬ. В связи с этим увеличивается содержание железа в плазме крови и клетках различных органов. При отравлении свинцом происходит блокада сульфгидрильных групп ферментов синтеза протопорфиринов (в частности, синтетазы 5-аминолевулиновой кислоты, декарбоксилазы уропорфириногена) и как следствие — тема. Нарушение синтеза гема нередко (особенно при отравлении соединениями свинца) сочетается со снижением скорости образования глобина (преимущественно (3-цепи).
В костном мозге увеличено количество эритробластов, а также сидеробластов.
В периферической крови снижено количество эритроцитов (они гипохромные, мишеневидные), увеличено количество ретикулоцитов, повышен уровень железа (до 60-80 мкмоль/л).
Железо обнаруживается также в клетках разных органов и тканей т.е. развивается гемосидероз.
В моче значительно увеличено содержание аминолевулиновой кислоты .
Поражение нервной системы характеризуется развитием энцефалопатии (проявляющейся головной болью, снижением памяти, судорогами). Повреждение ЖКТ проявляется резким снижением аппетита, болями в животе.
Картина крови: незначительное снижение в периферической крови числа эритроцитов, выраженная их гипохромия, анизоцитоз (макроцитоз), пойкилоцитоз, наличие единичных мишеневидных эритроцитов, увеличение содержания железа в сыворотке крови.
источник
К анемиям, развивающимся при нарушениях обмена железа, относят железодефицитные (сидеропенические) и железорефрактерные (сидероахрестические) анемии.
Железо участвует в функционировании всех биологических систем. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности и лактации — 38 и 33 мг соответственно). Общее количество железа в организме составляет 4–4,5 г. Различают клеточное железо, внеклеточное железо и железо запасов (рис. 21–12).
Рис. 21–12. Схема обмена железа (Fe) в организме здорового мужчины с массой тела 70 кг.
Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. К этому могут привести:
† Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.), а также массированных кровоизлияниях.
† Возрастание расходования железа организмов при беременности и последующем вскармливании ребёнка (за этот период теряется в общей сложности более 800 мг железа), особенно на фоне ещё не проявляющегося клинического дефицита железа).
† Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (всасывается главным образом двухвалентное железо, входящее в состав гема; нарушение этого процесса развивается при хронических гастритах, энтеритах, резекциях желудка и особенно тонкой кишки).
† Общая и клиническая характеристика железодефицитных анемий рассмотрена в статье «Анемия железодефицитная» (приложение «Справочник терминов» на компакт диске).
† Патогенез железодефицитных анемий приведён на рис. 21–13.
Рис. 21–13. Основные звенья патогенеза железодефицитных анемий.
† Проявления железодефицитных анемий приведены на рис. 21–14.
Рис. 21–14. Основные гематологические проявления железодефицитных анемий.
‡ Костный мозг.
§ Сохраняется нормобластический тип кроветворения.
§ Часто (но не всегда) наблюдаются умеренная гиперплазия клеток красного ростка гемопоэза. Увеличено число базофильных и полихроматофильных эритробластов при уменьшении количества оксифильных (признак торможения эритропоэза).
§ Снижено содержание депонированного в костном мозге железа и числа сидеробластов — нормобластов с гранулами железа.
‡ Периферическая кровь.
§ Снижено количество эритроцитов и значительно уменьшено содержание Hb (до 30–40 г/л). Это обусловливает развитие гемической гипоксии.
§ Цветовой показатель снижен до 0,6 и более.
§ Количество ретикулоцитов различно: от нормального до сниженного (при хроническом течении анемии) или повышенного (на начальных этапах анемии).
§ Пойкилоцитоз, анизоцитоз (много микроцитов), наличие «теней» эритроцитов (в связи со сниженным содержанием в них Hb).
§ Уровень железа (Fe 2+ ) в плазме крови понижен (сидеропения) до 1,8–7,2 мкмоль/л (при норме 12–30 мкмоль/л).
§ Содержание лейкоцитов имеет тенденцию к снижению (за счёт нейтрофилов).
§ Число тромбоцитов обычно в пределах нормы.
‡ Ткани и органы. В большинстве тканей организма развиваются различные дистрофии. Они вызваны дефектами структуры и функциональной активности железосодержащих ферментов и других соединений (например, глутатионпероксидаз, каталазы, пероксидаз, цитохромов, миоглобина). В связи с этим, а также вследствие развития тканевой гипоксии, выявляются мышечная слабость (миастения), шелушение, трещины кожи и слизистых оболочек, повышенная ломкость ногтей, выпадение волос, изменения стенки ЖКТ (сопровождающиеся гипотрофическим глосситом, гастритом, энтеритом).
† Железорефрактерные (порфиринодефицитные, сидеробластные, сидероахрестические) анемии развиваются в результате нарушения включения в гем железа. В молекуле гема железо связано с одной из разновидностей порфирина — протопорфирином (см. рис. 21–2). Порфирины синтезируются во всех клетках организма, но в наибольшем количестве — в эритрокариоцитах костного мозга и клетках печени. Порфирины являются обязательным компонентом железосодержащих ферментов — каталазы, пероксидаз, цитохромов, а также гемо‑ и миоглобина.
† Общая и клиническая характеристика железорефрактерных анемий рассмотрена в статье «Анемия сидеробластная» (приложение приложение «Справочник терминов» на компакт диске).
† Железорефрактерные анемии подразделяют на первичные (наследственные и идиопатические) и вторичные (приобретённые).
Первичные железорефрактерные анемии. Проявления первичных железорефрактерных анемий рассмотрены на рис. 21–15.
Рис. 21–15. Основные гематологические проявления первичных железорефрактерных (порфиринодефицитных) анемий.
Вторичные (приобретённые) железорефрактерные анемии.
‡ Наиболее частые причины: дефицит пиридоксина (витамина B6) и хронические интоксикации (соединениями свинца, алкоголем, антимикобактериальным средством изониазидом).
‡ Патогенез.
§ При дефиците витамина B6 нарушаются включение железа в молекулу гема и синтез Hb. В связи с этим увеличивается содержание железа в плазме крови и клетках различных органов.
§ При отравлении свинцом происходит блокада сульфгидрильных групп ферментов синтеза протопорфиринов (в частности, синтетазы d‑аминолевулиновой кислоты, декарбоксилазы уропорфириногена) и как следствие — гема.
§ Нарушение синтеза гема нередко (особенно при отравлении соединениями свинца) сочетается со снижением скорости образования глобина (преимущественно b‑цепи).
‡ Проявления.
При свинцовом отравлении, как правило, наблюдаются изменения в системе крови, а также признаки поражения нервной системы и ЖКТ.
§ В костном мозге увеличено количество эритробластов, а также сидеробластов.
§ В периферической крови снижено количество эритроцитов (они гипохромные, мишеневидные, с базофильной пунктацией цитоплазмы), увеличено количество ретикулоцитов, повышен уровень железа (до 60–80 мкмоль/л).
§ Железо обнаруживается также в клетках разных органов и тканей, т.е. развивается гемосидероз.
§ В моче значительно увеличено содержание аминолевулиновой кислоты. Это является одним из наиболее характерных признаков свинцового отравления (как следствие блокады свинцом синтетазы d-аминолевулиновой кислоты).
§ Поражение нервной системы характеризуется развитием энцефалопатии (проявляющейся головной болью, снижением памяти, судорогами), полиневритов (с расстройством движений и чувствительности), парезов.
§ Повреждение ЖКТ проявляется резким снижением аппетита, «свинцовыми коликами» — схваткообразными сильными болями в животе, запорами.
Для витамин B6‑дефицитной анемии характерны незначительное снижение в периферической крови числа эритроцитов, выраженная их гипохромия, анизоцитоз (макроцитоз), пойкилоцитоз, наличие единичных мишеневидных эритроцитов, увеличение содержания железа в сыворотке крови.
Дата добавления: 2016-11-18 ; просмотров: 376 | Нарушение авторских прав
источник
Существует аутосомно-рецессивное заболевание гемохроматоз , связанное с нарушением гепсидиновой регуляции и избыточностью всасывания железа в кишечнике. В результате железо накапливается в органах и тканях: печени, поджелудочной железе, миокарде, селезёнке, коже, эндокринных железах и др. Общее содержание железа в организме достигает 20-60 г при норме 2-4 г. Постепенно развиваются цирроз печени, кардиомиопатии, сахарный диабет 1 типа, артрит.
Приобретенный избыток железа возникает при гемолитических анемиях и избыточной задержке железа в макрофагах, нарушении мобилизации железа из депо, при избыточной парентеральной терапии железодефицитных состояний. Накапливающийся ферритин преобразуется в гемосидерин , в результате резко снижается использование железа. Такое состояние называется гемосидероз .
К образованию гемосидерина приводит перенасыщение ферритина железом, деградация его белковой части и полимеризация молекул. Провоцирующим повреждение фактором является способность железа инициировать образование активных кислородных радикалов.
Избыточное потребление препаратов железа per os не приводит к интоксикации, так как возможности транспорта металла из кишечника ограничены саморегуляцией энтероцитов и свойствами транспортных систем. Избыток железа задерживается в эпителии кишечника и выводится со слущивающимися клетками.
При недостаточности железа в организме (железодефицит) мобилизация резервов происходит в следующем порядке:
- Сначала используется железо из депо (ферритин),
- Затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
- Далее истощаются запасы сывороточного железа (холотрансферрин),
- В последнюю очередь страдает синтез гемоглобина.
Причинами нехватки железа являются
- недостаток его в пище (несбалансированное вегетарианство),
- заболевания ЖКТ со снижением всасывания (гипоацидные гастриты и энтериты),
- потери железа с кровью при менструальных, кишечных или иных кровотечениях,
- у новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии,
- в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
- ухудшение внимания и памяти у детей и взрослых,
- иногда детская гиперактивность,
- уплощение, волнистость и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
- выпадающий и секущийся волос,
- поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
- неинфекционный ларингофаринготрахеит (гиперемия, покраснение и охриплость), что дезориентирует врача,
- мышечная слабость:
– общая утомляемость,
– недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение капель мочи при резком кашле, смехе, чихании,
– недостаточное сокращение сфинктеров пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу.
- атрофический м анацидный гастрит – может быть как причиной, так и следствием железодефицита, половина больных гастритом имеет недостаток железа,
- обострение ишемической болезни сердца и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов дыхательной цепи в миокардиоцитах),
- извращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
- извращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
источник
Железодефицитная анемия – клинико-гематологический синдром, обусловленный недостатком железа в организме человека, что влечет нарушение нормального синтеза гемоглобина и гипоксию тканей.
Патология широко распространена. По статистическим данным, у 8-10% женщин детородного возраста диагностируется железодефицитная анемия, а у 30% женщин – латентный дефицит железа. В раннем детском возрасте признаки железодефицитной анемии выявляются у каждого второго ребенка. В структуре всех анемий на долю железодефицитной приходится 90%.
В основе развития железодефицитной анемии лежит отрицательный баланс обмена железа. К этому могут приводить разные факторы, но чаще всего причиной дефицита железа становится хроническая кровопотеря:
- кровотечения из геморроидальных узлов или анальных трещин;
- дисфункциональные маточные кровотечения;
- обильные менструации;
- желудочно-кишечные кровотечения (из эрозий и язв слизистой оболочки желудка или кишечника).
Другие причины кровопотери:
- гельминтозы;
- гемосидероз легких;
- геморрагические диатезы (болезнь Виллебранда, гемофилия);
- гемоглобинурия;
- обширные травмы и операции;
- частая сдача крови (донорство).
Нередко железодефицитная анемия развивается и у пациентов с хронической почечной недостаточностью, находящихся на программном гемодиализе.
При железодефицитных состояниях происходит снижение активности IgA; в результате у пациентов зачастую возникают кишечные и респираторные инфекции.
Недостаток железа в организме также может сформироваться в результате недостаточного поступления его из пищи по следующим причинам:
- низкий уровень жизни;
- вегетарианство;
- соблюдение диеты, ограничивающей употребление мясных продуктов;
- анорексия;
- искусственное вскармливание детей грудного возраста, особенно при позднем введении прикорма.
Ряд заболеваний и патологических состояний органов пищеварительной системы может приводить к нарушению всасывания железа и развитию железодефицитной анемии:
- гастерэктомия;
- состояние после резекции тонкой кишки;
- синдром мальабсорбции;
- хронический энтерит;
- гипоацидный гастрит;
- кишечные инфекции.
Железодефицитная анемия развивается и у пациентов, страдающих хроническими гепатитами или циррозом печени. В данном случае нарушается транспорт железа из депо.
Железодефицитная анемия может также появиться на фоне повышенной потребности в железе (в период полового созревания, беременности либо лактации) или при значительных потерях этого элемента (при онкологических, инфекционных заболеваниях).
В зависимости от причины железодефицитные анемии делятся следующим образом:
- алиментарные;
- постгеморрагические;
- связанные с нарушением транспорта железа, недостаточностью его резорбции или повышенным расходом;
- обусловленные врожденным (исходным) дефицитом железа.
По степени выраженности лабораторных и клинических признаков железодефицитные анемии бывают:
- легкими (гемоглобин выше 90 г/л);
- средней тяжести (гемоглобин от 70 до 90 г/л);
- тяжелыми (гемоглобин менее 70 г/л).
Железодефицитная анемия легкой степени в большинстве случаев протекает без-каких либо клинических проявлений или с минимальной их выраженностью. Тяжелая форма сопровождается развитием гематологического, сидеропенического и циркуляторно-гипоксического синдромов.
В течении железодефицитной анемии выделяют несколько стадий:
- Предлатентный железодефицит – истощается депонированное железо, гемоглобиновые и транспортные запасы сохранены.
- Латентный железодефицит – происходит снижение запасов содержащегося в плазме крови транспортного железа.
- Собственно железодефицитная анемия – истощение всех метаболических запасов железа (эритроцитарного, транспортного и депонированного).
В клинической картине железодефицитной анемии выделяют синдромы:
- циркуляторно-гипоксический;
- сидеропенический;
- астеновегетативный.
Возникающие на фоне железодефицитной анемии циркуляторно-гипоксические нарушения ухудшают течение сопутствующих заболеваний сердечно-сосудистой и дыхательных систем.
Развитие циркуляторно-гипоксического синдрома обусловлено нарушением синтеза гемоглобина, в результате чего страдает транспорт кислорода и развивается тканевая гипоксия. Клинически это проявляется:
- общей слабостью;
- сонливостью;
- головокружениями;
- шумом в ушах;
- преходящими обмороками;
- учащенным сердцебиением;
- повышенной чувствительностью к низкой температуре;
- одышкой, возникающей при физических нагрузках, а при тяжелой анемии – и в состоянии покоя.
Механизм развития сидеропенического синдрома связан с дефицитом железосодержащих тканевых ферментов (цитохромов, пероксидазы, каталазы). Недостаток названных ферментов становится причиной наблюдаемых на фоне железодефицитной анемии трофических расстройств со стороны слизистых оболочек и кожных покровов. Признаки сидеропенического синдрома:
- сухость кожи;
- деформация, повышенная ломкость и поперечная исчерченность ногтей;
- выпадение волос;
- атрофический гастрит;
- дисфагия;
- ангулярный стоматит;
- глоссит;
- искажения вкуса (желание употреблять в пищу несъедобные предметы, например глину или зубной порошок);
- дизурические расстройства;
- диспепсия;
- мышечная слабость.
Астеновегетативный синдром характеризуется эмоциональной лабильностью, повышенной раздражительностью, ухудшением памяти, снижением работоспособности.
Клиническая картина железодефицитной анемии у детей неспецифична, преобладает один из следующих синдромов:
- Астеновегетативный. Связан с кислородным голоданием тканей нервной системы. Проявляется снижением мышечного тонуса и задержкой психомоторного развития ребенка. При тяжелой степени железодефицитной анемии и отсутствии необходимой терапии возможна интеллектуальная недостаточность. К другим проявлениям астеновегетативного синдрома относят энурез, обморочные состояния, головокружение, раздражительность и плаксивость.
- Эпителиальный. Характеризуется изменениями со стороны кожи и ее придатков. Кожные покровы становятся сухими, в области коленей и локтей развивается гиперкератоз, волосы теряют блеск и активно выпадают. Часто развиваются хейлит, глоссит, ангулярный стоматит.
- Диспепсический. Снижается аппетит вплоть до полного отказа от еды, наблюдаются неустойчивость стула (поносы, чередующиеся с запорами), вздутие живота, дисфагия.
- Сердечно-сосудистый. Развивается на фоне тяжелой железодефицитной анемии и проявляется одышкой, снижением артериального давления, тахикардией, шумами в сердце и дистрофическими изменениями в миокарде.
- Синдром иммунодефицита. Характеризуется немотивированным повышением температуры до субфебрильных значений. Дети подвержены респираторным кишечным инфекциям с тяжелым и (или) затяжным течением.
- Гепатолиенальный. Наблюдается на фоне выраженной железодефицитной анемии, особенно сочетающейся с другими видами анемий или рахитом. Проявляется увеличением размеров печени и селезенки.
В раннем детском возрасте признаки железодефицитной анемии выявляются у каждого второго ребенка.
Диагностика состояния, а также определение степени его тяжести осуществляются по результатам лабораторных исследований. Для железодефицитной анемии характерны следующие изменения:
- снижение содержания гемоглобина в крови (норма для женщин – 120–140 г/л, для мужчин – 130–150 г/л);
- пойкилоцитоз (изменение формы эритроцитов);
- микроцитоз (наличие в крови аномально маленьких по своим размерам эритроцитов);
- гипохромия (цветовой показатель – менее 0,8);
- снижение концентрации сывороточного железа (норма для женщин – 8,95–30,43 мкмоль/л, для мужчин – 11,64–30,43 мкмоль/л);
- уменьшение концентрации ферритина (норма для женщин – 22–180 мкг/л, для мужчин – 30–310 мкг/л);
- уменьшение насыщения трансферрина железом (норма – 30%).
Для эффективного лечения железодефицитной анемии важно установить причину, ее вызвавшую. С целью обнаружения источника хронической кровопотери показано проведение:
- ФЭГДС;
- рентгенографии желудка с контрастированием;
- колоноскопии;
- ирригоскопии;
- ультразвукового исследования органов малого таза;
- исследования кала на скрытую кровь.
По статистическим данным, у 8-10% женщин детородного возраста диагностируется железодефицитная анемия, а у 30% женщин – латентный дефицит железа.
В сложных диагностических случаях выполняют пункцию красного костного мозга с последующим гистологическим и цитологическим исследованием полученного пунктата. Значительное снижение в нем сидеробластов свидетельствует о наличии железодефицитной анемии.
Дифференциальная диагностика проводится с другими видами гипохромных анемий (талассемией, сидеробластной анемией).
Принципы терапии железодефицитной анемии:
- устранение источника хронической кровопотери;
- коррекция рациона;
- восполнение недостатка железа.
Важную роль играет диетотерапия. В рацион включают язык, печень, мясо кролика, баранину, говядину, телятину – продукты, богатые гемовым железом. Для улучшения всасывания железа из желудочно-кишечного тракта необходимы аскорбиновая, янтарная и лимонная кислоты, которые в большом количестве содержатся в свежих фруктах и ягодах. Исключают шоколад, молоко, соевый протеин, чай, кофе, поскольку они ингибируют всасывание железа.
Но только лишь диетой восполнить уже образовавшийся дефицит железа невозможно. Пациенты с железодефицитной анемией проходят заместительную терапию ферропрепаратами длительным курсом (не менее 2-2,5 месяцев).
При тяжелой форме железодефицитной анемии и выраженном циркуляторно-гипоксическом синдроме возникают показания к проведению гемотрансфузии.
Возникающие на фоне железодефицитной анемии циркуляторно-гипоксические нарушения ухудшают течение сопутствующих заболеваний сердечно-сосудистой и дыхательных систем.
При железодефицитных состояниях происходит снижение активности IgA; в результате у пациентов зачастую возникают кишечные и респираторные инфекции.
На фоне длительного течения тяжелой формы железодефицитной анемии у больных может развиться миокардиодистрофия.
Прогноз благоприятный при условии своевременной коррекции дефицита железа и устранения причины развития анемии.
Профилактика железодефицитной анемии включает:
- полноценное рациональное питание;
- ежегодный контроль содержания гемоглобина в крови;
- своевременное устранение источников хронической кровопотери;
- профилактический прием препаратов железа лицами из группы риска.
Видео с YouTube по теме статьи:
Образование: окончила Ташкентский государственный медицинский институт по специальности лечебное дело в 1991 году. Неоднократно проходила курсы повышения квалификации.
Опыт работы: врач анестезиолог-реаниматолог городского родильного комплекса, врач реаниматолог отделения гемодиализа.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
источник
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Анемии, развивающиеся в результате дефицита железа в организме, наиболее широко распространены в клинической практике. По данным ВОЗ около 2,5 млрд. человек на Земле имеют скрытый дефицит железа и 1 млрд. человек страдает железодефицитной анемией (ЖДА). Даже в развитых странах Европы и Северной Америке железодефицитная анемия выявляется у 7,5-11% всех женщин детородного возраста, а у 20-25%наблюдается скрытый тканевой дефицит железа. Значительно большая частота железодефицитных анемий в странах Азии, Африки и Латинской Америки. Из всех анемий, встречающихся в клинической практике, около 80% являются железодефицитными.
Впервые ЖДА описал немецкий врач Иоганесс Ланге в 1554 году, а препараты для ее лечения впервые применил Sydenham в 1600 году.
Для того, чтобы были ясны механизмы развития ЖДА, необходимо иметь представления об обмене железа в организме. В организме здорового человека в среднем содержится 3–4 г железа, 72,9% которого входит в состав гемоглобина ( Hb ), 3,3% — в составе миоглобина и 16,4% находится в запасах (депо) в виде ферритина (80%) и гемосидерина (20%). Наибольшая часть ферритина содержится в плазме и по его уровню можно оценить содержание железа в депо.
Суточная потребность организма в железе составляет 22–24 мг и в основном покрывается за счет железа гема распадающихся эритроцитов. Физиологическая потеря железа с мочой, калом, слущивающимся эпидермисом составляет 0,6– 1,2 мг/сут. у мужчин и 1,5– 2 мг/сут. у женщин (учитывается кровопотеря во время менструального цикла – 25 мг/мес.), и покрывается за счет железа пищи, которого при обычной диете содержится около 14 мг.
В пищевых продуктах железо присутствует либо в виде составной части гема (мясо, рыба), либо как негемовое железо (овощи, фрукты). Органическое железо ( Fe 2+ ) хорошо всасывается (до 20–30%), а неорганическое железо ( Fe 3+ ) – не более, чем на 5%. Всего за сутки в верхних отделах тонкого кишечника абсорбируется 1– 2 мг (или 8-15%) содержащегося в пище железа.
Всасывание железа регулируется эпителиоцитами кишечника: оно возрастает при дефиците железа и блокируется при его избытке в организме. Транспорт железа от кишечной стенки до предшественников эритроцитов и клеток депо (макрофагов) осуществляется плазменным белком – трансферрином. Мерой количества свободного трансферрина в плазме, способного полностью насытиться железом, служит общая железосвязывающая способность (ОЖСС). В норме трансферрин насыщен железом на одну треть. Ненасыщенная железом часть трансферрина обозначается как латентная железосвязывающая способность (ЛЖСС). Большая часть депонированного железа находится в виде гранул в макрофагах или сидерофагах, которые снабжают железом эритробласты. Предшественники эритроцитов, содержащие в своей цитоплазме гранулы железа, получили название сидеробластов и составляют 10-15% всех вызревающих клеток – эритрокариоцитов.
Дефицит железа в организме проходит несколько этапов: сначала наступает латентный дефицит железа, при котором железо исчезает из депо, что определяется по снижению уровня ферритина плазмы и содержания сидерофагов в костном мозге. Затем падает уровень железа сыворотки и возрастает ЛЖСС. На втором этапе выраженного дефицита железа развивается гипохромная анемия с низким содержанием гемоглобина в эритроцитах и иногда – нарушение функции железосодержащих ферментов (цитохромов), что вызывает нарушение окислительных процессов в тканях и трофические расстройства.
В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого гемоглобинизация эритро-нормобластов запаздывает по сравнению с процессом обратного развития ядерных структур. Поскольку синтез гемоглобина из-за дефицита железа страдает в большей степени, чем образование эритроцитов, для железодефицитной анемии при сравнительно умеренном снижении числа эритроцитов свойственно более выраженное падение содержания в них гемоглобина, что проявляется гипохромией эритроцитов.
В зависимости от причин, вызывающих дефицит железа, выделяется 5 групп железодефицитных анемий:
1. Хронические постгеморрагические железодефицитные анемии;
2. Железодефицитные анемии, связанные с нарушением всасывания и поступления его с пищей;
3. Железодефицитные анемии, связанные с недостаточным исходным уровнем железа в организме (чаще у детей);
4. Железодефицитные анемии, обусловленные повышением потребности организма в железе (без кровопотери);
5. Железодефицитные анемии, связанные с нарушением транспорта железа.
Наиболее часто хроническая постгеморрагическая ЖДА встречается у женщин детородного возраста, что связано с обильными и длительными менструациями (у 30% -50% женщин) и частыми родами (чаще 1 раза в 3 года), которые характерны для жительниц Азии, Африки и Латинской Америки. Если кровопотеря за один менструальный цикл превышает 50 – 100 мл (или 25 – 50 мг железа), то недостаток железа сверх этого уровня не компенсируется пищевым железом (обильные и/или продолжительные кровотечения – гиперполименорея, дисфункциональные маточные кровотечения, менометроррагии). У 50% женщин меноррагии имеют органические причины: полипы, эндометрит, миомы, аденомиоз, открывающийся в полость матки. Определенную долю женщин с меноррагиями составляют больные с дисфункцией яичников. Поэтому всех женщин с нарушениями менструального цикла в виде гиперполименореи и менометроррагии обязательно необходимо обследовать у гинеколога. Нередко причиной меноррагий может быть нарушение гемостаза: тромбоцитопении и тромбоцитопатии, болезнь Виллебранда, наследственные или приобретенные дефициты свертывающих факторов VII , X , V и II . Основную роль в высокой частоте ЖДА у женщин, особенно в странах Азии, Африки и Латинской Америки, играют частые беременности и роды. В США анемия среди беременных составляла 9% в первом, 14% — во втором и 37% в третьем триместрах беременности.
Кровопотеря из желудочно-кишечного тракта (ЖКТ) является основной причиной ЖДА у мужчин и неменструирующих женщин. Даже небольшая кровопотеря (5 – 10 мл за сутки) приводит к месячной потере 200 -250 мл крови, что соответствует 100 – 125 мг железа. При такой ситуации ЖДА развивается через 1 – 1,5 года. Следует отметить, что такая кровопотеря не диагностируется при исследовании кала пробами Вебера или Грегерсена, которые положительны при суточной кровопотере в 30 мл. Наиболее чувствительным методом, позволяющим выявить кровопотерю свыше 2,5 мг в сутки, является метка крови по радиоактивному хрому с последующим определением радиоактивности кала.
Желудочно-кишечные кровотечения (ЖКК), характерны для заболеваний желудочно-кишечного тракта: эрозивный гастрит, грыжа пищеводного отверстия диафрагмы, изъязвившийся дивертикул Меккеля (слепой мешок тонкой кишки), неспецифический язвенный колит, болезнь Крона, полипы желудочно-кишечного тракта, дивертикулез толстого кишечника, кровотечение из геморроидальных вен. Одной из частых причин кровопотери из ЖКТ являются опухоли желудка и кишечника, язвы желудка и двенадцатиперстной кишки, анкилостомидоз (одна анкилостома потребляет 0,3 мл крови). Поэтому всех мужчин с выявленной ЖДА обязательно необходимо обследовать у гастроэнтеролога для исключения заболеваний ЖКТ.
Следущей причиной развития ЖДА является кровотечение из расширенных с истонченной стенкой сосудов слизистых оболочек (болезнь Рендю-Ослера), которые наиболее часто выявляются в слизистой носа и высывают хроническое носовое кровотечение.
Дефицит железа может развиться у больных с хроническим внутрисосудистым гемолизом, протекающим с гемоглобинурией. Железо при внутрисосудистом гемолизе выделяется с мочой, так как входит в состав гемоглобина (гемоглобинурия) и гемосидерина (гемосидеринурия). Наиболее часто дефицит железа наблюдается при следующих гемолитических анемиях: пароксизмальной ночной гемоглобинурии и аутоиммунной гемолитической анемии с тепловыми гемолизинами.
Скрытый дефицит железа и ЖДА могут наблюдаться у доноров крови.
В редких случаях постгеморрагическая ЖДА может быть связана с кровоизлияниями в замкнутые полости с последующим нарушением реутилизации железа гема разрушившихся эритроцитов. Такие кровопотери встречаются при гломических (сосудистых) опухолях, при эндометриозе, не связанном с полостью матки. Подобный механизм развития анемии имеет место при изолированном легочном сидерозе, поскольку легочные сидерофаги не способны предавать железо эритробластам.
ЖДА при синдроме мальабсорбции наблюдается при хронических энтеритах (глютеновая энтеропатия, тропическое и нетропическое спру), синдроме Турнера, резекции желудка, осложненной демпинг-синдромом. Следует помнить, сто ЖДА не развивается в результате ахилического гастрита, поскольку органическое железо отлично всасывается при полной ахилии.
Железодефицитные анемии встречаются у 12–13% детей в возрасте от 6 мес. до двух лет. В развивающихся странах этот показатель значительно выше, в Индии, Африканских странах достигает 72–76%. В большинстве случаев железодефицитные анемии детей раннего возраста связаны с антенатальной недостаточностью депонирования железа, обусловленной сидеропеническим состоянием матери.
У подростков, особенно девушек, в период полового созревания, ЖДА, или «ювенильный хлороз», является следствием сочетания нескольких причин: повышения потребности в железе вследствие быстрого роста девушек и появления менструаций, исходно низкого уровня железа и плохого питания (отсутствия мясных продуктов в диете).
Описаны редкие случаи ЖДА, обусловленные наследственным нарушением выработки трансферрина (наследственная атранферринемия).
Со временем дефицит железа прогрессирует, течет долгие годы латентно, а затем, после полного истощения запасов железа в депо, развивается ЖДА.
В настоящее время выделяется несколько стадий дефицита железа:
1. Предрасположенность к развитию железодефицита (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических заболеваний ЖКТ или женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции 59 Fe 3+ в ЖКТ, которое может превышать 50% (в норме 10 – 15%)
3. Латентный дефицит железа. Характеризуется развитием сидеропенического синдрома, снижением запасов железа в организме по данным лабораторных исследований.
4. ЖДА. Диагноз устанавливается при снижении концентрации гемоглобина ниже 120 г/л у женщин и 130 г/л у мужчин. Выделяется несколько стадий ЖДА:
— регенераторная стадия, характеризующаяся повышением выработки эритроцитов в ответ на гипоксию, связанную со снижением концентрации гемоглобина и появлением микроцитарных гипохромных форм эритроцитов. Основными лабораторными критериями являются ретикулоцитоз, расширение эритроидного ростка костного мозга;
— гипорегенераторная стадия, при которой формируется истинная недостаточность кроветворения, связанная с неэффективным эритропоэзом. На этой стадии выявляется эритроцитопения, ретикулоцитопения, сужение эритроцитарного ростка костного мозга.
Клиническая картина железодефицитных анемий складывается из общеанемических симптомов, связанных с недостаточным обеспечением тканей кислородом (слабости, головокружения, сердцебиения, одышки, обмороков), сидеропенических симптомов, свойственных только дефициту железа и заболеваний, приводящих к развитию ЖДА.
К сидеропеническим симптомам стоит отнести:
— мышечную слабость, не соответствующую степени анемии;
— извращение вкуса ( picachlorotica ) в виде стремления есть несъедобные вещества (мел, уголь, глину), сырые продукты (сырые крупы, тесто, сырой мясной фарш), а также пристрастие к необычным запахам (керосина, мазута, бензина, ацетона, гуталина, нафталина, выхлопных газов машин);
— выпадение волос и сухость кожи с образованием трещин, особенно часто в уголках рта (ангулярный стоматит);
— изменения ногтей: ломкость, появление исчерченности, вогнутости (койлонихии);
— болезненность и очаговое покраснение слизистой языка с атрофией сосочков («географический язык»);
— дисфагия, характеризующаяся затруднением глотания сухой пищи и развитием болезненных спазмов пищевода (синдром Пламмера-Вильсона);
— дизурические расстройства (недержание мочи, ночной энурез).
Наиболее характерным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. Количество ретикулоцитов зависит от стадии ЖДА, может быть несколько выше или несколько ниже нормы, но не более чем в 5 — 10 раз. Выраженный ретикулоцитоз (более 100 ‰ ) является признаком активного кровотечения или гемолиза, что позволяет провести необходимые дифференциально диагностические мероприятия.
О гипохромии эритроцитов свидетельствуют:
— среднее содержание гемоглобина в эритроците ( MCH )
— средняя концентрация гемоглобина в эритроците (МСНС)
О микроцитозе свидетельствуют:
— средний диаметр эритроцита (СДЭ)
— средний объем эритроцита ( MCV )
Уровень сывороточного железа снижен
Об истощении запасов железа при ЖДА свидетельствуют низкие цифры ферритина сыворотки
В костном мозге в регенераторную стадию обнаруживается умеренное или даже резкое преобладание красного ростка (до 40 – 60% всех ядросодержащих клеток костного мозга) и признаки нарушения гемоглобинизации эритрокариоцитов в виде увеличения количества базофильных и полихроматофильных эритробластов за счет уменьшения содержания оксифильных форм (содержащих гемоглобин). Характерной особенностью костного мозга является почти полное отсутствие сидеробластов – эритрокариоцитов, содержащих гранулы железа, которые в норме составляют 10– 15% предшественников эритроцитов. Окраска костного мозга на присутствие гранул железа при этом дает отрицательные результаты. В гипорегенераторную стадию отмечается снижение содержания эритрокариоцитов до 10 — 20%, в периферической крови выраженная эритроцитопения, отсутствие ретикулоцитоза или даже ретикулоцитопения.
Диагноз железодефицитной анемии можно считать установленным, если у больного обнаружены лабораторные признаки и найдены причины её развития ЖДА.
Лабораторные признаки ЖДА:
1. гипохромная микроцитарная анемия;
2. низкий уровень сывороточного железа и высокие цифры трансферрина при высокой ОЖСС и ЛЖСС, низком насыщении трансферрина;
3. отсутствие запасов железа в депо, о чем свидетельствуют низкий уровень сывороточного ферритина, отсутствие в костном мозге гранул ферритина и гемосидерина, а также сидеробластов и сидерофагов, содержащих эти гранулы.
После подтверждения диагноза железодефицитной анемии необходимо установить причину дефицита железа. У женщин детородного возраста следует оценить величину кровопотери во время одного менструального цикла, принять во внимание число беременностей и родов, а у мужчин и женщин в менопаузе практически всегда нужно привести исследование желудочно-кишечного тракта на предмет явных и скрытых кровотечений и заболеваний, их вызывающих. Эти исследования должны включать определение крови в каловых массах (проба Грегерсена или проба с Cr 51 ), эзофагогастродуоденоскопию, колоноскопию, ректороманоскопию. Следует принимать во внимание симптомы хронического энтерита, демпинг-синдрома и синдрома мальабсорбции. В странах, где распространен анкилостомидоз, обязательным является исследование кала на яйца глист.
Несмотря на весь комплекс исследований, в 5% случаев причину ЖДА установить не удается. Нередко это связано с кровопотерей из тонкого кишечника, не доступного для ректороманоскопии и колоноскопии. Применение беспроводной капсульной эндоскопии позволяет выявить наличие дивертикула Меккеля, опухолей, ангиодисплазий, телеангиоэктазий и возможного кровотечения из этих источников.
Наиболее точным критерием подтверждающим диагноз ЖДА является прирост концентрации Н b более чем на 10 г/л через четыре недели после начала приема препаратов железа. При приросте Hb менее 10 г/л необходимо дообследование для исключения продолжающегося кровотечения или пересмотр диагноза ЖДА (критерии ВОЗ).
Дифференциальная диагностика микроцитарных гипохромных анемий
Диагностические признаки
Гетерозиготная талассемия
Анемия хронической болезни
источник
А.Л.Тихомиров, С.И.Сарсания, А.А.Кочарян
Кафедра акушерства и гинекологии лечебного факультета МГМСУ
Железодефицитная анемия (ЖДА) является общенациональной проблемой систем здравоохранения различных стран. Если в странах Западной Европы и США вопросы, связанные с дефицитом Fe, во многом решаются благодаря реализации программы Всемирной организации здравоохранения (ВОЗ) «Гемоглобиновое оздоровление населения», то для ряда государств, в том числе и России, дефицит Fe остается серьезной медико-социальной проблемой.
Несмотря на возросший интерес врачей к этой проблеме и большой арсенал лекарственных средств для лечения, число больных железодефицитной анемией неуклонно растет. Учитывая данные многолетних исследований, это, на наш взгляд, связано с неадекватным ведением этапов прелатентного и латентного дефицита железа, неадекватным назначением терапевтических доз, низким комплаенсом к проводимой терапии, отсутствием достаточного по времени этапа поддерживающей терапии, недостаточно активное проведение профилактических мероприятий в группах риска. К тому же мероприятия, направленные на борьбу с анемией, должны соответствовать принципам доказательной медицины.
ЖДА — клинико-гематологический симптомокомплекс, характеризующийся нарушением образования гемоглобина вследствие дефицита железа в сыворотке крови и костном мозге, а также развитием трофических нарушений в органах и тканях. По данным ВОЗ, в мире, население которого сейчас приближается к 6 млрд человек, около 2 млрд страдает ЖДА.
Из всех анемий 80% составляет ЖДА. Возрастные группы, в которых анемия встречается чаще, — это женщины детородного возраста, беременные и дети 12-17 лет. Распространенность ЖДА у детей меняется с возрастом. В период быстрого роста дефицит железа достигает 50% и превалирует у девочек (они быстрее растут, и у них появляются менструальные кровопотери). Среди детей от многоплодной беременности и детей с опережающим обычные нормы ростом ЖДА на первом году жизни выявляется более чем в 60% случаев. В пожилом возрасте половые различия постепенно исчезают, и даже отмечается преобладание мужчин с дефицитом железа. По данным официальной статистики Минздрава России, из числа родивших женщин в 1995 г. имели анемию 34,4%, а в 2000 г. — 43,9%- В отдельных группах населения частота встречаемости железодефицитных состояний достигает 50% и даже 70-80%. Дефицит железа, по данным ВОЗ 1992 г., определяется у 20-25% всех младенцев, 43% детей в возрасте до 4 лет и до 50% подростков (девочки).
Скрытый дефицит железа (предстадия ЖДА, латентная анемия, «анемия без анемии») характеризуется:
Обмен железа в организме включает следующие процессы:
Критерии постановки диагноза ЖДА
1. Снижение уровня гемоглобина, цветового показателя.
2. Уровень эритроцитов, как правило, снижен, но возможны случаи ЖДА с нормальным уровнем эритроцитов, но сниженным гемоглобином. Гипохромные анулоциты, склонность к микроцитозу, анизо- и пой-килоцитозу (неодинаковая величина, разные формы). Снижается среднее содержание гемоглобина в эритроците. Осмотическая резистентность эритроцитов нормальная или несколько повышена.
3. Снижение уровня сывороточного железа (гипоферремия).
4. Повышение общей железосвязывающей способности сыворотки (ОЖСС). Вычитая из ОЖСС уровень сывороточного железа, определяют латентную железосвязывающую способность сыворотки (норма 28,8-50,4 мкмоль/л), при дефиците железа она повышена.
5. Снижение насыщения трансферрина железом. Насыщение трансферрина железом может снижаться при воспалении, инфекции, злокачественных новообразованиях, болезнях печени, нефротическом синдроме, а увеличиваться при беременности, применении оральных контрацептивов.
6. Гематокрит используют для оценки выраженности анемии, при которой, как правило, отмечается его снижение.
7. Уровень ретикулоцитов чаще нормальный. Небольшое повышение происходит при значительной кровопотере, а также при лечении препаратами железа.
8. Уменьшение запасного фонда железа (снижение ферритина сыворотки). По мнению многих исследователей, одного этого показателя достаточно для выявления анемии, однако повышение ферритина как острофазового белка при наличии в организме воспалительного процесса может маскировать дефицит железа, при беременности может не соответствовать степени анемии (влияние субклинически протекающих инфекций), поэтому для установления правильного диагноза следует использовать комплекс клинико-морфобиохимических критериев.
9. Нередко тенденция к лейкопении, количество тромбоцитов чаще нормальное, при более выраженной кровопотере возможен тромбоцитоз.
10. Десфераловый тест (снижение выведения железа с мочой).
Наряду с истинной ЖДА существует скрытый дефицит железа, который в Европе и России составляет 30-40%, а в некоторых регионах (Север, Северный Кавказ, Восточная Сибирь) — 50-60%.
Основным источником железа для человека являются пищевые продукты животного происхождения (мясо, свиная печень, почки, сердце, желток), которые содержат железо в наиболее усвояемой форме (в составе гема). Количество железа в пище при полноценном и разнообразном питании составляет 10-15 мг в сутки, из которых только 10-15% усваивается организмом. Усвоение железа из продуктов снижается после их тепловой обработки, при замораживании, длительном хранение.
Железо — жизненно важный для человека элемент, входит в состав гемоглобина, миоглобина, играет первостепенную роль во многих биохимических реакциях. Находясь в комплексе с порфирином и будучи включенным в структуру соответствующего белка, железо не только обеспечивает связывание и высвобождение кисло рода, но и принимает участие в ряд 2+ в сутки не следует, так как объем его всасывания при этом не увеличивается. Суточная доза препаратов железа определяется этапом терапии. Количество таблеток, капсул, капель подбирается с учетом содержания элементарного железа в одной таблетке, капсуле.
Таким образом, при выборе препарата для лечения ЖДА не должно возникать никаких трудностей. Врач, знающий об адекватной терапевтической дозе, веществах, повышающих всасывание железа, о длительности терапии легко сможет преодолеть вместе с пациентом болезнь.
В нашей практике для лечения ЖДА, скрытого дефицита железа, мы использовали препарат «Тотема».
Преимущества состава Тотемы:
Глюконат железа
Роль меди и марганца в организме человека
Эффективная доза выражается через количество элементарного железа. Для взрослых она составляет от 100 до 200 мг (20-40 мл препарата «Тотема») железа в день (2-3 мг/кг), что соответствует реальному усвоению примерно 30 мг железа. Для маленьких детей (до 10 лет) доза уменьшается в 2 раза и составляет от 50-100 мг железа в день. Грудные дети могут переносить более высокие дозы: 5 мг/кг/день. Для беременных женщин в профилактических целях рекомендуется назначать 50 мг в сутки (10 мл препарата «Тотема») в течение двух последних триместров беременности. Соли двухвалентного железа лучше усваиваются натощак. Дозы должны быть распределены на 3 ежедневных приема. Содержимое ампулы растворяют в простой или подслащенной воде или в другом безалкогольном напитке. Пациентам с сахарным диабетом следует учитывать, что 10 мл препарата содержат 3 г сахарозы.
Тотема быстро повышает гемоглобин, восстанавливает депо железа в организме, что позволяет компенсировать ЖДА при подготовке к родам и гинекологическим операциям. Также важно, что при работе с Тотемой отмечали высокий комплаенс, что незамедлительно сказалось на результатах лечения. Приятный вкус препарата был оценен пациентками.
Литература
1. Аркадьева Г.В. Диагностика и лечение ЖДА. М., 1999
2. Воробьев П. А. Анемический синдром в клинической практике. М: Ньюдиамед, 2001; 168 с.
3. Дворецкий Л.И. ЖДА.- М.: Ньюдиамед-АО, 1998.
4. Ковалева Л. Железодефицитная анемия. М.: Врач, 2002; 12: 4-9.
5. Серов В.Н., Орджоникидзе Н.В. Анемия — акушерские и перинатальные аспекты. РМЖ. М.: ООО «Волга-Медиа», 2004; 12, 1 (201): 12-5.
6. Харрисон Г.Р. Внутренние болезни. Т.
7. М.: Медицина, 1996; с. 572-877. Шехтман М.М. Экстрагенитальная патология и беременность. М.: Медицина, 1987; с. 143-155.
8. Шеффер Р.М., Гаше К, Хух Р., Краффт А. Железное письмо: рекомендации по лечению жепезодефицитной анемии. Гематол. и трансфузиол. 2004; 49 (4): 40-8.
9. Perewusnyk G, Нuсh R. Huch А, Вrеуmаnn С. British Jornal of Nutrition 2002; 88: 3-10.
источник
Обмен железа: всасывание, транспорт кровью, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз.
Железо. В цельной крови железо содержится в основном в эритроцитах (около 18,5 ммоль/л), в плазме концентрация его составляет в среднем 0,02 ммоль/л. Ежедневно в процессе распада гемоглобина эритроцитов в селезенке и печени освобождается около 25 мг железа и столько же потребляется при синтезе гемоглобина в клетках кроветворных тканей. В костном мозге (основная эритропоэтическая ткань человека) имеется лабильный запас железа, превышающий в 5 раз суточную потребность в железе. Значительно больше запас железа в печени и селезенке (около 1000 мг, т.е. 40-суточный запас). Повышение содержания железа в плазме крови наблюдается при ослаблении синтеза гемоглобина или усиленном распаде эритроцитов.
При анемии различного происхождения потребность в железе и всасывание его в кишечнике резко возрастают. Известно, что в двенадцатиперстной кишке железо всасывается в форме двухвалентного железа. В клетках слизистой оболочки кишечника железо соединяется с белком апоферритином и образуется ферритин. Предполагают, что количество поступающего из кишечника в кровь железа зависит от содержания апоферритина в стенках кишечника. Дальнейший транспорт железа из кишечника в кроветворные органы осуществляется в форме комплекса с белком плазмы крови трансферрином. Железо в этом комплексе трехвалентное. В костном мозге, печени и селезенке железо депонируется в форме ферритина – своеобразного резерва легкомобилизуемого железа.
Недостаток железа в организме может вызвать нарушение последнего этапа синтеза гема – превращение протопорфирина IX в гем. Как результат этого развивается анемия, сопровождающаяся увеличением содержания порфиринов, в частности протопорфирина IX, в эритроцитах.
Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При желе-зодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях снижается концентрация ферритина. Причина этих изменений — недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках.
Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных отложений избыточного железа ферритин превращается в гемосидерин . Гемосидерин плохо растворим в воде и содержит до 37% железа. Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке приводит к повреждению этих органов — гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике, при этом содержание железа в организме больных может достигать 100 г. Это заболевание наследуется по ауто-сомно-рецессивному типу, причём около 0,5% европеоидов гомозиготны по гену гемохрома-тоза. Накопление гемосидерина в поджелудочной железе приводит к разрушению β-клеток островков Лангерханса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах — сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови состав-ляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой.
Альбумин — глобулиновый коэффициент — соотношение альбуминов и глобулинов крови, величина в норме относительно постоянная (1,5—2,3). При определении альбумин — глобулинового коэффициента обычно пользуются методом высаливания, используя различия в растворимости альбуминов и глобулинов, или путем электрофореза сыворотки. Уменьшение альбумин — глобулинового коэффициента, характерное для многих патологических состояний, может быть связано как с увеличением глобулиновой фракции (острые инфекции, хронические воспалительные процессы), так и с уменьшением количества альбуминов (цирроз,гепатиты и другие заболевания печени).
Энзимодиагностика – это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатдегидрогеназа, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах.
С другой стороны, заболевания тех или иных органов всегда сопровождаются специфичным «ферментативным профилем». Например, инфаркт миокарда сопровождается увеличением активности лактатдегидрогеназы, креатинкиназы, аспартатаминотрансферазы .
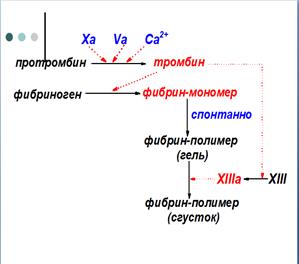
145. Свертывающая система крови. Этапы образования фибринового сгустка. Внутренний и внешний пути свертывания и их компоненты.
В остановке кровотечения различают 3 этапа.
На первом этапе происходит сокращение кровеносного сосуда. Затем к месту повреждения прикрепляются тромбоциты, которые, наслаиваясь друг на друга, образуют тромбоцитарную пробку (белый тромб). Белый тромб является непрочным и может закупорить только небольшой кровеносный сосуд.
На третьем этапе растворимый белок плазмы крови фибриноген превращается в нерастворимый белок фибрин, который откладывается между тромбоцитами, и формируется прочный фибриновый тромб. Такой тромб содержит эритроциты и поэтому называется красным тромбом.
Образованию фибринового тромба предшествует каскад протеолитических реакций, приводящий к активации фермента тромбина, который и превращает фибриноген в фибрин. Все белки, участвующие в свёртывании крови, называют факторами свёртывания. Они синтезируются в основном в печени и клетках крови в виде неактивных предшественников, обозначаются римскими цифрами, но имеют и тривиальные названия. Большинство этих белков активируется в каскаде ферментативных реакций свёртывания крови. Активные формы этих белков обозначают такими же римскими цифрами, но с добавлением буквы «а».
146. Принципы образования и последовательность фукционирования ферментных комплексов прокоагулянтного пути. Роль витамина К в свертывании крови.
Для остановки кровотечения из капилляров и сосудов необходимо быстрое образование прочного тромба, препятствующего потере крови.
Это достигается каскадом ферментативных реакций с механизмами усиления на многих этапах.
Прокоагулянтный путь занимает центральное место в свёртывании крови.
В циркулирующей крови содержатся проферменты протеолитических ферментов: фактор II (протромбин), фактор VII (проконвертин), фактор IX (Кристмаса), фактор X (Стюарта). Находящиеся в крови факторы Vа (акцелерин) и VIIIa (антигемофильный фактор), а также мембранный белок — тканевый фактор (ТФ, фактор III) являются белками-активаторами этих ферментов.
При повреждении сосуда «включается» каскадный механизм активации ферментов с последовательным образованием трёх связанных с фосфолипидами клеточной мембраны ферментных комплексов. Каждый комплекс состоит из протеолитического фермента, белка-активатора и ионов Са 2+ : VIIa-TФ-Ca 2+ , IXa-VIIIa-Ca 2+ (теназа), Xa-Va-Ca 2 + (протромбиназа) (рис. 14-12). Комплекс Xa-Va-Са 2 + (протром-биназный комплекс) активирует протромбин(фактор II). Каскад ферментативных реакций завершается образованием мономеров фибрина и последующим формированием тромба.
В активации ферментов каскада выделяют три основных механизма: частичный проте-олиз, взаимодействие с белками-активаторами и взаимодействие с модифицированными клеточными мембранами.
Взаимодействие ферментных комплексов с клеточными мембранамипроисходит с участием ионов Са 2+ . Все проферменты прокоагулянтного пути (II, VII, IX, X) содержат остатки γ-карбоксиглу-таминовой кислоты, образующиеся в результате посттрансляционой модификации этих белков в ЭР гепатоцитов.
Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXа и Xа обеспечивают взаимодействие этих ферментов посредством Са 2+ с отрицательно заряженными фосфолипидами клеточных мембран. В отсутствие ионов Са 2+ кровь не свёртывается.
Ферментные мембранные комплексы прокоагу-лянтного пути образуются только при наличии на внешней поверхности плазматической мембраны клеток тканевого фактора и отрицательно заряженных фосфолипидов. Поперечная асимметрия плазматических мембран, в частности, определяется преобладанием в наружном слое нейтральных фосфолипидов (фосфатидилхолина и сфингомиелина), а во внутреннем — отрицательно заряженных (фосфатидилинозитолбис-фосфата и фосфатидилсерина). Специальная ферментная система обеспечивает трансмембранный перенос и такое распределение фосфолипидов в клеточных мембранах, при котором в норме внешняя поверхность плазматических мембран клеток не заряжена.
При нарушении поперечной асимметрии мембран тромбоцитов и эндотелиальных клеток на их поверхности формируются отрицательно заряженные (тромбогенные) участки и экспонируется апопротеин III тканевого фактора. Такие нарушения могут возникнуть при физической травме. В этом случае тканевый фактор и внутренняя поверхность клеточной мембраны становятся доступными для плазменных факторов прокоагулянтного пути.
Биологическая функция витамина К связана с его участием в процессе свёртывания крови. Он участвует в активации факторов свёртывания крови: протромбина (фактор II), проконвертина (фактор VII), фактора Кристмаса (фактор IX) и фактора Стюарта (фактор X). Эти белковые факторы синтезируются как неактивные предшественники. Один из этапов активации — их карбоксилирование по остаткам глутами-новой кислоты с образованием γ-карбок-сиглутаминовой кислоты, необходимой для связывания ионов кальция.
источник