Анемия – состояние, характеризующееся снижением гемоглобина и почти всегда эритроцитов в крови. У мужчин анемия возникает при уровне гемоглобина менее 130 г/л, эритроцитов – 4 *1012/л. У женщин аналогичные показатели составляют – 120 г/л и 3,8 * 1012/л соответственно.
В основу клинических проявлений положен дефицит эритроцитов и гемоглобина. Нехватка этого белка приводит к неспособности поддерживать газообмен крови на необходимом уровне.
Анемия может быть относительной и абсолютной. Абсолютная вызвана снижением уровня красных кровяных клеток. Относительная – является результатом процесса, происходящего в организме. Одним из таких может быть:
- увеличение объёма плазмы;
- беременность;
- недостаточность сердца;
- острая потеря крови;
- переливание кровезаменителей.
Для того чтобы немножко разбираться в анемии, разберём её основную классификацию.
- гипохромные – цветовой показатель ниже нормы (менее 0,85). Характерно для железодефицитной анемии и талассемии;
- нормохромные – цветовой показатель в пределах нормы;
- гиперхромные – повышен цветовой показатель (более 1,1). Характерно для мегалобластных анемий.
Цветовой показатель показывает степень насыщения эритроцита гемоглобином. В норме составляет 0,85 – 1,05. Высчитывается он следующим образом:
Цветовой показатель = (гемоглобин * 3)/ первые три цифры показателя уровня эритроцитов.
Например, гемоглобин составляет 140 г/л, а число эритроцитов – 4,5*1012/л. Тогда цветовой показатель будет равен 140 * 3/450 = 0,93. Это соответствует нормальному значению.
- лёгкая степень – уровень гемоглобина не опускается ниже 90 г/л;
- средняя степень – концентрация гемоглобина составляет 70 – 90 г/л;
- тяжёлая степень – содержание гемоглобина в крови менее 70 г/л.
- арегенераторная – характерно отсутствие ретикулоцитов в крови, такое может быть, например, при апластической анемии;
- гипорегенераторная – низкое содержание ретикулоцитов в крови. Наблюдается при железодефицитной анемии;
- норморегенераторная – уровень ретикулоцитов в пределах нормы;
- гиперрегенераторная – количество ретикулоцитов выше нормы, характерно для гемолитической анемии.
Регенераторная способность костного мозга оценивается по уровню ретикулоцитов крови. В норме их содержание в крови составляет 2 – 12‰ или 0,2 – 1,2%.
- в результате потери эритроцитов. Анемия возникает при кровопотере (острой или хронической);
- в результате повышенного разрушения красных кровяных клеток. Это приводит к развитию гемолитической анемии;
- вследствие нарушения образования эритроцитов и гемоглобина. Примером такого механизма развития является мегалобластная анемия.
Микросфероцитарная гемолитическая анемия (болезнь Минковского — Шоффара)
В основе данной патологии лежит дефект, в результате которого нарушается взаимодействие спектрина и анкирина – белков мембраны эритроцита, что приводит к нарушению её проницаемости.
Микросфероцитарная гемолитическая анемия наследуется по аутосомно-доминантному типу. Заподозрить это заболевание можно по проявлению гемолитического синдрома (желтуха, спленомегалия), развитию анемии. При развитии микросфероцитоза в детском возрасте могут быть деформации костей скелета, отставание в развитии. Может манифестировать и лёгкая форма без ярко-выраженных клинических признаков.
Явным диагностическим признаком наличия у пациента болезни Минковского — Шоффара является:
- микросфероцитарная форма эритроцитов;
- низкая осмотическая резистентность эритроцитов;
- присутствует ретикулоцитоз – повышение уровня ретикулоцитов.
Данная патология может сопровождаться гемолитическим кризом.
Овалоцитарная гемолитическая анемия
Наследственный овалоцитоз, эллиптоцитоз – другие названия овалоцитарной гемолитической анемии. Это редко встречаемая форма, при которой снижается стабильность мембраны эритроцитов.
По большей части овалоцитоз протекает без каких-либо симптомов, лишь у 10% возможно развитие более тяжёлого состояния.
Клинически проявления ничем не отличаются от болезни Минковского — Шоффара. Дифференциальная диагностика между овалоцитозом и микросфероцитозом проводится в основном по форме эритроцитов.
Акантоцитоз – заболевание, которое наследуется по аутосомно-рецессивному типу. Обычно такое состояние возникает при абеталипопротеинемии. При данной патологии снижается уровень триглицеридов, холестерина, что сказывается на строении мембраны эритроцитов. При акантоцитозе красные кровяные клетки принимают форму листа аканта. Эритроциты разрушаются внутриклеточно в селезёнке.
К клиническим симптомам помимо признаков анемии и гемолитического синдрома добавляется пигментный ретинит (заболевание глаз), тремор рук, атаксия.
Особенностью акантоцитоза являются форма эритроцитов при микроскопии – клетки с зубчатым контуром.
Дефицит глюкозо-6-фосфатдегидрогеназы
Дефицит глюкозо-6-фосфатдегидрогеназы приводит к гемолизу эритроцитов. Этот фермент катализирует реакцию образования НАДФН. При дефиците НАДФН эритроцит и гемоглобин разрушаются.
Дефицит глюкозо-6-фосфатдегидрогеназы является наиболее распространённой гемолитической анемией, связанной с дефектом фермента.
Провоцирующим фактором являются инфекционные заболевания, вдыхание пыльцы растений, употребление конских бобов, некоторых лекарственных средств (их список представлен ниже).
Первыми признаками развития гемолитической анемии при приёме лекарств является пожелтение склер и потемнение мочи. Если не прекратить их употребление, то в дальнейшем может развиться гемолитический криз.
Гемолиз внутри сосудов может привести к поражению микроциркуляции, образованию тромбов и, как следствие, поражению почек.
Диагноз дефицита глюкозо-6-фосфатдегидрогеназы подтверждается определением уровня этого фермента в крови.
Дефицит пируваткиназы
Пируваткиназа катализирует реакцию, в ходе которой образуется АТФ (аденозинтрифосфат), являющийся энергетическим субстратом. АТФ обеспечивает много процессов клетке, например, поддерживает необходимую концентрацию ионов внутри клетки.
При дефиците пируваткиназы снижается уровень АТФ, нарушается электролитный состав клетки, что приводит к сморщиванию эритроцита. В таком виде клетки с трудом выполняют свои функции по транспорту газов в крови.
Чаще всего клинические симптомы появляются при возникновении тяжёлых форм дефицита пируваткиназы, которые проявляются с рождения. Часто бывают гемолитические кризы.
При кризах в крови:
- повышен непрямой билирубин;
- ретикулоцитоз до 70%.
Криз может быть спровоцирован беременностью или инфекционным процессом.
Диагноз также подтверждается уровнем фермента в крови.
Изменение структуры гемоглобина также может являться причиной развития гемолитической анемии. Выделяют качественные и количественные гемоглобинопатии.
К количественным относится талассемия, обусловленная генетическим дефектом строения цепей гемоглобина. В результате нарушается процесс переноса кислорода к тканям. Различают альфа-талассемию и бета-талассемию. Бывают также лёгкие бессимптомные и тяжёлые формы.
При талассемиях изменяется состав фракций гемоглобина, превалирует фетальный (HbF). Вовремя назначенное лечение снижает риск развития неблагоприятного исхода.
К качественным гемоглобинопатиям относится серповидноклеточная анемия. Это заболевание распространено в станах Африки, Индии, Азии. Дефект в строении молекулы гемоглобина приводит к изменению формы эритроцитов на серповидные. Продолжительность таких видоизменённых красных кровяных клеток составляет 17 дней.
Для лиц с серповидноклеточной анемией характерна устойчивость к воздействию малярийного плазмодия. Эритроциты так изменены, что паразит просто не может проникнуть в них.
Характерными симптомами серповидноклеточной анемии являются боли в суставах, их симметричное опухание, боли в животе, увеличение селезёнки, пожелтение кожи.
Диагноз подтверждается по наличию HbS и серповидной формы эритроцитов.
Данная группа заболеваний обусловлена возникновением антител против собственных эритроцитов крови, в результате чего они агглютинируют и разрушаются. Существует подразделение аутоиммунной гемолитической анемии на:
- аутоиммунная гемолитическая анемия, при которой образуются неполные тепловые агглютинины;
- аутоиммунная гемолитическая анемия с образованием тепловых гемолизинов;
- аутоиммунная гемолитическая анемия с образованием полных холодовых агглютининов;
- аутоиммунная гемолитическая анемия с двухфазными гемолизинами.
Чаще всего аутоиммунная гемолитическая анемия развивается у детей до 10 лет или у взрослых после 40.
Диагностика аутоиммунной анемии должна включать проведение прямой и непрямой пробы Кумбса.
В таблице 2 представлена краткая характеристика разновидности аутоиммунной гемолитической анемии.
| Разновидность | Иммунный фактор | Клинические проявления |
| Аутоиммунная гемолитическая анемия, развитие которой обусловлено неполными тепловыми агглютининами | Тепловые агглютинины, которые могут появиться при антибиотикотерапии. | Анемический синдром, |
Гемолитический синдром
Гемолитическая болезнь плода и новорождённого
Данное заболевание является разновидностью аутоиммунной гемолитической анемии. Развивается при несовместимости матери и плода по резус-фактору: мама резус-отрицательная, а ребёнок резус-положительный.
Кровь ребёнка, так или иначе, попадает в организм матери. В результате этого начинают вырабатываться антитела против эритроцитов ребёнка. Они попадают в организме плода, вызывают гемолиз эритроцитов.
Гемолитическая анемия у детей в первые дни будет сопровождаться такими симптомами, как гемолитическая желтуха, повышение непрямого билирубина в крови, стеркобилина в кале и уробилина в моче, увеличение печени и селезёнки, увеличение ретикулоцитов.
Основными причинами гемолитической анемии могут быть инфекции, лекарственные средства, токсины.
Обусловленные инфекцией
Малярийный плазмодий в процессе своего жизненного цикла в эритроцитах способен вызывать их гемолиз.
Гемолитико-уремический синдром – патологическое состояние, для которого характерно развитие тромбоцитопении, азотемии и гемолитической анемии. Чаще всего данная патология развивается у детей. Опасно при этом поражение почек. Причиной развития этого синдрома является кишечная инфекция (E. coli).
Обусловленные механическим повреждением эритроцитов
- Травма с микроангиопатическим гемолизом. Причина травмирования эритроцитов может быть различной:
- маршевая гемоглобинурия;
- дефект протезов клапана сердца или развитие стеноз аортального клапана;
- ДВС-синдром;
- злокачественная артериальная гипертензия.
В анализах крови наблюдается повышенный уровень лейкоцитов, низкий уровень тромбоцитов, факторов свёртывания, MCV.
- Маршевая гемоглобинурия. Механическое разрушение эритроцитов происходит в капиллярах стоп. Основным клиническим проявлением является появление чёрной мочи после длительной ходьбы. После прекращения ходьбы моча приобретает нормальный цвет. Такая форма гемолитической анемии встречается редко. Из всех выявленных случаев чаще всего болели мужчины, у которых имелась значительная нагрузка на ноги – ходьба, марш, бег.
- Химические вещества. Эти вещества могут вызывать окисление гемоглобина, также приводят к образованию радикалов и перекиси водорода, что в дальнейшем может привести к кислородному взрыву и гемолизу клеток. Гемолиз эритроцитов могут вызывать:
- сапонин;
- фенилгидразин;
- мышьяк;
- свинец;
- токсины грибов;
- и другие.
- Ожоговая болезнь. При ожоговой болезни может отмечаться гемолиз эритроцитов. Его проявления видны не сразу. В послешоковом периоде происходит снижение уровня гемоглобина, эритроцитов, иногда появляется желтуха. В моче может присутствовать гемоглобин при тяжёлых случаях.
- Тромботическая тромбоцитопеническая пурпура (болезнь Мошковица).Заболевание развивается внезапно и его основными признаками могут быть:
- снижение уровня тромбоцитов в крови;
- геморрагический синдром (кровотечения различной локализации);
- снижение гемоглобина;
- нарушения сознания;
- судороги;
- лихорадка;
- поражение почек;
- ретикулоцитоз;
- повышение билирубина;
- наличие шизоцитов в крови (1 – 18%).
Гемолитическая анемия симптомы имеет общие для всех её разновидностей. Клинические проявления гемолитической анемии обширны. Но основными являются анемический и гемолитический синдромы.
Проявления анемического синдрома:
- бледная кожа и слизистые оболочки;
- головокружение;
- слабость;
- быстрая утомляемость;
- наличие одышки при физической нагрузке;
- учащённое сердцебиение.
Проявления гемолитического синдрома:
- спленомегалия – увеличение селезёнки в размерах;
- потемнение мочи;
- кожа и слизистые приобретают жёлтый окрас.
Клинические симптомы характерные для конкретной формы гемолитической анемии мало отличаются между собой.
К осложнениям, которые могут развиться при гемолитической анемии, относятся:
- появление сердечной недостаточности;
- появление почечной недостаточности;
- разрыв селезёнки;
- гемолитический криз.
Диагностические мероприятия по выявлению гемолитической анемии подразделяются на две составляющие:
- диагностика процесса гемолиза;
- выявление источника разрушения эритроцитов.
Разрушение эритроцитов может происходить внутри клеток путём переваривания неправильных эритроцитов фагоцитами. Обычно это происходит в селезёнке. Также гемолиз красных кровяных клеток может происходить внутри сосудистого русла под действием циркулирующих, например, антител.
Как узнать, каким образом происходит разрушение эритроцитов, помогут следующие показатели, представленные в таблице 3.
Таблица 3. Лабораторные показатели, свидетельствующие о внутриклеточном и внутрисосудистом гемолизе
| Вид гемолиза | Лабораторный показатель |
| Внутриклеточный | Обнаружение гемосидерина (продукт окисления избытка свободного гемоглобина) в моче. Обнаружение гемоглобина в моче (вследствие быстрого разрушения эритроцитов). |
| Внутрисосудистый | Снижение эритроцитов, гемоглобина, повышение ретикулоцитов. Увеличение непрямого билирубина. Патологические эритроциты могут встречаться в мазках крови. |
После того, как по анализам крови понятно, что в организме происходит разрушение красных кровяных клеток, необходимо найти причину.
Важно собрать полную информацию о жизни пациента: где жил, что ел, кем работал. Пациент рассказывает, какие симптомы у него появились сначала, прогрессировали ли они.
Врач проводит осмотр кожи и слизистой оболочки пациента, пальпацию печени и селезёнки.
Лабораторные анализы, назначенные врачом, для диагностики причины гемолиза:
- прямая проба Кумбса – обнаружение антител, фиксированных на эритроцитах;
- непрямая проба Кумбса – выявление циркулирующих в крови антител к эритроцитам;
- определение ЦИК (циркулирующих иммунных комплексов) в крови;
- определение осмотической резистентности эритроцитов – понижена при сфероцитозе, овалоцитозе и акантоцитозе;
- определение эритроцитов с тельцами Гейнца;
- определение активности ферментов в эритроцитах, например, глюкозо-6-фосфатдегидрогеназы и пируваткиназы;
- определение фракций гемоглобина путём электрофореза – для диагностики гемоглобинопатии (талассемии и серповидноклеточной анемии);
- исследование эритроцитов на серповидность;
- исследование крови на наличие паразитов – «толстая капля» помогает обнаружить малярийного плазмодия;
- пробы Хема и Хартмана – определение длительности жизни эритроцитов при добавлении кислоты или сахара;
- миелограмма – результат пункции костного мозга.
Кроме лабораторных анализов могут быть назначены инструментальные методы исследования, например, УЗИ для оценки состояния селезёнки и печени.
Гемолитическая анемия лечение имеет, которое является нелёгким процессом, и зависит от различных факторов.
Если в процессе диагностики удалось выяснить, что служит причиной разрушения эритроцитов, то пытаются устранить этот фактор.
При подтверждении аутоиммунной природы патологии назначаются глюкокортикоиды в качестве подавителя иммунных реакций. Напомню, что аутоиммунная гемолитическая анемия возникает при выработке антител к эритроцитам, в результате чего они подвергаются гемолизу.
Если же процесс разрушения эритроцитов протекает остро, то назначается переливание эритроцитарной массы.
При гемоглобинопатиях тяжёлых форм, которым зачастую требуются частые переливания крови, назначаются препараты, связывающие и выводящие из организма избыток железа. Таким образом, не допускается откладывание избытка железа в органах и тканях.
В ситуациях, когда гемолитическая анемия является осложнением какого-либо состояния, важная роль отводится лечению основного заболевания. После выздоровления обычно признаки гемолитической анемии исчезают.
Имеется ряд ситуаций, когда проводится оперативное вмешательство, например, удаление селезёнки. Чаще всего спленэктомия применяется как метод лечения мембранопатий и гемоглобинопатий.
Пересадка костного мозга также является одним из способов лечения гемолитической анемии.
Исход заболевания будет зависеть от причин возникновения гемолитической анемии, её формы и степени течения. Если не брать во внимание наследственные формы, характеризующиеся внутриутробной гибелью плода, то прогноз в целом благоприятный при правильном вовремя назначенном лечении.
Имеется ряд профилактических мероприятий, направленных на предотвращение возникновения приобретённых аутоиммунных гемолитических анемий:
- избегать змеиных укусов;
- избегать длительного нахождения в среде с высоким содержанием тяжёлых металлов и токсических веществ;
- при наличии холодовых антител в организме избегать пребывания в среде с низкими температурными условиями.
Также необходимо быть аккуратнее с приёмом таких лекарственных средств, как:
- противомалярийные средства;
- ацетилсалициловая кислота (аспирин);
- сульфаниламиды;
- антибактериальные препараты;
- противотуберкулёзные средства.
Эти препараты могут вызывать гемолиз при недостаточности глюкозо-6-фосфатдегидрогеназы в эритроцитах.
Анемия гемолитическая у детей протекает обычно наиболее выражено, чем у взрослых, так как в таком возрасте симптомы указывают на среднюю или тяжёлую форму заболевания.
Заподозрить гемолитическую анемию можно по следующим симптомам:
- раздражительность;
- плаксивость;
- быстрая утомляемость;
- бледность кожи и слизистых оболочек;
- пожелтение кожи и слизистых оболочек;
- одышка;
- увеличение печени и селезёнки в размерах (крупный живот);
- деформация костей при наличии врождённой формы заболевания (укорочение фаланг пальцев, изменение большеберцовых костей, башенный череп, узкие глазницы).
Гемолитическая анемия – комплекс заболеваний, которые объединены в одну группу из-за того, что при всех из них снижается продолжительность жизни эритроцитов. Это способствует потере гемоглобина и приводит к гемолизу. Эти патологии схожи друг с другом, но их происхождение, течение и даже клинические проявления разнятся. Гемолитическая анемия у детей также имеет свои особенности.
Гемолиз представляет собой массовую гибель форменных элементов крови. По своей сути это патологический процесс, который может происходить в двух пространствах организма.
- Экстраваскулярно, то есть вне сосудов. Чаще всего очагами являются паренхиматозные органы – печень, почки, селезенка, а также красный костный мозг. Такой вид гемолиза протекает схоже с физиологическим;
- Интраваскулярно, когда кровяные клетки разрушаются в просвете кровеносных сосудов.
Массовая деструкция эритроцитов протекает с типичным симптомокомплексом, при этом проявления интраваскулярного и экстраваскулярного гемолиза различны. Они определяются при общем осмотре больного, помогут установить диагноз общий анализ крови и другие специфические тесты.
Нефизиологическая гибель красных клеток крови возникает по разным причинам, среди которых одно из самых главных мест занимает дефицит железа в организме. Однако это состояние следует разграничивать с нарушениями синтеза эритроцитов и гемоглобина, в чем помогают лабораторные анализы, клинические симптомы.
- Желтушность кожных покровов, которая отображается повышением общего билирубина и его свободной фракции.
- Несколько отдаленным проявлением становится повышенная вязкость и густота желчи с повышенной склонностью к камнеобразованию. Она также меняет свою окраску, поскольку содержание желчных пигментов увеличивается. Этот процесс обусловлен тем, что клетки печени стараются обезвредить избыток билирубина.
- Кал также меняет свою окраску, поскольку желчные пигменты «добираются» и до него, провоцируя рост показателей стеркобилина, уробилиногена.
- При экстраваскулярной гибели клеток крови повышается уровень уробилина, что отображается потемнением мочи.
- Общий анализ крови реагирует снижением эритроцитов, падением гемоглобина. Компенсаторно растут молодые формы клеток – ретикулоциты.
Разрушение эритроцитов происходит или в просвете кровеносных сосудов, или в паренхиматозных органах. Поскольку экстраваскулярный гемолиз по своему патофизиологическому механизму схож с нормальной гибелью эритроцитов в паренхиматозных органах, различие заключается лишь в его скорости, и он частично описан выше.
При разрушении эритроцитов внутри просвета сосудов развиваются:
- повышение свободного гемоглобина, кровь приобретает так называемый лаковый оттенок;
- изменение цвета мочи за счет свободного гемоглобина или гемосидерина;
- гемосидероз – состояние, когда железосодержащий пигмент откладывается в паренхиматозных органах.
По своей сути гемолитическая анемия представляет собой патологию, при котором продолжительность жизни эритроцитов значительно снижается. Это обуславливается большим количеством факторов, при этом они бывают внешними или внутренними. Гемоглобин во время деструкции форменных элементов частично разрушается, а частично приобретает свободную форму. Снижение гемоглобина менее 110 г/л указывает на развитие анемии. Крайне редко гемолитическая анемия имеет связь со снижением количества железа.
Внутренними факторами, способствующими развитию заболевания, служат аномалии строения кровяных клеток, а внешними – иммунные конфликты, инфекционные агенты, механические повреждения.
Заболевание может быть врожденным или приобретенным, при этом развитие гемолитической анемии после рождения ребенка называется приобретенным.
Врожденная разделяется на мембранопатии, ферментопатии и гемоглобинопатии, а приобретенная на иммунные, приобретенные мембранопатии, механические повреждения форменных элементов, по причине инфекционных процессов.
На сегодняшний день врачи не разделяют форму гемолитической анемии по месту деструкции эритроцитов. Наиболее часто фиксируется аутоиммунная. Также, большая часть всех фиксированных патологий этой группы приходится на долю приобретенных гемолитических анемий, при этом они характерны для всех возрастов, начиная с первых месяцев жизни. У детей следует проявить особую преднастороженность, поскольку эти процессы могут быть наследственными. Их развитие обусловлено несколькими механизмами.
- Появлением антиэритроцитарных антител, которые попадают извне. При гемолитической болезни новорожденных речь идет об изоиммунных процессах.
- Соматическими мутациями, что служит одним из триггеров хронической гемолитической анемии. Это не может стать генетическим наследственным фактором.
- Механическое повреждение эритроцитов возникает как результат воздействия тяжелых физических нагрузок или протезирования клапанов сердца.
- Гиповитаминоз, особую роль играет витамин Е.
- Малярийный плазмодий.
- Воздействие отравляющих веществ.
При аутоиммунных анемиях организм отвечает повышенной восприимчивостью к любым чужеродным белкам, а также имеет повышенную склонность к аллергическим реакциям. Это обусловлено увеличением активности собственной иммунной системы. В крови могут изменяться следующие показатели: специфические иммуноглобулины, количество базофилов и эозинофилов.
Аутоиммунные анемии характеризуются выработкой антител к нормальным кровяным клеткам, что приводит к нарушению распознавания своих клеток. Подвидом такой патологии является трансиммунная анемия, при которой мишенью иммунной системы плода становится материнский организм.
Для обнаружения процесса применяются тесты Кумбса. Они позволяют выявить циркулирующие иммунные комплексы, которые нет при полном здоровье. Лечением занимается аллерголог либо иммунолог.
Заболевание развивается по ряду причин, также они могут быть врожденными или приобретенными. Примерно 50% случаев заболевания остаются без выясненной причины, такая форма называется идиопатической. Среди причин гемолитической анемии важно выделить те, которые провоцируют процесс чаще других, а именно:
- переливание несовместимой крови при гемотрансфузиях, в том числе по резус-фактору;
- воздействие отравляющих веществ, токсические эффекты лекарственных препаратов;
- аномалии развития малышей, пороки сердца;
- лейкозы;
- изменения, провоцируемые жизнедеятельностью паразитов.
Под воздействием вышеперечисленных триггеров и наличии других пусковых механизмов форменные клетки разрушаются, способствуя появлению типичной для анемии симптоматики.
Клинические проявления гемолитической анемии достаточно обширные, но их характер всегда зависит от причины, вызвавшей заболевание, тот или иной его тип. Иногда патология проявляется лишь тогда, когда развивается криз или обострение, а ремиссия протекает бессимптомно, человек не предъявляет никаких жалоб.
Все симптомы процесса можно обнаружить только при декомпенсации состояния, когда имеет место выраженный дисбаланс между здоровыми, формирующимися и разрушенными форменными элементами крови, а костный мозг не справляется с возложенной на него нагрузка.
Классические клинические проявления представлены тремя симптомокомплексами:
- анемическим;
- желтушным;
- увеличение печени и селезенки – гепатоспленомегалия.
Обычно они развиваются при внесосудистой деструкции форменных элементов.
Серповидно-клеточная, аутоиммунная и другие гемолитические анемии проявляются такими характерными признаками.
- Повышенная температура тела, головокружение. Встречается при стремительном развитии заболевания в детском возрасте, а сама температура достигает 38С.
- Синдром желтухи. Появление этого признака обусловлено деструкцией эритроцитов, что приводит к повышению уровня непрямого билирубина, который перерабатывается печенью. Его высокая концентрация способствует росту стеркобилина и уробилина кишечника, за счет чего окрашивается кал, кожа, слизистые оболочки.
- По мере развития желтухи спленомегалия также развивается. Этот синдром достаточно часто протекает с гепатомегалией, то есть одновременно увеличиваются и печень, и селезенка.
- Анемия. Сопровождается снижением количества гемоглобина в крови.
Другими признаками гемолитической анемии бывают:
- болевые ощущения в эпигастрии, животе, поясничной области, почках, костях;
- инфарктоподобные боли;
- пороки развития детей, сопровождающиеся признаками нарушения внутриутробного формирования плода;
- изменение характера стула.
Диагностика гемолитической анемии проводится врачом-гематологом. Он устанавливает диагноз на основании данных, полученных при обследовании больного. Сначала происходит сбор анамнестических данных, уточняется наличие триггерных факторов. Врач оценивает степень бледности кожных покровов и видимых слизистых оболочек, проводит пальпаторное исследование органов живота, при котором можно определить увеличение печени, селезенки.
Следующим этапом служит лабораторное и инструментальное обследование. Проводится общий анализ мочи, крови, биохимическое обследование, при котором можно установить наличие в крови высокого уровня непрямого билирубина. Также выполняется УЗИ органов брюшной полости.
В особо тяжелых случаях назначается биопсия костного мозга, при которой можно определить, как развиваются эритроциты при гемолитической анемии. Важно провести правильную дифференциальную диагностику, чтобы исключить такие патологии, как вирусные гепатиты, гемобластозы, онкологические процессы, цирроз печени, механическую желтуху.
Каждая отдельно взятая форма заболевания требует своего подходу к лечению по причине особенностей возникновения. Важно сразу же устранить все гемолизирующие факторы, если речь идет о приобретенном процессе. Если лечение гемолитических анемий происходит во время криза, то больной должен получать большой объем гемотрансфузий – плазма крови, эритроцитарная масса, также проводят метаболическую и витаминотерапии, при этом особую роль играет компенсация дефицита витамина е.
Иногда возникает потребность назначения гормонов и антибиотиков. В случае установки диагноза микросфероцитоза единственным вариантом лечения является спленэктомия.
Аутоиммунные процессы подразумевают применение стероидных гормонов. Препаратом выбора считается преднизолон. Такая терапия снижает гемолиз, а иногда прекращает его полностью. Особо тяжелые случаи требуют назначение иммунодепрессантов. Если заболевание полностью резистентно к медикаментозным лекарственным средствам, врачи прибегают к удалению селезенки.
При токсической форме заболевания возникает необходимость в проведении дезинтоксикационной интенсивной терапии – гемодиализ, лечение антидотами, форсированный диурез при сохраненной работоспособности почек.
Как уже было сказано ранее, гемолитические анемии – группа патологических процессов, которая по своему механизму развития может значительно отличаться, но у всех заболеваний есть одна общая черта – гемолиз. Он происходит не только в кровяном русле, но и в паренхиматозных органах.
Первые признаки развития процесса зачастую не вызывают никаких подозрений у заболевших лиц. Если у ребенка малокровие развивается стремительно, то появляются раздражительность, быстрая утомляемость, плаксивость, а также бледность кожи. Эти признаки могут быть легко приняты за особенности характера малыша. Особенно если речь идет о часто болеющих детях. И это неудивительно, поскольку при наличии этой патологии люди подвержены развитию инфекционных процессов.
Основные симптомы анемии у детей – бледность кожи, которую необходимо дифференцировать с почечными патологиями, туберкулезом, интоксикацией различного генеза.
Главным признаком, который позволит определить наличие именно анемии без определения лабораторных показателей – при малокровии слизистые оболочки также приобретают бледный оттенок.
Основными осложнениями гемолитических анемий являются:
- самое страшное – анемическая кома и летальный исход;
- снижение показателей артериального давления, сопровождающееся учащенным пульсом;
- олигоурия;
- образование камней в желчном пузыре и желчевыводящих протоках.
Следует отметить, что некоторые пациенты отмечают обострение заболевания в холодное время года. Таким пациентам врачи рекомендуют не переохлаждаться.
Профилактические мероприятия бывают первичными и вторичными:
- первичные способствуют предотвращению развития заболевания;
- вторичные превентивные меры борются с обострениями патологии.
Если развивается анемия врожденная, то сразу нужно приступать ко вторичным мероприятиям. Единственный верный способ предупреждения заболевания – соблюдение принципов здорового образа жизни, отдавать предпочтение натуральным продуктам питания, своевременная терапия любых патологических процессов.
источник
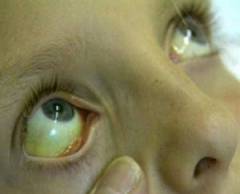
Поскольку симптомокомплекс гемолитических анемий одинаков для большинства вызвавших их причин, огромное значение приобретает правильно собранный анамнез, а также дополнительные лабораторные и параклинические исследования.
Лечение гемолитических анемий должно проводиться лишь после установления окончательного диагноза, однако далеко не всегда это представляется возможным ввиду высоких темпов разрушения эритроцитов и недостаточности времени на постановку диагноза. В таких случаях на первый план выступают мероприятия, направленные на жизнеобеспечение пациента, такие как переливание донорской крови, плазмаферез, эмпирическое лечение антибактериальными препаратами и глюкокортикоидными гормональными препаратами.
Интересные факты
- Среднее количество железа, содержащееся в крови взрослого человека, составляет порядка 4 грамм.
- Суммарное количество эритроцитов в теле взрослого человека в пересчете на сухую массу составляет в среднем 2 кг.
- Регенераторная способность эритроцитарного ростка костного мозга достаточно велика. Однако, для того чтобы регенераторные механизмы успели активизироваться, требуется длительное время. По этой причине хронический гемолиз значительно легче переносится пациентами, чем острый, даже если при этом уровень гемоглобина достигает 40 – 50 г\л.
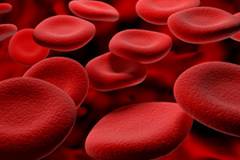
Нормальный эритроцит обладает рядом параметров, которые обеспечивают успешное выполнение им своих функций.
Основными параметрами эритроцитов являются:
- форма двояковогнутого диска;
- средний диаметр — 7,2 – 7,5 мкм;
- средний объем — 90 мкм 3 ;
- длительность «жизни» — 90 – 120 дней;
- нормальная концентрация у мужчин — 3,9 – 5,2 х 10 12 \л;
- нормальная концентрация у женщин — 3,7 – 4,9 х 10 12 \л;
- нормальная концентрация гемоглобина у мужчин — 130 – 160 г\л;
- нормальная концентрация гемоглобина у женщин — 120 – 150 г\л;
- гематокрит (соотношение форменных элементов крови к жидкой ее части) у мужчин — 0,40 – 0,48;
- гематокрит у женщин — 0,36 – 0,46.
Изменение формы и размера эритроцитов отрицательно отражается на их функции. Например, уменьшение размеров эритроцита свидетельствует о меньшем содержании гемоглобина в нем. В таком случае количество эритроцитов может быть в норме, но, тем не менее, анемия будет присутствовать, поскольку общий уровень гемоглобина будет снижен. Увеличение диаметра эритроцита часто свидетельствует о мегалобластной B12-дефицитной или фолиеводефицитной анемии. Присутствие в анализе крови эритроцитов разного диаметра называется анизоцитозом.
Правильная форма эритроцита с точки зрения физиологии имеет большое значение. Во-первых, она обеспечивает наибольшую площадь соприкосновения эритроцита с сосудистой стенкой во время прохождения по капилляру, а соответственно и высокую скорость газообмена. Во-вторых, измененная форма эритроцитов часто свидетельствует о низких пластических свойствах цитоскелета эритроцита (система белков, организованных в сеть, поддерживающую необходимую форму клетки). Вследствие изменения нормальной формы клетки происходит преждевременное разрушение таких эритроцитов при прохождении через капилляры селезенки. Присутствие в периферической крови эритроцитов различной формы именуется пойкилоцитозом.
Цитоскелет эритроцита является системой микротрубочек и микрофиламентов, придающих эритроциту ту или иную форму. Микрофиламенты состоят из трех видов белков — актина, миозина и тубулина. Данные белки способны активно сокращаться, изменяя форму эритроцита для осуществления необходимой задачи. Например, для прохождения через капилляры эритроцит вытягивается, а по выходу из узкого участка снова принимает первоначальную форму. Данные преобразования происходят при использовании энергии АТФ (аденозинтрифосфат) и ионов кальция, являющихся пусковым фактором в перестройке цитоскелета.
Еще одной особенностью эритроцита является отсутствие ядра. Данное свойство крайне выгодно с эволюционной точки зрения, поскольку позволяет более рационально использовать пространство, которое бы занимало ядро, и вместо него поместить в эритроцит большее количество гемоглобина. Более того, ядро значительно бы ухудшило пластические свойства эритроцита, что недопустимо, учитывая, что данная клетка должна проникать через капилляры, диаметр которых в несколько раз меньше ее собственного.
Гемоглобин является макромолекулой, заполняющей 98% объема зрелого эритроцита. Он располагается в ячейках цитоскелета клетки. Подсчитано, что в среднем эритроците содержится приблизительно 280 – 400 миллионов молекул гемоглобина. Он состоит из белковой части – глобина и небелковой части – гема. Глобин, в свою очередь, состоит из четырех мономеров, два из которых мономеры α (альфа) и остальные два – мономеры β (бета). Гем является сложной неорганической молекулой, в центре которой располагается железо, способное окисляться и восстанавливаться в зависимости от условий среды. Основной функцией гемоглобина является захват, транспортировка и высвобождение кислорода и углекислого газа. Данные процессы регулируются кислотностью среды, парциальным давлением газов крови и другими факторами.
Различают следующие виды гемоглобина:
- гемоглобин А (HbA);
- гемоглобин А2 (HbA2);
- гемоглобин F (HbF);
- гемоглобин Н (HbH);
- гемоглобин S (HbS).
Гемоглобин А является наиболее численной фракцией, доля которой составляет 95 – 98%. Данный гемоглобин является нормальным, а его строение соответствует описанному выше. Гемоглобин А2 состоит из двух цепей α и двух цепей δ (дельта). Данный тип гемоглобина не менее функционален, чем гемоглобин А, однако его доля составляет всего 2 – 3% . Гемоглобин F является детской или фетальной фракцией гемоглобина и встречается в среднем до 1 года. Непосредственно после рождения фракция такого гемоглобина наиболее высока и составляет 70 – 90%. К концу первого года жизни фетальный гемоглобин разрушается, а его место занимает гемоглобин А. Гемоглобин Н встречается при талассемии, при этом он формируется из 4-х мономеров β. Гемоглобин S является диагностическим признаком серповидноклеточной анемии.
Мембрана эритроцита состоит из двойного липидного слоя, пронизанного различными белками, выполняющими роль насосов для разнообразных микроэлементов. К внутренней поверхности мембраны прикрепляются элементы цитоскелета. На внешней поверхности эритроцита располагается большое количество гликопротеидов, выполняющих роль рецепторов и антигенов – молекул, определяющих уникальность клетки. На сегодняшний день на поверхности эритроцитов обнаружено более 250 видов антигенов, наиболее изученными из которых являются антигены системы АВ0 и системы резус-фактора.
По системе АВ0 различают 4 группы крови, а по резус-фактору – 2 группы. Открытие данных групп крови ознаменовало начало новой эры в медицине, поскольку позволило производить переливание крови и ее компонентов пациентам со злокачественными заболеваниями крови, массивными кровопотерями и др. Также благодаря переливанию крови значительно возросла выживаемость пациентов после массивных хирургических вмешательств.
По системе АВ0 различают следующие группы крови:
- агглютиногены (антигены на поверхности эритроцитов, которые при контакте с одноименными агглютининами вызывают осаждение красных кровяных телец) на поверхности эритроцитов отсутствуют;
- присутствуют агглютиногены А;
- присутствуют агглютиногены В;
- присутствуют агглютиногены А и В.
По наличию резус-фактора различают следующие группы крови:
- резус-положительная – 85% населения;
- резус-отрицательная – 15% населения.
Несмотря на тот факт, что, теоретически, переливая полностью совместимую кровь от одного пациента другому анафилактических реакций быть не должно, периодически они случаются. Причиной такого осложнения является несовместимость по остальным типам эритроцитарных антигенов, которые, к сожалению, практически не изучены на сегодняшний день. Кроме того, причиной анафилаксии могут быть некоторые компоненты плазмы – жидкой части крови, Поэтому согласно последним рекомендациям международных медицинских гидов переливание цельной крови не приветствуется. Вместо этого переливаются компоненты крови – эритроцитарная масса, тромбоцитарная масса, альбумины, свежезамороженная плазма концентраты факторов свертывания и т. д.
Упомянутые ранее гликопротеиды, расположенные на поверхности мембраны эритроцитов, формируют слой, называющийся гликокаликсом. Важной особенностью данного слоя является отрицательный заряд на его поверхности. Поверхность внутреннего слоя сосудов также имеет отрицательный заряд. Соответственно, в кровеносном русле эритроциты отталкиваются от стенок сосуда и друг от друга, что предотвращает образование кровяных сгустков. Однако стоит произойти повреждению эритроцита или ранению стенки сосуда, как отрицательный их заряд постепенно сменяется на положительный, здоровые эритроциты группируются вокруг места повреждения, и формируется тромб.
Понятие деформируемости и цитоплазматической вязкости эритроцита тесно сопряжено с функциями цитоскелета и концентрацией гемоглобина в клетке. Деформируемостью называется способность эритроцита клетки произвольно изменять свою форму для преодоления препятствий. Цитоплазматическая вязкость обратно пропорциональна деформируемости и возрастает вместе с увеличением содержания гемоглобина по отношению к жидкой части клетки. Увеличение вязкости происходит при старении эритроцита и является физиологическим процессом. Параллельно с увеличением вязкости происходит уменьшение деформируемости.
Тем не менее, изменение данных показателей может иметь место не только при физиологическом процессе старения эритроцита, но еще и при многих врожденных и приобретенных патологиях, таких как наследственные мембранопатии, ферментопатии и гемоглобинопатии, которые более подробно будут описаны далее.
Эритроцит, как и любая другая живая клетка, нуждается в энергии для успешного функционирования. Энергию эритроцит получает при окислительно-восстановительных процессах, происходящих в митохондриях. Митохондрии сравниваются с электростанциями клетки, поскольку преобразуют глюкозу в АТФ в ходе процесса, именуемого гликолизом. Отличительной способностью эритроцита является то, что его митохондрии образуют АТФ только путем анаэробного гликолиза. Иными словами, данные клетки не нуждаются в кислороде для обеспечения своей жизнедеятельности и поэтому доставляют тканям ровно столько кислорода, сколько получили при прохождении через легочные альвеолы.
Несмотря на то, что об эритроцитах сложилось мнение как об основных переносчиках кислорода и углекислого газа, помимо этого они выполняют еще ряд важных функций.
Второстепенными функциями эритроцитов являются:
- регуляция кислотно-щелочного равновесия крови посредством карбонатной буферной системы;
- гемостаз – процесс, направленный на остановку кровотечения;
- определение реологических свойств крови – изменение численности эритроцитов по отношению к общему количеству плазмы приводит к сгущению или разжижению крови.
- участие в иммунных процессах – на поверхности эритроцита находятся рецепторы для прикрепления антител;
- пищеварительная функция – распадаясь, эритроциты высвобождают гем, самостоятельно трансформирующийся в свободный билирубин. В печени свободный билирубин превращается в желчь, использующуюся для расщепления жиров пищи.
Эритроциты образуются в красном костном мозге, проходя через многочисленные стадии роста и созревания. Все промежуточные формы предшественников эритроцитов объединяются в единый термин – эритроцитарный росток.
По мере созревания предшественники эритроцита претерпевают изменение кислотности цитоплазмы (жидкой части клетки), самопереваривание ядра и накопление гемоглобина. Непосредственным предшественником эритроцита является ретикулоцит – клетка, в которой при рассмотрении под микроскопом можно встретить некоторые плотные включения, являвшиеся некогда ядром. Ретикулоциты циркулируют в крови от 36 до 44 часов, за которые они избавляются от остатков ядра и заканчивают синтез гемоглобина из остаточных цепей матричной РНК (рибонуклеиновой кислоты).
Регуляция созревания новых эритроцитов осуществляется посредством прямого механизма обратной связи. Веществом, стимулирующим рост числа эритроцитов, является эритропоэтин – гормон, вырабатываемый паренхимой почек. При кислородном голодании выработка эритропоэтина усиливается, что приводит к ускорению созревания эритроцитов и в конечном итоге – восстановлению оптимального уровня насыщения тканей кислородом. Второстепенная регуляция деятельности эритроцитарного ростка осуществляется посредством интерлейкина-3, фактора стволовых клеток, витамина В12, гормонов (тироксин, соматостатин, андрогены, эстрогены, кортикостероиды) и микроэлементов (селен, железо, цинк, медь и др.).
По истечении 3 – 4 месяцев существования эритроцита происходит его постепенная инволюция, проявляющаяся выходом внутриклеточной жидкости из него по причине износа большинства транспортных ферментных систем. Вслед за этим происходит уплотнение эритроцита, сопровождающееся снижением его пластических свойств. Снижение пластических свойств ухудшает проходимость эритроцита через капилляры. В конечном итоге такой эритроцит попадает в селезенку, застревает в ее капиллярах и разрушается лейкоцитами и макрофагами, располагающимися вокруг них.
После разрушения эритроцита в кровеносное русло выделяется свободный гемоглобин. При скорости гемолиза менее 10% от общего числа эритроцитов в сутки гемоглобин захватывается белком под названием гаптоглобин и оседает в селезенке и внутреннем слое сосудов, где разрушается макрофагами. Макрофаги уничтожают белковую часть гемоглобина, но высвобождают гем. Гем под действием ряда ферментов крови трансформируется в свободный билирубин, после чего транспортируется в печень белком альбумином. Наличие в крови большого количества свободного билирубина сопровождается появлением желтухи лимонного оттенка. В печени свободный билирубин связывается с глюкуроновой кислотой и выделяется в кишечник в виде желчи. При наличии препятствия оттоку желчи она поступает обратно в кровь и циркулирует в виде связанного билирубина. В таком случае также появляется желтуха, однако более темного оттенка (слизистые и кожные покровы оранжевого или красноватого цвета).
После выхода связанного билирубина в кишечник в виде желчи происходит его восстановление до стеркобилиногена и уробилиногена при помощи кишечной флоры. Большая часть стеркобилиногена превращается в стеркобилин, который выделяется с калом и окрашивает его в коричневый цвет. Остаточная часть стеркобилиногена и уробилиноген всасывается в кишечнике и поступает обратно в кровоток. Уробилиноген трансформируется в уробилин и выделяется с мочой, а стеркобилиноген повторно поступает в печень и выводится с желчью. Данный цикл с первого взгляда может показаться бессмысленным, однако, это заблуждение. Во время повторного попадания продуктов распада эритроцитов в кровь осуществляется стимуляция активности иммунной системы.
При увеличении скорости гемолиза от 10% до 17 – 18% от общего числа эритроцитов в сутки резервов гаптоглобина становится недостаточно, для того чтобы захватывать высвобождающийся гемоглобин и утилизировать его путем, описанным выше. В таком случае свободный гемоглобин с током крови поступает в почечные капилляры, отфильтровывается в первичную мочу и окисляется до гемосидерина. Затем гемосидерин поступает во вторичную мочу и выводится из организма.
При крайне выраженном гемолизе, темпы которого превышают 17 – 18% от общего количества эритроцитов в сутки, гемоглобин поступает в почки в слишком большом количестве. Из-за этого не успевает происходить его окисление и в мочу поступает чистый гемоглобин. Таким образом, определение в моче избытка уробилина является признаком легкой гемолитической анемии. Появление гемосидерина свидетельствует о переходе в среднюю степень гемолиза. Обнаружение гемоглобина в моче говорит о высокой интенсивности разрушения эритроцитов.
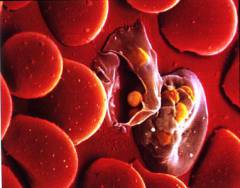
Гемолитические анемии классифицируются на врожденные и приобретенные.
Различают следующие виды врожденных гемолитических анемий:
- мембранопатии;
- ферментопатии;
- гемоглобинопатии.
Различают следующие виды приобретенных гемолитических анемий:
- иммунные гемолитические анемии;
- приобретенные мембранопатии;
- анемии из-за механического разрушения эритроцитов;
- гемолитические анемии, вызванные инфекционными агентами.
Как описывалось ранее, нормальной формой эритроцита является форма двояковогнутого диска. Такая форма соответствует правильному белковому составу мембраны и позволяет эритроциту проникать через капилляры, диаметр которых в несколько раз меньше диаметра самого эритроцита. Высокая проникающая способность эритроцитов, с одной стороны, позволяет им максимально эффективно выполнять основную свою функцию – обмен газов между внутренней средой организма и внешней средой, а с другой стороны – избегать избыточного их разрушения в селезенке.
Дефект определенных белков мембраны приводит к нарушению ее формы. С нарушением формы происходит снижение деформируемости эритроцитов и как следствие усиленное их разрушение в селезенке.
На сегодняшний день различают 3 вида врожденных мембранопатий:
- акантоцитоз
- микросфероцитоз
- овалоцитоз
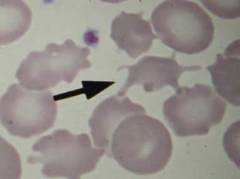
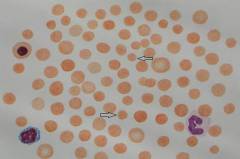
С детства у таких пациентов происходит гипертрофия эритроцитарного костномозгового ростка, компенсирующая гемолиз. Поэтому при микросфероцитозе чаще наблюдается легкая и средней тяжести анемия, появляющаяся преимущественно в моменты ослабления организма вирусными заболеваниями, недостаточным питанием или интенсивным физическим трудом.
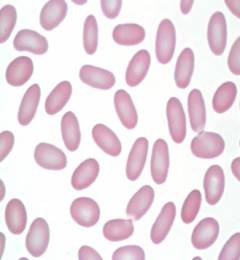
Эритроцит содержит ряд ферментов, при помощи которых поддерживается постоянство его внутренней среды, осуществляется переработка глюкозы в АТФ и регуляция кислотно-щелочного баланса крови.
Соответственно вышеуказанным направлениям различают 3 вида ферментопатий:
- дефицит ферментов, участвующих в окислении и восстановлении глутатиона (см. ниже);
- дефицит ферментов гликолиза;
- дефицит ферментов, использующих АТФ.
Глутатион является трипептидным комплексом, участвующим в большинстве окислительно-восстановительных процессов организма. В частности, он необходим для работы митохондрий – энергетических станций любой клетки, в том числе и эритроцита. Врожденные дефекты ферментов, участвующих в окислении и восстановлении глутатиона эритроцитов, приводят к снижению скорости продукции молекул АТФ – основного энергетического субстрата для большинства энергозависимых систем клетки. Дефицит АТФ приводит к замедлению обмена веществ эритроцитов и их скорому самостоятельному уничтожению, называемому апоптозом.
Гликолиз является процессом распада глюкозы с образованием молекул АТФ. Для осуществления гликолиза необходимо присутствие ряда ферментов, которые многократно преобразуют глюкозу в промежуточные соединения и в итоге высвобождают АТФ. Как указывалось ранее, эритроцит является клеткой, не использующей кислород для образования молекул АТФ. Такой тип гликолиза является анаэробным (безвоздушным). В результате из одной молекулы глюкозы в эритроците образуется 2 молекулы АТФ, использующиеся для поддержания работоспособности большинства ферментных систем клетки. Соответственно врожденный дефект ферментов гликолиза лишает эритроцит необходимого количества энергии для поддержания жизнедеятельности, и он разрушается.
АТФ является универсальной молекулой, окисление которой высвобождает энергию, необходимую для работы более чем 90% ферментных систем всех клеток организма. Эритроцит также содержит множество ферментных систем, субстратом которых является АТФ. Высвобождаемая энергия расходуется на процесс газообмена, поддержание постоянного ионного равновесия внутри и снаружи клетки, поддержание постоянного осмотического и онкотического давления клетки, а также на активную работу цитоскелета и многое другое. Нарушение утилизации глюкозы как минимум в одной из вышеупомянутых систем приводит к выпадению ее функции и дальнейшей цепной реакции, итогом которой является разрушение эритроцита.
Гемоглобин – молекула, занимающая 98% объема эритроцита, ответственная за обеспечение процессов захвата и высвобождения газов, а также за их транспортировку от легочных альвеол к периферическим тканям и обратно. При некоторых дефектах гемоглобина эритроциты значительно хуже осуществляют перенос газов. Кроме того, на фоне изменения молекулы гемоглобина попутно изменяется и форма самого эритроцита, что также отрицательно отражается на длительности их циркуляции в кровеносном русле.
Различают 2 вида гемоглобинопатий:
- количественные – талассемии;
- качественные – серповидноклеточная анемия или дрепаноцитоз.
Талассемии являются наследственными заболеваниями, связанными с нарушением синтеза гемоглобина. По своей структуре гемоглобин является сложной молекулой, состоящей из двух альфа-мономеров и двух бета-мономеров, связанных между собой. Альфа цепь синтезируется с 4-х участков ДНК. Цепь бета – с 2-х участков. Таким образом, при возникновении мутации в одном из 6 участков снижается или прекращается синтез того мономера, ген которого поврежден. Здоровые гены продолжают синтез мономеров, что со временем приводит к количественному преобладанию одних цепей над другими. Те мономеры, которые оказываются в избытке, образуют непрочные соединения, функция которых значительно уступает нормальному гемоглобину. Соответственно той цепи, синтез которой нарушен, выделяют 3 основных типа талассемий – альфа, бета и смешанная альфа-бета талассемия. Клиническая картина зависит от количества мутировавших генов.
Серповидноклеточная анемия является наследственным заболеванием, при котором вместо нормального гемоглобина А формируется аномальный гемоглобин S. Данный аномальный гемоглобин значительно уступает в функциональности гемоглобину А, а также изменяет форму эритроцита на серповидную. Такая форма приводит к разрушению эритроцитов в срок от 5 до 70 дней в сравнении с нормальной длительностью их существования – от 90 до 120 дней. В результате в крови появляется доля серповидных эритроцитов, величина которой зависит от того, является мутация гетерозиготной или гомозиготной. При гетерозиготной мутации доля аномальных эритроцитов редко достигает 50%, а больной испытывает симптомы анемии только при значительной физической нагрузке или в условиях сниженной концентрации кислорода в атмосферном воздухе. При гомозиготной мутации все эритроциты больного являются серповидными и поэтому симптомы анемии проявляются с рождения ребенка, а болезнь характеризуется тяжелым течением.
При данном типе анемий разрушение эритроцитов происходит под действием иммунной системы организма.
Различают 4 типа иммунных гемолитических анемий:
- аутоиммунные;
- изоиммунные;
- гетероиммунные;
- трансиммунные.
При аутоиммунных анемиях собственный организм пациента вырабатывает антитела к нормальным эритроцитам крови вследствие сбоя в работе иммунной системы и нарушения распознавания лимфоцитами своих и чужих клеток.
Изоиммунные анемии развиваются при переливании пациенту крови несовместимой по АВ0 системе и резус-фактору или, иными словами, крови другой группы. В данном случае накануне перелитые эритроциты разрушаются клетками иммунной системы и антителами реципиента. Аналогичный иммунный конфликт развивается при положительном резус-факторе в крови плода и отрицательном – в крови беременной матери. Такая патология именуется гемолитической болезнью новорожденных детей.
Гетероиммунные анемии развиваются в случае появления на мембране эритроцита чужеродных антигенов, признаваемых иммунной системой пациента как чужеродные. Чужеродные антигены могут появиться на поверхности эритроцита в случае употребления некоторых медикаментов или после перенесенных острых вирусных инфекций.
Трансиммунные анемии развиваются у плода, когда в организме матери присутствуют антитела против эритроцитов (аутоиммунная анемия). В данном случае мишенью иммунной системы становятся как эритроциты матери, так и эритроциты плода, даже если не выявляется несовместимость по резус-фактору, как при гемолитической болезни новорожденных.
К данной группе заболеваний относят:
- маршевую гемоглобинурию;
- микроангиопатическую гемолитическую анемию;
- анемию при пересадке механических клапанов сердца.
Маршевая гемоглобинурия, исходя из названия, развивается при длительном маршировании. Форменные элементы крови, находящиеся в ступнях, при длительном регулярном сдавлении подошв подвергаются деформации и даже разрушаются. В результате в кровь выделяется большое количество несвязанного гемоглобина, который выделяется с мочой.
Микроангиопатическая гемолитическая анемия развивается из-за деформации и последующего разрушения эритроцитов при острых гломерулонефритах и синдроме диссеминированного внутрисосудистого свертывания. В первом случае по причине воспаления почечных канальцев и соответственно окружающих их капилляров просвет их сужается, а эритроциты деформируются при трении с их внутренней оболочкой. Во втором случае во всей кровеносной системе происходит молниеносная агрегация тромбоцитов, сопровождающаяся образованием множества фибриновых нитей, перекрывающих просвет сосудов. Часть эритроцитов сразу застревает в образовавшейся сети и образует множественные тромбы, а оставшаяся часть на высокой скорости проскальзывает через данную сеть, попутно деформируясь. В результате деформированные таким образом эритроциты, называющиеся «венценосными», какое-то время еще циркулируют в крови, а затем разрушаются самостоятельно или при прохождении через капилляры селезенки.
Анемия при пересадке механических клапанов сердца развивается при столкновении эритроцитов, двигающихся с высокой скоростью, с плотным пластиком или металлом, из которого состоит искусственный клапан сердца. Темпы разрушения зависят от скорости кровотока в области клапана. Гемолиз усиливается при совершении физической работы, эмоциональных переживаниях, резком повышении или снижении артериального давления и повышении температуры тела.
Таким образом, гемолитическая анемия может развиться по следующим причинам:
- попадание в кровь различных токсинов и ядов (ядохимикаты, пестициды, укусы змей и т. д.);
- механическое разрушение эритроцитов (во время многочасового хождения, после имплантации искусственного клапана сердца и др.);
- синдром диссеминированного внутрисосудистого свертывания;
- различные генетические аномалии строения эритроцитов;
- аутоиммунные болезни;
- паранеопластический синдром (перекрестное иммунное уничтожение эритроцитов вместе с опухолевыми клетками);
- осложнения после переливания донорской крови;
- заражение некоторыми инфекционными болезнями (малярия, токсоплазмоз);
- хронический гломерулонефрит;
- тяжелые гнойные инфекции, сопровождающиеся сепсисом;
- инфекционный гепатит B, реже С и D;
- беременность;
- авитаминозы и др.

Анемический синдром проявляется следующими симптомами:
- бледность кожных покровов и слизистых оболочек;
- головокружение;
- выраженная общая слабость;
- скорая утомляемость;
- одышка при обычной физической нагрузке;
- сердцебиение;
- частый пульс и др.
Гемолитический синдром проявляется следующими симптомами:
- желтушно-бледный окрас кожных покровов и слизистых оболочек;
- моча темно-коричневого, вишневого или алого цвета;
- увеличение размеров селезенки;
- болезненность в левом подреберьи и др.
Гемолиз эритроцитов бывает двух видов. Первый вид гемолиза называется внутриклеточным, то есть разрушение эритроцитов происходит в селезенке посредством поглощения дефектных эритроцитов лимфоцитами и фагоцитами. Второй вид гемолиза называется внутрисосудистым, то есть разрушение эритроцитов имеет место в кровеносном русле под действием циркулирующих в крови лимфоцитов, антител и комплемента. Определение вида гемолиза крайне важно, поскольку дает исследователю подсказку, в каком направлении далее продолжать поиски причины разрушения красных кровяных телец.
Подтверждение внутриклеточного гемолиза осуществляется при помощи следующих лабораторных показателей:
- гемоглобинемия – наличие свободного гемоглобина в крови вследствие активного разрушения эритроцитов;
- гемосидеринурия – наличие в моче гемосидерина – продукта окисления в почках избыточного гемоглобина;
- гемоглобинурия – наличие в моче неизмененного гемоглобина, признака крайне высокой скорости разрушения эритроцитов.
Подтверждение внутрисосудистого гемолиза осуществляется при помощи следующих лабораторных анализов:
- общий анализ крови – снижение количества эритроцитов и\или гемоглобина, увеличение количества ретикулоцитов;
- биохимический анализ крови – увеличение общего билирубина за счет непрямой фракции.
- мазок периферической крови – при различных способах окраски и фиксации мазка определяется большинство аномалии строения эритроцита.
При исключении гемолиза исследователь переключается на поиск иной причины анемии.
Причин развития гемолиза огромное множество, соответственно их поиск может занять непозволительно много времени. В таком случае необходимо максимально детально выяснить анамнез заболевания. Иными словами, требуется выяснить места, которые посещал пациент в последние полгода, где работал, в каких условиях жил, очередность появления симптомов заболевания, интенсивность их развития и многое другое. Такая информация может оказаться полезной для сужения круга поиска причин гемолиза. При отсутствии таковой информации осуществляется ряд анализов на определение субстрата наиболее частых заболеваний, приводящих к разрушению эритроцитов.
Анализами второго этапа диагностики являются:
- прямой и непрямой тест Кумбса;
- циркулирующие иммунные комплексы;
- осмотическая резистентность эритроцитов;
- исследование активности ферментов эритроцита (глюкоза-6-фосфатдегидрогназа (Г-6-ФДГ), пируваткиназа и др.);
- электрофорез гемоглобина;
- проба на серповидность эритроцитов;
- проба на тельца Гейнца;
- бактериологический посев крови;
- исследование «толстой капли» крови;
- миелограмма;
- проба Хема, проба Хартмана (сахарозная проба).
Прямой и непрямой тест Кумбса
Данные тесты осуществляются с целью подтверждения или исключения аутоиммунной гемолитической анемии. Циркулирующие иммунные комплексы косвенно свидетельствуют об аутоиммунной природе гемолиза.
Осмотическая резистентность эритроцитов
Снижение осмотической резистентности эритроцитов чаще развивается при врожденных формах гемолитических анемий, таких как сфероцитоз, овалоцитоз и акантоцитоз. При талассемии, напротив, наблюдается увеличение осмотической резистентности эритроцитов.
Исследование активности ферментов эритроцитов
С данной целью сначала осуществляют качественные анализы на наличие или отсутствие искомых ферментов, а затем прибегают к количественным анализам, осуществляемым при помощи ПЦР (полимеразной цепной реакции). Количественное определение ферментов эритроцитов позволяет выявить их снижение по отношению к нормальным значениям и диагностировать скрытые формы эритроцитарных ферментопатий.
Электрофорез гемоглобина
Исследование осуществляется с целью исключения как качественных, так и количественных гемоглобинопатий (талассемий и серповидноклеточной анемии).
Проба на серповидность эритроцитов
Сутью данного исследования является определение изменения формы эритроцитов по мере снижения парциального давления кислорода в крови. В случае если эритроциты принимают серповидную форму, то диагноз серповидноклеточной анемии считается подтвержденным.
Проба на тельца Гейнца
Целью данной пробы является обнаружение в мазке крови специальных включений, являющихся нерастворимым гемоглобином. Данная проба осуществляется для подтверждения такой ферментопатии как дефицит Г-6-ФДГ. Однако нужно помнить, что тельца Гейнца могут появиться в мазке крови при передозировке сульфаниламидов или анилиновых красителей. Определение данных образований осуществляется в темнопольном микроскопе или в обычном световом микроскопе при специальном окрашивании.
Бактериологический посев крови
Бак-посев проводится с целью определения видов циркулирующих в крови инфекционных агентов, которые могут взаимодействовать с эритроцитами и вызывать их разрушение прямым путем или посредством иммунных механизмов.
Исследование «толстой капли» крови
Данное исследование проводится с целью выявления возбудителей малярии, жизненный цикл которых тесно сопряжен с разрушением эритроцитов.
Миелограмма
Миелограмма является результатом пункции костного мозга. Данный параклинический метод позволяет выявить такие патологии как злокачественные заболевания крови, которые посредством перекрестной иммунной атаки при паранеопластическом синдроме разрушают и эритроциты. Помимо этого в пунктате костного мозга определяется разрастание эритроидного ростка, что свидетельствует о высоких темпах компенсаторной продукции эритроцитов в ответ на гемолиз.
Проба Хема. Проба Хартмана (сахарозная проба)
Обе пробы проводятся с целью определения длительности существования эритроцитов того или иного пациента. Для того чтобы ускорить процесс их разрушения, тестируемый образец крови помещают в слабый раствор кислоты или сахарозы, а затем оценивают процент разрушенных эритроцитов. Проба Хема считается положительной при разрушении более 5% эритроцитов. Проба Хартмана считается положительной, когда разрушается более 4% эритроцитов. Положительная проба свидетельствует о пароксизмальной ночной гемоглобинурии.
Помимо представленных лабораторных тестов для установления причины гемолитической анемии могут быть проведены другие дополнительные тесты и инструментальные исследования, назначаемые специалистом в области того заболевания, которое предположительно является причиной гемолиза.
Лечением первичных идиопатических (неясной причины) гемолитических анемий, а также вторичных гемолитических анемий вследствие заболеваний системы крови занимается врач-гематолог. Лечение вторичных гемолитических анемий по причине других заболеваний выпадает на долю того специалиста, в поле деятельности которого находится данное заболевание. Таким образом, анемию, вызванную малярией, будет лечить врач-инфекционист. Аутоиммунную анемию будет лечить врач-иммунолог или аллерголог. Анемию вследствие паранеопластического синдрома при злокачественной опухоли будет лечить онкохирург и т. д.
Основой лечения аутоиммунных болезней и, в частности, гемолитической анемии являются глюкокортикоидные гормоны. Они применяются длительное время – сначала для купирования обострения гемолиза, а затем в качестве поддерживающего лечения. Поскольку глюкокортикоиды обладают рядом побочных действий, то для их профилактики осуществляется вспомогательное лечение витаминами группы B и препаратами, снижающими кислотность желудочного сока.
Помимо снижения аутоиммунной активности большое внимание должно уделяться профилактике ДВС-синдрома (нарушение процесса свертываемости крови), в особенности при средней и высокой интенсивности гемолиза. При низкой эффективности глюкокортикоидной терапии препаратами последней линии лечения являются иммунодепрессанты.
| Медикамент | Механизм действия | Способ применения |
| Преднизолон | Является представителем глюкокортикоидных гормонов, обладающих наиболее выраженным противовоспалительным и иммуносупрессивным действием. | 1 – 2 мг\кг\сутки внутривенно, капельно. При выраженном гемолизе дозу препарата увеличивают до 150 мг\сутки. После нормализации показателей гемоглобина дозу медленно снижают до 15 – 20 мг\сутки и продолжают лечение еще 3 – 4 месяца. После этого дозу снижают по 5 мг каждые 2 – 3 дня до полной отмены препарата. |
| Гепарин | Является прямым антикоагулянтом короткого действия (4 – 6 часов). Данный препарат назначается для профилактики ДВС-синдрома, часто развивающегося при остром гемолизе. Применяется при нестабильном состоянии пациента для более совершенного контроля свертываемости. | 2500 – 5000 МЕ подкожно каждые 6 часов под контролем коагулограммы. |
| Надропарин | Является прямым антикоагулянтом длительного действия (24 – 48 часов). Назначается пациентам со стабильным состоянием для профилактики тромбоэмболических осложнений и ДВС. | 0,3 мл\сутки подкожно под контролем коагулограммы. |
| Пентоксифиллин | Периферический вазодилататор с умеренным антиагрегантным действием. Увеличивает поступление кислорода к периферическим тканям. | 400 – 600 мг\сутки в 2 – 3 приема внутрь в течение минимум 2 недель. Рекомендуемая длительность лечения 1 – 3 месяца. |
| Фолиевая кислота | Относится к группе витаминов. При аутоиммунной гемолитической анемии используется с целью восполнения его запасов в организме. | Лечение начинают с дозы 1 мг\сутки, а затем увеличивают ее до появления стойкого клинического эффекта. Максимальная суточная доза – 5 мг. |
| Витамин В12 | При хроническом гемолизе запасы витамина В12 постепенно истощаются, что приводит к увеличению диаметра эритроцита и снижению его пластических свойств. Во избежание данных осложнений осуществляется дополнительное назначение данного препарата. | 100 – 200 мкг\сутки внутримышечно. |
| Ранитидин | Назначается с целью снижения агрессивного действия преднизолона на слизистую желудка посредством снижения кислотности желудочного сока. | 300 мг\сутки в 1 – 2 приема внутрь. |
| Хлористый калий | Является внешним источником ионов калия, которые вымываются из организма в процессе лечения глюкокортикоидами. | 2 – 3 г в сутки под ежедневным контролем ионограммы. |
| Циклоспорин А | Препарат из группы иммунодепрессантов. Применяется в качестве последней линии лечения при неэффективности глюкокортикоидов и спленэктомии. | 3 мг\кг\сутки внутривенно, капельно. При выраженных побочных эффектах осуществляется отмена препарата с переходом к другому иммунодепрессанту. |
| Азатиоприн | Иммунодепрессант. | 100 – 200 мг\сутки в течение 2 – 3 недель. |
| Циклофосфамид | Иммунодепрессант. | 100 – 200 мг\сутки в течение 2 – 3 недель. |
| Винкристин | Иммунодепрессант. | 1 – 2 мг\неделю капельно в течение 3 – 4 недель. |
При дефиците Г-6-ФДГ рекомендуется избегать применения препаратов, входящих в группу риска. Тем не менее, при развитии острого гемолиза на фоне данного заболевания осуществляется немедленная отмена препарата, вызвавшего разрушение эритроцитов, и при острой необходимости переливается отмытая донорская эритроцитарная масса.
При тяжелых формах серповидноклеточной анемии или талассемии, требующих частых переливаний крови, назначается Дефероксамин – препарат, связывающий избыток железа и выводящий его из организма. Таким образом осуществляется профилактика гемохроматоза. Еще одним выходом для пациентов с тяжелой формой гемоглобинопатий является пересадка костного мозга от совместимого донора. При успешности данной процедуры существует вероятность значительного улучшения общего состояния пациента, вплоть до полного выздоровления.
В случае, когда гемолиз выступает в качестве осложнения определенного системного заболевания и является вторичным, все лечебные мероприятия должны быть направлены на излечение заболевания, ставшего причиной разрушения красных кровяных телец. После излечения первичного заболевания прекращается и разрушение эритроцитов.
При гемолитической анемии наиболее практикующейся операцией является спленэктомия (удаление селезенки). Данная операция показана при первом рецидиве гемолиза после проведенного лечения глюкокортикоидными гормонами аутоиммунной гемолитической анемии. Помимо этого спленэктомия является предпочтительным методом лечения таких наследственных форм гемолитических анемий как сфероцитоз, акантоцитоз, овалоцитоз. Оптимальным возрастом, при котором рекомендуется удаление селезенки в случае вышеперечисленных заболеваний, является возраст 4 – 5 лет, однако в индивидуальных случаях операция может быть проведена и в более раннем возрасте.
Талассемия и серповидноклеточная анемия длительное время может лечиться посредством переливания донорских отмытых эритроцитов, однако при наличии признаков гиперспленизма, сопровождающегося снижением количества и остальных клеточных элементов крови, операция по удалению селезенки является оправданной.

Первичная профилактика идиопатических аутоиммунных анемий не производится за отсутствием причин таковых.
Первичная профилактика вторичных аутоиммунных анемий заключается в:
- избегании сопутствующих инфекций;
- избегании нахождения в среде с низкой температурой при анемии с холодовыми антителами и с высокой температурой при анемии с тепловыми антителами;
- избегании укусов змей и нахождении в среде с высоким содержанием токсинов и солей тяжелых металлов;
- избегании употребления медикаментов из расположенного ниже списка при дефиците фермента Г-6-ФДГ.
При дефиците Г-6-ФДГ гемолиз вызывают следующие медикаменты:
- антималярийные средства — примахин, памахин, пентахин;
- обезболивающие и жаропонижающие — ацетилсалициловая кислота (аспирин);
- сульфаниламиды — сульфапиридин, сульфаметоксазол, сульфацетамид, дапсон;
- другие антибактериальные препараты — хлорамфеникол, налидиксовая кислота, ципрофлоксацин, нитрофураны;
- противотуберкулезные средства — этамбутол, изониазид, рифампицин;
- препараты других групп — пробенецид, метиленовый синий, аскорбиновая кислота, аналоги витамина К.
Вторичная профилактика заключается в своевременной диагностике и соответствующем лечении инфекционных заболеваний, способных вызвать обострение гемолитических анемий.
источник