*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Ж елезодефицитная анемия (ЖДА) – клинико–гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Важность проведения рациональной и эффективной терапии ЖДА обусловлена медико–социальным значением и высокой распространенностью данного состояния среди населения, особенно женщин детородного возраста, т.к:
- женщины детородного возраста составляют основную группу риска развития ЖДА
- запасы железа в организме женщин в 3 раза меньше, чем у мужчин
- потребление железа у девушек и фертильных женщин в развитых странах (США) составляет 55–60% от должного
- ЖДА составляет 75–95% всех анемий беременных
- в России около 12% женщин детородного возраста страдают ЖДА
- латентный дефицит железа в некоторых регионах России достигает 50%.
Диагностика железодефицитной анемии
Этапы диагностического поиска:
1 – диагностика гипохромной анемии
1 – диагностика гипохромной анемии
2 – диагностика железодефицитного характера анемии
3 – диагностика причины ЖДА.
1. Диагностика гипохромной анемии. Все ЖДА являются гипохромными. Поэтому гипохромный характер анемии является ключевым признаком, позволяющим заподозрить в первую очередь ЖДА и определить дальнейшее направление диагностического поиска.
Врач–клиницист при трактовке результатов анализа крови должен обязательно обращать внимание не только на цветовой показатель (может быть рассчитан неправильно при ошибке в подсчете лаборантом количества эритроцитов), но и на морфологическую картину эритроцитов, которая описывается врачом–лаборантом при просмотре мазка (например, гипохромия, микроцитоз и т.д.).
2. Диагностика железодефицитного характера анемии (дифференциальный диагноз гипохромной анемии). Не все гипохромные анемии являются железодефицитными. С учетом этого наличие гипохромной анемии не исключает гипохромные анемии другого происхождения В связи с этим на данном этапе диагностического поиска необходимо проведение дифференциальной диагностики между ЖДА и так называемыми сидероахрестическими (ахрезия – неиспользование) анемиями. При сидероахрестических анемиях (групповое понятие), обозначаемых также, как железонасыщенные анемии, содержание железа в организме находится в пределах нормы или даже имеется его избыток, однако в силу различных причин железо не используется для построения гема в молекуле гемоглобина, что в итоге ведет к образованию гипохромных эритроцитов с низким содержанием гемоглобина. Неиспользованное железо поступает в запасы, откладывается в органах и тканях (печень, поджелудочная железа, кожа, макрофагальная система и др.), приводя к развитию гемосидероза.
Правильно распознавать ЖДА и отличить ее от сидероахрестических анемий чрезвычайно важно, так как ошибочный диагноз ЖДА у больных железонасыщенными анемиями может повлечь за собой неоправданное назначение таким больным препаратов железа, что в данной ситуации приведет к еще большей «перегрузке» органов и тканей железом. При этом лечебный эффект от препаратов железа будет отсутствовать.
Основными гипохромными анемиями, с которыми следует проводить дифференциальный диагноз ЖДА, являются следующие:
- анемии, связанные с нарушением синтеза гема, возникающие в результате угнетения активности некоторых ферментов (гемсинтетаза), обеспечивающих включение железа в молекулу гема. Этот ферментный дефект может иметь наследственную природу (наследственные сидероахрестические анемии) или возникать в результате воздействия некоторых медикаментов (изониазид, ПАСК и др.), хронической алкогольной интоксикации, контакта со свинцом и др.;
- талассемия, относится к группе наследственных гемолитических анемий, связанных с нарушением синтеза глобина – белковой части гемоглобина. Заболевание имеет несколько вариантов и характеризуется признаками гемолиза (ретикулоцитоз, повышение уровня непрямого билирубина, увеличение селезенки), высоким содержанием железа в сыворотке и в депо, гипохромной анемией. Фактически при талассемии речь также идет о сидероахрезии, т.е. о неиспользовании железа, но не в результате дефектов ферментов, участвующих в синтезе гема, а вследствие нарушения процесса построения молекулы гемоглобина в целом из–за патологии глобиновой его части;
- анемии, связанные с хроническими заболеваниями. Этим термином принято обозначать группу анемий, возникающих у больных на фоне различных заболеваний, чаще всего воспалительного характера (инфекционных и неинфекционных). Примером могут служить анемии при нагноительных заболеваниях различной локализации (легкие, брюшная полость, остеомиелит), сепсисе, туберкулезе, инфекционном эндокардите, ревматоидном артрите, злокачественных опухолях при отсутствии хронических кровопотерь. При всем многообразии патогенетических механизмов анемии в данных ситуациях одним из основных считается перераспределение железа в клетки макрофагальной системы, активирующейся при воспалительных и опухолевых процессах. Поскольку истинного дефицита железа при этих анемиях не наблюдается, более оправданно говорить не о ЖДА, а о железоперераспределительных анемиях. Последние носят, как правило, умеренно гипохромный характер, содержание железа в сыворотке может быть незначительно снижено, ОЖСС обычно в пределах нормы или умеренно снижена, что отличает этот вариант анемий от ЖДА. Характерно повышение уровня ферритина в крови. Понимание и правильная трактовка патогенетических механизмов развития анемий при вышеуказанных заболеваниях позволяют врачу воздерживаться от назначения этим больным препаратов железа, которые обычно малоэффективны.
Таким образом, о наличии ЖДА можно говорить в случаях гипохромной анемии, сопровождающейся снижением содержания сывороточного железа, повышением ОЖСС, снижением концентрации ферритина. Во избежание ошибок при трактовке результатов определения содержания железа в сыворотке необходимо учитывать следующие правила и рекомендации:
- исследование должно проводиться до начала лечения препаратами железа. В противном случае, даже при приеме препаратов в течение короткого промежутка времени, полученные показатели не отражают истинного содержания железа в сыворотке. Если препараты железа были назначены, то исследование может проводиться не ранее чем через 7 дней после их отмены;
- трансфузии эритроцитов, нередко проводимые до уточнения природы анемии (выраженное снижение уровня гемоглобина, признаки сердечной недостаточности и т. д.), также искажают оценку истинного содержания железа в сыворотке;
- для исследования сыворотки на содержание железа должны использоваться специальные пробирки, дважды промытые дистиллированной водой, так как использование для мытья водопроводной воды, содержащей незначительные количества железа, влияет на результаты исследования. Для высушивания пробирок не следует использовать сушильные шкафы, так как с их стенок при нагревании в посуду попадает незначительное количество железа;
- в настоящее время для исследования железа принято использовать в качестве реактива батофенантралин, образующий с ионами железа цветной комплекс со стойкой окраской и высоким молярным коэффициентом экстинкции; точность метода довольно высока;
- кровь для анализа следует брать в утренние часы, так как имеют место суточные колебания концентрации железа в сыворотке (в утренние часы уровень железа выше);
- на показатели содержания железа в сыворотке оказывают влияние фаза менструального цикла (непосредственно перед менструацией и во время нее уровень сывороточного железа выше), беременность (повышение содержания железа в первые недели беременности), прием оральных контрацептивов (повышение), острые гепатиты и циррозы печени (повышение). Могут наблюдаться случайные вариации исследуемых показателей.
3. Выявление причины ЖДА. После подтверждения железодефицитного характера анемии, т. е. верификации синдрома ЖДА, не менее важной задачей является установление причины данного анемического синдрома. Распознавание причины развития ЖДА в каждом конкретном случае является конечным этапом диагностического поиска. Ориентация на нозологическую диагностику очень важна, так как в большинстве случаев при лечении анемии можно воздействовать на основной патологический процесс.
Алгоритм диагностики железодефицитных анемий
В основе развития ЖДА лежат разнообразные причины, среди которых основное значение имеют следующие:
– хронические кровопотери различной локализации (желудочно–кишечные, маточные, носовые, почечные) вследствие различных заболеваний;
– нарушение всасывания поступающего с пищей железа в кишечнике (энтериты, резекция тонкого кишечника, синдром недостаточного всасывания, синдром «слепой петли»);
– повышенная потребность в железе (беременность, лактация, интенсивный рост и др.);
– алиментарная недостаточность железа (недостаточное питание, анорексии различного происхождения, вегетарианство и др.).
Причины железодефицитных анемий
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). Однако в целом ряде случаев радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). Однако в целом ряде случаев радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Лекарственные препараты железа (ПЖ) являются средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА. ПЖ следует предпочитать пищевым продуктам, содержащим железо.
Лекарственные препараты железа для лечения железодефицитных анемий
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, лекарственной формой.
В клинической практике лекарственные ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. Кроме того, все железосодержащие препараты могут быть разделены на две группы – препараты солей железа и препараты в виде железосодержащих комплексов, имеющие некоторые отличительные свойства (состав, фармакокинетика, переносимость и т.д.), см. табл. 1.
Принятие решения о назначении препаратов железа
1. Путь введения препаратов железа
1. Путь введения препаратов железа
В подавляющем большинстве случаев препараты железа следует назначать внутрь.
Парентерально препараты железа могут применяться при следующих клинических ситуациях:
– нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по Бильрот II с включением двенадцатиперстной кишки);
– обострение язвенной болезни желудка или двенадцатиперстной кишки;
– непереносимость ПЖ для приема внутрь, не позволяющая продолжать лечение;
– необходимость более быстрого насыщения организма железом, например, у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
2. Выбор железосодержащего препарата для приема внутрь
- Количество двухвалентного железа
- Наличие в препарате веществ, улучшающих всасывание железа
- Переносимость препарата
При выборе конкретного препарата и оптимального режима дозирования необходимо иметь в виду, что адекватный прирост показателей гемоглобина при наличии ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг двухвалентного железа. Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг двухвалентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Таким образом, минимальная эффективная доза составляет 100 мг, максимальная – 300 мг двухвалентного железа в сутки. Индивидуальные колебания в количестве необходимого железа обусловлены степенью дефицита железа в организме, истощения запасов, скоростью эритропоэза, всасываемостью, переносимостью и некоторыми другими факторами. С учетом этого при выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но главным образом на количество двухвалентного железа, которое всасывается только в кишечнике.
ПЖ следует принимать во время еды. В то же время всасывание железа лучше при приеме лекарственных препаратов перед едой.
Предпочтительнее препараты, содержащие аскорбиновую кислоту (Сорбифер Дурулес). Не рекомендуется запивать препараты железа чаем, так как танин образует с железом плохо растворимые комплексы. Не следует одновременно с препаратами железа принимать препараты кальция, тетрациклиновые и фторхинолоновые антибиотики.
3. Оценка эффективности назначенного препарата
- Количество ретикулоцитов через 7–10 дней после назначения препарата
- Величина и темпы прироста гемоглобина каждую неделю
Вещества, влияющие на всасывание препаратов железа
При назначении ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Нормализация уровня гемоглобина отмечается в большинстве случаев через 3–4 недели лечения, но иногда сроки нормализации показателей гемоглобина затягиваются до 6–8 недель и может наблюдать резкое скачкообразное повышение гемоглобина. Эти индивидуальные проявления и особенности могут быть обусловлены выраженностью ЖДА, степенью истощения запасов железа, а также не полностью устраненной причиной (хронические кровопотери и др.).
4. Оценка переносимости препарата при назначении внутрь
- Наблюдение за больными, контроль за лечением
Среди побочных проявлений на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, требующие их отмены и перехода на парентеральный путь введения.
Оценка переносимости перорального введения препарата железа
Диспептические расстройства могут уменьшаться при приеме препаратов после еды или снижении дозы.
По современным технологиям в настоящее время выпускаются ПЖ с замедленным высвобождением из них железа (Сорбифер Дурулес) благодаря наличию инертных субстанций, из которых через мелкие поры постепенно поступает железо. Это обеспечивает пролонгированный эффект всасывания и сокращает частоту нарушений со стороны желудочно–кишечного тракта.
5. Длительность насыщающей терапии
- Темпы прироста уровня гемоглобина
- Сроки нормализации уровня гемоглобина
- Клиническая ситуация
Продолжительность так называемой насыщающей терапии препаратами железа определяется темпами прироста гемоглобина, а следовательно и сроками нормализации уровня гемоглобина. Это, в свою очередь, может зависеть от активности препарата железа, от степени истощения запасов железа в организме. По нашим данным, высокий темп прироста гемоглобина наблюдается на фоне лечения препаратом сорбифер–дурулес. Средняя величина прироста гемоглобина в сутки составляет при этом около 2 г/л, что позволяет завершить курс насыщающей терапии за 2–3 недели.
6. Необходимость поддерживающей терапии
- Клиническая ситуация (беременность, неустранимые меноррагии и носовые кровотечения и др.)
Лечение оральными препаратами железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь.
В настоящее время на российском фармацевтическом рынке имеется большое количество препаратов железа для приема внутрь – в виде различных солей железа либо в виде железосодержащих комплексов. Препараты различаются количеством содержащихся в них солей железа, в том числе двухвалентного железа, наличием дополнительных компонентов (аскорбиновая и янтарная кислоты, витамины, фруктоза и др.), лекарственными формами (таблетки, драже, сиропы, растворы) и стоимостью.
Основные железосодержащие препараты представлены в виде сульфата железа, глюконата, хлорида, фумарата железа, глицинсульфата, причем наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицинсульфата.
В таблице 2 представлены основные зарегистрированные в России лекарственные ПЖ в виде солей и железосодержащих комплексов для приема внутрь. Причины неэффективности терапии препаратами железа внутрь и способы коррекции приведены в таблице 3.
Лечение препаратами железа для парентерального введения
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме.
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме.
На фоне парентерального лечения ПЖ, особенно при внутривенном применении, нередко возникают аллергические реакции в виде крапивницы, лихорадки, анафилактического шока. Кроме того, при внутримышечном введении ПЖ может возникать потемнение кожи в местах инъекций, инфильтраты, абсцессы. При внутривенном введении возможно развитие флебитов. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза. В то же время при ошибочном назначении ПЖ внутрь никогда не наблюдается возникновение гемосидероза.
В таблице 4 представлены ПЖ, использующиеся для парентерального введения.
Тактика лечения ЖДА при различных клинических ситуациях
Лечение больных ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, старики), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Далее приводятся наиболее часто встречающиеся в клинической практике ситуации и некоторые особенности лечения больных ЖДА.
Лечение больных ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, старики), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Далее приводятся наиболее часто встречающиеся в клинической практике ситуации и некоторые особенности лечения больных ЖДА.
ЖДА у новорожденных и детей. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. У детей раннего возраста наиболее частой причиной ЖДА является алиментарный фактор, в частности, вскармливание исключительно молоком, поскольку содержащееся в женском молоке железо всасывается в незначительных количествах. Среди ПЖ, которые показаны новорожденным и детям наряду с соответствующей коррекцией питания (витамины, минеральные соли, животный белок), следует назначать препараты для приема внутрь, содержащие малые и средние дозы двухвалентного железа (10–45 мг). Предпочтительнее назначение ПЖ в каплях или в виде сиропа. У детей раннего возраста удобно применение полимальтозного комплекса железа в виде жевательных таблеток (мальтоферфол).
ЖДА у девушек–подростков является чаще всего следствием недостаточных запасов железа в результате дефицита железа у матери во время беременности. При этом имеющийся у них относительный дефицит железа в период интенсивного роста и с появлением менструальных кровопотерь может приводить к развитию клинико–гематологических признаков ЖДА. Таким больным показана терапия ПЖ для приема внутрь. Целесообразно использование препаратов сульфата железа, содержащих различные витамины, так как в период интенсивного роста повышается потребность в витаминах группы А, В, С. После восстановления показателей гемоглобина до нормальных значений следует рекомендовать повторные курсы лечения, особенно если устанавливаются обильные месячные или имеются другие незначительные кровопотери (носовые, десневые).
ЖДА у беременных является самым частым патогенетическим вариантом анемий, возникающих во время беременности. Чаще всего ЖДА диагностируется во II–III триместре и требует коррекции лекарственными ПЖ. Целесообразно назначать препараты сульфата железа, содержащие аскорбиновую кислоту. Содержание аскорбиновой кислоты должно превышать в 2–5 раз количество железа в препарате. Суточные дозы двухвалентного железа у беременных с нетяжелыми формами ЖДА могут не превышать 100 мг, так как при более высоких дозах вероятно возникновение различных диспептических расстройств, к которым и без того склонны беременные. Комбинации ПЖ с витамином В12 и фолиевой кислотой, а также ПЖ, содержащими фолиевую кислоту, не оправдан, так как фолиеводефицитная анемия у беременных возникает редко и имеет специфические клинико–лабораторные признаки.
Парентеральный путь введения ПЖ у большинства беременных без специальных показаний следует считать нецелесообразным. Лечение ПЖ при верификации ЖДА у беременных должно проводиться до конца беременности. Это имеет принципиально важное значение не только для коррекции анемии у беременной, но главным образом для профилактики дефицита железа у плода.
По рекомендации ВОЗ все беременные на протяжении II–III триместров беременности и в первые 6 мес лактации должны получать ПЖ.
ЖДА у женщин, страдающих меноррагиями. Независимо от причины меноррагий (миома, эндометриоз, дисфункция яичников, тромбоцитопатии и др.) и необходимости воздействия на соответствующий фактор, необходима длительная терапия ПЖ для приема внутрь. Доза, режим дозирования и конкретный ПЖ подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т.д. При выраженной анемии с клиническими признаками гипосидероза целесообразно назначение препаратов с высоким содержанием двухвалентного железа (100 мг), что позволяет, с одной стороны, осуществлять адекватную компенсацию дефицита железа, а с другой – облегчает и делает более удобным прием железосодержащих препаратов (1–2 раза в сутки). После нормализации уровня гемоглобина необходимо проводить поддерживающую терапию ПЖ в течение 5–7 дней после окончания менструации. При удовлетворительном состоянии и стабильных показателях гемоглобина возможны перерывы в лечении, которые, однако, не должны быть длительными, так как продолжающиеся у женщин меноррагии быстро истощают запасы железа с риском рецидива ЖДА.
ЖДА у больных с нарушением всасывания (энтериты, резекция тонкого кишечника, синдром «слепой петли») требует назначения ПЖ для парентерального введения наряду с лечением основного заболевания. Назначают ПЖ в виде железо–полимальтозного комплекса для внутримышечного или для внутривенного введения. Не следует применять более 100 мг железа в сутки (содержание 1 ампулы препарата). Следует помнить о возможности развития побочных явлений при парентеральном введении ПЖ (флебиты, инфильтраты, потемнение кожи в местах инъекций, аллергические реакции).
ЖДА у лиц пожилого и старческого возраста может иметь полиэтиологический характер. Так, например, причинами развития ЖДА у данного возрастного контингента могут быть хронические кровопотери на фоне опухолевого процесса в желудке, толстом кишечнике (трудно выявляемая локализация опухоли у стариков), нарушение всасывания, алиментарная недостаточность железа и белка. Возможны случаи сочетания ЖДА и В12–дефицитной анемии. Кроме того, признаки ЖДА могут появляться у больных В12–дефицитной анемией (наиболее частый анемический синдром в позднем возрасте) на фоне лечения витамином В12. Возникающая при этом активация нормобластического кроветворения требует повышенного расхода железа, запасы которого у стариков по различным причинам могут быть ограничены.
Если по объективным причинам не представляется возможным верифицировать ЖДА у стариков (тяжесть состояния, декомпенсация сопутствующей патологии, отказ от обследования и т.д.), то правомочно назначение пробного лечения ПЖ в виде солей железа (сульфат железа, фумарат железа) или в виде железо–полимальтозного комплекса внутрь (при отсутствии признаков нарушения всасывания) с высоким содержанием железа. Ориентиром для правильности выбранной тактики и дальнейшего продолжения лечения ПЖ может быть повышение количества ретикулоцитов по сравнению с исходным через 7–10 дней после начала лечения. Тактика лечения ЖДА у различных групп больных представлена в таблице 5.
источник
Выдыборец С.В., д.м.н., профессор кафедры гематологии и трансфузиологии
Национальная медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины
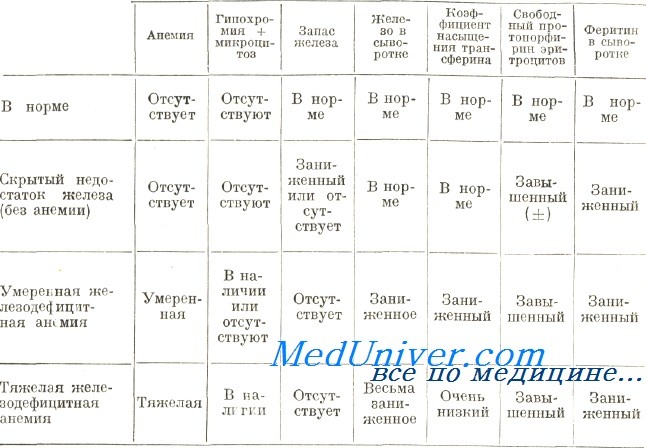
Показатели метаболизма железа при ЖДА характеризуются уменьшением содержания железа в сыворотке (в норме у мужчин и женщин соответственно 13-30 и 12-25 мкмоль/л), увеличением общей железосвязывающей способности сыворотки крови (в норме 30-85 мкмоль/л). Разница между показателями общей железосвязывающей способности сыворотки крови и сывороточного железа отражает латентную железосвязывающую способность сыворотки (в норме менее 47 мкмоль/л). При ЖДА этот показатель повышен. Соотношение показателя железа сыворотки и общей железосвязывающей способности выражает насыщение трансферрина железом (норма 16-50%). При ЖДА этот показатель снижается. ЖДА характеризуется уменьшением содержания ферритина в сыворотке крови (норма 15-150 мкг/л). Оценка запасов железа в организме, кроме определения показателя ферритина, может быть осуществлена по десфераловому тесту. Суть последнего состоит в том, что после внутривенного введения 500 мг десферала у здорового человека с мочой выделяется от 0,8 до 1,2 мг железа, в то время, как у больных ЖДА этот показатель снижен. Следует помнить, что показанием для назначения данного теста может быть только невозможность доказать другими методами предполагаемый дефицит железа в организме больного [5, 6]. Определение протопорфиринов в эритроцитах больных ЖДА показывает их увеличение (норма 18-89 мкмоль) [15, 18]. По данным радиологических исследований выявляют увеличение клиренса железа плазмы [19, 20]. На сегодняшний день наиболее точными методами количественного определения железа в биологических жидкостях и тканях являются методы: спектрального анализа, нейтронно-активационный, атомно-абсорбционный, рентген-флюоресцентный [4, 15, 18]. Таким образом, ЖДА характеризуется нарушениями метаболизма железа в сыворотке, изменениями транспортного и депонированного фондов железа в организме.
Считают, что для диагностики ЖДА морфологическое исследование костного мозга малоинформативно [1, 9, 16, 20]. Однако, значимость его существенно возрастет, если применить цитохимическое исследование с окрашиванием мазков на железо. Существуют три классические метода выявления неорганического железа: 1) метод Perisс берлинской лазурью; 2) с турбуленовым синим; 3) реакции с образованием сульфидов железа. В гематологии, чаще всего, используют метод окраски с берлинской лазурью, что базируется на образовании ферриферрицианида при взаимодействии ионов трехвалентного железа с ферроцианидом в кислой среде [10]. Реакция проявляется в виде образования синего или сине-зеленого осадка ферриферрицианида.
Определение содержания железа в костном мозге при помощи реакции с берлинской лазурью дает ценную информацию для оценки адекватности накопления железа в организме. Большие зерна или конгломераты окрашенного в синий цвет железа в норме наблюдают в макрофагальных клетках костного мозга или свободно лежащими между клеток. Более мелкие гранулы могут наблюдаться в молодых красных клетках мазков костного мозга после соответствующей обработки, а также в клетках системы фагоцитирующих макрофагов. В макрофагальных элементах железо просматривается в виде неплотных агрегатов и предполагают, что оно не идентично гранулам, которые наблюдаются в созревающих красных клетках. Такое железо рассматривают как форму накопления, которая используется на синтез гемоглобина. Истощение отложений железа наблюдают при ЖДА, а избыточное накопление при гемохроматозе, хронических гемолитических анемиях, талассемии, рефрактерных анемиях [10, 18].
Критерии лабораторной диагностики ЖДА приведены в табл. 3.
Таким образом, лабораторными критериями ЖДА является гипохромная анемия, которая сопровождается морфологическими изменениями эритроцитов, уменьшением содержания сывороточного железа, увеличением общей железосвязывающей способности сыворотки крови, уменьшением насыщения трансферрина железом и снижением концентрации ферритина в сыворотке крови.
Во избежание ошибок при интерпретации результатов исследований, необходимо помнить следующее. Полученные результаты исследований могут не отражать истинное содержание железа в сыворотке, если больной перед исследованием, даже кратеовременно принимал препараты железа. Для определения железа следует использовать пластиковые или стеклянные пробирки, промытые перед исследованием соляной кислотой и дважды – дистиллированной водой, поскольку обычное промывание не гарантирует защиту от внесения незначительных количеств железа. При центрифугировании пробирки следует закрывать пробками из пластмассы, поскольку в них может попасть железная пыль из центрифуги. Кровь для исследований следует брать натощак утром, поскольку существуют суточные биоритмы колебания концентрации железа в сыворотке. Показатели сывороточного железа могут изменяться в зависимости от фаз менструального цикла.
Учет вышеизложенных фактов позволит избежать неточностей в исследованиях и ошибок в диагностике ЖДА.
Критерии лабораторной диагностики ЖДА
Лабораторный показатель
Изменения при ЖДА
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В соответствии с рекомендациями ВОЗ, стандартизованы следующие критерии диагностики железодефицитных анемий у детей:
- снижение уровня СЖ менее 12 мкмоль/л;
- повышение ОЖСС более 69 мкмоль/л;
- насыщение трансферрина железом менее 17%;
- содержание гемоглобина ниже 110 г/л в возрасте до 6 лет и ниже 120 г/л — в возрасте старше 6 лет.
Таким образом, ВОЗ рекомендует достаточно точные критерии для диагностики железодефицитной анемии, однако методы диагностики требуют забора крови из вены и проведения достаточно дорогих биохимических исследований, что не всегда возможно в украинских лечебных учреждениях. Имеются попытки минимизации критериев диагностики железо-дефицитной анемии.
Федеральная служба по заболеваемости, эпидемиологии и образованию (United States Federal Government Centers for Disease Control — CDC) со штаб-квартирой в Атланте (Джорджия, США) рекомендует использовать для диагностики железо-дефицитной анемии 2 доступных критерия: снижение концентрации гемоглобина и гематокрита (Ht) при отсутствии у больного других заболеваний. Устанавливают предположительный диагноз железодефицитной анемии и назначают лечение препаратами железа на 4 нед из расчёта 3 мг элементарного железа на 1 кг массы тела больного в сутки. Достоинство данных рекомендаций — регистрация ответа на терапию препаратами железа по строго фиксированным критериям. К концу 4-й нед лечения концентрация гемоглобина должна повыситься на 10 г/л по отношению к исходной, a Ht — на 3%. Такой ответ подтверждает диагноз «железодефицитная анемия», и лечение продолжают в течение нескольких месяцев. Если ответ не получен, рекомендуют остановить лечение препаратами железа и пересмотреть данный случай с точки зрения диагностики процесса. Перегрузка железом организма за 4 нед при приёме препаратов железа внутрь маловероятна.

Лабораторную диагностику железодефицитной анемии осуществляют с помощью:
- общего анализа крови, выполненного «ручным» методом;
- анализа крови, выполненного на автоматическом анализаторе крови;
- биохимических исследований.
При диагностике любой анемии обязательно выполнение общего анализа крови с определением количества ретикулоцитов. Врач ориентируется на гипохромный и микроцитарный характер анемии. В общем анализе крови, выполненном «ручным» методом, выявляют:
- снижение концентрации гемоглобина ( 12 /л) количество эритроцитов;
- снижение цветового показателя ( 12-16 мм/ч);
- анизоцитоз (характерны микроциты) и пойкилоцитоз эритроцитов.
Ошибка определения параметров может достигать 5% и более. Стоимость одного общего анализа крови составляет около 5 долларов США.
Точным и удобным методом диагностики и дифференциальной диагностики служит метод определения эритроцитарных показателей на автоматических анализаторах крови. Исследование проводят как в венозной, так и в капиллярной крови. Ошибка в определении параметров значительно ниже, чем при «ручном» методе, и составляет менее 1%. При развитии дефицита железараньше всего повышается показатель выраженности анизоцитоза эритроцитов — RDW (норма
Портал iLive не предоставляет медицинские консультации, диагностику или лечение.
Информация, опубликованная на портале, предназначена только для ознакомления и не должна использоваться без консультации со специалистом.
Внимательно ознакомьтесь с правилами и политикой сайта. Вы также можете связаться с нами!
Copyright © 2011 — 2019 iLive. Все права защищены.
источник
Периферическая кровь при железодефицитной анемии. Свойственные крови морфологические изменения заключаются в микроцитозе и гипохромии. Однако эти признаки отражают длительную недостаточность железа, сочетающуюся с тяжелой анемией. Исходно, когда в процессе гемоглобиногенеза отмечается отрицательное влияние недостаточного подвоза железа в костный мозг, кроветворение начинает приспосабливаться к новым условиям. По началу сокращается объем эритроцитов.
Микроцитоз и нормохромия обычное явление у женщин при показателе гемоглобина от 9 до 10 г на 100 мл. Гипохромия развивается, когда показатель уровня гемоглобина падает до меньших значений, причем вначале она умеренная, а затем становится все более выраженной. При тяжелой форме анемии эритроциты имеют кольчатый аспект (аннулоциты) или обретают вид клеток-мишень. Пойкилоцитоз наблюдается лишь при тяжелых формах анемии (Дачие и сотр.).
Показатели эритроцитов свидетельствуют о небольшом объеме (менее 80 мкг3), о количестве гемоглобина менее 27 пг и о средней концентрации гемоглобина на каждый эритроцит (менее 30 г/100/мл.). В принципе число ретикулоцитов в норме или немного больше; лишь е редких случаях их число занижено. Число эритроцитов обычно нормальное или немного меньшее нормы. Вот почему определение не дает точную справку о тяжести анемии. В отдельных случаях, особенно у детей, число эритроцитов превышает 5 млн/мм3. Следует отметить, что, при железодефицитной анемии увеличивается устойчивость эритроцитов к гипотонии.
Наиболее часто число лейкоцитов укладывается в норму. При длительной недостаточности железа развивается умеренная гранулоцитопения. В некоторых случаях выявляются гиперсегментированные нейтрофилы. Их появление при недостатке железа можно объяснить развитием вторичной недостаточности фолиевокислых солей или витамина В12 (Брукнер и сотр.).
В большинстве случаев показатель численности тромбоцитов высокий, однако еше не разработано четкое объяснение этому явлению. Высказана мысль о возможности появления тромбоцитоза в результате активной кровоточивости. В случаях тяжелой или длительной анемии отмечена умеренная тромбоцитопения, обратимая после проведения железотерапии.
У страдающих железодефицитной анемией количество клеточной массы в костном мозге выше нормы. Рост показателя костномозговых клеток объясняется увеличением числа эритробластов. Последние, в частности полихроматофильные и оксифильные меньших размеров, чем нормальные эритробласты в связи с сокращением количества цитоплазмы. Исследование мазка в условиях железодефицитной анемии выявляет не только малые размеры эритробластов, но также их нерегулярный, «изорванный» контур. В таких клетках были описаны аспекты дисэритропоэза и кариорексиса, почкования ядер, в некоторых случаях многоядерность и ядерные фрагменты.
Непосредственное исследование, без окраски, размозженных на стекле зерен костного мозга не выявляет наличие аггрегатов мелких, нерегулярных, золотистых, характерных гемосидерину частиц. Окраска по Перлсу выявляет отсутствие запасного железа в макрофагах и наличие менее 10% сидеробластов (Дачие и сотр.). В целях определения заболевания железодефицитной анемией этот тест представляет наибольшее диагностическое значение.
Сывороточное железо при железодефицитной анемии. Концентрация железа в сыворотке всегда меньше 50 мкг/100 мл., причем в отдельных случаях она не больше 10 мкг/100 мл. Общая связывающая способность железа (ОССЖ), отражающая количество находящегося в кровотоке трансферина, чаще завышена и лишь в редких случаях укладывается в норму или занижена. У больных с заниженной ОССЖ возможно вмешательство и других факторов, например гипопротеинемии (McGibbon и Mollin5). Насыщение трансферином (железо сыворотки/ОССЖ х 100) в любом случае меньше 16%, однако встречаются и случаи 1%-ой насыщенности.
Следует обратить особое внимание на интерпретацию насыщения трансферином у женщин на последнем квартале беременности. У последних насыщение трансферином менее 16% не всегда указывает на наличие недостатка железа. Объяснение такому явлению следует искать в повышении количества трансферина, что характерно беременным независимо от возможного дефицита железа.
Показатель свободного протопорфирина эритроцитов (СПЭ) в принципе характеризуется высокими значениями — более 70 мкг/100 мл. а в отдельных случаях даже больше 300 мкг/мл. При этом следует обратить внимание на тот факт, что на повышение уровня СПЭ влияет больше продолжительность железо дефицита, чем его интенсивность (Dameshek).
Показатель феритина в сыворотке — растворимой формы находящегося в запасе железа—составляет менее 12 мкг/л. у женщин и детей раннего возраста и менее 35 мкг/л. у мужчин. Существует четкая взаимосвясь сывороточного феритина и количеством железа выявляемого в костном мозге и печени путем окраски по Перлсу.
Кинетика железа. В процессе выявления недостатка железа кинетика последнего не применяется как текущий метод. При использовании этого метода обнаруживается весьма быстрый клиренс железа плазмы, перенос железа в костный мозг и его расход нормальными или увеличенными эритроцитами, при этом интенсивность и скорость метаболизма железа эритроцитов больше нормы. Эти данные свидетельствуют о наличии неэффективного кроветворения в условиях недостатка железа:
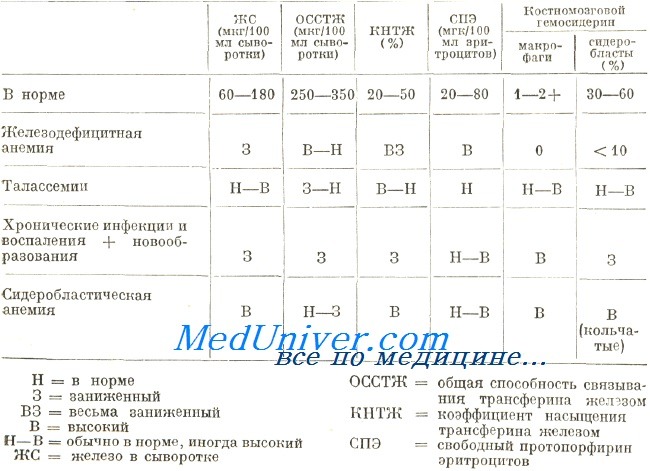
Диагностирование тяжелой железодефицитной анемии по клиническим и лабораторным данным дело несложное, при этом сделанное определение подтверждается терапевтическим испытанием. Осложнения появляются при мало выраженной форме анемии и нечетких клинических и лабораторных признаках. Ниже в таблице приведены морфологические, биохимические и цитохимические данные, на основе которых дифференцируются этапы недостатка железа.
Элементы лабораторного диагноза стадий железной недостаточности
Железодефицитную анемию следует отличать от остальных видов гипохромной анемии. Среди последних, на втором месте по частоте после железодефицитной анемии, находится бета-талассемия (по данным приема для страдающих болезнями крови при Центре гематологии). Учитывая тяжесть заболевания, ранный возраст страдающего и характерную клиническую картину тяжелая бета-талассемия (анемия Кули) распознается без затруднений.
В противоположность этому легкая форма бета-талассемии в отдельных случаях не различима от железодефицитной анемии по клиническим признакам и результатам морфологического исследования крови. Возможные кровоточивость в анамнезе, наблюдаемые в слизистых оболочках и роговых образованиях изменения, равно как и бледность сыворотки подсказывают диагноз железодефицитной анемии. Гипохромия и микроцитоз общее, для обеих групп явление, однако при талассемии они выделяются более ярко.
Отмечаем, что, при талассемии, более характерной чертой микроцитоза это не сокращенный диаметр эритроцитов, а их значительно уменьшенная толщина (микроплатициты). Вот почему выраженная гипохромия с показателем гемоглобина примерно 10 г/100 мл или более подсказывает диагноз талассемии. Также, при железодефицитной анемии с более 8 г/100 мл гемоглобина пойкилоцитоз единичное явление, в то время как при талассемии наблюдается часто. В условиях талассемии выраженный микроцитоз отражается ростом численности эритроцитов, по сравнению с железодефицитной анемией.
Что касается остальных лабораторных данных следует не забывать, что при талассемии чаще наблюдаются такие признаки, как повышенное число ретикулоцитов, полихроматофильных эритроцитов и наличие точечно-базофильных красных кровяных клеток, к тому же осмотическая устойчивость последних больше.
В связи со сказанным для различения этих двух заболеваний наибольшую ценность представляют тесты метаболизма железа. В принципе, при талассемии показатель железа в крови характеризуется нормальными или завышенными значениями. Редко, у больных с хронической кровоточивостью развивается гипосидеремия. В таких случаях ОССТЖ, показатель которой при талассемии отличается низкими значениями (обычно менее 250 мкг/100 мл), увеличивается до нормы и даже более.
За исключением случаев, осложненных недостатком железа, костномозговые запасы железа при талассемии укладываются в норму или несколько больше. В отдельных случаях количество железа в митохондриях нормобластов очень велико, что создает аспект кольчатых сидеробластов.
Анемия с многонедельным течением, развивающаяся при инфекциях и хронических воспалениях, в принципе носит нормоцитный и нормохромный характер, причем эта характеристика действительна и в отношение анемий, наблюдаемых при свежих новообразованиях. Но после длительного течения в условиях этих заболеваний анемия становится микроцитной и гииохромной. В подобном случае различение этой анемии от железодефицитной возможна путем выявления первичного заболевания, в частности посредством лабораторных исследований. Морфологическое исследование крови не представляет данные, способствующие дифференциальному диагнозу.
Элементы дифференциальной диагностики при гипохромной анемии
Концентрация железа в сыворотке невелика в обеих группах заболеваний, в то время как показатель ОССТЖ в принципе высокий при железодефицитной анемии и низкий при хронических воспалениях и новообразованиях. По этой причине коэффициент насыщенности трансферина меньше у страдающих железодефицитной анемией. Обследование дополняется определением гемосидерина на костномозговом мазке. В костном мозге страдающих хроническим воспалением и новообразованием содержатся макрофаги, загруженные гемосидерином, который всегда отсутствует в условиях железодефицитной анемии. При обоих заболеваниях сидеробласты обнаруживаются в малом количестве или совсем отсутствуют.
В процессе, диагностирования возникают затруднения и в случае сидеробластической анемии. Тем не менее, в условиях сидеробластической анемии, эритроциты отличаются частным видом. На мазге различаются две популяции эритроцитов, из них одна микроцитная и гипохромная) другая — макроцитная и нормохромная («частичная гипохромия»). Дифференциальная диагностика основывается на определении метаболизма железа, который, при сидеробластической анемии, отражает нормальную или завышенную сидеремию, нормальную или низкую ОССТЖ и высокий показатель гемосидерина в костном мозге с наличием кольчатых сидеробластов.
Из гемолитических анемий наличие гипохромии отмечается при гемоглобинопатиях К, КС, Е, Кёлн. В отдельных случаях наблюдаются клетки мишень. Высокие показатели сидеремии и гемосидерина в костном мозге исключают возможность наличия железодефицитной анемии. Гемолитическая анемия с хроническим внутрисосудистым гемолизом, в частности ночной пароксизмальной гемоглобинурией сочетается с характерной для железодефицитной анемии картиной. Дифференциация возможна по признакам гемолиза и данным лабораторных анализов специфических ночной пароксизмальной гемоглобинурии.
После проведения курса лечения витамином В12 или фолиевой кислотой сидеремия и запасы железа быстро сокращаются под влиянием ускоренного эритропоэза. Это сокращение четко выражено у женщины с небольшим запасом железа. Дифференциальная диагностика представляет трудности, поскольку признаки мегалобластоза в костном мозге исчезают после проведения специфической терапии. В таком случае наиболее важным представляется исследование мазка крови, выявляющее наличие макроцитоза с нормохромией и гиперсегментирование нейтрофилов.
Нередко исследование мазка крови страдающего недостатком железа указывает на наличие нормохромии. Вот почему представляется важной постановка дифференциального диагноза по сравнению с группой нормохромных анемий. Отсутствие костномозгового гемосидерина характеризует железодефицитную анемию, даже при ее умеренной форме.
Необходимо отметить, что в условиях истинной полицитемии, эритроциты нередко гипохромные уже при первом обследовании врача, до вскрытия вен. К тому же обнаруживается невысокая сидеремия и отсутствие костномозгового запаса железа. Тем не менее истинная полицитемия отличается характерной клинической и лабораторной симптоматологией.
источник
Комплексное исследование количественного и качественного состава форменных элементов и биохимических показателей крови, которое позволяет оценить насыщенность организма железом и обнаружить недостаточность данного микроэлемента даже до появления первых клинических признаков железодефицита.
Результаты исследований выдаются с бесплатным комментарием врача.
Колориметрический фотометрический метод, SLS (натрий лаурил сульфат) – метод, кондуктометрический метод, проточная цитофлуориметрия, иммунотурбидиметрия.
Мкмоль/л (микромоль на литр), *10^9/л, *10^12/л, г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за 24 часа до исследования.
- Прекратить принимать пищу за 8 часов до исследования, можно пить чистую негазированную воду.
- Не употреблять лекарственные препараты в течение 24 часов перед анализом (по согласованию с врачом).
- Исключить прием лекарственных препаратов, содержащих железо, в течение 72 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Нехватка железа встречается довольно часто. Около 80-90 % всех форм анемий связано с дефицитом данного микроэлемента.
Железо содержится во всех клетках организма и выполняет несколько важных функций. Основная его часть входит в состав гемоглобина и обеспечивает транспорт кислорода и углекислого газа. Некоторое количество железа является кофактором внутриклеточных ферментов и участвует во многих биохимических реакциях.
Железо из организма здорового человека постоянно выводится с потом, мочой, слущивающимися клетками, а также менструальными выделениями у женщин. Для поддержания количества микроэлемента на физиологическом уровне необходимо ежедневное поступление в организм 1-2 мг железа.
Всасывание данного микроэлемента происходит в двенадцатиперстной кишке и верхних отделах тонкой кишки. Свободные ионы железа токсичны для клеток, поэтому в организме человека они транспортируются и депонируются в комплексе с белками. В крови железо переносится белком трансферрином к местам использования или накопления. Апоферритин присоединяет железо и образовывает ферритин, который является основной формой депонированного железа в организме. Его количество в крови взаимосвязано с запасами железа в тканях.
Общая железосвязывающая способность сыворотки (ОЖСС) является непрямым показателем уровня трансферрина в крови. Она позволяет оценить максимальное количество железа, которое может присоединить транспортный белок, и степень насыщения трансферрина микроэлементом. При уменьшении количества железа крови насыщение трансферрина снижается и, соответственно, ОЖСС возрастает.
Дефицит железа развивается постепенно. Вначале возникает отрицательный баланс железа, при котором потребности организма в железе и потери данного микроэлемента превышают объемы его поступления с пищей. Это может быть связано с потерей крови, беременностью, скачками роста в период полового созревания или недостаточным употреблением продуктов, содержащих железо. В первую очередь железо мобилизируется из запасов ретикулоэндотелиальной системы для компенсации потребностей организма. Лабораторные исследования в этот период выявляют уменьшение количества ферритина сыворотки крови без изменения других показателей. Вначале клинические симптомы отсутствуют, уровень железа в крови, ОЖСС и показатели клинического анализа крови находятся в пределах референсных значений. Постепенное истощение депо железа в тканях сопровождается повышением ОЖСС.
На этапе железодефицитного эритропоэза синтез гемоглобина становится недостаточным и развивается железодефицитная анемия с клиническими проявлениями малокровия. В клиническом анализе крови обнаруживаются небольшие бледноокрашенные эритроциты, снижаются показатели МНС (среднее количество гемоглобина в эритроците), MCV (средний объем эритроцита), МСНС (средняя концентрация гемоглобина в эритроците), падает уровень гемоглобина и гематокрит. При отсутствии лечения количество гемоглобина в крови прогрессивно снижается, изменяется форма красных кровяных телец, сокращается интенсивность деления клеток в костном мозге. Чем глубже дефицит железа, тем ярче становится клиническая симптоматика. Утомляемость переходит в выраженную слабость и вялость, утрачивается трудоспособность, бледность кожных покровов становится более выраженной, изменяется структура ногтей, появляются трещины в углах губ, возникает атрофия слизистых, кожа становится сухой, шелушащейся. При дефиците железа у больного меняется способность чувствовать вкус и запах – возникает желание есть мел, глину, сырые крупы и вдыхать запахи ацетона, бензина, скипидара.
При своевременной и правильной диагностике железодефицита и причин, вызвавших его, лечение препаратами железа позволяет восполнить запасы этого элемента в организме.
Для чего используется исследование?
- Для ранней диагностики железодефицита.
- Для дифференциальной диагностики анемий.
- Для контроля за лечением препаратами железа.
- Для обследования лиц, у которых существует высокая вероятность железодефицита.
Когда назначается исследование?
- При обследовании детей в период интенсивного роста.
- При обследовании беременных.
- При симптомах недостаточности железа в организме (бледность кожных покровов, общая слабость, утомляемость, атрофия слизистой языка, изменение структуры ногтей, аномальные вкусовые предпочтения).
- При выявлении гипохромной микроцитарной анемии по данным клинического анализа крови.
- При обследовании девушек и женщин с обильными менструальными выделениями и маточными кровотечениями.
- При обследовании ревматологических и онкологических больных.
- При контроле за эффективностью применения препаратов, содержащих железо.
- При обследовании пациентов с астенией неясного генеза и выраженной утомляемостью.
источник
Цель занятия: Изучить патогенез, клинику и лабораторную диагностику анемий.
Патогенез железодефицитной анамии
Патогенез мегалобластной анамии
Патогенез анамии при хронических заболеваниях
Принципы лабораторной диагностики анемий.
Изменение гематологических показателей при различных анемиях
Правильно назначить лабораторные исследования необходимые для подтверждения диагноза анемия.
Определить характер анемии по изменениям в гематологическом исследовании.
Анемия может быть проявлением широчайшего спектра различных заболеваний и, соответственно, является одним из самых распространенных видов патологии.
Распространенность и разнообразие анемий являются предпосылками к возникновению достаточно часто встречающихся диагностических и тактических ошибок. Кроме того, до сих пор дискутируются некоторые вопросы классификации, этиологии, патогенеза, диагностики и лечения анемий. Анемия характеризуется уменьшением количества гемоглобина, которое проявляется снижением его концентрации в единице объема крови. Поэтому при определении выраженности анемии лучше ориентироваться на показатели гемоглобина.
Таким образом, для взрослых мужчин анемия — это снижение концентрации гемоглобина в периферической крови менее 135 г/л, для взрослых женщин — менее 115 г/л. У новорожденных нижней границей нормальной концентрации гемоглобина считается 150 г/л. У детей старше 3 месяцев признаком анемии будет содержание гемоглобина 110 г/л. При проведении серии исследований крови у одного больного снижение концентрации гемоглобина на 10 г/л должно расцениваться как анемия.
Концентрация гемоглобина определяется общим его содержанием в периферической крови и объемом плазмы. При дегидратации (ожоги, обильный диурез, и пр.) концентрация гемоглобина может быть нормальной даже при значительном уменьшении общего его количества. И наоборот, концентрация гемоглобина может быть снижена при нормальном общем его количестве у больных с увеличенным объемом плазмы (недостаточность кровообращения, беременность).
Как правило, анемия является проявлением какого-либо заболевания, а не самостоятельным видом патологии. Кроме того, следует подчеркнуть, что анемия обычно не является единственным синдромом данного вида патологии и важно помнить о негематологических его проявлениях.
Распросраненность анемий широко варьирует в зависимости от пола, возраста населения, а также социально-бытовых и этнографических условий. Соотношение различных видов анемий также значительно различается в разных регионах. В среднем анемия выявляется более чем у 10% населения.
КЛИНИЧЕСКИЕ ПРИЗНАКИ АНЕМИЙ
Клинические признаки анемий зависят от формы патологии, выраженности и продолжительности существования анемии. Анемия приводит к снижению оксигенации органов и тканей, которая может быть компенсирована улучшением кровоснабжения (повышением частоты сердечных сокращений и ударного объема ) и уменьшением сродства гемоглобина к кислороду с помощью 2,3-ДФГ. Выраженность анемического синдрома может широко варьировать и определяется четырьмя основными факторами:
1. Скорость развития анемии. Быстро развившаяся анемия сопровождается значительно более выраженной симптоматикой, чем медленно развившаяся, при которой есть время для адаптации сердечно-сосудистой системы и выработки нужного количества 2,3-ДФГ в эритроцитах.
2. Выраженность анемии. Умеренно выраженная анемия (содержание гемоглобина более 90 г/л) может не сопровождаться специфическими жалобами и симптомами, в то время как дальнейшее снижение гемоглобина обычно сопровождается клиническими проявлениями анемического синдрома.
3. Возраст больного. Пожилые пациенты переносят анемию хуже, чем молодые, поскольку компенсаторные возможности сердечно-сосудистой системы у них, как правило, снижены.
4. Сродство гемоглобина к кислороду. Анемия, в общем, сопровождается повышением содержания 2,3-ДФГ в эритроцитахи “сдвигом вправо” кривой диссоциации кислорода в крови, в связи счем кислород легче отдается тканям.
При сборе жалоб и анамнеза особое внимание следует обратить на следующие признаки:
признаки кровопотери (мелена, гематурия, меноррагия, метроррагия);
признаки патологии гемостаза (послеоперационные кровотечения, спонтанные крововоизлияния, кровотечения при родах и т.п.);
применение медикаментов, которые могут вызвать депрессии кроветворения, гемолиз и т.д.;
признаки поражения нервной системы и желудочно-кишечного тракта, характерные для дефицита витамина В 12 (парестезии, нарушение походки. боли в языке, зловонный стул);
признаки новообразования (снижение массы тела. немотивированная лихорадка, оссалгии и пр.);
профессиональные вредности (ионизирующие излучения, тяжелые металлы, ароматические углеводороды и т. д.);
перенесенные инфекции (гепатит при апластической анемии, индуцированные инфекцией гемолиз, красноклеточная аплазия);
характер питания (дефицит продуктов, содержащих железо, витамины В 12 , Е, фолиевую кислоту, наличие извращений вкукса придефиците железа);
Кроме того, имеет значение пол больног (наследуемые с Х хромосомой дефициты глюкозо-6-фосфатдегидрогеназы и фосфоглицераткиназы у мужчин), его возраст (анемии у новорожденных как правило связаны с врожденной патологией синтеза гемоглобина, дефицит витамина В 12 чаще встречается у пожилых и т.п.) и этническая характеристика, например, талассемии чаще встречаются у жителей Закавказья и Средней Азии. Следует выяснить, не было ли у родственников больного анемии, желтухи, желчнокаменной болезни, т.е. признаков наследственной анемии.
Объективные признаки анемий можно разделить на общие и специфические для отдельных видов анемий. К наиболее часто встречающимся общим признакам анемии можно отнести бледность кожи, слизистой полости рта, конъюнктивы, ногтевого ложа, кожных складок на ладонях и т.д. Появление бледности связано с двумя основными причинами: снижением концентрации гемоглобина и перераспределением кровотока для улучшения оксигенации жизненноважных органов. Поэтому точно определить степень анемии с помощью этих признаков трудно. Считается, что бледность конъюнктивы появляется при концентрации гемоглобина 100 г/л.
Специфичные для отдельных видов анемий объективные признаки включают койлонихии при дефиците железа, желтуху при гемолитической или мегалобластной анемии, язвы голеней при серповидноклеточной анемии, деформации костей талассемии и т.д.
При объективном исследовании больного с анемией особое внимание следует обратить на следующие признаки:
кожа: гиперпигментация ( анемия Фанкони ), желтуха (гемолитические анемии, мегалобластные анемии, апластическая анемия), подкожные кровоизлияния (апластическая анемия, инфильтрация костного мозга злокачесвенными клетками, иммунная анемия и тромбоцитопения), инфекционные экзантемы( анемия при хронических инфекционных заболеваниях);
лимфаденопатия ( инфильтрация костного мозга злокачесвенными клетками, анемия при хронических воспалительных и злокачественных заболеваниях);
болезненность костей (лейкоз, злокачественная лимфома, солидные опухоли);
ротовая полость: глоссит. (дефицит витамина В 12 , железа), ангулярный стоматит(дефицит железа), кровоизлияния(апластическая анемия, лейкоз), уремический запах ( анемия при уремии);
брюшная полость: гепатомегалия спленомегалия(лейкоз, лимфома, солидные опухоли, врожденная гемолитическая анемия, потология печени), асцит(солидные опухоли, лимфома) и другие признаки новообразования;
органы таза. прямая кишка: признаки кровотечения, новообразования;
нервная система: нарушение чувствительности. нарушение вибрационной чувствительности, неустойчивость в позе Ромберга(дефицит витамина В 12 ), менингеальные знаки (нейролейкоз);
эндокринная система: признаки гипотиреоза.
ЛАБОРАТОРНЫЕ ПРИЗНАКИ АНЕМИЙ
Лабораторные признаки анемий являются основой диагностики анемий. Особое значение имеют размеры эритроцита и его объем, содержание гемоглобина в эритроците, форма эритроцита, патологические включения в эритроцитах. в последние годы все шире в внедряется в практику применение современных автоматических анализаторов периферической крови, с помощью которых можно быстро и высокой точностью определить, помимо обычны[ параметров (концентрация гемоглобина, содержание эритроцитов, гематокрит), средний объем эритроцита, среднее содержание гемоглобина в эритроците, среднюю концентрацию гемоглобина в эритроците и индекс анизоцитоза.
1. Размер эритроцита. При анемиях эритроциты могут быть нормального размера (нормоцитарные), а также больше (макроцитарные) и меньше нормы (микроцитарные).
Аномальные размеры эритроцитов могут встречаться и при некоторых физиологических состояниях . У новорожденных в течение первых нескольких недель размеры эритроцитов значительно превышают норму, затем они становятся меньше нормы и постепенно в течение нескольких лет достигают нормальных размеров. При нормальной беременности отмечено умеренное увеличение размеров эритроцитов даже при отсутствии других причин макроцитоза например, дефиците фолиевой кислоты. В некоторых случаях можно выявить сочетание микроцитоза и макроцитоза (например, одновременный дефицит железа и витамина В 12 ), при этом средний объем эритроцитов может быть нормальным.
Определение размеров эритроцитов с помощью светового микроскопа производится при подсчете кривой Прайс-Джонса ( диаметр эритроцитов) или с помощью автоматического анализатора крови (объем эритроцитов, гистограмма, индекс анизоцитоза).
Наличие эритроцитов разных размеров называется анизоцитозом.
2. Определение цветового показателя и содержания гемоглобина в эритроците (MCH) позволяет разделить анемии на гипохромные , нормохромные и гиперхромные.
Поскольку гемоглобин составляет основную часть эритроцита , существует отчетливая зависимость между размерами эритроцита и содержанием в нем гемоглобина, т. е. микроцитарные анемии как правило гипохромные, макроцитарные — гиперхромные, а нормоцитарные — нормохромные.
Определение размеров эритроцитов и содержания в них гемоглобина позволило создать полезную для клинической работы морфологическую классификацию анемий. Эта классификация позволяет с помощью минимального количества признаков с достаточной точночтью определить патогенез анемии и выработать тактику диагностического поиска. Кроме того, аномальные показатели эритроцитов могут выявляться и при номальном или субнормальном содержании гемоглобина, например, макроцитоз на ранней стадии дефицита витаминВ 12 или фолиевой килоты. В этих случаях возможно раннее выявление и лечение патологии.
3. Форма эритроцитов имеет важное значение для диагностики анемий, особенно гемолитических.
4. Аномальные включения в эритроцитах, выявляемые при микроскопическом исследовании, также могут помочь в диагностике анемий .
5. Содержание ретикулоцитов в норме составляет 0,5-2,0% или 25-75 х 10*12/л. При сохраненном эритропоэзе снижение количества эритроцитов сорповождается выработкой эритропоэтина, ускоренным выходом ретикулоцитов в периферическую кровь и ретикулоцитозом. Эта рекция особенно выражена при гемолитических анемиях, когда развивается эритроидная гиперплазия. Другими причинами ретикулоцитоза могуть быть:
2.Восстановление ранее поврежденного эритропоэза, например, ретикулоцитарный криз после начала лечения витамином В 12 ;
3. Метастазы опухолей в костный мозг.
Отсутствие ретикулоцитоза у больного с анемией свидетельствует о нарушении эритропоэза или дефекте выраборотки эритропоэтина. У больных с выраженной анемией необходимо производить коррекцию количества ретикулоцитов в зависимовти от количества эритроцитов, иначе возможна диагностическая ошибка.
Применение автоматических анализаторов крови может сопровождаться диагностическими ошибками. Можно выделить два источника этих ошибок: технические нарушения и особенности крови больного ( при лейкоцитозе > 25 x 10*9/л искусственно повышается гемоглобин из-за снижения прозрачности; при очень высоком лейкоцитозе лейкоциты могут считаться вместе с эритроцитами; при наличии холодовых антител в высоком титре и образовании агрегатов эритроцитов искусственно снижается гемоглобин и повышается МСНС — кровь надо подогреть).
7. Исследование костного мозга обязательно при обследовании больного с любой неясной анемией. Особенно диагностическая ценность исследования костного мозга при анемии вследствие нарушения продукции эритроцитов. При этом, чем тяжелее анемия, тем выше информативность показателей морфологии костного мозга.
Показанием к проведению трепанобиопсии является диагностика апластической анемии, милопролиферативных заболеваний, остеомиелофиброза, метастазов опухолей и пр.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА АНЕМИЙ
Начальную дифферинциальную диагностику анемий можно провести на основании результатов клинического обследования больного и общеклинического анализа крови. Диагностический поиск начинается с выяснения патофизиологических причин развития анемии. Прежде всего необходимо выяснить: связана ли анемия с кровопотерей, с нарушеним продукции эритроцитов или с их повышенным разрушением. Источником ошибки прииспользовании этого алгоритма может быть применение количества ретикулоцитов без коррекции.
Для более подробной диагностики анемий на основе показателей общеклинического анализа крови можно использовать предлагаемый алгоритм. В данном случае возможна ошибка в случае комбинированных дефицитов (Fe+B 12 , Fe+фолиевая кислота), когда эритроцитарные индексы могут быть нормальными.
Железодефицитная анемия, т.е. анемия, развивающаяся, когда количество железа, поступающего в костный мозг, недостаточно для нормальной продукции эритроцитов. ЖДА — наиболее распространенная причина анемии во всем мире. В европейских странах дефицит железа выявляется примерно у 20% женщин и 2% мужчин.
Железо является одним из самых распространенных элементов земной коры, и при этом его дефицит — основная причина анемий. Это кажущееся противоречие объясняется высокой частотой кровопотерь и ограниченной способностью желудочно-кишечного тракта к всасыванию железа.
Средняя суточная диета содержит 10-15 мг железа, из которого абсорбируется только 5-10%. Обычно в сутки всасывается не более 3,5 мг железа. При некоторых состояниях, например, дефиците железа или беременности,доля абсорбируемого железа может увеличиться до 20-30%, но все равно основная часть диетического железа не утилизируется.
Ежедневная потребность в железе зависит в основном от пола и возраста (таб.16), особенно она велика при беременности, у подростков и менструирующих женщин. Именно у этой категории людей наиболее высока вероятность развития дефицита железа, если возникает дополнительная его потеря или недостаточное поступление.
Главной причиной возникновения дефицита железа является хроническая кровопотеря в результате маточных и желудочно-кишечных кровотечений. Один мл цельной крови содержит примерно 0,5 мг железа, так что, несмотря на усиление всасывания железа у таких лиц, хроническая потеря даже небольших объемов крови приводит к дефициту железа. У женщин дефицит железа чаще возникает вследствие меноррагий (потеря более 80 мл крови в течение менструального цикла) или других вариантов гинекологической патологии. Тем не менее всем больным с железодефицитной анемии показано тщательное обследование желудочно-кишечного тракта для выявления возможного источника кровопотери.
Повышение потребности в железе у младенцев, подростков, беременных и кормящих грудью женщин способствует развитию дефицита железа. У новорожденных имеется запас железа из разрушающегося избыточного количества эритроцитов, однако к 3-6 месяцам эти запасы истощаются в связи с быстрым ростом, и возникает вероятность развития дефицита железа. Увеличение потребности в железе у беременных складывается из увеличения на 35% общего количества эритроцитов, передачи 300 мг железа плоду и кровопотери при родах. В общем, в ходе беременности и рождения ребенка женщина теряет примерно 500 мг железа.
Нарушение всасывания железа редко является единственной причиной железодефицитной анемии. Тем не менее, гастрэктомия (ускоренное прохождение пищи), хронический дуоденит, хронический атрофический гастрит, энтерит могут способствовать возникновению дефицита железа. Следует помнить, что сам дефицит железа способствует развитию хронического атрофического гастрита и дуоденита.
Подсчитано, что у взрослого мужчины, совсем не получающего железа из-за неадекватного поступления его с пищей или нарушения всасывания, железодефицитная анемия возникнет примерно через 8 лет. Поэтому всегда следует предусмотреть возможность одновременного существования нескольких причин дефицита железа.
Редко железодефицитная анемия может быть обусловлена нарушением инкорпорации связанного с трансферрином железа эритроидными клетками вследствие дефекта или отсутствия рецепторов к трансферрину. Эта патология может быть как врожденной, так и приобретенной вследствие появления антител к этим рецепторам.
По мере развития дефицита запасы железа в организме (ферритин, гемосидерин макрофагов ретикулоэндотелиальной системы) полностью истощаются до того как развивается анемия и возникает так называемый латентный дефицит железа. При прогрессировании дефицита возникает железодефицитный эритропоэз, а затем — анемия.
Дефицит железа приводит к развитию не только анемии, но и к негематологическим его последствиям. Они включают в себя замедление развития плода при тяжелом дефиците железа у матерей, изменения кожи, ногтей и слизистых оболочек, нарушение функции мышц, снижение толерантности при отравлениях тяжелыми металлами. Изменение поведения, снижение мотивации, интеллектуальных способностей также отмечены при дефиците железа. Известно, что негематологические проявления дефицита более выражены у детей, чем у взрослых. Восстановление запасов железа обычно приводит к исчезновению указанных изменений.
Поскольку дефицит железа обычно развивается постепенно, симптоматика его, особенно в начальном периоде, может быть скудной. По мере прогрессирования заболевания появляются признаки так называемого сидеропенического синдрома: мышечная слабость, снижение работоспособности и толерантности к физической нагрузке, извращения вкуса и обоняния (pica chlorotica — больным нравится вкус мела, извести, запах краски, бензина и пр.), своеобразные изменения кожи, ногтей, волос, слизистых оболочек (глоссит, ангулярный стоматит, легко ломающиеся ногти и пр.). Эти симптомы могут появляться при нормальном содержании гемоглобина, т.е. при латентном дефиците железа.
Снижение концентрации гемоглобина сопровождается появлением признаков анемического синдрома: общей слабости, головокружения, сердцебиения одышки при физической нагрузке и т.п.
У многих больных железодефицитной анемией часто появляются жалобы, связанные с патологией желудочно-кишечного тракта (как правило, атрофического гастрита с ахлоргидрией): боли, чувство тяжести в эпигастральной области после приема пищи, снижение аппетита и т.д.
Лабораторные исследования позволяют выявить все этапы развития дефицита железа. Латентный дефицит железа будет характеризоваться резким уменьшением или отсутствием депозитов железа в макрофагах костного мозга, которые выявляются с помощью специальной окраски. Второй признак истощения запасов железа в организме — снижение ферритина в сыворотке крови ( N: м -30-300 нг/мл, ж — 20-120нг/мл, дети — 7-140нг/мл).
Железодефицитный эритропоэз сопровождается появлением умеренного гипохромного микроцитоза при нормальной концентрации гемоглобина. Повышается уровень ненасыщенных трансферринов ( больше 2/3 от общего N=23-45 мкмоль/л), снижается содержание насыщенных трансферринов ( 12 могут определяться одновременно гипохромные микроциты и гиперхромные макроциты.
Наверное одними из самых распространенных ошибок в диагностике анемий являются ошибки в дифферинциальном диагнозе гипохромных микроцитарных анемий.
Дифферинциальный диагноз проводится с талассемией, сидеробластной анемией и анемией при хронических заболеваниях.
При сборе анамнеза следует обратить внимание на наличие признаков кровотечения, хронических воспалительных заболеваний. Сведения о наследственности или происхождении больного могут вызвать предположение о талассемии.
Клиническим отличием железодефицитных анемий от указанных является наличие сидеропеничечкого синдрома. Тщательное клиническое обследование позволяет выявить признаки хронического воспалительного или злокачественного заболеваия, увеличение сезенки при талассемии.
При дефиците железа микроцитоз и гипохромия выражены пропорциональны степени анемии. Для анемии при хронических заболеваниях характерны небольшие гипохромия и микроцитоз. Врожденные варианты сидеробластной анемии характеризуются выраженной гипохромией и микроцитозом, а для приобретенных выраженный микроцитоз нехарактерен.
При гетерозиготной бета-талассемии или вариантах альфа-талассемии микроцитоз более выражен, чем гипохромия эритроцитов. анизоцитоз меньше, чем при железодефицитной анеми6 а мишеневидность и базофильная пунктация эритроцитов больше. Содержание гемоглобина А2 повышено при бета-талассемии и снижено прижелезодефицитной анемии и альфа-талассемии. Диагноз альфа-талассемии вероятен при исключении других причин гипохромной микроцитарной анемии с нормальным количеством эритроцитов (выраженный микроцитоз).
При талассемии содержание сывороточного железа повышено или нормальное, а у больных анемиями, обусловленными хроническими заболеваниями и дефицитом железа, снижено. Определение концентрации ферритина в периферической крови и содержащих железо макрофагов в костном мозге позволяет отличить железодефицитную анемию от анемии при хронических заболеваниях. Диагноз сидеробластной анемии устанавливается на основании определениисидеробластов в костном мозге.
Если диагностика железодефицитной анемии при выполнении соответствующих исследованиях обычно не представляет существенных проблем, то определение причины ее не всегда бывает простым, а нередко требует настойчивости врача и комплексного обследования больного. Одной из наиболее часто встречающихся ошибок при обследовании и лечении больных ЖДА является невыявление источника кровотечения. Особое внимание следует обратить на больных пожилого возраста, у которых дефицит железа может быть первым признаком злокачественного новообразования.
У девочек-подростков и женщин детородного возраста основной причиной дефицита железа обычно является меноррагия и повторные беременности, хотя следует исключить и другие возможные причины. У мужчин и женщин постменопаузного возраста основной причиной дефицита железа является кровотечение из желудочно-кишечного тракта и диагностический поиск должен быть направлен на выявление его источника. Всем больным с железодефицитной анемией показано тщательное обследование желудочно-кишечного тракта с исследованием кала на скрытую кровь, проведением фиброгастродуоденоскопии, ректороманоскопии. При необходимости показано проведение рентгеноскопии пищевода и желудка, ирригоскопии, фиброколоноскопии, УЗИ и компъютерной томографии органов брюшной полости. Если анализ на скрытую кровь свидетельствует о кровотечении из желудочно-кишечного тракта, а указанные методы не привели к идентификации источника, может быть проведена ангиография сосудов брюшной полости для исключения гемангиомы. точным методом идентификации кровотечения из желудочно-кишечног тракта является прба с радиоактивным хромом, при которой эритроциты больного после инкубации с хромом реинфузируются больному, а затем в течении 5 дней производится радиоактивная оценка кала больного. Обследование желудочно-кишечного тракта позволяет одновременно выявить причины возможного нарушения всасывания железа.
Если маточная и желудочно-кишечная кровопотери не подтверждаются, следует исключить более редкие ее источники (изолированный гемосидероз легких, макрогематурию, а также гемосидеринурию вследствие хронического внутрисосудистого гемолиза),
Следует еще раз подчеркнуть,что недостаток железа в пище и нарушение его всасывания реко бывают единственной причиной дефицита железа.
АНЕМИЯ, ОБУСЛОВЛЕННАЯ ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Анемия, обусловленная хроническими воспалительными и злокачественными заболеваниями — это вариант анемии, о котором относительномало сведений в нашей литературе, хотя это один из наиболее расространенных видов анемии. Анемия, обусловленная хроническими заболеваниями — это умеренно выраженная (концентрация гемоглобина обычно не менее 90 г/л) непрогрессирующая нормохромная или умеренно гипохромная анемия, которая, как правило, сочетается с гемосидерозом макрофагов ретикулоэндотелиальной системы (РЭС).
Среди заболеваний способствующих развитию таких анемий, можно выделить несколько групп.
В патогенезе анемий, обусловленными хроническими воспалительными и злокачественными заболеваниями, принимают участие по крайней мере три механизма: укорочение продолжительности жизни эритроцитов, нарушение реакции эритропоэза на анемию и нарушение способности макрофагов РЭС отдавать железо эритроидным клеткам.
Абсорбция железа в желудочно-кишечном тракте при таких анемиях нормальная или сниженная, но в любом случае достаточная для поддержания нормальных запасов железа.
Скорость снижения концентрации гемоглобина зависит от вида патологии и от выраженности воспалительного процесса. при инфекционных заболеваниях эта скорость составляет примерно 18 г/л за 1 неделю активного воспалительного периода. Достигнув определенного уровня (обычно 90 г/л), снижение концентрации гемоглобина прекращается.
Клинические признаки анемии, обусловленной хроническими воспалительными или злокачественными заболеваниями, определяются, прежде всего, проявлениями основной патологии. Поскольку снижение гемоглобина обычно небольшое, определяются признаки умеренно выраженного анемического синдрома. Клинически значимого сидеропенического синдрома у таких больных не бывает.
1. Умеренно выраженная нормоцитарная нормохромная или умеренная гипохромная анемия;
2. Непрогрессирующая анемия, выраженность которой зависит от активности основного заболевания;
3. Содержание сывороточного железа — снижено, ненасыщенных трансферринов — повышено;
4. Содержание ферритина в сыворотке нормальное или повышенное;
5. Содержание железосодержащих макрофагов в костном мозге нормальное или повышенное, количество сидеробластов снижено или они не определяются.
Дифферинциальный диагноз. Анемию, обусловленную хроническими воспалительными или злокачественными заболеваниями, следует отличать от других гипохромных анемий.
Необходимо подчеркнуть, что у таких больных патогенез анемии может быть комплексным. Например, у больных злокачественными новообразованиями желудочно-кишечного тракта хроническая кровопотеря может привести к дефициту железа, а метастазы в костный мозг — к миелофтизной анемии. Анемия хронических заболеваний при ревматоидном артрите часто сочетается с железодефицитной, вследствие хронических желудочных кровотечений на фоне применения противовоспалительных препаратов. Поэтому у каждого больного необходимо исключить все возможные причины анемии. Если содержание гемоглобина менее 90 г/л, то маловероятно, что единственной причиной его снижения является анемии, обусловленная хроническим заболеванием.
АНЕМИИ, ОБУСЛОВЛЕННЫЕ НАРУШЕНИЕМ СИНТЕЗА ДНК МЕГАЛОБЛАСТНЫЕ
Эта группа анемий характеризуется наличием в костном мозге мегалобластов — клеток эритроидного ряда, в которых вследствие нарушения синтеза ДНК развитие ядра отстает отразвития цитоплазмы. Отставание ядра приводит к образованию необычно крупных клеток с характерной “нежной” структурой ядерного хроматина и хорошо гемоглобинизированной цитоплазмой. Наиболее часто мегалобластные анемии возникают вследствие дефицита витамина В 12 или фолиевой кислоты, другие причины встречаются значительно реже.
Мегалоблатные изменения свойсвенны не только эритроидным клеткам, при соответствующих условиях они могут возникать и в других клетках костного мозга, а также в клетках эпителия желудочно-кишечного тракта и пр.
Витамин В 12 синтезируется микроорганизмами, человек получает его с пищей. Основными источниками витаминаВ 12 являются продукты животного происхождения (печень, мясо, рыба) в растительных прдуктах витамина В 12 нет.
Обычная диета содержит витамин В 12 в количестве, значительно превосходящем дневную потребность.
Витамин В 12 является коэнзимом для двух биохимических реакций: превращения гомоцистеина в метионин с помощью метилтетрагилрофолата и конверсии метилмалонил коэнзима А в сукцинил коэнзим А.
Фолиевая кислота является предшественником большой группы соединений — фолатов, играющих важную роль в метаболических реакциях организма (синтез пуринов и пиримидинов, а также превращение гомоцистеина в метионин и серина в глицин). Нарушение синтеза пиримидина, возникающее при дефиците фолиевой кислоты, приводит к нарушению синтеза ДНК и является биохимической основой мегалобластных анемий.
Вклетки организма из плазмы поступает метилтетрагидрофолат, но для дальнейших биохимических реакций необходимо его превращение в тетрагидрофолат. для этого превращения и нужен витамин В 12 .
Мегалобластные анемии, не связанные с дефицитом витамина в 12 или фолиевой кислоты, также возникают вследствие нарушения синтеза пуринов или пиримидинов.
Удвоение хромосомной ДНК при наличии дефицита пуринов или пиримидинов может нарушаться, что приводит к хромосомным поломкам, гибели клеток в “S” фазе клеточного цикла и неэффективному эритропоэзу.
Основной причиной дефицита витамина В 12 является пернициозная анемия. Значительно реже он возникает в результате недостатка его в пище, гастрэктомии или патологии кишечника. Дефицит витамина В 12 не возникает вследствие повышения потребности в нем или потери витамина из организма, поскольку запасы в организме истощаются только через 2-4 года после прекращения поступления. Кратковременную инактивацию витамина В 12 в организме может вызвать применение закиси азота при анестезии.
Причиной пернициозной анемии(ПА) является аутоиммунное поражени слизистой желудка, с развитием атрофического гастрита и наушением продукции соляной кислоты и внутреннего фактора.
ПА возникает у женщин чаще, чем (1,6:1), обычно в возрасте старше 60 лет. Нередко встречается сочетание ПА с такими заболеваниями, как аутоиммунный тиреодит, витилиго, недостаточность коры надпочечников, гипогаммаглобулинемия. ПА чаще встечается у людей с 2-ой (А) группой крови, голубыми глазами и ранней сединой. Наконец, у 2-3% больных ПА развивается рак желудка.
Наиболе частой причиной дефицита фолиевой килоты является неадекватное поступление ее с пищей, особенно в сочетании повышенной потребностью в этом витамине ( таб.25). К повышению пторебности в фолиевой кислоте приводит повышеный рост любых клеток организма, включая беременность. В связи с относительно небольшими запасами в организме дефицит фолиевой кислоты может развиться быстро.
Нередко развивается сочетанный дефицит витамина В 12 и фолиевой кислоты. Так, выраженный дефицит одного витамина может привести к поражению слизистой желудочно-кишечного тракта и, тем самым, к дефициту второго. Кроме того, дефицит витамина В 12 может быть причиной дефицита фолатов в клетках.
Поскольку фолиевая кислота и витамин В 12 принимают участие в различных биохимических процессах, их дефицит или нарушение метаболизма приводят к поражению многих органов и систем (таб.26).
Одной из причин неврологических осложнений при дефиците витамина В 12 считают дефицит метионина, что приводит к нарушению образования миелина нервных волокон. Кроме того, нарушение синтеза сукцинил-коэнзима А способствует образованию большого количества нефизиологических жирных кислот, встраивающихся в липиды нейронов, что тоже может привести к поражению нервной системы. Врезультате развивается прогрессирующая нейопатия с поражением периферических чувсвительных нервов, а также задних и боковых стволов спинного мозга (фуникулярный миелоз).
Клинические признаки дефицита витамина В 12 развиваются медленно, постепенно. Клиническая картина состоит из анемического синдрома, симптомов поражения желудочно-кишечного тракта и нервной системы. Иногда клиническая симптоматика может быть сглаженной и анемия выявляется случайно. Нередко такие больные попадают к гематологу после длительного обследования и неэффективного лечения у других специалистов.
При осмотре часто выявляется не только бледность: но и умеренно выраженная желтушность кожи и склер: связанная с с внурикостномозговым гемолизом вследствие неэффективного гемопоэза.
Поражение желудочно-кишечного тракта характеризуется неприятными ощущениями и болями в языке, появлением болезненных трещин в углу рта, снижением аппетита, ахиллическими поносами, снижением массы тела. При осмотре у таких больных выявляется ангулярный стоматит, ярко красный болезненный язык с атрофированными сосочками — “ лакированный язык“. Иногда определяется умеренно выраженные гепато- и спленомегалия.
Первыми признаками поражения нервной системы при дефиците витамина В 12 являются онемение, парестезии конечностей, затем появляются слабость, нарушение походки и координации, атаксия. Нередко больные падают в темноте. Нейропатия чаще развивается у мужчин. Выраженность рефлексов может быть повышена или снижена, выявляется положительная проба Ромберга, симптом Бабинского.
Психические нарушения варьируют от легкой раздражительности до тяжелой деменции и выраженного психоза. Редко встечается атрофия зрительного нерва.
Дефицит фолиевой кислоты проявляется анемическим синдромом и поражением желудочно-кишечного тракта, которое может быть более выражено, чем при дефиците витамина В 12 . Неврологических расстройств придефиците фолиевой кислоты не бывает.
Лабораторные признаки мегалобластных анемий:
1. Макроцитарная гиперхромная анемия (при сочетании с дефицитом железа может быть менее выраженной).
2. Пойкилоцитоз (овалоциты, дегенеративные формы эритроцитов), тельца Жоли, кольца Кебота. В тяжелых случаях определяются мегалоциты и мегалобласты.
3. Количество ретикулоцитов снижено, отсутствует ритикулоцитарная реакция на анемию.
4. Лейкопения, тромбоцитопения. Характерна гиперпигментация (6 и более сегментов) ядра нейтрофилов, иногда встречаются гигантские палочкоядерные нейтрофилы и метамиелоциты.
5. Костный мозг: выраженная гиперплазия эритроидного ростка, мегалобластный тип кроветворения — увеличение размеров эритротидных клеток, “нежная “ структура ядра отхорошо гемоглобинизированной цитоплазмы. Встечаются гигантские клетки нейтрофильного ряда аномальной формы.
6. Повышение содержания в сыворотке несвязанного билирубина, лактатдегидрогеназы; содержание сывороточного железа и ферритина нормальное.
Обследование пациента может быть проведено амбулаторно, если тяжесть анемии и поражения нервной системы не требует госпитализации. При пернициозной анемииобязательно проведение фиброгастроскопии для выявления хроническогоатрофическогогастрита и исключения рака желудка. Диагноз основывается на специфических изменениях крови и костного мозга. Выраженность лаборатоных признаков обычно пропорционально дефициту витамина В 12 или фолиевой кислоты, поэтому на ранних стадиях заболевания могут быть затруднения в диагностике. Важно помнить, что характерные изменения костного мозга исчезают через 1-2 суток после начала специфической терапии, поэтому стернальная пункция должна быть сделана до применения витамина В 12 или фолиевой кислоты.
Дифференциальный диагноз мегалобластных анемий проводится путем исключения причин дефицита витамина В 12 и фолиевой кислоты. Важно установить, с дефицитом какого именно витамина связана анемия, поскольку назначение больших доз фолиевой кислоты больным пернициозной анемией может привести не только к улучшению гематологических показателей, но и к прогрессированию неврологической симптоматики. Кроме того, больные с дефицитом фолиевой кислоты как правило не нуждаются в многолетней терапии.
При выяснении анамнеза важно оценить характер питания больных (дефицит витамина В 12 чаще бывает у вегетариацев, фолиевой кислоты — плохо питающихся людей), их социальный статус (дефицит фолиевой кислоты — признак бедности), сопутствующие заболевания (дефицит фолиевой кислоты часто возникает у алкоголиков) и ранее проведенное лечение ( препараты, влияющие на метаболизм витамина В 12 и фолиевой кислоты).
Наличие характерной неврологической симптоматики свидетествует о дефиците витамина В 12 . Обязательное инструментальное обследование желудочно-кишечного тракта помогает определить причину анемии. Для дефицита витамина В 12 характерен атрофический гастрит с ахлоргидрией. При проведении пробы сгистамином pH желудочного сока у таких больных остается более 5,0.
В сложных случаях возможно определение содержания витамина В 12 и фолиевой кислоты в плазме крови.
Апластическая анемия характеризуется панцитопенией (анемией, лейкопенией и тромбоцитопенией) и аплазией костного мозга.
Распространенность идиопатической апластической анемии широко варьирует в различных регионах и составляет 10-35 случаев на миллион населения в год. Распределение по возрасту достаточно равномерное до 60 лет, после чего частота возникновения апластической анемии возрастает. Идиопатическая апластическая анемия несколько чаще возникает у мужчин.
Классификация. Этиопатогенетически апластические анемии делят на первичные, среди которых выделяют врожденные и приобретенные, и вторичные, возникшие вследствие различных внешних воздействий (таб.11).
Кроме того, апластические анемии делят по степени тяжести. Тяжелой называют апластическую анемию при наличии по крайней мере двух из следующих критериев:
— количество гранулоцитов менее 0,5х10*9/л;
— количество тромбоцитов менее 20х10*9/л;
— количество гранулоцитов после коррекции менее 1%.
Коррекция содержания ретикулоцитов производится по формуле:
где А — количество ретикулоцитов после коррекции;
рет. — содержание ретикулоцитов в %;
эр. — содержание эриторцитов в 10*12/л.
Кроме этих критериев для тяжелой апластической анемии характерна клеточность костного мозга менее 30%. Точная диагностика тяжести апластической анемии принципиально важна для прогноза и правильного лечения заболевания.
Этиология апластической анемии определяется видом заболевания, указанным в. Более чем в 50% случаев апластической анемии этиологической фактор выявить не удается и анемия называется идиопатической. Общим для всех апластических анемий является резкое снижение количества плюрипотентных кроветворных клеток и их неспособность обеспечить полноценный гемопоэз.
Клиника апластической анемии может быть различной. Иногда заболевание возникает остро и стремительно прогрессирует. Чаще оно развиается постепенно и проявляется нарастающим анемическим синдромом. Такие больные жалуются на общую слабость, сердцебиение, снижение толерантности к физической нагрузке, одышку и т.д. Тромбоцитопения может привести к развитию геморрагического синдрома: Подкожным кровоизлияниям, кровоточивости десен, меноррагиям, повторным кровотеченям. Нейтропения может манифестировать повторными атипично протекающими инфекциями. В начале заболевания часто возникают ангина, стоматит, пневмония, парапроктит. Угрожающие жизни генерализованные инфекции в начале заболевания возникают относительно редко.
1.Нормоцитарная нормохромная или макроцитарная анемия различно степени в зависимости от тяжести болезни. Значительное снижение количества ретикулоцитов, отсутствие ритикулоцитарной реакции на анемию.
2. Лейкопения с селективным снижением количества нейтрофилов. Нередко развивается агранулоцитоз. Морфологически нейтрофилы выглядят нормально, хотя нередко определяется токсическая зернистость; содержание щелочной фосфатазы высокое. В тяжелых случаях развиваются абсолютная моноцитопения, лимфопения.
3. Тромбоцитопения очень характерна для апластической анемии, в тяжелых случаях количество тромбоцитов менее 20х10*9/л. В отличие от иммунной тромбоцитопении размеры тромбоцитов не увеличены.
4. Костный мозг малоклеточный. В миелограмме обычно резко снижено количество мегакариоцитов и миелоидных клеток, в меньшей степени выражено уменьшение количества эритроидных клеток. Характерно увеличение относительного количества клеток лимфоидного ряда и плазматических клеток. Увеличение количества бластов и клетки негематологических опухолей не определяются.
5. Трепанобиопсия является обязательным исследованием при подозрении на апластическую анемию. Характерно почти полное (более 75%) замещение жировой тканью миелоидной. В миелоидной ткани определяются небольшие группы эритроидных клеток, малочисленные гранулоциты и единичные мегакариоциты. В тяжелых случаях в костном мозге встречаются только плазматические клетки.
6. При идиопатической апластической анемии цитогенетическое исследование не выявляет характерных хромосомных аномалий, в отличие от анемии Фанкони, некоторых вариатов миелопоэтического синдрома и острого лейкоза.
Выявление у больного двух- или трехростковой цитопении является показанием для консультации гематолога. Начальное обследование может быть проведено амбулаторно при отсутствии глубокой цитопении, Клинических признаков инфекционных и геморрагических осложнений. В последних случаях необходима срочная госпитализация в специализированный стационар.
Прогноз, исходы заболевания.
Прогноз течения идиопатической апластической анемии определяются, прежде всего, тяжестью заболевания, возрастом больного и вариантом проводимого лечения. Принципиально важно определить тяжесть заболевания, поскольку 50% больных с тяжелой апластической анемией умирают в первые 6 месяцев и вероятность 3-летнего выживания для них не превышает 30%. Примерно такие же перспективы у болных апластической анемией вследствие вирусного гепатита и применения левомицетина. Основной причиной летальных исходов у этих больных являются инфекционные и геморрагические осложнения. У больных моложе 20 лет и пожилых прогноз, как правило, хуже, чем у людей среднего возраста. Применениесовременных методов лечения позволяет резко увеличить продолжительность жизни больных тяжелой апластической анемией.
Идиопатическая апластическая анемия средней степени тяжести характеризуется значительно более благоприятным течением. Возможно острое непродолжительное течение со спонтанной ремиссией. Более часто Залевание протекает хронически, и при адекватном лечении возможна полная длительная ремиссия и выздоровление, хотя нередко в течение длительного времени сохраняется тромбцитопения. При этом сохраняется вероятность рецидивов, которые могут быть тяелыми. Менее вероятна трансформация заболевания в острый лейкоз, миелодисплазию или пароксизмальную ночную гемоглобинурию.
Дифферинциальная диагностика апластической анеми проводится путем исключения других причин панцитопении. Тщательный сбор анамнеза необходим для выявления врожденных видов патологии, исключения токсического или радиационного поражения кроветворения, парксизмальной ночной гемоглобинурии, а также инфекционных и аутоиммунных заболеваний. Наличие спленомегалии и/или лимфаденопатии ставит под сомнение возможность апластической анеми. Дефицит витамина В 12 и фолиевой килоты можно исключить с учетом характерных осбенностей клеток крови и костного мозга. Исследование аспирата и трепанобиоптата костного мозга позволяет исключить миелодиспластический синдром, гемобластозы, метастазы опухолей в костный мозг, милофиброз и т. д.
Анемия может быть проявлением широчайшего спектра различных заболеваний и, соответственно, является одним из самых распространенных видов патологии. Распространенность и разнообразие анемий являются предпосылками к возникновению достаточно часто встречающихся диагностических и лечебных ошибок. Знание этиологии, патогенеза, клиники, диагностики и лечения анемий необходимо для успешной работы врача.
Справочник по гематологии: Ростов н/Д.: Феникс, 2000.
Руководство по гематологии: / Под ред. А.И.Воробьёва. – М.:Медицина, 1985.
Руководство по гематологии: в 3т. Т.1. Под ред. А.И.Воробьёва. М.: Ньюдиамед: 2002.
Окороков А.Н. – «Диагностика болезней внутренних органов». Руководство, т. 4. М., 2001 г.
Методики клинических лабораторных исследований. Справочное пособие. Т1./ Под. ред. В.В.Меньшикова — М.,Лабора.2008.-448с.
К.А.Лебедев, И.Д.Понякина. «Иммунограмма в клинической практике. – М.,Наукв.1990. – 224с.
источник