Не существует постоянных или отличительных форм распределения отложений амилоида в органах и тканях для какой-либо из описанных категорий. Классическая локализация — почки, печень, селезенка, лимфоузлы, надпочечники, щитовидная железа и многие другие ткани.
Макроскопически пораженные органы часто увеличены, восковидные, имеют плотную консистенцию. Если отложения достаточно велики, то нанесение йода на поверхность среза дает желтое окрашивание, переходящее в сине-фиолетовое после аппликации серной кислоты.
Как указано ранее, гистологическая диагностика амилоидоза основана на особенностях окрашивания амилоида. Чаще всего используют метод окрашивания конго красным, после чего отложения амилоида приобретают розовый или красный цвет при обычном освещении. В поляризованном свете окрашенный конго красным амилоид дает ярко-зеленое двойное лучепреломление.
Такая реакция является общей для всех форм амилоида и обусловлена перекрестной p-складчатой конфигурацией его фибрилл. Подтверждение можно получить с помощью электронной микроскопии. Амилоиды АА, AL и транстиретин различают, используя специфические иммуногистохимические методы. Поскольку типы распределения амилоида в органах при различных клинических формах амилоидоза варьируют, рассмотрим каждый из наиболее часто поражаемых органов отдельно.
а) Почки. Амилоидоз почек является наиболее частой и потенциально наиболее опасной формой заболевания. Почки могут иметь нормальные размеры и цвет или быть увеличенными, а в запущенных случаях иметь сальный вид и сморщиваться вследствие ишемии, вызванной сужением сосудов за счет отложения амилоида в стенках артерий и артериол.
Гистологические исследования выявили, что в основном амилоид откладывается в базальных мембранах клубочков, однако также поражаются интерстициальная перитубулярная ткань, артерии и артериолы. Гломерулярные отложения вначале выглядят как незначительные утолщения мезангиального матрикса, обычно сопровождающиеся неровным расширением базальной мембраны гломерулярных капилляров.
Со временем мезангиальные отложения и отложения вдоль базальной мембраны вызывают сужение капилляров, а также искривление сосудистого пучка клубочка. С развитием гломерулярного амилоидоза просвет капилляров облитерируется и исчезающий клубочек заполняется слившейся массой или широкими переплетенными лентами амилоида.
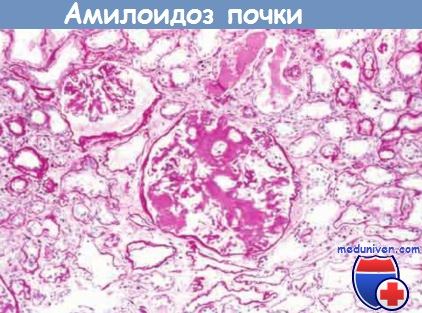
Клубочек почти целиком облитерирован в результате массивного накопления амилоида.
б) Селезенка. Амилоидоз селезенки может не отразиться на ее величине, а может вызвать спленомегалию — от умеренной до выраженной (до 800 г). Существует две формы отложений амилоида в селезенке, причины которых неизвестны. В первом случае отложения в основном ограничиваются фолликулами селезенки с образованием подобных тапиоке гранул, видимых при макроскопическом исследовании. Это так называемая саговая селезенка.
При другой форме амилоид откладывается в стенках синусов селезенки и захватывает соединительнотканную сеть красной пульпы. Слияние ранних отложений приводит к образованию больших, похожих на карту областей амилоидоза. Это так называемая сальная (напоминающая свиное сало) селезенка.
в) Печень. Отложения могут быть незаметными либо приводить к умеренной или выраженной гепатомегалии. Вначале амилоид появляется в пространстве Диссе, а затем неуклонно оттесняет соседние клетки печеночной паренхимы и синусоиды. Со временем происходят деформация и атрофия (в результате сдавливания), гепатоциты исчезают и обширные области печеночной паренхимы замещаются амилоидом. Часто вовлекаются сосуды и амилоид откладывается в перисинусоидальном пространстве. Функция печени обычно сохранена, несмотря на порой обширное вовлечение органа.
г) Сердце. Амилоидоз сердца может иметь любую форму системного амилоидоза. Сердце — главный орган, поражаемый при сенильном системном амилоидозе. Сердце может быть увеличенным и плотным, однако чаще при макроскопическом исследовании отклонения не обнаруживаются. Гистологическими изменениями могут быть локальные скопления амилоида под эндокардом и в миокарде между мышечными волокнами. Распространение этих отложений в миокарде со временем вызывает компрессионную атрофию волокон миокарда.
Если отложения амилоида располагаются субэндокардиально, могут произойти повреждения проводящей системы, отражающиеся у некоторых пациентов на электрокардиограмме.
д) Другие органы. Амилоидоз других органов встречается, как правило, в случае системных заболеваний. Обычными местами его локализации являются надпочечники, щитовидная железа и гипофиз. Может вовлекаться ЖКТ на любом уровне — от полости рта (десны, язык) до ануса. На ранних стадиях отложения амилоида появляются в кровеносных сосудах, однако могут распространяться на прилежащие области подслизистой и субсерозной ткани и мышц.
Узелковые отложения в языке могут вызвать макроглоссию, откуда возник термин опухолеобразующий амилоид языка. Дыхательные пути могут быть вовлечены локально или диффузно, начиная с гортани и заканчивая мельчайшими бронхиолами. Образуются амилоидные бляшки, поражаются также кровеносные сосуды. Амилоидоз периферических и вегетативных нервов служит признаком некоторых амилоидных нейропатий.
Отложения амилоида у пациентов на длительном гемодиализе наиболее выражены в связках запястья, что приводит к сдавливанию срединного нерва (туннельному синдрому запястья). У таких пациентов также могут быть обширные отложения амилоида в суставах.
— Рекомендуем ознакомиться со следующей статьей «Клиника амилоидоза и его проявления»
источник
При вторичном амилоидоза, это «вторая болезнь».
Различают несколько стадий:
1. Латентная – внешне почки изменены мало, амилоид откладывается по ходу прямых сосудов.
2. Протеинуритическая – почка белого цвета «большая сальная почка».
Амилоид в клубочках и в пирамидах. Выключается большое количество нефронов. В канальцах – эпителий – в состоянии глубокой дистрофии, в просвете – цилиндры.
3. Нефротическая – в почках амилоидно-липоидный нефроз. Почка большая белая амилоидная почка. Наряду с нарушением белкового обмена присоединяется нарушение жирового обмена.
4. Уремическая стадия – амилоидно-сморщенная почка. Выраженный амилоидоз, склероз. Большинство нефронов погибло. Размеры почек немного уменьшены, на поверхности множественные западания. Развивается гипертрофия левого желудочка за счет симптоматической гипертензии.
Осложнения: 1) присоединение инфекции за счет нарушения иммунной системы; 2) за счет гипертензии – инфаркты, кровоизлияния, сердечная недостаточность; 3) ОПН.
Смерть от уремии чаще всего.
Рак печени — сравнительно редкая опухоль. Он обычно развивается на фоне цирроза печени, который считают предраковым состоянием; среди предрако-вых изменений печени наибольшее значение имеет дисплазия гепатоцитов. В Азии и Африке — регионах Земного шара с высокой частотой рака печени — рак развивается часто в неизмененной печени; регионами с низкой частотой рака печени считаются Европа и Северная Америка, где рак развивается обычно в цирротической печени.
Морфологическая классификация рака печени предусматривает макроскопическую форму, характер и особенности роста опухоли, гистогенез, гистологические типы.
Патологическая анатомия. Среди макроскопических форм рака печени различают: узловой рак — опухоль представлена одним или несколькими узлами; массивный рак — опухоль занимает массивную часть печени и диффузный рак — вся печень занята многочисленными сливающимися опухолевыми узлами. К особым формам относят маленький и педункулярный рак,.
Печень при раке резко увеличена (иногда в 10 раз и более), масса ее может составлять несколько килограммов. При узловатом раке она бугристая, умеренно плотная, при диффузном раке — нередко каменистой плотности.
Характер роста опухоли может быть экспансивным, инфильтрирующим и смешанным (экспансивно-инфильтративным). К особенностям роста рака печени относят рост по ходу синусоидов и замещающий рост.
В зависимости от особенностей гистогенеза рак печени делят на:
1) печеночно-клеточный (гепатоцеллюлярный^; 2) из эпителия желчных протоков (холангиоцеллюлярный); 3) смешанный (гепатохолангиоцеллюлярный);
Среди гистологических типов рака печени различают трабекуляр-ный, тубулярный, ацинозный, солидный, светлоклеточный. Каждый из гистологических типов может иметь различную степень дифференцирования.
Метастазирует рак печени как лимфогенно (околопортальные лимфатические узлы, брюшина), так и гематогенно (легкие, кости). Метастазы, как и основной узел гепатоцеллюлярного рака, иногда зеленого цвета, что связано с сохранившейся сйОсобностью раковых клеток к секреции желчи.
Осложнениями и причиной смерти наиболее часто являются гепатаргия, кровотечение в брюшную полость из распадающихся узлов опухоли, кахексия.
Рак печени. В Тюменской области встречается в 9-10 раз чаще, чем в
соседних областях. Обусловлен описторхозом, т.е. развивается без предшествующего цирроза печени.
гепатоцеллюлярный – из гепатоцитов ( на фоне цирроза печени)
холангиоцеллюлярный – из эпителия желчных протоков (характерен для описторхоза)
19г. Рак легкого, особенности локализации, гистологические формы, метастазирование.
Рак легкого в подавляющем большинстве случаев развивается из эпителия бронхов и очень редко — из альвеолярного эпителия. Поэтому когда говорят о раке легкого, то имеют в виду прежде всего бронхогенный рак легкого; пневмо-ниогенный рак легкого находят не более чем в 1 % случаев.
Этиология и патогенез неоднозначны для центрального и периферического рака легкого. В этиологии центрального рака легкого имеют значение прежде всего вдыхаемые канцерогенные вещества, курение сигарет. Морфогенез центрального рака легкого связан с такими предраковыми изменениями эпителия крупных бронхов, как базально-клеточная гиперплазия, дисплазия и плоскоклеточная метаплазия. В развитии периферического рака легкого велика роль канцерогенных веществ, проникающих с кровью и лимфой. Определенную роль в развитии рака легкого играют хронические воспалительные процессы, ведущие к развитию пневмосклероза, хронического бронхита, бронхоэктазов, так как на почве этих процессов развиваются гиперплазия, дисплазия и метаплазия эпителия, способствующие развитию рака (предраковые изменения). Морфогенез периферического рака легкого иной. Показано, что эта форма рака возникает в очагах пневмосклероза после перенесенного туберкулеза, пневмонии, инфаркта легкого, вокруг инородных тел («рак в рубце»). В рубце появляется ряд условий, способствующих злокачественной трансформации клеток: депонирование преимущественно экзо- и эндогенных канцерогенов, гипоксия, местная иммуносупрессия, нарушение межклеточных взаимодействий и др. Поэтому в очагах пневмосклероза при периферическом раке обнаруживают более широкий спектр предопухолевых изменений, чем в крупных бронхах: базально-клеточную гиперплазию, плоскоклеточную метаплазию, дис-плазию эпителия мелких бронхов, бронхиол и альвеол, аденоматозную гиперплазию и так называемые опухольки. Ключевым моментом патогенеза рака легкого является повреждение генома эпителиальной клетки. При этом выделяют три типа генетических изменений: хромосомные аберрации, точечные мутации, акти вацию и повреждение протоонкогенов (протоонкогены — нормальные гены клеток, являющиеся прародителями вирусных и невирусных онкогенов).
Клинико-анатомическая классификация рака легкого.
По локализации: 1) прикорневой (центральный), исходящий из стволового, долевого и начальной части сегментарного бронха; 2) периферический, исходящий из периферического отдела сегментарного бронха и его ветвей, а также из альвеолярного эпителия; 3) смешанный (массивный).
По характеру роста: 1) экзофитный (эндобронхиальный); 2) эндофитный (экзоброн-хиальный и перибронхиальный);
По макроскопической форме: 1) бляшковидный; 2) полипозный; 3) эндобронхиальный диффузный; 4) узловатый; 5) разветвленный; 6) узловато-разветвленный.
По микроскопическому виду: 1) плоскоклеточный (эпидермоидный) рак; 2) аде-нокарцинома; 3) недифференцированный анапластический рак: мелкоклеточный, крупноклеточный;
4) железисто-плоскоклеточный рак; 5) карцинома бронхиальных желез: аденоидно-кистозная, мукоэпидермоидная.
Прикорневой (центральный) рак. Развивается в слизистой оболочке стволового, долевого и начальной части сегментарного бронхов, первоначально в виде небольшого узелка (бляшки) или полипа, а в дальнейшем в зависимости от характера роста (экзофитный, эндофитный), приобретает форму эндобронхиального диффузного, узловатого, разветвленного или узловато-разветвленного рака. Осложняется сегментарным или долевым ателектазом, являющимся почти постоянным спутником прикорневого рака. Из крупного бронха опухоль при эндофитном росте распространяется на ткань средостения, сердечную сорочку и плевру. Развивающийся при этом плеврит носит серозно-геморрагический или геморрагический характер. Прикорневой рак чаще имеет строение плоскоклеточного, реже — железистого или недифференцированного.
Периферический рак. Возникает в слизистой оболочке периферического отдела сегментарного бронха, его более мелких ветвей и бронхиол, редко — из альвеолярного эпителия. Периферический рак долгое время растет экспансивно в виде узла, достигая иногда больших размеров (диаметр до 5—7 см). Часто рак развивается в области рубца (капсула заживших туберкулезных очагов, зарубцевавшийся инфаркт легкого и др.) вблизи плевры в любом участке легкого, может перейти на плевру, вследствие чего она утолщается и в плевральной полости скапливается серозно-геморрагический или геморрагический экссудат, сдавливающий легкое. Периферический рак имеет строение железистого, реже — плоскоклеточного или недифференцированного.
Смешанный (массивный) рак. Он представляет собой мягкую белесоватую, нередко распадающуюся ткань, которая занимает всю долю или даже все легкое. Массивный рак чаще имеет строение недифференцированного или аденокарциномы. Микроскопический вид рака легкого разнообразен, что определяется как различными источниками его происхождения (покровный и железистый эпителий бронхов, пневмоциты второго типа, эндокринные клетки), так и степенью дифференцировки опухоли (дифференцированный и недифференцированный рак). В дифференцированном раке легкого, как правило, сохраняются признаки ткани, из которой он исходит: слизеобразование — в аденокарциноме, кератинобразование — в плоскоклеточном раке.
Плоскоклеточный (эпидермоидный) рак может быть высоко-, умеренно- и низкодифференцированным. Для высокодифференцированного рака характерно образование кератина многими клетками и формирование раковых жемчужин, для умеренно дифференцированного — митозы и полиморфизм клеток, некоторые из которых содержат кератин, для низкодифференцированного плоскоклеточного рака — еще больший полиморфизм клеток и ядер (наличие полигональных и веретенообразных клеток), большое число митозов; кератин определяется лишь в отдельных клетках.
Аденокарцинома легкого также может иметь различную степень дифференцировки. Высокодифференцированная аденокарцинома состоит из ацинарных, тубулярных или сосочковых структур, клетки которых продуцируют слизь; умеренно дифференцированная аденокарцинома имеет железисто-солидное строение, в ней встречается большое число митозов, слизеобразование отмечается лишь у части клеток; низкодифференцированная аденокарцинома состоит из солидных структур, полигональные клетки ее способны продуцировать слизь. Разновидность аденокарциномы — бронхиолярно-альвеолярный рак.
Недифференцированный анапластический рак легкого бывает мелкоклеточным и крупноклеточным. Мелкоклеточный рак состоит из мелких лимфоцитоподобных или овсяновидных клеток с гиперхромными ядрами, клетки растут в виде пластов или тяжей. В ряде случаев они обладают эндокринной активностью — способны к продукции АКТГ, серотонина, кальцитонина и других гормонов; электронно-микроскопически в цитоплазме таких клеток выявляются нейросекреторные гранулы. Мелкоклеточный рак может сопровождаться артериальной гипертонией. В таких случаях мелкоклеточный рак можно рассматривать как злокачественную апудому. Крупноклеточный рак представлен крупными полиморфными, нередко гигантскими многоядерными клетками, которые неспособны продуцировать слизь.
Железисто-плоскоклеточный рак легкого называют также смешанным, так как он представляет собой сочетание двух форм — аденокарциномы и плоскоклеточного рака. Карцинома бронхиальных желез, имеющая аденоидно-кистозное или мукоэпидермоидное строение, встречается довольно редко.
Осложнения рака легкого представлены метастазами, которые в равной мере можно считать и проявлением опухолевой прогрессии, и вторичными легочными изменениями. Первые лимфогенные метастазы возникают в перибронхиальных и бифуркационных лимфатических узлах, затем шейных и др. Среди гематогенных метастазов наиболее характерны метастазы в печень, головной мозг, кости (особенно часто в позвонки) и надпочечники. Прикорневой рак чаще дает лимфогенные, периферический — гематогенные метастазы. Как уже говорилось, у больных периферическим раком легкого (небольшим по размеру и протекающим без симптомов) первые клинические признаки могут быть обусловлены гематогенным метастазированием.
Вторичные легочные изменения связаны с развитием ателектаза в случаях прикорневого рака легкого. К ним следует отнести и те изменения, которые появляются в связи с некрозом опухоли: образование полостей, кровотечение, нагноение и др.
Смерть больных раком легкого наступает от метастазов, вторичных легочных осложнений или от кахексии.
источник
Профессор Батюшин Михаил Михайлович — Председатель Ростовского областного общества нефрологов, заместитель директора НИИ урологии и нефрологии, Руководитель нефрологической службы ГОУ ВПО РостГМУ, заведующий отделением нефрологии клиники РостГМУ
Бова Сергей Иванович — Заслуженный врач Российской Федерации,заведующий урологическим отделением — рентгено-ударноволнового дистанционного дробления камней почек и эндоскопических методов лечения, ГУЗ «Областная больница №2», г. Ростов-на-Дону.
Летифов Гаджи Муталибович — зав.кафедрой педиатрии с курсом неонатологии ФПК и ППС РостГМУ, д.м.н., профессор, член Президиума Российского творческого общества детских нефрологов, член правления Ростовского областного общества нефрологов, член редакционного совета «Вестника педиатрического фармакологии нутрициолгии», врач высшей категории.
Редактор страницы: Семенистый Максим Николаевич.
Почки располагаются на внутренней поверхности задней брюшной стенки и только спереди покрыты брюшиной. Вещество почки окружено соединительнотканной капсулой (tunica fibrosa), снаружи от которой располагается жировая прослойка. В ворота почки (hilus renalis) вступает почечная артерия, из них выходят почечная вена, лимфатические сосуды и мочеточник (ureter), который берет начало из лоханки (pelvis renalis).
На продольном разрезе почки четко разграничиваются корковый (substantia corticalis) и мозговой (substantia medullaris) слои. Корковое серо-красное вещество, спускаясь в мозговой слой в виде почечных колонок (columnae renaies), разделяет его на пирамиды (pyramides renales); в свою очередь мозговое вещество в виде тонких лучей проникает внутрь коркового и образует так называемые мозговые лучи. Вершина пирамиды представлена почечным сосочком (papilla renalis), открывающимся в почечные чашечки (calyx renalis), а основание (basis pyramidis) граничит с интермедиарной (пограничной) зоной, отделяющей корковый слой от мозгового (рис. 1).
Паренхиму почки составляют эпителиальные канальцы, а строму — тонкие прослойки соединительной ткани, в которых проходят сосуды и нервы почки.
Структурно-функциональной единицей почки является нефрон.
За последние десятилетия нефрология обогатилась сведениями о тонкой структуре и функции нефрона, полученными благодаря применению новых методов исследования, прежде всего — пункционной биопсии, электронной микроскопии и гистохимии.
Не менее важные сведения получены о своеобразии структуры и функции сосудистой и гормональной систем почек как в норме, так и в патологии.
ТОНКОЕ СТРОЕНИЕ И ГИСТОФЕРМЕНТОХИМИЯ НЕФРОНА
Нефрон, состоящий из сосудистого клубочка, его капсулы и почечных канальцев (рис. 2), обладает высокой структурно-функциональной специализацией. Эта специализация определяется гистологическими и физиологическими особенностями каждого из составных элементов клубочковой и канальцевой части нефрона.
Сосудистый клубочек имеет примерно 50 капиллярных петель, стенка которых представляет клубочковый фильтр. При электронномикроскопическом исследовании установлено, что клубочковый фильтр состоит из трех элементов: 1) эпителия клубочка, 2) эндотелия его капилляров и 3) располагающейся между ними базальной мембраны (рис. 3).
Элементы клубочка обладают крайне низкой активностью гидролитических, гликолитических ферментов и ферментов цикла Кребса.
По данным большинства авторов (Ю. В. Наточин, 1961, 1962, 1965; В. В. Серов и А. Г. Уфимцева, 1967), в клубочке отсутствуют щелочная фосфатаза, глюкозо-6-фосфатаза, глюкозо-6-фосфатдегидрогеназа, сукцинатдегидрогеназа. Лишь Du- bach (1965) указывает на незначительную активность щелочной фосфатазы и глюкозо-6-фосфатдегидрогеназы в гломерулах крыс.
Умеренную активность кислой фосфатазы в цитоплазме подоцитов обнаружили Forster и соавторы (1963).
Элементы клубочка характеризуются очень небольшой Активностью дегидрогеназы молочной, яблочной и изолимонной кислот, а-глицерофосфатдегидрогеназы, алкогольдегидрогеназы, НАД- и НАДФ-диафораз.
Слабая активность ферментов тканевого дыхания в структурах клубочка отражает в основном пассивную их функцию в механизме фильтрации.
Эпителий клубочка. Эпителий клубочка, иначе эпицит или подоцит, состоит из крупного клеточного тела (диаметром 20—30 мк) с ядром, митохондриями, аппаратом Гольджи и другими включениями. Цитоплазма имеет большие отростки — трабекулы, от которых в виде узких стебельков отходят малые отростки, или педикулы. Педикулы своим внешним утолщенным концом «опираются» на базальную мембрану. Таким образом, трабекулы не лежат непосредственно на базальной мембране, а приподняты над ней благодаря педикулам, в результате чего создается так называемое подподоцитарное пространство. В этом пространстве переплетаются педикулы соседних клеток, образуя сложный лабиринт из щелей шириной от 300 до 1000 А. Через межпедику- лярные щели, как полагает большинство исследователей, фильтрат плазмы может поступать в полость капсулы Шумлянского—Боумена, минуя цитоплазму подоцита. Считают, что изменение величины этих щелей и педикул может играть определенную роль в регуляции размера фильтрации (Hall, 1954, 1957; Yamada, 1955; Farquhar et al., 1957).
Однако Oberling (1951) на основании находок мельчайших пузырьков в педикулах, крайней изменчивости малых отростков подоцитов и межпедикулярных щелей предполагает, что фильтрат плазмы не может миновать тело подоцита. При этом подподоцитарное пространство сравнивается с субмикроскопической «губкой-насосом», откачивающим фильтрат Плазмы в полость капсулы клубочка.
Изменения подоцитов при нефротическом синдроме выражаются в нарушении трабекулярного строения клетки с исчезновением педикул и гиперплазией фибриллярных структур тела подоцита (В. В. Серов, 1972). Гиперплазия подоцитов встречается редко.
Отмечается определенная зависимость между изменениями подоцитов и появлением протеинурии, например при экспериментальном ами- нонуклеозидном нефрозе.
Farquhar и соавторы (1957) наблюдали характерные изменения подоцитов лишь при чистых формах нефроза. При смешанных формах эти изменения не были достаточно выражены. Показано, что при эффективном лечении липоидного нефроза преднизолоном структура подоцитов восстанавливается.
Некоторые исследователи расценивают изменения подоцитов при нефротическом синдроме как первичные (Farquhar et al., 1957). Однако правильнее считать, что они наступают после возникновения изменений в базальной мембране (Rouiller, 1961; David, 1967). Возможно, исчезновение педикул при нефротическом синдроме является своеобразным приспособлением клубочка, попыткой закрыть пробоины в фильтре (Farquhar et al., 1957) и тем самым препятствовать нарастанию про- теинурии.
Эндотелий капилляров клубочка. Эндотелий представлен цитоплазматической пластинкой, лежащей на базальной мембране и пронизанной через довольно правильные промежутки порами размером от 600 до 1000 A (Pearse, 1955; Yamada, 1955; Rhodin, 1955; Mueller, 1958; Rouiller, 1961). На этом основании эндотелиальную пластинку называют lamina fenestrata и полагают, что через нее плазма проходит как через своеобразное сито. Однако не все разделяют эту точку зрения. Rinehart (1955), например, сомневается в существовании пор в эндотелиальной пластинке и допускает возможность ультрафильтрации через цитоплазму эндотелия.
Изменения эндотелия капилляров клубочка разнообразны: набухание, вакуолизация, некробиоз клеток, гиперплазия, пролиферация и десквамация. При липоидном и амилоидном нефрозе, экспериментальном нефрозе, вызванном введением аминонуклеозида и казеина, диабетическом гломерулосклерозе преобладают, картины набухания, вакуолизации и некробиоза эндотелия, тогда как при остром и подост- ром гломерулонефрите, нефрите Мазуги, системной красной волчанке больше выражены явления набухания и гиперплазии.
Базальная мембрана клубочка. В настоящее время убедительно показано, что из трех элементов почечного фильтра (эндотелий капилляров клубочка, подоциты и расположенная между ними базальная мембрана) только базальная мембрана представляет собой непрерывный барьер между кровью и полостью капсулы Шумлянского—Боумена. Эндотелий порозен, не является препятствием для прохождения плазмы, хотя и способен задерживать форменные элементы крови. То же следует сказать о подоцитах. Обладая особой структурой, они, вероятно, в какой-то мере играют роль регулятора клубочковой фильтрации, но не способны удерживать крупномолекулярные белки и другие макрочастицы плазмы, поскольку размеры межпедикулярных щелей и пор эндотелия примерно одни и те же. В связи с этим состояние базальной мембраны прежде всего определяет состав первичной мочи.
Гломерулярная базальная мембрана состоит по существу из двух мембран: наружной, субэпителиальной, которая продолжается в базальную мембрану капсулы Шумлянского—Боумена, и внутренней, суб- эндотелиальной, являющейся продолжением базальной мембраны арте- риол клубочка. Субэпителиальная мембрана довольно толстая, субэндотелиальная — тоньше и нежнее. Обе дают резко положительную PAS- реакцию, аргирофильны, содержат сульфгидрильные и дисульфидные группы. Bruchhausen и Merker (1965, 1966) методом ультрацентрифугирования выделили из почечного гомогената чистую фракцию базальной мембраны гломерулярного фильтрата. Биохимическое изучение этой фракции показало, что она содержит много гидрооксипролина, входящего в состав коллагенового белка, фосфолипиды, неколлагеновый белок и мукополисахариды. Молекулы коллагенового белка (тропокол- лагена) образуют в мембране фибриллы длиной 2800 А и шириной 15 А. Эти фибриллы чаще представлены филаментами до 150 А, которые заключены в основном веществе и способны к полимеризации.
Высокое содержание во фракции базальной мембраны коллагенового белка свидетельствует о тесной связи базальной мембраны гломерулярных капилляров с соединительной тканью клубочка, клетки которой (мезангиальные клетки) способны продуцировать вещество мембраны.
Между субэндотелиальной и субэпителиальной мембраной существует соединительная ткань, названная мезангиумом (Zimmerman, 1933). Мезангиум связывает капиллярные петли клубочка друг с другом и подвешивает их наподобие брыжейки к гломерулярному полюсу (рис. 4). Вместе с базальными мембранами он образует поддерживающий стержень клубочка. Мезангиум рассматривают как перикапиллярное (Jones, 1957) или межкапиллярное (Kimmelstiel, 1936) интерстициальное пространство. В мезангиуме найдены волокнистые структуры и особые клетки, которые получили название «третьих», интеркапиллярных, или мезангиальных, клеток.
С помощью электронного микроскопа и методов гистохимии внесено много нового в прежние представления о базальной мембране клубочка, волокнистых структурах и «третьих» клетках мезангиума.
В электронном микроскопе базальная мембрана имеет толщину 1200—2000 А и выглядит трехслойной: центральный плотный слой, или lamina densa, толщиной 550—1300 А окружен более тонким прозрачным слоем толщиной 300—600 А как с наружной (lamina externa), так и с внутренней (lamina interna) стороны (Rhodin, 1955; Mueller, 1958; Rouiller, 1961). Центральный плотный слой некоторые авторы рассматривают как фибриллярный, богатый мелкими частицами (Yamada, 1955), однако многие считают, что базальная мембрана однородна и непрерывна.
Hall (1954) обнаружил в базальной мембране поры (диаметром 50—150 А) и предположил, что их размеры определяют функцию мембраны как фильтра. Согласно данным Pappenheimer (1955), радиус пор равен 38 A, a Scholtan (1959) —Зб± A. Gekle, Bruchhausen и Fuchs (1966) определяли размеры пор базальной мембраны гломерулярного фильтра с помощью разделительного коэффициента молекул разного удельного веса. Они показали, что средний радиус пор равен 29±10 А и определяется расстоянием между нормально расположенными и неизмененными филаментами коллагенового белка базальной мембраны. На основании этих данных можно считать, что порозность основной мембраны гломерулярного фильтра зависит как от характера пространственного расположения ее белковых филаментов, так и от состояния окружающего их основного вещества, т. е. от ритмов и глубины полимеризации и деполимеризации ее белково-полисахаридных комплексов.
Ультрамикроскопическая структура и функция мезангиума изучены столь же подробно (Huhn et al., 1962; Michielson, Creemers, 1967). Выявлены гистохимические особенности основного вещества мезангиума, сближающие его с фибромуцином фибрилл, способных воспринимать серебро, и клеток мезангиума, отличающихся ультраструктурной организацией от эндотелия, фиброцита и гладкомышечного волокна. На электронных микрофотограммах мезангиальные клетки образуют сеть, тесно связанную с базальной мембраной капилляров, окутывающую последние наподобие футляра, причем отростки цитоплазмы проникают в просвет капилляра (рис. 5). Цитоплазма клеток мезангиума богата белками основного и кислого характера, SH-группами, тирозином, триптофаном и гистидином, полисахаридами, РНК и гликогеном (В. В. Серов, А. Г. Уфимцева, 1967). Богатство пластического материала объясняет высокие фагальные и пролиферативные потенции мезангиальных клеток (Layton, 1963), способность реагировать на те или иные воздействия коллагенообразованием (Bencosme, Morrin, 1967), что имеет огромное значение в патологии почек. Считают, что от состояния мезангиума зависят тонус капилляров клубочка и уровень фильтрации плазмы через гломерулярный фильтр (Farquhar, Palade, 1962; Bencosme, Morrin, 1967).
5. Мезангиальные клетки, их топография:
а — схематическое изображение: Mes — мезангиум, Msp — сотростки» мезаи- гиума, Сар — капилляр, Fe — поры в эндотелии, Ер—эпицит (подоцит), Тг — трабекулы подоцита, Fp— педикулы, Nu — ядро; б — электронограмма, увел. X 9300 (по Pirani, 1966): Mes— мезангиальные клетки, Сар — капилляр, End — эндотелий, Вш — базальная мембрана, Bbm — «выросты* базальной мембраны, Fp — педикулы, Us — полость капсулы Шумлянского — Боумена.
Изменения базальной мембраны клубочка характеризуются ее утолщением и гомогенизацией, возникновением пластинчатости, разрыхлением и фибриллярностью, а также появлением тех или иных отложений кнутри или кнаружи от мембраны.
Утолщение базальной мембраны, очаговое или диффузное, встречается при всех заболеваниях, сопровождающихся протеинурией. Для липо- идного нефроза, начальных стадий амилоидоза почек характерны очаговые, а для диабетического гломерулосклероза, гломерулонефрита, выраженного амилоидоза — диффузные утолщения мембраны. В утолщенной базальной мембране наблюдаются увеличение промежутков между коллагеновыми филаментами, деполимеризация основного вещества, уменьшение содержания фосфатидов, с чем связывают повышенную порозность мембраны для белков плазмы крови.
Почти при всех заболеваниях, сопровождающихся протеинурией, с помощью электронного микроскопа выявляются, помимо утолщения мембраны, те или иные отложения, находящиеся на ней или в непосредственной близости от нее. Удалось показать, что каждому той или иной химической природы отложению соответствует своя ультраструктура (Farquhar et al., 1957, 1959), и точно локализовать отложения в клубочковом фильтре.
При гломерулонефрите отмечается накопление материала, идентичного базальной мембране, между пролиферирующими эндотелиальными и интеркапиллярными клетками (Farquhar et al., 1957) или появление преципитата комплекса антиген—антитело (Huhn et al., 1962) чаще на эпителиальной стороне мембраны, что доказывается с помощью методов флюоресцирующих антител. При амилоидозе фибриллы амилоида до 300 А толщины выпадают не только под эндотелием в базальной мембране клубочка, но и в интеркапиллярном пространстве. Есть основание предположить, что амилоид не механически загружает мезангиум, а представляет продукт его клеток (В. В. Серов, 1968). При диабетическом гломерулосклерозе такова же локализация отложений гиалина (Ditscherlein, 1969), фибриллярная структура которого отличается, однако, от структуры амилоида.
Исследования клубочковой мембраны и мезангиума патологически измененных почек подтверждают возможность «интеркапиллярных заболеваний клубочка», впервые описанных McCallum (1934), Kimmel- stiel, Wilson (1936). Эти «заболевания» составляют большую главу нефропатологии и продолжают разносторонне изучаться. Однако выделять их в самостоятельную группу, видимо, нет оснований, ибо реакции мезангиума являются, как правило, соподчиненными.
До последнего времени, ссылаясь на классические опыты Wearn » Richards (1924, 1925), считали, что через базальную мембрану нормального клубочка не проходят частицы с молекулярным весом более 60 000, поскольку молекулярный вес белков плазмы крови (альбуминов 75000, глобулинов 170000) превышает эту критическую величину. Однако исследования последних лет показали, что неизмененный клубочковый фильтр пропускает не только сывороточные белки, но и такие высокомолекулярные частицы, как вирусы, полные антигены, гиалуро- нидазу и др. Если признать эти данные, то при поражении базальной мембраны можно говорить прежде всего о повышении порозности ее для плазменных белков, причем это поражение должно рассматриваться при всех протеинурических состояниях как первичное, отражающее уровень деполимеризации полисахаридов мембраны. Причины поражения базальной мембраны, естественно, могут быть разными. Разные причины ведут, видимо, и к различной степени участия в процессе остальных элементов почечного фильтра и мезангиума, что определяет соответствующие патоморфологию клубочка и клинические проявления.
Капсула клубочка состоит из: 1) базальной мембраны и 2) покрывающего ее эпителия.
Базальная мембрана. Продолжается в проксимальный сегмент и по сравнению с базальной мембраной клубочка имеет иное строение. В ней различают внутренний — гомогенный и наружный — ретикулярный слой. Однако принято считать, что собственно базальную мембрану капсулы составляет только внутренний, гомогенный, слой, тогда как наружный представляет собой часть ретикулярной стромы почки (Mueller, 1958). Это положение, вероятно, справедливо, поскольку отмечается тесная связь базальной мембраны капсулы с эндотелием перитубулярных капилляров, чем и объясняются столь характерные для капсулы процессы склерозирования при тех или иных патологических состояниях.
Эпителий капсулы. Представлен уплощенными клетками с четкими границами и выбухающим ядром. Они имеют немного митохондрий и не обладают той сложной организацией цитоплазмы, которая характерна для эпителия проксимальных канальцев’ (Rhodin, 1954; Yamada, 1955).
Эпителиальные клетки капсулы отличаются весьма умеренной ферментативной активностью дегидрогеназ и диафораз. Исключение составляет дегидрогеназа изолимонной кислоты, содержание которой довольно высоко (Ю. В. Наточин, 1965). Отмечается также умеренная активность в этих клетках глюкозо-6-фосфатазы.
Эпителий капсулы крайне изменчив и в патологических условиях склонен к гиперпластическим реакциям. Кроме того, доказано, что изменчивость его структуры определяется рядом гормональных влияний.
Канальцевую часть нефрона принято делить на три сегмента: 1) проксимальный каналец, состоящий из извитой и прямой части (толстый нисходящий отдел петли Генле); 2) тонкий сегмент петли Генле; 3) дистальный каналец, состоящий из прямой части (толстый восходящий отдел петли Генле) и извитой части. Дистальные извитые канальцы впадают в систему собирательных трубок, которые, собственно, не являются составной частью нефрона.
Клетки проксимального канальца. Клетки извитой части проксимального канальца построены наиболее сложно по сравнению с другими отделами нефрона. Это высокие (до 8 мк) клетки, для которых характерно наличие щеточной каемки, внутриклеточных (интрацитоплазматических) мембран и большого числа правильно ориентированных митохондрий (рис. 6,а, б).
В цитоплазме клеток отмечается высокое содержание аминокислот (тирозин, триптофан, гистидин), белков основного и кислого характера, полисахаридов и активных SH-групп (В. В. Серов, А. Г. Уфимцева, 1967).
Щеточная каемка состоит из многочисленных пальцевидных выростов (нитей) цитоплазмы, покрытых клеточной мембраной. Они имеют длину до 1—2,5 мк и диаметр около 800 A (Pearse, 1955; Rhodin, 1954). Число пальцевидных выростов на поверхности клетки достигает 6500, что увеличивает рабочую площадь каждой клетки в 40 раз (Rhodin, 1958).
Интрацитоплазматические мембраны или пластинки обнаруживаются лишь в базальной части клетки и представляют собой инвагинации или складки наружной клеточной мембраны. В последние годы удалось показать, что внутриклеточные пластинки образованы изгибами не только мембранных базальных отделов клетки, но и латеральных мембран соседних клеток, которые как бы перекрывают друг друга (Rhodin, 1958; Latta et al., 1967). Если исходить из этих данных, то интрацито- плазматические мембраны являются по существу не внутриклеточными, а межклеточными образованиями.
Многочисленные митохондрии расположены в базальной части клетки между внутриклеточными мембранами, что и создает впечатление об их правильной ориентации. Каждая митохондрия, таким образом, заключена в камере, образованной складками цитоплазматической мембраны. Так как эта мембрана представляет собой выпячивание интерстиция внутрь клетки (или между клетками), то продукты энзиматических процессов, разыгрывающихся в митохондриях, могут легко выходить за пределы клетки.
Помимо митохондрий, эпителий проксимального извитого канальца содержит микротельца, аппарат Гольджи, эндоплазматический ретикулум, рибосомы, лизосомы, а также вакуоли, которых много в апикальной части клетки, и крупные плотные однородные тельца — «гиалиновые гранулы».
Клетки прямой части проксимального канальца (толстый нисходящий отдел петли Генле) в основном имеют то же строение, что и клетки извитой части, но пальцевидные выросты щеточной каемки более грубые и короткие, внутриклеточных мембран и митохондрий меньше и они не столь строго ориентированы, значительно меньше цитоплазматических гранул, в результате чего цитоплазма становится более прозрачной.
а — структура канальца: щеточная каемка (стрелка), митохондрии и белковые частицы в цитоплазме эпителия, увел. X 3000, б — электронограмма среза клетки, увел. X 9800 (по Piranl, 1966): Nu — ядро, Nul — ядрышко, Вт — базальная мембрана, Mt — митохондрии, ВЬ — щеточная каемка, Lu — просвет канальца; в — электронограмма поперечного среза микроворсин щеточной каемки после реакции Гомори. Активность щелочной фосфатазы отчетливо выражена на поверхности микроворсин (по Tranzer)
Ультраструктура и ферментохимия клеток проксимального канальца позволяют объяснить его сложную и дифференцированную функцию. Щеточная каемка, как и лабиринт внутриклеточных мембран, является своеобразным приспособлением для осуществления колоссальной по объему функции реабсорбции, которую выполняют эти клетки.
Избирательная реабсорбция глюкозы в проксимальных канальцах доказывается локализацией в щеточной каемке щелочной фосфатазы, осуществляющей дефосфорилирование гексозофосфата (рис. 6,в), и высокой активностью в цитоплазме глюкозо-6-фосфатазы. Реабсорбция сахара связана также с глюкозо-6-фосфат-дггидрогеназой, умеренное содержание ее выявляется в проксимальных канальцах. Избирательная реабсорбция глюкозы в проксимальном сегменте находит доказательства в так называемой флоридзиновой глюкозурии, так как флоридзин блокирует процессы фосфорилирования только в клетках этого сегмента нефрона.
Реабсорбция воды и электролитов связана с функцией внутриклет ных (межклеточных) мембран. На электронных микрофотограммах мс но проследить образование на месте этих мембран пузырьков и цистеН которые представляют собой путь резорбированной жидкости в клет от щеточной каемки до базальной мембраны. Минуя последнюю, ж! кость поступает в интерстиций и капиллярное русло. Большое значен в функции облигатной реабсорбции воды и натрия придают сукцинг дегидрогеназе, активность которой в проксимальном канальце оче высока (Ю. В. Наточин, 1963, 1965; В. В. Серов и А. Г. Уфимцева, 196′;
Особый интерес представляет вопрос о канальцевой реабсорбции бе ка. Можно считать доказанным, что весь фильтрующийся в клубочк. белок реабсорбируется в проксимальных канальцах, чем и объясняем его отсутствие в моче здорового человека. Эти положения основывают* на результатах многих исследований, выполненных, в частности, с п мощью электронного микроскопа. Считают, что белок, попавший в кле ку, вступает во взаимодействие с митохондриями и лизосомами, чт ведет к образованию «гиалиновых капель», и, подвергаясь катаболич ским процессам с участием многих энзимов, преобразуется в полипе! тиды и аминокислоты. Действительно, в эпителии проксимального кг нальца по сравнению с другими отделами нефрона особенно резк выражена активность дегидрогеназ (дегидрогеназа глютаминово] молочной, яблочной и изолимонной кислот, сс-глицерофосфатдегидроп наза), диафораз (НАД- и НАДФ-диафораза), нуклеотидаз (Ю. В. Нг точин, 1963, 1965; В. В. Серов, А. Г. Уфимцева, 1967). Вероятнее всегс «основные усилия» дегидрогеназ и диафораз в проксимальных каналь цах направлены на осуществление реабсорбции белка. Эпителий про ксимальных канальцев отличается высоким содержанием гидролаз, осо бенно кислой фосфатазы, локализующейся в лизосомах.
В связи с этими данными намечаются совершенно определенные ме ханизмы «повреждения» проксимальных канальцев При протеинурических состояниях, нефротическом синдроме любого ге неза изменения проксимальных канальцев в виде так называемой белковой дистрофии (гиалиново-капельная, вакуольная) отражают либо функциональное перенапряжение реабсорбционного механизма в условиях повышенной порозности гломерулярного фильтра для белка, либо неизбирательную резорбционную недостаточность канальцев и связаны с инфильтрационным механизмом (И. В. Давыдовский, 1958; В. В. Серов, 1966, 1968). Нет необходимости видеть в изменениях канальцев при нефротическом синдроме первично-дистрофические процессы. Нефроз — всегда гломерулонефроз. В равной мере нельзя рассматривать и протеи- нурию как результат только повышенной порозности гломерулярного фильтра. Протеинурия наблюдается при нефрозах как клубочкового, так и канальцевого происхождения. Она отражает повреждение фильтра почки и истощение, блокаду ферментных систем проксимального сегмента, ведающих реабсорбцией белка. Не удивительно, что морфологическим эквивалентом нефротического синдрома становятся «светлые» или «пенистые» клетки канальцев (чаще эпителий проксимальных канальцев, цитоплазма которого подверглась гидропической дистрофии) .
При ряде инфекций и интоксикаций блокада ферментных систем проксимальных канальцев может наступить остро, поскольку эти канальцы как первое звено реабсорбции первыми попадают пол удар токсинов, ядов при их элиминации почками. В таких случаях обычно развивается дистрофия декомпозиционного механизма, то, что Вирхов называл фане- розом. Активация гидролаз лизосомного аппарата в ряде случаев завершает этот процесс развитием некроза клетки (острый нефроз). Особенно ярко подобный механизм представлен при отравлении сулемой, которая блокирует SH-группы ферментных белков. При этом ртуть вступает в химическое взаимодействие с тиоловыми группами в основном дыхательных ферментов цикла Кребса.
В свете приведенных данных становится понятной патология «выпадения» ферментов канальцев почек наследственного порядка, так называемых наследственных ферменгопатий (например, проксимальный тубулярный синдром).
Клетки тонкого сегмента петли Генле. Имеют малые размеры, бедны митохондриями, вместо щеточной каемки на поверхности их обнаружены короткие и тонкие выросты, отстоящие друг от друга на расстоянии 700—1000 A (Rhodin, 1958). Эпителий отличается небольшим содержанием тирозина, триптофана и гистидина, белков основного и кислого характера, а также активных SH-групп (В. В. Серов, А. Г. Уфимцева, 1967).
Характерная особенность структуры этих клеток состоит в том, что внутриклеточные мембраны и пластинки пересекают тело клетки на всю ее высоту, образуя в цитоплазме щели шириной до 70 А, идущие от поверхности клетки до базальной мембраны. Создается впечатление, что цитоплазма состоит из отдельных сегментов, причем часть сегментов одной клетки как бы вклинивается между сегментами соседней клетки. Тонкий сегмент является областью, в высшей степени проницаемой для воды, и в этом смысле особое устройство его клеток должно способствовать обмену между содержимым канальца и интерстиция и, вероятно, регуляции постоянного внутрипочечного давления.
Ферментохимия тонкого сегмента свидетельствует о функциональной особенности этого отдела нефрона, который как «дополнительное приспособление» уменьшает до минимума фильтрационный заряд воды и обеспечивает ее пассивную резорбцию.
По сравнению с проксимальными канальцами тонкий сегмент характеризуется низкой ферментативной активностью и отсутствием ряда ферментов, например щелочной фосфатазы, глюкозо-6-фосфатазы, глюкозо- (i-фосфатдегидрогеназы, сукцинатдегидрогеназы. Большинством авторов в клетках этого сегмента обнаружено крайне низкое содержание дегидрогеназ молочной, яблочной, глютаминовой кислот и а-глицерофосфат- дегидрогеназы. Лишь НАД- и НАДФ-диафоразы выявлялись в значительном количестве.
Клетки дистального канальца. Ультраструктура клеток напоминает клетки проксимальных канальцев. Они богаты сигарообразными митохондриями, заполняющими пространства между внутриклеточными мембранами и пластинками, а также цитоплазматическими вакуолями и гранулами вокруг ядра, расположенного апикально, но лишены щеточной каемки (рис. 7). Вместо нее на поверхности клетки имеются немногочисленные отростки цитоплазмы длиной до 0,5 мк, диаметром до 800 А, отстоящие друг от друга на расстоянии 0,3—0,4 мк (Rhodin, 1958).
Эпителий дистального канальца богат аминокислотами, белками основного и кислого характера, РНК, полисахаридами и реактивными SH-группами (В. В. Серов, А. Г. Уфимцева, 1967).
Сложность устройства клеток дистальных канальцев, обилие митохондрий, внутриклеточных мембран и пластического материала свидетельствуют о сложности их функции — факультативной реабсорбции, направленной на поддержание постоянства физико-химических условий внутренней среды.
Процессы, регулирующие постоянство осмотического давления и кислотно-щелочного баланса мочи, обеспечиваются не только структурными, но и ферментными системами дистальных канальцев. Они осуществляются путем изменения соотношений кислых и щелочных фосфатов в результате действия активных фосфатаз (щелочная и кислая фосфатаза, глюкозо-6-фосфатаза), на высокое содержание которых в эпителии ди стальных канальцев указывают большинство
7. Дистальный каналец. Электронограмма, увел. X 8200 (по Pirani, 1966).
Nu — ядро; Сш — клеточная мембрана; Mt — митохондрии; Mv — микроворсинки; Lu — просвет канальца.
исследователей. С помощью сукцинатдегидрогеназы, содержание которой преобладает в дистальном сегменте, здесь осуществляется реабсорбция электролитов, в частности натрия, через дегидрирование янтарной кислоты.
Эпителий дистальных канальцев отличается выраженной активностью НАД- и НАДФ-диафораз, дегидрогеназ молочной, яблочной, изолимон- ной, глютаминовой, а-кетоглютаровой кислот, а-глицерофосфатдегидро» геназы и глюкозо-6-фосфат-дегидрогеназы (Ю. В. Наточин, 1963, 1965; В. В. Серов, А. Г. Уфимцева, 1967).
Таким образом, для дистального отдела нефрона характерна очень высокая активность гидролитических, гликолитических ферментов и ферментов цикла Кребса, обеспечивающая энергией его специализированные функции. Факультативная (дистальная) реабсорбция регулируется гормонами задней доли гипофиза, коры надпочечников и юкстагломеру- лярным аппаратом почки. Доказано, что местом приложения действия антидиуретического гормона гипофиза (АДГ) в почке, «гистохимическим плацдармом» этой регуляции служит система гиалуроновая кислота — гиалуронидаза, заложенная в пирамидах, главным образом в их сосочках. При этом кислые мукополисахариды входят в состав базальных мембран, «межклеточного цемента» канальцев и парапластической субстанции стромы, а продукция гиалуронидазы осуществляется, вероятно, эпителием дистальных канальцев и собирательных трубок (А. Г. Гинецинский, 1961, 1963). Подтверждением такого механизма регуляции АДГ служит высокая гиалуронидазная активность мочи и экстрактов почечной ткани (у собак ткань почек превышает по своей гиалуронидазной активности тестикулярную ткань) и обратная зависимость между активностью гиалуронидазы мочи и величиной диуреза у здорового человека.
Альдостерон, а по некоторым данным и кортизон, осуществляют свое влияние на уровень дистальной реабсорбции прямым включением в ферментную систему клетки, обеспечивающую перенос ионов натрия из просвета канальца в интерстиций почки. Особое значение в этом процессе принадлежит прямой части дистального канальца, причем дистальный эффект действия альдостерона опосредован секрецией ренина, закрепленной за клетками ЮГА. Ангиотензин, образующийся под воздействием ренина, не только стимулирует секрецию альдостерона (А. М. Вихерт, 1963), но и принимает непосредственное участие в дистальной реабсорбции натрия.
Таким образом, в почках осуществляется соподчиненная работа клубочковых и околоклубочковых структур с канальцами и стромой пирамид, причем это соподчинение идет не только по линии «прямых связей» (клубочек—каналец—строма), но и на уровне нейргормональных строго координированных регуляций.
Со структурно-функциональной особенностью дистальных канальцев, их повышенной чувствительностью к кислородному голоданию связано до некоторой степени избирательное поражение дистальных канальцев при острых гемодинамических повреждениях почек, в патогенезе которых основную роль играют глубокие нарушения почечного кровообращения с развитием аноксии тубулярного аппарата. В условиях острой аноксии клетки дистальных канальцев, чувствительные к кислородному голоданию, подвергаются воздействию содержащей токсические продукты кислой мочи, что ведет к их поражению вплоть до некроза. При хронической аноксии клетки дистального канальца чаще, чем клетки проксимального канальца, подвергаются атрофии.
Итак, структура нефрона необычайно сложна и в высокой степени подчинена дифференцированной его функции. Однако структурно-функциональная специализация отдельных элементов нефрона не подменяет, а скорее обеспечивает единство нефрона как анатомо-функциональной единицы. Благодаря этому единству почки выполняют большую и слож> ную работу регуляции гомеостаза.
КРОВЕНОСНАЯ СИСТЕМА ПОЧКИ
Исследования последнего времени показали необычайную сложность и своеобразие архитектоники кровеносной системы почек. Они прежде всего полностью отвергли прежние взгляды относительно концевого характера ветвления кровеносных сосудов почек. Было доказано наличие артериальных анастомозов и коллатералей между впереди- и позади- лоханочными сосудистыми системами, дуговыми артериями и артериями коркового слоя почек. Однако интраренальных анастомозов в норме немного и диаметр их не превышает 100—150 мк. Анастомозы чаще можно найти между крупными артериальными стволами у верхушек пирамид, ветвями, оплетающими лоханку, и между сосудами сплетений ин- гермедиарной зоны.
Помимо этих внутриорганных артериальных анастомозов и коллатера- лей, в почке обнаружено окольное, добавочное к основным путям кровотока параартериальное, паравенозное и параневральное русло. Чаще параартериальные сосуды калибром до 50 мк обнаруживаются в области синуса. Они сопровождают ветви первого и второго порядка и анасто- мозируют с лоханочными коллатералями. Капсулярные коллатерали встречаются в неизмененных почках довольно редко, и калибр их не превышает 120 мк в диаметре.
Артерио-венозные анастомозы в условиях нормального почечного кровообращения редко обнаруживаются в пограничном слое и синусе почки. Они формируются обычно в патологических условиях.
В почках имеются два фунщи налъно различных круга кровообращения: большой — кортикальный и малый — юкстамедуллярный (рис. 8). Это доказано исследованиями Trueta и соавторов (1947, 1953), до некоторой степени подготовленными работам В. 3. Голубева (1894), Ganssle; (1934) и развитыми позже в тру дах многих авторов.
Кортикальный (большой) круг представлен сосудами коркового вещества: междольковыми артериями, приносящими сосудами и «чудесной сетью» основной массы гломерул, выносящими сосудами и постгломерулярной капиллярной и венозной сетью коры. Юкстамедуллярный (малый) круг кровообращения почки по Trueta составляют: проксимальные отрезки ин- терлобулярных артерий, приносящие артериолы юкстамедуллярных клубочков и их сосудистая сеть, выносящие артериолы юкстамедуллярных клубочков, артериальные и венозные компоненты прямых сосудов пирамид, а также проксимальные отрезки интер- лобулярных вен. Установлено, что элементами юкстамедуллярного пути почечного кровотока могут быть также межканальцевые капилляры кортикомедуллярной зоны, перигломерулярные сосудистые сплетения, связующие афферентные и эфферентные артериолы юкстамедуллярных клубочков, а также негломерулярные артерио-венозные анастомозы пограничного слоя почки.
Возможность кровообращения в почке по юкстамедуллярному «укороченному» пути обеспечивается прежде всего особым строением, а также своеобразием функции юкстамедуллярных клубочков и сосудов пограничного слоя почки. Особенность строения юкстамедуллярных клубочков состоит в том, что, составляя 1/10 часть общего числа гломерул, они в отличие от кортикальных имеют выносящие сосуды гораздо большего диаметра, чем приносящие. Широкие выносящие сосуды юкстамедуллярных клубочков обильно анастомозируют между собой и с венами, спускаются в пирамиды, где образуют широкопетлистые артерио-веноз- ные сплетения с прямыми сосудами, после чего впадают в основные венозные стволы почки. Кроме того, описывают анастомотические связи между приносящими и выносящими сосудами юкстамедуллярных клубочков.
Юкстамедуллярные клубочки рассматриваются, таким образом, не только как «аппараты фильтрации», но и как «дренажные системы». Они первыми включаются в корковый кровоток, причем скорость кровотока в них в 8 раз больше, чем в кортикальных клубочках. В силу особенностей строения и функции юкстамедуллярные клубочки раньше, чем кортикальные, подвергаются склерозу и гиалинозу.
Значение пограничного слоя в регуляции почечного кровообращения подчеркивал еще В. 3. Голубев (1894), который обнаружил в сосудистой сети этого слоя обильно анастомозирующие сплетения, напоминающие почечные гломерулы, и назвал их «новыми чудесными сетями почек». Позже было установлено, что в состав этих сплетений входят прямые артерио-венозные связи. Gansslen (1934) правильно называет пограничный слой «распределительной зоной», поскольку в ней происходит перераспределение крови между корой и пирамидами и определяется «доля участия» кортикального и юкстамедуллярного пути в почечном кровотоке, чему способствуют клапанно-сфинктерные образования в проксимальных отделах дольковых артерий вблизи отхождения от них приносящих сосудов.
В физиологических условиях перераспределение крови в почках происходит таким образом, что 85—90% ее течет по кортикальному и лишь 10—15% по юкстамедуллярному пути. Но при определенных условиях основная масса крови может циркулировать по укороченному почечному пути. Тогда юкстамедуллярный путь становится своеобразным шунтом (шунт Труета), по которому кровь сбрасывается в пирамиды, минуя корковое вещество, что ведет к избирательной ишемии коры вплоть до развития кортикальных некрозов почки. Trueta (1947), исходя из результатов своих разносторонних опытов (изучение почечного кровообращения при раздражении седалищного или чревного нерва, при сдавлении конечности, кровопотере, денервации почки), пришел к заключению, что почечное шунтирование связано с нервнорефлекторными механизмами, спазмом артерий коркового вещества почки. Однако исследования последних лет, посвященные этому вопросу, доказывают значение не только нервного, но и гуморального механизма в развитии шунта Труета. Эти исследования позволяют рассматривать шунтирование как один из вариантов ауторегуляции почечного кровотока.
На основании данных о механизме шунтирования почечного кровотока пересматриваются механизм развития шоковой почки и гепаторенального синдрома, патогенез токсикоинфекционной почки, геморрагического нефрозонефрита, амилоидного нефроза и гломерулонефрита.
ЛИМФАТИЧЕСКАЯ СИСТЕМА И СТРОМА ПОЧКИ
Строение лимфатической системы почки соответствует особой ее конструкции, которая подчинена функциональной специфике органа (Д. А. Жданов, 1952, 1957; В. Я. Бочаров, 1957). Начальные сети лимфатических капилляров (корни лимфатической системы почки) оплетают капсулу Шумлянского—Боумена клубочков, извитые и прямые канальцы, причем лимфатические капилляры имеют больший калибр (15 мк), чем кровеносные. В гломерулах лимфатические капилляры отсутствуют, поскольку для них там не только «нет места», но и «нет дела», так как функция гломерулярной фильтрации исключает необходимость лимфатической резорбции.
Стенка лимфатических капилляров находится в тесной связи с волокнами окружающей соединительной ткани, а эндотелий капилляров как бы сращен с этими волокнами, так как базальная мембрана отсутствует. Эта особенность строения объясняет расширение лимфатических капилляров не только при увеличении внутрисосудистого давления лимфы, но и при повышении тканевого давления, отеке ткани.
Лимфатические капилляры вокруг клубочков и канальцев коркового вещества переходят в окружающие междольковые артерии и вены футлярообразные сети лимфатических капилляров (калибр некоторых из них достигает 25—30 мк), причем между этими сетями имеются анастомозы капиллярного типа. В интермедиарной зоне лимфатические капилляры, сопровождающие междольковые кровеносные сосуды, укрупняются и впадают в лимфатические сосуды (до 50 мк в диаметре), которые имеют клапаны и в виде сплетений-футляров окутывают дуговые артерии и вены. Babies и Renyi-Vamos (1952) называют эти лимфатичеа сосуды, стенка которых имеет все три слоя (интима, медия и адвен ция), дугообразными, а В. Я. Бочаров обозначает их как первопоряд: вые. В интермедиарной зоне, над основанием пирамид, сплетения лк фатических сосудов по ходу дуговых артерий и вен образуют сложи; конструкцию, так как здесь собирается лимфа из коркового и мозговс вещества. Пограничный слой для лимфатической системы почки становится собирательной зоной.
Лимфатические капилляры мозгового вещества немногочисленны, обнаруживаются лишь по ходу прямых артерий и вен, а вне артерио-венозных пучков отсутствуют (В. Я. Бочаров, 1957). Они имеют калибр 10 15 мк, образуют на незначительном протяжении крупнопетлистые и сливаются в лимфатические стволики (диаметром до 30—40 мк), которые впадают в дугообразные лимфатические сосуды.
Сплетения дугообразных лимфатических сосудов, собирая лимфу кг от коркового, так и от мозгового вещества почки, формируют сети-фу ляры по ходу междолевых артерий и вен. Лимфатические сосуды эти сетей (до 40—50 мк в поперечнике) обозначают как междолевые (Babic: Renyi-Vdmos, 1952), или сосуды второго порядка (В. Я. Бочаров, 1957] Несколько междолевых сплетений дают более крупные, формирующих основные отводящие лимфатические сосуды.
Такова схема строения лимфатической системы почки. Следует под черкнуть тот факт, что лимфатическая система повторяет кровеносную систему почки футлярообразными сетями своих капилляров и сосудов. Междольковые кровеносные сосуды и оплетающие их лимфатические капилляры, так же как дуговые и междолевые кровеносные и лимфатические сосуды, находятся в едином соединительнотканном ложе, формируют единый сосудистый пучок.
Лимфатические сосуды находятся в тесном взаимоотношении и с соединительной тканью органа, причем их функция в значительной степени зависит от строения и состояния соединительной ткани. В различных слоях почки соединительная ткань развита неодинаково, да и «качество» ее различно, что, естественно, определяет и различные потенциальные возможности лимфатической системы коркового слоя, интермедиарной зоны и пирамид.
В пограничном слое соединительная ткань, представленная в основном ретикулярными волокнами, наиболее хорошо развита. Этот слой, как уже упоминалось, более всего богат лимфатическими дренажами, формирующими сложную высокофункционально-потентную систему.
В мозговом веществе соединительной ткани немного, она крайне рыхлая, способна легко «набухать» и «отбухать» (Д. А. Жданов, 1952;В.Я. Бочаров, 1957; Babies, Renyi-Vfimos, 1952), что зависит от состояния имеющейся здесь системы гиалуронидаза—гиалуроновая кислота, находящейся под регулирующим влиянием ряда гормонов и определяющей по существу размер факультативной канальцевой реабсорбции, а также интерстициальных клеток, причастных к работе противоточно-множительного механизма. В силу этого, вероятно, лимфатическая система пирамид бедна, представлена лимфатическими капиллярами лишь в артерио-венозных пучках и крайне лабильна. Функциональная специфика соединительной ткани пирамид, обилие в ней кислых мукопо- лисахаридов, плохо развитая система лимфатических дренажей объясняют избирательную ранимость стромы мозгового вещества почки в условиях патологии. Здесь раньше всего развивается отек, при нарастающей тканевой гипоксии — чаще склероз и гиалиноз, здесь в строме почки парапротеины образуют с кислыми мукополисахаридами глюкопротеид-амилоид. Как указывает Д. А. Жданов (1958), слабое развитие соединительной ткани в корковом веществе служит причиной большой ранимости почечной паренхимы при травме, отеке, воспалении.
Лимфатическая система почки функционально подчинена главным образом реабоорбционной работе канальцев, является вторым звеном почечной реабсорбции, поэтому по сравнению с другими органами поставлена в специфические функциональные условия.
Канальцевая реабсорбция — сложный динамический процесс, транспорт белка, сахаров, электролитов, воды из канальцевой мочи к кровеносному руслу. Транспорт этих продуктов, прежде всего белка, резорби- рованного канальцами, так же как и профильтрованного через эндотелиальную мембрану постгломерулярных капилляров, осуществляется в первую очередь лимфатическими капиллярами (Rusznyak et al., 1957).
Лимфатическая система почек проделывает колоссальную работу по транспорту реабсорбированного белка: в 1 минуту почки образуют около 1 мл лимфы, т. е. приблизительно такое же количество, как и мочи, причем содержание белка в лимфе колеблется в пределах 2,8—3,7 %. Если содержание белка в лимфе считать равным 2,8—3,79 %, то суточный его транспорт почками составит 40—55 г.
Полноценная функция лимфатического дренажа почки обеспечивает как нормальную экскреторную диуретическую функцию почки, так и нормальный метаболизм самой почечной ткани. Если же по каким-либо причинам эта функция лимфатической системы нарушается, то наступают отек и гипоксия ткани почки (поскольку накапливающийся в ин- терстиции белок в силу коллоидно-осмотического давления связывает воду), возникает зернистая, гиалиново-капельная дистрофия эпителия канальцев, сопровождающаяся протеинурией, цилиндрурией («лимфогенный нефроз», по Kaiserling, 1942), а позже — склероз почки. Последовательность возникновения этих изменений прослежена в эксперименте при перевязке отводящих лимфатических сосудов почки или мочеточника.
В свете приведенных данных изучаются морфология и патогенетическое значение недостаточности лимфатической системы при гидронефрозе, гломерулонефрите, амилоидном нефрозе и других заболеваниях почек.
Юкстагломерулярный аппарат (ЮГА) представлен гранулированными эпителиоидными клетками в стенке приносящей артериолы клубочка, скоплениями недифференцированных клеток в углу между приносящей и выносящей артериолой (lacis) и эпителиальной пластинкой извитой части дистального канальца там, где каналец подходит, к сосудистому клубочку (macula densa). Гистогенетически этот комплекс клеток расценивается как нейромиоэпителиальный.
КЛЕТКИ ПРИНОСЯЩЕЙ АРТЕРИОЛЫ
Впервые дифференцировку гладкомышечных клеток стенки приносящей артериолы (у места ее вхождения в клубочек) в гранулированные афиб- риллярные клетки описал у мышей Ruyter (1925). Он сравнивал эти клетки с эпителиоидными клетками артерио-венозных анастомозов и придавал им значение в регуляции клубочкового кровообращения. В участках скопления этих клеток эластические мембраны стенки отсутствовали, но обнаруживались импрегнирующиеся серебром нервные волокна.
Аналогичные клетки в стенке приносящей артериолы, иногда в виде периваскулярной манжетки у полюса клубочка, обнаружил в почке человека Oberling (I960). Он считал их нервно-мышечными образованиями, подобными гломусным тельцам Массона, и приписывал им роль периферического вазомоторного центра.
источник