Несмотря на то, что амилоидоз — это достаточно редкая причина нарушения работы почек, ее нельзя вычеркивать из списка возможных заболеваний. По статистике, им страдает один человек на 50-60 тысяч, при этом патология может маскироваться под гломерулонефрит или хронический пиелонефрит. Наличие амилоидоза, как правило, выявляется случайно при исключении других почечных болезней. Чтобы своевременно его заподозрить, следует внимательно наблюдать за состоянием организма, особенно пациентам из «группы риска».
Название болезни происходит от слова «амилоид» — это сложное вещество, которое в норме, практически не вырабатывается у человека. Оно состоит из ряда белков и сахаров и не содержит чужеродных частиц (бактериальных, вирусных и т.д.). Именно поэтому наш организм не реагирует на него, как на «угрозу здоровью», и не устраняет избыточное количество этого вещества.
До настоящего времени, точно неизвестно, как и почему активируется выработка амилоида. Ученые считают, что основную роль в этом играют генетическая предрасположенность и нарушение работы иммунных клеток (плазмоцитов), так как именно они ответственны за выработку этого вещества.
Чем опасен амилоид для почек? Накапливаясь в органе, он постепенно разрушает его и изменяет обмен веществ. Этот процесс протекает очень медленно и, в первое время, никак себя не проявляет. Однако по мере поражения почек, в организме начинают задерживаться вода и целый ряд опасных токсинов (креатинин, мочевина, мочевая кислота).
В настоящее время, принципиально выделяют три вида болезни, в зависимости от предполагаемой причины:
- Первичный амилоидоз – главную роль в возникновении данной формы доктора отводят наследственности. Считается, что при определенных изменениях в хромосомах (это микроскопические структуры, сохраняющие нашу генетическую информацию), иммунные клетки могут вырабатывать патологический белок, необходимый для создания амилоида;
- Вторичный амилоидоз – основной причиной возникновения этого вида является наличие другой хронической болезни, при которой нарушается работа иммунитета;
- Старческий – известно, что с возрастом наш организм утрачивает способность адекватно выполнять часть жизненно-необходимых функций. Работа иммунитета – одна из них. В старости, уровень лейкоцитов сохраняется на прежнем уровне, но обмен веществ в них часто изменяется. Из-за этого могут вырабатываться патологические вещества, в том числе компоненты амилоида.
Учитывая эти причины, доктора составили «группы риска» среди пациентов, у которых вероятность заболеть амилоидозом почек несколько выше. К ним относятся:
- Люди, чьи родственники страдали любой формой этой болезни или нарушением работы почек из-за неясной причины;
- Пациенты старше 65 лет;
- Больные ревматоидным артритом, спондилоартритом анкилозирующего характера (болезнь Бехтерева), волчанкой, любыми злокачественными патологиями (раком, саркомой, лейкозами и т.д.).
При появлении у этих групп пациентов признаков поражения почек, обязательно следует исключать амилоидоз, как возможную причину нарушения их функций.
Так как амилоид накапливается в органах постепенно, то для этой болезни характерно очень медленное течение с постепенным нарастанием симптомов. В среднем, от появления первых признаков заболевания до тяжелых поражений почек проходит несколько десятков лет. За это время больные успевают тщательно обследоваться и выявить истинную причину заболевания, но, как правило, слишком поздно для проведения успешного лечения.
Трудности со своевременной диагностикой возникают из-за скрытого течения патологии на первых стадиях. Первый симптом амилоидоза почек долгое время никак не беспокоит пациента – это появление белка в моче (синоним – протеинурия). При этом больрой не испытывает дискомфорта в области поясницы, отеки отсутствуют, а артериальное давление остается в норме.
Чем опасно это состояние? Сами по себе незначительные потери белка не имеют большого значения для организма, однако протеинурия свидетельствует о нарастающем поражении почек. В последующем, этот незначительный симптом перерастет в целый комплекс нарушений по всему организму.
Эта стадия, как правило, течет 10-15 лет. В это время, ее можно обнаружить только в ходе случайного медицинского осмотра с исследованием анализа мочи. Именно поэтому пациентам из группы риска рекомендуется 1 раз в 6-12 месяцев проходить тщательное обследование по месту жительства (у своего участкового доктора).
С течением времени, в органе накапливается значительное количество амилоида, из-за чего нарушается большая часть его функций. Почечный фильтр уже сильно поврежден – он не способен удержать необходимые для организма вещества, поэтому ежедневно может теряться около 3-х грамм белка (в норме потери не должны превышать 0,13 г/л). Также у пациентов появляются отеки различной степени выраженности – от небольшой отечности лица и рук до обширного пропотевания жидкости во все органы и ткани.
Помимо вышеперечисленных симптомов, больные амилоидозом почек также могут предъявлять жалобы на:
- Частое и обильное мочеиспускание – несостоятельность почечного фильтра может привести к значительным потерям жидкости (до 7-10 литров/сутки). Такое состояние доктора называют «почечный диабет». Несмотря на это, отечность может сохраняться, из-за того что жидкость уходит из кровеносного русла в ткани;
- Изменение артериального давления (АД) – заболевание может протекать, как на фоне сниженного давления (менее 100/70 мм.рт.ст) так и с гипертензией (более 140/90 мм.рт.ст). Какой из вариантов будет у пациента сказать трудно, но значительно чаще амилоидоз почек сочетается с гипотонией. Это зависит от характера повреждения органа, степени протеинурии и состояния организма пациента;
- Изменение цвета мочи – появление красного оттенка жидкости (образное название – «цвет мясных помоев») еще один признак повреждения почечного фильтра;
- Увеличение массы тела – этот симптом может возникнуть по двум причинам. В первую очередь, вес может возрасти из-за задержки жидкости в отеках. Помимо этого, у почечных больных нарушается липидный обмен в организме – возрастает уровень холестерина, триглицеридов и липопротеидов. Эти вещества приводят к накоплению жиров в тканях (в частности – подкожной клетчатке).
В научной литературе, эту стадию доктора называют «амилоидно-липоидный нефроз». Протекает она, в среднем, около 6-ти лет. Очень важно, чтобы на этом этапе (или раньше) был поставлен правильный диагноз и были начаты лечебные мероприятия. В противном случае, болезнь очень быстро перейдет в заключительную необратимую стадию.
На этом этапе почечная ткань практически полностью утрачивает свои функции. Фильтр не только пропускает большое количество белка, но и задерживает в организме различные токсины (креатинин, мочевую кислоту, мочевину, продукты распада лекарств и т.д.). К перечисленным выше симптомам, присоединяются:
- Постоянная слабость;
- Нарушение внимания, рассеянность;
- Постоянная головная боль с регулярными эпизодами головокружения;
- В тяжелых случаях, нарушения сознания, вплоть до ступора и даже комы.
Это состояние обозначают, как почечную недостаточность хронического характера. Особенность ее при амилоидозе заключается в том, что она практически всегда протекает на фоне пониженного давления и сопровождается с признаками повреждения других органов (из-за отложения в них амилоида).
| Поврежденный амилоидозом орган/система | Характерные симптомы |
| Кожа |
|
| Сердце |
|
| Пищеварительный тракт |
|
| Суставы | Характерна утренняя скованность, которая уменьшается после движений. |
| Нервная система | Снижение чувствительности на стопах и кистях – пациент может не ощущать прикосновения острым, горячим или холодным предметом. Кожа в этих областях теряет свою эластичность, становиться сухой, усиливается ее шелушение. Это также связано с повреждением нервных путей. |
Наличие одного из симптомов, которые перечислены в таблице, в сочетание с признаками поражения почек – повод заподозрить амилоидоз.
Как уже было сказано, своевременно определить эту болезнь достаточно трудно. Для этого нужно тщательно проанализировать все жалобы пациента, оценить состояние не только почек, но и других органов и назначить необходимое лабораторное обследование. При амилоидозе почек изменения можно найти в следующих анализах:
| Лабораторный анализ | Изменения при амилоидозе |
| Клинический анализ крови (из пальца) |
|
| Биохимический анализ крови (из вены) | Увеличение уровня:
Снижение количества общего белка крови (из-за выделения его с мочой) – менее 67 г/л. |
| Клинический анализ мочи |
|
Для подтверждения диагноза этих исследований недостаточно. В настоящее время, существуют две методики, благодаря которым можно достоверно убедиться в наличии болезни:
- Пункция подкожной клетчатки – если амилоид откладывается во внутренних органах, существует высокая вероятность того, что он присутствует в жировой клетчатке. Чтобы его обнаружить, шприцом с широкой иглой берут небольшую часть этой ткани у больного. Ее окрашивают по специальной методике и смотрят под микроскопом. Обнаружение патологического белка, в сочетание с почечными нарушениями позволяет убедиться в правильности диагноза;
- Пункция почки – процедура проводится аналогичным образом, только забор материала производят прямо из органа.
Другие методы диагностики, такие как УЗИ почек, КТ или МРТ не позволяют оценить наличие амилоида и определить причину повреждения.
Важно отметить, что эта патология тяжело поддается лечению. Полностью вывести амилоид из почки с помощью каких-либо препаратов, физиотерапевтических процедур или методик народного лечения невозможно. Однако с помощью своевременно начатой терапии, можно значительно уменьшить активность болезни и предотвратить необратимые повреждения почек.
Один из самых важных компонентов лечения амилоидоза почек – это правильное питание. Чтобы уменьшить количество вырабатываемого амилоида и снизить нагрузку на фильтрационный барьер, необходимо ограничить в своем рационе:
- Поваренную соль – во время приготовления блюда можно добавлять эту приправу, однако не следует в последующем досаливать уже приготовленную пищу. Также следует воздержаться от употребления малосольных/соленых консервов (рыбы, огурцов, грибов и т.д.);
- Казеин, который содержится любых молочных продуктах (сыр, творог, сметана, молоко и т.д.) и специальных смесях для культуристов;
- Телятину, говядину.
В диету можно включать любые крупы (особенно ячменную и перловую), овощи, баранину и куриное мясо. Употребление мучных изделий следует ограничивать пациентам с избыточной массой тела, так как они могут стать «донорами» холестерина и триглицеридов.
В настоящее время, для лечения амилоидоза почек используют, в основном три препарата:
| Препарат | Принцип действия | Типичные побочные явления |
| Унитиол | Это лекарство связывает определенные группы белков, из которых происходит синтез амилоида. Благодаря этому течение болезни существенно замедляется и частично стабилизируется. |
|
| Диметилсульфоксид (синоним – Димексид) | Точный механизм действия на эту болезнь не известен, однако достоверно подтверждено, что после курса препарата у пациентов наступает улучшение состояния. |
|
| Делагил/Плаквенил | Препараты уменьшают выработку амилоида, за счет торможения синтеза определенных ферментов. Эффективны только для лечения начальных стадий болезни. |
|
Следует сказать, что строгого алгоритма лечения амилоидоза почек не разработано, поэтому опытный доктор самостоятельно корректирует терапию, в зависимости от активности процесса и самочувствия пациента.
К такому радикальному методу прибегают только при необратимых поражениях почек, когда вопрос стоит о жизни и смерти пациента. К сожалению, в России донорство органов – это один из самых проблематичных вопросов, в отношении законодательства. Поэтому шансы получить совместимую с определенным больным почку, в нужное время и специально обустроенную операционную с врачами-трансплантологами, достаточно малы.
При выявлении болезни на ранних стадиях и адекватно проводимом лечении, часто удается затормозить процесс настолько, что он медленно и постепенно развивается в течение 30-40 лет. В течение жизни, больной может испытывать дискомфорт из-за периодически возникающих симптомов повреждения органа, однако качество их жизни страдает незначительно.
Как правило, пациенты умирают от амилоидоза почек только при развитии необратимых изменений. Они могут возникнуть при позднем выявлении болезни и быстропрогрессирующем процессе.
В настоящее время, колхицин используют достаточно редко, из-за его выраженного побочного действия. Однако эффективность этого препарата подтверждена клиническими испытаниями и эмпирическим опытом, поэтому вопрос о назначении решается индивидуально лечащим доктором.
Такая вероятность есть, она особенно высока, если в вашей семье это не первый случай заболевания. Чтобы ее снизить, необходимо перед зачатием провести прегравидарную подготовку и максимально уменьшить активность процесса.
Каких-либо мер по профилактике этой болезни не разработано.
Да, вероятность того, что амилоидоз разовьется в пересаженной почке, очень высока. Однако следует помнить, что от начала болезни до появления первых симптомов проходит около 15 лет. При своевременно начатом лечении, этот срок можно увеличить в 2-2,5 раза. Поэтому значительное повреждение почки не успевает повторно развиться у пациента.
источник
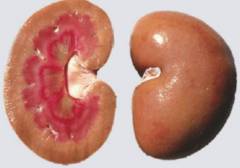
Амилоидоз — группа заболеваний (форм), общим признаком которых является отложение в органах и тканях особого белка b-фибриллярной структуры.
Амилоид в тканях появляется либо вокруг коллагеновых волокон (периколлагеновый амилоидоз), либо на базальных мембранах или вокруг ретикулярных волокон (периретикулярный амилоидоз).
Эпидемиология. Частота в популяции составляет не менее 1:50 000. Некоторые клинические формы амилоидоза отмечают в определенных районах земного шара: например, средиземноморская семейная лихорадка или семейная амилоидная полинейропатия (последняя распространена в Японии, Португалии, Швеции, Италии).
Амилоидоз чаще выявляют во второй половине жизни.
Классификация Номенклатурного комитета Международного союза иммунологических обществ (Бюллетень ВОЗ, 1993).
— AL-амилоидоз (А — amyloidosis, амилоидоз, L — light chains, легкие цепи) — первичный, связанный с миеломной болезнью (амилоидоз регистрируют в 10-20% случаев миеломной болезни).
— АА-амилоидоз (acquired amyloidosis, приобретенный амилоидоз) — вторичный амилоидоз на фоне хронических воспалительных заболеваний, а также при средиземноморской семейной лихорадке (периодической болезни).
— ATTR-амилоидоз (А — amyloidosis, амилоидоз, TTR — transthyretin, транстиретин) — наследственно-семейный амилоидоз (семейная амилоидная полинейропатия) и старческий системный амилоидоз.
— Аb2М-амилоидоз (A—amyloidosis, амилоидоз, b2М — b2-микроглобулин) — амилоидоз у больных, находящихся на плановом гемодиализе.
Локализованный амилоидоз чаше развивается у людей старческого возраста (AIAPP-амилоидоз — при инсулиннезависимом сахарном диабете, АВ-амилоидоз — при болезни Альцхаймера, AANF-амилоидоз — старческий амилоидоз предсердий).
Патогенез и патоморфология. Современные представления об амилоидогенезе предполагают выработку особого белка-предшественника амилоида под влиянием так называемого амилоидвысвобождающего фактора, продуцируемого макрофагами вследствие генетического дефекта под воздействием стимулирующего агента. Образование АА из SAA осуществляется путем неполного расщепления протеазами, связанными с поверхностной мембраной моноцитов-макрофагов.
Полимеризация растворимого АА-белка в фибриллы происходит также на поверхности макрофагов механизмом перекрестного связывания полипептидов при участии мембранных ферментов.
В эксперименте с казеиновым амилоидозом у мышей показана важная роль в индукции АА-отложений так называемого амилоидускоряющего фактора, образующегося в процессе воспаления в селезенке и печени. К ATTR-амилоидозу относятся семейная амилоидная полинейропатия (реже кардиопатия и нефропатия) с аутосомно-доминантным типом наследования и системный старческий амилоидоз. Сывороточным белком-предшественником амилоидоза в этой группе является компонент молекулы преальбумина — транстиретин (transthyretin — TTR) — транспортный белок для тироксина и ретинола, первично синтезируемый в печени. Наследственный семейный амилоидоз является результатом мутации в гене, ответственном за синтез молекулы транстиретина. Мутантный транстиретин имеет точечную замену в молекуле. Допускают, что в основе семейного наследственного амилоидоза могут лежать мутантные формы и других белков. Основу амилоидных депозитов составляют фибриллы.
Очищенный амилоид, полученный из фибрилл, представляет собой белок. При амилоидозе почек первично страдают клубочки, хотя амилоид обнаруживают также в интерстициальной, перитубулярной и васкулярной зонах. На ранних стадиях происходит отложение амилоида в виде небольших очагов в мезангии и вдоль базальной мембраны.
По мере прогрессирования заболевания клубочки интенсивно заполняются амилоидными массами и их капиллярное ложе редуцируется.
Клиническая картина.
Очень часто в течение длительного времени амилоидоз протекает бессимптомно.
Характер клинических проявлений зависит от биохимического типа амилоида, локализации амилоидных отложений, степени их распространенности в органах, длительности заболевания, наличия осложнений. Как правило, наблюдают комплекс симптомов, связанных с поражением нескольких органов. Признаки вовлечения почек (собственно амилоидоз почек) типичны для АА- и AL-амилоидоза, их не отмечают при семейной амилоидной поли- нейропатии и болезни Альцгеймера.
Клинические проявления амилоидоза почек варьируют от легкой протеинурии до развернутого НС: массивной протеинурии, гипопротеинемии, гиперлилидемии (гиперхолестеринемии, нарушений батанса ЛП, увеличения содержания Э-ЛП и триглицеридов), отечного синдрома.
Отеков может не быть при инфильтрации амилоидом надпочечников и гипонатриемии.
АГ развивается в 20—25% случаев, в основном при длительно существующем АА-амилоидозе.
Среди сопутствующих тубулярных дисфункций наблюдают каналылевый ацидоз, почечный диабет.
На фоне амилоидоза почек возможно развитие тромбоза почечных вен.
Амиюидоз сердца может развиться при AL-амилоидозе, редко — при АА-амилоидозе; обычно он проявляется рестриктивной кардиомиопатией. Наиболее частые клинические проявления: кардиомегалия, сердечная недостаточность, различные аритмии.
Выпотной перикардит возникает редко.
Локализованный амилоидоз предсердий часто отмечают у людей старше 80 лет.
Поражение ЖКТ объясняют либо прямым вовлечением органов в амилоидный процесс, либо опосредованными изменениями вследствие амилоидной инфильтрации регионарных нервных волокон.
Амилоидоз пищевода встречается чаще одновременно с поражениями других отделов пищеварительной системы. Характерны дисфагия при проглатывании плотной и сухой пищи, особенно при еде лежа, отрыжка. При рентгенологическом исследовании пищевод гипотоничен, перистальтика ослаблена, при исследовании больного в горизонтальном положении бариевая взвесь долго задерживается в пищеводе.
Осложнения: амилоидные язвы пищевода и пищеводные кровотечения.
Амилоидоз желудка обычно сочетается с амилоидозом кишечника и других органов. Клиническая картина: ощущение тяжести в эпигастральной области после еды, диспепсические расстройства; при рентгенологическом исследовании — сглаженность складок слизистой оболочки, ослабление перистальтики и эвакуации содержимого из желудка.
Осложнения: амилоидные язвы желудка, желудочные кровотечения, перфорация язв.
Дифференциальный диагноз проводят с хроническим гастритом, язвенной болезнью желудка, реже — опухолью.
Решающее значение имеют данные биопсии (выявление амилоидоза). Амилоидоз кишечника — частая локализация этого заболевания. Проявляется ощущением дискомфорта, тяжести, реже умеренными тупыми или спастическими болями в животе, нарушениями стула: запорами или упорными поносами.
Копрологическое исследование выявляет выраженную стеаторею, амилорею, креаторею. В крови анемия, лейкоцитоз, повышение СОЭ, гипопротеинемия (за счет гипоальбуминемии), гиперглобулинемия, гипонатриемия, гипопротромбинемия, гипокальциемия.
Специальные методы исследования обнаруживают нарушение пристеночного пищеварения и всасывания в кишечнике.
При рентгенологическом исследовании характерна развернутость («вздыбленность») кишечных петель, утолщение складок и сглаженность рельефа слизистой кишки, замедление или ускорение пассажа бариевой взвеси по кишечнику.
Биопсия слизистой оболочки тонкой и толстой кишок подтверждает диагноз и позволяет провести дифференциальную диагностику с энтеритами и колитами, особенно с неспецифическим язвенным колитом. Изолированный опухолевидный амилоидоз кишечника протекает под маской опухоли (боль, непроходимость кишечника) и обычно обнаруживается уже на операционном столе.
Осложнение: тяжелая гипопротеинемия вследствие нарушения процессов всасывания в кишечнике, полигиповитаминозы, стенозирование кишечника, амилоидные язвы, кишечные кровотечения, перфорации.
Амилоидоз печени встречается сравнительно часто.
Характерны увеличение и уплотнение печени, при пальпации край ее ровный, безболезнен. Нередок синдром портальной гипертензии, асцит. Реже встречаются боль в правом подреберье, диспепсические явления, спленомегалия, желтуха, геморрагический синдром.
Лабораторные исследования определяют изменение белково-осадочных проб, гиперглобулинемию, гиперхолестеринемию, в ряде случаев — гипербилирубинемию, повышение активности щелочной фосфатазы, аминотрансфераз сыворотки крови; положительная проба с бромсульфалеином.
Решающее значение в диагностике имеет пункционная биопсия печени. Осложнения: печеночная недостаточность (в 7% случаев).
Амилоидоз поджелудочной железы диагностируется редко (протекает под маской хронического панкреатита); характерны тупая боль в левом подреберье, диспепсические явления, панкреатогенные поносы, стеаторея.
Исследование дуоденального содержимого выявляет внешнесекреторную недостаточность поджелудочной железы.
В тяжелых случаях развивается вторичный сахарный диабет.
Поражения кожи имеют вид полупрозрачных восковидных папул или бляшек на лице, шее, в зонах естественных складок.
Описаны периорбитальные экхимозы («глаза енота»).
Зуд не характерен. Возможны кровоизлияния в бляшки.
В ряде случаев наблюдают плотные отеки на пальцах рук, напоминающие склеродермию.
Психические нарушения в виде деменции отмечают при локализованных формах амилоидоза (болезнь Альцгеймера).
Геморрагический синдром может развиться при AL-амилоидозе вследствие недостаточности фактора свертывания X, имеющего сродство к амилоидным фибриллам.
Диагностика.
Лабораторные исследования.
Анализ мочи. Протеинурия варьирует от микро- альбуминемии до массивной протеинурии, сопутствующей НС. Гематурия возникает редко, лейкоцитурия не бывает массивной и не связана с сопутствующей инфекцией («скудные изменения мочевого осадка»). Цилиндры гиалиновые, восковидные, реже зернистые; они не обладают метахромазией при окраске, но дают резко положительную ШИК-реакцию.
Вследствие массивной протеинурии возникает гипопротеинемия (за счет гипоальбуминемии).
Возможен лейкоцитоз, характерно повышение СОЭ.
Анемия сопутствует ХПН или связана с хроническим воспалительным процессом. Биопсия почек на ранних стадиях амилоидоза позволяет выявить в мезангии аморфные гиалиновые массы, а также утолщение базальной мембраны.
В дальнейшем находят диффузный внеклеточный эозинофильный материал, окрашивающийся конго красным со специфическим зеленым двойным лучепреломлением при исследовании в поляризованном микроскопе. При иммунофлюоресцентном исследовании имеет место слабое свечение Ig, поскольку амилоидные фибриллы (при AL-амилоидозе) содержат вариабельные участки легких цепей. При ЭМ обнаруживают характерные неветвящиеся амилоидные фибриллы диаметром 7,5—10 нм. Отложения амилоидных масс обнаруживают не только в клубочках, но и в интерстиции.
УЗИ. Размеры почек увеличены или соответствуют норме.
Функциональные пробы с конго красным или метиленовым синим (быстрое исчезновение красителей при внутривенном введении из сыворотки крови вследствие их фиксации амилоидом, а также значительное снижение выделения их почками) имеют историческое значение вследствие низкой информативности. Необходимо предполагать развитие амилоидоза при выявлении протеинурии у больных, относящихся к группе риска (с РА, миеломной болезнью, БЭБ, туберкулезом и лепрой).
При наследственно-семейных синдромах, проявляющихся периферической нейропатией, нефропатией, кардиомегалией, следует исключить амилоидоз. Лечение. Задачи: ограничение синтеза предшественника амилоида (колхицин); ингибирование синтеза амилоида и предотвращение отложения его в тканях; лизис тканевых амилоидных структур.
Лечение фонового заболевания (хронического воспаления, РА) необходимо.
При активном лечении РА цитостатиками (циклофосфамидом, хлорамбуцилом, азатиоприном, метотрексатом) амилоидоз возникает реже, а при уже развившемся амилоидозе наблюдают уменьшение выраженности его клинических проявлений — стабилизацию почечной функции и снижение протеинурии. Для лечения первичного амилоидоза и миеломной болезни применяют химиотерапию (например, комбинированную терапию мелфаланом и преднизолоном).
Однако ее недостаточная эффективность и высокая токсичность обусловливают поиск новых методов лечения.
Среди последних разработок в этом направлении — антрациклин и йододокеорубицин, связывающиеся с AL-амилоидом и способствующие его резорбции.
Колхицин. При средиземноморской семейной лихорадке применение колхицина на ранних стадиях задерживает развитие нефропатии, но он хуже влияет на уже сформировавшийся амилоидоз почек.
Изучают эффект колхицина при вторичном АА-амилоидозе почек.
На ранних стадиях АА-амилоидоза допустима попытка лечения аминохинолиновыми производными (хлорохин по 0,25—0,5 г/сут длительно), однако его эффективность в контролируемых исследованиях не доказана.
Для лечения амилоидоза предлагают использовать диметилсульфоксид перорально.
Начальная доза — 1% раствор диметилсульфоксида по 10 мл 3 раза в сут. При хорошей переносимости дозу постепенно повышают до 100—200 мл 3—5% раствора в сут.
Схемы лечения первичного амилоидоза.
— Циклическое пероральное применение мельфалана (0,15—0,25 мг/кг веса в сутки) и преднизолона (1,5—2,0 мг/кг в сутки) по четыре — семь дней каждые четыре — шесть недель в течение года, до достижения курсовой дозы 600 мг.
— Пероральное применение мельфалана в дозе 4 мг/сут в течение трех недель, затем, после двухнедельного перерыва — 2—4мг/сут четыре дня в неделю постоянно, до достижения курсовой дозы 600 мг, в комбинации с преднизолоном.
— Внутривенное введение высоких доз мельфолана (100—200 мг/м2 поверхности тела в течение двух дней) с последующей трансплантацией аутологичных стволовых клеток.
— Внутривенное введение дексаметазона в дозе 40 мг в течение четырех дней каждые три недели — восемь циклов.
— Внутривенное введение дексаметазона в дозе 40 мг в 1—4, 9—12-й и 17-20-й дни 35-дневного цикла, три — шесть циклов, с последующим применением ос-интерферона в дозе 3—6 млн единиц три раза в неделю.
— Схема винкристин-доксорибуцин-дексаметазон (VAD).
Развитие ХПН — показание к плановому диализу.
Предпочтителен перитонеальный диализ, так как он создает условия для выведения b2-микроглобулина.
Выживаемость больных с амилоидозом почек, находящихся на гемодиализе, ниже, чем у больных с другими причинами ХПН (годичная выживаемость 60%).
Трансплантацию почек проводят при АА-амилоидозе (при условии успешного лечения фонового заболевания) и AL-амилоидозе.
Однако показатели выживаемости ниже, чем при другой почечной патологии, что связано с серьезными внепочечнsми органными поражениями, главным образом сердечно-сосудистыми.
Рецидив амилоидоза в трансплантате происходит часто, но мало влияет на общий прогноз.
Путем трасплантации печени устраняют место синтеза предшественника амилоида — транстиретина.
Спленэктомию выполняют в целях купирования геморрагического синдрома (устранение селезенки, связывающей наибольшее количество фактора X).
«Чудеса» в последние годы связываются с применением стволовых клеток. Помечтаем вместе. Сотрудники Питсбургского института злокачественных опухолей предложили следующую методику.
Сначала в/в в течение 4 сут вводится препарат Neupogen, стимулирующий выход в периферический кровоток гемопоэтических стволовых клеток. Затем с помощью специального оборудования выделяют фракцию стволовых гемопоэтических клеток из крови.
После чего выделенные клетки замораживают в криокамере, чтобы их можно было хранить долгое время.
После приготовления «лекарства» больному проводится курс высокодозной химиотерапии в течение одного или двух дней, чтобы уничтожить белки, находящиеся в плазме крови.
После проведения курсов химиотерапии больному внутривенно вводятся его же стволовые клетки, которые были заморожены.
Прогноз.
Причина смерти — сердечная или почечная недостаточность.
После развития ХПН пациенты обычно живут менее года, после развития СН — около 4 мес.
При вторичном амилоидозе прогноз лучше, чем при AL-амилоидозе.
При любом типе заболевание протекает тяжелее у лиц пожилого возраста.
источник
Только самые актуальные официальные инструкции по применению лекарственных средств! Инструкции к лекарствам на нашем сайте публикуются в неизменном виде, в котором они и прилагаются к препаратам.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ РЕЦЕПТУРНОГО ОТПУСКА НАЗНАЧАЮТСЯ ПАЦИЕНТУ ТОЛЬКО ВРАЧОМ. ДАННАЯ ИНСТРУКЦИЯ ТОЛЬКО ДЛЯ МЕДИЦИНСКИХ РАБОТНИКОВ.
По современным представлениям, целью терапии любого типа амилоидоза служит уменьшение (или, если возможно, удаление) количества белков-предшественников для того, чтобы замедлить или приостановить прогрессирование болезни. Неблагоприятный прогноз при естественном течении амилоидоза оправдывает применение агрессивных методов лечения. Клиническое улучшение, достигаемое с помощью лечения, включает стабилизацию или восстановление функции жизненно важных органов, а также предотвращение функциональных нарушений, с увеличением продолжительности жизни больных.
Морфологическим критерием эффективности лечения считают уменьшение отложений амилоида в тканях, что в настоящее время можно оценить, применяя радиоизотопную сцинтиграфию с сывороточным амилоидным Р компонентом, меченным J131. Кроме основных антиамилоидных терапевтических режимов, лечение амилоидоза должно включать симптоматические методы, направленные на уменьшение выраженности застойной недостаточности кровообращения, аритмии, отёчного синдрома, коррекцию артериальной гипертензии и гипотензии.
Целью терапии вторичного амилоидоза служит подавление продукции белка-предшественника SAA, что достигают лечением хронического воспаления, в том числе и хирургическим путем (секвестрэктомия при остеомиелите, удаление доли лёгкого при бронхоэктатической болезни), опухоли, туберкулеза. Особое значение в настоящее время придают лечению ревматоидного артрита, учитывая его лидирующее положение среди причин вторичного амилоидоза.
Базисная терапия ревматоидного артрита цитостатическими лекарственными средствами – метотрексатом, циклофосфамидом, хлорамбуцилом, назначаемая на длительный срок (более 12 мес), способствует более редкому развитию амилоидоза. У пациентов с уже развившимся амилоидозом лечение цитостатиками позволяет в большинстве случаев уменьшить клинические проявления амилоидной нефропатии — снижение протеинурии, купирование нефротического синдрома, стабилизация функций почек. У части пациентов удаётся предотвратить развитие ХПН или замедлить её прогрессирование, что существенно улучшает прогноз. Об эффективности лечения цитостатиками свидетельствует также нормализация концентрации С-реактивного белка в крови. Средством выбора для лечения АА амилоидоза при периодической болезни служит колхицин. При его постоянном приёме можно полностью прекратить рецидивирование приступов у большинства больных и затормозить у них развитие амилоидоза. При развившемся амилоидозе длительный, возможно, пожизненный приём колхицина в дозе 1,8-2 мг/сут приводит к ремиссии, выражающейся в ликвидации нефротического синдрома, уменьшении или исчезновении протеинурии у больных с нормальной функцией почек. При наличии хронической почечной недостаточности (ХПН) начальную дозу лекарств уменьшают в зависимости от величины клубочковой фильтрации, хотя при снижении концентрации креатинина в крови возможно вновь повышение дозы до стандартной. Колхицин также предотвращает рецидив амилоидоза в трансплантированной почке.
Больные хорошо переносят данное лекарство. При развитии диспепсии (наиболее частом побочном эффекте колхицина) нет необходимости в отмене лекарственных средств, т.к. она, как правило, исчезает самостоятельно или при назначении ферментных препаратов.
Антиамилоидный эффект колхицина основан на его способности в эксперименте подавлять острофазовый синтез белка предшественника SAA, блокировать образование амилоидускоряющего фактора и тормозить образование фибрилл амилоида. Если эффективность колхицина при амилоидозе в рамках периодической болезни не вызывает сомнений, то результаты его применения у больных вторичным амилоидозом не однозначны. Кроме колхицина, при АА типе амилоидозе применяют диметилсульфоксид, вызывающий резорбцию амилоидных отложений. Необходимо его использование в высоких дозах (не менее 10 г/сут), что ограничено из-за крайне неприятного запаха, исходящего при его приёме. Современным препаратом, направленным на резорбцию амилоида является фибриллекс, его применение оправдано в качестве дополнения к основной терапии предрасполагающего заболевания или к лечению колхицином.
Основной стратегией лечения АА-амилоидоза является эффективная борьба с причиной воспаления. Лечение должно проводиться вне зависимости от клинической активности воспалительного заболевания до нормализации маркеров острой фазы воспаления – «С»-реактивного белка (предпочтительно применение высокочувствительной методики измерения – hsCRP) и/или SAA с последующим поддержанием уровня этих маркеров в нормальных пределах
У больных ревматоидным артритом и серонегативными полиартритами необходимо постоянное пожизненное лечение различными схемами базисной терапии. Отдают предпочтение современным ингибиторам фактора некроза опухоли α (ФНО-α), интерлейкина-1 или интерлейкина-6, анти-СD20-агентам. Для многолетнего приема удобно применение метотрексата в небольших дозах (7,5мг в неделю). Менее желательно, но не противопоказано также лечение глюкокортикоидами. После оценки эффективности и безопасности базисной терапии оправдано присоединение терапии колхицином 2мг/сут.
Препаратом выбора при периодической болезни и тяжелой рецидивирующей подагре является колхицин 2мг/сут. Начальная доза препарата 0,5мг/сут, затем постепенно дозу доводят до целевой под контролем клинического анализа крови и сывороточного уровня креатинина. Для предупреждения осмотической диареи, обусловленной колхицином, возможно временное назначение ферментных препаратов (мезим-форте, фестал) с отменой по мере адаптации к лечению колхицином. Дозу колхицина снижают до 1мг/сут у больных с продвинутой хронической болезнью почек (ХБП) 4-5 стадии.
При криопиринопатиях препаратами выбора являются ингибиторы интерлейкина 1 (ИЛ-1), при TRAPS – ингибиторы ФНО-α. В дальнейшем присоединяют колхицин.
При хронических нагноениях важное значение имеет по возможности хирургическое иссечение очагов, даже при отсутствии признаков активного воспаления в них. В дальнейшем или одновременно проводят лечение димексидом (5-10г/сут в разведении большим количеством соков – томатного, гранатового и др.). Препарат предпочтителен при легочных нагноениях.
При AL типе амилоидоза, как и при миеломной болезни, целью лечения служит подавление пролиферации клона плазматических клеток для уменьшения продукции легких цепей иммуноглобулинов. Этого достигают при назначении мелфалана в сочетании с преднизолоном, более эффективно сочетание мелфалана с дексаметазоном в большой дозе. Однако длительное (не менее 12 мес) лечение можно провести не всем больным, поскольку прогрессирование болезни может опережать достижение положительного эффекта мелфалана. Мелфалан обладает миелотоксическими свойствами, приводя к развитию острого лейкоза или миелодисплазии. В последние годы показал свою эффективность ингибитор протеасом бортезомиб (велкейд). Основное преимущество бортезомиба связано с возможностью достижения быстрой гематологической ремиссии. По мере достижения ремиссии у некоторых больных применяют химиотерапию высоких доз с поддержкой аутологичными стволовыми клетками.
Больным внутривенно вливают мелфалан в дозе 200 мг/м 2 поверхности тела с последующим введением аутологичных стволовых клеток (CD34+) крови.
Аутологичные стволовые клетки получают методом лейкафереза крови больного после предварительной их мобилизации из костного мозга под влиянием введенного извне гранулоцитарного колониестимулирующего фактора. При строгом подборе больных с исключением противопоказаний к этой терапии эффект получают у 60% больных. У больных с клиническими симптомами амилоидоза сердца, ортостатической гипотензией, диареей, наличием желудочно-кишечных кровотечений в анамнезе, а также лиц старше 70 лет с амилоидным поражением 2 и более систем организма проведение химиотерапии высоких доз не рекомендуется. Тяжелый агранулоцитоз и другие осложнения этой терапии существенно ограничивают ее применение. Проводят также лечение талидомидом или леналидомидом.
Несомненными признаками эффективности терапии через 12 мес являются уменьшение протеинурии на 50% без нарушения функций почек, нормализацию/стабилизацию концентрации креатинина в крови, повышенной до начала лечения, исчезновение симптомов недостаточности кровообращения, а также уменьшение на 50% уровня моноклонального иммуноглобулина в крови и моче.
Применение колхицина для лечения AL типа амилоидоза неэффективно.
Основной стратегией лечения АL-амилоидоза является элиминация амилоидогенного клона плазматических клеток костного мозга. После достижения гематологической ремиссии проводят противорецидивное лечение не менее 12 месяцев. В этот период при отсутствии противопоказаний возможна химиотерапия высоких доз с поддержкой аутологичными стволовыми клетками – метод, позволяютщий добиваться длительной ремиссии.
Полный гематологический ответ диагностируют на основании исчезновения моноклональных амилоидогенных иммуноглобулинов по данным иммунофиксации крови и суточной мочи, количественного определения свободных легких цепей иммуноглобулинов методом Freelite (нормальный уровень легких цепей каппа – менее 19,4мг/л, лямбда – менее 26,3мг/л, нормальное соотношение легких цепей в пределах 0,26-1,65). При снижении уровня свободных легких цепей на 50% от исходного диагностируют частичный ответ, критерием очень хорошего частичного ответа является разница между содержанием обеих легких цепей иммуноглобулинов менее 40мг/л.
Клинический эффект терапии в первую очередь оценивают по динамике кардиологических и ренальных показателей. Особо выделяют NT-proBNP-ответ (снижение этого маркера на 30% и более, или на 300нг/л и более у пациентов с исходным уровнем более 650нг/л). С клиническим эффектом лечения больше коррелирует почечный ответ (снижение протеинурии на 75% и более, повышение сывороточного креатинина не более 25% от исходного). Ответ со стороны других органов не обладает существенной прогностической информативностью.
Эффективность лечения амилоидоза печени оценивают по снижению уровня щелочной фосфатазы (50% и более) и уменьшению размеров печени (краниокаудальный размер по данным КТ должен уменьшиться на 30% в течение года после достижения гематологической ремиссии), эффективность лечения амилоидной полинейропатии выясняют, главным образом, по результатам клинического неврологического осмотра. Уменьшение амилоидных депозитов в мягких тканях может быть оценено по данным компьютерной томографии или магнитно-резонансной томографии. Эффективным методом общего содержания амилоида в тканях служит метод сцинтиграфии с радиоактивным амилоидным Р-компонентом.
Благодаря возможности получения быстрого гематологического ответа терапией первой линии, в особенности у больных с высоким риском быстрого прогрессирования, являются комбинированные схемы, содержащие бортезомиб, например трехкомпонентная схема терапии: бортезомиб 1,3мг/м2 в/вено или подкожно 1, 5, 8 и 11-й дни, мелфалан 0,15мг/кг с 1 по 4 дни внутрь, дексаметазон 20мг/сут 1, 5, 8 и 11-й дни внутрь. Для большей безопасности предпочтительно подкожное введение бортезомиба.
При планировании в дальнейшем химиотерапии высоких доз с поддержкой аутологичными стволовыми клетками мелфалан в составе схемы с бортезомибом заменяют на циклофосфан (400мг в/венно капельно в 1, 8, 12 дни), который не истощает пул стволовых клеток в костном мозге. Курсы бортезомиб содержащей терапии проводят каждые 4 недели, всего 8 курсов. Терапия сопровождения: омепразол, низкомолекулярные гепарины (для профилактики тромбозов при назначении больших доз дексаметазона), при наличии показаний – антибиотики, противогрибковые препараты, ацикловир
Не менее эффективна схема мелфалан (внутрь 0,15мг/кг с 1 по 4 дни) – дексаметазон (внутрь 20мг/сут с 1 по 4 дни, с 9-12 дни и с 17 по 21 дни) каждые 4-6 недель. Основным недостатком этой схемы является медленное формирование гематологического ответа, что делает эту схему менее перспективной у больных с высоким риском быстрого прогрессирования амилоидоза. Терапия сопровождения: омепразол, низкомолекулярные гепарины, при наличии показаний – антибиотики, противогрибковые препараты, ацикловир
У тяжелых больных с декомпенсированной сердечной недостаточностью может применяться схема мелфалан (внутрь 0,15мг/кг с 1 по 4 дни) – преднизолон (0,8мг/кг с 1 по 7 день с последующей постепенной отменой). Однако эффективность этой схемы ограничена
Симптоматическая терапия амилоидоза представляет существенные трудности. Назначение больших доз салуретиков лимитировано ортостатической гипотензией и нефротическим синдромом, в то же время наполнение объема циркулирующей крови может быть фактором декомпенсации сердечной недостаточности. Из-за возможности аккумуляции амилоидом токсической дозы с развитием парадоксальных реакций больным противопоказано назначение сердечных гликозидов, недигидропиридиновых (верапамил, дилтиазем) антагонистов кальциевых каналов, требует осторожности назначение бета-блокаторов и ингибиторов АПФ. У некоторых больных из-за высокого риска тахиаритмий показано установление искусственных кардиовертеров-дефибрилляторов. Для лечения ортостатической гипотензии рекомендуют подбор дозы минералокортикоидов или глюкокортикоидов для постоянного приема, однако это создает риск декомпенсации сердечной недостаточности. Для контроля кишечной моторики высокую эффективность показали пролонгированные препараты соматостатина (октреотид-лонг 20мг 1р в месяц)
Поскольку хроническая почечная недостаточность служит одной из основных причин смерти больных системным амилоидозом, проведение гемодиализа или постоянного амбулаторного перитонеального диализа позволяет улучшить прогноз этих пациентов. Выживаемость больных амилоидозом при проведении гемодиализа, независимо от его типа, сопоставима с выживаемостью больных другими системными заболеваниями и сахарным диабетом. При этом хорошую и удовлетворительную реабилитацию отмечают у 60% пациентов с АА и AL типами болезни. Поражение сердца и сосудов бывает основной причиной смерти больных амилоидозом при проведении гемодиализа. Постоянный амбулаторный перитонеальный диализ имеет некоторые преимущества перед гемодиализом поскольку нет необходимости в постоянном сосудистом доступе, меньше риск артериальной гипотензии во время процедуры диализа, а у больных AL типом амилоидоза во время процедуры возможно удаление легких цепей иммуноглобулинов. Трансплантация почки одинаково эффективна при обоих типах системного амилоидоза: 5-летняя выживаемость больных и трансплантата составляет 65 и 62% соответственно и сопоставима с таковыми показателями других групп больных с ХПН.
Трансплантация почки показана больным с медленным прогрессированием амилоидоза без поражения сердца и ЖКТ. Амилоидоз в трансплантированной почке возникает, по разным данным, примерно у 30% больных, однако он служит причиной потери трансплантата всего у 2-3% пациентов.
ИЛ-1 – интерлейкин 1
ЛС – лекарственное средство
ФНО-α – фактор некроза опухоли α
ХБП – хроническая болезнь почек
ХПН – хроническая почечная недостаточность
СD20 – основной иммунофенотипический маркер В-лимфоцитов
CD34 – основной иммунофенотипический маркер гемопоэтических родоначальных клеток
hsCRP – «С»-реактивный белок, определенный высокочувствительным методом
NT-proBNP – N-концевой пробелок мозгового натрийуретического фактора
TRAPS – аутовоспалительный периодический синдром, обусловленный наследственной аномалией рецептора к фактору некроза опухоли α
источник
По данным последних исследований амилоидозом страдает менее 1% населения Земли, при этом частота выявления отдельных форм заболевания неодинакова. Встречаемость вторичного амилоидоза в несколько раз превышает остальные формы. Наследственный (генетически обусловленный) амилоидоз преобладает в странах Средиземноморского бассейна, а также среди людей армянской и еврейской национальности.
Из клинических форм амилоидоза наиболее часто встречается нефропатическая (с преимущественным поражением почек) и генерализованная форма, при которой амилоид откладывается во всех органах и тканях. Мужчины болеют почти в 2 раза чаще женщин.
Интересные факты
- Химическая структура амилоида различна при разных формах патологии. Амилоидозом, по сути, называется группа заболеваний, схожих по механизму развития, клиническим и патологоанатомическим проявлениям.
- На сегодняшний день не существует методов лечения, позволяющих раз и навсегда избавиться от амилоидоза.
- Амилоидоз может развиваться на протяжении десятилетий, при этом никак себя не проявляя.
- Причины некоторых форм амилоидоза науке неизвестны.
Иммунная система человека представляет собой комплекс органов и клеток (лейкоцитов), участвующих в защите организма от воздействия чужеродных микроорганизмов (бактерий, вирусов, грибов и других) и собственных клеток, представляющих опасность для человека (например, опухолевых клеток или «старых» клеток крови).
Основными органами иммунной системы являются:
- Красный костный мозг. Особый тип ткани, располагающийся в полостях костей (таза, тел позвонков, грудины и других) и участвующий в образовании всех клеток крови.
- Тимус (вилочковая железа). Данный орган располагается в грудной клетке. В нем происходит размножение и дифференцировка («обучение») некоторых клеток иммунной системы (Т-лимфоцитов).
- Лимфатические узлы. Данные образования располагаются по ходу кровеносных сосудов во всех органах и тканях. Они содержат большое количество иммунных клеток (лимфоцитов) и представляют собой барьер, предотвращающий распространение чужеродных бактерий и вирусов из очага инфекции по всему организму.
- Селезенка. В селезенке происходят процессы дифференцировки лимфоцитов, а также разрушаются фрагменты чужеродных микроорганизмов и старых или поврежденных клеток крови.
- Пейеровы бляшки. Данным термином обозначаются небольшие (диаметром несколько миллиметров) скопления лимфоидной ткани, располагающиеся в стенках кишечника.
Основными клетками иммунной системы являются:
- лимфоциты;
- моноциты;
- базофилы;
- нейтрофилы;
- эозинофилы.
Лимфоциты
Данные клетки не только принимают непосредственное участие в защите организма, но и регулируют деятельность всей иммунной системы.
По функциональным признакам различают:
- В-лимфоциты. Любой чужеродный микроорганизм имеет на своей поверхности различные структурные компоненты, называемые антигенами. При контакте с «чужим» антигеном В-лимфоциты превращаются в так называемые плазмоциты, которые начинают вырабатывать специфические антитела (иммуноглобулины класса A, G, M, D и E). Иммуноглобулин представляет собой гликопротеид (белково-сахаридный комплекс), состоящий из белка и связанных с ним сахаридов (глюкозы, фруктозы и других). Данные антитела взаимодействуют только с тем антигеном, против которого они были выработаны, вызывая его уничтожение и гибель клетки, на которой он расположен.
- Т-лимфоциты. Способны обнаруживать и уничтожать клетки, пораженные вирусами, а также опухолевые клетки (данную функцию выполняют так называемые Т-киллеры). Другие разновидности Т-лимфоцитов участвуют в регуляции иммунного ответа организма. Одни из них (Т-хелперы) усиливают активность В-лимфоцитов, стимулируя образование большего количества антител, в то время как другие (Т-супрессоры) оказывают угнетающее влияние на активность всех остальных лимфоцитов.
- NK-клетки. Обеспечивают противоопухолевую и противовирусную защиту организма.
Моноциты
Моноцитами называются крупные клетки иммунной системы, которые циркулируют в крови в течение 2 – 3 дней, после чего переходят в ткани организма, превращаясь в так называемые гистиоциты. Гистиоциты поглощают и разрушают попавшие в ткань чужеродные антигены, а также собственные поврежденные лейкоциты.
Базофилы, нейтрофилы и эозинофилы
Являясь разновидностями лейкоцитов, данные клетки также участвуют в защите организма от чужеродных бактерий, внутриклеточных и внеклеточных паразитов и опухолевых клеток.
Макрофагами называются особые крупные клетки, которые образуются в процессе эмбрионального развития во всех тканях человеческого организма, а также поступают в ткани из крови в течение жизни человека. Данные клетки обладают способностью поглощать (фагоцитировать) и разрушать чужеродные микроорганизмы, фрагменты погибших клеток и других микрочастиц, попавших в ткань.
Основными макрофагами человеческого организма являются:
- моноциты крови;
- гистиоциты;
- макрофаги печени (Купферовские клетки);
- легочные макрофаги;
- эндотелиальные клетки (эндотелий – внутренняя поверхность сосудов) селезенки, лимфатических узлов, костного мозга.
При попадании инфекции в организм происходит активация клеток системы макрофагов и их усиленное размножение, в результате чего обеспечивается защита органов и тканей от повреждающего действия чужеродных микроорганизмов и их токсинов.
Как говорилось ранее, термином «амилоидоз» объединяется группа схожих заболеваний, общим для которых является накопление амилоида в тканях организма. Амилоид представляет собой сложный комплекс, который на 95% состоит из специфического фибриллярного белка и на 5% из нуклеопротеидов (белково-сахаридных комплексов) крови и тканей. Фибриллярный белок в норме в организме не встречается и образуется только при развитии амилоидоза.
Образование амилоида характеризуется:
- Образованием амилоидобластов. Первый этап развития амилоидоза характеризуется мутационными изменениями, происходящими в различных клетках иммунной системы. Клетки системы макрофагов, моноциты, лимфоциты и некоторые другие мутируют, превращаясь в качественно новый тип клеток – амилоидобласты. По мере прогрессирования заболевания количество амилоидобластов увеличивается, и они заселяют различные органы (селезенку, печень, костный мозг, лимфатические узлы и другие).
- Синтезом фибриллярного белка. Внутри амилоидобластов образуется фибриллярный белок, представляющий собой тонкие и длинные структуры (нити), которые впоследствии объединяются, формируя так называемый каркас амилоида. Фибриллярный белок является чужеродным для организма, поэтому в ответ на его появление запускаются характерные защитные реакции. Вокруг амилоидобластов появляются другие клетки, которые поглощают и разрушают выделяющийся из амилоидобластов фибриллярный белок, препятствуя его поступлению в ткани организма. Данный процесс может длиться неопределенно долгий промежуток времени (так называемая латентная, скрытая стадия заболевания), однако в конечном итоге всегда развивается иммунологическая толерантность (то есть организм «привыкает» к новому белку и перестает «защищаться» от него), в результате чего большое количество фибриллярного белка поступает в ткани.
- Отложением амилоида в тканях. Образование амилоида происходит в межклеточном пространстве в результате соединения фибриллярного белка с различными белками и нуклеопротеидами крови и тканей. Связь, образующаяся между данными веществами, настолько прочная, что разрушить ее практически невозможно, в результате чего образующийся амилоид накапливается в тканях, постепенно вытесняя нормальные клетки органа.
При некоторых формах амилоидоза в амилоидобласты могут превращаться и клетки других органов, что будет обуславливать клинические проявления заболевания.
В амилоидобласты могут превращаться:
- Кардиомиоциты (мышечные клетки сердца) – при амилоидозе сердца.
- Кератиноциты – при амилоидозе кожи.
- Гладкие мышечные клетки – при амилоидозе крупных кровеносных сосудов.
- В-клетки поджелудочной железы (продуцирующие инсулин) – при инсулярном амилоидозе.
- С-клетки щитовидной железы (секретирующий гормон кальцитонин).
- КлеткиAPUD-системы – представляют собой рассеянные по всему организму клетки, продуцирующие различные типы гормонов.
Стоит отметить, что описанный механизм характерен для большинства, но не для всех видов амилоидоза. В некоторых случаях образование амилоида происходит по другим механизмам, которые на сегодняшний день окончательно не изучены.
Амилоид, образующийся при различных видах заболевания, структурно неодинаков. В зависимости от состава и строения выделяют несколько типов амилоида (более 15), механизмы образования которых также различны.
Двумя основными типами амилоида являются:
- АА-амилоид. При развитии любого воспалительного процесса запускается целый ряд биохимических реакций, в том числе происходит синтез и выделение в кровоток так называемых белков острой фазы воспаления, одним из которых является сывороточный белок амилоида А (SAA). В норме он циркулирует в крови непродолжительное время и потом разрушается. При хронических воспалительных заболеваниях концентрация белка SAA в плазме поддерживается на высоком уровне в течение длительного времени. В результате его неполного расщепления и образуется фибриллярный компонент АА-амилоида.
- AL-амилоид. Фибриллярные белки AL-типа выделяются из амилоидобластов (мутировавших плазмоцитов) и представляют собой аномальные цепи иммуноглобулинов.
Другие типы амилоида (AF, AH, AE и так далее) образуются при конкретных формах амилоидоза.

В зависимости от причины развития различают:
- первичный (идиопатический) амилоидоз;
- вторичный (реактивный) амилоидоз;
- наследственный амилоидоз;
- старческий амилоидоз;
- амилоидоз при опухолях;
- амилоидоз у пациентов на гемодиализе.
Данная форма заболевания характеризуется отложением амилоида во многих органах и тканях, причем причину его образования установить, как правило, не удается. В абсолютном большинстве случаев при первичном амилоидозе отмечается мутационное перерождение клеток иммунной системы и образование AL-амилоида, который накапливается в тканях мезодермального происхождения (в сердечно-сосудистой системе, мышцах, нервах и коже).
Другой причиной образования AL-амилоида может быть миеломная болезнь (плазмоцитома) – опухолевое заболевание, характеризующееся злокачественным перерождением и размножением плазмоцитов (дифференцированных В-лимфоцитов). Они выделяют аномальные глобулины в больших количествах, которые связываются с нуклеопротеидами плазмы и превращаются в амилоид.
Вторичный амилоидоз характеризуется образованием АА-амилоида и развивается в результате длительно прогрессирующих воспалительных процессов, то есть всегда является осложнением других заболеваний.
Причиной вторичного амилоидоза могут быть:
- Хронические инфекции –малярия, лепра (проказа), сифилис, туберкулез и хронические неспецифические воспалительные заболевания легких, бронхоэктатическая болезнь, хронический пиелонефрит (инфекционное воспаление почечной ткани).
- Хронические гнойные заболевания –остеомиелит (гнойное разрушение кости), длительное нагноение ран.
- Неспецифический язвенный колит – воспалительное заболевание толстого кишечника.
- Опухоли –лимфогранулематоз, лейкозы и другие опухоли системы крови.
- Ревматологические заболевания –ревматоидный артрит, анкилозирующий спондилоартрит и другие.
Вторичный амилоидоз может поражать практически любые органы и ткани в организме человека. Клиническая картина начинает проявляться через несколько лет (иногда через десятилетия) после начала основного заболевания и характеризуется нарушением функции того органа, в котором отложение амилоида наиболее выражено (обычно это почки и надпочечники, печень, селезенка, лимфатические узлы). По мере прогрессирования заболевания поражаются остальные органы, развивается полиорганная недостаточность и наступает смерть.
Генетический аппарат человека состоит из 23 пар хромосом, каждая из которых содержит огромное количество генов. Каждый ген, в свою очередь, кодирует образование определенных белков в клетке, что в конечном итоге определяет ее строение и функции. Наследственные формы амилоидоза характеризуются наличием генетических мутаций в клетках иммунной системы, которые передаются из поколения в поколение и приводят к образованию амилоидобластов. Данная форма заболевания диагностируется у людей определенных этнических групп либо проживающих в определенной местности.
К наследственному амилоидозу относится:
- Периодическая болезнь (семейная средиземноморская лихорадка). Данное заболевание встречается преимущественно у арабов, армян и евреев. Клинически данная форма амилоидоза характеризуется приступами лихорадки (повышением температуры выше 39ºС, проливным потом, головными и мышечными болями), сопровождающимися воспалением серозных оболочек организма – брюшины (оболочки органов брюшной полости), плевры (оболочки легких) и синовиальных оболочек (выстилающих внутренние поверхности суставов). Часто отмечаются психические отклонения.
- Семейный нефропатический амилоидоз (английский амилоидоз, болезнь Макла и Уэллса). Характеризуется приступами лихорадки, крапивницей и нарушением слуха (вплоть до глухоты).
- Наследственный нейропатический амилоидоз. Для данной формы заболевания характерно поражение нервной ткани различной локализации. Могут поражаться нервы ног (португальский амилоидоз) или рук (американский амилоидоз), а также встречается сочетанное поражение нервной системы, почек и роговицы глаза (финский амилоидоз).
- Наследственный кардиопатический амилоидоз. Встречается преимущественно у жителей Дании и по клиническим проявлениям схож с первичным генерализованным амилоидозом.
У многих людей в возрасте старше 80 лет происходит отложение амилоида в различных тканях и органах. Данный процесс обычно носит локальный характер и связан с другими старческими заболеваниями.
К старческому амилоидозу относится:
- Старческий церебральный (мозговой) амилоидоз. Встречается при болезни Альцгеймера и характеризуется отложением амилоида типа Ab в ткани головного мозга.
- Старческий сердечный амилоидоз. Характеризуется поражением сердечной мышцы, причем при разных формах данного заболевания образуются разные типы амилоида. Так, в состав амилоида может входить мутантная форма транстиретина (белка крови, в норме транспортирующего гормон щитовидной железы тироксин и витамин А в организме), что характеризуется преимущественным поражением желудочков сердца. В другом случае амилоид может образовываться из предсердного натрийуретического пептида (гормона, выделяющегося клетками сердца), что характеризуется отложением амилоида преимущественно в области предсердий. В обоих случаях депозиты амилоида обнаруживаются и в тканях других органов (селезенки, легких, поджелудочной железы).
При некоторых опухолях наблюдается злокачественное перерождение клеток пораженного органа, в результате чего они начинают секретировать фибриллярный белок. Амилоидоз в данном случае носит локальный характер и характеризуется отложением амилоида в ткани органа, в котором развивается злокачественный процесс.
Причиной амилоидоза может быть:
- Медуллярный рак щитовидной железы. В данном случае опухоль развивается из С-клеток щитовидной железы, которые в норме продуцируют гормон кальцитонин (регулирующий обмен кальция в организме). Образующийся при этом амилоид (AE-типа) состоит из фрагментов кальцитонина, синтез которого нарушен.
- Опухоль островков поджелудочной железы. Данные островки представляют собой скопление клеток, продуцирующих различные гормоны (инсулин, глюкагон, соматостатин и другие). При их злокачественном перерождении в окружающие ткани может выделяться фибриллярный белок, который впоследствии превращается в амилоид.
Гемодиализ («искусственная почка») – процесс искусственного очищения крови человека от побочных продуктов обмена веществ, которые в норме выделяются через почки. Данная процедура назначается пациентам, страдающим острой или хронической почечной недостаточностью и заключается в пропускании крови через аппарат, содержащий особый раствор, отделенный от крови полупроницаемой мембраной. В результате этого различные вредные вещества и лишняя жидкость удаляются, а клетки крови и крупные белки возвращаются обратно в организм.
Структурной основой амилоида при длительном гемодиализе является В2-микроглобулин (в норме удаляющийся исключительно почками), который не фильтруется через мембрану диализатора и поэтому не выводится из организма. При хронической почечной недостаточности, когда пациенты находятся на гемодиализе в течение нескольких месяцев или лет, концентрация данного белка в крови повышается в несколько раз. Он связывается с нуклеопротеидами плазмы и выпадает в осадок в тканях различных органов (в том числе в почках, что усугубляет почечную недостаточность).
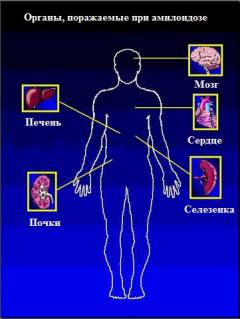
Амилоидоз может проявляться:
- поражением почек;
- поражением печени;
- поражением сердца;
- надпочечниковой недостаточностью;
- увеличением селезенки (спленомегалией);
- поражением желудочно-кишечного тракта (ЖКТ);
- поражением нервной системы;
- поражением кожи;
- поражением суставов;
- поражением мышц.
Поражение почек является наиболее частым и в то же время наиболее опасным проявлением амилоидоза.
В клинической картине амилоидоза почек выделяют 4 стадии:
- латентную (скрытую);
- протеинурическую;
- нефротическую;
- азотемическую.
Латентная стадия
В латентной стадии заболевание практически никак не проявляется. При вторичных формах на первый план выступают симптомы основной патологии, а симптомы поражения почек появляются спустя несколько лет или десятилетий, однако описаны случаи более быстрого развития амилоидоза (через 3 – 4 месяца).
Протеинурическая стадия
Может длиться 10 и более лет и характеризуется отложением депозитов амилоида в почечной ткани – в мелких сосудах, в клубочках (в которых происходит ультрафильтрация крови), в межклеточном пространстве. Все это приводит к сдавливанию, атрофии (уменьшению в размерах) и гибели нефронов (функциональных единиц почечной ткани, обеспечивающих образование мочи). При этом нарушается целостность почечного фильтра (который в норме непроницаем для клеток крови и крупномолекулярных белков), в результате чего с мочой начинают выделяться белки (протеины). Выделительная функция почек на данном этапе нарушена незначительно, поэтому заподозрить амилоидоз можно только на основании лабораторных данных.
Нефротическая стадия
Дальнейшее нарушение целостности почечного фильтра приводит к развитию нефротического синдрома, характеризующегося потерей большого количества белка с мочой (более 3 г/л) и снижением концентрации белков в крови. Так как белки участвуют в поддержании коллоидно-осмотического давления (то есть удерживают жидкую часть крови в сосудистом русле), снижение их концентрации приводит к переходу жидкости в ткани организма, в результате чего развиваются генерализованные отеки, являющиеся основным проявлением амилоидоза на данном этапе.
Отеки появляются независимо от положения тела и времени суток. Они начинают появляться в области лица, век, половых органов, в поясничной области. По мере прогрессирования заболевания отеки усиливаются и могут достигать крайней степени выраженности (анасарки). Отмечается скопление жидкости в полостях организма – асцит (в брюшной полости), гидроторакс (в плевральной полости), гидроперикард (в полости сердечной сумки). Кожа становится бледной, отмечается повышенная ломкость ногтей и волос. Возможно выделение крови с мочой.
Продолжительность данной стадии обычно не превышает 4 – 6 лет, после чего (в отсутствии лечения) развивается азотемическая стадия.
Азотемическая стадия
Количество функциональной почечной ткани на данном этапе амилоидоза составляет менее 25%. Этого недостаточно, чтобы выводить из организма побочные продукты обмена веществ (мочевину, мочевую кислоту и другие), в результате чего их концентрация в крови начинает повышаться.
Клинически почечная недостаточность проявляется:
- Нарушением мочеобразования – человек может выделять менее 50 мл мочи в сутки (при норме не менее 800 мл).
- Нарушением общего самочувствия –слабостью, повышенной утомляемостью.
- Нарушением системы пищеварения –отсутствием аппетита, частой тошнотой и рвотой, сухостью во рту, неприятным запахом изо рта и так далее.
- Поражением кожных покровов – больные жалуются на кожный зуд, кожа бледная и сухая, со следами расчесов (из-за зуда).
- Поражением сердечно-сосудистой системы – может отмечаться повышение артериального давления, аритмии (нарушение частоты сердечных сокращений), гипертрофия (увеличение в размерах) сердечной мышцы.
- Повреждением мозга – развивается в результате воздействия высоких концентраций мочевины и мочевой кислоты на нервную ткань мозга и проявляется раздражительностью, бессонницей, нарушением памяти, психики и умственных способностей.
- Анемией (уменьшением концентрации гемоглобина и эритроцитов в крови) – развивается из-за недостатка эритропоэтина – вещества, синтезируемого почками и активирующего образование красных клеток крови в костном мозге.
Поражение печени также является частым симптомом генерализованных форм амилоидоза. Отложения амилоида сдавливают печеночные клетки, желчевыводящие протоки и кровеносные сосуды органа, в результате чего нарушаются его функции.
При отложении депозитов амилоида в печеночной ткани отмечается увеличение размеров органа, определяемое при пальпации (прощупывании) живота. Поверхность печени гладкая, нижний край ровный, болезненность не определяется. Стоит отметить, что даже при длительном прогрессировании амилоидоза выраженная почечная недостаточность развивается редко, что, вероятнее всего, связано высокими регенераторными (восстановительными) способностями данного органа.
Амилоидное поражение печени может проявляться:
- Увеличением печени. При пальпации живота определяется увеличенная, плотная, однако безболезненная печень. Поверхность ровная и гладкая.
- Портальной гипертензией. Кровь от большинства внутренних органов (от желудка, кишечника, селезенки и других) собирается в так называемую воротную (портальную) вену и поступает в печень (где происходит ее детоксикация). Только после этого она возвращается в системный кровоток. Сдавливание кровеносных сосудов печени отложениями амилоида приводит к повышению давления в системе воротной вены и расширению вен внутренних органов (с возможным их разрывом). Это может проявляться кровотечениями в желудочно-кишечном тракте, поносом и рвотой с кровью, отеками на ногах и асцитом.
- Желтухой. Крайне редкое проявление амилоидного поражения печени. Развивается при нарушении желчеобразующей функции органа либо в результате нарушения оттока желчи по желчевыводящим путям (сдавливаемым извне отложениями амилоида). В этом случае пигмент желтого цвета билирубин (являющийся продуктом распада клеток крови эритроцитов, который в норме удаляется из организма печенью) задерживается в крови, придавая кожным покровам и слизистым оболочкам желтоватый оттенок. Если желтуха обусловлена нарушением оттока желчи, она будет сопровождаться сильным кожным зудом.
Поражение сердечной мышцы чаще отмечается при первичном и некоторых формах наследственного амилоидоза. Отложение амилоида происходит не только в миокарде (непосредственно сердечной мышце), но и в оболочках сердца – в перикардиальной сумке и эндокарде. Результатом этого является сдавливание кровеносных сосудов и нарушение кровообращения органа, что обуславливает гибель мышечных клеток.
Клинически амилоидоз сердца может проявляться:
- аритмиями;
- рестриктивной кардиомиопатией;
- сердечной недостаточностью.
Аритмии
Проводящая система сердца представляет собой особую группу мышечных клеток, которые обеспечивают последовательное проведение нервного импульса по сердечной мышце, в результате чего происходит синхронное сокращение предсердий и желудочков. В случае отложения амилоида в данной области проведение нервного импульса нарушается, в результате чего камеры сердца начинают сокращаться разобщено, то есть развивается аритмия. Клинически это может проявляться потемнением перед глазами, частыми головокружениями и обмороками, что обусловлено нарушением кровоснабжения головного мозга и может привести к смерти больного.
Рестриктивная кардиомиопатия
В результате отложения амилоида миокард уплотняется и становится менее растяжимым. Во время диастолы (расслабления сердечной мышцы) камеры сердца не могут расшириться в достаточной степени и вместить необходимый объем крови, что приводит к уменьшению ударного объема (количества крови, выбрасываемой сердцем во время сокращения).
Клинически данное состояние проявляется повышенной утомляемостью, одышкой (развивающейся из-за скопления крови в легочных сосудах) и отеками ног (возникающими из-за скопления крови в венах нижних конечностей), асцитом и гидротораксом (в результате повышения давления в сосудах кровь пропотевает в полости организма). Частым симптомом является ортостатическая гипотензия, то есть снижение артериального давления при резком переходе из горизонтального положения в вертикальное, что обусловлено снижением приспособительных реакций сердечной мышцы.
По мере прогрессирования заболевания наполнение сердца еще больше снижается, что в конечном итоге приводит к развитию сердечной недостаточности.
Сердечная недостаточность
Характеризуется неспособностью сердца обеспечивать циркуляцию крови в организме, что клинически проявляется более выраженными отеками (преимущественно в нижней части тела, усиливающимися к вечеру), одышкой и другими симптомами. Характерной особенностью сердечной недостаточности при амилоидозе является неэффективность стандартного лечения, быстрое прогрессирование заболевания и смерть пациента в течение нескольких месяцев.
Надпочечники представляют собой небольшие железы, располагающиеся у верхнего края каждой почки и выделяющие гормоны. В надпочечниках выделяют корковое и мозговое вещество, каждое из которых вырабатывает определенные гормоны.
При амилоидозе депозиты амилоида откладываются по ходу сосудов исключительно в корковом веществе, в результате чего развивается хроническая надпочечниковая недостаточность, характеризующаяся уменьшением или полным прекращением синтеза всех гормонов данной области.
| Гормоны коркового вещества надпочечников | Функция в организме | Нарушения, возникающие при недостаточности данного гормона |
| Альдостерон |
|
|
| Кортизол | Регулирует обмен веществ в организме во время стрессовых ситуаций, а именно:
| При недостатке кортизола нарушаются адаптационные (приспособительные) функции организма, в результате чего человек чаще болеет и тяжелее переносит различные заболевания, инфекции, травмы и так далее. |
| Андрогены (мужские половые гормоны) | Влияют на развитие вторичных половых признаков (роста бороды и усов, низкого тембра голоса и других) у мальчиков в подростковом возрасте. |
|
Отложение амилоида в селезенке приводит к увеличению органа в размерах, в результате чего он может быть пропальпирован (в норме при пальпации селезенка не определяется). При пальпации амилоидная селезенка плотная, поверхность гладкая и ровная, болезненность не определяется.
Как говорилось ранее, селезенка участвует в удалении «старых» и деформированных клеток крови из кровотока. Это происходит благодаря наличию в структуре органа так называемых синусоидов, представляющих собой тонкие щелевидные пространства. Нормальные клетки крови пластичны и с легкостью проходят через них, в то время как старые и поврежденные застревают и разрушаются. Отложение амилоида в селезенке приводит к развитию гиперспленизма, то есть в увеличенной селезенке начинают задерживаться и разрушаться нормальные, неповрежденные клетки крови – эритроциты (транспортирующие дыхательные газы), тромбоциты (отвечающие за остановку кровотечений) и лейкоциты.
Гиперспленизм характеризуется:
- Анемией – проявляется общей слабостью, бледностью кожных покровов и слизистых оболочек, иногда одышкой (чувством нехватки воздуха).
- Тромбоцитопенией – уменьшением концентрации тромбоцитов, что может проявляться кожными кровоизлияниями, кровотечениями из носа, кровоточивостью десен и так далее.
- Лейкопенией – уменьшением общего количества лейкоцитов, что проявляется частыми инфекциями, тяжело поддающимися лечению.
При генерализованных формах амилоидоза поражение кишечника носит распространенных характер, в результате чего нарушается всасывание многих питательных веществ, витаминов и минералов.
Нарушение всасывания в кишечнике может проявляться:
- частым поносом;
- снижением веса (вплоть до кахексии – крайней степени истощения, представляющей непосредственную опасность для жизни);
- общей и мышечной слабостью;
- повышенной утомляемостью;
- умственными и психическими расстройствами;
- анемией (в результате нарушения всасывания железа, витамина B12 и фолиевой кислоты);
- ломкостью и выпадением волос;
- отеками (из-за снижения количества белков в крови).
В случае локальных форм амилоидоза отложения амилоида могут скапливаться в одном месте, имитируя опухоль. Увеличиваясь в размерах, они сдавливают петли кишечника и нарушают проходимость пищи по ним, в результате чего на первый план будут выступать симптомы кишечной непроходимости – запоры, вздутие и боли в животе, рвота каловыми массами (в тяжелых случаях).
В результате отложения амилоида в суставах происходит их воспаление, причем вначале поражаются более мелкие суставы (кистей и стоп), а по мере прогрессирования заболевания вовлекаются и более крупные (коленные, локтевые).
Поражение суставов при амилоидозе характеризуется:
- Болезненностью, усиливающейся при движениях.
- Покраснением кожи над поверхностью пораженных суставов, появляющейся из-за расширения сосудов в очаге воспаления.
- Отеком тканей, который развивается в результате пропотевания жидкости через стенки расширенных сосудов.
- Повышением температуры кожи в области воспаленных суставов.
- Нарушением функции пораженного сустава.
Отложение депозитов амилоида происходит в межмышечной соединительной ткани, в результате чего функция мышц длительное время не страдает (так как структура мышечных клеток не нарушается). При прогрессировании заболевания происходит сдавливание мышечных клеток, нарушение их кровоснабжения и гибель.
Амилоидное поражение мышц проявляется:
- болями в мышцах;
- мышечной слабостью;
- гипертрофией мышц (увеличением в размерах);
- появлением плотных узелков на поверхности мышц;
- уплотнением мышц («каменистой» плотностью).
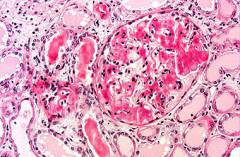
В диагностике амилоидоза применяется:
- общий анализ крови;
- общий анализ мочи;
- биохимический анализ крови;
- ультразвуковое исследование внутренних органов;
- генетическое исследование;
- биопсия.
| Показатель | Что обозначает | Норма | Возможные изменения при амилоидозе |
| Концентрация эритроцитов (RBC) | Эритроциты – красные клетки крови, которые транспортируют дыхательные газы (кислород и углекислый газ) в организме. | Мужчины(М): 4,0 – 5,0 х 10 12 /л. | Уменьшение концентрации эритроцитов отмечается на поздних стадиях амилоидоза и обычно являться признаком:
|
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | |||
| Общий уровень гемоглобина (HGB) | Гемоглобин – содержащий железо дыхательный пигмент, который непосредственно участвует в транспортировке дыхательных газов. | М: 130 – 170 г/л. | Снижение уровня гемоглобина происходит по тем же причинам, что и снижение концентрации эритроцитов. |
| Ж: 120 – 150 г/л. | |||
| Концентрация лейкоцитов (WBC) | Основной функцией лейкоцитов является защита организма от инфекций. | 4,0 – 9,0 х 10 9 /л. |
|
| Концентрация тромбоцитов (PLT) | Тромбоциты обеспечивают остановку кровотечений из мелких сосудов, а также предотвращают выход крови из сосудистого русла. | 180 – 320 х 10 9 /л. | При развитии гиперспленизма концентрация тромбоцитов резко снижается. |
| Концентрация ретикулоцитов (RET) | Ретикулоциты представляют собой молодые формы эритроцитов, которые образуются в костном мозге, после чего выделяются в системный кровоток, где и превращаются в зрелые эритроциты. | М: 0,24 – 1,7%. | Причиной снижения концентрации ретикулоцитов может быть:
Причиной компенсаторного повышения концентрации ретикулоцитов может быть:
|
| Ж: 0,12 – 2,05%. | |||
| Гематокрит (Hct) | Гематокрит – процентное соотношение между клеточными элементами крови и объемом плазмы. | М: 42 – 50%. | Так как основная масса клеточных элементов крови представлена эритроцитами, снижение их концентрации приведет к снижению гематокрита. |
| Ж: 38 – 47%. | |||
| Скорость оседания эритроцитов (СОЭ) | На поверхности клеток крови имеются определенные отрицательные заряды, вследствие чего они отталкиваются друг от друга и находятся во взвешенном состоянии. Если поместить кровь в пробирку, тот через некоторое время более тяжелые эритроциты осядут на ее дно. Время, за которое это произойдет и будет скоростью оседания эритроцитов. | М: 3 – 10 мм/час. | СОЭ может увеличиваться при развитии анемии, а также при наличии в крови белков острой фазы воспаления, что является признаком системного воспалительного процесса и может указывать на вторичную природу амилоидоза. |
| Ж: 5 – 15 мм/час. |
Изменения в общем анализе мочи могут наблюдаться при почечном амилоидозе, а также при хронических воспалительных заболеваниях почек.
На поражение почек может указывать:
- Протеинурия (появление белка в моче). Является первым и наиболее значимым проявлением поражения почек при амилоидозе. В норме концентрация белка в моче не превышает 0,033 г/л, однако при нарушении целостности почечного фильтра клетки крови и крупномолекулярные белки начинают выделяться с мочой. Протеинурия более 3 г/л свидетельствует о выраженном нефротическом синдроме и тяжелом поражении почечной ткани.
- Гематурия (появление эритроцитов в моче). В норме при микроскопическом исследовании мочи допускается не более 1 – 3 эритроцитов в поле зрения. Кровь в моче может указывать на развитие нефротического синдрома либо являться признаком воспалительного поражения почечной ткани (гломерулонефрита).
- Лейкоцитурия (появление лейкоцитов в моче). При микроскопическом исследовании мочи допускается наличие 3 – 5 лейкоцитов в поле зрения. Лейкоцитурия редко наблюдается при почечном амилоидозе и чаще свидетельствует о наличии инфекционно-воспалительного заболевания почек или других органов мочеполовой системы.
- Цилиндрурия (наличие цилиндров в моче). Цилиндры представляют собой слепки, которые образуются в почечных канальцах и имеют различную структуру. При амилоидозе они обычно образуются из слущенных клеток почечного эпителия и белков (гиалиновые цилиндры), однако могут также содержать эритроциты и лейкоциты.
- Снижение плотности мочи. Нормальная плотность мочи колеблется в пределах от 1,010 до 1,022, однако при разрушении почечных нефронов концентрационная способность органа заметно снижается, в результате чего плотность мочи будет уменьшаться.
Данное исследование позволяет не только оценить функциональное состояние внутренних органов, но и заподозрить причину амилоидоза.
Диагностическую ценность при амилоидозе представляют:
- белки общей фазы воспаления;
- печеночные пробы;
- уровень холестерина;
- уровень белков в крови;
- уровень креатинина и мочевины.
Белки общей фазы воспаления
Данные белки вырабатываются печенью и некоторыми лейкоцитами в ответ на развитие воспалительного процесса в организме. Главной их функцией является поддержание воспаления, а также предупреждение повреждения здоровых тканей.
| Белок | Нормальные значения |
| Сывороточный белок амилоида А (SAA) | Менее 0,4 мг/л. |
| Альфа-2-глобулин | М: 1,5 – 3,5 г/л. |
| Ж: 1,75 – 4,2 г/л. | |
| Альфа-1-антитрипсин | 0,9 – 2 г/л. |
| С-реактивный белок | Не более 5 мг/л. |
| Фибриноген | 2 – 4 г/л. |
| Лактоферрин | 150 – 250 нг/мл. |
| Церулоплазмин | 0,15 – 0,6 г/л. |
Следует отметить, что прогрессирующее повышение концентрации фибриногена в крови часто встречается и при наследственных формах амилоидоза, что необходимо учитывать при оценке данного показателя.
Печеночные пробы
В данную группу входит ряд показателей, позволяющих оценить функциональное состояние печени.
| Показатель | Что обозначает | Норма | Изменения при амилоидозе печени |
| Аланинаминотрансфераза (АлАТ) | Данные вещества содержатся в клетках печени и попадают в кровоток в большом количестве лишь при массивном разрушении ткани органа. | М: до 41 Ед/л. | Концентрация повышается при развитии печеночной недостаточности. |
| Ж: до 31 Ед/л. | |||
| Аспартатаминотрансфераза (АсАТ) | |||
| Билирубин общий | При распаде эритроцитов в селезенке происходит образование несвязанного билирубина. С током крови он поступает в печень, где связывается с глюкуроновой кислотой и в таком виде выделяется из организма в составе желчи. | 8,5 – 20,5 мкмоль/л. | Концентрация повышается при массивном отложении амилоида в печени. |
| Билирубин (несвязанная фракция) | 4,5 – 17,1 мкмоль/л. | Концентрация повышается при печеночной недостаточности и нарушении желчеобразующей функции органа. | |
| Билирубин (связанная фракция) | 0,86 – 5,1 мкмоль/л. | Концентрация повышается при сдавливании внутрипеченочных или внепеченочных желчевыводящих протоков. |
Уровень холестерина в крови
Холестерин представляет собой вещество жировой природы, которое образуется в печени и играет важную роль в поддержании целостности мембран всех клеток организма. Увеличение концентрации холестерина в крови более 5,2 ммоль/л может наблюдаться при нефротическом синдроме, причем, чем выше данный показатель, тем тяжелее протекает заболевание.
Уровень белков в крови
Норма общего белка в крови составляет 65 – 85 г/л. Снижение данного показателя может наблюдаться при развитии нефротического синдрома (в результате потери белка с мочой), а также при тяжелой печеночной недостаточности, так как все белки организма синтезируются в печени.
Уровень креатинина и мочевины
Мочевина (норма – 2,5 – 8,3 ммоль/л) представляет собой побочный продукт белкового обмена, который выделяется через почки. Креатинин (норма – 44 – 80 мкмоль/л у женщин и 74 – 110 мкмоль/л у мужчин) образуется в мышечной ткани, после чего поступает в кровь и также выделяется почками. Увеличение концентрации данных веществ в крови является очень чувствительным показателем степени нарушения почечной функции при амилоидозе.
Данное исследование позволяет оценить строение и структуру внутренних органов, что необходимо для оценки степени нарушения их функции и определения распространенности патологического процесса.
УЗИ при амилоидозе может выявить:
- Уплотнение и увеличение (или уменьшение в азотемической стадии) почек.
- Наличие почечных кист (что могло стать причиной вторичного амилоидоза).
- Увеличение и уплотнение печени и селезенки, а также нарушение кровотока в данных органах.
- Гипертрофию различных отделов сердечной мышцы.
- Отложения амилоида в стенках крупных сосудов (например, аорты – самой крупной артерии организма).
- Скопление жидкости в полостях организма (асцит, гидроторакс, гидроперикард).
Генетическое исследование назначается при подозрении на наследственный амилоидоз (то есть если не удается подтвердить вторичную природу данного заболевания). Обычно для этого используется полимеразная цепная реакция, принцип которой заключается во взятии генетического материала у больного человека (обычно это кровь, моча, слюна или любая другая биологическая жидкость) и исследовании генов на определенных хромосомах. Выявление генетических мутаций в определенной области будет являться стопроцентным подтверждением диагноза.
При выявлении одной из форм наследственного амилоидоза генетическое исследование рекомендуется выполнить всем членам семьи и ближайшим родственникам больного, чтобы исключить наличие у них данного заболевания.
Биопсия представляет собой прижизненное взятие небольшого кусочка ткани или органа и исследование его в лаборатории с помощью специальных методик. Данное исследование является «золотым стандартом» в диагностике амилоидоза и позволяет подтвердить диагноз более чем в 90% случаев.
При амилоидозе для исследования может быть взята мышечная ткань, ткань печени, селезенки, почки, слизистой оболочки кишечника или другого органа (в зависимости от клинической картины заболевания). Забор материала проводится в стерильной операционной, обычно под местным обезболиванием. С помощью специальной иглы с острыми краями производится прокол кожи и забор небольшого количества ткани органа.
В лаборатории часть полученного материала обрабатывают раствором Люголя (йода в водном растворе йодида калия), а затем 10% раствором серной кислоты. При наличии большого количества амилоида он окрасится в сине-фиолетовый или зеленоватый цвет, что будет видно невооруженным глазом.
Для микроскопического исследования материал окрашивают специальными красителями (например, конго красным, после которого амилоид приобретает специфический красный цвет), и исследуют под микроскопом, причем фибриллы амилоида четко определяются как хаотично располагающиеся палочковидные образования.
При подозрении на амилоидоз рекомендуется госпитализация в отделение нефрологи или терапии с целью проведения тщательного обследования мочеполовой системы, так как поражение почек является наиболее частым и в то же время наиболее опасным осложнением амилоидоза. Также должны быть привлечены специалисты из других областей медицины (гепатолог, кардиолог, невролог и так далее) для выявления и лечения повреждений других органов и систем.
Если в процессе диагностики не выявлено серьезных функциональных нарушений со стороны каких-либо органов, дальнейшее лечение может проводиться в амбулаторных условиях (на дому) при условии, что пациент будет строго соблюдать все предписания врача и являться на контроль как минимум 1 раз в месяц.
Основными показаниями для госпитализации являются:
- наличие системного воспалительного процесса (подтвержденное лабораторно или клинически);
- наличие гнойного инфекционного заболевания;
- нефротический синдром;
- почечная недостаточность;
- печеночная недостаточность;
- сердечная недостаточность;
- надпочечниковая недостаточность;
- выраженная анемия (концентрация гемоглобина менее 90 г/л);
- гиперспленизм;
- внутреннее кровотечение.
Если в процессе амбулаторного лечения состояние пациента ухудшается, он также должен быть госпитализирован для уточнения диагноза и коррекции лечения.
В лечении амилоидоза применяется:
- медикаментозное лечение;
- диетотерапия;
- перитонеальный диализ;
- пересадка органов.
| Группа препаратов | Представители | Механизм лечебного действия | Способ применения и дозы |
| Стероидные противовоспалительные препараты | Преднизолон | Угнетают иммунные реакции, обладают выраженным противовоспалительным действием. Снижают скорость образования лимфоцитов, а также тормозят миграцию лейкоцитов в очаг воспаления, чем и обусловлен положительный эффект при амилоидозе. | Дозировка, длительность применения и путь введения подбирается индивидуально в каждом конкретном случае в зависимости от тяжести основного и сопутствующих заболеваний. |
| Дексаметазон | |||
| Противоопухолевые препараты | Мелфалан | Нарушает процесс образования ДНК (дезоксирибонуклеиновой кислоты), что угнетает синтез белка и размножение клеток. Так как амилоидобласты в определенной степени считаются мутантными (опухолевыми) клетками, их уничтожение может замедлить процесс образования амилоида (особенно при первичной форме заболевания). | Внутрь, один раз в сутки в дозе 0,12 – 0,15 мг/кг. Длительность лечения 2 – 3 недели, после чего необходимо сделать перерыв (не менее 1 месяца). При необходимости курс лечения можно повторить. |
| Аминохинолиновые препараты | Хлорохин (хингамин) | Противомалярийный препарат, который также тормозит синтез ДНК в клетках человеческого организма, уменьшая скорость образования лейкоцитов и амилоидобластов. | Внутрь, по 500 – 750 мг ежедневно или через день. Длительность лечения определяется эффективностью и переносимостью препарата. |
| Противоподагрические препараты | Колхицин | Угнетает скорость образования лейкоцитов и процесс синтеза амилоидных фибрилл в амилоидобластах. Эффективен при семейной средиземноморской лихорадке и в меньшей степени при вторичном амилоидозе. | Внутрь по 1 мг 2 – 3 раза в стуки. Лечение длительное (более 5 лет). |
Специфической диеты, которая смогла бы предотвратить развитие амилоидоза или замедлить процесс образования амилоида не существует. Основными осложнениями амилоидоза, требующим соблюдения строгой диеты, являются нефротический синдром и почечная недостаточность. При развитии данных синдромов рекомендуется диета номер 7, целью которой является защита почек от действия токсических продуктов обмена веществ, нормализация водно-солевого баланса и артериального давления.
Принимать пищу рекомендуется малыми порциями по 5 – 6 раз в сутки. Основным условием является ограничение потребления поваренной соли (не более 2 грамм в сутки) и жидкости (не более 2 литров в сутки), что в определенной степени предотвращает образование отеков и нормализует артериальное давление. Сложность в данном случае заключается в необходимости восполнять потери белка при нефротическом синдроме и в то же время уменьшить их потребление с пищей, так как при почечной недостаточности нарушается процесс выделения побочных продуктов их обмена.
| Что рекомендуется употреблять? | Что не рекомендуется употреблять? |
|
|
Принцип данного метода схож с принципом гемодиализа (который описан ранее), однако существуют определенные различия. При перитонеальном диализе полупроницаемой мембраной, через которую происходит удаление побочных продуктов обмена веществ, является брюшина – тонкая, хорошо кровоснабжаемая серозная оболочка, выстилающая внутреннюю поверхность и органы брюшной полости. Общая площадь брюшины близка к площади поверхности тела человека. Специальный раствор вводится в брюшную полость через катетер (трубку в животе) и вступает в контакт с брюшиной, в результате чего из крови в него начинают просачиваться продукты обмена веществ, то есть происходит очищение организма. «Недостатком» данного метода является более медленное очищение крови, чем при гемодиализе.
Основными преимуществами данного метода перед гемодиализом являются:
- Выведение В2-микроглобулина, который может стать причиной развития амилоидоза.
- Постоянное (непрерывное) очищение крови от побочных продуктов обмена веществ.
- Возможность использования в амбулаторных условиях (на дому).
Техника выполнения
Установка катетера выполняется в операционной под местным или общим обезболиванием. Обычно он устанавливается в нижней части брюшной стенки, причем наружу выходит лишь небольшое его отрезок. Через катетер в брюшную полость вводится около 2 литров специального диализирующего раствора, после чего катетер плотно закрывается и жидкость остается в брюшной полости на срок от 4 до 10 часов. В это время пациент может заниматься практически любой повседневной деятельностью.
Через установленные промежуток времени (обычно каждые 6 – 8 часов) необходимо слить «старый» раствор из брюшной полости и заменить на новый. Вся процедура занимает не более 30 – 40 минут и требует минимальных усилий.
Перитонеальный диализ противопоказан:
- при наличии спаек в брюшной полости;
- при инфекционных заболеваниях кожи в области живота;
- при беременности;
- при психических заболеваниях.
Пересадка донорских органов является единственным средством спасения жизни пациентов с развившейся органной недостаточностью. Однако стоит помнить, что данный метод лечения является лишь симптоматическим и не устраняет причину развития амилоидоза, поэтому в отсутствии постоянного адекватного лечения возможен рецидив заболевания.
При амилоидозе возможно пересадить:
- почку;
- ткань печени;
- сердце;
- кожу.
Донорские органы могут быть получены от живого донора (кроме сердца), а также от трупа либо от человека, у которого диагностирована смерть мозга, однако функциональная активность внутренних органов поддерживается искусственно. Кроме того, сегодня существует искусственное сердце, представляющее собой полностью механизированный аппарат, который может перекачивать кровь в организме.
Если донорский орган приживется (что бывает не всегда), пациенту требуется пожизненное применение иммуносупрессоров (препаратов, угнетающих активность иммунной системы), чтобы предотвратить отторжение «чужеродной» ткани собственным организмом.
Наиболее опасными осложнениями амилоидоза являются:
- Инфаркт миокарда. При повышении системного артериального давления (всегда наблюдающемся при нефротическом синдроме и почечной недостаточности) нагрузка на сердечную мышцу возрастает в несколько раз. Данное состояние отягощается отложением амилоида в ткани сердца, что еще больше ухудшает его кровоснабжение. В результате этого при резкой физической нагрузке либо эмоциональном стрессе может развиться несоответствие между потребностью сердечной мышцы в кислороде и уровнем его доставки, что может привести к гибели кардиомиоцитов (мышечных клеток сердца). Если человек не погибает сразу (что наблюдается довольно часто), в зоне инфаркта формируется рубец, что еще больше «ослабляет» сердце (так как рубцовая ткань не способна сокращаться) и может привести к хронической сердечной недостаточности.
- Инсульт.Инсультом называется острое нарушение кровоснабжения ткани головного мозга. При амилоидозе данное состояние обычно развивается в результате кровотечения через деформированную стенку кровеносного сосуда (геморрагический инсульт). В результате пропитывания нервных клеток кровью они погибают, что в зависимости от зоны инсульта может проявляться самыми разными симптомами – от нарушения чувствительности и двигательной активности до смерти больного.
- Тромбоз печеночных вен. Данное осложнение может развиваться в результате повышения концентрации фибриногена (белка свертывающей системы крови) в системе почечных вен, что приводит к образованию тромбов, которые закупоривают просветы сосудов. В результате этого развивается острая почечная недостаточность. Механизм развития данного осложнения обусловлен тем, что при нефротическом синдроме через почки выделяется большое количество альбуминов (основных белков плазмы крови), в то время как фибриноген остается в крови и его относительная концентрация повышается.
- Инфекционные заболевания. Истощение защитных систем, потеря большого количества белков с мочой и развитие полиорганной недостаточности делает организм больного практически беззащитным перед различными патогенными микроорганизмами. При амилоидозе часто регистрируется пневмония (воспаление легких), пиелонефрит и гломерулонефрит, инфекции кожи (рожистое воспаление) и мягких тканей, пищевые токсикоинфекции, вирусные инфекции (например, паротит) и так далее.

Некоторые локальные формы амилоидоза не представляют никакой опасности для беременности. Если скопление амилоида происходит лишь в одном органе или ткани (например, в мышце или в стенке кишечника) и не достигает больших размеров, беременность и роды будут протекать без осложнений, и ребенок родится абсолютно здоровым. В то же время при генерализованных формах амилоидоза прогноз для матери и плода целиком и полностью определяется длительностью заболевания и сохранившимися функциональными резервами жизненно-важных органов.
Исход беременности и родов определяется:
- функциями сердца;
- функциями почек;
- функциями печени;
- функциями надпочечников;
- скоростью образования амилоида.
Функции сердца
Опасным осложнением амилоидоза является сердечная недостаточность (СН), развивающаяся из-за отложения амилоида в ткани сердца. Это приводит к нарушению его сократительной активности, в результате чего при нагрузках появляются определенные симптомы – слабость, одышка (чувство нехватки воздуха), учащенное сердцебиение, боли за грудиной. Так как вынашивание ребенка и роды сопровождаются значительной нагрузкой на сердце, поражение данного органа может стать причиной развития серьезных осложнений во время беременности.
В зависимости от тяжести выделяют 4 функциональных класса СН. Первый характеризуется появлением симптомов лишь при крайне тяжелых физических нагрузках, в то время как четвертый выставляется пациентам, которые не могут самостоятельно себя обслуживать. Женщины с I – II функциональным классом могут спокойно выносить ребенка, однако им рекомендуется искусственное родоразрешение (с помощью кесарева сечения). При наличии III – IV функционального класса беременность и роды абсолютно противопоказаны, так как организм в данном случае не сможет справиться с возрастающей нагрузкой. Вероятность гибели плода и матери в данном случае крайне велика, поэтому рекомендуется искусственное прерывание беременности (аборт по медицинским показаниям).
Функции почек
Развивающемуся плоду требуется постоянная доставка различных питательных веществ, в том числе и белков. Однако при отложении амилоида в почках матери происходит разрушение почечной ткани, вследствие чего клетки крови и крупномолекулярные белки начинают выделяться с мочой, что в конечном итоге приводит в выраженной белковой недостаточности, отекам и асциту (скоплению жидкости в брюшной полости). Плод также начинает испытывать недостаток в белках (являющихся основным строительным материалом для растущего организма), в результате чего может наблюдаться задержка в развитии, а после рождения могут отмечаться пороки развития, отставание в росте, умственные и психические отклонения.
Крайней степенью поражения почек при амилоидозе является хроническая почечная недостаточность, при которой почки не в состоянии удалять побочные продукты обмена веществ из организма. В результате этого они скапливаются в крови матери, оказывая токсическое влияние на все органы и системы, что может отразиться и на состоянии плода (от легкой задержки развития до внутриутробной гибели).
Функции печени
При отложении амилоида в ткани печени происходит сдавливание кровеносных сосудов органа, в результате чего повышается давление в системе так называемой воротной вены, которая собирает кровь от всех непарных органов брюшной полости (от желудка, кишечника, селезенки и других). Вены данных органов расширяются, а их стенки истончаются. При дальнейшем повышении давления жидкая часть плазмы начинает выходить из сосудистого русла и скапливаться в брюшной полости, то есть развивается асцит. Если ее скапливается достаточно много, она начинает оказывать давление на растущий плод. Результатом этого может стать задержка в развитии, различные врожденные аномалии, а при выраженном напряженном асците (если количество жидкости превышает 5 – 6 литров) может произойти внутриутробная гибель плода.
Функции надпочечников
В нормальных условиях надпочечники секретируют определенные гормоны, участвующие в регуляции обменных процессов в организме. При поражении амилоидозом количество функциональной ткани в данных органах уменьшается, в результате чего заметно снижается продукция гормонов.
Во время беременности важную роль играет гормон надпочечников кортизол, функция которого заключается в активации приспособительных механизмов в организме матери. При его недостатке данные механизмы выражены крайне слабо или вовсе отсутствуют, в результате чего любая физическая или эмоциональная травма может привести к гибели плода и матери.
Скорость образования амилоида
Обычно данный процесс протекает довольно медленно, ввиду чего от начала заболевания до развития полиорганной недостаточности проходит не менее десятка лет. Однако в некоторых случаях (обычно при вторичном амилоидозе, развивающемся на фоне хронических гнойно-воспалительных процессов в организме) амилоид образуется очень быстро. Результатом этого может стать амилоидная инфильтрация сосудов плаценты (органа, обеспечивающего обмен веществ между матерью и плодом), что приведет к кислородному голоданию плода, задержке его развития или даже к внутриутробной гибели.
Причиной амилоидоза у детей может быть:
- Семейная средиземноморская лихорадка. Генетически обусловленное заболевание, наследующееся по аутосомно-рецессивному типу, то есть ребенок родится больным только в том случае, если унаследует дефектные гены от обоих родителей. Если же от одного родителя ребенок получит дефектный ген, а от второго – нормальный, он будет являться бессимптомным носителем заболевания, а его дети могут унаследовать дефектные гены с определенной долей вероятности. Клинически данный недуг проявляется генерализованным амилоидозом, который развивается в первые 10 лет жизни. Преимущественно поражается почечная ткань. Помимо амилоидоза наблюдаются приступы лихорадки (повышение температуры тела, озноб, повышенная потливость) и психические расстройства.
- Английский амилоидоз. Характеризуется преимущественным поражением почек, а также приступами лихорадки и потерей слуха.
- Португальский амилоидоз. В клинической картине преобладает поражение нервов нижних конечностей, что проявляется чувством ползания мурашек, нарушением чувствительности и двигательными расстройствами. Прогноз для жизни благоприятный, однако часто развивается паралич (неспособность выполнять произвольные движения).
- Американский амилоидоз. Характеризуется преимущественным поражением нервов верхних конечностей. Клинические проявления такие же, как при португальском амилоидозе.
- Вторичный амилоидоз. Данная форма заболевания развивается при наличии в организме хронических гнойно-воспалительных процессов (туберкулеза, остеомиелита, сифилиса и других). Если ребенок был заражен во время родов или сразу после рождения, вполне вероятно, что через 5 – 10 (а иногда и меньше) лет у него начнут появляться первые признаки генерализованного амилоидоза. Прогноз в данном случае крайне неблагоприятен – довольно быстро развивается полиорганная недостаточность и наступает смерть. Проводимое лечение дает положительные результаты лишь в половине случаев и на короткий промежуток времени, после чего заболевание обычно рецидивирует (обостряется повторно).
| Форма амилоидоза | Краткая характеристика | Профилактические мероприятия |
| Первичный (идиопатический амилоидоз) | Причина данной формы заболевания неизвестна. | Отсутствуют. |
| Наследственный амилоидоз | Развитие амилоидоза в данном случае связано с наличием мутантных генов на определенных хромосомах (в генетическом аппарате человека их всего 23 пары). Данные гены передаются из поколения в поколение, в результате чего все потомство больного человека с определенной долей вероятности может заболеть амилоидозом. Дефектные гены запускают образование мутантных клеток (амилоидобластов), синтезирующих фибриллярные белки, которые впоследствии превращаются в амилоид и откладываются в тканях организма. |
|
| Вторичный амилоидоз | Развитие данной формы заболевания возникает при хроническом воспалительном процессе в организме – при гломерулонефрите (воспалении почечной ткани), туберкулезе, остеомиелите (гнойном процессе в костной ткани) и других. В данном случае в крови повышается концентрация особого белка – сывороточного предшественника амилоида, который и обуславливает развитие заболевания. | Профилактика заключается в своевременном и полноценном лечении хронических воспалительных и гнойных процессов в организме. Это осуществляется с помощью применения антибактериальных препаратов широкого спектра действия (пенициллинов, цефтриаксона, стрептомицина, изониазида и других) до исчезновения клинических и лабораторных проявлений заболевания, а также в течение определенного периода времени после полного излечения. |
На выживаемость пациентов с амилоидозом влияет:
- Функция почек. При развитии почечной недостаточности пациент погибает в течение нескольких месяцев. Гемодиализ (очищение крови с помощью специального аппарата) продлевает жизнь больного на 5 лет и более. Пересадка почки может стать эффективным методом лечения, однако отложение амилоида в донорском органе наблюдаются более чем в половине случаев.
- Функция печени. При выраженной портальной гипертензии (повышении давления в системе воротной вены) происходит расширение вен внутренних органов (кишечника, пищевода, желудка). Пациент с такой симптоматикой может умереть в любой момент в результате кровотечения из разорвавшейся вены. Длительность жизни таких больных без радикального лечения (пересадки печени) не превышает 1 – 2 лет.
- Функция сердца. При развитии сердечной недостаточности VI степени большинство пациентов умирает в течение 6 месяцев. Пересадка сердца может продлить жизнь больных (при условии, что остальные органы и системы функционируют нормально).
- Функцией кишечника. При амилоидозе кишечника нарушение всасывания может достигать крайней степени выраженности. В отсутствии специфического лечения (полноценного внутривенного питания) смерть пациента может наступить уже через несколько недель из-за крайней степени истощения организма (кахексии).
В зависимости от формы заболевания выделяют:
- Идиопатический генерализованный амилоидоз. Причина заболевания неизвестна. Проявляется поражением всех органов и тканей, быстрым развитием полиорганной недостаточности и смертью больного. Через год после постановки диагноза в живых остается лишь 51 человек из ста. Пятилетняя выживаемость составляет 16%, в то время как десятилетняя – не более 5%.
- Наследственный амилоидоз. Если заболевание развивается в раннем детском возрасте – прогноз неблагоприятен. Смерть обычно наступает из-за почечной недостаточности в течение нескольких лет после установления диагноза.
- Вторичный амилоидоз. Прогноз определяется функциональным состоянием внутренних органов. Основной причиной смерти при данной форме заболевания также является хроническая почечная недостаточность.
Локальные (местные) формы амилоидоза обычно представляют собой опухолевидные образования различных размеров (от 1 – 2 до десятков сантиметров в диаметре). В процессе роста они могут сдавливать соседние органы, однако своевременное хирургическое лечение позволяет устранить заболевание. Угроза для жизни практически отсутствует.

При амилоидозе можно применять:
- Травяной противовоспалительный настой. В состав входят свежие цветки полевой ромашки (обладают противовоспалительным и противомикробным действием), цветки бессмертника (обладают противовоспалительным действием, а также улучшают выделение билирубина с желчью), трава зверобоя (повышает физическую и психическую выносливость) и березовые почки (обладают мочегонным действием). Для приготовления настоя необходимо по 200 грамм каждого ингредиента поместить в стеклянную банку и залить литром кипятка. После этого плотно закрыть крышкой и оставить в темном месте на 5 – 6 часов. Принимать по 200 мл 1 раз в сутки перед сном. Длительность непрерывного лечения не более 3 месяцев.
- Настой из плодов рябины и черники. Для приготовления настоя необходимо взять по 100 грамм плодов каждой ягоды и залить литром кипятка. Через полчаса процедить, дать остынуть и принимать по 100 мл 3 раза в день перед едой. Настой обладает противовоспалительным и вяжущим действием.
- Настой из глухой крапивы. Данное растение содержит дубильные вещества, аскорбиновую кислоту, гистамин и много других веществ. Применяется при хронических инфекционных заболеваниях почек. Для приготовления настоя 3 – 4 ложки измельченной травы крапивы следует залить в термосе 500 миллилитрами горячей воды (не кипятком) и принимать по 100 миллилитров 4 – 5 раз в день.
- Настой из плодов можжевельника. Обладает противовоспалительным, противомикробным, желчегонным и мочегонным действием. Для приготовления настоя 1 столовую ложку сушеных ягод необходимо залить 1 литром кипятка и настаивать в темном месте в течение 2 – 4 часов. Принимать по 1 столовой ложке 3 – 4 раза в день перед едой.
- Настойка травы посевного овса. Обладает противовоспалительным и общетонизирующим действием. Повышает работоспособность и стрессоустойчивость организма. Для приготовления настойки необходимо 200 мг измельченной травы овса залить 70% спиртом и настаивать в темном месте в течение 3 недель, ежедневно взбалтывая банку. После этого процедить и принимать по 1 чайной ложке 3 раза в день, разбавляя в 100 мл теплой кипяченой воды.
источник