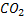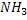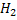1.Каково состояние азотистого баланса у 30-летнего здорового мужчины, работающего каменщиком, если он в сутки употребляет около 40 г белка. Ваши рекомендации? Ответ поясните.
2.Какие ферменты активируются при острых панкреатитах? Какие лекарственные препараты могут уменьшить разрушительное действие панкреатических пептидаз? Каков механизм их действия?
3.В отделении лежат двое больных: 1-й после частичной резекции желудка, 2-й с хроническим панкреатитом. При какой патологии будут сильнее выражены нарушения переваривания белков? Ответ поясните.
4.В эксперименте животному произведена перевязка протоков поджелудочной железы. Нарушится ли переваривание белков? Приведите схему переваривания белков в желудочно-кишечном тракте.
5.Больного беспокоят неприятные ощущения в области желудка, отрыжка с неприятным запахом, чувство тяжести после приема пищи. Что может быть причиной наблюдаемых симптомов. Что можно порекомендовать для нормализации процессов пищеварения?
6.Пациент на приеме жалуется наплохой аппетит, тошноту. При осмотре отмечена большая потеря веса. Анализ желудочного сока показал: общая кислотность – 20 ТЕ, свободной соляной кислоты нет, проба на кровь и молочную кислоту положительная, резко повышена активность ЛДГ. Сделайте заключение по анализу.
7.Здоровых крыс длительное время содержали на искусственной белковой диете, исключающей аминокислоты метионин и лизин. Как изменится у этих животных азотистый баланс? Дайте определение азотистого баланса. Назовите, к какой группе аминокислот по возможности синтеза в организме относятся метионин и лизин.
8.Взрослых здоровых крыс длительное время содержали на искусственной белковой диете, не содержащей глутамат и аспартат. Как изменится у этих животных азотистый баланс? Ответ поясните. Дайте определение азотистого баланса. Назовите, к какой группе аминокислот по возможности синтеза в организме относятся глутамат и аспартат.
9.После введения мышам аминокислоты аланина, содержащей меченый атом азота (N 15 ) в α- аминогруппе, обнаружили, что метка быстро появляется в α- аминогруппах других аминокислот печени (кроме лизина и треонина). Объясните, почему это происходит, аргументируя ответ соответствующей схемой.
10.У пациента с подозрением на инфаркт миокарда определяли активность аланин – и аспартатаминотрансферазы (соответственно АлАТ и АсАТ ) в крови? Активность какой аминотрансферазы наиболее увеличится при такой патологии и почему? Назовите другие ферменты, активность которых определяют в крови для подтверждения указанной патологии.
11.У пациента, перенесшего гепатит, определяли активность АлАТ и АсАТ в крови. Активность какого из этих ферментов увеличивается в большей степени и почему? При ответе на вопрос: напишите реакции которые катализируют эти ферменты; объясните значение этих реакций в метаболизме аминокислот, перечислите основные принципы, лежащие в основе энзимодиагностики.
12.После введения голодающим крысам глутамата и аспартата концентрация глюкозы в крови животных увеличилась. Как это объяснить? Напишите схему использования безазотистых остатков аминокислот при снижении уровня глюкозы в крови. Назовите, к какой группе аминокислот по судьбе безазотистого остатка относятся глутамат и аспартат.
13.Животные длительное время получали только белковую пищу; однако снижения концентрации глюкозы в крови при этом не отмечалось. Объясните результаты опыта. Напишите схему процесса, поддерживающего уровень глюкозы в крови при углеводном голодании. Укажите нормальную концентрацию глюкозы в крови.
14.Накопление аммиака в клетках мозга является непосредственной причиной нарушения психического состояния при циррозах печени. Причиной токсического действия аммиака считается его вторжение в энергетический метаболизм клетки. Определите возможный механизм токсического действия аммиака.
15.В эксперименте установлено, что добавка глутаминовой кислоты в раствор, питающий сердце, оказывает положительное воздействие на физиологическую функцию сердечной мышцы, особенно в условиях недостаточного обеспечения кислородом. Объясните механизм положительного действия указанной аминокислоты на деятельность сердца.
16.У больного с заболеванием печени содержание мочевины в крови 12% мг (2 ммоль/л), за сутки с мочой выведено 13 г. О нарушении какой функции печени можно думать? Какие ферменты надо исследовать для проверки предположения?
17.Установлено, что с мочой больного выделяется за сутки 1 г аммиака в виде аммонийных солей. Cколько аммонийных солей выделяется с мочой здорового человека? Есть ли нарушения выделения аммиака у исследуемого больного? При каких заболеваниях выделение аммиака с мочой меняется (повышается или снижается)?
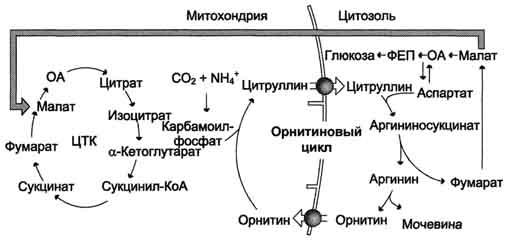
18.Известно, что вирус гриппа нарушает синтез фермента карбамоилфосфатсинтетазы I. При этом у детей возникают рвота, головокружение, судороги, возможна потеря сознания. Укажите причину наблюдаемых симптомов. Напишите схему орнитинового цикла. Укажите, концентрация какого вещества повышается в крови больног. Объясните механизм его токсического действия на нервную ткань.Какую диету можно рекомендовать при данном нарушении.
19.При наследственном заболевании аргининосукцинатурии суточная экскреция аргининосукцината почками достигает 3 г (в норме отсутствует). Укажите возможную причину и проявления этого заболевания. Напишите схему орнитинового цикла, на схеме укажите место ферментного блока. Перечислите вещества, содержание которых повышено в крови у данного больного.
20.Объясните, каковы причины повторяющейся рвоты, припадков с потерей сознания у ребенка в возрасте 4 месяцев, если в крови обнаружена высокая концентрация цитруллина. Ответ проиллюстрируйте схемой нарушенного процесса, указав место ферментного блока. Объясните механизмы развития перечисленных симптомов. Почему состояние больного улучшается при назначении малобелковой диеты.
21.При биохимическом исследовании крови и моче больного обнаружили, что концентрация мочевины в моче составляет 180 ммоль/сут, а в крови- 2,0 ммоль/л (в норме содержание в крови 3,5-9,0 ммоль/л, в моче 330-580 ммоль/сут). Объясните причину указанной патологии. Напишите схему метаболического пути, который нарушен в данном случае. Перечислите возможные причины и последствия его нарушения.
22.Какие изменения щелочных резервов крови можно ожидать у человека при длительном выделении с мочой повышенного количества аммонийных солей?
23.Пациенты с наследственными нарушениями орнитинового цикла избегают белковой пищи, у них отмечаются приступы рвоты, сонливость, судорожные припадки и умственная отсталость. Выскажите предположения о причинах наблюдаемых явлений. Напишите схему орнитинового цикла, укажите ферменты. Объясните, в чем заключается биологическая роль орнитинового цикла. Перечислите вещества, содержание которых увеличено в крови у таких пациентов. Объясните токсическое действие одного из этих веществ на нервные клетки.
24.При мегалобластной и других анемиях для стимулирования эритропоэза назначают витамин Вс. (Вс, фолиевая кислота) в комплексе с витамином В12. Объясните механизм действия таких витаминных препаратов. Перечислите производные кофермента фолиевой кислоты и процессы, в которых они участвуют. Назовите аминокислоты, необходимые для синтеза этих соединений.
25.Объясните, почему сульфаниламидные препараты оказывают антибактериальное действие, не проявляя при этом цитостатического влияния на клетки человека. Опишите механизм действия этих препаратов. Приведите примеры процессов, которые нарушаются в бактериальных клетках при введении сульфаниламидных препаратов.
26.Аминокислота метионин используется как лекарственный препарат с липотропным эффектом при циррозе, токсических поражениях печени, хроническом алкоголизме. Введение метионина при атеросклерозе вызывает снижение содержания в крови холестерина и повышение уровня фосфолипидов. Объясните терапевтические эффекты метионина, перечислите его биологические функции. Напишите реакцию его активации. Укажите, в синтезе каких соединений, необходимых для транспорта липидов, он участвует; напишите соответствующую схему.
27.У недоношенного ребенка отмечается высокое содержание тирозина в плазме – 2мМ, при норме менее 0,7 мМ. Снижена активность, наблюдается сонливость. При ограничении потребления белка до 2 г в сутки и введении 100 мг в день витамина С уровень тирозина снижается. Объясните механизм. Напишите уравнения реакций.
28.У ребенка отмечаются судороги, которые проходят после введения пиридоксаля. Объясните предполагаемый механизм. Напишите уравнения реакций, объясняющих положительный эффект введения пиридоксаля.
29.У больного ребенка уровень фенилаланина в крови 5 мкмоль/л (норма 0,2 мкмоль/л), в моче повышено содержание фенилпирувата. Для какого заболевания характерны эти симптомы. Напишите уравнение реакции, нарушающейся при этом, назовите дефектный фермент.
30.При дефиците витамина В6 у недоношенных грудных детей могут возникнуть признаки нарушения нервной системы. Объясните механизмы развития патологии. Вспомните роль витамина В6 в обмене аминокислот и нейромедиаторов. Приведите уравнения реакций образования биогенных аминов.
31.У грудного ребенка отмечается отставание в умственном и физическом развитии, уровень гистидина в крови 25 мг/дл (в норме 2,0 мг/дл). Для какого заболевания характерны эти симптомы? Напишите реакцию, нарушающуюся при этом. Укажите фермент и его диагностическое значение.
32.Пациенту с болезнью Паркинсона назначили ипраниазид ( ингибитор МАО). Укажите возможные причины заболевания и механизм действия препарата. Для этого напишите уравнения реакций: синтеза медиатора, концентрация которого снижена при паркинсонизме; инактивации этого медиатора.
33.У новорожденного ребенка наблюдается потемнение мочи при контакте с воздухом. Накопление каких веществ обуславливает этот симптом? Назовите заболевание, напишите уравнение реакции, нарушаемой при этом. Назовите дефектный фермент.
34.У альбиносов отсутствуют механизмы защиты от ультрафиолетовых лучей, не появляется загар. Укажите причины нарушений. Назовите вещества, синтез которых нарушен; б) напишите реакцию, скорость которой снижена при альбинизме, назовите дефектный фермент.
35.В детскую больницу поступил трехлетний ребенок с признаками умственной отсталости. При обследовании в моче обнаружена фенилпировиноградная кислота. Метаболизм какой аминокислоты нарушен? Напишите уравнение реакции, нарушаемой при этом. Назовите дефектный фермент. Каковы рекомендации по питанию для этого ребенка?
36.У больного ребенка обнаружили повышенное содержание фенилпирувата в моче (в норме практически отсутствует). Содержание фенилаланина в крови составило 35 мг/дл ( норма около 1,5 мг/дл). Укажите, для какого заболевания характерны перечисленные симптомы, приведите возможные причины его возникновения, написав соответствующую реакцию.
37.Витамин В6 часто назначают при паркинсонизме, невритах, депрессивных состояниях. Объясните, на чем основано действие пиридоксина. Напишите схему синтеза катехоламинов. Укажите на схеме реакцию, для которой необходим витамин В6.
38.После внутривенного введения животным N 15 – аспартата радиоактивная метка появляется в составе нуклеиновых кислот разных органов и тканей. Вспомните пути синтеза нуклеотидов и укажите, какие атомы в пуриновых и пиримидиновых основаниях будут содержать метку. Правильность выбора иллюстрируйте схемами соответствующих реакций.
39.Причинами подагры могут быть суперактивация ФРДФ-синтетазы либо частичная недостаточность гипоксантин-гуанинфосфорибозилтрансферазы. Объясните, почему такие изменения в активности этих ферментов могут вызвать развитие заболевания. Напишите схемы реакций, катализируемых указанными ферментами. Укажите, почему скорость этих реакций влияет на количество мочевой кислоты, образующейся в организме.
40.В клинике, куда пациент поступил с жалобами на острые боли в мелких суставах, у него была диагностирована подагра и назначено лечение аллопуринолом. Объясните, почему аллопуринол облегчает состояние больного. Представьте схему метаболического пути, скорость которого увеличится у этого больного. Объясните механизм действия аллопуринола. Укажите, какое вещество будет конечным продуктом катаболизма пуринов при лечении этим препаратом.
41.Структурный аналог тимина – 5-фторурацил оказывает сильное цитостатическое действие и часто используется в химиотерапии опухолей. Напишите схему реакции, которую ингибирует этот препарат. Укажите, синтез какой нуклеиновой кислоты нарушается в присутствии этого препарата и почему.
42.Метотрексат – структурный аналог фолиевой кислоты, является эффективным противоопухолевым препаратом и широко используется в клинике. Он снижает скорость синтеза пуриновых и пиримидиновых нуклеотидов и тормозит рост и размножение быстрорастущих клеток. Укажите, какие стадии синтеза нуклеотидов будут ингибированы при использовании этого лекарства. Назовите производные Н4-фолата, которые обеспечивают включение углеродных атомов в азотистые основания нуклеотидов. Напишите строение пуринового и пиримидинового оснований, отметив атомы, включение которых тормозится в присутствии метотрексата.
43.В химиотерапии опухолей применяют структурной аналог глутамина – антибиотик азасерин, который ингибирует амидотрансферазные реакции. Как этот препарат изменяет скорость синтеза нуклеотидов? Укажите атомы азота, которые включаются в молекулы пуриновых и пиримидиновых оснований за счет амидной группы глутамина. Напишите схемы соответствующих реакций, иллюстирующие правильность вашего выбора.
44.У детей с синдромом Леша-Нихана наблюдается тяжелая форма гиперурикемии, сопровождающаяся появлением тофусов, уратных камней в мочевых путях и серьезными неврологическими отклонениями. С потерей активности какого фермента связано развитие заболевания? Представьте схему катаболизма пуриновых нуклеотидов. Напишите схемы реакций, которые не идут у больных при указанной патологий. Укажите лекарственный препарат, который может снизить содержание мочевой кислоты в крови этих детей, и механизм его действия.
45.При наследственной оротатацидурии с мочой выводится до 1,5 г оротата. Укажите, дефект какого фермента приводит к возникновению этого заболевания. Напишите схему синтеза пиримидиновых нуклеотидов и укажите место блока при оротатацидурии. Какие метаболиты могут устранить «пиримидиновый голод» при этой патологии.
46.Фосфорибозилдифосфат (ФРДФ) является общим субстратом в синтезе пуриновых и пиримидиновых нуклеотидов de novo из простых предшественников и по «запасным» путям. Объясните, почему суперактивация фермента ФРДФ-синтетазы приводит к возникновению подагры. Напишите реакцию образования ФРДФ. Объясните, на каких стадиях синтеза пуриновых нуклеотидов de novo и по «запасным» путям используется ФРДФ. Укажите, что происходит с конечными продуктами этих процессов, если они образуются в избытке.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Причина заболевания — дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота — 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено.
Причина метаболического нарушения — врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний. При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы:
заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) — леводопа, мадопар, наком и др.
подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
Конечные продукты обмена белков:
C, H, O, N , S. – CO2 , H2O, NH3, H2S.
Соли аммония выводятся с мочой:
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой .
Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
В печени – синтез мочевины ( в следующих вопросах будет подробно описано. Честно говоря, странный вопрос – скорее всего надо просто сказать где образуется.)
Вопрос №38. Основные источники и пути обезвреживания аммиака в организме.
Непрямое дезаминирование(основной путь дезаминирования амк)
Окислителное дезаминирование глутамата
Окислителное дезаминирование амк(малозначимый путь дезаминирования)
неокислительное дезаминирование Гис,Сер ,Тре
окислительное дезаминирование (путь инактивации биогенных аминов)
гидролитическое дезаминирование АМФ
гниение белков в кишечнике в результате действия бактерий на пищевые белки.
Пути обезвреживания:связывание аммиака с образованием нетоксичных соединений,которые выводятся из организма вместе с мочой
Синтез глутамина под действием глутаматсинтетазы
Синтез аспарагина под действием аспарагинсинтета
Синтез мочевиы в печени
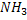
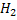
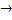
Восстановительное аминирование а-кетоглутарата
Вопрос №39 Роль глутамина в обезвреживании и транспорте аммиака в организме.
глутамин образуется при обезвреживании аммиака (мышцы, мозг, печень)Связывание аммиака глутамином протекает во всех тканях организма
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии и транспортируется из тканей в кровь.
Вопрос №40 Глутамин как донор амидной группы при синтезе ряда соединений.
Высокий уровеньглутамина в крови и легкость его поступления в клетки обусловливают использования глутамина во многих анаболических процессах
Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений
Вопрос №41 Синтез мочевины, химизм, ферменты, энергетика, происхождение атомов азота в мочевине
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла.Источник первого азота-аммиак. Аспартат — источник второго атома азота мочевины
Вопрос №42 Связь орнитинового цикла с циклом трикарбоновых кислот.
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины. ЦЦ
ЦТК и орнитиновый цикл протекают в печени.
Вопрос№43 Нарушение синтеза и выведения мочевины. Гипераммониемия, происхождение
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла
Наследственные нарушения орнитинового цикла и основные их проявления
Карбамоил- фосфат- синтетаза I
В течение 24-48 ч после рождения кома, смерть
Орнитин- карбамоил- трансфераза
Гипотония, снижение толерантности к белкам
Аргинино- сукцинат- синтетаза
Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки
Гипераммонимия, атаксия, судороги, выпадение волос
Аргини- носукци- нат, Глн, Ала, Лиз
Основной диагностический признак — повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме — 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Вопрос№44 Определение мочевины в сыворотке крови, принцип метода, диагностическое значение. Количество морчевины в сыворотке крови определяется уреазным методом
Под действием уреазы мочевина распадается на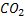
Значение:при повышении концентрации мочевины , которое встречается при хронических поражениях почек, усиленном распаде белков в тканях, непроходимости кишечника ,закупорке мочевыводящих путей.Снижение уровня мочевины наблюдается при голодании, безбелковой диете, ферментных дефектах мочеобразования.
45. Образование и выведение солей аммония. Глутаминаза почек
Почка располагает рядом ферментных систем, разрушающих глутамин, но, подобно большинству реакций анаболизма аминокислот, синтез глутамина не осуществляется. Глутамин доставляется к почкам током крови. Клетки почек жадно поглощают из циркулирующей крови глутамин, который образуется в основном за счет аммиака клеток печени. В почках же аммиак образуется преимущественно из глутамина, так что последний можно рассматривать как нетоксичную форму аммиака, который совершает челночные движения между печенью и почками. Глутаминаза почек действует подобно глутаминазе печени, освобождая глутамат и NH3 путем простой реакции гидролиза Однако фермент почек отличается тем, что его активность значительно возрастает под влиянием неорганического фосфата. Образующийся глутамат может, конечно, подвергаться затем дезаминированию при участии глутаматдегидрогеназы, так что из глутамина в конечном итоге образуются две молекулы аммиака.
В общем регулирует кислотно-щелочное равновесие в организме и задерживает натрий и калий.
источник
113. Пациенту с острыми болями в области сердца определили активность аминотрансфераз (ГПТ-АлАТ; ГОТ-АсАТ) в крови.
А. Активность какой из аминотрансфераз в наибольшей степени увеличивается при этой патологии?
Б. Объясните причины повышения активности этих энзимов в плазме крови. Каков диагностическое значение определения их активности?
В. Чем может быть обусловлено повышение АсАТ в плазме крови у новорожденных ?
Здесь необходимо вспомнить, что такое трансферазы и зачем они нужны.
Трансферазы (аминотрансферазы) – это ферменты (значит они катализирует какую то реакцию в организме), коферментом которых является витамин В6 (пиридоксальфосфат), которые участвуют в реакциях трансаминирования, т.е. переноса аминогруппы (-NH2) c аминокислоты на кетокислоту.
В результате этого свободные аминокислоты теряют свои аминогруппы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в ЦТК, ну а далее в дыхательную цепь. А при необходимости может использоваться для синтеза глюкозы в глюконеогенезе.
Существует несколько видов аминотрансфераз, при чем концентрация их в различных тканях неодинакова.
Например, АСТ (или аспартатаминотрансфераза) – осуществляет реакция трансаминирования между аспартатом и кетоглутаратом, в результате чего образуется оксалоацетат и глутамат. По обратной реакции – ГОТ (или глутаматоксалоацетатаминотрансфераза).
Эти ферменты (АсАТ-ГОТ) наибольшее их концентрация наблюдается в клетках миокарда.
Отсюда мы даем первый ответ на вопрос:
Повыситься активность Аспартатаминотрансфразы. Так как у пациента наблюдаются боли в миокарде, что свидетельствует о нарушении целостности клеток миокарда и ферменты АсАТ выйдут в кровяное русло, что можно подтвердить биохимическими анализами крови.
Какое же это имеет диагностическое значение.
Для клинических целей определяют активность двух аминотрансфераз (АсАТ и АлАТ). У здоровых людей, в сыворотке крови активность этих трансфераз в тысячи раз ниже, чем в органах. При органических поражениях, сопровождающихся деструкцией клеток, происходит выход трансаминаз из очага в кровь. Через 3-5 часов после развития инфаркта миокарда уровень АсАТ повышается в крови в 8-10 раз. Через 2-3 дня при благоприятном исходе болезни уровень АсАТ в крови возвращается к норме. При различного рода коронарной недостаточности (пороки сердца, стенокардия) гиперактивность АсАТ в крови не наблюдается или незначительна, так как деструкция миокардиоцитов не наблюдается.
То есть можно судить о характере и о динамике заболевания сердца.
А вот при заболеваниях печени (при деструкции гепатоцитов) наблюдается повышение активности другой трансферазы – Аланинаминотрансферазы (АлАТ)
В. Повышение АсАТ в плазме крови у новорожденных не являются патологией, что обусловлено повышенной проницаемостью клеточных мембран. Понижение же до нормы у здорового ребенка происходит после 6 мес.
114.При тяжелых вирусных гепатитах у больных может развиться печеночная кома, приводящая к токсическому повреждению клеток мозга.
А. Каковы причины столь значительного повреждения функции ЦНС?
Б. Объясните причины токсичности аммиака.
Вспомним одну из функции печени, а точнее гепатоцитов. Вспомним, что в гепатоцитах осуществляется реакции синтеза мочевины из аммиака. Мочевина безвредна и нетоксична, а аммиак являются токсичным для всего организма, но прежде он являются крайне токсичным для клеток ЦНС.
Разбираем, что же происходит при тяжелых вирусных гепатитах. А при них наблюдаются поражение гепатоцитов печени, если поражение их массивно, то гепатоциты не будут справляются со своей функцией, это привет к снижению синтеза мочевины (один из путей обезвреживания аммиака), следовательно повыситься уровень аммиака в крови, что приведет к гипераммониемии.
Б. Причины токсичности аммиака.
1. аммиак сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата (глутаминовой кислоты).
а- кетоглутарат+НАДФН2+NH3 à глутамат + НАДФ + ;
В результате снижается функция ЦТК и возникает гипоэнергетическое состояние. А почему, до потому что а-кетоглутарат, является продуктом цикл Кребса, именно принимает на себя, от аминотрансфераз, аминогруппу аминокислот и превращается в глутамат. Следовательно, снижение а-кетоглутарата приведет к нарушению ЦТК, а этот цикл являются одним из главных источников энергии в организме человека.
2. Аммиак усиливает синтез глутамина из глутамата в нервной ткани:
Накопление глутамина в нервных клетках приводит к повышению осмотического давления и может вызвать отек мозга.
3. Снижение концентрации глутамата нарушает синтез ГАМК (путем декарбоксилирования) – основного медиатора проведения нервного импульса, что вызывает судороги.
4. Аммиак в плазме крови образует ион NH4 + (аммония)
Накопление аммония вызывает алколоз (смещение рН крови в щелочную сторону) и нарушает трансмембранный перенос ионов Na + и К + , проведение нервного импульса, что ведет к повреждению клеток мозга.
115.При длительном голодании белки скелетных мышц используются в качестве источника энергии. Составьте последовательность превращений, которые должны произойти с белками и продуктами их распада, прежде чем мозг и сердечная мышца смогут использовать энергию их распада (1à2à3à4à5).
1. Белки скелетных мышц являются эндогенными источниками аминокислот, то есть происходит гидролиз собственных белков под влиянием тканевых протеаз.
2. Транспорт аминокислот в печень при помощи Na + -зависимого механизма симпорта.
3. Дезаминирование аминокислот, точнее трансдезаминирование.
4. Использование углеродного скелета аминокислот для образование энергии (АлаàПВКàацетилКоАàЦТК àДыхательная цепьàАТФ)
5. Транспорт глюкозы в мозг и сердечную мышцу (как источник энергии).
116.В моче больного обнаружено значительно количество гомогентизиновой кислоты.
А. Назовите и охарактеризуйте аминокислоты, метаболизм которых сопровождается образованием гомогентизиновой кислоты.
Б. Содержится ли гомогентизиновая кислота в моче здоровых людей?
В. Назовите заболевание, обнаруженное у больного, и причину его возникновения.
1. Фенилаланин – незаменимая аминокислота; тирозин – условно заменимая аминокислота, синтезируется из фенилаланина, (90 фенилаланина превращается в тирозин).
Фен àТирà …. à Гомогентизиновая кислота à Фумарилацетатоацетат àфумарат + ацетатоацетат.
2. В норме у здоровых людей в моче гомогентизиновой кислоты нету, т.к. она являются промежуточным продуктом обмена Фен и Тир и в норме превращается в фумарилацетатоацетат.
3. Алкаптонурия. Причина патологии- наследственный дефект фермента, катализирующего окисление гомогентизиновой кислоты (Е2 – диоксигеназа гомогентизиновой кислоты).Для этой болезни характерно выделение с мочой значительных количеств гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует черный пигмент. Болезнь врожденная, ее обычно обнаруживают по появлению черных пятен на пеленках.
117.Животных длительно время содержали на белковой диете, в которой отсутствовали глутаминовая, аспарагиновая кислоты и серин. Нарушение в развитии этих животных не обнаружили. Как можно объяснить этот факт? Ответ подтвердите схемами реакций из метаболических карт.
Глутаминовая, Аспарагиновая кислоты и серин – являются заменимыми аминокислотами, они легко синтезируются в организме путём трансаминирования.
1. Аланин+ а-кетоглутаровая кислота à Глутамин + ПВК.
2. Глутамин + Щук à Аспарагиновая + а-кетоглутаровая.
3. Углеродный скелет серина образуется из глюкозы:
118.Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 ммоль/л. При каких состояниях в сыворотке крови может быть обнаружение повышение мочевины.
А. При значительно поступлении белков с пищей (продукционная азотемия). Т.к. увеличивается поступление белков с пищей, будет образовываться больше аммиака, который идет на синтез мочевины.
Б. При усиленном распаде тканевых белков (продукционная азотемия).
В. При лихорадках (продукционная азотемия). Т.к. идет усиленный распад белков.
Г. При нарушении фильтрационной способности почек (почечная ретенционная азотемия). Т.к. образовавшаяся мочевина не выводится с мочой, отсюда и ее накопление в крови.
Д. Нарушение функции ССС, замедление кровообращения, повышение свертываемости крови и др. (ретенционная анемия внепочечного происхождения)
119.У больного яркая желтушность склер, кожи, слизистых оболочек. Моча цвета тёмного пива; кал бесцветный. В крови повышены содержание общего билирубина (за счет прямого). В моче определяется билирубин. О каком типе желтухе идет речь?
Вспомним, что такое билирубин и как он образуется в нашем организме.
Тут необходимо вспомнить распад гемоглобина. Гемоглобин содержится в эритроцитах. Живут эритроциты пример 120 дней. А далее они катаболизируются главным образом в ретикулоэндотелиальных клетках селезенки, костного мозга, печени и эритроцитов.
Распад эритроцитов начинается с распада гемоглобина на гем и глобин. Двухвалентное железо далее окисляется до трёхвалентного, а также образуется биливердин.
А затем, билирубин. Билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы. Образование подобного комплекса не позволяет билирубину выделится с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин. Далее непрямой билирубин попадает в печень с помощью переносчика (лигандина). В гепатоцитах происходит реакции связывания билирубина с глюкороновой кислотой. Билирубин-глюкоронид получил название связанны (конъюгированный) или прямой билирубин.
После образования прямого билирубина АТФ-зависимый переносчик переносит его в желчные протоки и далее в кишечник, где при участии бактериальных ферментов разрушается до конечных продуктов (билирубин àмезобилирубин à мезобилиноген (уробилиноген) (под действием ферментов бактерий) àстеркобилиноген (окрашивает кал) à стеркобилин и уробилин (под действием кислорода).
· В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается с током крови и вновь попадает в печень, где окисляется до моно, ди и трипирролов. Оставшаяся в кишечнике часть восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена по геморроидальным сосудам попадает в кровь, а далее в почки, где выводится с мочой. На воздухе стеркобилиноген и уробилиноген превращаются соответственно, стеркобилин и уробилин.
Отсюда ответ, это механическая желтуха. Так как образовавшийся прямой (конъюгированный) билирубин не может попасть в кишечник и выводится из организма, т.к. имеется закупорка желчных протоков, например, при желчекаменной болезни (камень в желчном протоке), опухоли в желчновыводящих путях или послеоперационным сужением общего желчного протока.
Будет наблюдаться следующая картина. Прямой билирубин будет продолжать образоваться в печени, сосуды будут переполняться прямым билирубином, их проницаемость повыситься (проницаемость сосудов) и он (прямой билирубин) будет высвобождаться в кровь. Это объясняет следующие симптомы:
— Бесцветный кал, объясняется отсутствием поступления стеркобилиногена в кишечник, который окрашивает кал.
— Желтушность склер, слизистых и кожи, объясняется высоким содержанием прямого билирубина в крови, который имеет оранжевый цвет.
— Моча цвета темного пива – объясняется тем, что прямой билирубин будет выводится с почками.
120.У пациента содержания билирубина в крови повышено (за счет непрямого билирубина), кал интенсивно окрашен (повышено количество стеркобилина). В моче билирубин не найден.
А. Объясните, какой вид желтухи можно диагностировать.
Б. Напишите, используя метаболическую карту, схему образования билирубина и опишите его дальнейшую судьбу.
Это гемолитическая желтуха. При гемолитической желтухе:
Наблюдается усиленный гемолиз эритроцитов, что приводит к образованию непрямого билирубина в крови, он будет поступать в печень, некоторая его часть будет удаляться, а некоторая часть вновь возвратиться в кровь и будет накапливаться в тканях и крови.
Интенсивно окрашенный кал, свидетельствует об интенсивном образовании стрекобилиногена, который и окрашивает кал.
В моче билирубин не найден – т.к. непрямой билирубин не фильтруется почками.
121.При наследственном дефекте ферментов синтеза гема кожа больных обладает повышенной чувствительностью к солнечному облучению, и моча приобретает красный цвет.
А. Накопление каких промежуточных продуктов синтеза гема вызывают эти симптомы? А. Как называют эти болезни, обусловленные генетическими дефектами синтеза гема?
Для начала необходимо разобрать схему реакций синтеза гема.
1. Реакция. Образования 5-аминолевулиновой кислоты из глицина и сукцинил-S-КоА. Это происходит в митохондриях.
2. Из митохондрий 5-аминолевулиновая кислота поступает в цитозоль. Далее под действием фермента порфобилиногенсинтазы образуется циклический порфобилиноген из двух молекул 5-аминолевулиновой кислоты.
3. Порфобилиноген (ПБГ) под действием фермента уропорфириноген-синтазы дезаминируется и образуется уропорфиноген I или уропорфиноген III. Они могут окисляться до уропорфирина или же
4. Декарбоксилироваться до копропорфиногена соответствующего типа.
5. Далее под действием копропорфиноген –декарбоксилазы и копропорфиноген-оксидазы образуется протопорфиноген IX, из него далее Протофирин IX, который присоединяя железо, с помощью фермента феррохелотазы и образуется Гем.
В результате генетических дефектов синтеза гема, развиваются порфирии. При этих заболевания накапливаются промежуточные продукты синтеза гема.
При накоплении уропорфиногенов:
· моча больных приобретает красный цвет.
· Зубы при УФ-облучении сильно флуоресцируют,
· Кожа имеет повышенную чувствительность к солнечном свету, т.к. на свету превращаются в порфирины, которые взаимодействуя с кислородом образуют активные радикалы, повреждающие клетки кожи.
122.ГАМК в виде препаратов аминалона или гаммалона используется в клинике при лечении заболеваний, сопровождающихся резким возбуждением коры головного мозга.
А. Напишите, используя метаболическую карту, реакцию образования ГАМК, назовите аминокислоту-предшественник, фермент, кофермент.
Б. Какова биологическая роль ГАМК? При каких патологиях ГАМК в виде препаратов аминалона или гаммалона используется в клинике?
1. ГАМК – это биогенный амин, который образуется при декарбоксилировании глутамата (отщепляется а-карбоксильная группа).
Глутамат (фермент – глутаматдекарбоксилаза) à ГАМК + СО2.
Фермент Глутаматдекарбоксилаза, а коферментом является Пиридоксальфосфат (активная форма витамина В6).
2. ГАМК в нервных клетках является основным тормозным медиатором проведения нервного импульса. ГАМК в виде препаратов аминалона и гаммалона применяются при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях, а также при резком возбуждении ЦНС (эпилепсии).
123.При синдроме Баттлера-Олбрайта отмечаются следующие нарушения: снижается выделение солей аммония с мочой, повышается экскреция натрия и калия (приводит к гипонатриемии и гипокалиемии), возникает ацидоз.
А. Предположите, активность какого фермента снижена в почках?
Б. Назовите реакцию, которую он катализирует.
В. Почему развивается ацидоз у увеличиваются потери калия и натрия?
Необходимо знать образование амидов дикарбоновых кислот – важный путь обезвреживания аммиака, в тканях мозга, скелетных мышцах и печени, откуда он (в составе глутамина и аспарагина) поступает в кровь, а затем в печень и почки, где превращается в мочевину и соли аммония, которые удаляются с мочой. Это глюкозо-аланиновый цикл.
Вначале, под действием фермента глутаминсинтетазы образуется глутамин. Глутамин является безопасной транспортной формой аммиака. Аммиак по действием фермент глутаминазыв почках превращается в соли аммония и выводятся с мочой. Или же поступить в печени и пойти по орнитиновому циклу.
Ион аммония поддерживает кислотно-щелочное равновесие, т.е. способствует выведению протонов водорода и аниона кислоты. В отсутствии солей аммония анионы кислоты выводятся в виде натриевых и калиевых солей.
124.Животному ввели метионин с меченым атомом углерода 14 С в метильной группе. Укажите соединения, в которых была обнаружена метка через некоторое время (А,Б,В,Г). Для написания реакций используйте метаболические карты.
Метионин в активной форме в виде S-аденозилметионина (SAM) участвует в многочисленных реакциях трансметилирования и образования:
А. Синтез креатина и креатинфосфата.
Креатин необходим для образования в мышцах высокоэргического соединения — креатинфосфата. Синтез креатина идет в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина.
В почках образуется гуанидинацетат, соединяется аргинин с глицином, при действии глицинамидинотрансферазы.
АРГ+ГЛИàГуанидинацетат+ Орнитин (пойдет в орнитиновый цикл).
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования (метильная группа от S-аденозилметионина), с образованием креатина.
Далее, с током крови креатин поступает в мышцы, где под действием фермент креатинфосфокиназы (КК), образуется креатинфосфат. Это высокоэргическое соединение. Энергия креатинфосфата используется для работы мышц, затем снова образуется креатин, который выводится с мочой.
Для синтеза холина требуются аминокислоты серин, метионин. Этаноламин может быть использован и в готовом виде
B.Синтез катехоломинов (адреналин, норадреналин).
Тирозин à ДОФАàдофаминàнорадреналин à Адреналин.
Последняя реакция (превращение норадреналина в адреналин осуществляется при участии S-аденозилметионина).
Глутаминовая кислота à (декарбоксилирование) ГАМКà при участии S-аденозилметионина, через несколько реакций образуется Карнитин.
125.Заболевание: семейная гипераммониемия (передается по аутосомно-рецессивному типу) характеризуется стойким увеличением содержания в крови аммиака и полным отсутствием цитруллина, основные клинические симптомы связаны с поражением ЦНС.
А. Напишите, используя метаболическую карту, реакция, которая блокирована при данной патологии.
Б. почему состояние больных улучшается после введения глутаминовой кислоты?
В. Как изменится суточное выделение мочевины при этой патологии?
А.Если не образуется цитруллин, значит нарушен фермент, который образует цитруллин (спасибо КЭП)
Вспомним, что цитруллин образуется при взаимодействии цитруллина и карбомоилфосфата, эта реакция идет при помощи фермента орнитинкарбомоилтрансферазы.
Б.При введении глутамата количество аммиака снизится за счет образования амидов дикарбоновых кислот. Образуется глутамин (безопасная форма транспорта аммиака к печени и почкам).
В. Суточное выделение мочевины снизится, так как не «работает» орнитиновый цикл, который является основным механизмом обезвреживания аммиака в организме.
126.Обнаружено, что вирус гриппа может вызывать нарушение синтеза фермента карбамоилфосфатсинтетазы I у детей.
А. Пользуясь метаболической картой, напишите уравнение реакции, катализируемой этим ферментом, укажите его органную и клеточную локализацию.
А. NН3+ СО2 + 2 АТФ à (карбомоилфосфатсинтетаза, кофермент биотин) образуется карбомоилфосфат.
Б. Реакция происходит в митохондриях клеток печени.
Гипераммониемия (содержания аммиака более 0,06 ммоль/л вызывает судороги, потерю сознания, рвота и т.д.
126.Альбиносы плохо переносят воздействие солнца, загар у них не развивается, а появляются ожоги, снижена острота зрения, светобоязнь. Какое нарушение метаболизма лежит в основе этого явления?
Альбинизм- врожденное отсутствие пигментов в коже, волосах и сетчатке глаз. Метаболический дефект связан с потерей меланоцитами способности синтезировать тирозиназу – фермент, катализирующий окисление тирозина в ДОФА и диоксифенилаланинхинон, являющихся предшественниками меланина.
128.У ребенка 1,5 мес. в крови содержание фенилаланина составляет 35 мг/дл (норма 1,4-1,9 мг/дл), содержание фенилпирувата в моче – 150 мг/сут (норма 5-8 мг/сут.).
А. На основании представленных данных сделайте вывод о заболевании, его причинах, и проявлениях;
Б. Напишите, используя метаболическую карту, реакцию, которая блокирована при этом заболевании.
А.Это свидетельствует о таком заболевании как фенилкетонурия.
При этом заболевании нарушается структура фермента фенилаланингидроксилазы или он вообще синтезируется. Этот фермент катализирует реакцию превращения фенилаланина в тирозин. Болезнь проявляется в виде нарушения умственного и физического развития, судорогами. Тяжелые проявления этой болезни объясняются токсическим действием фенилаланина, фенилпирувата и фенилактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина).
129.При анализе желудочного сока пациента обнаружено:
Какие заболевания можно предположить?
А. рН желудочного сока больше 6,0 свидетельствует о ахлоргидрии. Связано с потерей слизистой оболочки желудка обкладочных клеток, которые секретируют соляную кислоту.
Б.Молочная кислота в норме в желудочном соке отсутствует. Образуется она при уменьшении содержания или отсутствии соляной кислоты в результате размножения молочнокислых бактерий.
130.Цитруллинемия проявляется рвотой, судорогами, нарушениями сознания. Наследственный дефект какого из ферментов орнитинового цикла является причиной нарушений?
1. карбомоилфосфатсинтазы I.
Фермент – аргининсукцинатсинтетаза. Этот фермент в норме катализирует реакцию:
Цитруллин + аспартат + АТФ à аргинсукцинат +АМФ+ РР.
При его дефекте увеличивается содержание цитруллина в крови и моче, возникает тяжелая гипераммониемия после белковой нагрузке, т.к. снижаются количество орнитина в клетках и скорость орнитинового цикла.
131.Перечислите, используя метаболическую карту, реакцию синтеза мочевины, нуждающиеся в энергии АТФ. Сколько молекул АТФ затрачивается при синтезе 1 молекулы мочевины?
Как цикла Кребса восполняет расход АТФ?
1. NH3 + СО2 (карбомоилфосфатсинтетаза) (2 АТФ) à Карбомоилфосфат.
2. Цитруллин + аспартат (аргининсукцинатсинтетаза) (АТФ) à Аргининсукцинат.
Б. Фумарат – общий метаболит орнитинового цикла и ЦТК. В ЦТК: фумарат à малат àЩУК. при дегидрировании малата НАД-зависимой малатдегидрогназой образуется НАДН2, который в ЦПЭ обеспечивает образование 3 молекулы АТФ по механизму окислительного фосфорилирования.
132.Биогенные амины, продукты декарбоксилирования аминокислот, являются биологически активными веществами, выполняющими функции нейромедиаторов, гормонов, регуляторных факторов местного действия. Назовите аминокислоты, из которых ;образовались следующие биогенные амины и укажите их функции:
1. Серин à коламин à холин à фосфатидилхолин и ацетилхолин (возбуждающий медиатор вегетативной нервной системы);
2. Тирозин à катехоламиныà дофамин (медиатор среднего отдела мозга) и норадреналин и адреналин.
3. Глутамат à ГАМК – тормозной медиатор высших отделов мозга.
4. Гистидин à гистамин àмедиатор воспаления, аллергических реакций.
источник
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке — энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей.
Фенилкетонурия (ФКУ). Фенилаланин (ФА) принадлежит к числу незаменимых аминокислот. Только часть ФА используется для синтеза белков; основное количество этой аминокислоты окисляется до тирозина. Реакцию гидроксилирования ФА катализирует фермент – фенилаланингидроксилаза. Причина ФКУ – недостаточность этого фермента. В результате этого нарушения ФА не превращается в тирозин, из которого образуется фенилпировиноградной кислоты (ФПВК), которая выделяется с мочой и потом, вследствие чего от больных детей исходит «мышиный» запах. Высокая концентрация ФПВК приводит к нарушению формирования миелиновой оболочки вокруг аксонов в ЦНС. ФПВК является нейротропным ядом, в результате чего повышаются возбудимость, тонус мышц, развиваются гиперрефлексия, тремор, судорожные эпилептиформные припадки. Позже присоединяются нарушения высшей нервной деятельности, умственная отсталость, микроцефалия. У больных детей наблюдается слабая пигментация из-за нарушения синтеза меланина. Диагностика заболевания осуществляется биохимическими методами: ещё до развития клинической картины в моче определяется ФПВК, в крови — высокое содержание фенилаланина. В родильных домах обязательно проводится скрининг-тест на фенилкетонурию.
Алкаптонурия. Нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота — промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты — диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета — алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов — меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) — одного из ферментов, катализирующего метаболический путь образования меланинов.
Болезнь Хартнупа. Причина — недостаточность белков-переносчиков триптофана в кишечной стенке и почечных канальцах. Наблюдаются:повышенное образование индикана, который превращается в индиго синего цвета – симптом «голубых пеленок»; аминоацидурия; признаки пеллагры. нарушение психики. Лечение: полноценная белковая диета, прием никотинамида, предохранение от УФО.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения/презентации —«Энзимопатии обмена аминокислот. Генетический скрининг новорожденных».
Лекция № 3. Конечные продукты обмена простых белков.
План лекции:
1. Реакции образования аммиака в организме. Токсичность аммиака.
2. Способы обезвреживание аммиака в организме. Орнитиновый цикл. Диагностическое значение определения мочевины.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
Содержание лекционного материала:
1. Реакции образования аммиака в организме. Токсичность аммиака.
Источники аммиака в организме:
a) Дезаминирование аминокислот.
b) Дезаминирование биогенных аминов.
c) Дезаминирование пуриновых и пиримидиновых азотистых оснований.
d) Гниение аминокислот в кишечнике.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов.
Часть аммиака образуется в кишечникев результате действия бактерий на пищевые белки (гниение белков вкишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 25-40 мкмоль/л.
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
2. Способы обезвреживание аммиака в организме.
2.1. Локальный – в тканях. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в почки и печень.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутаратапод действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата.
2.2. 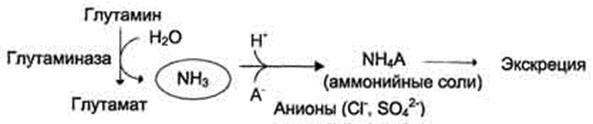
2.3. Орнитиновый цикл. Диагностическое значение определения мочевины.
Мочевина — основной конечный продукт азотистого обмена,в составе которого из организма выделяется до 90% всего выводимого азота. В норме концентрация мочевины в сыворотке/плазме крови – 2,61-8,35 ммоль/л (уреазный метод).
Мочевина выводится из организма с мочой. Азот мочевины составляет 85-90% от общего азота мочи. В норме у взрослых выводится мочевины с мочой 20-35 г/сут (330-580 ммоль/сут).
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название «орнитиновый цикл»,или «цикл Кребса-Гензелейта».
Суммарное уравнение синтеза мочевины:
NH3 + Аспартат + СО2 + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 АДФ +
В первой реакции процесса аммиак связывается с СО2 с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфосфатсинтетазы I. Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
Биологическая роль орнитинового цикла
Орнитиновый цикл в печени выполняет 2 функции:
· превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
· синтез аргинина и пополнение его фонда в организме.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови— гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемиясопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме).
Клинико-диагностическое значение исследования концентрации мочевины в сыворотке крови и моче.
Определение концентрации мочевины в сыворотке крови используется для оценки функции печени и выделительной функции почек. Критическая концентрация мочевины в крови: ˃28,0 ммоль/л. Причины увеличения концентрации мочевины в сыворотке крови:острые или хронические заболевания почек; обтурация мочевыводящих путей; снижение тока крови через почечные клубочки (застойная сердечная недостаточность, обширные ожоги, тяжелая диарея и рвота, инфаркт миокарда и др.); повышенный катаболизм белков (длительное голодание, кровотечения в ЖКТ, инфекции, канцерогенез, сахарный диабет и др.); снижение концентрации Cl — . Причины снижения концентрации мочевины в сыворотке крови: функциональная недостаточность печени (гепатит, цирроз, отравления мышьяком и др.); энзимопатии синтеза мочевины; повышенная скорость клубочковой фильтрации, обусловленная беременностью, чрезмерным объемом внутривенных инфузий, неадекватной секрецией антидиуретического гормона; мальабсорбция (целиакия). Влияющие факторы. Увеличение концентрации: диета с высоким содержанием белка, прием нефротоксичных лекарств, повышенный распад тканей при гипертиреозе, приеме глюкокортикоидов. Уменьшение концентрации:вегетарианская диета.
Определение концентрации мочевины в моче позволяет контролировать азотистый баланс у больных в тяжелом состоянии, получающих зондовое энтеральное и парентеральное питание. Корректно оценить азотистый баланс с использованием этого теста можно лишь при отсутствии тяжелой печеночной или почечной патологии. Увеличением концентрации мочевины в моче, указывающим на отрицательный азотистый баланс, сопровождаются: послеоперационный период, лихорадка; гипертиреоз; тяжелые острые или хронические соматические заболевания. Уменьшением, указывающим на положительный азотистый баланс, сопровождаются: беременность; период роста у детей; период восстановления после тяжелых заболеваний.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
Синтез креатина. Креатин необходим для образования в мышцах высокоэнергетического соединения — креатинфосфата. Синтез креатина идёт в 2 стадии с участием 3-х аминокислот: аргинина, глицина и метионина. В почкахобразуется гуанидинацетат при действии глицинамидинотрансферазы.Затем гуанидинацетат транспортируется в печень,где происходит реакция его метилирования:
SAM – S-аденозилметионин – активная форма метионина – донор СН3-группы.

 |
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Обнаружено три изоферментные формы креатинкиназы (КК-ВВ – мозговой тип, КК-МВ – сердечный тип, КК-ММ – мышечный тип). Измерение активности общей креатинкиназы и ее изоферментов используется в лабораторной диагностике.
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период.
Креатинин– это конечный продукт неферментативного превращения креатина и креатинфосфата, участвующих в энергообеспечении мышечного сокращения:
Креатинин выводится из организма через почки с мочой, относится к беспороговым веществам, которые поступают в мочу путем фильтрации и не реабсорбируются в канальцах. Нормы креатинина в сыворотке крови у взрослых: мужчины – 40-100 мкмоль/л, женщины – 44-88 мкмоль/л; креатинина в моче у взрослых — 4,4-17,7 ммоль/сут.
Клинико-диагностическое значение исследования концентрации креатина и креатинина в сыворотке крови и моче. Гиперкреатининемия – увеличение уровня креатинина в крови обусловлено как усиленным образованием, так и задержкой его в организме. Критическая концентрация креатинина в сыворотке крови: ˃400 мкмоль/л. Ретенционная гиперкреатининемия обусловлена нарушением (острым и хроническим) функции почек любого происхождения. Продукционная гиперкреатининемия отмечается при кишечной непроходимости, декомпенсации деятельности ССС, пневмонии, лихорадочных состояниях, гипертиреозе, голодании, усиленной мышечной работе. Снижение уровня креатинина в сыворотке крови коррелирует с уменьшением мышечной массы (мышечные дистрофии и атрофии, параличи и др.). Увеличение суточного выведения креатинина с мочойуказывает на увеличение почечной фильтрации и/или повышенное образование креатинина в скелетных мышцах. Увеличением концентрации сопровождаются: усиленная мышечная работа, лихорадочные состояния, пневмония, акромегалия, сахарный диабет, острые инфекционные заболевания. Уменьшение выведения креатинина с мочой наблюдается при мышечной атрофии, параличах, хронических заболеваниях почек, острой почечной недостаточности, голодании. В моче помимо эндогенного креатинина содержится экзогенный креатинин, поступающий в организм с мясной пищей. На концентрацию креатинина в крови и моче влияет характер диеты: преимущественно мясная диета приводит к увеличению, и наоборот, вегетарианская диета – к снижению концентрации креатинина в крови и моче.
Креатинемия (креатин + греч. haima кровь) — наличие в крови креатина. В плазме взрослого человека концентрации креатина в норме составляет 15,25—76,25 мкмоль/л. Повышение уровня креатина в крови (гиперкреатинемия) может быть при избыточном употреблении мяса, а также при заболеваниях мышечной системы, при кишечной непроходимости. поражениях печени. Креатинв моче взрослых людей в норме практически отсутствует. В первые годы жизни ребенка возможна «физиологическая креатинурия». По-видимому, появление креатина в моче детей раннего возраста обусловлено усиленным синтезом креатина, опережающим развитие мускулатуры. Некоторые исследователи к физиологическим явлениям относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При концентрации креатина в плазме крови свыше 122,0 мкмоль/л он начинает выделяться с мочой. Наибольшее содержание креатина в моче наблюдается при патологических состояниях мышечной системы и прежде всего при миопатии, или прогрессирующей мышечной дистрофии. Принято считать, что креатин в моче (креатинурия) больных миопатией может появляться в результате нарушения в скелетной мускулатуре процессов его фиксации (удержания) и фосфорилирования. Если нарушен процесс синтеза фосфокреатина, то не образуется и креатинин; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель мочи: (количество креатина + количество креатинина)/(количество креатинина). В норме этот показатель близок к 1,1.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения презентации«Энзимопатии цикла синтеза мочевины. Лабораторная диагностика гипераммониемии».
Дата добавления: 2015-10-01 ; просмотров: 1551 | Нарушение авторских прав
источник