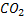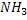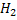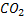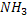Альбинизм – наследственное заболевание, обусловленное геномными мутациями, в результате которых снижается выработка или полностью отсутствие меланина. Это вещество отвечает не только за оттенок кожи человека, но и лежит в основе пигмента радужки глаз. Отсутствие меланина объясняется неспособностью меланоцитов к его продуцированию в результате неактивации тирозиназов.
Заболевание известно еще издавна, способно поражать людей любых рас и половой принадлежности. Несмотря на это, клиницисты отмечают различную статистику в частоте возникновения патологии у разных народностей от 1:10000 до 1:1500000. Статистика неоднозначна и при различных формах альбинизма.
Альбинизм относится к врожденным патологиям. Геномные мутации происходят еще в период внутриутробного развития, вне зависимости от пола ребенка. Механизм развития меланиновой недостаточности обусловлен отсутствием блокады особого фермента — тирозиназы, который участвует в регуляции и распределении меланина по кожным покровам, волосам, радужке глаз. Нередко вместе с альбинизмом у пациентов отмечаются сочетанные патологии и состояния:
- нарушение репродуктивной функции;
- снижение зрения вплоть до слепоты;
- нарушение психоэмоционального развития.
Генетическое заболевание альбинизм передается по наследству. Путь передачи геномных мутаций полностью зависит от форм и типа заболевания. Сочетанные осложнения при альбинизме проявляются сниженным зрением и нарушением психического развития. По другим критериям пациенты не отличаются от других людей.
Классификация генной болезни – альбинизма определяется по формам и видам заболевания, исключая возрастные критерии и оценку общего клинического анамнеза пациента. Выделяю такие формы:
- Тотальное поражение. Альбинизм манифестируется с периода новорожденности, когда имеет место абсолютная меланиновая недостаточность во всех тканях человеческого тела (кожа, волосяной покров, ногтевые пластины, глазные структуры).
- Неполное поражение. Клиницисты именуют состояние альбиноидизмом, когда у пациентов отмечается сниженная пигментация волос, внешнего дермального слоя, радужной оболочки глаз. Тип наследования по аутосомно-доминантному типу. Тирозиназная активность резко снижена, но не блокирована полностью.
- Частичность в проявлении. Именуется как пиебалдизм, который отмечается сразу же после рождения ребенка. Форма нередко сопутствует другим патологическим отклонениям или является их симптомом. Локализация кожных изменений определяется кожей живота, лицевых структур, нижних конечностей, волос на голове.
Полный альбинизм формируется на фоне генетического дефекта на коже, волосах и органах зрения. При частичном альбинизме отмечается меланиновая недостаточность только в системе органов зрения. В результате многолетних исследований выявили и некоторые типы полного и частичного альбинизма.
Имеет место развитие глазной или кожно-глазной форм. Симптоматические проявления по кожно-глазному типу характеризуют течение ксантизма. Классификация альбинизма происходит и по типу геномных мутаций, что выражается в течении патологии и ее симптоматическом проявлении. Так, выделяют несколько типов заболевания:
- 1 тип. Геномные нарушения в 11 хромосомной единице. Кожа и волосы обретают цвет топленого молока, а глаза серого или голубого оттенка.
- 2 тип. Мутационные изменения происходят в 15 хромосоме. Кожа может иметь белый или коричневатый оттенок. Волосы же желтые, золотистые, красного оттенка. Цвет глаз пациентов может быть желтовато-белым или серо-голубым. Тип встречается у жителей близ Сахары, индейцев или афроамериканской расы Северной Америки. Кожа таких людей покрыта веснушками от малейшего воздействия солнечных лучей.
- 3 геномный тип. Мутация происходит в 9 хромосоме, представляет собой очень редкое явление. Кожа неравномерно коричневая, имеет красноватый оттенок. Глаза багрового или красноватого оттенков, рыжеватые или медные волосы. Заболевание встречается у людей, которые живут на юге Африканского континента.
- 4 геномный тип. Геномные нарушения в 5 хромосоме. Крайне редкий клинический случай, свойственный пациентам, живущим в южной или восточной Азии. Симптоматика наследственного глазного или кожно-глазного альбинизма аналогична 2 типу.
Изменение пигментации кожи всегда неравномерно. Так, при 2 или 3 типе кожные покровы покрываются коричневыми пятнами различной локализации. Цвет волос и радужки глаз тоже неровный, имеет в сочетании сразу несколько оттенков.
Учитывая наследственность патологии, клинические проявления отмечаются уже с первых дней жизни ребенка. Выделяют следующие общие признаки альбинизма для всех его форм:
- бледность кожных покровов;
- просвечивание сосудов через дерму;
- голубой или красноватый оттенок глаз при разных ракурсах;
- первородный пушок молочно-белого оттенка;
- сниженная реакция на источник света или полное его отсутствие.
По мере роста ребенка симптомы сохраняются. При появлении волос их цвет становится соломенным или белым в зависимости от типа течения патологии. В отдельных случаях выработка меланина полностью восстанавливается, окрашивая глаза, волосы в ровные насыщенные оттенки. Снижение зрительной способности становится более выраженным, может возникать косоглазие, нистагм, астигматизм. Отсутствие меланоцитов провоцирует развитие светобоязни и развитие дневной слепоты.
При подозрении на альбинизм достаточно физикального осмотра пациента, изучения жалоб по поводу косоглазия, светобоязни, солнечных ожогов, сильного нарушения зрения. Далее назначается биохимическое исследование волосяных луковиц на количество тирозиназы для подтверждения альбинизма и типа патологии.
Дополнительно проводят специальные дерматологические тесты, оценивают состояние зрения пациента, его способность к нормальному психическому развитию. Окончательно диагноз выставляется на основании данных молекулярно-генетического исследования.
На данный момент не существует какого-то особенного лечения альбинизма любого типа. Терапия направлена на улучшение качества жизни пациента, сохранение нормального уровня зрения. Пациенты должны беречь глаза, обязательно соблюдая рекомендации врача и используя защитные очки, линзы, другие оптические изделия. Возможно назначение пожизненной медикаментозной коррекции, а лечение должно быть схематичным, курсовым. Прогноз при заболевании обычно благоприятный при условии системного поддержания здоровья.
Дисциплинированность пациента в отношении собственного здоровья, регулярные посещения офтальмолога и врача-дерматолога вполне способны позволить человеку социально адаптироваться и прожить полноценную жизнь. В отдельных случаях может потребоваться помощь психолога из-за имеющихся дефектов внешности на фоне нетипичной пигментации. Для устранения дефектов или смягчения их проявлений следует использовать местные средства.
источник
Тирозин, помимо участия в синтезе белков, является предшественником гормонов надпочечников адреналина, норадреналина, медиатора дофамина, гормонов щитовидной железы тироксина и трийодтиронина, пигментов. Нарушения катаболизма тирозина многочисленны и называются тирозинемии.
Тирозинемия типа I (гепаторенальная тирозинемия) возникает при недостаточности фумарилацетоацетат-гидролазы . При этом накапливается фумарилацетоацетат и его метаболиты (сукцинилацетон), поражающие печень и почки. Частота заболевания 1:100-120 тыс новорожденных.
Существует две формы – острая и хроническая.
Острая форма составляет большинство случаев этой тирозинемии с началом в возрасте 2-7 мес и смертью 90% больных в возрасте 1-2 года из-за недостаточности печени.
К симптомам относится гипотрофия, рвота, «капустный запах» от тела и мочи, задержка развития, кровоточивость, диарея, мелена, гематурия, желтуха, анемия, периферические невропатии и параличи, кардиомиопатия, слабость мышц, дыхательные нарушения. Отмечают гипогликемию вследствие гиперплазии островковых клеток поджелудочной железы.
При хронической форме болезнь развивается позднее, медленнее прогрессирует. Продолжительность жизни около 10 лет.
Наблюдаются гипотрофия, узелковый цирроз печени и печеночная недостаточность, множественные дефекты почечной канальцевой реабсорбции с появлением синдрома Фанкони (щелочная рН мочи, глюкозурия, протеинурия), аминоацидурия, лейкопения, тромбоцитопения.
Из-за поражения печени и почек возникают проявления рахитоподобных заболеваний (остеопороз, остеомаляция). В результате печеночной недостаточности возникают симптомы, напоминающие острую порфирию. Непостоянными признаками являются умственная отсталость и неврологические изменения.
Лекарственным средством является нитизинон , конкурентный ингибитор 4-гидроксифенилпируват-диоксигеназы. В результате прекращается образование гомогентизиновой кислоты и ее дальнейший распад. Также используется диета со снижением количества фенилаланина и тирозина, инъекции глутатиона.
Гораздо более редкое заболевание по сравнению с тирозинемией I типа.
Тирозинемия типа II (глазокожная тирозинемия) возникает при недостаточности тирозин-аминотрансферазы .
Наблюдается задержка умственного и физического развития, микроцефалия, катаракты и кератоз роговицы (псевдогерпетический кератит), гиперкератоз кожи, членовредительство, нарушение тонкой координации движений.
Поражения почек и печени не наблюдается.
Эффективна диета с низким содержанием тирозина, при этом поражения кожи и роговицы быстро исчезают.
Тирозинемия III типа – результат генетического дефекта 4-гидроксифенилпируват-диоксигеназы . Зафиксировано лишь несколько случаев этой болезни.
Характерные особенности включают умеренную умственную отсталость, судороги и периодическую потерю равновесия и координации (прерывистая атаксия).
Тирозинемия новорожденных – результат кратковременного снижения активности 4- гидроксифенилпируват-диоксигеназы . Чаще наблюдается у недоношенных детей.
Наблюдается сниженная активность и летаргия. Аномалия считается безвредной. Дефицит аскорбиновой кислоты усиливает клиническую картину.
Диета со снижением количества белка, фенилаланина, тирозина и высокие дозы аскорбиновой кислоты (100 мг/день).
Генетическая аутосомно-рецессивная энзимопатия. В основе заболевания лежит снижение активности печеночного фермента гомогентизат-оксидазы , в результате в организме накапливается гомогентизиновая кислота.
Так как гомогентизат на воздухе окисляется и полимеризуется в меланиноподобное соединение, то наиболее частым и постоянным симптомом является темная моча, на пеленке и нижнем белье остаются темно-коричневые пятна. Другим образом в детском возрасте болезнь не проявляется.
С возрастом гомогентизиновая кислота, накапливается в соединительно-тканных образованиях, склерах и коже, вызывает шиферно-глубокий оттенок ушного и носового хрящей (охроноз), окрашивает одежду, контактирующую с потеющими участками тела (подмышки).
Из-за связывания гомогентизата с коллагеном ухудшается состояние соединительной ткани, что делает хрупкими хрящевые образования. После 30 лет развивается дегенеративный артрит позвоночника и крупных суставов (бедренные, коленные), межпозвонковые пространства сужены, снижается минеральная плотность костей. Может наблюдаться поражение почек и сердца.
Хотя эффективные способы неизвестны, по аналогии с другими аминокислотными нарушениями рекомендуется с раннего возраста ограничить потребление фенилаланина и тирозина, что должно препятствовать развитию охроноза и суставных нарушений. Назначают большие дозы аскорбиновой кислоты для снижения связывания гомогентизиновой кислоты в соединительной ткани. Предлагается использовать препарат нитизинон , конкурентный ингибитор 4-гидроксифенилпируват-диоксигеназы.
Заболевание обусловлено полным или частичным дефектом синтеза фермента тирозиназы (частота 1:20000), необходимой для синтеза диоксифенилаланина и далее меланинов в пигментных клетках.
При полном отсутствии фермента наблюдается тотальная депигментация кожи, волос, глаз, причем окраска одинакова для всех расовых групп и не меняется с возрастом. Кожа не загорает, совершенно отсутствуют невусы, какие-либо пигментные пятна, развиваются фотодерматиты. Сильно выражены нистагм, светобоязнь, дневная слепота (т.к. имеется депигментация сетчатки и ускоренный распад родопсина), красный зрачковый рефлекс.
При частичной недостаточности фермента отмечаются светло-желтые волосы, слабо пигментированные родинки, очень светлая кожа.
Рекомендуется использовать различные средства защиты от ультрафиолетовых лучей.
Биохимической причиной паркинсонизма (частота после 60 лет 1:200) является низкая активность тирозин-гидроксилазы или ДОФА-декарбоксилазы в нервной ткани, при этом развивается дефицит нейромедиатора дофамина и накопление тирамина.
Наиболее распространенными симптомами являются ригидность мышц, скованность движений, тремор и самопроизвольные движения.
Требуется систематическое введение лекарственных аналогов дофамина и применение ингибиторов моноаминоксидазы.
источник
Альбинизм представляет собой генетическое состояние, также называемое ахромией, ахромазией или ахроматозом. Оно характеризуется недостаточной выработкой меланина, а также частичным или полным отсутствием пигмента в коже, волосах и глазах.
Это наследственное расстройство может развиться как у человека (поражает представителей любых рас), так и у млекопитающих, птиц, рыб, рептилий и земноводных.
Хотя альбинизм считается наследственным состоянием, в большинстве случаев он не отмечен в семейной истории.
Люди-альбиносы часто имеют проблемы со зрением, они очень чувствительны к солнечному излучению и имеют высокую вероятность к возникновению рака кожи, если своевременно не защищаются от прямых солнечных лучей. Согласно данным Национальной Организации Альбинизма и Гипопигментации (NOAH – National Organization for Albinism and Hypomelanosis), в США случаи появления полного альбинизма регистрируется с частотой 1:16-20 тыс. населения, и в соотношении 1:20-25 тыс. – при частичном альбинизме.
С самого рождения люди-альбиносы практически не имеют пигмента в коже, глазах и волосах (окулокутанный альбинизм) или только в глазах (окулярный альбинизм). Степень пигментации в каждом случае варьирует. Некоторые люди приобретают небольшую пигментацию волос или глаз с возрастом. У других формируются окрашенные цветом веснушки на коже. Лица с полным отсутствием меланина называются альбиносами. Альбиноиды – люди с очень маленьким количеством меланина.
Люди с альбинизмом достаточно бледны, у них очень светлые волосы и обесцвеченные глаза. Иногда их глаза даже приобретают красный или пурпурный цвет, что зависит от количества пигмента. Это происходит вследствие того, что в радужной оболочке практически нет цвета, а глаза кажутся розовыми или красными из-за просвечивающих через радужку сосудов внутри глаза. Впрочем, люди с альбинизмом в остальном так же здоровы, как и остальное население. Но нельзя не обратить внимание на распространенные среди альбиносов проблемы со зрением и кожей.
Проблемы со зрением. Они возникают благодаря патологическому развитию сетчатки (гипоплазия центральной ямки) и аномальным системам нервного сообщения между глазом и головным мозгом: полный перекрест зрительных нервов, в то время как в норме – частичный. При альбинизме могут выявляться: нистагм и прозрачность радужки, а также снижение остроты зрения, косоглазие, нарушение бинокулярного зрения, повышенная чувствительность к световому воздействию – светобоязнь.
Проблемы с кожей. Темный пигмент меланин помогает защищать кожу от ультрафиолетового излучения солнечного света. Альбиносы не имеют этого пигмента, поэтому их кожа крайне чувствительна к прямому солнечному свету. Необходимо предпринимать меры предосторожности, чтобы избежать ожогов кожи, а именно использовать солнцезащитные средства, обязательно носить головные уборы и специальную одежду.
- К первой группе относятся тирозиназонегативный полный альбинизм (тип I) и тирозиназопозитивный полный альбинизм (тип II). Причина – мутации гена тирозиназы (тип I) или гена Р (тип II), которые приводят к нарушению образования меланина из тирозина. В зависимости от характера мутации возможны депигментация, гипопигментация, желтая пигментация кожи, а также так называемая термозависимая форма альбинизма.
- Ко второй группе относятся заболевания, обусловленные дефектами мембран меланосом и других органелл. Синдром Чедиака-Хигаси: гипо- или депигментация кожи, волос и глаз, тромбоцитопения, гигантские гранулы в лейкоцитах, снижение бактерицидной активности нейтрофилов и частые бактериальные инфекции. Синдром Хержманского-Пудлака: гипо- или депигментация кожи, волос и глаз, нарушения агрегации тромбоцитов из-за недостатка в них плотных гранул, кровоточивость.

Исследователи уже определили, какие именно гены участвуют в процессе. Они расположены в аутосомах. Аутосомы представляют собой хромосомы, одинаковые у мужчин и женщин и содержащие гены основных характеристик организма.
Гены несут в себе информацию, формирующую индивидуальные особенности человека. В норме у нас есть две копии хромосом и генов: одни наследуются от отца, а другие – от матери. Альбинизм имеет аутосомно-рецессивный путь наследования. И для того, чтобы ребенок родился альбиносом, оба родителя должны иметь дефектный ген. Если ни один из родителей не страдает альбинизмом, но у обоих есть этот ген, то вероятность что у ребенка будет альбинизм составляет 1:4 .
Большинство альбиносов имеют светлую кожу, волосы и глаза. Однако нельзя ставить диагноз лишь по внешнему виду. Как правило, его определяют по наличию патологии зрения. Таким образом, главный тест по диагностике альбинизма – анализ зрения, который в обязательном порядке выявляет наличие нистагма, прозрачность радужки, соответствующие изменения глазного дна.
Пренатальная диагностика. Для пар, которые не имеют детей-альбиносов, не существует прямого теста на определение носителя дефектного гена. Масштабные генетические исследования не дали никаких результатов, поэтому сегодня нет эффективных анализов для пренатального определения альбинизма. Но для пар, которые уже имеют ребенка-альбиноса, существует тест, в ходе которого проводится амниоцентез (ввод иглы в матку для взятия на пробу околоплодных вод) и взятие хорионических ворсинок. Клетки околоплодных вод исследуются на предмет наличия гена альбинизма от обоих родителей.
Дополнительными методами диагностики являются:
- Исследование крови. При этом основное внимание обращают на тромбоциты, которы могут иметь функциональные, морфологические и биохимические дефекты. Признаки патологических изменений тромбоцитов, наряду с изменениями пигментации, известны как синдром Хержманского-Пудлака. Наиболее часто он выявляется у голландцев, пуэрториканцев и жителей юго-восточной Индии.
- Световая и электронная микроскопия помогают в дифференциации альбинизма I и II типов.
Излечить расстройство на сегодняшний день нельзя, поэтому основное внимание при этом заболевании уделяют мерам, способствующим профилактике осложнений.
- Необходимо избегать воздействия прямого солнечного света, особенно в часы наибольшей интенсивности излучения (с 10 до 15 часов), использовать специальные солнцезащитные очки, мази для кожи и помаду для губ с высокой степенью защиты, одежды и шляп.
- Применение ретиноевой кислоты (третиноин) для профилактики развития злокачественных опухолей кожи и солнечной геродермии. При этом важно защищать обработанные участки кожи от солнечного света, иначе эффект будет прямо противоположным ожидаемомму.
- Регулярные ежегодные осмотры дерматологом с целью профилактики, раннего выявления и лечения солнечной геродермии и рака кожи.

Общество в первую очередь должно предпринять попытки принятия людей-альбиносов такими, какие они есть. Дети и взрослые с альбинизмом должны состоять в группах поддержки, чтобы улучшить свое моральное состояние, учиться позитивному восприятию происходящего.
источник
Альбинизм – это наследственная болезнь, которая очень ярко проявляется в белом «неестественном» цвете кожи, волос и глаз. Если среди азиатов и европейцев данная патология – редкое явление, по статистике 1 человек на 20 000 только может страдать этим заболевание, то в Африке, вопреки всем законам логики, альбиносом является 1 человек из 4000 в Танзании и ЮАР, а в Нигерии -1 из 1100.
Африканцы до сих пор живут во тьме суеверий и невежества относительно этой болезни. С одной стороны они считают альбинизм – проклятием, с другой стороны, что он приносит удачу. Самое страшное то, что в Танзании до сих пор идет торговля органами альбиносов, части их тела продают шаманам и колдунам, которые делают различные снадобья из органов и «рекламируют» их от всяких бед. С целью спасения людей альбиносов создаются закрытые интернаты, за стены которых они не могут и не хотят выходить в целях своей же безопасности.
Настолько ли страшна эта болезнь? Откуда появляется это светлый ген у негров? Обо всем этом мы будем разбираться в нашей статье.
Известно, что в данной болезни задействован механизм мутации генов, поэтому в этом нам поможет разобраться 2 науки генетика и биохимия.
В нашем организме присутствует аминокислота тирозин, который отвечает за синтез пигмента меланина. Синтез меланина включает в себя следующие стадии:
- Тирозин «доставляют» через мембрану меланосом к ферментам, которые будут взаимодействовать с аминокислотой. «Доставку» осуществляет Р-белок.
- Тирозин вступает в обменные реакции с ферментом тирозиназа, который отвечает за количество вырабатываемого пигмента;
- Далее идет взаимодействие ферментами TRP 2 и TRP1, которые образовывают эумеланин и феомеланин. За черный и коричневый цвет кожи несет ответственность эумелани, а за желтый и красный – феомеланин.
Биохимическая причина альбинизма заключается в ферменте тирозиназа. Этот фермент провоцирует развитие тирозиназа- позитивного/негативного альбинизма. Негативный развивается, если в волосяных луковицах отсутствует тирозиназа, в противном случае развивается позитивный.
Генетика определяет цвет кожи человека, до конца неизвестно, какие именно мутации происходят с генами, отвечающими за выработку тирозиназы, потому что существует альбинизм с нормальным синтезом этого фермента.
Ученые считают, что механизм развития альбинизма зависит от разнообразных генных мутаций, связанных также с ответственными генами за фермент энзим и других.
Ребенок рождается данной патологией, в случае если оба родителя имеют дефектный ген, т.е наследование осуществляется по аутосомно-рецессивному типу.
Результат этих мутаций один, в коже отсутствует пигмент меланин, который защищает кожу и глаза от ультрафиолетового излучения.
Существует различные виды альбинизма, которые определяют степень последствия для каждого больного человека.
В зависимости от вовлеченности клеток в патологический процесс выделяют глазной и 3 типа глазокожного альбинизма.
Глазо-кожный альбинизм первого типа (ГКА 1) возникает из-за того, что 11 хромосоме в результате мутации происходит трансформация здорового гена в кодирующий ген, который препятствует полному либо частичному синтезу фермента тирозиназы. Если происходит полное прекращение синтеза, то это относится к подтипу 1 А, который имеет самые тяжелые последствия и проявления. При данном типе ребенок рождается с абсолютно бело-молочной кожей и волосами, на теле ребенка нет ни одной родинки, глаза голубые, его кожа никогда не сможет загореть.
Подтип 1В характеризуется лишь частичным синтезом тирозиназы, она вырабатывается лишь в количестве 20-30% от нормы. Симптомы присутствуют с самого рождения, но наблюдается малая пигментация кожи, ребенок может иметь желтоватого цвета волоса, так называемый желтый или платиновый альбинизм. С годами кожа и волосы могут приобретать цвет, в ряде случаев кожа получает небольшой загар и могут появляться родинки.
Отсутствие меланина в пигментом слое сетчатки глаза приводит к тому, что развивается в обоих подтипах нистагм – быстрое неконтролируемое движение глаз, острота зрения не превышает 0,1-0,2 при норме 1, появляется светобоязнь.
У подтипа 1В существует свой подтип температуро-чувствительный (теплозависимый) альбинизм. Данная форма формируется под влиянием температуро-чувствительного фермента, который образовался в результате мутации гена тирозиназы. В отличие от здорового фермента, теплозависимая тирозиназа «капризничает» при повышении температуры. Проявляется это в том, что в холодных местах тела (конечности) волосы темные, т.е фермент участвует в синтезе меланина, в теплых же местах – под мышками, на голове – они остаются белыми (меланин не вырабатывается), со временем они могут пожелтеть.
Когда ребенок рождается, температура его тела более высокая, чем температура взрослых людей, поэтому теплозависимая форма альбинизма проявляется со временем. Пигмент начнет вырабатываться на конечностях в случае «похолодания», но изменения будут происходить только на коже, глаза являются «теплолюбивым» органом.
Глазо-кожный альбинизм второго типа (ГКА 2) не затрагивает ген, контролирующий синтез тирозиназы, т.е. фермент вырабатывается в достаточном количестве, он находится в волосяных луковицах. Мутация происходит в гене, находящимся на хромосоме 25 и контролирующем мембранный Р –белок (он отвечает за транспортировку фермента и ионов).
В всех странах этот тип наиболее распространен. Отличительными признаками этой разновидности является то, что с возрастом кожа, волосы начинают темнеть, т.е. происходит пигментация, количество вырабатываемого пигмента зависит от расовой принадлежности, по мере увеличения пигмента повышается острота зрения.
Для европейцев характерно появление веснушек, родинок, пигментных пятен. У негроидной расы возможно появление коричневой окраски кожи и волос, на чаще цвет волос у них желтый.
Характерным является развитие амблиопии — обратимого нарушения глаз, при котором функционирует только один глаз.
Глазо-кожный альбинизм третьего типа (ГКА 3) – это достаточно редкий вариант альбинизма, связанный с мутацией гена, контролирующего выработку TRP1 фермента, в результате снижается концентрация этого фермента и происходит купирование синтеза эумеланина, отвечающего за коричневую окраску. Проявления этой болезни схожи с проявлениями первого типа, но они более умеренные. У новорожденного присусвует слабая окраска кожи и волос, с возрастом может произойти увеличение в коже пигмента. Кожа воспринимает загар и на ней присутствуют родинки, глаза страдают горазда меньше, чем в вышеописанных типах.
Глазной альбинизм, как следует из названия, от него страдают только глаза, кожа может быть чуть светлее, чем у родителей. Отсутствие пигмента в сетчатке приводит к тому, что ухудшается зрение, развиваются рефракционные дефекты, нистагм , косоглазие и много других зрительных аномалий.
Отличие глазного альбинизма от глазо–кожных типов в том, что носителями деформированного гена являются женщины, а болеют мужчины. Женщины лишь могут иметь слабые проявления болезни, в виде пятен на глазном дне и прозрачной радужки.
Мутация происходит с геном, отвечающим за формирование гликобелка, в результате мутации он кодируется и меланосомы, которые содержат меланин не созревают.
Кроме того крайне редко встречаются формы альбинизма, совмещенные с различными патологиями организма, выделяют следующие синдромы:
Синдром Хермански—Пудлака — заболевание, характеризуется альбинизмом и низкой свёртываемостью крови. Цвет кожи проявляется индивидуально от почти нормального до белого, присутствуют различные зрительные дефекты. Оба родителя имеют дефектный ген.
Синдром Чедиака—Хигаси — заболевание, которое характеризуется частичным альбинизмом и низким иммунитетом.
Мутации, происходящие в генах, отвечающих за производство Р-белка и вызывающих ГКА 2 типа, могут быть частью мутации происходящей в генах PWS и AS, а эти мутация вызывают Синдром Прадера-Вилли и синдром Ангельмана, около 1 % людей с этими синдромами имеют также альбинизм.
Для этих синдромов характерны умственные нарушения, пониженное давление и др.
По степени вовлеченности кожных покровов различают:
- Полный альбинизм – это весь кожный покров страдает от болезни;
- Частичны, который имеет название пьебалдизм, характерными признаками у новорожденного является белая(седая) прядь волос и белые пятна различного размера по всему телу, в некоторых пятнах могут быть вкрапления нормальной кожи. Эти пятна остаются с человеком на всю жизнь, солнце их может чуть-чуть подкорректировать. Отличие от витилиго заключается в том, что это врожденная болезнь, а не приобретенная. В некоторых случаях частичный альбинизм сочетается с глухотой и неврологическими отклонениями.
Эта патология сама по себе не угрожает жизни пациента, но солнце несет прямую угрозу для человека-альбиноса, поэтому основная задача защитит человека от солнца, потому что иначе больной долго не проживет. В Африканских бедных странах длительность их жизни составляет около 40 лет из-за того, что просто нет солнцезащитных кремов. Врачи, обследовавшие африканцев-альбиносов, заметили, что к 16-18 годам они практически все слепые и у многих развивается рак кожи.
Основное лечение включает в себя – солнцезащитный крем, солнцезащитные очки, полный запрет на загар.
Не смотря на то, что биохимия и генетика возникновения альбинизма изучается специалистами, на данный момент исправить мутацию невозможно, поэтому эффективного лечения этой болезни нет.
источник
Причина заболевания — дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота — 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено.
Причина метаболического нарушения — врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний. При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы:
заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) — леводопа, мадопар, наком и др.
подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
Конечные продукты обмена белков:
C, H, O, N , S. – CO2 , H2O, NH3, H2S.
Соли аммония выводятся с мочой:
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой .
Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
В печени – синтез мочевины ( в следующих вопросах будет подробно описано. Честно говоря, странный вопрос – скорее всего надо просто сказать где образуется.)
Вопрос №38. Основные источники и пути обезвреживания аммиака в организме.
Непрямое дезаминирование(основной путь дезаминирования амк)
Окислителное дезаминирование глутамата
Окислителное дезаминирование амк(малозначимый путь дезаминирования)
неокислительное дезаминирование Гис,Сер ,Тре
окислительное дезаминирование (путь инактивации биогенных аминов)
гидролитическое дезаминирование АМФ
гниение белков в кишечнике в результате действия бактерий на пищевые белки.
Пути обезвреживания:связывание аммиака с образованием нетоксичных соединений,которые выводятся из организма вместе с мочой
Синтез глутамина под действием глутаматсинтетазы
Синтез аспарагина под действием аспарагинсинтета
Синтез мочевиы в печени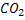
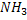
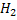
Восстановительное аминирование а-кетоглутарата
Вопрос №39 Роль глутамина в обезвреживании и транспорте аммиака в организме.
глутамин образуется при обезвреживании аммиака (мышцы, мозг, печень)Связывание аммиака глутамином протекает во всех тканях организма
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии и транспортируется из тканей в кровь.
Вопрос №40 Глутамин как донор амидной группы при синтезе ряда соединений.
Высокий уровеньглутамина в крови и легкость его поступления в клетки обусловливают использования глутамина во многих анаболических процессах
Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений
Вопрос №41 Синтез мочевины, химизм, ферменты, энергетика, происхождение атомов азота в мочевине
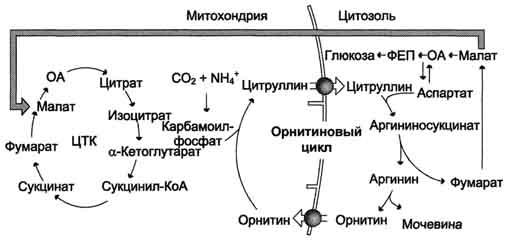
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла.Источник первого азота-аммиак. Аспартат — источник второго атома азота мочевины
Вопрос №42 Связь орнитинового цикла с циклом трикарбоновых кислот.
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины. ЦЦ
ЦТК и орнитиновый цикл протекают в печени.
Вопрос№43 Нарушение синтеза и выведения мочевины. Гипераммониемия, происхождение
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла
Наследственные нарушения орнитинового цикла и основные их проявления
Карбамоил- фосфат- синтетаза I
В течение 24-48 ч после рождения кома, смерть
Орнитин- карбамоил- трансфераза
Гипотония, снижение толерантности к белкам
Аргинино- сукцинат- синтетаза
Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки
Гипераммонимия, атаксия, судороги, выпадение волос
Аргини- носукци- нат, Глн, Ала, Лиз
Основной диагностический признак — повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме — 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Вопрос№44 Определение мочевины в сыворотке крови, принцип метода, диагностическое значение. Количество морчевины в сыворотке крови определяется уреазным методом
Под действием уреазы мочевина распадается на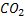
Значение:при повышении концентрации мочевины , которое встречается при хронических поражениях почек, усиленном распаде белков в тканях, непроходимости кишечника ,закупорке мочевыводящих путей.Снижение уровня мочевины наблюдается при голодании, безбелковой диете, ферментных дефектах мочеобразования.
45. Образование и выведение солей аммония. Глутаминаза почек
Почка располагает рядом ферментных систем, разрушающих глутамин, но, подобно большинству реакций анаболизма аминокислот, синтез глутамина не осуществляется. Глутамин доставляется к почкам током крови. Клетки почек жадно поглощают из циркулирующей крови глутамин, который образуется в основном за счет аммиака клеток печени. В почках же аммиак образуется преимущественно из глутамина, так что последний можно рассматривать как нетоксичную форму аммиака, который совершает челночные движения между печенью и почками. Глутаминаза почек действует подобно глутаминазе печени, освобождая глутамат и NH3 путем простой реакции гидролиза Однако фермент почек отличается тем, что его активность значительно возрастает под влиянием неорганического фосфата. Образующийся глутамат может, конечно, подвергаться затем дезаминированию при участии глутаматдегидрогеназы, так что из глутамина в конечном итоге образуются две молекулы аммиака.
В общем регулирует кислотно-щелочное равновесие в организме и задерживает натрий и калий.
источник
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке — энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей.
Фенилкетонурия (ФКУ). Фенилаланин (ФА) принадлежит к числу незаменимых аминокислот. Только часть ФА используется для синтеза белков; основное количество этой аминокислоты окисляется до тирозина. Реакцию гидроксилирования ФА катализирует фермент – фенилаланингидроксилаза. Причина ФКУ – недостаточность этого фермента. В результате этого нарушения ФА не превращается в тирозин, из которого образуется фенилпировиноградной кислоты (ФПВК), которая выделяется с мочой и потом, вследствие чего от больных детей исходит «мышиный» запах. Высокая концентрация ФПВК приводит к нарушению формирования миелиновой оболочки вокруг аксонов в ЦНС. ФПВК является нейротропным ядом, в результате чего повышаются возбудимость, тонус мышц, развиваются гиперрефлексия, тремор, судорожные эпилептиформные припадки. Позже присоединяются нарушения высшей нервной деятельности, умственная отсталость, микроцефалия. У больных детей наблюдается слабая пигментация из-за нарушения синтеза меланина. Диагностика заболевания осуществляется биохимическими методами: ещё до развития клинической картины в моче определяется ФПВК, в крови — высокое содержание фенилаланина. В родильных домах обязательно проводится скрининг-тест на фенилкетонурию.
Алкаптонурия. Нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота — промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты — диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета — алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов — меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) — одного из ферментов, катализирующего метаболический путь образования меланинов.
Болезнь Хартнупа. Причина — недостаточность белков-переносчиков триптофана в кишечной стенке и почечных канальцах. Наблюдаются:повышенное образование индикана, который превращается в индиго синего цвета – симптом «голубых пеленок»; аминоацидурия; признаки пеллагры. нарушение психики. Лечение: полноценная белковая диета, прием никотинамида, предохранение от УФО.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения/презентации —«Энзимопатии обмена аминокислот. Генетический скрининг новорожденных».
Лекция № 3. Конечные продукты обмена простых белков.
План лекции:
1. Реакции образования аммиака в организме. Токсичность аммиака.
2. Способы обезвреживание аммиака в организме. Орнитиновый цикл. Диагностическое значение определения мочевины.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
Содержание лекционного материала:
1. Реакции образования аммиака в организме. Токсичность аммиака.
Источники аммиака в организме:
a) Дезаминирование аминокислот.
b) Дезаминирование биогенных аминов.
c) Дезаминирование пуриновых и пиримидиновых азотистых оснований.
d) Гниение аминокислот в кишечнике.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов.
Часть аммиака образуется в кишечникев результате действия бактерий на пищевые белки (гниение белков вкишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 25-40 мкмоль/л.
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
2. Способы обезвреживание аммиака в организме.
2.1. Локальный – в тканях. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в почки и печень.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутаратапод действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата.
2.2. 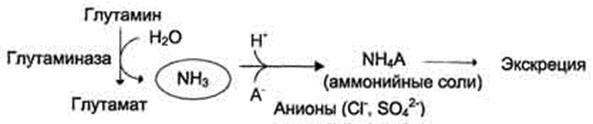
2.3. Орнитиновый цикл. Диагностическое значение определения мочевины.
Мочевина — основной конечный продукт азотистого обмена,в составе которого из организма выделяется до 90% всего выводимого азота. В норме концентрация мочевины в сыворотке/плазме крови – 2,61-8,35 ммоль/л (уреазный метод).
Мочевина выводится из организма с мочой. Азот мочевины составляет 85-90% от общего азота мочи. В норме у взрослых выводится мочевины с мочой 20-35 г/сут (330-580 ммоль/сут).
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название «орнитиновый цикл»,или «цикл Кребса-Гензелейта».
Суммарное уравнение синтеза мочевины:
NH3 + Аспартат + СО2 + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 АДФ +
В первой реакции процесса аммиак связывается с СО2 с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфосфатсинтетазы I. Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
Биологическая роль орнитинового цикла
Орнитиновый цикл в печени выполняет 2 функции:
· превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
· синтез аргинина и пополнение его фонда в организме.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови— гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемиясопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме).
Клинико-диагностическое значение исследования концентрации мочевины в сыворотке крови и моче.
Определение концентрации мочевины в сыворотке крови используется для оценки функции печени и выделительной функции почек. Критическая концентрация мочевины в крови: ˃28,0 ммоль/л. Причины увеличения концентрации мочевины в сыворотке крови:острые или хронические заболевания почек; обтурация мочевыводящих путей; снижение тока крови через почечные клубочки (застойная сердечная недостаточность, обширные ожоги, тяжелая диарея и рвота, инфаркт миокарда и др.); повышенный катаболизм белков (длительное голодание, кровотечения в ЖКТ, инфекции, канцерогенез, сахарный диабет и др.); снижение концентрации Cl — . Причины снижения концентрации мочевины в сыворотке крови: функциональная недостаточность печени (гепатит, цирроз, отравления мышьяком и др.); энзимопатии синтеза мочевины; повышенная скорость клубочковой фильтрации, обусловленная беременностью, чрезмерным объемом внутривенных инфузий, неадекватной секрецией антидиуретического гормона; мальабсорбция (целиакия). Влияющие факторы. Увеличение концентрации: диета с высоким содержанием белка, прием нефротоксичных лекарств, повышенный распад тканей при гипертиреозе, приеме глюкокортикоидов. Уменьшение концентрации:вегетарианская диета.
Определение концентрации мочевины в моче позволяет контролировать азотистый баланс у больных в тяжелом состоянии, получающих зондовое энтеральное и парентеральное питание. Корректно оценить азотистый баланс с использованием этого теста можно лишь при отсутствии тяжелой печеночной или почечной патологии. Увеличением концентрации мочевины в моче, указывающим на отрицательный азотистый баланс, сопровождаются: послеоперационный период, лихорадка; гипертиреоз; тяжелые острые или хронические соматические заболевания. Уменьшением, указывающим на положительный азотистый баланс, сопровождаются: беременность; период роста у детей; период восстановления после тяжелых заболеваний.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
Синтез креатина. Креатин необходим для образования в мышцах высокоэнергетического соединения — креатинфосфата. Синтез креатина идёт в 2 стадии с участием 3-х аминокислот: аргинина, глицина и метионина. В почкахобразуется гуанидинацетат при действии глицинамидинотрансферазы.Затем гуанидинацетат транспортируется в печень,где происходит реакция его метилирования:
SAM – S-аденозилметионин – активная форма метионина – донор СН3-группы.

 |
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Обнаружено три изоферментные формы креатинкиназы (КК-ВВ – мозговой тип, КК-МВ – сердечный тип, КК-ММ – мышечный тип). Измерение активности общей креатинкиназы и ее изоферментов используется в лабораторной диагностике.
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период.
Креатинин– это конечный продукт неферментативного превращения креатина и креатинфосфата, участвующих в энергообеспечении мышечного сокращения:
Креатинин выводится из организма через почки с мочой, относится к беспороговым веществам, которые поступают в мочу путем фильтрации и не реабсорбируются в канальцах. Нормы креатинина в сыворотке крови у взрослых: мужчины – 40-100 мкмоль/л, женщины – 44-88 мкмоль/л; креатинина в моче у взрослых — 4,4-17,7 ммоль/сут.
Клинико-диагностическое значение исследования концентрации креатина и креатинина в сыворотке крови и моче. Гиперкреатининемия – увеличение уровня креатинина в крови обусловлено как усиленным образованием, так и задержкой его в организме. Критическая концентрация креатинина в сыворотке крови: ˃400 мкмоль/л. Ретенционная гиперкреатининемия обусловлена нарушением (острым и хроническим) функции почек любого происхождения. Продукционная гиперкреатининемия отмечается при кишечной непроходимости, декомпенсации деятельности ССС, пневмонии, лихорадочных состояниях, гипертиреозе, голодании, усиленной мышечной работе. Снижение уровня креатинина в сыворотке крови коррелирует с уменьшением мышечной массы (мышечные дистрофии и атрофии, параличи и др.). Увеличение суточного выведения креатинина с мочойуказывает на увеличение почечной фильтрации и/или повышенное образование креатинина в скелетных мышцах. Увеличением концентрации сопровождаются: усиленная мышечная работа, лихорадочные состояния, пневмония, акромегалия, сахарный диабет, острые инфекционные заболевания. Уменьшение выведения креатинина с мочой наблюдается при мышечной атрофии, параличах, хронических заболеваниях почек, острой почечной недостаточности, голодании. В моче помимо эндогенного креатинина содержится экзогенный креатинин, поступающий в организм с мясной пищей. На концентрацию креатинина в крови и моче влияет характер диеты: преимущественно мясная диета приводит к увеличению, и наоборот, вегетарианская диета – к снижению концентрации креатинина в крови и моче.
Креатинемия (креатин + греч. haima кровь) — наличие в крови креатина. В плазме взрослого человека концентрации креатина в норме составляет 15,25—76,25 мкмоль/л. Повышение уровня креатина в крови (гиперкреатинемия) может быть при избыточном употреблении мяса, а также при заболеваниях мышечной системы, при кишечной непроходимости. поражениях печени. Креатинв моче взрослых людей в норме практически отсутствует. В первые годы жизни ребенка возможна «физиологическая креатинурия». По-видимому, появление креатина в моче детей раннего возраста обусловлено усиленным синтезом креатина, опережающим развитие мускулатуры. Некоторые исследователи к физиологическим явлениям относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При концентрации креатина в плазме крови свыше 122,0 мкмоль/л он начинает выделяться с мочой. Наибольшее содержание креатина в моче наблюдается при патологических состояниях мышечной системы и прежде всего при миопатии, или прогрессирующей мышечной дистрофии. Принято считать, что креатин в моче (креатинурия) больных миопатией может появляться в результате нарушения в скелетной мускулатуре процессов его фиксации (удержания) и фосфорилирования. Если нарушен процесс синтеза фосфокреатина, то не образуется и креатинин; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель мочи: (количество креатина + количество креатинина)/(количество креатинина). В норме этот показатель близок к 1,1.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения презентации«Энзимопатии цикла синтеза мочевины. Лабораторная диагностика гипераммониемии».
Дата добавления: 2015-10-01 ; просмотров: 1548 | Нарушение авторских прав
источник
Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический дефект, проявление болезни, методы предупреждения, диагностика и лечение.
Основное количество фенилаланина расходуется по 2 путям:
• включается в белки;
• превращается в тирозин. Превращение фенилаланина в тирозин прежде
всего необходимо для удаления избытка фени-лаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и катаболизируется до СО2 и Н2О.
Классическая ФКУ — наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 2030 раз (в норме — 1,0-2,0 мг/дл), в моче — в 100-300 раз по сравнению с нормой (30 мг/дл).
Наиболее тяжёлые проявления ФКУ — нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет
Диагностика:
Производится полуколичественным тестом или количественным определением фенилаланина в крови. При нелеченных случаях возможно выявление продуктов распада фенилаланина (фенилкетонов) в моче (не ранее 10—12 дня жизни ребёнка).
Лечение:
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фе-нил-аланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону «пожизненной диеты».
90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.
Алкаптонурия («чёрная моча»)
Причина заболевания — дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота — 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомно-рецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено.
Причина метаболического нарушения — врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
источник