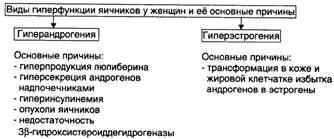
Адреногенитальный синдром — патологическое состояние, обусловленное дисфункцией коры надпочечников (чрезмерная секреция андрогенов) и проявляющееся признаками вирилизации.
Практически все случаи адреногенитального синдрома — врождённые.
Синдром обусловлен недостаточностью одного из ферментов, необходимых для синтеза кортизола. Дефицит кортизола стимулирует выработку АКТГ, что приводит к гиперплазии коры надпочечников и избыточной продукции АКТГ-зависимых стероидов, синтез которых при данной недостаточности фермента не нарушен (в основном надпочечниковых андрогенов — дегидроэпиандростерона, андростендиона и тестостерона).
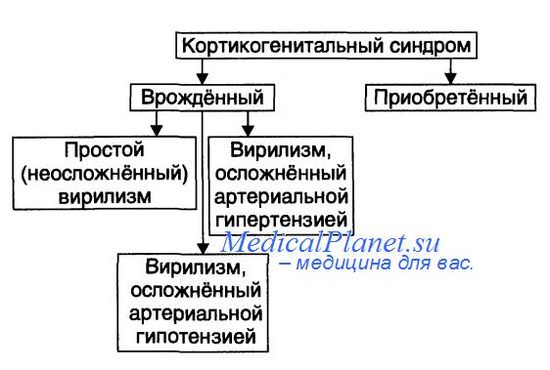
Виды адреногенитального синдрома представлены на рисунке.
• Врождённый адреногенитальный синдром. Встречается в 95% случаев гиперплазии надпочечников.
+ Клинические варианты.
— Вирильная форма — простая (неосложнённая) вирилизирующая форма.
— Сольтеряющая форма — вирилизм с гипотензивным синдромом.
— Гипертензивная форма — вирилизм с гипертензивным синдромом.
• Приобретённый адреногенитальный синдром.
— Причина: андростерома — доброкачественная или злокачественная опухоль, развившаяся из аденоцитов сетчатой зоны коры надпочечника. Такие опухоли синтезируют избыточное количество андрогенов. Андростерома может развиться в любом возрасте.
— Проявления приобретённого адреногенитального синдрома могут отличаться от врождённых форм нормальным или незначительным повышением содержания в крови АКТГ.
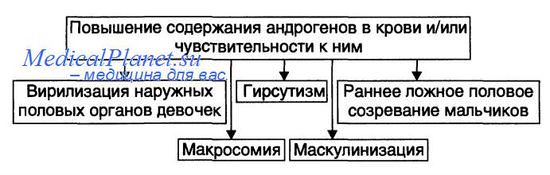
Проявления адреногенитального синдрома представлены на рисунке.
• Общие проявления.
— Врождённая вирилизация наружных половых органов у девочек (пенисообразный клитор, мошонкообразные большие половые губы). Внутренние половые органы под влиянием андрогенов не меняются: матка и яичники развиваются, как правило, в соответствии с возрастной нормой. Этот признак обозначают также как женский псевдогермафродитизм, или вирилизм по гетеросексуальному типу. Причина: избыток в организме андрогенов, вызывающих маскулинизацию наружных гениталий.
— Макросомия (увеличенные масса тела и рост новорождённых). Наблюдается как у девочек, так и у мальчиков. В первые годы жизни больные дети растут быстрее, чем их сверстники. Однако в 12—14 лет эпифизарный рост трубчатых костей прекращается и такие дети остаются низкорослыми, непропорционального телосложения, с сильно развитой мускулатурой. Причина: анаболическое действие избытка андрогенов.
— Гирсутизм — рост волос на теле по мужскому типу — ранний признак вирилизма (он может появиться в возрасте 2—5 лет) в виде избыточного оволосения: на лице (усы, борода), лобке, в подмышечных впадинах, на груди, спине, конечностях. Причина: гиперпродукция андрогенов и реализация их эффектов.
— Маскулинизация — развитие мужских вторичных половых признаков у индивидов генетически женского пола. Это проявляется атрофией (гипотрофией) молочных желёз и матки, различными нарушениями менструального цикла или отсутствием менструаций, телосложением по мужскому типу, низким голосом, изменением поведения (по «мужскому типу»: появление властолюбия, стремления к лидерству, увлечение техникой, мужскими видами развлечений и т.п.). Причина: высокий уровень андрогенов в крови и их действие на ткани и клетки — мишени.
— Раннее ложное половое созревание мальчиков по изосексуальному типу. Проявляется преждевременным формированием вторичных половых признаков и наружных половых органов, сохранением темпа развития половых желёз, свойственного данному возрасту (отсутствие сперматогенеза) и изменением телосложения (низкий рост, сильно развитая мускулатура, короткие мускулистые ноги — феномен «ребёнок—Геркулес»).
• Проявления, свойственные сольтеряющей форме.
Артериальная гипотензия — стойкое снижение АД ниже нормы. Нередко отмечаются коллапсы. Причины: гипонатриемия, гиперкалиемия, гиповолемия, гипогидратация организма вследствие дефицита альдостерона и его эффектов по регуляции водно-солевого обмена.
• Проявления, характерные для гипертензивной формы.
Артериальная гипертензия — стойкое увеличение АД выше нормы. Причина: избыток в крови минералокортикоида 11-дезоксикортикостерона при недостаточности 11 -гидроксилазы.
источник
Надпочечники (син.: надпочечные железы; неточный син.: адреналовые железы; лат. — glandulae suprarenales, epinephra, hypemephra ) представляют собой парные эндокринные органы, расположенные в забрюшинном пространстве над верхними полюсами почек. Каждый надпочечник состоит из внутреннего мозгового вещества и наружного коркового вещества. Мозговое и корковое вещество различны по происхождению, строению, функции и характеру продуцируемых гормонов. Кора надпочечников происходит из мезодермы и секретирует несколько стероидных гормонов — кортикостероидов; мозговое вещество происходит из эктодермы и продуцирует биогенные монрамины — катехоламины.
Кора надпочечников имеет жизненно важное значение, функцию мозгового вещества может заменять вненадпочечниковая хромафинная ткань, способная к синтезу катехоламинов. Гормоны надпочечников обладают большим разнообразием биологических свойств и весьма широким спектром действия на обменные процессы, участвуют в регуляции многих физиологических функций в обычных условиях и в процессе адаптации организма к меняющимся условиям, в том числе при воздействии экстремальных факторов.
Гормоны коры надпочечников действуют в клетках-мишенях аналогично другим стероидным гормонам. Проникнув в клетку, они после связи с цитозольным специфическим рецептором в виде комплекса «гормон-рецептор» транспортируются в ядро клетки и после связи с акцептором хроматина инициируют образование мРНК и другие протеосинтетические реакции.
Корковое вещество надпочечников состоит из трех зон: клубочковой (zona glomerulosa ), пучковой (zona fasciculata) и сетчатой (zona retieulans).
Эта зона надпочечников синтезирует минералокортикоиды, главным из которых является альдостерон; другие минералокортикоиды играют лишь второстепенную роль. Основная точка приложения действия альдостерона — почки, он действует также на слюнные железы, желудочно-кишечный тракт, сердечно-сосудистую систему. В почках альдостерон стимулирует канальцевую реабсорбцию натрия и экскрецию ионов калия, водорода, аммония и магния. Этот процесс играет важнейшую роль в поддержании электролитного баланса организма, а также имеет существенное значение в регуляции объема экстрацеллюлярной жидкости. Подобное воздействие, хотя и значительно более слабое, альдостерон оказывает на внепочечный транспорт натрия и калия. Через натрий альдостерон влияет на резистивные сосуды, способствуя повышению их тонуса.
В регуляции биосинтеза и секреции альдостерона участвуют несколько механизмов: ренин-ангиотензиновая система через образование ангиотензина-11, связанное с изменениями объема крови и почечного кровотока, непосредственная субстратная регуляция через концентрацию натрия и калия; определенное влияние на образование альдостерона оказывает АКТГ, а возможно и другие факторы.
Пучковая зона.
Данная зона продуцирует глюкокортикоиды — гидрокортизон (кортизол) и кортикостерон. Главная роль принадлежит кортизолу. Глюкокортикоиды обладают различными метаболическими и физиологическими (патофизиологическими) эффектами. Метаболические воздействия глюкокортикоидов проявляются в основном на уровне углеводного и белкового обменов. Они участвуют также в жировом, водно-электролитном обменах и некоторых других метаболических процессах. Глюкокортикоиды способствуют всасыванию углеводов в кишечнике, тормозят их превращение в печени в жиры, способствуют накоплению гликогена в печени, ослабляют утилизацию глюкозы в мышцах, соединительной, лимфоидной ткани. Особо важное значение имеет способность глюкокортикоидов стимулировать процессы гликонеогенеза, т. е. мобилизовать резервные источники углеводов при израсходовании их непосредственных запасов.
Своеобразно влияние глюкокортикоидов на белковый обмен. Они активизируют синтез многих ферментных и неферментных белков в печени и в то же время обладают выраженным ингибирующим синтез и катаболическим действием в отношении белков мышц, соединительной, лимфоидной и других тканей.
Глюкокортикоиды оказывают действие на жировой обмен. Помимо торможения липогенеза и усиления мобилизации жиров из депо и кетогенеза, они оказывают пермиссивное действие на жиромобилизующий эффект катехоламинов, а при длительном избытке способствуют избыточному отложению жира с характерной его топографией. Роль этих гормонов в поддержании артериального давления в основном обусловлена их пермиссивным свойством, которое заключается в действии катехоламинов на сосудистые стенки и миокард, а также стимуляцией синтеза катехоламинов.
Другие свойства глюкокортикоидов проявляются в основном в патологических условиях или при длительном воздействии значительных доз экзогенных гормонов.
- Противовоспалительное действие глюкокортикоидов обусловлено их сильно выраженным стабилизирующим действием в отношении мембран клеток и их органелл (лизосом, митохондрий и др.), торможением освобождения гистамина, серотонина, синтеза кининов и простагландинов, адгезии и эмиграции лейкоцитов, влиянием на активность комплемента и др.
- Противоаллергическое и иммуносупрессивное (депрессивное) действие глюкокортикоидов включает ряд их противовоспалительных свойств. Кроме того, они тормозят образование лимфоцитов и способствуют их разрушению. инволюции лимфоидной ткани и лимфопении. Одним из проявлений действия глюкокортикоидов служит также эозинопения.
- Глюкокортикоиды ограничивают и подавляют размножение и активность фибробластов и образование коллагена. В связи с этим (а также с катаболическим эффектом в белковом обмене) они задерживают заживление механических и других повреждений тканей (ран и др.).
- В пищеварительной системе глюкокортикоиды вызывают усиленную секрецию соляной кислоты и пепсина и способствуют возникновению язвы.
Секреция глюкокортикоидов полностью находится под контролем АКТГ, в свою очередь контролируемого гипоталамическим КРГ (кортиколиберином). Между уровнем глюкокортикостероидов и кортиколиберина в норме существует отрицательная обратная связь.
Эта зона синтезирует мужские половые (андрогенные) гормоны. Последние влияют на развитие мужских наружных половых органов и вторичных половых признаков, а также на другие внешние признаки мужского организма (строение тела, липа, тембр голоса) и некоторые свойственные мужским особям особенности поведения. Кроме того, андрогены обладают выраженным анаболическим действием, усиливая синтез белков (особенно — скелетных мышц). Секреция андрогенов находится под контролем АКТГ. Однако в отличие от кортизола в системе регуляции их синтеза в заметной степени обратная связь не реализуется и при повышении уровня андрогенов ингибирования синтеза кортиколиберина и адренокортикостероидного гормона не происходит.
Такая патология возникает при двустороннем грубом повреждении коры надпочечников в результате травмы, кровоизлияния, связанного с родовой травмой, общей капилляропатией или неадекватным применением антикоагулянтов, при тромбозе сосудов (вен), ДВС-синдроме, тяжелых инфекциях. Удаление надпочечника, пораженного гормонально активной опухолью, также может привести к острой недостаточности в связи с атрофией парного надпочечника.
При отсутствии эффективной терапии быстро развиваются прогрессирующая мышечная слабость, тяжелая артериальная гипотензия, диспепсические явления и наступает смерть от острой недостаточности кровообращения.
Эта болезнь может быть связана с двусторонним туберкулезным процессом, метастазами опухолей, токсическими поражениями надпочечников (например, при хронической интоксикации некоторыми инсектицидами — ДДТ и др.), амилоидозом и др. Часто встречается идиопатическая атрофия надпочечников аутоиммунного происхождения. У некоторых таких больных есть антитела против всех стероидогенных клеток и гипокортицизм комбинируется у них с гипогонадизмом. Нередко встречаются комбинации с другими аутоиммунными заболеваниями (тиреоидитом, сахарным диабетом и др.). Парциальные формы гипокортицизма обычно связаны с ферментными дефектами.
Вторичные (центральные) формы недостаточности функции надпочечников обусловлены дефицитом АКТГ вследствие повреждения аденогипофиза или (редко) гипоталамуса. Имеются случаи резистентности к кортизолу, связанные с аномалиями глюкокортикоидных рецепторов. Хронический гипокортицизм проявляется астенизацией, апатией, снижением работоспособности, мышечной слабостью, артериальной гипотензией, анорексией, похуданием. Нередко наблюдается лолиурия в сочетании с почечной недостаточностью, характерная гиперпигментация кожи и слизистых оболочек.
В зависимости от причины и эффективности лечения хронические формы недостаточности функции надпочечников продолжаются длительное время или переходят в острую форму.
В основе проявления тотального гипокортицизма лежит недостаточность эффектов всех гормонов надпочечников. Мышечная слабость связана с нарушением электролитного баланса (при дефиците альдостерона) и гипогликемией (дефицит глюкокортикостероидов), а также с уменьшением мышечной массы (вследствие дефицита андрогенов). Артериальная гипотензия связана с гипонатриемией, выпадением пермиссивного эффекта глюкокортикостероидов и вследствие этого снижением реактивных свойств сосудистой стенки к прессорным влияниям. Гипотензия может усугубиться ослаблением сократительной функции сердца. Потеря натрия сопровождается полиурией, гипогидратацией, сгущением крови. Наряду с артериальной гипотензией ухудшение реологических свойств крови приводит к уменьшению клубочкового кровотока, эффективного фильтрационного давления и общего объема фильтрации. Отсюда наряду с полиурией возникает недостаточность выделительной функции почек. Пищеварительные расстройства связывают с недостаточной секрецией пищеварительных соков и интенсивным выделением слизистой оболочкой кишечника иона натрия (недостаток альдостерона), что приводит к профузным поносам и также способствует гипогидратации.
Изолированная (парциальная) недостаточность продукции альдостерона встречается сравнительно редко. Она может возникнуть вследствие нарушения механизмов, стимулирующих его секрецию (система «ренин — ангиотензин»), первичного ферментного дефекта в клубочковой зоне коры надпочечников с нарушением последних этапов биосинтеза альдостерона при нормальном образовании кортизола и кортикостерона. Встречается также врожденный так называемый псевдогипоальдостеронизм, обусловленный низкой чувствительностью эпителия почечных канальцев к альдостерону. Изолированный гипоальдостеронизм возникает после удаления одного из надпочечников по поводу опухоли альдостеромы, когда в другом надпочечнике клубочковая зона атрофируется. Проявления гипоальдостеронизма определяются недостаточной продукцией альдостерона на фоне нормальной или повышенной секреции других гормонов, в частности глюкокортикоидов. Отмечаются быстрая утомляемость, мышечная слабость, артериальная гипотензия, периодические обморочные состояния, брадикардия до полной атриовентрикулярной блокады (приступы Адамса —Стокса), гипонатриемия и гиперкалиемия.
Различают две формы избыточной секреции альдостерона: первичный и вторичный гиперальдостеронизм.
Причиной первичного гиперальдостеронизма (синдром Конна) обычно является гормонально-активная опухоль, происходящая из клубочковой зоны — альдостерома. Проявления первичного гиперальдостеронизма сводятся к трем основным группам симптомов: сердечно-сосудистым, почечным, нервно-мышечным. Основными причинами этих нарушений служат почечная задержка натрия и потеря калия. Накопление натрия в клетках стенок сосудов приводит к их гипергидратации, сужению просвета, увеличению периферического сопротивления и повышению артериального давления. Артериальной гипертензии способствует также увеличение чувствительности сократительных элементов сосудистых стенок к действию прессорных аминов.
В результате гипертензии часто встречаются (особенно у детей) изменения глазного дна, приводящие к нарушению зрения вплоть до слепоты. Нередко наблюдаются нарушения ритма сердца, характерные для гипокалиемии изменения ЭКГ. В начальной стадии болезни суточный диурез понижен. Позднее олигурия сменяется стойкой полиурией, которая обусловлена дегенерацией эпителия почечных канальцев и снижением их чувствительности к АДГ. Как правило, существуют нарушения в нервно-мышечной системе — мышечная слабость, парестезии, судороги; иногда вялые параличи.
Вторичный гиперальдостеронизм может возникать при некоторых физиологических состояниях: сильном физическом напряжении, менструации, беременности и лактации, высокой внешней температуре с интенсивным потоотделением и др.
Патологический гиперальдостеронизм возникает при острой кровопотере, различных формах сердечной недостаточности, нефрозе с выраженной протеинурией и гипопротеинемией. В этих случаях усиленная продукция альдостерона связана с активацией ренин-ангиотензиновой системы в ответ на гиповолемию. Активация данной системы возникает и при заболеваниях почек, сопровождающихся их ишемией. Повышение уровня альдостерона при заболеваниях печени (в основном — циррозе) связано с тем, что этот гормон, как и многие другие, метаболизируется в основном в печени. Вторичный гиперальдостеронизм также проявляется задержкой натрия, артериальной гипертензией, гипергидратацией и некоторыми другими симптомами, свойственными первичному гиперальдостеронизму. Однако при этом в отличие от синдрома Конна в крови наблюдается высокий уровень ренина и ангиотензина; развиваются отеки, что связано с особенностями этиологии и патогенеза этих двух видов гиперальдостеронизма.
Гиперпродукция глюкокортикоидов может иметь: центральное, регуляторное происхождение, связанное с избытком АКТГ, выражающееся в первичной гиперфункции коры надпочечников.
Кроме того, встречаются эктопические очаги продукции подобных АКТГ веществ в злокачественных опухолях различных органов.
Центральный гиперкортицизм представлен болезнью Иценко-Кушинга, возникающей при базофильной аденоме гипофиза или избыточной продукции гипоталамусом кортиколиберина. Усиленное образование АКТГ приводит к чрезмерной стимуляции пучковой и сетчатой зон надпочечников и их двусторонней гиперплазии. Основные проявления болезни Иценко— Кушинга связаны с гиперпродукцией глюкокортикоидов.
Симптоматика болезни весьма разнообразна, так как связана с избыточностью многочисленных эффектов глюкокортикоидов. а отчасти — и других гормонов коры надпочечников. Из неспецифических признаков больных беспокоят общее недомогание, слабость, повышенная утомляемость, головная боль, боли в ногах, спине, сонливость, жажда. Весьма характерен внешний вид больного — круглое, «лунообразное», багрово-красное лицо, умеренный гипертрихоз (у женщин), диспластическое ожирение с преимущественным отложением жира в области лица, шеи, верхней половины туловища при непропорционально худых конечностях. Весьма характерны атрофические западающие багрово-красные или фиолетовые полосы растяжения (стрии) на коже живота, плеч, молочных желез, внутренней поверхности бедер. Часто выявляется остеопороз, нередко приводящий к патологическим переломам позвонков, шейки бедра и др. «Стрии» и костные изменения связывают с белково-катаболическим и антианаболическим действием избытка глюкокортикоидов.
Как правило, значительно страдает сердечно-сосудистая система. Развивается стойкая высокая артериальная гипертензия с вторичными нарушениями, свойственными данному виду патологии: расстройством мозгового кровообращения, ретинопатией, сморщенной почкой, перегрузочной формой сердечной недостаточности. В генезе кардиальных нарушений существенное значение может иметь так называемая электролитно-стероидная кардиопатия, связанная с электролитными сдвигами в миокарде, увеличением внутриклеточного натрия и уменьшением калия.
Таким образом, перегрузочная форма сердечной недостаточности сочетается с миокардиальной. Наряду с указанными проявлениями при болезни Иценко— Кушинга часто наблюдается снижение устойчивости к инфекционным заболеваниям, гнойничковым поражениям кожи, инфекциям мочевыводящих путей и др. Это связано с иммунодепрессивным действием избытка глюкокортикостероидов. Как правило, при болезни Иценко—Кушинга наблюдается гипергликемия и нередко — сахарный диабет. В основе данных нарушений лежат гиперглике-мизирующее и «контринсулярные» свойства глюкокортикостероидов.
В периферической крови обнаруживаются лимфопения, эозинопения, эритроцитоз. Нередко возникают различные нарушения в половой сфере, неврологическом и нервно-психическом статусе. Первично гландулярная (периферическая) форма гиперкортицизма, как было указано выше, может быть вызвана кортикостеромой — гормонально-активной опухолью коры надпочечников, исходящей из пучковой зоны и продуцирующей кортизол, или злокачественной (раковой) опухолью. Название этого варианта гиперкортицизма иногда не дифференцируют от центральной, гипоталамо-гипофизарной формы заболевания. Однако в связи с явными различиями в этиологии, патогенезе, некоторых решающих диагностических признаках и терапевтических подходах в настоящее время признается целесообразным использовать понятие и термин «болезнь Иценко—Кушинга» применительно к центральным, гипоталамо-гипофизарным формам гиперкортицизма, а периферическую, первично-гландулярную форму обозначать термином «синдром Иценко— Кушинга».
Внешние проявления синдрома Иценко—Кушинга весьма сходны с симптоматологией болезни Иценко — Кушинга. Принципиальное различие заключается в том, что для болезни Иценко —Кушинга характерно сочетание гиперкортицизма с высоким уровнем АКТГ; при синдроме Иценко— Кушинга продукция АКТГ по механизму обратной связи подавлена первичным избытком глюкокортикостероидов и уровень АКТГ в крови понижен.
Принципиальным отличием синдрома и болезни Иценко—Кушинга является также то, что во втором случае обнаруживается двусторонняя диффузная гиперплазия надпочечников, а при синдроме Иценко — Кушинга (аденоме или карциноме) — одностороннее увеличение с атрофией другого надпочечника, вызванной избытком глюкокортикостероидов, продуцируемых опухолью.
Своеобразная форма гиперкорти-цизма, не связанная с нарушением гормонообразования в коре надпочечников, иногда встречается при поражениях печени (циррозах и др.). В нормальных условиях большая часть образовавшегося в надпочечниках кортизола (до 80%) образует в крови комплекс со специфическим кортико-стероидсвязывающим глобулином — транскортином, до 10% кортизола связано с альбуминами и не более 10 % кортизола плазмы находится в свободном состоянии и проявляет свою биологическую активность. При поражении печеночных клеток синтез транс-кортина нарушается, что может привести к увеличению свободной фракции кортизола в крови и возникновению так называемого кушингизма — симптомокомплекса, сходного с синдромом Ипенко — Кушинга, хотя обычно менее ярко выраженным.
Адреногенитальный (кортикогенитальный) синдром (КГС). Данный вид расстройств функций коры надпочечников встречается в двух основных формах: врожденной вирилизирующей гиперплазии коры надпочечников и гормонально-активной опухоли — ан-дростеромы (андробластомы).
Врожденная форма кортико-генитального синдрома связана с нарушениями синтеза гормонов в коре надпочечников, в результате в кровь поступает избыточное количество стероидов с андрогенными свойствами. Основные проявления патологии обусловлены вирилизирующим и анаболическим действием данных гормонов. В этиологии врожденного кортико-генитального синдрома главную роль играет наследственность. Развитию данного заболевания могут способствовать также различные неблагоприятные факторы во время беременности матери (токсикоз, применение гормональных препаратов и др.).
В основе врожденного кортико-генитального синдрома лежит дефицит ферментов 21-гидроксилазы, 11-гидроксилазы и, возможно, 3-дегидрогеназы, участвующих в многоэтапном синтезе кортикостероидов.
Различают три клинические формы заболевания:
- простая вирилизирующая (от лат. virilis — мужской, свойственный мужчине; син.: андрогенизируюшая, маскулинизирующая) форма (наиболее частая);
- вирилизм с гипотоническим синдромом (сольтеряющая форма);
- вирилизм с гипертензивным синдромом (встречается редко).
Считается, что две первые формы связаны с дефицитом 21-гидроксилазы, а третья форма — с дефицитом 11-р-гидроксилазы. Во всех случаях нарушается синтез кортизола, кортикостерона и альдостерона, что сопровождается накоплением андрогенных предшественников и увеличением образования гипофизарного АКТГ. Последнее обусловлено по механизму обратной связи дефицитом кортизола: в то же время андрогены не обладают тормозящим влиянием на синтез АКТГ. Избыток АКТГ дополнительно стимулирует сетчатую зону, усиливая образование андрогенов и вызывая гиперплазию надпочечников. Из-за дефицита необходимых для синтеза кортизола ферментов стимулирующее влияние AKTT на пучковую зону и синтез кортизола реализоваться при этом не может.
Проявления кортико-генитального синдрома наиболее ярко выражены у женщин и в большинстве случаев обнаруживаются сразу после рождения (хотя встречаются и случаи значительно более позднего проявления признаков болезни).
Как правило, дети с этим заболеванием рождаются крупными в результате анаболического действия андрогенов. Если гиперпродукция андрогенов возникла на раннем этапе развития плода, изменения наружных половых органов у девочек выражены настолько резко, что бывает трудно установить пол новорожденного (женский псевдогермафродитизм). В случаях, когда избыток андрогенов проявляется только после рождения, наружные половые органы имеют нормальный вид и их изменение происходит постепенно по мере нарастания дисфункции надпочечников. Ранним признаком вирилизации у девочек является также появляющееся в возрасте 2 — 5 лет, а иногда и раньше, ненормальное, избыточное оволосение — гипертрихоз (или гирсутизм), рост волос на лобке, в подмышечных впадинах, на лице, спине, конечностях. В более поздние сроки избыток андрогенов сказывается и на строении тела девочек. В связи с усилением анаболизма вначале отмечается быстрый рост, однако в результате преждевременного окостенения эпифизов трубчатых костей рост вскоре прекращается и в конечном итоге обычно наблюдается низкорослость. Характерны чрезмерное развитие скелетной мускулатуры и большая физическая сила. При отсутствии или неэффективности лечения андрогенизация прогрессирует и девочки приобретают еще более мужеподобный вид, усиливается рост волос на лице (усы, борода) и теле, грубеет голос. Молочные железы не развиваются, менструации не наступают. У взрослых женщин также наблюдаются аменорея, атрофия матки и молочных желез, телосложение приближается к мужскому типу, часто появляется облысение. Имеются также определенные отклонения в поведенческих особенностях.
Мальчики с врожденной гиперплазией надпочечников обычно рождаются с нормальной дифференциацией наружных половых органов. В дальнейшем происходит раннее ложное половое созревание по изосексуальному типу: явно преждевременно развиваются вторичные половые признаки и наружные половые органы (макрогенитосомия). В то же время из-за торможения избытком андрогенов образования гипофизарных гонадотропинов половые железы остаются недоразвитыми и сперматогенез может полностью отсутствовать. Весьма характерен внешний вид больных: низкий рост, короткие нижние конечности и сильно развитая мускулатура (так называемый «ребенок-геркулес»).
При гипотензивной (сольтеряющей) форме кортико-генитального синдрома в связи с резким уменьшением продукции альдостерона наряду с описанными выше характерными признаками заболевания наблюдаются серьезные нарушения электролитного баланса: потеря натрия, гиперкалиемия, гипогидратация и, как следствие, артериальная гипотензия. Нередко развиваются кризы с судорогами и расстройствами гемодинамики вплоть до коллапса, иногда — со смертельным исходом.
Кортико-генитальный синдром с гипертензивным синдромом характеризуется значительным избытком дезоксикортикостерона, что ведет к стойкому повышению артериального давления. Имеются также отчетливые признаки вирилизации вплоть до псевдогермафродитизма у девочек и макро-генитосомии у мальчиков.
Нередко встречаются стертые формы кортико-генитального синдрома, проявляющиеся нерезко выраженными симптомами гиперпродукции андрогенов: умеренным гипертрихозом, нарушением менструального цикла и др.
Приобретенная форма КГС вызывается гормонально-активной опухолью — андростеромой, происходящей из сетчатой зоны надпочечников и продуцирующей большое количество андрогенов. Опухоль может носить доброкачественный или злокачественный характер и развиваться в любом возрасте.
Проявления заболевания у женщин весьма характерны и совпадают с врожденным кортико-генитальным синдромом. При раннем возникновении опухоли у мальчиков также имеются характерные признаки данного заболевания. У взрослых мужчин с нормально развитыми вторичными половыми признаками при возникновении андростеромы бывает трудно выявить прогрессирование вирилизма, в связи с чем заболевание часто своевременно не диагностируется. В отличие от врожденного кортико-генитального синдрома при андростероме обычно нет значительного повышения содержания АКТГ в плазме, но резко увеличено выделение с мочой 17-кетостероидов.
Мозговое вещество надпочечников синтезирует и выделяет два гормона, являющихся производными аминокислоты тирозина, — катехоламины адреналин и норадреналин. В нормальных условиях надпочечники выделяют значительно больше адреналина (около 80 %).
Метаболические и физиологические эффекты катехоламинов многообразны. Они обладают выраженным прессорным (гипертензивным) действием, стимулируют работу сердца, влияют на гладкую мускулатуру, регуляцию углеводного обмена, катаболизм белков, окислительные процессы, гормональную активность некоторых эндокринных желез и другие процессы.
Метаболические и физиологические эффекты адреналина и норадре-налина в основном совпадают, хотя между ними есть и ряд отличий. Эти отличия, однако, сказываются лишь на некоторых деталях реально встречающихся эндокринных расстройств и существенного значения не имеют.
Как самостоятельная форма эндокринопатий эта патология практически не встречается. Даже двустороннее удаление мозгового вещества обычно не сопровождается видимыми расстройствами. Это связано с тем, что в организме, помимо мозгового слоя надпочечников, есть достаточное количество хромафинной ткани, способной продуцировать адреналин.
Чрезмерная секреция катехоламинов.
Данная патология возникает при опухоли, исходящей из мозгового вещества надпочечников — феохромоцитоме и некоторых других (редких) опухолях хромаффинной ткани. Усиленное выделение гормонов может провоцироваться психической или физической нагрузкой, болевым раздражением и другими стрессорными факторами. В некоторых случаях гиперсекреция гормонов связана с незначительными воздействиями или происходит непрерывно.
Для данного заболевания характерны прежде всего сердечно-сосудистые расстройства: тахикардия, спазм периферических сосудов и резкое повышение артериального давления. При пароксизмальной форме больные ощущают тревогу, страх, резкие пульсирующие головные боли, а также боли в подложечной области; возникает мышечная дрожь, возможны тошнота, рвота, нарушения дыхания, временное прекращение выделения мочи.
В крови отмечается гипергликемия, обусловленная усилением гликогенолиза под влиянием избытка адреналина. При сохраненном диурезе или после его восстановления возникает глюкозурия. В связи с чрезвычайным увеличением периферического сопротивления и перенапряжением левого желудочка может возникнуть его острая недостаточность с застоем крови в малом круге и отеком легких. В случаях с постоянно повышенным артериальным давлением возникают изменения сосудов (в частности — глазного дна) и другие нарушения, свойственные тяжелой прогрессирующей артериальной гипертензии. При наличии стойкой гипергликемии также могут возникать соответствующие осложнения, включая сахарный диабет.
В результате гипофункции коры надпочечников повышается выработка гипофизом меланоцитостимулирующего (меланофорного) гормона и секреция АКТГ.
Вследствие отложения меланина в клетках происходит пигментация слизистой оболочки полости рта, что служит характерным признаком длительно текущей аддисоновой болезни. Она обычно проявляется в виде небольших пятен и полос коричневого или серовато-черного цвета, которые локализуются на красной кайме губ, в области углов рта, на деснах, боковых поверхностях языка, а также на слизистой оболочке щек по линии смыкания зубов, на твердом или мягком нёбе, задней стенке глотки. На слизистой оболочке десен могут быть также неправильной формы синевато-черные или черные участки пигментации. Пигментация может появиться задолго до других симптомов заболевания (за 5— 10 лет) и быть первым ее признаком.
Следует учитывать, что и в норме у ряда народностей, проживающих на юге, нередко бывает пигментация слизистой оболочки полости рта и половых органов.
При болезни Аддисона наблюдается увеличение миндалин и лимфатических узлов, расположенных у корня языка.
При врожденном адреногенитальном синдроме у больных отмечается акселерация развития, особенно костного скелета. Ускоренная дифференцировка скелета у детей опережает возраст на 2—8 лет, однако это сопровождается асимметрией и нарушением последовательности окостенения костей. Избыток андрогенов вызывает усиленную минерализацию и изменение структуры костной ткани. Эти изменения, наблюдаемые обычно в возрасте от 3 — 7 лет, характеризуют состояние, обозначаемое как ложное преждевременное половое созревание у мальчиков (изосексуальный тип) и у девочек — гетеросексуальный тип (явления псевдогермафродитизма).
У детей с врожденной дисфункцией коры надпочечников зубной возраст чаще всего соответствует хронологическому, но возможны случаи более раннего прорезывания и формирования постоянных зубов.
Своевременное выявление и лечение основного заболевания способствует пропорциональному развитию лицевого скелета.
При опухолях коры надпочечников (обычно аденоме) отмечается более раннее прорезывание постоянных зубов и ускоренное формирование их корней. На фоне генерализованного остеопороза костей скелета происходит истончение или потеря кортикальных пластинок альвеол.
Изменения в полости рта при опухолях коры надпочечников характеризуются иианозом и отечностью слизистой оболочки, хроническим катаральным гингивитом, слабовыраженным остеопорозом челюстных костей. Сходство изменений в пародонте при опухолях и болезни Иценко—Кушинга объясняется гиперкортииизмом. определяющим течение заболевания.
Изменения в челюстных костях при гиперкортицизме отличаются от изменений, наблюдаемых при гиперпаратиреоидизме, для которого характерно образование гигантоклеточной опухоли и кистозных изменений. При гиперкортицизме наблюдаются остеопороз челюстных костей, истончение или облитерация кортикальной пластинки, а также частичная или полная облитерация кортикальных пластинок альвеол, что объясняется катаболическим действием кортикостероидов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
источник
Типовые формы патологии, обусловленные нарушениями эндокринной функции половых желёз, подразделяют на три группы: нарушения ^половой дифференцировки, расстройства полового развития у девочек и половой функции у женщин, нарушения полового развития у мальчиков и половой функции у мужчин.
Расстройства полового развития женского пола:
Преждевременное половое созревание:
Половое созревание считается преждевременным, если какой-либо из вторичных половых признаков появляется у девочек ранее 7,5 пет.
Различают центральное (истинный пубертат), периферическое (ложный пубертат, псевдопубертат) и частичное (неполное) преждевременное половое созревание.
Истинный преждевременный пубертат:
Причины: преждевременная активация синтеза гонадолиберина (при опухолях диэнцефальной области), травмах головного мозга; гиперпродукция гонадотропинов аденогипофизом.
Проявления: Изосексуальность развития: комплексность развития (ускорение роста тела, оволосение).
Причины: автономный избыточный синтез эстрогенов яичниках или надпочечниках.
Проявления: 1. бивалентность полового развития – изосексуальное, гетеросексуальное; нарушение гармоничности развития организма, незавершенность полового развития.
Задержка полового созревания
Задержкой полового созревания считается отсутствие вторичных половых признаков к 14-летнему возрасту, а также отсутствие менструаций к 16-летнему возрасту (первичная аменорея) при наличии вторичных половых признаков.
Первичный гипогонадизм (яичниковый). Является следствием наследуемой, врождённой или приобретённой яичниковой недостаточности.
Вторичный гипогонадизм (гипогонадотропный, внеяичниковый). Обусловлен дефицитом гонадотропных гормонов (ФСГ, ЛГ) транзиторного (преходящего) или постоянного (хронического) характера.
Причины: 1. транзиторный вторичный гипогонадизм (стресс, хронич. истощающие болезни; эндокринопатии) 2. хронический вторичный гипогонадизм.
Гипофункция яичников:
Эндокринная недостаточность яичников подразделяется на первичную и вторичную.
• Первичная яичниковая недостаточность (первичный гипогонадизм) — состояния, обусловленные патологией яичников и заключающиеся в недостаточной продукции ими половых гормонов, а также нарушениями менструального цикла. В связи с этим в крови, как правило, обнаруживают компенсаторно увеличенный уровень ФСГ. Причины: те же, что и первичного гипогонадизма, вызывающего задержку полового развития у девочек.
• Вторичная недостаточность (вторичный, или внеяичниковый гипогонадизм). Является результатом дефицита либо гонадолиберинов гипоталамуса, либо гонадотропных гормонов аденогипофиза. Причины: те же, что и вторичного гипогонадизма.
• Проявления: нарушения менструального цикла, аменорею, бесплодие.
Расстройства полового развития мужского пола:
Преждевременный (первичный) пубертат — состояние, характеризующееся появлением всех или отдельных вторичных половых признаков у мальчиков до 9-летнего возраста.
1. Истинное преждевременное развитие;
2. Ложноепреждевременное развитие.
Проявления: являются результатом избытка в организме мужских половых гормонов. Это вызывает признаки вирилизации (появление лобкового и подмышечного оволосения, огрубение голоса, увеличение яичек и полового члена; низкий рост.
Задержка полового созревания
Отсутствие у мальчиков признаков полового созревания к 14-летнему возрасту считается задержкой пубертата.
1. Дефицит гонадолиберинов гипоталамуса и/или гонадотропинов аденоги-пофиза
2. Сниженная выработка тестостерона яичками
3. Пониженная чувствительность тканей-мишеней к действию тестостерона.
Признаки евнухоидизма: сниженное содержание тестостерона в крови.
Причины тестикулярной недостаточности.
— Те же, что и при задержке полового развития мальчиков.
— Дефекты яичек. (наследуемые или врождённые (первичные) — снижение продукции андрогенов и нарушения сперматогенеза; приобретённые (вторичные) — при травме, вирусном или бактериальном воспалении).
Стоматологические проявления нарушения секреции половых гормонов
Влияние кастрации. Кастрация обезьян и крыс сопровождается снижением степени минерализации дентина. Удаление семенников и яичников у животных приводит к развитию гингивита, а затем к изменениям в околозубных тканях, сопровождающимся резорбцией межзубных перегородок, часто происходят также изменения в височно-нижнечелюстном суставе.
После кастрации у детей нередко развиваются аномалии прикуса, рост лицевой части продолжается дольше, чем обычно, что может привести к непропорциональному развитию лица.
Гипогонадизм. Функция гонад оказывает большое влияние на формирование зубочелюстной системы. При юношеском гипогонадизме сохраняются нормальные черты лица, тонкая, мягкая, бархатистая кожа.
У евнухоидов-мужчин зубы обычно резистентны к кариесу. Евнухоидизм обычно сопровождается замедлением процесса минерализации коронок постоянных зубов, а также их прорезывания и формирования. Развитие деформаций лицевого скелета сопровождается аномалией прикуса. Отмечается непропорциональность развития нижней челюсти — значительный рост тела по сравнению с восходящей ветвью. Известно, что вследствие отсутствия в крови тестостерона или эстрогенов зоны роста костей остаются длительное время открытыми. По-видимому, это связано с влиянием половых гормонов на продукцию гормона роста аденогипофизом.
Синдром Клайнфелтера (ХХY-синдром). Распространенной формой мужского гипогонадизма является синдром Клаинфелтера — тестикулярная дистенезия. Для этого заболевания характерны высокий рост и евнухоидное телосложение.
При стоматологическом обследовании взрослых больных (18 — 37 лет) с синдромом Клайнфелтера выявляются следующие изменения: женственные черты лица, аномалии формы коронок отдельных зубов (увеличение размера и изменение формы боковых резцов верхней челюсти). Наблюдается ретенция и дистония клыков верхней челюсти, патологическая сгораемость жевательной поверхности моляров, хронический катаральный гингивит и резорбция межзубных перегородок.
Синдром Шерешевского— Тернера. У детей и подростков (12—16 лет) с синдромом Шерешевского — Тернера, выявлены различные отклонения в структуре лицевого черепа, выражающиеся в нарушении пропорциональности его развития (уменьшение передневерхней высоты лица, длины верхней челюсти и переднего отдела основания черепа). Характерно высокое переднее положение височнонижнечелюстного сустава, уменьшение длины тела нижней челюсти и ее высоты в области первых моляров.
Применение анаболических стероидов у детей с данной патологией способствует стимуляции роста скелета, в том числе и лицевого, но лишь в известных пределах. Применение эстрогенов для феминизации в известной мере усугубляет нарушение развития лицевого скелета.
90. Понятие о недостаточности кровообращения; ее формы, основные гемодинамические показатели и проявления.
Недостаточность кровообращения — наличие дисбаланса (несоответствие) между потребностью органов и тканей в кислороде, питательных веществах и доставкой этих агентов с кровью.
Причины: расстройства сердечной деятельности, нарушения тонуса стенок кровеносных сосудов и изменения ОЦК и/или реологических свойств крови.
Виды: классифицируют по критериям компенсированности расстройств, остроте развития и течения, выраженности признаков.
— компенсированные (признаки расстройств кровообращения выявляются при нагрузке)
— некомпенсированные (признаки нарушения кровообращения обнаруживаются в покое)
Острота развития и течения:
— острая (развивается в течение нескольких часов и суток).
Частые причины: инфаркт миокарда, острая сердечная недостаточность, некоторые аритмии (тахикардия, выраженная брадикардия, мерцательная аритмия и др.), шок, острая кровопотеря.
— хроническую (развивается на протяжении нескольких месяцев или лет) Причины: перикардиты, длительно текущие миокардиты, миокардиодистрофии, кардиосклероз, пороки сердца, гипер- и гипотензивные состояния, анемии, гиперволемии различноro генеза.
Стадия I — начальная — первой степени. Признаки: уменьшение скорости сокращения миокарда и снижение фракции выброса, одышка, сердцебиение, утомляемость. Выявляются при физической нагрузке и отсутствуют в покое.
Стадия II — второй степени (умеренно или значительно выраженная недостаточность кровообращения). Указанные для I стадии признаки обнаруживаются не только при физической нагрузке, но и в покое.
Стадия III — конечная — третьей степени. Характеризуется значительными нарушениями сердечной деятельности и гемодинамики в покое, а также развитием существенных дистрофических и структурных изменений в органах и тканях.
91 Сердечная недостаточность, ее виды. Этиология и патогенез.
Сердечная недостаточность – состояние, при котором сердце не может обеспечить органы и ткани достаточным количеством артериальной крови.
1.Миокардиальная – вследствие действия повреждающих факторов на миокард.
Физические – механическая травма, действие электрического тока
Химические – высокие концентрации БАВ, этиловый спирт
Биологические – стрептококки, стафилококки и их токсины
2.Перегрузочная – вследствие перегрузки сердца.
Перегрузка объемом – чрезмерное ↑ объема притекающей к сердцу крови (при ↑ОЦК, деформации клапанов сердца)
Перегрузка давлением – сопротивление, крое оказывается при выбросе крови (при сужении аорты, перегрузки легочной артерии).
По первичности нарушения сократительной функции миокарда
1.первичная(кардиогенная) — ↓ сократит. способности миокарда при его повреждении
1.Левожелудочковая; 2.Правожелудочковая; 3.Тотальная
Этиологические факторы → нарушения энергообеспечения к/м, повреждение мембран и ферментов к/м, дисбаланс ионов и жидкости к/м. расстройства регуляции миокарда → силы и скорости сокращения и расслабления миокарда → СН.
1.↑сократимости миокарда при ↑ его растяжимости; 2. сократимости миокарда при возрастании нагрузки на него; 3. сократимости сердца при ↑ЧСС; 4. сократимости сердца при ↑ симпатоадреналовых влияний на него.
1.Рост к/м происходит быстрее, чем образование капилляров; 2.Рост к/м быстрее, чем нервные волокна; 3.Несоответствие между ростом к/м и образованием митохондрии.
Застой крови в тех отделах, из которых кровь притекает к сердцу.
Проявления л/ж СН – застой крови в МКК
-одышка; -кашель(с мокротой и примесью крови); -признаки сердечной астмы, приступ удушья; -отек легкого
Проявления п/ж СН – застой крови в БКК
-↑ печени в размере (боль в правом подреберье); -↑ селезенки в размере (боль в левом подреберье); -↑ яремных вен (в шее); -асцит (накопление крови в брюшной полости); -гидроторакс (накопление жидкости в плевральной полости); -гидроперикард (жидкость накапливается в области перикарда); -цианоз (синюшность кожных покровов); -↑ т-ра;
В тяжелых случаях – сердечная кахексия
92 Ишемическая болезнь сердца. Причины и механизмы развития.
Ишемия — несоответствие между притоком к тканям и органам артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям.
Причины Причины ишемии могут иметь различное происхождение и природу.
По природе причины ишемии делят на физические, химические и биологические.
Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры.
Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета. Примеры: никотин, ряд ЛС (мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины).
Биологические факторы: БАБ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелии), БАВ микробного происхождения: их экзо- и эндотоксины, метаболиты с вазоконстрикторным действием.
По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное).
Дата добавления: 2019-02-12 ; просмотров: 40 ; ЗАКАЗАТЬ РАБОТУ
источник
Эндокринная система (от греч. endon внутри и krino отделять, выделять) система, состоящая из специализированных структур, расположенных в центральной нервной системе, различных органах и тканях, а также желез внутренней секреции, вырабатывающих специфические биологически активные вещества — гормоны.
Наряду с нервной эндокринная система участвует в регуляции функций различных систем, органов и метаболических процессов, является важнейшим звеном координации функций, обеспечивающих единство организма, сохранение его гомеостаза, его связь и приспособление к внешней среде. Как любая функциональная система, она включает в себя три звена или компонента:
1. афферентный, воспринимающий аппарат, представленный всеми видами экстеро-, проприо— и интерорецепторов функциональных элементов органов и тканей;
2. центральное звено регуляции сосредоточено в симпатических и парасимпатических центрах вегетативного отдела нервной системы, особенно в гипоталамусе.
3. исполнительный (эффекторный) аппарат в виде желез внутренней секреции: гипофиз, щитовидная железа, паращитовидные железы, поджелудочная железа, надпочечники и половые железы.
Общие причины и механизмы патологии эндокринной системы:
1) инфекции и интоксикации;
2) острые и хронические воспаления;
3) наследственные дефекты биосинтеза гормонов;
6) недостаточность кровообращения.
В механизмах нарушения функций эндокринной системы выделяют четыре патогенетических пути:
1) нарушение центральных механизмов регуляции,
3) нарушение активности гормонов на периферии,
4) нарушение принципа обратной связи между гипофизом и периферической железой, между количеством гормонов и выработкой тропных гормонов — + взаимодействие по Завадовскому.
1. Этиология и патогенез нарушений центральных механизмов регуляции эндокринных желез. Это связано прежде всего с состоянием гипоталамуса (hypothalamus). Его поражение может быть
1) первичным: воспаление, опухоли, кровоизлияния и
2) вторичным в результате патологического влияния на гипоталамус ретикулярной формации и вышележащих отделов центральной нервной системы (лимбической системы, коры головного мозга).
2. Патология самих желез. Причины и патогенез:
3) опухоли: а) инсулома, б) аденома гипофиза,
4) недостаток кровообращения (гипоксия → диабет).
3. Этиология и патогенез периферических внежелезистых механизмов — это нарушение активности гормонов уже выделенных и циркулирующих в крови:
1) слишком прочная связь гормона с белком носителем плазмы крови (например, липопротерический диабет), или слишком рыхлая (тиреотоксикоз),
2) нарушение инактивации гормонов в тканях, особенно в печени. При гепатитах и циррозах усиление активации инсулиназы при гипоксии в печени и образование внепанкреатической инсулиновой недостаточности,
3) аутоагрессия к молекуле гормона в результате образования антител, блокирующих белковые и полипептидные молекулы гормонов в крови,
4) нарушение соединения гормона со своими рецепторами: а) в клетках-мишенях или б) с рецепторами соответствующих ферментов и нарушение механизмов аллостерического эффекта (например, глюкокортикоиды находятся на гексокиназе вместо инсулина).
В результате этих внежелезистых механизмов гормона в крови достаточно, или его содержание в крови даже повышено, но действия своего он не проявляет.
4. Этиология и патогенез нарушения принципа обратной связи. Большое значение в механизмах нарушения эндокринных желез имеет нарушение принципа обратной связи или закона + — взаимодействия по Завадовскому между гипофизом и периферическими железами. Об этом механизме особенно важно помнить при введении в организм гормонов с лечебной целью, которые вызывают:
1) угнетение эндогенной выработки гормонов, что ведет
2) к гипофункции соответствующих желез, а при длительном введении гормонов даже к
3) атрофии. Это особенно опасно в отношении коры надпочечников. Например, при длительном лечении ревматизма по . наступает атрофия надпочечников и после отмены гормонов развивается синдром отмены — острая надпочечниковая недостаточность, что ведет к резкому снижению сопротивляемости организма. В итоге любое стрессовое состояние, бытовая или операционная травма, может закончиться смертью в результате острой кортикостероидной недостаточности.
Гипофиз (hypophysis) занимает в . особое место. Он
1) Вырабатывает этиопные гормоны, стимулирующие выработку гормонов периферических желез. В передней доле вырабатываются: АКТГ → на кору надпочечников, СТГ имеет широкий спектр действия, ТТГ — тиреотропный, паратиреотропный, ГТГ — гонадотропный. В задней доле — вазопрессин (АДГ) и окситоцин. Межуточная доля — интермедин и меланоформный гормон.
2) Гипофиз является переходным звеном с нервных на гуморальные механизмы, осуществляющий включение нейрогуморальной регуляции функций.
Гипофиз находится под контролем высших отделов и коры головного мозга. В свою очередь гормоны гипофиза оказывают влияние на кору головного мозга прямым путем через кровь, попадая в общий кровоток .
Нарушения выработки СТГ (анаболический гормон, вырабатывается в эозинофильных клетках передней доли гипофиза).
Механизм действия СТГ проявляется в стимуляции роста
1) костей за счет улучшения их кальцификации в результате активации щелочной фосфатазы;
2) рост мышц и внутренних органов под влиянием СТГ обеспечивается за счет увеличения и ускорения синтеза белка.
Избыток образования СТГ в раннем возрасте ведет к макросомии или гигантизму за счет усиления роста костей и внутренних органов. У лиц с законченным физическим развитием избыток СТГ ведет к акромегалии. Акромегалия характеризуется прежде всего увеличением периостального роста и разрастанием выдающихся частей тела: челюсти, кисти рук, стопа, череп. За счет разрастания соединительной ткани увеличиваются и мягкие ткани и внутренние органы: спленомегалия, увеличены язык, печень, почки, сердце. Установлено, что если в норме в крови СТГ 16 мг%, то при акромегалии до 30 мг%. Возникновение акромегалии связано с первичным разрастанием клеток гипоталамуса и увеличением выработки соматотропина, стимулирующего СТГ, а изменения гипофиза вторичны. Разрастание опухоли в гипоталамусе нередко приводит к стимуляции других тропных гормонов и у больных кроме акромегалии могут быть:
1) гиперфункция щитовидной железы — тиреотоксикоз,
2) увеличение выработки половых гормонов,
3) полиурия и полидипсия — явление несахарного диабета (diabetes insipidus).
Как особую форму патологии выработки СТГ выделяют евнухоидальный гигантизм — он проявляется высоким ростом, но недостатком половых гормонов и половых функций. При снижении обмена веществ развивается ожирение. Механизм этого явления обусловлен комбинацией в виде недостатка выработки гонадотропного гормона и увеличения выработки СТГ.
Этиология и патогенез недостатка выработки СТГ. Если недостаток выработки СТГ развивается в период роста — возникает карликовый нанизм, человек маленького роста (до 1 метра), но пропорции тела сохранены, в отличие от кретинов умственное развитие не страдает. Карликовый рост происходит от недостатка роста 1) костей, 2) тканей и 3) органов из-за недостатка синтеза белка. Вот почему лицо карлика детское по своим размерам, но выражение его старческое. Недостаток СТГ, как правило, сопровождается недостатком щитовидной железы, снижением обмена веществ и отложением жира — маленькие, толстенькие. Недостаток функции половых желез ведет к инфантилизму. Причинами недостатка СТГ, ведущими к карлику, могут быть:
1) первичная врожденная наследственно обусловленная неполноценность гипоталамоцитов, обеспечивающих выработку соматотропина,
2) перерождение эозинофильных клеток при поражении их инфекцией или интоксикации. Особенно тяжелые изменения в организме возникают при полном разрушении гипоталамуса опухолью, при воспалении → происходит нарушение выработки рилизинг-факторов и развивается вторичная гипофизарная недостаточность или пангипопитуитаризм. Помимо локальных нарушений выработки отдельных тропных гормонов, патология гипофиза может быть обусловлена поражением его долей или тотальным разрушением всего гипофиза и недостаток функции ведет к развитию гипофизарной кахексии или болезни Симондса.
Причины тотального поражения гипофиза:
1. Морфологического характера:
д) травма основания черепа,
При этом на 1-й план выступает недостаточность СТГ и надпочечников, преобладание процессов распада над синтезом и постепенное развитие прогрессирующей кахексии.
Другой формой пангипопитуитаризма является
2. функциональное нарушение — психогенное, невротическое подавление активности всего гипоталамуса и недостаток всех рилизинг-факторов: проявляется потерей аппетита, анорексией, полным истощением и гибелью.
Этиология и патогенез нарушения образования АКТГ (вырабатывается базофильными клетками). Его выработка стимулируется специфическим рилизинг-фактором — кортикотропином, который вырабатывается в заднем симпатическом отделе гипоталамуса. Кортикотропин очень активен — его концентрация 10 мг/кг уже вызывает увеличение выработки АКТГ.
Причины увеличения выработки АКТГ:
1) Стрессовые состояния, действующие на организм постоянно и повседневно, особенно психоэмоциональные стрессы.
Физические, механические, химические и биологические стрессоры и травмы, электрический ток, свет, шум, инфекционные заболевания, отморожения одним словом — любые чрезвычайные воздействия, вызывающие раздражение с экстеро-, проприо— и интерорецепторов. Усиление выработки АКТГ имеет приспособительный характер.
2) Недостаток функции коры надпочечников и недостаток выработки кортикоидов. Это ведет к снятию их тормозящего влияния на гипофиз и увеличению АКТГ.
3) Третья причина — базофильная аденома гипофиза и избыток АКТГ может привести к болезни Иценко-Кушинга — сегментарное отложение жира на лице и животе, а конечности остаются относительно худыми. Увеличение АКТГ, может быть не связано непосредственно с поражением гипофиза и является вторичным — может быть 1) в гипоталамусе повышение выработки кортикотропина или 2) в надпочечниках разрушение их опухолью, туберкулезом → недостаток глюкокортикоидов по закону + — ведет к усилению выработки АКТГ.
Этиология и патогенез недостатка выработки АКТГ:
1) разрушение заднего симпатического отдела гипоталамуса и недостаток кортикотропина или
2) поражение передней доли гипофиза.
Это ведет к развитию надпочечниковой недостаточности — недостатку гормонов коры надпочечников и резкому снижению сопротивляемости организма.
Надпочечниковая недостаточность острая:
I. Функциональная (при стрессе).
II. Органическая — дифтерия, некрозы, менингококковая инфекция → кровоизлияния → коллапс → смерть.
Хроническая недостаточность надпочечников ведет к развитию болезни Аддиссона (бронзовая болезнь):
а) адинамия — мышечная слабость,
б) пигментация — отложение меланина,
в) недостаток альдостерона → переход натрия из внеклеточного депо внутрь клетки → поступление в клетку воды → отечность, набухание → развитие водной интоксикации,
Патогенез увеличения меланина и бронзовый цвет обусловлены уменьшением образования кортизола → растормаживание секреции меланоформного гормона средней доли гипофиза и усиление синтеза меланина.
Нарушение выработки гонадотропных гормонов. Они вырабатываются в базофильных клетках под влиянием специфических гипоталамических рилизинг-факторов, вырабатывающихся в преоптической зоне гипоталамуса.
В гипофизе вырабатываются:
1) фолликулостимулирующий гормон,
2) лютеинизирующий гормон — пролактин.
Повышение выработки гонадотропных гормонов может вызываться с различных рефлексогенных зон, прежде всего зрительных, слуховых, осязательно — особенно с кожи ладоней, обонятельных — приятные духи.
Недостаток гонадотропных гормонов проявляется гипогенитализмом — нарушением жирового обмена в виде ожирения по типу галифе — отложение жира на ногах.
Нарушение выработки гонадотропного гормона может иметь определенное значение в возникновении некоторых форм адрено-генитальных синдромов — это изменения в организме, которые развиваются при избыточной секреции андрогенов (мужские) или эстрогенов (женские) сетчатой зоны коры надпочечников. Различают:
1. Гетеросексуальный синдром — избыточное образование у данного пола половых гормонов противоположного пола. Если это возникает у женщин — то под влиянием мужских половых гормонов (андрогенов) по механизму обратной связи тормозится в гипофизе образование своих женских гонадотропных гормонов и снижается и атрофируется функция яичников. Господствуют андрогены, образующиеся в избытке в надпочечниках. У женщин атрофируются первичные и вторичные половые признаки, развивается маскулинизация — возникновение вторичных мужских половых признаков — вирилизм — рост волос по мужскому типу. Избыточное образование в надпочечниках эстрогенов у мужчин ведет к феминизации — атрофируются вторичные мужские признаки. Меняются:
4) оволосение по женскому типу — гирсутизм.
2. Изосексуальный адреногенитальный синдром — результат раннего и избыточного образования своих половых гормонов. Это ведет к преждевременному половому и физическому развитию.
Этиология и патогенез нарушения выработки ТТГ. Тиреотропный гормон вырабатывается базофильными клетками передней доли гипофиза, которые стимулируются специфическим рилизинг-фактором — тиреотропином, вырабатывающимся в гипоталамусе в зоне между передними и задними ядрами, и кроме того 2) стимулятором выработки ТТГ являются импульсы из высших отделов ЦНС через sympathicus. Повышение выработки ТТГ ведет к избыточному образованию тироксина и синдрому экзофтальмического тиреотоксикоза. Гипофизарный недостаток ТТГ встречается редко и легко устраняется введением ТТГ.
Этиология и патогенез нарушения функций щитовидной железы. Проявляется в виде
1) гипертиреоза — клинически тиреотоксикоз или Базедова болезнь, и
2) гипотиреоз — клинически у детей кретинизм, у взрослых — микседема.
Причины тиреотоксикоза: 80-90% — психическая травма:
а) ослабление и истощение регулирующих влияний с коры головного мозга;
б) развитие в гипоталамусе застойного очага возбуждения;
в) повышение продукции рилизинг-фактора – тиреотропина → усиленное выделение ТТГ;
д) → усиленное выделение тироксина.
Базедова болезнь чаще встречается у женщин. Это обусловлено физиологическими предпосылками — установлено, что у женщин
1. в предменструальном и особенно в менструальном периодах и во время беременности возникает повышение возбудимости гипоталамоцитов, вырабатывающих рилизинг-фактор тиреотропин → ТТГ → тироксин;
2. патологические процессы в гипоталамусе, усиливающие выработку рилизинг-фактора тиреотропина — травмы, инфекции, вирусы;
3. воспаление щитовидной железы — тиреоидит — как осложнение после гриппа и ангины — сопровождается увеличением образования трийодтиранина;
4. нейроциркуляторные дистонии;
5. образование и выделение в кровь особого белка иммуногенного происхождения в результате аутоиммунных процессов, так как ткань щитовидной железы является естественным аутоантигеном. Этот белок появляется в крови при тяжелом тиреотоксикозе. По своему строению он отличается от ТТГ и обладает медленным стимулирующим действием на щитовидную железу. В связи с замедленным действием это вещество назвали медленно действующий фактор или ЛАДС действующий стимулятор.
6. нарушение периферических внетиреоидных механизмов:
а) более рыхлая и менее прочная связь с белком а-глобулином,
б) быстрое освобождение тироксина и ускоренное поступление его в ткани.
Замедление метаболизма — разрушение тиреоидных гормонов в печени, почках и мышцах или усиленное образование из тироксина более активных токсических метаболитов: трийодтиранина, трийодуксусной кислоты и
в) изменения состава среды, в которой действуют тиреоидные гормоны и в которой усиливается это действие. Установлено, что эффект тироксина увеличивается при повышении концентрации K+ и повышение содержания фосфатов усиливает действие трийодтиранина. Это объясняется изменениями: 1) мембранного потенциала клеток и повышением 2) чувствительности рецепторов клетки к действию гормонов.
Патогенез гипертиреоза и его проявления:
1) нарушение энергетического обмена,
2) повышение основного обмена,
3) увеличение потребления кислорода,
4) нарушение всех видов обмена,
6) нарушение функций центральной нервной системы и
7) сердечно-сосудистой системы.
В основе патогенеза нарушений лежит а) усиленный распад белков → катаболизм, б) повышенная мобилизация гликогена и жира из жировых депо. Возникает преобладание окисления над окислительным фосфорилированием, повышается окисление вне митохондрий, разобщение окисления и окислительного фосфорилирования, уменьшение синтеза АТФ и увеличение его предшественников — АДФ и неорганического фосфора. Все это усиливает окислительные процессы и ведет к рассеиванию энергии. Токсическое влияние тироксина на центральную нервную систему проявляется в дегенеративных изменениях в нервных клетках Бетца и передних рогов спинного мозга. Происходит увеличение ретробульбарной ткани за счет увеличения 1) кислых мукополисахаридов и 2) их оводнения и набухания. Эти изменения в ведут к а) экзофтальму (пучеглазию), б) гиперкинезам, в) мышечному дрожанию.
Экзофтальм вызывается так же секрецией особого экзофтальмического фактора, связанного с ТТГ. Тиреоидные гормоны повышают возбудимость:
в) вегетативных центров, что ведет к нарушению регуляции функций внутренних органов. Особенно страдает при тиреотоксикозе сердечно-сосудистая система — возникает стойкая тахикардия, повышенная реакция сердца на мышечную работу, наклонность к мерцанию предсердий, что может привести к острой сердечной недостаточности и гибели. Поражение сердца связано: с угнетением моноаминооксидазы, разрушающей адреналин; с повышением чувствительности миокарда к катехоламинам (адреналину и норадреналину), со снижением в миокарде АТФ и гликогена. Усиление работы сердца вызывает его гипертрофию и дистрофические изменения в миокарде. Нарастание возбуждения симпатического отдела вегетативной нервной системы приводит к возбуждению и повышению тонуса артериол и повышается артериальное давление,
г) нарушаются функции печени, снижение в ней содержания гликогена ведет к уменьшению ее дезинтоксикационной функции, так как эта функция осуществляется через глюкуроновую кислоту, которая образуется из глюкозы.
Нарушается способность печени синтезировать белки, что ведет к гипопротеинемии и исхуданию.
Этиология и патогенез гипотиреоза и микседемы — может быть первичная врожденная недостаточность вследствие гипоплазии и аплазии щитовидной железы и дефицита тироксина в детском возрасте, что ведет к кретинизму.
У детей возникает недостаток роста и развития. Гипотиреоидные карлики-кретины отличаются от гипофизарных умственным недоразвитием и характерным внешним видом:большая голова с квадратным лбом, короткая шея, длинное туловище, короткие кривые ноги. Причиной приобретенного гипотиреоза у взрослых, ведущего к микседеме, может быть
1. недостаток выработки ТТГ при нарушении функции
а) гипоталамуса и недостаток рилизинг-фактора тиреотропина или
б) недостаток образования ТТГ в гипофизе.
Лечение больных введением ТТГ дает хороший эффект.
2. удаление (оперативное) большей части щитовидной железы по поводу зоба, аденомы, тиреотоксикоза или рака.
3. передозировка тиреостатических препаратов (например, метилтиоурацила).
4. воспалительные (особенно аутоаллергические) процессы в виде тиреоидита.
5. невротические процессы, вызывающие подавление выработки в гипоталамусе тиреотропина.
Могут быть внетиреоидные формы гипотиреоза:
1) в результате прочного связывания тироксина с глобулином или преальбумином и альбумином.
2) блокирование действия тироксина в тканях в результате нарушения электролитного обмена, например повышение содержания в крови и тканях Ca2+,
3) аутоиммунная инактивация гормонов в крови, обусловленная тем, что тиреотропные гормоны в сравнении с другими гормонами обладают наиболее высокой иммунологической активностью,что может вызвать тяжелую лимфоидную инфильтрацию самой ткани щитовидной железы и ее разрушение и возникновение аутоиммунного тиреоидита Хашимото. Основным звеном является снижение интенсивности:
а) окислительных процессов и
В тканях снижается содержание
в) РНК на фоне вялости белкового обмена, происходит задержка в организме азота, снижается синтез белка,
г) снижается активность фосфорилазы — мало образуется АТФ, что ведет к недостатку
е) развивается вялость и депрессия,
ж) ослабляется работа сердца,
з) замедляются психические реакции,
и) ослабляется память и даже может быть слабоумие,
к) ослабляется иммунологическая реактивность, что ведет к снижению устойчивости к инфекционным заболеваниям и создает предпосылки к развитию опухолей. Больные микседемой имеют характерный вид:слизистый отек в результате
в) накопление в соединительной ткани мукополисахаридов, обладающих гидрофильными свойствами.
Этиология и патогенез эндемического зоба:
Причиной его является недостаток в пище йода. Это доказывается возможностью его моделирования в эксперименте путем содержания животных на диете,лишенной йода. Недостаток йода приводит к тому, что хотя синтез тиреоглобулина увеличивается,но его завершение и образование из него ди— и трийодтиранина и тироксина из-за недостатка йода не происходит.
Кроме того снижение содержания в крови йода вызывает стимуляцию гипоталамуса и гипофиза → увеличение ТТГ. Щитовидная железа подхлестывается, но работает в холостую, так как без йода тироксин не образуется. Возникает увеличение массы щитовидной железы за счет разрастания как активных элементов-фолликулов, так и соединительной ткани. Это разрастание может быть диффузным и узловатым. При стимуляции пролиферации в фолликулах и накопления в них коллоида формируется коллоидный зоб.
По характеру функционального состояния зоб может быть:
1) эутиреоидный — когда железа увеличена,а функция остается нормальной,
2) гипотиреоидный — недостаток и
3) гипертиреоидный — тиреотоксикоз (предраковое состояние).
Возникновению этого заболевания препятствует профилактическое введение йода в организм в виде йодированных солей натрия или калия 0.002% — в 6 гр поваренной соли 120 мг йода — оптимальная суточная доза.
В последние годы изучено действие еще одного гормона щитовижной железы – тиреокальцитонина, который снижает содержание Ca в крови,то есть является антагонистом паратиреотропного (паратгормона) паращитовидных желез, который увеличивает Ca. Тиреокальцитонин тормозит выход Ca в кровь из костей и ведет к гипокальциемии. Она в свою очередь стимулирует образование паращитовидными железами паратгормона, который и увеличивает уровень Ca в крови до нормы. В организме имеет место саморегуляция содержания Ca в крови.
Наиболее частые и тяжелые проявления гипопаратиреоза — недостаток паратгормона, ведет к снижению в крови Ca ниже 7-8 мг% — развивается тетания — приступ тетанических судорог, которые могут привести к гибели.
Это может быть при случайном удалении паращитовидных желез во время операции. Гиперпаратиреоз — увеличение выработки паратгормона ведет к обеднению костей Ca → явления остеопороза. Костная ткань заменяется фиброзной и становится мягкой, скелет изгибается, не выдерживает веса.
Влияние гипоталамуса на эндокринные железы осуществляется через гипофиз — гипофизарный путь и парагипофизарный — минуя гипофиз.
1. Гипофизарный путь включает образование в гипоталамусе так называемых рилизинг-факторов (англ. release освобождать). Рилизинг-гормоны имеют полипептидное строение. Они опускаются по
1) аксонам нервных клеток гипоталамоцитов, а затем через
2) капиллярную систему срединного возвышения и
3) венозные сосуды ножки гипофиза попадают в аденогипофиз в котором 1) стимулируют и 2) облегчают выход в кровь тропных гормонов АКТГ, СТГ, ТТГ, партиреотропного и гонадотропного гормонов. Усиление или уменьшение образования в гипоталамусе того или иного стимулирующего фактора ведет к избытку или недостатку соответствующего гормона и гипер— или гипофункции соответствующей эндокринной железы.
2. Парагипофизарный путь осуществляется непосредственным влиянием ЦНС на железы внутренней секреции по нервным проводникам. Эти прямые нервные влияния проявляются
1) в стимуляции секреции (sympathicus → адреналин → усиление образования инсулина — тропный эффект) и
2) регуляции кровоснабжения — например, наиболее частой причиной сахарного диабета является спазм артериол и гипоксия инсуллярного аппарата в результате стойкого возбуждения симпатической нервной системы.
3) влияние на трофику эндокринных желез — в 80% причиной тиреотоксикоза является психическая травма.
Ножка гипофиза состоит из нервных отростков гипоталамоцитов, которые спускаются от супраоптических и супралатеральных ядер гипоталамуса, образуя гипоталамо-гипофизарный тракт т.о ножка гипофиза является как бы прямым продолжением самого гипоталамуса. Кроме того, передняя доля гипофиза связана с гипоталамусом единой сетью кровеносных сосудов →
а) сосуды, идущие к гипоталамусу продолжаются и спускаются в гипофиз, где распадаются на капилляры и образуют синуксы,
б) в верхне-гипофизарную артерию вливается кровь от гипоталамуса,
в) в свою очередь венозная кровь от гипоталамуса также проходит через гипофиз. Такая двойная система распределения артериальной и венозной крови называется портальной и имеет место в печени. Тесная функциональная взаимосвязь между гипоталамусом и гипофизом основана на 1) гормонообразовательной и 2) нейросекреторной функциях. Механизмы нейросекреторной ф-ции: рилизинг-факторы. В настоящее время их выделено до 10 видов, они облегчают образование и выход в кровь гормонов из различных отделов гипофиза. Рилизинг-факторами задней доли гипофиза явл-ся биологически активные вещ-ва: вазопрессин и окситоцин. Они образуются в супраоптических ядрах гипоталамуса и по ножке стекают в заднюю долю гипофиза. Пока не изучено, подвергаются ли они каким-либо превращениям или просто депонируются в гипофизе.
Нейрогормоны гипофиза в свою очередь действуют на клетки гипоталамуса через ликвор желудочков, в который они попадают из крови и лимфы. Все эти механизмы называются гипоталамо-гипофизарной или диэнцефальной системой. В нее входит: гипоталамус, ножка гипофиза, аденогипофиз, спиномозговой ликвор.
Как Вам известно из курса анатомии, гипоталамус — это небольшой участок в среднем мозге величиной с фалангу мизинца. Состоит из ряда ядер, в которых осуществляется 1) интеграция и 2) координация: а) симпатической (в задних ядрах) и б) парасимпатической (в передних) регуляции.
источник