Абсцесс в переводе с латинского означает «гнойник». В медицине под этим термином понимают ограниченное скопление гнойного экссудата в тканях и органах. Гнойное воспаление может возникнуть в любом месте. Абсцесс мягких тканей – это пространство, заполненное гнойным экссудатом и расположенное под кожей в жировой клетчатке или мышцах. Заболевание характеризуется отеком, покраснением и болезненностью кожи.
Абсцесс, или нарыв – гнойно-воспалительное заболевание, характеризующееся биологической деструкцией ткани и образованием в ней гнойной полости. Гнойно-воспалительное заболевание может возникать как самостоятельное или быть осложнением каких-либо патологий.
Нарыв может возникнуть в мышцах, подкожной клетчатки, костях, органах или между ними. В зависимости от локализации выделяют паратонзиллярный, заглоточный, аппендикулярный, абсцесс мягких тканей и пр. Чаще инфекция является экзогенной (возбудитель проникает извне), но бывают случаи эндогенной инфекции. Возбудитель может попасть как из близлежащих, так и отдаленных органов.
Заболевание является довольно распространенным. По некоторым данным ежегодно с подобной проблемой обращаются за медицинской помощью около 14 миллионов пациентов.
Основное отличие абсцесса мягких тканей (фото представлено ниже) – наличие капсулы (пиогенной мембраны). Такие капсулы присущи гнойникам любой локализации даже для тех, которые появляются во внутренних органах. Пиогенная мембрана нарывов мягких тканей выполняет очень важную роль – препятствует распространению гнойно-воспалительного процесса на близлежащие анатомические структуры. Однако избыточное количество экссудата может привести к истончению капсулы с последующим ее разрывом и выходом гнойного содержимого в окружающие пространства.
Еще одним плюсом гнойников мягких тканей является их локализация. Нарывы находятся на поверхности, что способствует наиболее точному диагностированию с назначением адекватной терапии.
По МКБ-10 абсцесс мягких тканей имеет код L02. Туда также включены фурункулы и фурункулезы. Международные стандарты относят заболевание к инфекциям мягких тканей и кожи.
При травмировании кожного покрова вследствие хирургических операций или при воспалительных патологиях возникают осложнения. В организм проникает инфекция и образуется абсцесс и инфильтрат. Последний – это скопление в ткани клеточных элементов с примесью крови и лимфы.
Несмотря на общую этиологию и патологическую анатомию – это два разных патологических процесса. Абсцесс мягких тканей от инфильтрата отличается следующим:
- Наличие жидкости в замкнутой полости. При абсцессе жидкость – гнойный экссудат, при инфильтрате вообще нет полости, ткань пропитана продуктами распада воспалительного процесса.
- Инфильтрат может возникнуть из опухолевых клеток, а абсцесс вызывается только патогенными микроорганизмами.
- Инфильтрат может привести к образованию абсцесса, а вот наоборот не бывает.
Гнойники мягких тканей классифицируют по-разному. Основной считается этиотропная систематизация:
- Простые – мономикробные с локализованными клиническими данными. Основные возбудители – стафилококк (чаще золотистый) и бета-гемолитический стрептококк. Чаще всего они небольших размеров, расположены на поверхности и легко поддаются лечению
- Сложные – могут быть моно- или полимикробными. Возбудителем выступает стафилококк в ассоциации с кишечной палочкой, протеем и прочими микроорганизмами, в основном анаэробными. Сложные проникают глубоко в ткани, фолликулы. По МКБ-10 абсцесс мягких тканей и фурункулы объединены в одну категорию и имеют общий код.
Классификация по характеру течения:
- Острый, характеризуется небольшим очагом воспаления и однослойной капсулой. На ранних стадиях воспаления стенки капсулы покрыты гнойно-фиброзными наложениями и частицами расплавленной ткани.
- Хронический абсцесс отличается тяжелым течением с обширной общетоксической симптоматикой. Образуется двухслойная пиогенная мембрана. Внутренний слой состоит из грануляций и обращен в полость, наружный состоит из зрелой соединительной ткани.
В отдельные группы выделяют следующие абсцессы:
- Холодный – скопление гноя в небольшой ограниченной полости, без каких-либо проявлений воспалительного процесса (покраснение, болезненность, повышение температуры). Такая инфекция является эндогенной и наблюдается при туберкулезе или актиномикозе.
- Натечный абсцесс протекает практически бессимптомно. Развиваться может в течение нескольких месяцев без признаков, характерных для воспалительного процесса. Опасность заключается в том, что люди не придают такому гнойнику значения и не занимаются терапией. А тем временем он переходит в хроническую форму.
Главная причина формирования абсцесса – попадание в организм патогенной микрофлоры. Чаще всего возбудителем инфекции является стафилококк, но посевы определяют наличие и других микроорганизмов:
- Эпидермальный, гемолитический, золотистый стафилококк.
- Стафилококки, чаще всего определяется бета-гемолитические, встречаются и пневмококковые. Последние характерны при осложненных эндогенных абсцессах.
- Грамотрицательные бактерии: кишечная палочка.
- Протей. Среда обитания данного вида энтеробактерий – почва и вода. В организм патоген попадает, как правило, через грязный водоем.
- Синегнойная палочка отличается высокой антибиотикорезистентностью. Является возбудителем нозокомиальных (внутрибольничных) инфекций.
- Клебсиеллы встречаются на коже, слизистых. Толчок к их биологической активности дает ослабленная иммунная система.
- Шигелы. Бактерионоситель и источник инфекции – больной человек.
- Палочка Коха.
Можно определить возбудителя абсцесса мягких тканей по гнойному содержимому, точнее по его характеру (запах, цвет). Опытные врачи по таким характеристикам ставят предварительный диагноз.
- Для гнилостной микрофлоры (кишечная палочка) характерны серый цвет и зловонный запах.
- Если возбудитель стафилококк – желто-зеленый гнойный экссудат.
- Сладковатый запах и сине-зеленый цвет экссудата характерен для синегнойной палочки.
Гноеродные микробы чаще всего попадают в организм при нарушении целостности кожи (раны, царапины). Гнойный процесс может возникнуть при распространении бактерий лимфогенным или гематогенным путем из уже имеющихся очагов воспаления.
Часто гнойно-воспалительное заболевание формируется на фоне других затяжных инфекций. Способствует развитию абсцесса мягких тканей хронический тонзиллит, синусит. Особую роль в развитии гнойников играет сахарный диабет.
Абсцесс возникает либо в омертвевших тканях, где происходят процессы аутолиза (саморастворение клеток под воздействием ферментов), либо в живых тканях, подверженных агрессивному воздействию патогенных микроорганизмов.
При попадании инфекции в организм активизируется иммунитет. Основными «защитниками» являются лейкоциты (нейрофильные, базофильные). Через 6-8 часов после внедрения инфекционного агента нейрофилы из сосудистого русла переходят в слизистые. При помощи хемоаттрактантов нейрофильные лейкоциты проникают к воспаленному очагу.
В начальной стадии гнойного процесса пораженное место инфильтруется (пропитывается) воспалительной жидкостью и лейкоцитами. Со временем под воздействием ферментов нейтрофилов ткань подвергается расплавлению, образуется внутреннее пространство, заполненное экссудатом. Гной в полости – это лизосомные ферменты остатков нейрофилов. Стенки абсцесса мягких тканей со временем образуют двуслойную пиогенную мембрану. Она не дает экссудату распространяться на соседние анатомические структуры.
Общие симптомы абсцессов такие же, как и при любых воспалительных процессах, сопровождающихся образованием гноя. Выраженность клинических проявлений определяется нескольким факторами:
- Состоянием человека. Люди имеют неоднородную восприимчивость к различным патогенным агентам, реакция может проявляться по-разному.
- Токсичностью инфекционного агента. Некоторые виды бактерий даже в очень маленьком количестве способны вызывать тяжелые воспалительные процессы.
- Обширность воспаления.
- Распространенность некротических изменений.
При абсцессах наблюдаются как местные, так и общесоматические симптомы.
- Гиперемия в месте воспаления.
- Небольшая припухлость.
- Повышение температуры в области абсцесса.
- Болезненные ощущения.
- При глубоких некротических изменениях наблюдается общее недомогание, повышение температуры тела до 40 °С с ознобом.
При туберкулезной этиологии гнойно-воспалительный процесс распространяется далеко от места возникновения. Например, может возникнуть натечный абсцесс мягких тканей бедра (в основном на медиальной поверхности).
Большие гнойники, возникшие на поверхности кожи конечностей, влияют на их функциональность. При ходьбе или движении руками возникает боль, что резко ограничивает двигательную активность.
Абсцесс мягких тканей ягодицы, возникший в результате внутримышечного введения лекарственных препаратов, обычно сопровождается сильными болевыми ощущениями. Воспаленная область может приобретать бордовый или даже синий оттенок. Образование гематомы препятствует прорыву капсулы наружу и создает риск формирования сепсиса.
При тяжелом течении гнойно-воспалительного процесса с преобладающей интоксикацией возникают проблемы в выяснении причин тяжелого состояния больного. Причин такого состояния может быть несколько:
- Гнойно-резорбтивная лихорадка – всасывание токсических продуктов распада в кровь из очага воспаления. При значительном скоплении гноя он проникает через мембрану. Всасывание происходит лимфогенным и гематогенным путями.
- Генерализация инфекции или сепсис – общая гнойная инфекция, вызванная попаданием в циркулирующую кровь возбудителей и их токсинов. Для инфекции характерны интоксикационный, тромбогеморрагический синдромы, метастатическое поражение тканей.
- Еще одно осложнение абсцесса мягких тканей – флегмона. Гнойный процесс имеет тенденцию к распространению. Флегмона отличается общим недомоганием, высокой температурой, болезненностью пораженной области при движении или ощупывании.
- Неврит может возникнуть вследствие гнойного расплавления стенки крупного сосуда и находящегося в нем нервного ствола.
- Остеомиелит. При распространении гнойного процесса на кости может развиться воспаление костного мозга.
Физикальным осмотром, сбором анамнеза, а также назначением диагностических мероприятий занимается гнойный хирург. При проведении опроса врач обращает внимание на наличие перенесенных инфекций, появление воспалений после травм, хирургических операций, инъекций.
В ходе физикального осмотра врач определяет следующее:
- Во время осмотра наблюдается отечность тканей и покраснение кожи в области абсцесса. Температура в месте воспаления гораздо выше. Кожа на поверхности гнойного образования сильно истончена, через нее просматривается экссудат.
- При пальпации ощущается возвышенность в месте воспаления, пациент при прощупывании испытывает боль. При нажатии на гнойный очаг отмечаются характерные волны – флюктуация.
В диагностические мероприятия включены лабораторные анализы:
- Микроскопический метод исследования позволяет изучить морфологические и тинкториальные свойства микробов.
- Бактериальный посев. С его помощью определяют возбудителя и его резистентность к антибактериальным препаратам.
- Клинический анализ крови.
- При подозрении на туберкулез делают пробу Манту.
Инструментальные методы диагностики:
- УЗИ абсцесса мягких тканей позволяет изучить глубокие и некротические гнойники.
- Диагностическая пункция проводится с той же целью, что и сонография.
- Рентгенологическое обследование назначают при подозрении на туберкулез.
Клинические проявления абсцессов имеют много общего с некоторыми патологическими состояниями. Дифференциальная диагностика позволяет не только подтвердить диагноз, но и определить характер воспаления, глубину пиогенной мембраны, выявить наличие некротических тканей. Диагностика включает сонографию, лабораторные анализы и другие методы исследования гнойник необходимо дифференцировать от:
- Инфильтрата.
- Распадающейся опухоли. Под воздействием продуктов распада возникает сильная интоксикации с характерными симптомами, также свойственными абсцессу.
- Инородного тела. Абсцесс мягких тканей на УЗИ выглядит как темное скопление жидкости с серым содержимым внутри, тогда как инородное тело имеет характерный вид, небольшие кусочки стекла могут вообще не просматриваться.
Терапия определяется в зависимости от течения гнойного процесса, самочувствия пациента. На начальных стадиях назначается консервативная терапия. Основная ее задача – вызвать самопроизвольный наружный прорыв капсулы. Применяют тепловые компрессы, прикладывают грелку. Назначают противовоспалительные препараты («Демиксид», мазь «Биопин») и УВЧ-терапию.
В большинстве случаев пациенты обращаются на более поздних стадиях гнойно-воспалительного заболевания, когда консервативное лечение абсцесса мягких тканей неэффективно. Такие гнойники подлежат хирургическому лечению. Вскрытие и дренирование очага воспаления обычно проводят хирург с медсестрой в амбулаторной операционной. Манипуляция выполняется с применением местной анестезии путем пропитывания тканей новокаином 0,5 % или внутривенным наркозом («Эпонтол», «Тиопентал натрия»). Рассечение проводят по всей длине гнойника, чтобы был обеспечен свободный отток экссудата. Вскрытую полость промывают антисептическим раствором до абсолютного очищения и устранения наркотизированной ткани. Для послеоперационной инцизии в полость абсцесса вставляют полихлорвиниловую трубку, турунды с солевым раствором.
При глубоких абсцессах через небольшой разрез проводят очищение внутренней стенки с отсасыванием содержимого, дренирование полости с промыванием и активной аспирацией.
Применение антибиотиков при абсцессах мягких тканей назначается, если после хирургического лечения интоксикационная симптоматика не ослабевает. Применение антибактериальных препаратов целесообразно при подозрении на генерализацию инфекции или гнойно-резорбтивную лихорадку.
Абсцессы – довольно опасное заболевание. Прорыв пиогенной мембраны с выходом гнойного экссудата во внутренние пространства грозит сильнейшей интоксикацией. Этиология заболевания хорошо изучена, что позволяет принимать меры по ее профилактике. Предупредительные мероприятия не являются специфическими и мало чем отличаются от правил антисептики.
- Своевременная и полная обработка ран.
- При ожогах, обморожениях терапию должен осуществлять врач и контролировать процесс до полного выздоровления.
- Соблюдение правил антисептики при инъекциях и других медицинских процедурах.
- Адекватная терапия любых заболеваний инфекционного генезиса.
- При подозрительных нарывах немедленно обращаться к врачу.
При своевременном обращении и назначении адекватной терапии прогноз на выздоровление благоприятный. По мере выздоровления устраняется неприятная симптоматика, пациенты возвращаются к привычной жизни. Применение антибиотиков при абсцессах мягких тканей может вызвать нарушения микрофлоры кишечника. Для восстановления следует пройти курс пробиотиков. В противном случае патогенные микроорганизмы могут вновь вызвать инфекцию.
источник
Абсцессом мягких тканей называется полость, заполненная гноем (пиогенной мембраной или инфильтративной капсулой) и расположенная в подкожной жировой клетчатке или мышцах. Она имеет четкие границы, отделяющие ее от окружающих здоровых тканей.
При накоплении большого количества гноя пораженная область увеличивается, капсула истончается и повышается вероятность прорыва абсцесса с выходом гнойного экссудата в расположенную рядом здоровую клетчатку и межмышечные пространства.
В результате развивается обширное разлитое воспаление, называющееся флегмоной. Кроме того, абсцесс в запущенной форме может вызвать сепсис, гнойное расплавление стенок кровеносного сосуда, нервного ствола (что приводит к невриту) и расположенной рядом кости (возникновение остеомиелита).
- Проникновение инфекции в мягкие ткани при нарушении кожного покрова в результате травм, ранений, порезов, отморожений, открытых переломов, ожогов. Возбудителями являются:
- стафилококки, вызывающие абсцесс в четверти случаев;
- кишечная палочка, часто инфицирующая ткани вместе со стафилококками;
- микобактерии туберкулеза, которые вызывают «холодный» абсцесс мягких тканей, возникающий при туберкулезе костей и суставов;
- стрептококки;
- протей;
- синегнойная палочка;
- клостридии и др.
- Введение под кожу вместе с лекарственными препаратами инфицированного содержимого или медикаментов, предназначенных только для внутримышечных инъекций. В результате абсцесса, возникшего по этой причине, может развиться асептический некроз клетчатки и гнойное расплавление мягких тканей. Гной при этом остается стерильным.
- Распространение бактерий через кровь и лимфу при наличии в организме гнойных очагов: карбункула, фурункула, гнойной ангины, перитонита, пиодермии.
- Попадание в ткани жидкостей, которые вызывают их некроз. К таким веществам относятся бензин, керосин и др.
- длительные заболевания ЖКТ (энтероколит, язва желудка, дуоденит, хронический гастрит);
- расстройства периферического кровообращения;
- наличие в организме человека различных хронических инфекций (тонзиллит, синусит, фарингит);
- нарушение обмена веществ (сахарный диабет, ожирение, авитаминоз, гипотериоз).
Развитию постинъекционного абсцесса способствуют:
- пролежни, длительный постельный режим и общее ослабление организма;
- несоблюдение техники внутримышечных инъекций, в результате чего игла попадает в сосуд с последующим развитием гематомы и ее инфицированием;
- введение препаратов, раздражающих ткани и попадающих под кожу (анальгина, сульфата магния, кофеина и т.д.).
Сначала на поверхности кожи появляется инфильтрат без четких границ. Затем формируется абсцесс с характерными признаками:
- Боль в пораженном участке, его отечность и покраснение.
- Флюктуация, которая является свидетельством скопления жидкого содержимого внутри очага. Она определяется следующим образом: пальцы обеих рук помещают в центре воспаленной области близко друг к другу и надавливают на кожу. Пальцы левой руки не двигаются, а правой — производят легкие толчки, которые при наличии жидкости в замкнутой полости с эластичными стенками передаются на левую руку. И наоборот, толчки, производимые левой рукой, ощущают пальцы правой.
Чем ближе к поверхности расположена полость и тоньше ее стенки, тем отчетливей определяется флюктуация. При глубоко расположенных гнойниках обнаружить ее трудно, поэтому симптом наличия жидкости появляется поздно. В последнем случае признаками, указывающими на абсцесс, будут изменения в общем состоянии больного.
Иногда может возникнуть ощущение ложной флюктуации (к примеру, при липоме). В этом случае толчки от одной руки к другой передаются только в одном направлении, а при изменении положения рук ощущение зыбления исчезает.
- Общесоматические изменения:
- слабость, разбитость и повышенная утомляемость;
- головная боль;
- высокая температура тела, достигающая 39-40 градусов и сопровождающаяся ознобом;
- нарушение сна;
- потеря аппетита.
Эти симптомы неспецифические и указывают на общую интоксикацию организма, возникающую из-за всасывания в кровь токсинов, которые образуются в результате распада тканей внутри пораженной полости. Такие признаки могут указывать и на распространение гнойного процесса с высокой вероятностью развития сепсиса.
Признаки послеинъекционного абсцесса
- повышение температуры;
- наличие инфильтрата на месте инъекции, при надавливании на который возникает боль, нарастающая через 4-6 дней после укола (как правило, в ягодичной области);
- отек и покраснение кожи;
- появление флюктуации через 2-3 дня после инъекции.
В первую очередь специалисты проводят осмотр пораженной области. Этого метода диагностики бывает достаточно при поверхностном поражении тканей. Если полость с гнойным содержимым расположена глубоко, направляют на ультразвуковое или рентгенологическое исследование.
При любой форме абсцесса производится диагностическая пункция инфильтрата с помощью толстой иглы и исследование содержащихся в гное бактерий. Это необходимо для того, чтобы определить чувствительность микроорганизмов к антибиотикам с целью назначения адекватной терапии. При подозрении на «холодный» абсцесс мягких тканей пациент направляется на рентген и ПЦР анализы на туберкулез.
Обязательно выявляются фоновые заболевания пациента. Для их диагностики могут потребоваться консультации эндокринолога, гастроэнтеролога или отоларинголога.
Важно начать своевременное лечение заболевания. При его отсутствии высока вероятность сепсиса с обильным затеком гноя в клеточные пространства.
На ранних стадиях при поверхностном поражении тканей назначают лечение холодом, которое может привести к рассасыванию гноя. Если улучшений нет, но флюктуация еще не обнаруживается, то переходят к применению тепла. Это могут быть согревающие компрессы, грелки, физиотерапевтические процедуры. При наличии полости, наполненной жидкостью, показано вскрытие абсцесса путем хирургического вмешательства, предполагающего его разрез и дренирование.
После операции требуется лечение раны с целью предотвращения слипания ее краев до момента грануляции полости из глубины. Для этого в прооперированных тканях оставляют рыхлый тампон с мазью Вишневского, вазелиновым маслом и т.п. Он оказывает раздражающее действие, вызывающее развитие грануляций. Его меняют при перевязках каждые 2-3 дня, вводя рыхло до соприкосновения с дном полости.
По мере развития грануляций тампон выталкивается из глубины. В это время накладывают редкие повязки с тем же вазелиновым маслом или мазью Вишневского до момента полного заживления раны. Излишки грануляций прижигают ляписом, стараясь не задеть эпителий, который растет по краям раны, и его островки по поверхности поврежденной области. Если рана зарастает медленно, а грануляции чистые и сочные, то показано наложение шва.
При глубоко расположенном абсцессе используют закрытый метод лечения, позволяющий сократить сроки лечения заболевания. Это происходит в несколько этапов:
- Поверхность обрабатывается антисептиком.
- Проводится местное обезболивание (чаще всего Лидокаином).
- Делается небольшой разрез не больше 2 см и расширяется при помощи шприца Гартмана до 4-5 см с одновременным разрывом связующих перемычек полости.
- Выскабливаются внутренние стенки полости, заполненной гноем (кюретаж), и отсасывается ее содержимое (аспирация).
- Делается дренирование абсцесса при помощи специальной трубки для отведения жидкости (двухпросветного дренажа), в результате чего обеспечивается отток гнойного экссудата. Одновременно производится активное отсасывание и промывание полости антисептиком.
Операция проводится амбулаторно и длится не более 10 минут. Срок лечения раны — до месяца.
Постинъекционный абсцесс на начальном этапе, пока не возникло гнойное расплавление, лечат консервативно: противовоспалительными средствами и антибиотиками. Также назначают УВЧ. При возникновении гнойника требуется хирургическое вмешательство.
После вскрытия абсцесса назначаются антибиотики. До операции их использование неэффективно, так как гнойные образования не снабжаются кровью, и активные вещества не могут поступать в поврежденную область.
Перед их назначением делают посев гноя с целью определения вида патогенных микроорганизмов и их чувствительности к антибиотикам. Есть несколько способов лечения:
- местное применение,
- оральный прием,
- введение лекарств в пораженную область (делается при лечении абсцесса ротовой полости).
Применяются антибиотики пенициллинового ряда (цефалексин, амоксициллин) в течение 10 дней 4 раза в день по 250-500 мг. При наличии у пациента аллергии на пенициллин назначают макролиды (кларитромицин, эритромицин), которые принимают также 10 дней по 250-500 мг, но 2 раза в сутки.
К антибиотикам для наружного применения относятся мази (Левомеколь, Мафенид, Левосин и т.д.), использование которых приводит к выздоровлению через 1-2 недели. Их преимущество в том, что препараты действуют только на место поражения, не всасываясь в кровь.
Помимо антибиотиков также назначают жаропонижающие средства (при высокой температуре), нестероидные противовоспалительные препараты и сульфаниламиды (по 0,5-1 г стрептоцида 3-4 раза в день).
Для предотвращения возникновения абсцесса необходимо принимать меры, направленные на исключение возможности проникновения инфекции в мягкие ткани и на общее укрепление организма.
Правильная обработка ран и их своевременное лечение
При ранении в первую очередь необходимо удалить видимые загрязнения стерильным бинтом или пинцетом, продезинфицированным спиртом. Чистую рану следует обработать антисептиком, а затем закрыть поврежденный участок бинтом или пластырем, защитив от повторного загрязнения. Важно менять повязку ежедневно до полного заживления поврежденной кожи.
Для обработки ран используют: хлоргексидин биглюканат, йод, 3 % перекись водорода. Последняя уничтожает микроорганизмы как химическим, так и механическим путем, выводя их на поверхность за счет образования пузырьков. Если медицинские препараты отсутствуют, то в качестве антисептика подойдет любой спиртовой раствор.
При глубоком ранении перечисленных выше процедур будет недостаточно. Необходимо обратиться к врачу, который произведет обработку раны, иссечение ее краев, остановит кровотечение и наложит швы. При необходимости назначается курс антибактериальной терапии.
Повышение неспецифической резистентности организма
Искусственно усилить устойчивость организма к любым повреждениям можно при помощи иммунизации и введения гамма-глобулина реконвалесцентов или сывороток. В народной медицине используют прижигания, создание очагов искусственного воспаления, иглоукалывание, женьшень. Методы традиционной медицины:
- Аутогемотерапия, предполагающая введение пациенту внутримышечно собственной крови, взятой из вены.
- Введение антиретикулярной цитотоксической сыворотки – биостимулятора, получаемого из сыворотки крови животных (как правило, ослов и лошадей), которые были иммунизированы антигеном из костного мозга и селезенки трубчатых костей, взятых у молодых особей животных или у трупа человека в течение 12 часов после его гибели.
- Протеинотерапия – введение белковых веществ в организм парентерально (не через ЖКТ): внутримышечно или внутривенно.
Соблюдение техники выполнения внутримышечных уколов
- Следовать правилам асептики. Делать уколы надо в условиях полной стерильности. Это касается и помещения, в котором проводится процедура.
- Применять препараты, вызывающие раздражение тканей (такие, как анальгин), только с использованием новокаина.
- Делать инъекции поочередно в разные стороны ягодичной области.
- Применять одноразовые иглы и шприцы. При отсутствии такой возможности обязательно автоклавировать иглы и шприцы.
- использование засорившихся и прочищенных мандреном инъекционных игл.
- применение для внутримышечных инъекций игл, которые предназначены для введения лекарств под кожу и в вену, так как подкожная клетчатка для них слишком толстая (достигает 8-9 см).
При обнаружении признаков абсцесса мягких тканей необходимо как можно быстрее обратиться к травматологу или хирургу, который произведет диагностику полости и ее содержимого для назначения терапии. Самостоятельное вскрытие категорически запрещено, так как может привести к распространению инфекции на расположенные рядом ткани и органы. Обращение к специалисту обязательно, но лечить заболевание можно и в амбулаторном режиме.
Так как развитию абсцесса способствуют различные заболевания внутренних органов, то придется проконсультироваться со смежными специалистами: эндокринологом, отоларингологом и гастроэнтерологом с целью назначения и прохождения необходимой терапии.
Не знаете как подобрать клинику или врача по приемлемым ценам? Единый центр записи по телефону +7 (499) 519-32-84 .
источник
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
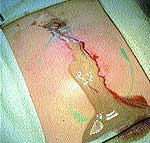 |
| Рис. 1 |
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
- хирургическая обработка гнойного очага с тщательным удалением всех девитализированных тканей;
- использование дополнительных методов обработки послеоперационной раны (пульсирующая струя, ультразвуковая кавитация, криовоздействие, вакуумирование и др.);
- дренирование раны с помощью перфорированного силиконового дренажа с последующим длительным промыванием раны растворами антисептиков;
- раннее закрытие послеоперационной раны с помощью первичных, первичных отсроченных, ранних вторичных швов, местными тканями или методом аутодермопластики;
- общая и местная антибактериальная терапия с учетом аэробного и анаэробного компонентов раневого процесса;
- назначение иммунных препаратов по данным лабораторного контроля иммунологических показателей.
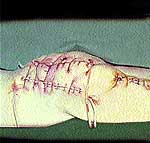 |
| Рис. 2 |
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
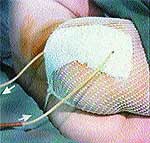 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
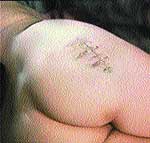 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
По-прежнему большой популярностью у медицинских работников пользуются препараты йода. Они обладают почти универсальным спектром активности: подавляют грамположительные бактерии, включая энтерококки и микобактерии, грамотрицательные бактерии, в том числе псевдомонады, ацинетобактерии, клебсиеллы, протей, споры бактерий, грибы, вирусы, включая вирусы гепатита В и С, энтеро- и аденовирусы, а также анаэробные, спорообразующие и аспорогенные бактерии.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
Мирамистин характеризуется широким спектром антимикробных свойств. Препарат губительно действует на грамположительные, грамотрицательные бактерии, грибы, вирусы, простейшие, аэробные и анаэробные, спорообразующие и аспорогенные микроорганизмы в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к лекарственным препаратам.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
- левомицетин (левосин, обладающий не только антибактериальным и противовоспалительным действием, но и благодаря входящим в него метилурацилу и тримекаину регенерирующим, некролитическим и анальгезирующим эффектами, что существенно облегчает состояние больного);
- диоксидин (5%-ная диоксидиновая мазь, диоксиколь, метилдиоксилин);
- йод с поливинил-пиролидоном (1%-ная йодопироновая мазь, йодметриксид);
- метронидазол + левомицетин (метрокаин);
- нитазол (стрептонитол, нитацид);
- фурациллин (фурагель);
- хинифурил (0,5%-ная мазь хинифурила);
- мафенид ацетат (10%-ная мазь мафенида-ацетата).
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
- диоксизоль (диоксидин);
- сульйодовизоль (йодовидон);
- сульйодопирон (йодопирон);
- нитазол (нитазол);
- цимезоль (циминаль + тримекаин + порошок окисленной целлюлозы);
- гипозоль-АН (нитазол + аекол + метилурацил).
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
- дигиспон А (коллаген + гелевин + диоксидин + анилокаин);
- альгикол-ФА (коллаген + альгинат + фурагин + анилокаин);
- коллахит-ФА (коллаген + хитозан + фурагин + анилокаин);
- анишиспон (коллаген + шиконин).
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.
источник