Абсцессы малого таза возникают в местах, где имеются благоприятные условия. К располагающим факторам относится застой воспалительного экссудата или выливание крови. Жидкость скапливается в самом низком месте брюшной полости — дугласовом пространстве. У женщин очаг болезни располагается между маткой и прямой кишкой, у мужчин в углублении между мочевым пузырем и прямой кишкой. Воспаление тканей с гнойной полостью возникает как осложнение хирургических вмешательств, аппендицита, гинекологических инфекций.
- травмы и операции на органах брюшной полости;
- острый аппендицит;
- несоблюдение правил асептики;
- недостаточное дренирование и санирование брюшной полости;
- гнойные гинекологические воспаления.
Предрасположенность к патологии наблюдается у пациентов с сахарным диабетом, болезнью Корна, а также беременных.
Патология характерна для любого пола и возраста, наблюдается у детей как форма осложнения после операции.

- ухудшение общего состояния;
- сильные боли внизу живота;
- проблемы с мочеиспусканием;
- позывы к дефекации;
- тенизмы;
- жажда;
- учащение пульса;
- тошнота;
- слизистые выделения из прямой кишки, влагалища.
Клиническая картина не одинакова для всех пациентов, патология может иметь минимальные проявления или совсем не проявляться до определенного момента. Симптоматика зависит от локализации очага нагноения. Пока капсула целая, брюшина не раздражается. Перфорация абсцесса в кишечник приводит к появлению свищей. Обычно они наблюдаются в толстой кишке.
В процессе сбора анамнеза врач учитывает недавние хирургические вмешательства и гинекологические проблемы. При подозрении на абсцесс проводится ректальное (для мужчин) и вагинальное (для женщин) обследование. Пальпаторно определяется плотный инфильтрат с размягченным участком в центре. Образование болезненное, при разрастании давит на прямую кишку. Возникают ложные позывы к дефекации.
Консистенция инфильтрата различается в зависимости от продолжительности формирования. Вначале образование плотное, с появлением гноя размягчается. У женщин шейка матки смещается в сторону. Более полную картину патологии дает инструментальное обследование и лабораторные анализы:
- УЗИ малого таза;
- КТ или МРТ для уточнения локализации очага нарыва;
- общий и биохимический анализ крови;
- анализ мочи — при вовлечении мочевого пузыря выявляются лейкоциты, белок.
Если при пальпации обнаружена флюктация (образование гноя), показана пункция. Она проводится через прямую кишку или задний свод влагалища. Для процедуры используется шприц с пункционной иглой. После извлечения жидкости проводится бактериологическое исследование.
Лечение абсцесса проводится оперативно, с госпитализацией пациента. На стадии плотного инфильтрата назначаются клизмы и спринцевание теплыми отварами лекарственных трав. Процедуры способствуют скорейшему образованию гноя и размягчению абсцесса. Также на этой стадии проводится консервативная терапия по снятию интоксикации. Пациенту прописываются антибиотики широкого спектра действия. Препараты подавляют аэробные и анаэробные бактерии.
В процессе консервативного лечения возможен произвольный прорыв абсцесса. Пациенты замечают вытекание гноя с мочой или калом. Их состояние улучшается. В большинстве случаев прибегают к дренированию очага нагноения. Перед операцией больному ставят очистительную клизму. Хирургическое лечение проходит под общим наркозом. Выбор метода зависит от пола пациента:
- У мужчин производится вскрытие стенки прямой кишки. Для проведения операции выполняется расширение ануса. В наиболее мягком месте происходит вскрытие по игле. Процесс контролируется с помощью аппарата УЗИ. Разрез увеличивают корнцангом. Происходит опорожнение и санирование полости нарыва. Вставляется трубка для дренажа.
- У женщин тазовые абсцессы вскрываются через задний свод влагалища. Слизистая разрезается скальпелем, полость нарыва расширяется зажимам для лучшего оттока содержимого. На 3-4 суток вставляется трубка дренажа.
При выборе места доступа хирург ориентируется по данным о локализации нарыва. Операционный разрез может выполняться в промежности или над лоном. Установка вагинального дренажа не рекомендуется девственницам. В отсутствии возможности сделать пункцию под контролем УЗИ, добраться до патологического образования трансректально и трансвагинально, проводится лапаротомия.
Продолжительность периода восстановления зависит от выбранного метода операции и возраста пациента. Дренажную трубку удаляют через 2-3 дня, после прекращения оттока гноя. Больного располагают в полусидящем положении для обеспечения оттока жидкости. Антибактериальная терапия продолжается. Температура и общее самочувствие быстро приходит в норму.
В первые дни рекомендуется питание бульонами и жидкой кашей. Дальше назначается бесшлаковая диета. В период реабилитации запрещен подъем тяжестей, продолжительная ходьба.
Среди медиков патология считается менее опасной, чем нагноение в других отделах брюшной полости – поддиафрагмальном и межкишечном. Степень угрозы зависит от размеров гнойника. В некоторых случаях он может быть объемом до 500 мл. Существует риск прорыва абсцесса, который приведет к перитониту. Расплавление тканей ближайших органов обернется попаданием гноя в кишечник, мочевой пузырь или матку. Дальнейшее развитие событий: прорыв в матку и мочевой пузырь ведет к их воспалению, вытекание в прямую кишку способствует улучшению состояния пациента.
Меры по предотвращению возникновения и развития абсцессов:
- качественное удаление экссудата, сгустков крови, гноя во время операций;
- правильный выбор наркоза, позволяющий выполнить хирургическое вмешательство в полном объеме;
- своевременное лечение гинекологических и проктологических болезней, связанных с гнойными образованиями;
- проведение ректального и влагалищного обследования пациентов после удаления аппендицита.
Профилактические мероприятия касаются медицинских работников. От их профессионализма и ответственности зависит здоровье пациентов.
Патология успешно лечится, прогноз благоприятный. Это касается одиночных очагов воспаления. Своевременность вмешательства играет значимую роль. Грамотное лечение нагноения предотвращает распространение патологии на ближайшие органы.
источник
К острым инфекциям органов малого таза (ОИОМТ) у госпитализированных женщин относят инфекционные осложнения после кесарева сечения, плановой гистерэктомии и септического неполного аборта.
Классификация:
- эндомиометрит, осложненный или не осложненный параметритом, флегмоной и (или) абсцессом, развившийся после кесарева сечения в группах низкого риска, высокого риска, или при естественных родах;
- ОИОМТ после гистерэктомии: культит, тазовый целлюлит, флегмона, абсцесс малого таза;
- неполный септический аборт (самопроизвольный или индуцированный).
Эти осложнения, в том числе эндомиометрит, тазовый целлюлит, параметрит, флегмона и абсцессы малого таза, могут быть вызваны различными видами аэробов и анаэробов, относящихся к эндогенной микрофлоре дистальных отделов половых путей. Особенно большое значение имеют анаэробные бактерии, в связи с чем терапия должна быть прямо направлена против этих микроорганизмов. Роль энтерококков, хламидий и микоплазм остается неопределенной. Клинический материал для микробиологического исследования следует получать в условиях, сводящих к минимуму возможность контаминации влагалищной микрофлорой.
Когда антимикробные препараты еще не были широко введены в клиническую практику, указанные осложнения являлись одной из главных причин смерти женщин детородного возраста. В настоящее время возникновение таких осложнений удается успешно контролировать с помощью эффективной антимикробной профилактики или общей антимикробной терапии.
Неосложненные инфекции следует лечить не менее 4 дней; осложненные случаи могут потребовать более длительного лечения. В течение, по меньшей мере, первых 4 дней лечения рекомендуется вводить антибактериальные препараты парентерально; последующее пероральное применение можно исследовать как завершающую часть более длительных курсов. Ожидаемая частота клинической эффективности — около 90%.
Несмотря на то, что наиболее важна клиническая эффективность, необходимо принимать во внимание также микробиологическую эффективность. При заключительном анализе исход лечения классифицируют как эффективность, неэффективность или неопределенный результат.
Родоразрешение с помощью кесарева сечения. Больные, у которых родоразрешение производят с помощью кесарева сечения, подвержены риску инфекции эндотелиального слоя (эндометрит) и мышечного слоя матки (миометрит). Инфекция может распространяться на мягкие ткани латерально от матки (параметрит) и в дальнейшем осложняться развитием флегмоны или абсцесса в параметрии над мочевым пузырем или в ретроутеральном пространстве. На придатки матки патологический процесс обычно не распространяется.
Основные факторы риска инфекции после кесарева сечения:
- Социально-экономический статус
- Длительность безводного периода
- Длительность I периода родов
- Число влагалищных исследований
- Внутренний мониторинг плода
- Слабость родовой деятельности
- Анемия до операции
- Анемия после операции
- Кровопотеря во время операции
- Тип анестезии
- Продолжительность операции
- Квалификация хирурга
- Возраст роженицы
- Продолжительность мониторинга плода
- Число ректальных исследований
- Нарушения правил асептики
- Вагинальный операционный доступ
- Отсутствие околоплодных вод
- Ожирение
- Раса
Главные среди них — социально-экономический статус, продолжительность безводного периода, продолжительность родов и число влагалищных исследований в родах.
Антимикробная профилактика значительно снижала частоту лихорадки в родах и послеродовом периоде. Частота инфекционных осложнений после кесарева сечения, когда не проводили антимикробной профилактики, составляла от 5 до 80% среди различных популяций в зависимости от факторов риска. В некоторых группах высокого риска даже на фоне профилактики частота развития инфекции может достигать 20%. В общем ожидаемая частота развития инфекции у женщин с минимальным числом факторов риска составляет около 5%.
В группу женщин с минимальным риском инфекции входят больные, подвергаемые плановому повторному кесареву сечению при отсутствии родовой деятельности или в ее начальном периоде, если цел плодный пузырь. Антимикробная профилактика в этой группе низкого риска обычно не показана.
Гистерэктомия. После гистерэктомии инфекция чаще всего развивается в области вагинального края зоны операции (культит). Культит развивается у всех больных, перенесших гистерэктомию, как физиологическая реакция на хирургическое вмешательство и обычно не требует лечения. Сочетание факторов защиты организма и антимикробной профилактики позволяют предупредить развитие осложнений.
Инфекция, требующая антимикробной терапии, может дать клинические проявления еще до того, как больная выписалась из стационара или через несколько недель после выписки. Инфекция обычно распространяется на одну или обе стороны параметрия (тазовый целлюлит). Если придатки не удалены, может развиться аднексит. Иногда инфекцию осложняет флегмона или абсцесс в области культи влагалища, в параметрии или придатках матки.
Риск инфекции при выполнении чрезвлагалищной гистерэктомии выше, чем при использовании абдоминального доступа. Антимикробная профилактика показана при чрезвлагалищной гистерэктомии, но мнения о ее целесообразности при абдоминальной гистерэктомии остаются противоречивыми.
Основные факторы риска инфекции после гистерэктомии:
- Нестерильное операционное поле
- Иммунные нарушения
- Низкий социально-экономический статус
- Длительная операция
- Пониженное питание
- Диабет
- Большая кровопотеря
- Предшествующие хирургические вмешательства
- Пременопауза
- Пожилой возраст
- Ожирение
- Абдоминальный хирургический доступ
- Квалификация хирурга
- Использование катетера
Септический неполный аборт. Женщины с неполным септическим абортом подвержены высокому риску тяжелых форм инфекции с серьезными осложнениями. В тактике лечения этого патологического состояния существенное место занимает антимикробная терапия, расширение шейки матки и выскабливание ее полости.
Осложнения. Любая из этих ОИОМТ может привести к развитию флегмоны или формированию абсцесса, септическому тазовому тромбофлебиту, который нередко служит источником тромбоэмболии, некротизирующему фасцииту и смерти. Результаты посева крови чаще всего положительны у женщин, входящих в группы высокого риска и подвергаемых кесаревому сечению, а также у больных, перенесших септический аборт (5-21%). При большинстве инфекций достаточно применения антимикробных препаратов и не требуется хирургического вмешательства. В некоторых случаях необходимо чрескожное дренирование.
Диагноз. Диагноз ОИОМТ основывается на анамнестических указаниях на предрасполагающие факторы, жалобах, клинических симптомах, обнаруженных при физическом исследовании, наличии лихорадки, а также результатах лабораторного обследования. Больные часто жалуются на острое начало болей в низу живота, спине и (или) ноге. Температура тела обычно 38 °С и выше, причем лихорадка носит ремиттирующий характер. Нередко наблюдается лейкоцитоз, повышение СОЭ и уровня СРБ, однако эти изменения часто не помогают поставить диагноз. Конкретный диагноз зависит от результатов физического исследования, но болезненность брюшной стенки при пальпации нередко препятствует полноценному исследованию. В этих случаях поставить диагноз помогают такие методы, как УЗИ.
Микроорганизмы. Инвазия микроорганизмов происходит из нижнего отдела половых путей; эти микроорганизмы представляют собой часть их эндогенной микрофлоры и включают широкий спектр грамположительных и грамотрицательных аэробных и анаэробных бактерий. Этиология большинства инфекций носит полимикробный характер, но отдельные виды могут доминировать в зависимости от объема инокулята и факторов вирулентности. Идентифицировать основной возбудитель обычно затруднительно, так как часто выделяют сразу не менее четырех различных видов бактерий.
Микроорганизмы, чаще всего выделяемые у больных с ОИОМТ: Staphylococcus epidermidis и другие коагулазанегативные стафилококки, Enterococcus faecalis (и другие энтерококки), Streptococcus agalactiae и другие виды стрептококков, Escherichia coli, Enterobacter spp, Proteus spp, Klebsiella spp, Peptostreptococcus spp, Clostridium spp, Bacteroides spp (включая группы В. bivius и В. fragilis) и другие бактерии, обитающие в женских половых путях.
До введения эффективной антимикробной профилактики и терапии большинство ОИОМТ вызывались грамположительными аэробными и анаэробными бактериями. С появлением антимикробных препаратов для борьбы с большей частью инфекций успешно применяли монотерапию пенициллином. В 60-е годы потребовались антибиотики более широкого спектра действия. Облигатные анаэробы впервые были выделены при ОИОМТ в 70-е годы. И хотя было установлено, что Васteroides fragilis — важный патогенный микроорганизм, его выделяли только из 0—10% очагов острой инфекции органов малого таза, включая фаллопиевы трубы. Чаще выделяли Bacteroides bivius.
Этиологическая роль Enterococcus faecalis в развитии ОИОМТ остается неясной. Хотя этот микроорганизм выделяют из очага инфекции у 60% больных с ОИОМТ, клиническая эффективность отмечена у 90% больных, получавших лекарственные средства, не обладающих активностью против энтерококков. Неясна также этиологическая роль Chlamydia trachomatis, Mycoplasma spp и Ureaplasma.
Микробиологические исследования. Материал для культивирования у больных с эндометритом или септическим абортом необходимо брать из полости матки. Эту процедуру следует производить под контролем влагалищного зеркала, чтобы уменьшить возможность контаминации микрофлорой влагалища, используя для получения проб патологического материала всасывающий шприц-канюлю или специальный многоканальный тампон-щетку, снабженную защитным покрытием. Количественный критерий для правильной оценки бактериального роста в пробах, полученных с помощью отсасывающего шприца — более 10 5 в 1 мл, в пробах, полученных с помощью щетки с защитным покрытием — более 10 3 на тампон.
Пробы для культуральной диагностики у больных с ОИОМТ после гистерэктомии получают из очага инфекции стерильными тампонами, используя хирургический доступ через свод влагалища. Следует также проводить бактериологическое исследование гнойного материала, аспирированного из абсцесса. Посевы должны быть выполнены как можно раньше после взятия проб. Для сохранения анаэробных бактерий следует использовать специальные транспортные среды.
Чувствительность к антимикробным средствам должна быть определена как у аэробных, так и анаэробных бактерий. Определение МПК предпочтительно, но возможно и использование дискодифузионного метода Кирби-Бауэра. Для характеристики чувствительности микроорганизмов, определенной тем или другим методом, к антимикробным средствам следует использовать такие категории как резистентность, умеренная чувствительность и чувствительность.
Если возникло предположение о септицемии, необходимо получить для посева по меньшей мере две пробы крови после соответствующей обработки кожи в одном и том же месте с интервалом 15-30 минут или в разных местах. Пробы следует брать до или сразу после начала лечения. Если результат исходного бактериологического исследования крови окажется положительным, посев крови необходимо повторить в течение 72 часов и продолжать проводить до получения отрицательного результата.
Если предполагают развитие инфекции мочевыводящих путей, для посева собирают в стерильную посуду среднюю порцию мочи, выделенной при самопроизвольном мочеиспускании или полученной с помощью катетера до начала лечения. Анализ мочи должен включать количественное определение бактериурии, выделение и идентификацию возбудителя и определение его чувствительности к антибиотикам.
Современная терапия острых инфекций органов малого таза. В настоящее время общепризнано, что терапия должна быть прямо направлена против аэробного и анаэробного компонентов полимикробной флоры, которую чаще всего выделяют у больных с ОИОМТ. В середине и конце 60-х годов схемы лечения состояли из комбинации пенициллина или цефалоспоринов I поколения с аминогликозидами. Частота неэффективности этого режима лечения составляла 22-37%, причем в большинстве случаев неудачи можно было связать с безуспешностью эрадикации анаэробных бактерий.
Большое значение применения лекарственных средств, эффективно действующих против анаэробных бактерий, при лечении ОИОМТ после кесарева сечения было показано G. diZerega и соавт. (США). В начале 80-х годов комбинация клиндамицина с гентамицином становится «золотым стандартом» при лечении ОИОМТ. Эффективность этой комбинации составила примерно 88%.
С тех пор появились другие эффективные схемы, в которых используют монотерапию или комбинацию антибактериальных средств. Выбирают препараты, активные в отношении грамположительных и грамотрицательных аэробов и анаэробов. «Приемлемая» в настоящее время клиническая эффективность должна быть не менее 90%. Начальные проявления реакции больных на адекватную антибактериальную терапию выражаются исчезновением жалоб и болезненности при пальпации. Нормализация температуры тела может быть последним признаком, предшествующим констатации клинической эффективности.
В начале терапии антимикробные препараты обычно вводят парентерально (из-за нарушения функций желудочно-кишечного тракта). Длительность терапии зависит от того, имеются ли осложнения, такие например, как флегмона или абсцесс. В общем парентеральную терапию нужно продолжать еще 24 часа после того как температура становиться ниже 37,8 °С. Если у больной развивается флегмона или абсцесс, большинство экспертов предпочитает продолжать парентеральную терапию еще 48 часов после нормализации температуры тела. Необходимость проводить антимикробную терапию более 4 дней у больных с целлюлитом возникает редко.
Курс терапии при осложненной инфекции редко превышает 10 дней. Хирургической установки дренажа чаще всего не требуется; опасностей, связанных с большой операцией, можно избежать, применив чрескожное дренирование. Если проведен полный курс антимикробной парентеральной терапии, то в проведении пероральной терапии после выписки из стационара нет необходимости.
Длительность лечения. Продолжительность лечения не должна быть меньше 4 дней и больше 10 дней. Терапия не должна удлинять пребывание в стационаре. Стационарное лечение больных эндометритом или культитом следует продолжать по меньшей мере 24 часа после нормализации температуры тела. Лечение в стационаре при абсцессе или флегмоне следует продолжать не менее 48 часов после нормализации температуры тела. Если во время пребывания в стационаре проведен полный курс терапии, нет необходимости продолжать лечение после выписки.
Если возможно использовать как пероральный, так и парентеральный пути введения лекарственного средства, допустимо продолжить терапию в амбулаторных условиях в объеме запланированного полного курса, соответственно сократив курс парентеральной терапии в стационаре.
Врач по своему усмотрению может принять решение продолжить терапию более 10 дней на основании реакции больной, тяжести инфекции, общего состояния больной и наличия сопутствующих заболеваний, но лечение в этом случае следует расценивать как неэффективное.
Эндомиометрит — это инфекция внутреннего слоя матки (эндометрия) и миометрия. Он может развиваться после кесарева сечения, естественных родов или неполного септического аборта. Клинические проявления включают боли, болезненность при пальпации в области малого таза, ремиттирующую лихорадку (температура в полости рта выше 38 °С) и лейкоцитоз (более 10500 лейкоцитов в 1 мкл крови).
Параметрит, флегмона и абсцесс. Эти инфекции поражают структуры, прилегающие к матке: связки матки, фаллопиевы трубы, яичники и прилежащие структуры малого таза. Они иногда развиваются как осложнения эндомиометрита после родов, септического аборта или гистерэктомии. Поставить точный диагноз не всегда просто. Предположительный диагноз ставят на основе данных тщательного исследования органов малого таза у больных с длительной лихорадкой или персистирующим лейкоцитозом. УЗИ и другие специфические методы исследования часто помогают определить локализацию очага и распространенность инфекции.
Инфекции органов малого таза после гистерэктомии. К ним относятся инфекции во влагалищной части области операционного разреза (культит), распространение воспаления на мягкие тканевые структуры вокруг удаленной матки (тазовый целлюлит), распространенная воспалительная реакция мягких тканей малого таза (флегмона) и локальные очаги инфекции с тяжелыми проявлениями воспаления и некрозом тканей (абсцесс в области малого таза). Культит проявляется уплотнением и болезненностью при пальпации в вагинальной части культи матки и лихорадкой, которая продолжается больше 1 дня после операции. Тазовый целлюлит характеризуется болезненностью при пальпации в зоне параметрия. Если при пальпации болезненность локализуется спереди и сверху параметрия, наиболее вероятен диагноз аднексита. Абсцесс и флегмону в тканях малого таза диагностируют на основании пальпаторного обнаружения объемных образований, а также данных УЗИ или других неинвазивных сканирующих методов.
Септический аборт — инфекция эндометрия и часто миометрия, вызванная присутствием в матке частей инфицированного плодного яйца. Инфекционный процесс может распространяться на параметрий.
Эндомиометрит. К клиническим критериям включения в исследование относятся боли в низу живота и болезненность при пальпации матки, появившиеся в течение 24—72 часов после кесарева сечения или естественных родов, и, по крайней мере, однократное повышение температуры в ротовой полости больше 38 °С.
Параметрит, флегмона и абсцесс. Критериями включения служат пальпируемые образования, расположенные латерально в зоне параметрия, спереди под мочевым пузырем или позади матки. Диагноз следует подтвердить с помощью УЗИ или другого неинвазивного метода.
Инфекция органов малого таза после гистерэктомии. Критериями включения являются жалобы на боли в низу живота и в спине, болезненность при пальпации в низу живота, культе влагалища, параметрии и придатках матки через 1—3 дня после операции. Повторные подъемы температуры тела (>38 °С) сохраняются больше 24 часов после операции. Как отмечено выше, могут сформироваться параметрит, флегмона и абсцесс. Если возможно, следует провести дифференциальный диагноз культита, тазового целлюлита и абсцесса.
Септический аборт. Этот диагноз ставят больным с аменореей или с ациклическими кровянистыми выделениями из половых путей при положительном тесте на беременность, температуре тела >38 °С при двух последовательных измерениях, болях в низу живота или малом тазу, напряжении матки, связанной с ее болезненностью или болезненностью параметрия. Внутренний зев шейки матки обычно открыт. Следует отметить характер аборта (самопроизвольный, плановый или вызванный самой больной). Необходимо исключить инфекцию другой локализации, например в мочевыводящих путях, или четко доказать лабораторными и клиническими методами, что она не имеет отношения к септическому аборту.
С использованием техники, описанной выше, должны быть выделены клинически значимые аэробные и анаэробные бактерии из проб эндометрия или гнойного отделяемого из культи влагалища, или содержимого абсцесса, полученного с помощью аспирации, по дренажу либо с помощью стерильного ватного тампона. Следует установить гнойный характер полученных образцов с помощью микроскопии мазков, окрашенных по Граму, и провести соответствующее бактериологическое исследование для выделения микроорганизмов.
Факторы риска для больных, родоразрешенных посредством планового кесарева сечения, указаны выше. На основе этих критериев определяют больных, подверженных высокому или низкому риску инфекции. В целом в группу высокого риска включают больных с низким социально-экономическим статусом, с затянувшимися родами, с длительным безводным периодом, с повторными влагалищными исследованиями.
Эффективность лечения. Эффективность лечения определяют как исчезновение клинических проявлений инфекции после завершения лечения и в период наблюдения после лечения. Больные должны получать лечение в течение определенного минимального периода времени. Определение «эффективность лечения» употребляют только в отношении больных, которым не требовалось другой терапии, оказывающей прямое воздействие на очаг инфекции, в течение, по крайней мере, 28 дней после выписки из стационара.
Улучшение. Это определение применяют, чтобы обозначить прекращение лихорадки, болей в животе и других жалоб и объективных признаков, типичных для активной инфекции, в течение или в конце курса терапии. Оно представляет собой только промежуточную оценку и не может использоваться для окончательной оценки эффективности лечения.
Неэффективность лечения. Неэффективность лечения может быть констатирована в любое время на протяжении лечения или наблюдения в отдаленный период. Лечение признают неэффективным, если клиническая картина инфекции остается прежней через 48 часов после начала лечения или ухудшается в процессе лечения, а также если возникает необходимость изменения антимикробной терапии или требуется хирургическое лечение. Единственное исключение — ситуация, в которой диагноз установлен во время операции. Как неэффективность лечения расценивают также случаи, когда после первичной эффективности или улучшения на фоне терапии признаки инфекции рецидивируют в сроки до 28 дней после выписки из стационара.
Неопределенный результат. В некоторых случаях оценить клиническую эффективность невозможно. К причинам этого относятся несоблюдение протокола исследования, неправильный диагноз, развитие внутрибольничной инфекции, требующей назначения дополнительной антимикробной терапии, или применение дополнительной антимикробной терапии, необходимое для борьбы с инфекциями другой локализации, возникшими в период наблюдения после выписки из стационара.
Смерть. Если смерть наступила от сопутствующего заболевания неинфекционной природы, причем вначале объективно отмечалась клиническая эффективность лечения изучаемой инфекции или улучшение, то клиническую реакцию расценивают как предположительную эффективность. Если причина смерти связана с инфекционным процессом, клиническую реакцию расценивают как неэффективность лечения.
На момент поступления в стационар. Следует собрать полный медицинский анамнез и провести физическое исследование с подтверждением инфекции, подлежащей лечению, и отсутствие других инфекций. Необходимо выполнить лабораторные и микробиологические исследования.
Микробиологические исследования:
- Локусы, из которых следует получать материал для культивирования аэробов и анаэробов:
- при эндометрите, эндомиометрите, септическом аборте материал должен быть получен из полости матки с помощью специальных устройств, обеспечивающих защиту полученного материала от контаминации;
- при культите, тазовом целлюлите материал для исследования берут в надвлагалищном пространстве с помощью защищенных стерильных ватных тампонов;
- при абсцессе малого таза материал для микробиологического исследования получают из надвлагалищного пространства (полость абсцесса) с помощью защищенного стерильного тампона или путем аспирации содержимого шприцем, при дренировании под контролем РКТ или при хирургическом дренировании.
- Кровь. Если предполагают возможность бактериемии, кровь получают путем двух отдельных венопункций. Используют аэробную и анаэробную технику культивирования.
- Моча. Если возможна сопутствующая инфекция мочевых путей, производят посев мочи и определяют чувствительность микрофлоры к антимикробным препаратам. Для посева используют среднюю порцию мочи, полученной или при самопроизвольном мочеиспускании, или с помощью катетера.
Следует провести специальные методы исследования. Такие исследования, как УЗИ, рентгенологическое исследование грудной клетки и сканирующая РКТ, чтобы исключить сопутствующие инфекционные процессы либо подтвердить диагноз абсцесса или флегмоны.
Оценка в процессе терапии. Клиническую оценку эффективности терапии и нежелательных реакций на применяемые препараты следует производить ежедневно. Необходимо регистрировать максимальную суточную температуру тела. Нежелательные эффекты отмечают в тот день, когда они возникли. Окончательно оценить результат лечения можно только после посещения врача больной в отдаленный период. Неэффективность лечения может быть констатирована после 48 часов от его начала вплоть до последнего посещения в отдаленный период.
Лабораторное обследование повторяют в следующих случаях: а) при неэффективности терапии; б) перед выпиской из стационара и в) по показаниям при посещении больной врача в отдаленный период.
Следует провести бактериологическую оценку. Если терапия неэффективна, следует получить материал из очага инфекции для бактериологического исследования. Если терапия предположительно эффективна, повторять посевы нет необходимости. Если результаты бактериологического исследования положительны, посевы крови повторяют через 48—72 часа до получения отрицательного результата исследования. Ожидается, что у большинства больных микробиологическая эффективность (эрадикация возбудителей) окажется предположительной, поскольку когда их выписывают из стационара, материал для посева получить обычно не удается, а поздние рецидивы инфекции наблюдаются редко. Неэффективность терапии может сопровождаться персистенцией возбудителя или развитием суперинфекции.
Оценка после завершения терапии и в отдаленный период. Клиническая оценка должна включать описание клинического течения заболевания и физического исследования после окончания курса терапии. Больная должна пройти повторную оценку через 28 дней после завершения курса терапии для определения клинической эффективности и выявления поздних нежелательных реакций.
Лабораторные исследования следует повторить при контрольном посещении врача тем больным, у которых результаты этих исследований не отвечали критериям нормы при выписке из стационара, или если была зарегистрирована неэффективность лечения.
Микробиологическое обследование при последнем посещении врача необязательно, если больная клинически здорова.
Заключительная оценка. Заключительная оценка о выздоровлении может быть сделана только после обследования больной в отдаленный период. Главный конечный показатель эффективности терапии — клиническое выздоровление. Микробиологическая эффективность имеет меньшее значение. Неэффективность (клиническая или микробиологическая) терапии может быть отмечена в любой момент лечения или в отдаленный период. Если при последнем посещении врача микробиологическое исследование не может быть выполнено из-за отсутствия клинического материала, исход лечения регистрируют как предположительную микробиологическую эрадикацию на фоне клинической эффективности терапии.
Общая схема исследования, клинической и микробиологической оценки
источник
Родила сама, и через две недели нагнал абсцесс на правой половой губе, его мне почистили и все ок.Вот ребенку 5 месяцев и у я начала только сейчас на месте абсцесса будто мышца тянет, пощупала никаких припухлостей ничего нет.Пошла к гинекологу , он сказал все отлично, единственное что есть немного молочница.Сейчас холодно на улице, думаю может переохладилась и немного подстудила то место, потому что на улице больше ощущаю.Я недавно начала задумываться, может сама себя накручиваю.Просто с появлением ребенка я все больше стала переживать за свое здоровье, у меня мама в 35 лет умерла от рака и переживаю. чтоб у меня не было предрасположенности.
Узнай мнение эксперта по твоей теме
Психолог, Помощь приходит изнутри. Специалист с сайта b17.ru
Психолог. Специалист с сайта b17.ru
Врач-психотерапевт. Специалист с сайта b17.ru
Психолог, Дианалитик. Специалист с сайта b17.ru
Психолог, Педагог-психолог. Специалист с сайта b17.ru
Психолог. Специалист с сайта b17.ru
Психолог, Консультант. Специалист с сайта b17.ru
Психолог. Специалист с сайта b17.ru
Психолог, Психолог-проводник. Специалист с сайта b17.ru
Психолог, Семейный психолог. Специалист с сайта b17.ru
У сёстры швы тянут и иногда восполяются/краснеют/, а после родов прошло 6 лет. На погоду реакция идёт тоже.
Вы проверяйтесь у врача, следите за здоровьем.
проверяйтесь раз в пол года и успокойтесь. это невроз или депрессия. вы посидите с ребенком пару лет и не то начнется. если есть возможность походите к психотерапевту. у меня вообще прикол был я мужа ночью проверяла жив или нет. ребенка дышит или нет.
Модератор, обращаю ваше внимание, что текст содержит:
Страница закроется автоматически
через 5 секунд
Пользователь сайта Woman.ru понимает и принимает, что он несет полную ответственность за все материалы частично или полностью опубликованные им с помощью сервиса Woman.ru.
Пользователь сайта Woman.ru гарантирует, что размещение представленных им материалов не нарушает права третьих лиц (включая, но не ограничиваясь авторскими правами), не наносит ущерба их чести и достоинству.
Пользователь сайта Woman.ru, отправляя материалы, тем самым заинтересован в их публикации на сайте и выражает свое согласие на их дальнейшее использование редакцией сайта Woman.ru.
Использование и перепечатка печатных материалов сайта woman.ru возможно только с активной ссылкой на ресурс.
Использование фотоматериалов разрешено только с письменного согласия администрации сайта.
Размещение объектов интеллектуальной собственности (фото, видео, литературные произведения, товарные знаки и т.д.)
на сайте woman.ru разрешено только лицам, имеющим все необходимые права для такого размещения.
Copyright (с) 2016-2019 ООО «Хёрст Шкулёв Паблишинг»
Сетевое издание «WOMAN.RU» (Женщина.РУ)
Свидетельство о регистрации СМИ ЭЛ №ФС77-65950, выдано Федеральной службой по надзору в сфере связи,
информационных технологий и массовых коммуникаций (Роскомнадзор) 10 июня 2016 года. 16+
Учредитель: Общество с ограниченной ответственностью «Хёрст Шкулёв Паблишинг»
источник
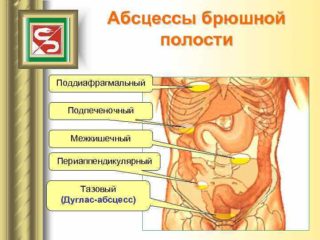
Локализуются у женщин в дугласовом, а у мужчин в прямокишечно-пузырном пространстве. Развитию их в значительной мере способствует анатомическая локализация указанных пространств, уровень которых в брюшной полости наиболее низок при любом положении тела больного.
Формирование абсцессов малого таза (AMT), как и межкишечных, начинается с 5-7-го дня после операции вследствие воспаления, затекания патологической жидкости в наиболее низкие пространства (прямокишечно-пузырное, прямокишечно-маточное углубления) при распространенном перитоните и других причинах. Это осложнение наблюдается у 0,06 % больных, перенесших операцию на органах брюшной полости [К.Д. Тоскин, В.В. Жебровский, 1986; М.Г. Сачек, 1987; Д.И. Кривицкий и соавт, 1990].
Относительно частому возникновению AMT способствует анатомическое строение брюшной полости. Оно способствует затеканию и скоплению воспалительного экссудата, гноя, образующихся при деструктивных процессах в 40, желчном пузыре и ПЖ, в других органах пищеварительного канала, а также содержимого желудка, тонкой и толстой кишок при их перфорации, изливающейся при травмах крови в полость малого таза.
При неадекватном дренировании полости малого таза или в том случае, если в конце операции не производится ее тщательный туалет, возникают предпосылки для образования абсцесса. Наиболее часто это происходит после операций, сопровождающихся общим или диффузным перитонитом при тазовом расположении деструктивно измененного 40, после гинекологических операций, операций на прямой и сигмовидной кишке [О.Б. Милонов и соавт, 1990].
В формировании AMT основную роль играют спайки, отграничивающие скопления гноя от свободных отделов брюшной полости. Вначале образуется инфильтрат, затем острая воспалительная реакция стихает, образуется пиогенная капсула абсцесса. При этом может произойти расплавление протеолитическими ферментами гноя и прорыв абсцесса в просвет прямой, сигмовидной или тонкой кишки, мочевого пузыря, матки. Опророжнение абсцесса в просвет кишечника может закончиться самоизлечением, а прорыв в просвет мочевого пузыря или матки ведет к развитию гнойного воспаления этих органов.
Доступность большинства AMT для пальцевого ректального (у женщин еще и вагинального) исследования, относительно несложные методы их дренирования через ПК (у женщин дополнительно и через задний свод влагалища) делают эти абсцессы относительно безопасными для здоровья и жизни больного по сравнению с поддиафрагмальными и особенно межкишечными абсцессами [Д.И. Кривицкий и соавт, 1990].
Частота образования AMT по отношению к общему числу послеоперационных внугрибрюшных абсцессов составляет от 10,8 до 24 % [Ю.М. Портной, 1984; АЛ. Быстрицкий, 1985; H.H. Малиновский, Б.Ю. Савчук, 1986].
К непосредственным причинам образования AMT относят недостаточное санирование и дренирование брюшной полости, недостаточный объем лечения в послеоперационном периоде, нерациональный выбор оперативного доступа, недостаточный гемостаз, частичная НША, неправильный выбор анестезии, необоснованно раннее удаление дренажей, соскальзывание лигатуры, оставление в ране ИТ, прокол кишки, нарушение правил асептики и техники выполнения операции в ситуациях, когда абсцессы возникают после пробных лапаротомий, и др. [Г.Л. Александрович, 1984; Б.К. Шуркалин и соавх, 1987; Д.И. Кривишсий исоавт., 1990 и др.].
АМТ часто образуются и после операций по поводу злокачественных опухолей прямой кишки, реже — сигмовидной ободочной, восходящей ободочной, поперечной ободочной, нисходящей ободочной и слепой кишок. Причина возникновения послеоперационных абсцессов у большинства больных —- ШЛА после резекции сигмовидной О К, левосторонней гемикоэктомии, резекции поперечной О К, правосторонней гемикоэктомии и паллиативной операции илеотрансаерзостомии.
Потенциально опасной в плане образования послеоперационных инфильтратов и абсцессов после радикальных резекций желудка, гастрэктомии по поводу РЖ является несостоятельность желудочно-кишечного и пищеводно-кишечного соустья в раннем послеоперационном периоде.
НШК ДПК после радикальных операций наблюдается нечасто в связи с крайне редкими случаями перехода злокачественного процесса на ДПК и возможностью тщательного ушивания культи кишки у подавляющего большинства больных.
Клинические признаки тазовых абсцессов достаточно характерны. При этом обычно на 5—6-е сут отмечаются жалобы больных на боли в нижней части живота, повышение температуры до 38-39 °С (постоянная или гектическая), дизурическое расстройство (частое болезненное мочеиспускание), учащенные позывы на стул, тенезмы. Температура тела больного зависит от выраженности воспалительных явлений. В стадии инфильтрата температура обычно постоянно повышена. Для сформировавшегося тазового абсцесса характерна гектическая температура, сопровождающаяся ознобами и обильным потоотделением.
Развитие тазового перитонита приводит к ухудшению общего самочувствия больного даже по сравнению с первыми сутками послеоперационного периода. Усиливаются боли внизу живота, сильная жажда, не проходящая даже при проведении адекватной инфузионной терапии. Отмечаются также тошнота, иногда рвота, не приносящая облегчения, задержка самостоятельного мочеиспускания. Учащается пульс, причем его частота не соответствует температуре.
Прогрессирующе нарастает метеоризм, временный эффект дают газоотводная трубка и микроклизма. Перистальтика кишечника либо вялая, либо отсутствует, она плохо корригируется стимулирующей терапией. Язык становится сухим, покрывается налетом. Отмечаются лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ, гипопротеинемия, уменьшение альбумино-глобулинового соотношения. В воспалительный процесс вовлекаются стенки мочевого пузыря, в моче появляются лейкоциты, эритроциты, белок.
Симптом раздражения брюшины обычно отсутствует. При нарушении капсулы, отграничивающей гнойник от свободной брюшной полости, появляется вздутие кишечника, а также симптом раздражения брюшины. При подозрении на тазовые инфильтраты и абсцессы обязательны ректальное и вагинальное исследования. При этом обнаруживают малоподвижный болезненный инфильтрат, который по мере «созревания» размягчается, нависание передней стенки ПК увеличивается, раздражение чувствительных рецепторов провоцирует появление ложных позывов к акту дефекации, сопровождающихся выделением белесоватой слизи, секрета кишечного эпителия [H.H. Малиновский, БД. Савчук, 1986].
Ректальное исследование (рисунок 22) определяет болезненный инфильтрат, выступающий в просвет кишки. СО над ним отечна, неподвижна. Аналогичные изменения в области заднего свода наблюдаются при влагалищном исследовании у женщин.
Рентгенологическая диагностика AMT затруднена ввиду того, что абсцесс окружен полыми органами, содержащими воздух и жидкость. Иногда в боковой проекции удается определять небольшую полость с горизонтальным уровнем жидкости на фоне диффузного затемнения.
Большое значение в диагностике абсцессов имеют специальные методы исследования (тепловидение, KT, УЗ И, радиосканирование). С помощью этих методов, а также пункции удается верифицировать диагноз.
При диагностировании AMT с наличием флюктуации показана его пункция через ПК или же через задний свод влагалища у женщин в зоне формирования гнойника (рисунок 23). При выявлении тазового инфильтрата без признаков размягчения лечебные мероприятия сводятся к детоксикационной и антибактериальной терапии (ампициллин, гентаминин, метронидазол). Хороший эффект дает инфузионная терапия с коррекцией энергетического, белкового, водно-солевого и других видов обмена, а также теплые клизмы из растворов ромашки, шалфея, физиотерапевтические процедуры (диатермия, УВЧ) [Д.И. Кривицкий и соавт, 1990].
В редких случаях происходит самопроизвольный прорыв содержимого тазового абсцесса в ПК, в свободную брюшную полость, в просвет кишки, в мочевой пузырь (рисунок 24). Прорыв абсцесса в ПК, влагалище или мочевой пузырь обычно сопровождается выздоровлением больного. При этом у больного внезапно появляется обильное истечение гноя при мочеиспускании или дефекации. Самочувствие резко улучшается, температура тела снижается. Появление флюктуации в области тазового инфильтрата или других характерных симптомов абс-цедирования — показание к срочному оперативному лечению. Перед операцией обязательны очистительная клизма и опорожнение мочевого пузыря.
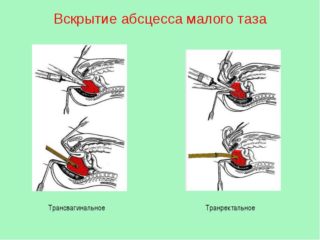
AMT чаще всего вскрывают через переднюю стенку ПК или задний свод влагалища у женщин (рисунок 25). В ПК вводят ректальное зеркало, СО тщательно очищают марлевыми тампонами, смоченными спиртом или фурацилином. С помощью пункции через ПК у мужчин и детей и задний свод влагалища у женщин по пальцу пунктируют полость абсцесса и толстой иглой в зоне наибольшего размягчения проникают в нее, аспирируют гной для идентификации микрофлоры, микроскопии мазка и определения чувствительности микрофлоры к антибиотикам.
Операцию проводят под наркозом. Абсцесс вскрывают скальпелем по ходу иглы разрезом 1-1,5 см, затем расширяют рану корнцангом. Полость обследуют пальцем. Полностью опорожняют полость абсцесса, санируют и дренируют ее толстой двухпросветной трубкой, которую фиксируют в слизистой оболочке ПК кетгутовым швом. Дренаж оставляют на 3-4 сут
Помимо ректального и вагинального доступа, возможно использование других доступов: промежностный (при скоплении гноя в околопузырной ямке) доступ или же абсцесс вскрывают и дренируют, делая поперечный разрез над лоном. При скоплении гноя в забрюшинном пространстве малого таза (ретроректальное пространство) используют промежностный и сакральный доступы. Дренирование абсцессов таза возможно и через седалищно-прямокишечную ямку.
Трансвагинальное дренирование не рекомендуется у девственниц и женщин преклонного возраста.
Эффективным методом лечения AMT считается аспирационно-промывной метод по H.H. Каншину (АЛ. Быстрицкий, 1985) (см. рисунок 18).
В послеоперационном периоде проводится фракционное промывание полости абсцесса растворами антисептиков и антибиотиков. Для временной задержки стула больным назначают бесшлаковую диету и соответствующие препараты. Дренаж удаляют после нормализации температуры и прекращения выделения гнойного экссудата.
В случаях, когда невозможно провести вскрытие абсцесса через ПК или влагалище, когда обнаружены признаки распространения воспалительного процесса в остальные отделы брюшной полости или абсцесс занимает более переднее положение, вскрытие производят разрезами в подвздошных областях с введением дренажей в малый таз.
Трансректальное или трансвагинальное дренировние AMT дает быстрый эффект [О.Б. Милонов и соавт., 1990].
Обобщая сказанное, следует отметить, что послеоперационные AMT легче диагностируются, более доступны оперативному лечению и адекватному дренированию, более благоприятны по своим исходам, нежели межкишечные и поддиафрагмальные абсцессы.
После операций по поводу перитонита и при развитии гнойно-септических осложнений после других операций больному следует придать фовлеровское (полусидячее) положение. Это способствует скоплению экссудата в прямокишечно-пузырном углублении у мужчин и в прямокишечно-влагалищном углублении у женщин. Регулярное ректальное и влагалищное исследование в послеоперационном периоде способствует своевременной диагностике AMT.
При наличии гноя в околопузырной ямке делают поперечный разрез над лоном или же используют промежностный доступ. Срединную лапаротомию выполняют только в случаях вскрытия абсцесса в свободную брюшную полость, отсутствия контакта абсцесса с ПК и влагалищем, при формировании абсцесса вокруг ИТ, при невозможности чрескожной пункции под контролем УЗИ или KT. Очень важна полноценная предоперационная подготовка этой категории больных. После операции проводится комплексная интенсивная терапия, включающая детоксикацию организма, переливание крови, адекватное парентеральное питание, форсированный диурез, целенаправленную антибиотикотерапию, сердечные средства, мероприятия, направленные на предупреждение осложнения со стороны дыхательной, сердечно-сосудистой и других систем организма.
Перейти к списку условных сокращений
источник
Инфекционные осложнения, возникающие в процессе родов или в ближайшие дни после них связаны с недостаточными санитарно-гигиеническими нормами процесса родов, с инфицированием матери различными штаммами бактерий.
Послеродовая лихорадка — повышение температуры тела > 38 ° С в любые 2 из первых 10 дней после родов, за исключением первых 24 ч. Послеродовая лихорадка требует дополнительного обследования (анализы крови, мочи, ультразвуковое исследование) с целью выявления возможных причин инфекционных осложнений.
Дифференциальная диагностика причин послеродовой лихорадки
- Эндометрит (эндомиометрит)
- Инфекции мочевых путей (пиелонефрит)
- Инфекция раны
- Тромбофлебит
- Мастит
- Пневмония
Отечественные аушеры-гинекологи традиционно используют классификацию послеродовой инфекции как отдельных этапов единого динамического септического процесса по С. В. Сазоновым и А. В. Бартельс:
- I этап — инфекция ограничена участком родовой раны (инфекция раны промежности, передней брюшной стенки; послеродовая язва влагалища, шейки матки; эндомиометрит).
- II этап — инфекция распространяется за пределы родовой раны, но есть локализованной (метрит, параметрит, тромбофлебит вен матки и таза, аднексит, пельвиоперитонит).
- III этап — инфекция, которая близка к генерализованной (перитонит, септический шок, анаэробная газовая инфекция).
- IV этап — генерализованная инфекция (сепсис без метастазов — септицемия, сепсис с метастазами — септикопиемия).
Инфекция раны после эпизиотомии не является частой при физиологических родах (благодаря развитой васкуляризации вульвы и промежности), но при неблагоприятных условиях (нарушение иммунологической резистентности макроорганизма, высокой вирулентности микроорганизмов) может быть входными воротами для развития септического шока и генерализации септического процесса.
Диагностика. Клиническая картина включает наличие отека, покраснения, боли и болезненности при пальпации, дизурии, гнойного экссудата, расхождение швов и краев раны, возможно повышение температуры, наличие язв с некротическим дном. Факторами риска могут быть расстройства коагуляции, курение, инфицирование вирусом папилломы человека (ВПЧ).
Инфекция раны влагалища может распространяться из промежности. Слизистая оболочка становится отечной, некротизируется в области травмы. Распространение в паравагинальной и параметральной клетчатке может происходить лимфогенным путем.
Инфекция раны шейки матки при глубоких разрывах может распространяться на ткань основы широкой связки матки и вызывать лимфангит, параметрит и бактериемию.
Лечение. Инфицированная рана промежности подлежит лечению согласно хирургическими принципами лечения раневой инфекции — раскрытие раны, удаление некротической ткани, очищения раны 2 раза в день с обработкой антисептиками (раствор бетадина и др.) и дренаж. Рекомендуют теплые сидячие купели несколько раз в день. При выраженном отеке без гнойного экссудата возможно консервативное лечение без снятия швов с применением внутривенного введения антибиотиков широкого спектра действия.
В большинстве случаев швы снимают и рану открывают. Вторичные швы накладывают при отсутствии проявлений инфекции (через 6 дней). В послеоперационном периоде осуществляют обработку раны, применяют диету для регуляции функций кишечника. Любые манипуляции на влагалище и прямой кишке противопоказаны до полного заживления раны.
Некротизирующий фасциит — редкое тяжелое осложнение раневой инфекции промежности и влагалища, которое включает глубокое поражение мягких тканей (мышц и фасций). Поражение характеризуется развитием выраженного отека, боли и распространенными некрозами мягких тканей и вызывается аэробно-анаэробными ассоциациями микроорганизмов, типичными для любых тазовых инфекций. Это осложнение может наблюдаться у пациенток с диабетом или имуноскомпрометованных лиц, но может возникать и у здоровых женщин.
Некротизирующий фасциит, который начинается с участка эпизиотомии, может распространяться на поверхностные и глубокие слои фасций и мышц таза, бедра, ягодицы и переднюю брюшную стенку. Прогрессирование осложнения приводит к септицемии и смерти больного в 100% случаев без адекватного хирургического лечения и снижается до 50% при агрессивном хирургическом вмешательстве (удаление некротизированной ткани, антибактериальная и дезинтоксикационная инфузионная терапия).
Инфекция раны после кесарева сечения обычно развивается на 4-й день после операции. Факторы риска включают:
- ожирение,
- диабет,
- терапию кортикостероидами,
- иммуносупрессию,
- анемию,
- недостаточный гемостаз,
- образование гематом.
Клиническая картина характеризуется лихорадкой (обычно на 4-й послеоперационный день). Наблюдается эритема, серозные выделения из раны. Нередко инфекция раны сочетается с инфекцией матки (эндомиометрит), поэтому пациентка, получающая антибактериальную терапию по поводу эндомиометрита, может не отвечать на лечение (персистенция лихорадки). Инфекция раны обычно вызывается теми же микроорганизмами, которые присутствуют в амниотической жидкости, но возможны случаи госпитальной инфекции.
Лечение включает антибактериальную терапию, хирургическую обработку (удаление некротических тканей, применение антисептиков) и дренаж раны при целостности апоневроза. Если целостность фасций нарушается, после очищения раны накладывают вторичные швы.
Мастит — это локализованное инфекционное заболевание молочной железы, которое развивается обычно между 1 и 5-й неделями после родов у 1-2% женщин, которые кормят грудью. Мастит вызывается условно-патогенной микрофлорой, присутствовать на коже молочных желез или в ротовой полости новорожденного (при кормлении грудью), чаще золотистым стафилококком, а также гемофильной палочкой, клебсиеллой, кишечной палочкой, энтерококком и энтеробактериями. Микроорганизмы попадают в ткань молочной железы через эрозии и трещины сосков, размножаются и вызывают инфекционную воспалительную реакцию.
Диагностика. Пациентки жалуются на лихорадку (до 40 ° С), озноб, недомогание, боль в молочной железе, который увеличивается при прибытии молока и кормлении грудью, увеличения ее размера, покраснение, затвердение. Это состояние следует дифференцировать с простым нагрубением молочных желез вследствие прибытия молока. Классическими симптомами мастита является локальная болезненность, эритема, разница температуры в различных участках молочной железы. Диагноз базируется на данных объективного обследования, наличии лихорадки, лейкоцитоза. Мастит может осложниться образованием абсцесса молочной железы, который требует хирургического лечения (вскрытие и дренирование абсцесса).
Лечение. Обычно назначают оральный прием антибиотиков пенициллинового ряда (диклоксацилин, амоксициллин по 500 мг 4 раза в день) и не прекращают грудное вскармливание для профилактики аккумуляции микроорганизмов в протоках молочной железы. При аллергии к пенициллинам применяют макролиды (эритромицин, азитромицин, мидекамицин и др.). Для уменьшения болевого синдрома и нормализации температуры тела применяют ацетаминофен, другие нестероидные противовоспалительные средства.
Если пациентка не кормит грудью, в острую фазу воспаления применяют молокоотсос. При неэффективности оральных антибиотиков проводят внутривенное введение антибактериальных препаратов широкого спектра действия, которое продолжают еще в течение 48 ч после нормализации температуры тела.
Эндометрит — полимикробная инфекционное заболевание слизистой оболочки матки. Учитывая, что инфекция нередко распространяется не только на децидуальную оболочку, но и на прилегающие слои миометрия (эндомиометрит) и параметральные ткани (ендопа- раметрит, панметрит), используется термин «метрит с тазовым целлюлитом».
Эндомиометрит обычно вызывается условно-патогенными аэробно-анаэробными ассоциациями, а также смешанной инфекцией: стрептококки групп А, В, бактероиды, энтерококки, кишечная палочка, клебсиелла и протей. Эндометрит является наиболее частой акушерской причиной послеродовой лихорадки.
Факторы риска. Эндомиометрит чаще развивается после кесарева сечения, чем после влагалищных родов. При влагалищных родах факторами риска эндомиометрита являются частые вагинальные исследования, внутренний мониторинг ЧСС плода, наличие мекония в околоплодных водах, хориоамнионит, длительный безводный промежуток после преждевременного разрыва плодных оболочек, ручное отделение плаценты, ручная ревизия полости матки, задержка продуктов концепции в матке. При хориоамнионите в родах частота послеродового эндомиометрита равна 13%.
На частоту эндомиометрита после кесарева сечения влияет социально-экономический статус женщины, профилактическое применение антибиотиков, длительность родов и безводного промежутка, частота вагинальных исследований и манипуляций. При кесаревом сечении по поводу клинически узкого таза (диспропорции между головкой плода и тазом матери) при отсутствии интраоперационного введения антибиотиков частота эндомиометрита достигает 90%.
Роль анемии матери как фактора риска послеродовых инфекционных осложнений является дискуссионной, так как рост некоторых бактерий в условиях дефицита железа подавляется. Кроме того, трансферрин, количество которого увеличивается при железодефицитной анемии, имеет существенные антибактериальные свойства. Другие факторы риска включают многоплодную беременность, юный возраст матери и первые роды, длительную индукцию родов и длительное применение кортикостероидов.
Бактериальная колонизация нижних отделов генитального тракта хламидиями, микоплазмами, гарднереллами и уреаплазмами ассоциируется с увеличением риска послеродовой инфекции. Хламидии могут вызывать эндометрит, характеризующийся поздним началом, латентным течением и развивается примерно у 1/3 пациенток с антенатальной хламидийной инфекцией шейки матки. Гарднереллы чаще являются возбудителями эндометрита у юных женщин.
Патогенез. Микроорганизмы, которые вызывают эндомиометрит, инвазируют плацентарную плоскость, места разрезов и разрывов и представлены типичной влагалищной, цервикальной и кишечной микрофлорой. Большинство этих бактерий имеют низкую вирулентность и редко вызывают инфекцию у здоровых тканях. Но при наличии девитализированных некротических тканей и гематом они проявляют свои патогенные свойства.
Несмотря на то, что шейка матки населена многочисленными бактериями, полость матки обычно является стерильной до момента плодовых оболочек. Течение родов происходит контаминация амниотической жидкости и, возможно, матки с аэробными и анаэробными бактериями. Инфекция может распространяться на параметральную клетчатку лимфатическим путем из мест разрывов шейки матки или разреза нижнего маточного сегмента. Этот процесс обычно ограничивается паравагинальной клетчаткой и редко распространяется в глубокие клетчаточные пространства таза.
Диагноз базируется на клинических данных:
- лихорадка (до 38-39 ° С),
- озноб,
- боль внизу живота,
- болезненность матки при пальпации,
- замедленная инволюция матки,
- наличие мутных кровянисто-гнойных лохий с неприятным запахом,
- лейкоцитоз,
- анемия.
Степень гипертермии обычно коррелирует с распространенностью инфекции. Если инфекция распространена только на эндометрий и прилегающий слой миометрия, лихорадка может быть субфебрильной. При объективном обследовании выявляют чувствительность в области параметриев. При подозрении на остатки продукта концепции (чрезмерные кровяные мутные выделения из обрывков тканей, замедленная инволюция матки, открытый маточный зев и т.д.) выполняют ультразвуковое исследование.
Эндомиометрит чаще развивается на 5-10 день после влагалищных родов (но раньше после кесарева сечения).
Возможно развитие эндометрита и через несколько недель после родоразрешения, в частности при остатках плацентарной ткани (в последнем случае диагноз ставится при исключении других возможных причин лихорадки).
Лечение эндомиометрита заключается во внутривенном назначении антибиотиков широкого спектра действия, обычно цефалоспоринов (цефокситин, цефотаксим) или ампициллина в сочетании с аминогликозидами (гентамицин) и метронидазолом, что перекрывает весь спектр микрофлоры.
Другая тактика включает назначение клиндамицина 900 мг + гентамицин 1,5 мг / кг через 8 ч внутривенно (влияние на аэробную и анаэробную флору). При подозрении на энтерококковую инфекцию дополнительно назначают ампициллин. Бета-лактамные антибиотики обладают активностью в отношении большинства аэробных и анаэробных возбудителей. Ингибиторы бета-лактамазы (клавуленова кислота, сульбактам) являются безопасными, нетоксичными и могут комбинироваться с ампициллином, амоксициллином для распространения спектра действия. Импиенем (тиенам) — карбопенем широкого спектра действия в комбинации с циластатином (подавляет почечный метаболизм импиенемив) обычно резервируется для случаев рефрактерной и распространенной инфекции.
У 90% пациенток симптомы метрита регрессируют в течение 48-72 ч после начала лечения. Инфузию антибактериальных препаратов продолжают еще в течение 24-48 ч после нормализации температуры тела и регрессии симптомов заболевания. Дальнейшее назначение оральных антибиотиков обычно не требуется. Персистенция лихорадки свидетельствует о рефрактерной тазовой инфекции.
При остатках продукта концепции выполняют инструментальную ревизию (выскабливание) полости матки большой («тупой») акушерской кюреткой (риск перфорации послеродовой матки). Антибактериальную терапию продолжают еще в течение 48 ч после нормализации температуры, стабилизации состояния пациентки (отсутствие болезненности матки, нормализация выделений, адекватная инволюция матки, отсутствие лейкоцитоза по показателям гемограммы).
В комплексном лечении эндомиометрита используют немедикаментозные средства, способствующие повышению иммунологической резистентности организма: аутотрансфузии крови, облучение ультрафиолетовыми лучами, низкоинтенсивное лазерное облучение крови, гипербарическая оксигенация и озонотерапия (при анаэробной инфекции) и др.
При интенсивном параметральном целлюлите может развиваться флегмона широкой связки матки, параметральная флегмона. Эту инфекцию следует заподозрить при отсутствии эффекта лечения эндомиометрита в течение 72 час. Параметрит обычно является односторонним и нередко ограниченным основой широкой связки матки. Если инфекция является агрессивной, параметрит может распространяться в латеральном направлении, вдоль основания широкой связки с тенденцией к распространению на боковую стенку таза (боковой параметрит).
При распространении на ректовагинальное пространство развивается задний параметрит. Интенсивный целлюлит с места разреза матки может вызвать некроз и распространение некротического материала в брюшную полость с развитием перитонита, но чаще имеет место ретроперитонеальная инфекция. Фактором риска перитонита может быть некроз и расхождение швов на матке или, реже, травма кишки или иного органа во время операции.
Лечение параметрита заключается в длительной внутривенной антибактериальной терапии препаратами широкого спектра действия (цефалоспорины, метронидазол, клиндамицин, гентамицин, амоксиклав, тиенам и др.). Гистерэктомия обычно становится необходима при развитии перитонита.
Иногда, при неэффективности антибактериальной терапии параметрита, параметральная флегмона может распространяться над пупартовой связкой. Если абсцесс прорывается в брюшную полость, возникает генерализованный перитонит. Но более часто этот абсцесс распространяется в переднем направлении и может быть дренируем под контролем компьютерной томографии. Если абсцесс распространяется в заднем направлении ректовагинальных перегородок, хирургический дренаж может быть осуществлен с помощью кольпотомного доступа (задняя кольпотомия). Редким осложнением является абсцесс поясничной мышцы (псоас-абсцесс).
Тубоовариальный абсцесс обычно является односторонним и редким осложнением послеродовой инфекции. Тубоовариальный абсцесс проявляется через 1-2 недель после родов. Разрыв тубоовариального абсцесса может привести к развитию перитонита и требует срочного хирургического вмешательства.
Бактериальная инфекция обычно начинается в месте имплантации плаценты (плацентарная плоскость) или, более часто, в месте разреза матки. Эта инфекция ассоциируется с венозным тромбозом миометрия и может распространяться вдоль венозных сосудов, что нередко сопровождается сопутствующим лимфангитом. Процесс может распространяться на яичниковые вены, потому что они дренируют верхнюю часть матки.
Частота септического тазового тромбофлебита составляет 1 9000 родов и 1: 3000 случаев кесарева сечения.
Диагноз септического тазового тромбофлебита определяется путем исключения при отсутствии эффекта от адекватной антибактериальной терапии эндомиометрита, наличии персистирующей гектической лихорадки, сильной боли внизу живота. У некоторых пациенток симптомы тромбофлебита яичниковых вен могут проявляться на 2-3 день после родов. При пальпации у рогов матки можно обнаружить болезненные образования с обеих сторон. Диагноз может быть подтвержден с помощью компьютерной или магнитно резонансной томографии (обструкция вен таза).
Лечение заключается в активной антибактериальной терапии и обязательном назначении гепарина внутривенно в течение не менее 72 ч. Если в ответ на введение гепарина состояние больного улучшается, диагноз подтверждается и лечение гепарином продолжают до полной ремиссии симптомов заболевания.
Перитонит — редкое осложнение, в современных условиях может появиться после кесарева сечения или вагинальных родов после предыдущего кесарева сечения. Причинами перитонита может быть хориоамнионит в родах; послеоперационный парез кишечника; расхождение швов на матке. Редко перитонит может развиться вследствие распространения тазового целлюлита, параметрального или тубоовариального абсцесса (генерализованный перитонит).
Клиника перитонита после кесарева сечения напоминает таковую при хирургическом перитоните. У больной наблюдается боль внизу живота, беспокойство или эйфория, повышение температуры, тахикардия, гипотония, холодный пот, слабый перистальтика, симптомы пареза кишечника, наличие жидкости в брюшной полости. Ригидность мышц брюшной стенки может быть невыраженной вследствие растяжения мышц при беременности; обнаруживают симптомы раздражения брюшины (симптом Щеткина-Блюмберга). Боль может быть очень сильной. Парез кишок может быть первым признаком перитонита. В крови обнаруживают лейкоцитоз, гемоконцентрация, тромбоцитопения.
Все пациентки с послеродовой инфекцией после кесарева сечения и подозрением на развитие перитонита должны быть внимательно обследованы по возможности некроза и расхождение швов на матке или перфорации кишки.
Лечение обычно заключается в гистерэктомии, тщательном промывании брюшной полости стерильными растворами для эвакуации гноя, широком дренировании брюшной полости, массивной антибактериальной терапии. В послеродовом периоде выполняют декомпрессию желудочно-кишечного тракта (назогастральный зонд, интубация кишечника в случае необходимости), проводят интенсивную инфузионную терапию (коррекция гиповолемии, метаболического ацидоза, водно-электролитного и белкового баланса, реологических свойств крови), поддержку деятельности сердечно-сосудистой системы, оксигенотерапию, витаминотерапию, профилактику печеночной и почечной недостаточности, стимуляцию диуреза и функции кишечника.
Синдром токсического шока — острое инфекционное заболевание с высокой лихорадкой и мультисистемным поражением жизненно важных органов. Смертность достигает 10-15% случаев.
Диагностика. Синдром токсического шока характеризуется:
- лихорадкой,
- головной болью,
- нарушением деятельности ЦНС,
- диффузной макулярной эритематозной сыпью,
- отеком подкожных тканей,
- тошнотой,
- рвотой,
- диареей,
- выраженной гемоконцентрацией.
Быстро развиваются диссеминированная внутрисосудистая коагуляция, сосудистый коллапс, почечная и печеночная недостаточность. При выздоровлении происходит десквамация эпителия пораженных сыпью зон. В большинстве случаев инфекция вызывается экзотоксином (токсин септического шока и, энтеротоксин Р, пирогенный экзотоксин С) золотистого стафилококка, что вызывает глубокое поражение эндотелия капилляров. Имеются сообщения о развитии синдрома, подобного септического шока, при инфицировании р-гемолитическим стрептококком.
Лечение синдрома токсического шока заключается в легочно-сердечной реанимации, инфузионной и антибактериальной терапии, почечном диализе.
Сепсис и септический шок (бактериемия, септицемия) в акушерстве чаще осложняет такие состояния, как острый пиелонефрит, хориоамнионит, септический аборт, некротизирующий фасциит и послеродовые гнойно-септические осложнения.
Этиология и патогенез. Учитывая тот факт, что тазовые инфекции являются полимикробными, септический шок может быть вызван различными патогенами. Бактерии, которые вызывают шок, обычно принадлежат к классу эндотоксинпродуцирующих энтеробактерий. Чаще этиологическим фактором септического (эндотоксинового) шока является кишечная палочка, менее часто — аэробные и анаэробные стрептококки, бактероиды и клостридии. Бета-гемолитический стрептококк и золотистый стафилококк продуцируют вирулентный экзотоксин и вызывают синдром токсического шока. При пиелонефрите кишечная палочка и клебсиелла является наиболее частой причиной бактериемии и септицемии.
Сепсис является воспалительным ответом на действие триггерного фактора — обычно микробного эндотоксина или экзотоксина. Токсины стимулируют продукцию воспалительных цитокинов (фактор некроза опухоли, интерлейкин-1, интерлейкин-8) в сосудистом эндотелии. Происходит адгезия нейтрофилов к эндотелиоцитам, лейкоциты образуют токсичные субстанции, включая протеазы и цитокины.
Эндотоксины — это липополисахарида, которые высвобождаются в результате лизиса клеточной стенки грамотрицательных бактерий. Образуются и другие бактериальные субстанции, которые усиливают высвобождение медиаторов воспаления с активацией комплемента, кининов, системы коагуляции. В 30-50% пациенток с грамотрицательным сепсисом имеет место диссеминированная внутрисосудистая коагуляция (ДВС-синдром).
Экзотоксины также могут вызывать септический шок и смерть, особенно экзотоксин А синегнойной палочки, экзотоксины золотистого стафилококка и стрептококка группы А. Обширный некроз тканей, гангрена послеродовой матки может вызывать кардиоваскулярный коллапс и смерть.
Высвобождение вазоактивных медиаторов приводит селективную вазодилатацию с патологическим перераспределением кровотока. Агрегация лейкоцитов и тромбоцитов приводит к образованию микротромбов в капиллярах. Повреждение эндотелия сосудов способствует вытеканию жидкости из сосудистого русла в межклеточное пространство. В зависимости от величины повреждения и воспалительного ответа (синдром системного воспалительного ответа (ССВО), возникают различные клинические проявления заболевания. Итак, сепсис имеет и клинический и патофизиологический смысл.
Конечный результат каскада патофизиологических реакций приводит к развитию синдрома септического шока. В ранней стадии клинический шок является следствием преимущественно уменьшение системного сосудистого сопротивления, не полностью компенсируется растущим сердечным выбросом. Гипоперфузия приводит к развитию лактатацидоза, уменьшение экстракции тканями кислорода и дисфункции органов-мишеней (синдром полиорганной недостаточности).
Гемодинамические изменения при септическом шоке. Если ОЦК изначально является восстановленным, септический шок характеризуется высоким сердечным выбросом и низким периферическим сосудистым сопротивлением. Этот период получил название теплой фазы септического шока. Параллельно развивается легочная гипертензия. Тяжелый сепсис сопровождается угнетением функции миокарда, несмотря на высокий сердечный выброс.
Большинство ранее здоровых женщин с сепсисом вследствие послеродовой инфекции хорошо отвечают на активную инфузионную и антибактериальную терапию и, в случае необходимости, удаление инфицированных тканей. Если артериальная гипотензия не корректируется агрессивной инфузионной терапией, прогноз ухудшается. Если ответ на в-адренергические инотропные агенты, имеет место тяжелая необратимая сосудистая недостаточность и чрезмерное угнетение функции миокарда. Олигурия и продолжающаяся периферическая вазоконстрикция характеризует вторую, холодную, фазу септического шока, при которой выживаемость больных мало вероятна. Прогноз является плохим и в случае возникновения дисфункции конечных органов (почек, легких, головного мозга), если гипотензию удается скорректировать.
Лечение. При подозрении на серьезную бактериальную инфекцию внедряется тщательный мониторинг АД и диуреза больного. Диагноз септического шока, как и геморрагического (гиповолемического) шока, определяется при наличии гипотензии или олигурии.
При подозрении на септический шок алгоритм действий врача заключается в дальнейших действиях:
- внедрение тщательного мониторинга жизненных функций, АО и диуреза;
- агрессивная инфузия для восстановления ОЦК;
- эмпирическое назначение антибиотиков в максимальных дозах, влияющих на все возможные патогены;
- оксигенация и искусственная вентиляция легких (ИВЛ) в случае необходимости;
- по показаниям — хирургическое вмешательство (удаление септического очага) после стабилизации жизненных функций пациентки.
Для восстановления почечного кровотока проводят быструю инфузию не менее 2 л растворов кристаллоидов (в тяжелых случаях — до 4-6 л). В связи с истечением жидкости из капиллярного русла, такие пациентки обычно имеют гемоконцентрацию. Поэтому сначала вводят кристаллоиды до достижения уровня гематокрита 30 об%, потом вместе с введением кристаллоидов проводят гемотрансфузии для поддержания гематокрита на уровне более 30 об%. Агрессивная инфузионная терапия должна восстановить диурез на уровне 30-50 мл / ч. Если этого не происходит, возможно развитие острого респираторного синдрома взрослых.
С целью диагностики этиологии сепсиса выполняют бактериологическое исследование крови, мочи, выделений из половых путей. Антибактериальная терапия сначала проводится антибиотиками широкого спектра действия максимальными дозами (клиндамицин + — гентамицин + ампициллин; амоксиклав + цефуроксим + метронидазол или тиенам и др.)
Хирургическое лечение. Долгий сепсис является фатальным осложнением, поэтому удаление девитализированных тканей является важным компонентом лечения сепсиса. При септическом аборте выполняют кюретаж полости матки. Показания к гистерэктомии возникают редко (только при массивного некроза матки). Гистерэктомия является необходимой в случае хориоамнионита, вызванного газообразующей штаммами Е.соli.
Ремиссии септического шока нередко можно достичь при эвакуации содержимого матки. При инфекции раны производится удаление всех некротизированных тканей и дренирование. При тазовом или интраабдоминальном абсцессе выполняют их эвакуацию. Пациенткам с острым обструктивным пиелонефритом необходимо применять уретральный катетер или перкутанную нефростомию, удаление детрита или даже нефрэктомию.
Поддерживающее лечение. Для поддержания АД применяют допамина гидрохлорид дозой 2-10 мг / кг / мин, который стимулирует а-рецепторы миокарда и увеличивает сердечный выброс. Доза 10-20 мг / кг / мин приводит стимуляцию в-рецепторов, рост системного сосудистого сопротивления и АД. При отсутствии эффекта допамина вводят добутамин (5-15 мг / кг / мин), или норэпинефрин (5-20 мг / кг / мин). С целью оксигенации больных проводят масочную ингаляцию кислорода или ИВЛ.
Иммунотерапия. В последние годы предложены и изучаются различные варианты моноклональных антител против эндотоксинов (антиэндотоксиновые антитела, Е5- ИдМ антитела, антицитокиновые антитела, рекомбинантный белок рецепторов р55-фактора некроза опухолей), но достоверных данных по улучшению результатов лечения сепсиса при их применении по сравнению с плацебо на форуме . При стафилококковой инфекции применяют антистафилококковый иммуноглобулин, антистафилококковую плазму и стафилококковый анатоксин.
источник